Similar presentations:
Физико-химические основы совместимости материалов и процессы коррозии
1.
СОВМЕСТИМОСТЬ И КОРРОЗИЯ2.
РАЗДЕЛ 1ТЕМА 1. Физико-химические основы совместимости
материалов и процессы коррозии
Совместимость материалов
Существенное влияние – примеси (H, O, N, C и т.д.)
Природа взаимодействия
химическая
Электрохимическая
Физико-химическая
физическая
3.
Коррозия. Основные понятия и определенияКоррозия – самопроизвольное поверхностное разрушение металлических
материалов вследствие химического или физико-химического взаимодействия их с
компонентами окружающей среды
Процесс коррозии
Эволюция термодинамической системы
(Me + газ или Ме + жидкость)
Коррозионный эффект – изменение в любой части коррозионной
системы, вызванное воздействием компонентов системы
Устойчивое
окисленное
Окислительный компонент
состояние
Me
(оксиды,
(не устойчивое состояние) (О2, СО, SO2, Cl и др.)
гидроксиды, соли
и др.)
Видимые продукты атмосферной коррозии сплавов железа, состоящие в
основном из гидратированных оксидов, называют ржавчиной, а продукты газовой
коррозии – окалиной.
+
4.
Цветные металлы - корродируютНеметаллические материалы (пластмассы) - набухают или трескаются
Дерево – расслаивается или гниет
Бетон - крошится
Коррозионные потери - количество металла, превращенного в
продукты коррозии за определенное время.
Скорость коррозии - коррозионные потери массы металла с единицы
поверхности или толщина прокорродировавшего слоя металла в единицу времени.
Коррозионная эрозия (коррозионный износ) - результат химического
взаимодействие металла и среды , вызванный физическим разрушением в
результате механического повреждения от истирания или ударов частиц среды
(например, теплоносителя).
Коррозионное разрушение - эффект повреждений, связанный с
потерями механической прочности металла
5.
Оценка коррозионной стойкости при равномерной коррозии (по ГОСТ 13819-68)Группа стойкости
Скорость коррозии
металла, мм/год
Совершенно стойкие
Балл
< 0,001
1
0,001 – 0,005
0,005 – 0,01
2
3
0,01 – 0,05
0,05 – 0,1
4
5
Пониженно-стойкие
0,1 – 0,5
0,5 – 1,0
6
7
Малостойкие
1,0 – 5,0
5,0 – 10,0
8
9
> 10,0
10
Весьма стойкие
Стойкие
Нестойкие
Коррозионная стойкость - способность металла сопротивляться
коррозионному воздействию среды.
Коррозионную стойкость определяют количественно скоростью коррозии в
данных условиях, качественно – группой или баллом стойкости по принятой шкале
Коррозионная стойкость
Природа, состав, структура
материала
Состав среды, термодинамические,
гидродинамические условия и др.
6.
Коррозионные проблемыПрямые потери
* стоимость капитального и текущего
ремонта преждевременно вышедших
из строя из-за коррозии машин,
оборудования и коммуникаций или их
полной
замены,
а
также
дополнительные и эксплуатационные
расходы на их защиту от коррозии.
* безвозвратные потери металла в
виде продуктов коррозии и потери от
истирания, которые достигают 10 %
от начальной массы металла.
Косвенные потери
экономические затраты:
* отказ в работе и простой
металлического оборудования в
следствии:
-загрязнения его продуктами коррозии;
- потери продуктов (масла, газа, воды и
др.) через прокорродировавшую
систему;
- загрязнения
чистого
продукта
продуктами коррозии;
- проектирования оборудования с
учетом допусков на коррозию;
* невосполнимые потери при авариях.
Фундаментальные исследования и противокоррозионные мероприятия на
стадии проектирования
7.
Роль термодинамики и химической кинетики при исследованиипроцессов коррозии
Термодинамическая неустойчивость чистых металлов
Свойства металла
Внешние условия
Характер коррозионной среды
∆G = G2 – G1
G1 > G2 или ∆G < 0
∆G° (T = 298К, p = 1 атм.) < 0
∆G > 0
∆G = 0
Энергия Гиббса продуктов реакции
Энергия Гиббса исходных веществ
Степень термодинамической неустойчивости
Самопроизвольно протекающий процесс
Процесс окисления на воздухе большинства металлов
(взаимодействие с кислородом с образованием оксида)
Восстановление металла из оксида
Равновесие
Элементарная стадий
Коррозионный процесс (граница Т-Г или Т-Ж):
последовательно
- Транспортировка реагирующих веществ к поверхности
параллельно
раздела фаз;
сопряжено
- Химическое взаимодействие;
ВЫЯВИТЬ И ВЛИЯТЬ НА
- Отвод продуктов реакции из реакционной зоны.
Состоят из элементарных стадий
ЛИМИТИРУЮЩЮЮ СТАДИЮ
8.
Классификация коррозионных процессовМеханизм реакции
взаимодействия
материала со средой
Вид и природа
коррозионной среды
Вид коррозионных
разрушений на
поверхности и в объеме
металла
Характер дополнительных
воздействий одновременно
с действием коррозионной
среды
9.
Механизм реакции взаимодействия материала со средойХимическая
коррозия
– взаимодействие металла с окислительным
компонентом коррозионной среды, при котором окисление металла и восстановление
окислительного компонента среды происходит в одном акте.
4Fe + 3O2 = 2Fe2O3
окислитель
продукт коррозии
химическая связь
электрический ток - НЕТ
Электрохимическая коррозия - разрушение металла под воздействием
возникающих в коррозионной электролитической проводящей среде гальванических элементов.
Ионизация металла и восстановление окислительного компонента среды протекают
не в одном акте и зависят от потенциала металла. Окислительный компонент при этом не
входит в состав продукта коррозии.
Fe + 2H2O = Fe(OH)2 + 2H+ + 2ē
электрический ток - ДА
Биологическая коррозия – разрушение под влиянием жизнедеятельности
микроорганизмов (по химическому, электрохимическому или смешанному механизму).
10.
Вид и природа коррозионной средыГазовая коррозия – химическое взаимодействие металлов с активными
компонентами газовой среды (сернистый газ, сероводород, кислород, галоиды, водяной пар и
др.) при повышенной температуре.
Атмосферная коррозия – разрушение
в результате электрохимических
процессов, происходящих в тонкой пленке влаги, осаждающейся на металле из атмосферного
воздуха.
Коррозия в жидкостях – разрушение материала:
- в неводных средах (жидкие металлы, расплавы солей);
- в неэлектролитах (органические растворители, жидкое топливо и т.д.);
- в электролитах (растворы солей, кислот, щелочей, морская и речная вода).
Подземная коррозия – разрушение металлов в почвах и грунтах.
Коррозия блуждающим током – электрохимическая коррозия металла под
воздействием блуждающего тока (из-за плохого заземления электрооборудования, что приводит
к утечкам тока через металлические конструкции и вызывает тем самым коррозию).
Биологическая – разрушение под влиянием микроорганизмов.
Радиационная – разрушение под действием радиоактивного излучения
11.
Вид коррозионных разрушений на поверхности и в объеме металлаМестная
(локальная)
Общая
(сплошная)
пятнами
равномерная
Компонентно-избирательная:
HNO3
Cu
Р-р щелочи
воздух
Избирательная
Al
сталь
Р-р H2SO4
язвами
точечное
сквозное
межкристаллитное
неравномерная
Углеродистая
сталь
ножевидное
Щелевая
Контактная
подповерхностное
Cu-↓Zn
Структурно-избирательная:
Р-р HNO3
Морская
вода
Cu-Zn
сталь
↓феррит
12.
Межкристаллитная коррозия (МКК) Х18Н10Межкристаллитная коррозия
на сварном шве:
1 – выделения карбида хрома;
2 – зона, обеднённая хромом (анод);
3 – зерно аустенитной
хромоникелевой стали (катод)
↓ механические характеристики
НАИБОЛЕЕ ОПАСНА!
13.
Характер дополнительных воздействий одновременно с действиемкоррозионной среды
-знакопеременные нагрузки;
- остаточная деформация;
Коррозия под напряжением
(коррозионное растрескивание)
межкристаллитная
- термические напряжения;
трещина
?
транскристаллитная
величина остаточных внутренних или приложенных извне напряжений, характер агрессивной среды,
структура материала, длительность воздействия, температуры степень пластической деформации, поведение
защитных пленок на материале.
Коррозионная усталость – циклическая нагрузка + коррозионное воздействие
↓ предел выносливости
Коррозия при трении (эррозионная коррозия) – разрушение под действием
коррозионной среды и сил трения.
Фреттинг-коррозия – разрушение под действием колебательных перемещений
соприкасающихся металлических поверхностей.
Кавитационная коррозия – разрушение поверхности металла или сплава
одновременным коррозионным и ударным воздействием агрессивной среды в результате
образования и схлопывания пузырьков газа на динамической поверхности раздела металл–
жидкость.
14.
РАЗДЕЛ 2ТЕМА 1. ХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Химическая газовая коррозия
Химическая коррозия – взаимодействие металлической поверхности
с
окислительным компонентом коррозионной среды по механизмам химических гетерогенных
реакций.
- cухие газы (воздух, продукты сгорания топлива);
- жидкие неэлектролиты (нефть, бензин, органические жидкости).
обмен электронами
Me →
MeZ+
+ zē
zē
O2 + zē → (z/2)Oz/2
Me + O2 → MeOz/2
Газовая коррозия!
Металлургическое
производство
Химическое
производство
Эксплуатация
металлоконструкций
15.
Химическая газовая коррозияУсловие газовой коррозии (отсутствие на поверхности Me пленки воды):
- реагирующие газы содержат минимальное количество влаги (не более сотых долей
процента);
Осушка газов
H2SO4
Cl
↓ до 0.003-0.04% влаги
- контакт металла и газов осуществляется при высоких температурах, превышающих
«точку росы», когда конденсации влаги на поверхности металла не происходит;
Область существования высокотемпературной газовой коррозии определяется
(T1, T2)
T1 ~ f(Pпарц. Н2O) - точка росы (температура конденсации пара на поверхности Me)
T2 – определяется свойством «ЖАРОСТОЙКОСТЬ» – способность сопротивляться
коррозионному воздействию газов при высоких температурах.
- металл находится в среде неполярных органических соединений.
16.
Термодинамика химической газовой коррозииприрода
оксиды, соли
направление протекание
процесса
∆GТ
знак
«–» или «+»
промышленность
Чистые Ме
Термодинамическая неустойчивость – причина химической коррозии
mMe(т) + (m·z/4)O2(г) = MemOm·z/2(т) , при p, T = const
Уравнение изотермы
∆GT = RT·2,303·lg(1/pO2mz/4) – RT ·2,303·lg(1/pO2mz/4)равн = RT·2,303·lg(1/pO2mz/4) –
– RT·2,303·lgKр = RT·2,303·lg(1/pO2mz/4) + ∆GТ0 , где :
рО2 – парциальное давление кислорода, соответствующее исходному состоянию системы, атм;
(рО2)равн – парциальное давление кислорода, соответствующее равновесному состоянию системы
(давление диссоциации оксида), атм;
m – число атомов металла в молекуле оксида; z – валентность металла;
Kр – константа химического равновесия;
∆GТ0 = – RT 2,303 lgKр – изменение стандартного изобарно-изотермического потенциала
(∆ Gт при рО2 = 1 атм), Дж/моль.
17.
Термодинамика химической газовой коррозииТермодинамическая возможность протекания реакции:
mMe(т) + (m·z/4)O2(г) = MemOm·z/2(т) , при p, T = const
характеризуется давлением диссоциации.
Давлением диссоциации - давление кислорода, соответствующее при данной температуре
равновесию с оксидом и металлом: рО2 = (рО2)равн.
Образование оксида
∆GТ < 0 и => рО2>(рО2)равн.
Диссоциация оксида
∆GТ > 0 и => рО2<(рО2)равн.
lg(рО2)равн = 4 /(2,303·RT·m·z)
Fe2O3
Fe3O4
FeO
Fe
диссоциация оксидов
В воздушной атмосфере рО2 0,2 атм
↑T
↑ (рО2)равн.
↑ Vок
18.
Термодинамика химической газовой коррозиирО2 << (рО2)равн.
Au (T = 300К, воздух )
Ag (T = 300К, воздух )
не окисляется!
рО2(0,2 атм) > (рО2)равн. (8,4∙10–5 атм)
4Ag + O2 = 2Ag2O
окисляется!
рО2 < (рО2)равн. (4,9∙10–1 атм)
Ag (T = 400К, воздух )
не окисляется!
рО2 < (рО2)равн. (249 атм)
Ag (T = 500К, воздух )
не окисляется!
Fe (T = 600К, воздух )
рО2 > (рО2)равн. (5,1∙10–42 атм)
Fe (T = 2000К, воздух )
рО2 > (рО2)равн. (1,6∙10–7 атм)
2Fe + O2 = 2FeO
окисляется!
19.
Термодинамика химической газовой коррозииРеакционная способность (химическое сродство) - величина изменения
стандартного потенциала Гиббса химической реакции, отнесенная к 1 г-экв. металла, т.е. ∆GТ0 /mz
(где m – число атомов металла в молекуле оксида, z – валентность металла).
∆GТ0 = – RT 2,303 lgKр
∆GТ0 = RT ·m·z·2,303·lg(pO2)равн /4
или
Изменение свободной энергии (∆ G ) для реакций окисления
металлов при стандартных условиях (25 С; 0,1 МПа)
Реакция
∆G обр,
кДж/гэкв.
Реакция
∆G обр,
кДж/гэкв.
К = К+ + e–
–360,9
Co = Co2+ + 2e–
–105,5
Ca = Ca2+ + 2e–
–356,3
Ni = Ni2+ + 2e–
–102,6
Na = Na+ + e–
–340,3
Sn = Sn2+ + 2e–
–91,8
Mg = Mg2+ + 2e–
–307,3
Pb = Pb2+ + 2e–
–90,9
Al = Al3+ + 3e–
–239,5
Cu = Cu2+ + 2e–
–46,14
Mn = Mn2+ + 2e–
–192,2
Ag = Ag+ + e–
–8,51
Zn = Zn2+ + 2e–
–153,6
Pd = Pd2+ + 2e–
+16,54
Cr = Cr3+ + 3e–
Fe = Fe2+ + 2e–
–150,3
–127,3
Ir = Ir3+ + 3e–
Pt = Pt2+ + 2e–
+17,84
+36,0
Cd = Cd2+ + 2e–
–117,2
Au = Au3 + 3e–
+65,73
20.
Пленки на металлах как продукты химической газовой коррозииMe
+
O2
Cl
I
CO2
SO2
и
др.
=
Пленки соединений
(защитные и незащитные)
Последовательность стадий окисления:
адсорбция молекулярного кислорода на чистой поверхности металла;
диссоциация молекул кислорода на атомы и их хемосорбция;
возникновение зародышей оксидов на локальных участках поверхности;
формирование и рост пленки оксида.
21.
Адсорбция молекулярного кислорода на чистой поверхности металла+
Диссоциация молекул кислорода на атомы и их хемосорбция
O2, O2–, O22–, O2–, O
адсорбат
(Ag, Hg, Pt, Au)
адсорбент
(Al, Cu, Fe и др.)
адсорбент
Места с высоким адсорбционным потенциалом: поверхностные дефекты
Физическая --- результат действия электростатических сил (при низких Т)
Адсорбция
Химическая --- результат химического взаимодействия адсорбированных
атомов с атомами поверхностного слоя металла
(хемосорбция)
22.
↑ (СО2)пов.↓ Епов.
↓ ∆H
физическая адсорбция (низкие T):
(∆H = ∆G + T·∆S)
↓S
Экзотермический процесс
- t (физ.адсорб.) → 0;
- формирование монослоя или слоев более высокого порядка;
- теплота физической адсорбции (прочность связи) – 8–25 кДж/моль;
химическая адсорбция, хемосорбция (высокие T):
- переход ē от металла к окислителю → ионизация частиц и образование ионной
или ковалентной связи;
- теплота химической адсорбции – 80 (Ag) –800 (W) кДж/моль;
- формирование хемосорбированного монослоя адсорбата;
силы Ван-дер-Ваальса
23.
Возникновение зародышей оксидов на локальных участках поверхности+
Формирование и рост пленки оксида
химическая связь
- захват ē молекулой O2 с образованием O2– и Me+
- перераспределение заряда и масс на поверхности металла;
- формирование смешенного слоя;
- адсорбция новых молекул и перераспределение заряда и масс: катионы (Me+) – наружу,
атомы кислорода – вглубь с образованием анионов O –;
r(Me) > r(Me+), r(A) < r(А–)
внешний слой заряжен отрицательно;
- и т.д.
1 – молекулы О2;
2 – хемосорбированные атомы кислорода;
3 – поверхностные атомы металла.
пограничный с металлом слой
заряжен положительно;
24.
Формирование оксидной пленки идет через образование зародышей!Благоприятные места для образования зародышей – поверхностные деффекты!
а – первичная мелкокристаллическая пленка оксида;
б – появление эпитаксических зародышей;
в – рост зародышей вдоль поверхности металла;
г – сплошная компактная плёнка оксида
образование поверхностного
уменьшение в нем числа дефектных мест
замедление диффузии
торможение скорости коррозии
Схематическое изображение роста
оксидной плёнки на поликристалле
25.
Состав и структура оксидов. ЭпитаксияСостав и структура оксидов определяются термодинамикой системы
металл – окислитель и структурой подложки (поверхности).
Принцип ориентационного и размерного соответствия структур соприкасающихся фаз
(Данков П.Д.):
направление
роста оксида
кристаллическая решетка оксидной фазы
сопрягается с решеткой подложки
кристаллографической плоскостью с наиболее
подобным расположением атомов
O
минимизация упругих напряжений
Fe
Схема взаимная ориентация -Fe и FeO
(исходная плоскость поверхности Fe – (100)
Возможно образование
термодинамически неустойчивых фаз
(в обычных условиях)
26.
Эпитаксия (близкий по структуре) – ориентированное формирование слояодного вещества на поверхности другого (подложки)
новая фаза вырастает на подслое, наследуя его кристаллографическую структуру
Условия эпитаксии:
существование в обеих решетках одной или нескольких плоских ячеек, близких по форме и
размерам;
достаточно малая скорость реакции, чтобы образующееся соединение имело возможность
ориентироваться в соответствии с подложкой.
эпитаксиальная пленка – лучшая защита от коррозии
(возникает барьер для диффузии окислителя)
Факторы, влияющие на эпитаксию (структурно-геометрическое соответствие):
температура процесса;
степень переохлаждения (пресыщения осаждаемого вещества в среде);
совершенство подложки;
чистота поверхности;
и др.
Эпитаксиальная температура – температура, ниже которой нарастает только
неориентированный слой (пленка).
27.
Виды эпитаксии:Гомоэпитаксия (автоэпитаксия) – эпитаксия, возникшая при взаимодействии веществ
подложки и нарастающего слоя одного состава (для элементов не склонных к химическому
взаимодействию).
Гетероэпитаксия – эпитаксия, возникшая при взаимодействии веществ подложки и
нарастающего слоя различного состава.
Хемоэпитаксия – процесс образования и ориентированного наращивания слоя за счет
химического взаимодействия веществ подложки с наносимым веществом.
Эндоэпитаксия – ориентированный рост кристалла внутри объема другого.
Графоэпитаксия – эпитаксия на аморфной подложке, на которой создан кристаллографически
симметричный микрорельеф.
Псевдоморфный слой – эпитаксиальный слой, являющийся продолжением решетки кристалла
подложки.
При толщинах более некой критической величины (60 нм для Au на Ag) – образуется слой с
собственной структурой.
Подготовка поверхности к эпитаксиальному росту: механическая, химическая, радиационная
наличие примесей при гомоэпитаксии
ориентация зерен
формирование
влияние
↑Vроста на плоскостях c ↑σпов
легированный поверхностный слой
скорость роста и толщина пленок
(111), (100), (110)
?
Оксид – электрически нейтрален (сумма всех положительных зарядов катионов равна сумме
всех отрицательных зарядов анионов)! Имеет свою кристаллическую решетку с катионной и
анионной подрешетками! Пластически деформируется! Имеет зернистую структуру!
28.
Толщина и защитные свойства пленокТолстые
Тонкие
Средние
(менее 40 нм)
(40 – 500 нм, цвета побежалости)
Толщина пленок на железе
Условия получения
(более 500 нм)
Толщина пленки, нм
Выдержка несколько дней в сухом
воздухе при комнатной температуре
Нагревание на воздухе при 400 С
Время нагрева,
Цвет пленки
мин
1,0
Желтый
1,5
Оранжевый
2,0
Красный
2,5
Фиолетовый
3,0
Синий
Нагревание на воздухе в течение
7 сут при 900 С
1,5–2,0
46
52
58
68
72
Классификация
Тонкие пленки
Пленки средней
толщины
Толстые
пленки
600
Толщина оксидных пленок на металлах
Металл, атмосфера
Цинк в сухом воздухе
Медь в сухом воздухе
Ртуть в сухом воздухе
Коррозионностойкая сталь в сухом воздухе
Коррозионностойкая сталь в воздухе с озоном
Железо в сухом воздухе
Железо во влажном воздухе с озоном
Алюминий в сухом воздухе
Толщина пленки, нм
0,5–0,6
1
1,5–2
1–2
2–3
1,5–2,5
3,5–4
10–15
29.
ЖаростойкостьЗащитные свойства – f (толщина)
- Сплошная, беспористая;
- Хорошая адгезия с поверхностью Me;
- Высокая прочность и эластичность;
- Близкий с Ме КТР;
- Химическая инертность с окружающей средой
Критерий сплошности (соотношение Пиллинга и Бедворса, СПБ):
молекулярный объем химического соединения металла и окислителя (оксида),
возникающего на металлической поверхности, Vок должен быть больше объема
металла VМе, израсходованного на образование молекулы соединения.
Vок/VMe = Mок Me/(mAMe ок)
Vок/VMe < 1 – пленка рыхлая
Vок/VMe ≥ 1 – пленка сплошная
AMe – атомная масса металла;
Me – плотность металла;
Мок – молекулярная масса оксида;
m – число атомов металла в молекуле оксида;
ок – плотность оксида.
VMe = AMe/ Me
Vок = Mок/(m ок)
30.
Отношение объемов оксида и исходного металлаМеталл
Li
Na
K
Mg
Ca
Sr
Ba
Cu
Cu
Ag
Be
Zn
Cd
U
U
Al
Ti
Zr
Оксид
Li2O
Na2O
K2O
MgO
CaO
SrO
BaO
Cu2O
CuO
Ag2O
BeO
ZnO
CdO
UO2
U3O8
Al2O3
TiO2
ZrO2
Vок/VMe
0,57
0,59
0,48
0,79
0,63
0,66
0,73
1,67
1,74
1,58
1,67
1,58
1,27
1,96
3,12
1,31
1,76
1,60
Металл
Sn
Pb
Nb
Nb
Ta
Cr
Mo
Mo
W
W
Fe
Fe
Fe
Co
Co
Co
Ni
Pt
Оксид
SnO2
PbO
NbO
Nb2O5
Ta2O5
Cr2O3
MoO2
MoO3
WO2
WO3
FeO
Fe3O4
Fe2O3
CoO
Co3O4
Co2O3
NiO
PtO
Vок/VMe
1,33
1,15
1,57
2,81
2,32
2,02
2,18
3,45
1,86
3,36
1,77
2,09
2,14
1,75
2,00
2,42
1,52
1,56
Сплошность пленки – необходимое условие!
Vок/VMe < 1
растягивающие напряжения
Vок/VMe >> 1
внутренние сжимающие напряжения
2,5 > Vок/VMe > 1
трещина
вспучивание, отслаивание
(U3O8, WO3, MоO3 )
31.
а)б)
в)
г)
д)
е)
Типы разрушения оксидных плёнок при росте:
а – пузырек без разрыва плёнки; б – пузырек с разрывом; в – газонепроницаемые
микропузырьки; г – отслаивание; д – растрескивание при сдвиге;
е – растрескивание на углах
а) - высокая прочность на разрыв, низкая адгезия;
б) - низкая прочность на разрыв, низкая адгезия, газопроницаемость;
в) - газонепроницаемые пузыри;
г) - отслаивание на неровных поверхностях;
д) - низкая прочность, высокая адгезия;
е) - углы – концентраторы напряжений – причина отслаивания;
32.
Кинетика химической газовой коррозииИзучение коррозии:
-изменение толщины образующейся пленки продуктов коррозии (глубинный
показатель Кп , мм/год);
- изменение массы образца металла (массовый показатель К±м , г/(м2 ·ч));
- объем поглощенного или выделившегося в процессе коррозии металла газа
(объемный показатель KV , см3 /(см2 ·ч))
v = dh/dt
v – скорость процесса; h – толщина оксидной пленки; t – время процесса.
v ~ f (природа металла, состав среды, Т,
если Vок/VMe < 1
свойства продуктов коррозии, t и др.)
пористая пленка
свободный доступ O2
-транспортировка окислителя к поверхности раздела фаз;
- адсорбция окислителя на поверхности металла;
- химическое взаимодействие окислителя с металлом;
- отвод (десорбция, возгонка) продуктов коррозии.
Лимитирующая стадия – химическое взаимодействие!
33.
Линейный закон роста пленок:dh/dt = kc·C0
h – толщина пленки;
t – время окисления металла;
kc – константа скорости химической реакции для данной концентрации окислителя (C0 ).
h = K1t + Ah
Ah → 0
h = K1t
Ah – постоянная интегрирования, начальная толщина пленки;
K1 = kc·C0 - постоянная для данной концентрации окислителя.
Рост пористой (незащитной) пленки,
контролируемый
скоростью
химической
реакции
окисления
(кинетический контроль), протекает
по линейному закону.
Пример: высокотемпературное окисление на воздухе
щелочных и щелочно-земельных металлов, а также
металлов, оксиды которых возгоняются при высоких
температурах (вольфрам, молибден, магния).
В порядке уменьшения скорости окисления K>Na>Ba>Ca>Mg
Mo, Os, Ru, Ir, V, W
Окисление магния на воздухе при
различных температурах
34.
Параболический закон роста: пленокГ. Тамман, (Ag + I)
Vок/VMe > 1
сплошная защитная пленка
замедление процесса
Замедляется диффузия компонентов через слой пленки
Влияние закона Фика!
dh/dt = KД ·dС/dh
KД – коэффициент диффузии;
Если стационарный процесс диффузии (без накопления
веществ в сечении), то:
dС/dh = (C0 – C1)/h
C0 – концентрация кислорода на внешней поверхности
пленки на границе с воздухом;
C1 – концентрация кислорода на внутренней поверхности
пленки на границе с металлом;
C1→0
dh/dt = KД ·(C0 – C1)/h
h2 = K2t, где K2 = 2 KД C0
dh/dt = KД ·C0/h
Пример: параболический закон роста оксидной пленки
наблюдается при окислении циркония, вольфрама, меди, железа,
никеля, кобальта, марганца, титана и других металлов.
В порядке устойчивости к окислению W<Fe<Co<Cu<Ni
Mn, Be, Zn, Ti
Окисление железа на воздухе при
различных температурах
35.
Сложные законы роста пленок:Диффузионно-кинетический контроль кинетики процесса:
химической реакции соизмеримы.
скорость диффузии и
Уравнение Эванса
h2/(2КД) + h/kc = C0t
K1 = kc·C0
K2 = 2 KД C0
K1h2 + K2h = K1K2t
(Сложный параболический закон)
Если пленка тонкая, то h >> h2
Если пленка толстая, то h2 >> h
h = K1 t
линейный
h2 = K2t
параболический
Уплотнение пленки или формирование дефектов
Торможение диффузии и затухание процесса коррозии
Типичные кривые законов
роста плёнок на металлах:
1 – логарифмический;
2 – обратнологарифмический;
3 – кубический;
4 – параболический;
5 – сложнопараболический;
6 – паралинейный;
7 – линейный
Al, Zn – 25–225 °C, В порядке возрастания к
Ni – до 650 °C,
стойкости к окислению:
Fe – до 375 °C,
Si<Al<Cr
Cu – до 100 °C
Рост толщины пленки металлов (Fe, Al, Ti, Cu, Mg, Zn, Ta, Mo, W и др.) – f(внешних условий)
h = ln(Kt)
При низких Т и тонких пленок:
Для толстых пленок (окалина):
h = ln(Kt) 1/h = K3 – K4 ln(Kt) h = K5(1 – exp(–K6t))
h 2 = K7 t
h = K8 t
hn = K9t, где n > 2
36.
Механизм химической газовой коррозииИонно-электронная теория окисления Вагнера для толстых пленок
Рост пленки – аналог гальванического элемента, в котором пленка работает как внутренняя, так
и внешняя электрическая цепь:
Анод (металл) – поставляет ионы металла (катионы) и электроны;
Катод (атомы кислорода) – принимает электроды
+-
НЕСТИХИОМЕТРИЯ
Ионно-электронная
проводимость !
+-
Ионная или электронная проводимость
+-
ПОЛУПРОВОДНИК
Область гомогенности
Двухсторонние фазы переменного состава
закись титана от TiO0,6 до TiO1,3
односторонние фазы переменного состава
Nb2O5– , TiO2– , Fe1– O
37.
v ~ D ~ Cdv – скорость химической газовой коррозии;
D – коэффициент диффузии;
Dd – коэффициент диффузии дефектов;
Cd – концентрация дефектов (вакансии, м/а);
↑δ
D = Cd∙Dd
↓ защитные свойства пленки
δ – отклонение от стехиометрии;
FeO (при ↑ T)
↑ CK
CK – концентрация катионных дефектов;
DК – коэффициент диффузии катионов;
NiO (при ↑ T)
Fe0,88O
↑ DK
↑v
δ = 0,12 молей Fe на моль FeO
Ni0,9999O
v (Ni) << v (Fe)
δ (сульфиды) >> δ (оксиды)
Взаимодействие дефектов
v (оксиды) << v (сульфиды)
↓ Dd
WO3– , TiO2– , Fe1– O
38.
Механизм массопереносамежузельный
rK < a
вакансионный
избыток анионов
избыток катионов
пустые катионные узлы
полупроводник n-типа
полупроводник p-типа
(ZnO, CdO, BeO, Al2O3, Fe2O3,
TiO2, ZrO2, Nb2O5, MoO3 и др.)
(Cu2O, FeO, NiO, WO2, Cr2O3 и др.)
↑T
(восстановительная
среда)
↑ электропроводность
ē по междоузльям
↑T
(окислительная
среда)
↑ электропроводность
ē по «электронным дыркам»
(катионы с более высокой валентностью)
полупроводник амфотерного типа
Низшие оксиды тугоплавких переходных металлов
(TiO, VO и др.) имеют двусторонние фазы
Σ Z+ = Σ ē
Электронейтральность!
39.
межузельныйСхема диффузии при росте пленки типа ZnO
Избыточные катионы Zn и эквивалентные им
электроны
находятся
в
межузельном
пространстве и могут в нем перемещаться:
1 – катионы металла в узле решетки; 2 – анионы
кислорода; 3 – катионы металла в межузельном
пространстве; 4 – электрон
вакансионный
Схема диффузии при росте пленки Cu2O
1 – адсорбированный атом кислорода; 2 – атом
кислорода, ассимилируя от соседних ионов металла
два электрона, превращается в ион; 3, 4, 5, 6, 7 –
катион металла перемещается по пустым местам; 8,
9, 10, 11 – электрон переходит от катиона меньшей
валентности к катиону большей валентности; а, б –
2-х и 3-х валентные катионы металла; в – анион
кислорода; г – электрон; д – атом кислорода.
40.
↓Gдвижущая сила
рО2(г)- парциальное давление кислорода
на границе MeO/O2
(давление в
газовой фазе
рО2(Д)парциальное
давление
кислорода
на
границе
Me/MeO
(равновесное давление диссоциации
оксида, упругость диссоциации)
рО2(г) > рО2(д)
max
(Me+,
[VO
q+])
min (O2-, [VMep-])
max
(O2-,
[VMe
p-])
min (Me+, [VOq+])
[VMep-] – катионные вакансии
[VOq+] – анионные вакансии
Оксид растет за счет направленного перемещения через него не нейтральных атомов, а
эквивалентных количеств положительных и отрицательных носителей тока – катионов,
анионов, электронов и вакансий.
grad (C, μ) – градиент концентраций (химического потенциала)
grad (φ) – градиент электрического потенциала
разная подвижность
зарядов
разделение заряда
электрическое поле
стационарное состояние
торможение
разделения заряда
41.
при h> 1 мкм - grad (φ) ↓ ↓
grad (C, μ)
Атомные и ионные радиусы (по Паулингу)
Водород
Алюминий
Магний
Калий
Кальций
Титан
Хром
Символ
Атома
Н
Al
Mg
К
Са
Ti
Cr
Железо
Fe
1,26
Кобальт
Никель
Медь
Цинк
Молибден
Серебро
Свинец
Кислород
Сера
Хлор
Со
Ni
Cu
Zn
Mo
Ag
Pb
О
S
Cl
1,25
1,25
1,28
1,31
1,39
1,44
1,74
0,6
1,04
1,07
Элемент
Зоны роста плёнки при окислении
металла по Вагнеру
а) DMe+
>> DOб) DMe+ << DOв) DMe+ ≈ DOЕсли пленка электроизолирующая то
окисление не происходит (Al)
Металлы с переменной валентностью
(Fe, Co) – имеют несколько оксидов
(послойно) от высших (газовая среда) к
низшим (Ме)
Наивысший оксид – проводник n-типа
Наинизший оксид – проводник p-типа
Атомный
радиус, Å
0,30
1,43
1,62
2,23
1,97
1,49
1,30
Ион
Н+
Al3+
Mg2+
К+
Ca2+
Ti3+
Cr3+
Cr6+
Fe2+
Fe3+
Со2+
Ni2+
Cu+
Zn2+
Mo6+
Ag+
Pb2+
О2–
S2–
Cl–
Ионный
радиус, Å
1,27
0,50
0,65
1,33
0,99
0,69
0,65
0,52
0,75
0,67
0,82
0,78
0,96
0,74
0,62
1,26
1,21
1,40
1,84
1,81
42.
Теория формирования тонких пленок(Теория Кабреры и Мотта)
Низкие T
замедление диффузии
Тонкие пленки (< 2 нм)
туннельный эффект
хемосорбция
(Me/MeO ) K+ →
( ē + O → O–)
электрическое поле
grad (φ)
←A - (MeO/O2 )
при h > h0 – теория Вагнера
ho – толщина оксидной пленки;
dh0/dt = niνiE/h0V
vi – подвижность ионов;
V – объем оксида, приходящийся на 1 ион металла;
ni – концентрация межузельных ионов (для оксида – полупроводника n-типа);
Е – разность потенциалов на внутренней и внешней границах пленки.
полупроводники n-типа – параболический закон роста пленки
полупроводники p-типа – кубический закон
очень тонкие пленки (движение ионов преобладает в одном направлении) из полупроводника
n-типа – обратнологарифмический закон роста пленки
43.
Оксидные пленки на поверхности железаFeO (вюстит) ГЦК-решетка типа NaCl, 4Fe2+ и 4О2–
Избыток кислорода
О
Fe2+ = Fe3+ + e–
Fe2+
Fe3+
↑ Катионные вакансии
Диффузия Fe2+ и через электронные дырки и межузельное
пространство e– посредством перехода Fe2+ = Fe3+ + e–
полупроводник р-типа
Fe3O4 (магнетит)
- кристаллическая
кубическая решетка типа
шпинели
Диаграмма состояний системы Fe–O
При T < 570 °C 4FeO Fe3O4 + Fe
↓ Cd
Меньший избыток кислорода
Элементарная ячейка содержит 8 Fe3O4. В решетке на
каждый ион Fe2+ приходится два иона Fe3+
Ферромагнитен и обладает электронной проводимостью
Fe3+ – Fe2+ – Fe3+
при рН = 0,3–1,3 растворяется
Структура кристаллической
решетки шпинели. Большие
белые шары – ионы О2-; шары
меньших размеров – ионы
металла в октаэдрических
узлах; маленькие черные
шарики – ионы металла в
тетраэдрических узлах
44.
Fe2O3 (гематит) - ромбоэдрическая структура с минимальной концентрацией дефектовВ элементарной ячейке: 2 Fe2O3: 4 Fe3+ и 6 О2–
До 220 С Сохранение структуры
-Fe2O3 (маггемит)
Fe3O4
Гематит – проводником n-типа
Соотношение толщин оксидов:
FeO:Fe3O4:Fe2O3 - 100:10:1
↑Т до 400–500 С
до 1100 С
-Fe2O3
Диффузия анионов
45.
Схема процесса образования окалиныИнтервал
температуры,
С
От комнатной
до 200
От 200 до 400
400–575
575–730
730–780
730–1150
Выше 1100
Стадии процесса и превращения в
окалине и металле
Закон роста
окалины
Образование пленки, состоящей
из -Fe2O3
Возникновение наружного слоя Fe2O3
на
внешней
стороне
окалины
Возникновение подслоя Fe3O4 на
внутренней стороне окалины
Возникновение подслоя FeO на
внутренней стороне окалины
Магнитное ( -Fe -Fe) и
эвтектоидное (перлит аустенит
эвтектоидной
концентрации)
превращение в стали
Аллотропическое превращение в
стали ( -Fe -Fe)
Частичная диссоциация Fe2O3
Логарифмическ
ий
Логарифмическ
ий
Fe2O3 (гематит)
- миграция ионов O по междоузлиям;
возникновение вакансий в гематите ;
- миграция электронов по анионным
дыркам
Степенной с n
>2
То же
Параболически
й
То же
Сложнопараболически
й
FeO (вюстит)
- миграция ионов Fe по междоузлиям
вюстита или вакантным позициям;
- миграция электронов по катионным
дыркам
Fe3O4 (магнетит)
- миграция ионов Fe по граням
октаэдров или тетраэдров ;
- миграция электронов по катионным
и анионным дыркам
46.
Формирование защитных жаростойких пленок на металлахЛЕГИРОВАНИЕ
Три теории легирования
Теория уменьшения дефектности образующегося оксида
(Вагнер и Хауффе)
Небольшая добавка легирующего элемента окисляется с образованием ионов определенной
валентности и, растворяясь в оксиде основного металла, уменьшает в его кристаллической
решетке концентрацию дефектов (межузельных катионов в оксидах с избытком металла или
катионных вакансий в оксидах с недостатком металла).
Требования к Лэ:
- иметь большее сродство к кислороду, чем у основного металла, т.е. (∆ Gт)ЛэО < (∆ Gт)МеО;
- оксид легирующего элемента ЛэО должен растворяться в оксиде основного металла;
- при легировании металлов, образующих оксиды с избытком металла, валентность ионов
легирующего элемента zЛэ должна удовлетворять неравенству zЛэ > z, где z – валентность
ионов основного металла;
- при легировании металлов, образующих оксиды с недостатком металла, необходимо
соблюдение неравенства zЛэ < z, а при zЛэ = z желательно соблюдение неравенства радиусов
ионов, т.е. rи.Лэ < rи.
Без образования новой фазы!
47.
Теория образования защитного оксида легирующего элемента(А.А. Смирнов, И.Д. Томашов и др.)
На поверхности металла (сплава) образуется защитный оксид легирующего элемента,
затрудняющий диффузию реагентов и окисление основного металла.
Требования к Лэ:
- его оксид удовлетворяет условию сплошности: Voк/V Лэ 1;
- он имеет большее сродство к кислороду, чем основной металл: (∆ Gт)ЛэО < (∆ Gт)МеО;
- размер ионов легирующего элемента должен быть меньше размера иона основного металла,
т.е. rи.Лэ < rи. Это облегчает диффузию легирующего элемента к поверхности сплава, на
которой образуется защитный оксид;
- образуется оксид с высоким электросопротивлением, затрудняющим движение в нем ионов
и электронов;
- оксиды легирующих элементов имеют высокие температуры плавления и возгонки и не
образуют низкоплавких эвтектик. (Это обеспечивает при высоких температурах сохранение оксида в
твердой фазе. Переход оксида в жидкое состояние облегчает протекание диффузионных процессов, а
частичная возгонка оксида увеличивает пористость пленки, что снижает ее защитные свойства);
- легирующий элемент и основной металл образуют твердый раствор, что обеспечивает
образование сплошной пленки оксида легирующего элемента по всей поверхности сплава.
48.
Теория образования высокозащитных двойных оксидов(В.И. Архаров, П.Д. Данков, И.И. Корнилов др.)
Оптимальными являются такие легирующие элементы, которые уменьшают возможность
образования малозащитной вюститной фазы и благоприятствуют образованию двойных
оксидов шпинельной структуры с малым параметром решетки (FeCr2O4, FeAl2O4, NiFe2O4,
NiCr2O4 и др.).
↑ T образования FeO при легировании Cr, Co, Si, Al
Первые следы FeO в окалине
Состав
Чистое железо
Fe + 1,03 %Cr
Fe + 1,5 %Cr
Fe + 1,0 %Co
Fe + 10 %Co
Fe + 1,14 %Si
Fe + 0,4 %Si + 1,1 %Al
Fe + 0,5 %Si + 2,2 %Al
В пассивном состоянии:
Температура Т
появления FeO, С
575
600
650
650
700
750
800
850
Влияние легирования железа
алюминием на относительную
скорость окисления при 900 С
- в чистом железе - магнетит FeO·Fe2O3
- в хромоникелевых сплавах - NiO·Cr2O3
z = 2: Mg, Fe, Ni, Mn
FeO·Cr2O3
z = 3: Al, Fe, Cr
↑Т
(Fe,Cr)2O3
Защитные пленки
49.
Легирование сталей на жаростойкостьЛэ (rЛэ < rFe): Cr, Al, Si
↓ a (параметр решетки)
↓ подвижность
↑ жаростойкость
ρ (Fe2O3) = 5100–5200 кг/ м2
ρ (Cr2O3) = 5210 кг/ м3
Отсутствие
напряжений
5%Cr – жаростойкость до 700 С
15–20%Cr – жаростойкость до 1100 С
Al, Si
FeO·SiO2 и FeO·Al2O3
(2200 и 3960 кг/м3)
Si (> 4 %) и Al (> 1,5 %)
напряжения
↓ пластичность
↑ хрупкость
Влияние легирующих элементов на
относительную скорость газовой
коррозии стали
S, P, Ni, Mn – не влияют
Ti, Cu, Co, Be – немного увеличивают жаростойкость
Мо (до 0,7 %) и V (0,1–0,35 %) – замедляют окисление
Увеличение концентраций
МоО3 (Тпл = 795 С) и V2O5 (Тпл = 660 С)
Для тугоплавких металлов:
- легированием для получения сложных нелетучих оксидов (например, Nb + Ti TiO2·3Nb2O5);
- легированием для приближения отношения Vок/VМе к единице (Nb + V или Мо);
- легированием элементами, оксиды которых термодинамически устойчивее основного металла (Nb + Ti или Zr);
- легированием оксидами для получения дисперсно-упрочненных материалов типа Ме + оксид (W + ThO2; Mo +
Al2O3, Cr2O3, ZrO2, TiO2 и др.)
50.
Влияние внутренних и внешних факторов на химическую коррозиюфакторы
внутренние
(структура, напряжения, качество поверхности)
↑T (∆ G0<0)
↑v
внешние
(состав среды, T, P, скорость движения среды)
Температура
k = A∙exp(–Q/(RT)
k – константа скорости химической реакции (или коэффициент диффузии);
А – постоянная, численно равная k при экстраполяции на 1/Т = 0;
Q – энергия активации химической реакции (или диффузии);
R – газовая постоянная, равная 8,32 кДж/моль;
Т – абсолютная температура.
Уравнение Аррениуса
lg k = lg A – Q/(2,303RT)
изменение лимитирующей стадии или
превращение в металле или окалине
излом наклона прямой линии
Температурная зависимость константы
скорости химической реакции (а) и
коэффициента диффузии (б)
Температурная зависимость окисления стали на воздухе:
а – скорость окисления Km близка к экспоненциальной
зависимости; б – скорость окисления в координатах 1/Т –
lgKm ; вертикальными штриховыми линиями отмечены
изменения наклона
51.
Влияние давления и состава газарО2(г)
лимитирующая стадия
химическая реакция
диффузия
Существенное
v ~ рО2-1/2
v ~?
↑ v с ↑ СО2 только при низких СО2
Дальнейшее ↑ PО2 не сопровождается пропорциональным ↑
v
Пример: v (Fe, Cu, 800–1000 С) в чистом O2 в 2 раза больше
чем на воздухе , хотя рО2 изменяется в 5 раз!
v контролируется диффузией катионов и
Зависимость скорости газовой коррозии
(Cu, Ti, Zr, хромистые стали) от
парциального давления кислорода
PО2 влияния не оказывает !
Совершенная пленка
Высокотемпературная
пассивация
52.
Агрессивная среда:Fe
F, Cl, O2 , SO2, H2S, CO, H2O и др.
– высокая коррозия во всех исследованных газовых средах, которая
значительно увеличивается в интервале 700 °С–900 °С
Cr – высокая жаростойкость во всех четырех атмосферах
Ni
– относительно устойчив в среде O2, H2O и CO2, но сильно
корродирует в атмосфере SO2
Co
– наибольшая скорость коррозии в среде SO2, которая значительно
возрастает при переходе от 700 °С к 900 °С
Cu – наибольшая скорость коррозии в атмосфере O2, но устойчива в
среде SO2
Al и его сплавы, Cr и стали с высоким содержанием Cr устойчивы в
атмосфере, содержащей O2, но неустойчивы в атмосфере, содержащей Cl.
Коррозия углеродистых и низколегированных сталей в выхлопных газах
двигателей внутреннего сгорания, в топочных и печных газах сильно
зависит от соотношения СО и О2.
2CO ↔ C + CO CH ↔ C + 2H
↑v
↑ C(О2)
↑ C(CО)
2
↓v
4
2
Относительная скорость коррозии стали в зависимости
от состава газовой среды при 900 С
Скорость газовой коррозии некоторых
металлов в атмосферах: O2, H2O, CO2 и SO2
за 24 часа при 700 °С и 900 °С
Ванадиевая коррозия:
Fe2O3 + V2O5 = 2FeVO4
4Fe + 3V2O5 = 2Fe2O3 + 3V2O3
V2O3 + O2 = V2O5
6FeVO4 + 4Fe = 5Fe2O3 + 3V2O3
SO2
Состав среды
Чистый воздух
Чистый воздух + 2 %SO2
Чистый воздух + 5 %H2O
Кислород
Воздух + 5 %SO2 + 5 %H2O
O2
SO3
H2 O
Скорость коррозии, %
100
118
134
200
276
SO3 + H2O→ H2 SO4
↑v
53.
Влияние состава, структуры сплава, деформации и обработки поверхностисостав
наличие аллотропических превращений
вид термической обработки
различное структурно-фазовое
состояние
различная стойкость против окисления
Наибольшая жаростойкость у аустенитной фазы
Хромоникелевые стали с однофазной аустенитной структурой более устойчивы против
окисления на воздухе, чем стали с двухфазной аустенитно-ферритной структурой.
Шаровидная форма графита, а также измельчение
графитовых включений присадками Si, Ni, Cu
способствуют повышению жаростойкости серых чугунов
Предварительная
деформация
металла
ускоряет
окисление в его начальной стадии (при температурах, не
превышающих температуру возврата или рекристаллизации)
Интенсивность окисления хромистых
чугунов при 9000С на воздухе: 1 – чугун
с пластинчатым графитом; 2 – чугун с
шаровидным графитом
Защитные свойства оксидной пленки на тщательно
обработанной, гладкой поверхности значительно выше
по сравнению с пленкой на неровной поверхности.
54.
Химическая коррозия в газовых тепелоносителяхПеренос тепловой энергии из активной зоны ЯЭУ осуществляет теплоноситель
Требования к теплоносителю:
- удовлетворительные ядерные свойства (малое сечение поглощения нейтронов, малая
активация при облучении);
- хорошие теплофизические свойства (высокая теплоемкость и теплопроводность, низкое
давление пара при высоких температурах, малая вязкость);
-Низкая коррозионная и эрозионная активность по отношению к конструкционным
материалам и ядерному топливу;
-Достаточная термо- и радиационная стойкость (стабильность состава и свойств в условиях
воздействия высоких температур и обучения);
- Минимальная себестоимость и достаточная распространенность, взрывобезопасность,
негорючесть, нетоксичность.
Углекислый газ (СO2);
Гелий (He);
Вид теплоносителя:
Диссоциирующие газы (N2O4).
- газы;
-вода;
-растворы и расплавы солей;
-органические вещества;
- металлы с низкой температурой плавления.
55.
Углекислый газ↓T или ↑ P
сухой лед
Разложение углекислого газа в поле облучения существенно зависит от параметров газа.
Наличие в СО2 примесей, взаимодействующих с атомами C или O, способствует
разложению углекислого газа под облучением.
не разлагается
При P(СО2)= 1 МПа
не разлагается
При P(СО )= 0,1 МПа
2
↑ T(СО2) или ↑ P(СО2)
Окисление и
науглероживание
конструкционных
материалов
(Zr, Ti, V, Nb, Ta, Be и др.)
Восстановление
СО2 до C
nMe + m/2CO2 MenOm + m/2C
2V + 5/2CO2 V2O5 + 5/2C
Образование
растворов и карбидов
↓ механических свойств
nMe + mCO2 MenOm + mCО
nMe + mCO MenOm + mC
2Cr + 3CO2 Cr2O3 + 3CO
2Cr + 3CO Cr2O3 + 3C
СО, как продукт реакции проникает через образующиеся в пленке поры и способствует
дальнейшему росту окалины и науглероживанию поверхности металла, что ухудшает сцепление
окалины с металлической поверхностью и снижает коррозионную стойкость сталей.
56.
Гелий(инертный газ)
теплоноситель для высокотемпературных реакторов на быстрых нейтронах
Низкое сечение поглощения тепловых нейтронов и не активируется при облучении нейтронами
Теплопроводность He в 10 раз больше, чем CO2
Низкая объемная теплоемкость, (ниже чем у СО2, N2, воздуха), поэтому для аккумуляции
значительного количества тепла в гелии необходимо иметь большой перепад температур на
входе в активную зону и выходе из нее.
Гелий очень текуч и требует высокой герметизации системы
Стоимость гелия очень высока
Загрязнение гелия кислородом, углекислым газом, парами воды,
углеводородными соединениями приводит к коррозии
конструкционных материалов.
Cпримесей < 0,01 %! влияние Zr, Ti, V, Mo, W
Стали обладают коррозионной стойкостью в технически чистом гелии при температуре
до 800–900 С
57.
Диссоциирующие газы(N2O4)
теплоноситель для высокотемпературных реакторов на быстрых нейтронах
(молекулярная теплопроводность и обратимые химические реакции)
Поглощение тепла
Выделение тепла
(диссоциация газа)
(ассоциация газа)
N2O4 ↔ 2NO2 - 620 кДж/кг при 160–180 С
2NO2 ↔ 2NO + O2 - 1250 кДж/кг при 1000–1200 С
Ткип(N2O4) = 21,3 С
Тхим.реак(N2O4, 0,1 МПа) - 21–700 С
Тхим.реак(N2O4, 10 МПа) - 158–900 С
Ткрит(N2O4) = 158,35 С
Продукты диссоциации – сильные окислители!
Коррозионно-стойкие: нержавеющие стали, Al и сплавы на его основе.
Малостойкие: углеродистая сталь, Ni
Не коррозионно-стойкие: Ag, Cu, Zn, Cd.
Коррозионное поведение различается в зависимости от температурного диапазона:
Низкотемпературная область фазовых переходов (зона кипения –конденсация) – 20–200 С
Высокотемпературная область – >200 С
Технический тетроксид N2O4 содержит примеси: NO2, N2, O2, H2O, HNO3, HNO2
↑↑v
Для ↓ v вводят 1–3 % NO (смесь - нитрин) с целью смещения равновесия реакции в сторону
уменьшения содержания HNO3:
2N2O4 + H2O ↔ 2HNO3 + N2O3 ↔ 2HNO3 + NO +NO2
↓ v в 2–3 раза
58.
РАЗДЕЛ 3ТЕМА 1. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Основные признаки и причины
Электрохимическая коррозия – процесс самопроизвольного разрушения
металлических материалов вследствие электрохимического взаимодействия их с
окружающей электрически проводящей средой.
Окислитель отнимает электроны у Me без образования с ним химического соединения
Протекание электрического тока!
(электроны в Ме, ионы в электролите)
взаимодействии Me с жидкими
электролитами
Электрохимическая коррозия
(водой, водными и неводными
растворами солей, кислот и
щелочей, расплавленными Пример: коррозия наружной обшивки судов в воде, металлических
частей гидросооружений, трубопроводов в земле и атомных реакторах.
солями и щелочами)
Пленка влаги
Растворение газов,
оксидов, сульфидов
и т.д
образование кислот
электролит
Электрохимическая
коррозия
Склонность Me к электрохимической коррозии зависит от:
- потенциал ионизации атомов металла (сила связи электрона с атомом)
- свойства электролитов (концентрация, электропроводность, присутствие растворенных газов,
степень диссоциации, коэффициент диффузии, числа переноса катионов и анионов и др.)
59.
Электролиты(Ионная проводимость!)
твердые
растворы
(Кристаллические
вещества)
(вещества, подвергающиеся
электролитической
диссоциации при
взаимодействии с
растворителем)
менее опасны
Наиболее опасны и
распространены
расплавы солей
(вещества, подвергающиеся
электролитической
диссоциации при плавлении,
MgCl2, NaCl)
опасны в определенных
температурных интервалах
Электролитическая диссоциация
60.
α – степень диссоциацииα ≈ 1 сильные электролиты (растворы солей и некоторые
органические кислоты)
α → 0 слабые электролиты (растворы большинства органических
кислот и оснований)
Гидратированный катион (анион) – в водном растворе
Сольватированный катион (анион) – в неводном растворе
Выделившаяся энергия – энергия гидратации или сольватации
Электрическая нейтральность раствора сохраняется!
H2SO4 = 2H+ + SO422 катиона и 1 анион
CuCl2 = Cu2+ + 2Cl1 катион и 2 аниона
Чем меньше ион, тем больше подвижность!
Наиболее подвижны – электроны в Me!
61.
Механизм электрохимической коррозии. Работа гальванического элементаЭлектрод
–
проводник,
имеющие
электронную проводимость (проводники
1-го рода) и находящиеся в контакте с
ионным проводником (проводник 2-го рода)
Замыкание цепи
Электрохимическая коррозия
Гальванического элемента Якоби–Даниэля
анод (-) Zn│ZnSO4││CuSO4│Cu катод (+)
Zn - 2е = Zn2+
Cu2+ + 2е = Cu
Окисление метала до
положительных ионов
суммарный
++
I
=
Σ
I
i
ток
катионы (H+, Me+)
А = neFE
восстановление подошедших
положительных ионов электролита
До полного растворения анода!
ΣIi- = Iē
I = E/R - закон Ома и для Me и для электролита
к катоду (-)
анионы (Cl-, OH-, SO42-)
к аноду (+)
- работа, производимая гальваническим элементом при расходе 1 моля
металла, определяется произведением количества электричества neF на ЭДС E
ne – число молей электронов, протекающих через цепь; F – число Фарадея, равное 96493 Кл
Если элемент работает обратимо при постоянном давлении и температуре, то произведенная им работа равна
убыли свободной энергии: -∆ G = A
(необратимо)
∆G = -ne·F·E
∆G > ne·F·E
62.
Гетерогенность поверхности и микрогальванические элементыГетерогенность в системе Me - электролит
Схематическое изображение многоэлектродной
системы, включающей макро- и микроэлементы:
1 и 2 – различно ориентированные кристаллиты;
3 – шлаковое включение; 4 – граница между
зёрнами;
5
–
обеднённая
легирующим
компонентом
зона
твёрдого
раствора;
6 – выделившееся из твёрдого раствора
интерметаллическое соединение; 7 – пора в
плёнке; 8 – защитная плёнка;
А – менее аэрируемый участок (анод); К – более
аэрируемый участок (катод)
Неоднородность металлической фазы:
- электропроводящие макро- и микровключения (примеси, интерметаллические и другие
соединений);
- ликвация сплавов;
-наличие поверхностных дефектов (шероховатость, скопление дислокаций);
- анизотропия металлического кристалла;
- неоднородности и дефекты в защитных оксидных пленок на поверхности металла.
Неоднородность жидкой фазы (электролита):
-различная концентрация ионов на отдельных участках контакта фаз и концентрацией окислителей;
- различие pH отдельных зон объема электролита.
Неоднородность наложения внешних физических условий:
-различная температура отдельных участков поверхности металла;
- различная интенсивность облучения;
- неравномерное наложение внешнего электрического поля.
63.
Электрохимическая коррозия(2 самостоятельных но сопряженных процесса)
Анодный процесс
переход атомов металла в раствор в виде
гидратированных (или сольватированных)
ионов с оставлением соответствующего
числа электронов на поверхности металла
Катодный процесс
присоединение электронов ионами или
молекулами раствора (деполяризаторами),
способными к восстановлению на катодных
участках.
zē ← zēMen+ + mH2O → Mez+·mH2O
Zn = Zn2++ 2е
Химическая энергия реакции окисления металла не
передается в виде работы, а лишь в виде теплоты!
Масса растворяющегося металла определяет количество освобождающихся электронов – силу
тока многоэлектродной системы, называемой током коррозии.
Отсутствует внешняя цепь!
Плотность тока (анодная или катодная) – удельная сила тока, приходящаяся на единицу
поверхности корродирующего металла, т.е.
ja = zFΔm/SaAmt
АМ – атомная масса металла; ∆m – убыль этой массы металла за время t; Sa – площадь анода; z – число
валентных электронов, F – число Фарадея.
64.
Явления на границе раздела фаз металл –электролитMe+·ē → Me+ + ē
ион-атомам
ион
Me+·ē +mH2O → Me+·H2O + ē
ион-атомам
гидратированный
ион
электроны перетекают с анодных участков к катодным
Ме становится заряженным отрицательно, а раствор – положительно
При растворении кислот:
2H+ + 2ē → 2H → H2 ↑
+
+
При избытке кислорода: на аноде: 4Me ·ē +4H2O → 4Me ·4H2O + 4ē
на катоде: 4ē +2H2O + О2 → 4(OH)-
На фазовой границе металл-раствор
возникает двойной электрический слой
(д.э.с.)
Активный Me пассивный Me
Схема двойного электрического слоя:
а – при выходе иона металла из металла в
раствор; б – при переходе катиона из раствора
на поверхность металла
Аналог плоского конденсатора!
65.
Двойной электрический слой электрически нейтрален(↑ ↑ напряженность электрического поля )
↑ Sпов и ↓d
↑L
(до 20 мкФ/см2)
плотный слой (порядка радиуса иона)
диффузный слой ( порядка 1 мкм)
электрофорез – движение в жидкости
взвешенных твердых частиц, пузырьков, капель
другой жидкости под действием внешнего
электрического поля
Изменение потенциала
металла в зависимости от
распределения зарядов в
растворе: Ппл. ч. – потенциал
металла относительно
раствора, приходящийся на
плотную часть д.э.с.
толщиной δ; Пдиф.–
потенциал металла,
соответствующий диффузной
части д.э.с. толщиной λ
электроосмос – движение жидкости д.э.с. при
наличии градиента потенциала в водной среде и др.
66.
Электродный потенциалыЭлектрод – система металл–раствор, содержащий его ионы
Электродный потенциал – разность (скачок) потенциалов между металлом и
раствором
Vокис.
=
Vвост.
равновесие
Me ↔ Mez+ + zē
равновесный электродный потенциал (обратимый электродный потенциал)
ja = jk= j
j0 – плотность тока обмена, которая характеризует
скорость процесса постоянного обмена ионами
0 между металлом и раствором.
Уравнение Нернста
φ = φ0 + RT/(zF) ln(aMez+)
φ° – стандартный потенциал металла, В; z – степень окисления металла; aMez+– активность ионов металла, г-ион/л
φ = φ0 + (0,059/z) lg(aMez+)
aMez+ = 1
φ = φ0
T = 298 К
67.
Определяется ЭДС!ЭДС (E) = φ - φ0
Потенциал измеряемого электрода
Принимаем φ0 = 0
Схема водородного электрода сравнения:
1 – платинированная (чернёная)
платина; 2 – раствор кислоты
aH+ = 1 г-ион/л
PH = 1атм.
H2 ↔ 2H+ + 2ē
на электроде
Стандартный электродный потенциала металла
(металлоида) – ЭДС, возникающая в цепи
(гальваническом элементе) «водородный электрод»–
металл, погруженный в раствор своей соли с
активностью
одноименных
ионов
металла
(металлоида), равной единице.
Стандартный электродный потенциал – в
частный случай равновесного потенциала.
E = φп – φл
Если φл – потенциал водородного электрода, то E
по водородной шкале!
= φп
68.
ЭДС элемента считают положительной, если положительные заряды внутри цепиперемещаются слева направо, при этом:
Emax = –ΔGT/(zF)
ЭДС элемента считают отрицательной, если положительные заряды внутри цепи
перемещаются справа налево, при этом:
Emax = +ΔGT/(zF)
В реальных условиях – участие других компонентов в обменных реакциях
установление неравновесного (необратимого) потенциала - стационарного
Уравнение Нернста - неприменимо!
Значения
неравновесных
электродных
потенциалов
определяют
экспериментально в зависимости от внутренних (связанных с металлом) и
внешних (связанных с электролитом и физическими условиями) факторов.
69.
Стандартные электродные потенциалы некоторых элементовв водных растворах при 25 ºС
Электрод
Li+ | Li
Rb+ | Rb
K+ | K
Ba2+ | Ba
Ca2+ | Ca
Na+ | Na
Mg2+| Mg
Be2+ | Be
U3+ | U
Hf4+ | Hf
Al3+ | Al
Ti2+ | Ti
Zr4+ | Zr
U4+ | U
Pu4+ | Pu
Ti3+ | Ti
Mn2+| Mn
Nb3+ | Nb
Zn2+ | Zn
Электродная
реакция
Li+ + e– = Li
Rb+ + e– = Rb
K+ + e– = K
Ba2+ + 2e– = Ba
Ca2+ + 2e– = Ca
Na+ + e– = Na
Mg2++ 2e– = Mg
Be2+ + 2e– = Be
U3+ + 3e– = U
Hf4+ + 4e– = Hf
Al3+ + 3e– = Al
Ti2+ + 2e– = Ti
Zr4+ + 4e– = Zr
U4+ + 4e– = U
Pu4+ + 4e– = Pu
Ti3+ + 3e– = Ti
Mn2++ 2e– = Mn
Nb3+ + 3e– = Nb
Zn2+ + 2e– = Zn
E0 , В
–3,04
–2,92
–2,92
–2,90
–2,87
–2,71
–2,38
–1,85
–1,80
–1,70
–1,66
–1,63
–1,53
–1,50
–1,28
–1,21
–1,18
–1,10
–0,76
Электрод
Cr3+ | Cr
Fe2+ | Fe
Cd2+ | Cd
Mn3+ | Mn
Co2+ | Co
Ni2+ | Ni
Sn2+ | Sn
Pb2+ | Pb
Fe3+ | Fe
H+ | H2, Pt
Cu2+ | Cu
Cu+ | Cu
Hg22+| Hg
Ag+ | Ag
Hg2+ | Hg
Br–| Br2, Рt
Pt2+ | Pt
Cl–| Cl2, Pt
Au3+ | Au
Электродная
реакция
Cr2+ + 3e– = Cr
Fe2+ + 2e– = Fe
Cd2+ + 2e– = Cd
Mn3++ 3e– = Mn
Co2+ + 2e– = Co
Ni2+ + 2e– = Ni
Sn2+ + 2e– = Sn
Pb2+ + 2e– = Pb
Fe3+ + 3e– = Fe
H+ + e– = ½ H2
Cu2+ + 2e– = Cu
Cu+ + e– = Cu
Hg22++2e–= 2Hg
Ag+ + e– = Ag
Hg2+ + 2e– = Hg
Br2 + 2e–= 2Br–
Pt2+ + 2e– = Pt
Cl2 + 2e–= 2Cl–
Au3+ + 3e– = Au
Ряд стандартных потенциалов или ряд напряжений
E0 , В
–0,74
–0,44
–0,403
–0,283
–0,27
–0,24
–0,136
–0,126
–0,036
0,000
+0,337
+0,52
+0,798
+0,799
+0,854
+1,066
+1,188
+1,359
+1,50
70.
Восстановление или окисление ионовMez+(раствор) + n/2Н2(газ) = Me(тв.) + nН+(раствор)
ΔG0 = n ΔG0H+ + ΔG0Me(тв.) – n/2 ΔG0H2(газ) – ΔG0Mez+
ΔG0Me(тв.) = 0
ΔG0H2(газ) = 0
ΔG0 = n ΔG0H+– ΔG0Mez+
ΔG0H+= 0
ΔG0 = – ΔG0Mez+
Стандартная свободная энергия иона:
Самый сильный восстановитель – Li
Самый сильный окислитель – ионы Au
Наиболее активный – анод!
ΔG0i = – zi E0F
71.
Mez+(раствор) + n/2Н2(газ) = Me(тв.) + nН+(раствор)ΔG0i = – zi E0F
ΔG0 = ΔH0 + TΔS0
При T = 298 К, ΔS0 → 0
ΔG0 = ΔH0
Me
ΔG0 = z (–1/2 Eд – UH+ + HH+ – HMez+ + UMez+ + U0)
H
Eд – энергия диссоциации молекулы водорода на атомы
UH+ – потенциал ионизации атома водорода
HH+ – теплота гидратации иона водорода
HMez+ – теплота гидратации иона металла
UMez+ – потенциал ионизации атома металла
U0 – теплота сублимации
ΔG0 ~ UMez+
↓UMez+
↑ HMez+
эндо
эндо
экзо
эндо
экзо
экзо
HMez+ ~ (Z, r)
переход в электролит
Образование пленок
Пример: Li
наименее благородный Me
Сдвиг потенциала!
Пример: Cr и Fe: пассивная пленка на Cr (катод)
72.
Термодинамика процессов электрохимической коррозии металловΔGT = – n ETF < 0
Протекание электрохимической коррозии
ΔGT – изменение энергии Гиббса, Дж;
n – число электронов или химических эквивалентов, участвующих в реакции;
ET = (φк)обр – (φа)обр
- ЭДС гальванического (или микрогальванического)
элемента, в котором обратимо осуществляется данный
коррозионный процесс;
(φк)обр – обратимый потенциал катодной реакции в данных условиях;
(φа)обр = (φMe)обр– обратимый потенциал металла (анода) в данных условиях.
φa = φ0Mez+/Me + RT/(zF) ln(aM)
Zn - 2е →
Zn2+
(φMe)обр =(φа)обр < (φк)обр = (φО2)обр
φк = φ0D/(Dzē) + RT/(zF) ln(aD)
2H+ + 2ē → 2H → H2 ↑
4ē +2H2O + О2 → 4(OH)-
(φMe)обр < φкор < (φО2)обр
Стационарный потенциал
Чем больше ЭДС любого гальванического элемента, тем больше
термодинамическая возможность протекания его суммарной реакции!
73.
Диаграммы Пурбедля воды
водородная деполяризация:
кислый раствор
H3O+ + ē = 1/2H2 + H2O
щелочной раствор
2H2O + 2ē = H2 + 2OH–
кислородная деполяризация:
нейтральный и щелочной раствор
O2 + H2O + 4ē = 4OH–
кислый раствор
Диаграмма φ - pH
O2 + 4H+ + 4ē = 2H2O
φH+/H2 = φ0H+/H2 + 0,059lg(aH)
(2)
φH+/H2 = – 0,059pH
(1)
φO2/OH- = 1,23 – 0,059pH
74.
для системы металл - водаТри типа равновесий Me – вода:
Mez+ + zē ↔Me
1. Равновесный обмен электрическими зарядами
(Не зависит от pH)
2. Ионно-молекулярные равновесия
(Не зависит от φ)
Mez+ + zOH– ↔Me(OH)z
3. Равновесия, которые зависят и от pH и от φ
Me(OH)z + zē↔ Me + zOH–
Окисление воды с выделением кислорода
Термическая устойчивость воды
Линия 1наклон:
Fe2+ + 3H2O ↔ Fe(OH)3 + 3H+ + ē
Линия 2:
Fe ↔ Fe2+ + 2ē
Линия 1 вертикаль:
Fe3+ + 3H2O ↔ Fe(OH)3 + 3H+
Линия 3:
Fe(OH)2 ↔ HFeO2–+ H+
В: Подщелачивание (увеличение pH);
С: Катодная защита;
D: Анодная защита;
Восстановление воды с выделением водорода
Диаграмма Пурбе для Fe, Т = 298 К, a(Fe) = 10-6 моль/л
75.
Кинетика электрохимических процессов коррозииПоляризация и деполяризация
j = (φк0 – φа0)/R
φк0 и φа0– начальные потенциалы катода и анода (до замыкания цепи);
R – омическое сопротивление системы, связанное с затруднениями, возникающими при прохождении
электронов через кристаллическую решетку металла или ионов через раствор.
Погружение в электролит
R - мало
↓j
φ = const – стационарный потенциал металла
φк0 → φа0
Δ φ → min
φа0 → φк0
!
Поляризация – сближение потенциалов и уменьшение их разности, приводящее к
уменьшению силы тока, протекающего через электрод, и, следовательно, скорости коррозии.
отставание электродных процессов (на аноде и катоде) от перетока e по проводнику в коррозионном элементе
Деполяризаторы (D) – вещества, добавление которых препятствует поляризации или
уменьшает ее на аноде или катоде. Пример: Cl– - затрудняют наступление анодной пассивности металлов
Деполяризация – уменьшение поляризуемости электродов. Пример:
перемешивание электролита
76.
Электрохимическая реакция (электродная):подвод реагентов к поверхности электрода;
электрохимическая реакция, способствующая переносу заряженных частиц (электронов или
ионов) через границу раздела фаз, может включать в себя и химические реакции;
отвод продуктов реакции от электрода.
Наиболее медленная – лимитирует реакцию!
реакция анодного окисления
(растворения) металла
смешанный контроль
реакции катодного
восстановления окислителя
анодный контроль
Анод
↑ Mez+
отстает
катодный контроль
+
ē!
Катод
↑ē
D + ze → Dze
отстает
–
–
Изменение потенциала электрода (поляризация), из-за изменения отвода и подвода
зарядов к границе раздела фаз Ме – электролит приводит к нарушению равновесия
электродной (катодной или анодной) реакции и изменению ее скорости.
77.
Поляризация:Концентрационная поляризация – смещение потенциала электрода вследствие изменения
концентрации ионов металла в приэлектродном (диффузионном) слое при прохождении тока.
Активационная поляризация – смещение потенциала электрода вследствие замедленности
электродной реакции (для начала электрохимической реакции на электроде требуется энергия
активации, необходимая для существенной перестройки структуры реагирующих частиц в
ходе реакции).
Частицы, энергия которых (Е) больше или равна энергии активации (Еа), называются
активными.
Для ↑
Пример:
Vкор
↑E
Т
или катализатор
или ↑
H3O+ + e – → Hадс + H2O
Лимитирующий процесс – стадия разряда!
↓ Еа
Водородное перенапряжение
(перенапряжение выделения водорода)
Подвижность H - не влияет!
2OH– → ½ O2 + H2O + 2e –
Перенапряжение выделения водорода
Перенапряжение
(электродное перенапряжение)
78.
Перенапряжение–отклонение потенциала от равновесного значения, показывающее
затрудненность электродного процесса, либо одной из его стадий.
Затрудненность отдельных стадий электродного процесса характеризуется соответствующими
перенапряжениями:
ηи – перенапряжение реакции ионизации;
η = ±(a + b·lgj) - Уравнение Тафеля
+
-
- анодное перенапряжение
ηр – перенапряжение химической реакции;
- катодное перенапряжение
ηд – перенапряжение стадии переноса (диффузии), когда наиболее затруднена доставка или отвод
участников реакции взаимодействия.
a - зависит от природы реакции, материала электрода, состояния его поверхности, состава
раствора и температуры, т.е. характеризует степень неравновесности данного электрода
Пример: a (Pb) = 1,56, a (Cd) = 1,4, a (Zn) = 1,24, a (Cu) = 0,87, a (Fe) = 0,7, a (Pt)= 0,1
b (0,1 – 0,12 при 298 К)- зависит от природы реакции, и температуры
j=1
η=a
ηД = RT/(nF)·lg(1 + j/jпр)
j – плотность тока электродной реакции при данном значении потенциала, А/м2;
jпр – предельная плотность тока диффузии, соответствующая максимальной скорости
электродного процесса при данных условиях, А/м2
jпр = nFCокD/δ
Сок – концентрация окислителя в растворе электролита;
D – коэффициент его диффузии,
δ – толщина диффузионного слоя
79.
Торможение коррозииПоляризация катода
Деполяризация катода
Х
Mez+, H+, анионы кислот, О2, H2О2
2H+ + 2ē → 2H → H2 ↑
4ē +2H2O + О2 → 4(OH)-
Водородная деполяризация
Кислородная деполяризация
φH+/H2 = – 0,059pH
φO2/OH- = 1,23 – 0,059pH
коррозии электроотрицательных
металлов в кислых средах, а также
в нейтральных средах металлов,
имеющих большое отрицательное
значение потенциала.
коррозия всех металлов, в том
числе и электроотрицательных, в
нейтральных и щелочных средах.
Это наиболее распространенный
тип коррозионного процесса.
80.
Коррозионные диаграммыjа = Kaexp(+βnFφкор/RT)
jк = Kк С ок exp(-αnFφкор/RT)
jа и jк – плотности тока анодного и катодного процесса соответственно;
Ka и Kк – константы скорости анодной и катодной реакций;
α и β – коэффициенты переноса в катодном и анодном процессах (α + β = 1);
С ок – концентрация восстанавливающегося окислителя в растворе электролита;
φкор – стационарный потенциал корродирующего металла.
∆φa – анодная поляризация
∆φк – катодная поляризация
φх – стационарный потенциал
jmax – максимальная
плотность тока коррозии
∆φR = jRR - омическое
торможение R ≠ 0
Поляризационная диаграмма, отражающая
изменение потенциала при протекании
тока: кривая А отражает кинетику
ионизации металла (анодная кривая),
кривая К – кинетику восстановления
деполяризатора (катодная кривая)
Для выбора
метода защиты!
Диаграмма Эванса:
1 – анодная кривая, 2 – катодная
кривая; плотность тока коррозии
(jкор = jmax) отвечает потенциалу
коррозии φx, когда jа = jк
81.
Если ∆ φa >> ∆ φк, - анодное торможениеЕсли ∆ φк >> ∆ φа, - катодный контроль
Если ∆ φк ≈ ∆ φа, - смешанный контроль
Тормозящий фактор при катодном контроле (φк >> φa):
- замедленность реакции восстановления (перенапряжения
ионизации) молекул кислорода (в хорошо перемешиваемых
нейтральных средах);
замедленность
реакции
разряда
иона
водорода
(перенапряжения водорода), коррозия Fe, Zn и др. Me в кислых
средах;
- замедленность диффузии кислорода (в перемешиваемых
нейтральных растворах) для Fe, Zn и др. Me.
Смешанный катодно-анодный контролье (φк ≈ φa, R ≠ 0):
- коррозия Fe, сталей, Al и др. Me в пассивном состоянии.
Поляризационные диаграммы для
основных практических случаев контроля
электрохимических коррозионных
процессов: катодный контроль при
основной роли перенапряжения ионизации
кислорода (а), диффузии кислорода (б) и
перенапряжения водорода (в); смешанный
анодно-катодный (г), катодно-омический (д)
и катодно-анодно-омический (е) контроль
Смешанный катодно-омический контроль (φк >> φa, R ≠ 0):
- пространственно разделенные катодные и анодные участки
Me в среде с низкой электропроводностью (коррозия
подземного трубопровода).
Cмешанный катодно-анодно-омический контроль
(φк ≈ φa, R ≠ 0):
- для Me, склонных к пассивации при большом омическом
сопротивлении
электролита
(атмосферная
коррозия
коррозионностойких сталей).
82.
Пассивность металловПассивность металла - состояние его повышенной коррозионной устойчивости в агрессивной
среде, вызванное торможением анодного процесса ионизации металла в определенной области
потенциала.
следствие образования на поверхности металла оксидных или иных защитных слоев.
(переходные металлы)
Пассивация или поляризация
Анодная пассивация
(внешний анодный ток)
Химическая пассивация
(введение подходящего окислителя)
Легирование
(Si, Cr в Fe)
Ускорение коррозии,
восстановление
Х
Пассивирование
металла
V
Пассивирующие факторы или пассиваторы – вещества или процессы, вызывающие в
определенных условиях (в нейтральных растворах, в воде и водных растворах солей) наступление
пассивного состояния металлов.
Пассивирующие факторы: анодная поляризация (анодное окисление)
Пассиваторы: неорганические окислители HNO3, NaNO3, K2Cr2O7, KMnO4, аэрированные
водные среды и др.
образуют пассивную пленку непосредственно сами или в виде продуктов реакций (оксиды)
83.
Теории пассивациипленочная
адсорбционно-пленочная
образования на поверхности
металла защитной оксидной
пленки.
Me
перестройка поверхностного слоя
металла в результате взаимодействия
металла с водным раствором
электролита.
адсорбционная
насыщение валентностей
поверхностных атомов металла
вследствие образования
химических связей с
адсорбирующимися атомами
кислорода или других
окислителей.
[Mem(H2O)]адс
гидратация
Поверхностный
комплекс
электролит
H2O
Поверхностные ион-атомы
Компоненты раствора
растворение
пассивация
[Me(H2O)]адс → MeO + 2H+ + 2e–
Диссоциативная адсорбция
Образование зародыша и рост оксидной пленки
φ↑
84.
Активаторы или депассиваторы - вещества или процессы, способствующие металлуперейти в активное состояние (депассивироваться).
Причины депассивации:
восстановление, механическое нарушение пассивного слоя, катодная поляризация, действие
активных ионов (SO22-, OH-, Cl, F-, I-, Br-), повышение температуры среды и др.
Разрушение пассивной пленки
Характер действия пассиватора и активатора
в растворе и соотношения их концентраций
Активное состояние
Пассивное состояние
Перепассивация - нарушение пассивности в сильно окислительных средах.
(Образование оксидов высших валентностей, растворимых в среде, ↑Т, ↑Cок)
Потенциал перепассивации – потенциал, соответствующий переходу металла из
пассивного состояния в состояние перепассивации.
Торможение перепассивации:
смещением потенциала металла в отрицательную сторону:
- уменьшение концентрации окислителя в среде;
- добавление восстановителя;
- катодная поляризация металла от внешнего источника постоянного тока.
85.
I – область активного растворения, где металл переходит вионное состояние.
II – область формирования пассивного состояния, начало
которого характеризуется потенциалом пассивации (φп) и
плотностью тока (jп). Замедление скорости растворения
вызвано образованием оксида или гидроксида металла:
Me + mH2O → MeOm + 2mH+ + mē
Me + mOH- → Me(OH)m + mē
III – область пассивного состояния, наступающего при
достижении
потенциала
полной
пассивности
(φпп),
характеризуемого плотностью тока полной пассивности.
φпр - потенциал «пробоя» или питтингообразования, (пробой
при наличии активаторов, ведущий к локальному анодному
растворению - точечной коррозии или питтингу (1).
IV – область перепассивации (φпер). Происходит образование
оксидов высших валентностей, растворимых в данных
условиях.
выделение кислорода (2) при потенциале выделения
кислорода (φO) по реакциям:
2H2O → 4H+ + 4ē +O2↑
кислая среда
4OH- → 2H2O + 4ē +O2↑ щелочная среда
Анодная поляризационная диаграмма анодирование (3), при φан – образование толстого (до 200 мкм)
пористого слоя оксида.
86.
Особенности коррозии конструкционных материалов в пароводяной средеЯдерные реакторы с водяным охлаждением
(P(H2O) до 16-25 МПа, Т(H2O) до 360 – 540 °С )
μO(H2O - пар)<< μO(воздух)
Изменение химического и фазового состава окалины
воздух
(гетерофазная окалина)
При T > 570 ºС:
- вюстит
- магнетит
- гематит
водяной пар
(однофазная окалина, низшие оксиды)
T до 500 ºС :
T от 500 ºС до 700 ºС:
T > 700 ºС:
– магнетит (Fe3O4) – вюстит (FeO)
- вюстит (FeO)
– магнетит (Fe3O4)
избирательное окисление (для сплавов)!
Хорошие защитные свойства!
Пример: В пароводяных котлах при T < 450 ºC:
3Fe + 4H2O → Fe3O4 + 4H2
растворение
при T > 450 ºC:
при T > 700 ºC:
наводороживание
Fe + H2O → FeO + H2
3FeO + H2O → Fe3O4 + 4H2
Fe + H2O → FeO + H2
Молизация водорода - образование газовых полостей (снижение механической прочности и охрупчивание стали).
Взаимодействие водорода с примесями
При
↑P и T:
4H + Fe3C ↔ 3Fe + CH4
Образование хрупких гидридов
образование Fe3C
↑T
по границам зерен
↑P
образование CH4
87.
Влияние внетренних и внешних факторов на процессы электрохимической коррозиифакторы
внутренние
внешние
-состав коррозионной среды
- pH раствора,
- наличие пассиваторов и депассиваторов
- температура
- давление
- скорость движения среды
- внешняя поляризация
- действие ультразвука и облучения
- и др.
- химический состав
- структура
- состояние поверхности
- напряжения в металле
- и др.
Возможность процесса коррозии
V
или
Х
Механизм и кинетика процессов
коррозии
Стандартный электродный потенциал
примеси
анодные
катодные
усиливают коррозию
не влияют
локальная коррозия
88.
Низкая коррозионная стойкость: щелочные и щелочноземельные металлы (левые подгруппы I и II групп)Высокая коррозионная стойкость: низ группы VIII (Os,
Ir, Pt) и в группе I B (Au).
Склонные к пассивации: металлы в правых подгруппах IV, V и VI групп (склонность к пассивации растет с ↓z)
89.
Правило Таммана:Скорость коррозии изменяется скачкообразно по мере добавления количества кратного n/8 атомной
доли более благородного металла
Диаграммы, иллюстрирующие правило Таммана:
а – для сплавов Cu-Au;
б – для сплавов Fe-Cr;
v – скорость коррозии
а
б
- кристаллографическая ориентация (разная плотность упаковки)
Размер зерна – не влияет!
↑ Eпов (наклеп)
- шероховатость поверхности
↑ S и количества активных центров
растянутые участки - анод
- внутренние напряжения
сжатые участки - катод
φ → “-”
φ → “+”
90.
Внешние факторыКонцентрация и состав среды:
кинетика
Концентрация деполяризаторов!
pH = - lgCH+
pH < 7
кислая среда
↑OH–
CH+ – концентрация ионов водорода в растворе, г-ион/л
pH > 7
Щелочная среда
pH ≈ 7
нейтральная среда
↑pH
OH– + H+ → H2O
Только на катодный процесс!
↑ H+
↓pH
↑ «+»
φH+/H2
Зависимость скорости коррозии железа от
концентрации неокислительной кислоты
(HCl, кривая 1) и окислительной (HNO3, кривая 2);
v – скорость коррозии
↑ Vкор
Для неокислительных кислот!
91.
Разделение металлов по виду зависимости скорости коррозии от pH среды:(Ag, Au, Pt)
(Mg, Mn, Fe)
(Ni, Co, Cd)
(Ta, Mo, W) (Al, Zn, Sn, Pb, Bi, Be, Cu)
а) металлы, устойчивые в кислой и щелочной средах, скорость коррозии которых не зависит от pH ;
б) металлы, нестойкие в кислой среде и недостаточно стойкие в нейтральной среде, но устойчивые в
сильно щелочной среде (pH ≈ 14) за счет образования пленок гидроксида;
в) металлы, неустойчивые в кислотах и устойчивые в нейтральной и щелочной средах;
г) металлы, устойчивые в кислой среде и неустойчивые в щелочной среде;
д) металлы, стойкие только в нейтральной среде за счет образования амфотерных гидроксидных
пленок. Такие пленки одинаково хорошо растворяются как в кислой, так и в щелочной среде.
92.
↓ОРастворы солей:
Mg
↑А–
Al
Влияние концентрации электролита на скорость коррозии (а),
растворимость кислорода СО2, концентрацию аниона Ca (б) и величину pH (в)
К+ и А–
адсорбция
Снижение агрессивности среды:
изменение строение ДЭС
разрушение пассивной пленки
- удаление кислорода - деаэрация раствора паром (кипячением) с последующим добавлением
связующих кислород веществ (сульфита натрия Na2SO3 или гидразина N2H4) или добавлением в
него поглотителей кислорода;
- удаление кислот путем нейтрализации раствора щелочью (едким натром NaOH);
- удаление солей из воды, идущей на питание паровых котлов путем обработки ее
ионообменными смолами;
- удаление из среды мелких твердых частиц и агрессивных компонентов фильтрацией или
абсорбцией.
93.
Замедлители (ингибиторы)Ингибиторы коррозии (ИК) – химические соединения, которые, присутствуя в коррозионной
системе в достаточной концентрации, уменьшают скорость коррозии без значительного изменения
концентрации любого коррозионного реагента.
Только для постоянных объемов раствора!
(резервуары, цистерны)
Cинг = f(состав, Т, pH, др.) > Cинг0 = 0,01 – 1,00
деполяризатор
Cинг < Cинг0
↑ Vкор
адсорбирующиеся
пленкообразующие
ингибиторы
анодные
(кислород, нитраты, хроматы,
фосфаты, силикаты и др.)
пассивация
смесь ингибиторов
активаторы
(стимуляторы)
изменение структуры ДЭС
экранирование Me от электролита
катодные
смешанные
(Na2SO3)
поглощение кислорода
ZnCl, ZnS
Zn(OH)2
(оксиды мышьяка и висмута) ↑η
(силикаты, полифосфаты,
нитриты аминов)
синергизм
антагонизм
анодные
катодные
(Cl–, Br–, I–, CN–)
(ионы с переменной валентностью)
Fe3+ + e– → Fe2+
катод
депассивация
4Fe2+ + O2 + 4H+ → 4Fe3+ + 2H2O
раствор
94.
Температура и давлениеУвеличение температуры:
- возрастание электропроводности;
- возрастание скорости диффузии окислителя к поверхности металла;
-возрастание подвижности продуктов коррозии от поверхности;
- снижение перенапряжения электродных реакций;
- снижается растворимости деполяризатора и вторичных продуктов коррозии.
↑Т
↑Т
раствор неокисляющих кислот
H2SO4 или HCl
↓η
нейтральные электролиты
↑ Vкор ~ A∙exp(–Q/(RT)
↓η, ↑D, ↓a
∆φ
↑Т
переполюсовка
Например: Zn - сталь
∆T
неоднородность
↑P
Термогальваническая
коррозия
↑a (O)
наводороживание, механические
напряжения, ↑ катодный процесс при
кислородной деполяризации
Зависимость скорости коррозии железа
в воде, содержащей растворенный кислород,
от температуры
↑ Vкор
95.
Скорость и характер движения средыCl–
Зависимость скорости коррозии от скорости
движения электролита
кавитационная эрозия или кавитационная коррозия
1 – увеличение скорости коррозии за счет увеличения скорости движения электролита,
облегчающего диффузию окислителя (кислорода) к катодным участкам поверхности металла;
2 – процесс коррозии замедляется вследствие пассивации анодных участков кислородом и
образованием на них защитных оксидных пленок;
3 – скорость коррозии резко возрастает из-за механического удаления защитной пленки
быстродвижущимся потоком жидкости (эрозия).
Например: лопатки гидравлических турбин, гребных винтов, труб, втулок дизелей и т.п.
трещины, углубления, раковины
96.
Ультразвук- перемешивание, устраняющее концентрационную поляризацию;
- активационное воздействие на реагирующие частицы и внедрение их в двойной электрический слой;
- возбуждение электронных оболочек реагирующих частиц, вызывающее переход электронов;
- десорбционное и диспергирующее воздействие;
- возникновение механических напряжений
- и др.
ультразвук
электролитическое выделение водорода и кислорода
ускорение растворения (алюминий в растворе NaOH)
слабое поляризующее или сильное деполяризующее воздействие
Облучение
среда
Me
Нарушение кристаллической решетки
(увеличивается число дефектов, плотность
дислокаций)
- понижение пластичности;
- рост электропроводности;
- ускорение процессов диффузии;
- инициирование фазовых превращений в Me
распад молекул среды на атомы и радикалы
(радиолиз)
H и O, H2O2, радикалы (OH, HO2) и др.
↑C(воздух)
↑C(HNO3)
Изменение pH
↑C(HNO3)
↓C(O)
↓pH (до 3-4)
↑С(NH3) ↑pH
(до 9-10)
97.
Эобл = f(Эр, Эд, Эф)Радиолизный эффект (Эр) - изменение химического потенциала коррозионной среды (воды) в
результате ее радиолиза (H2O2, O3, радикалы OH, HO2 облегчают катодный процесс).
для металлов не склонных к пассивации
Деструктирующий эффект (Эд) - изменении структуры (деструкции) защитной пленки и
поверхностного слоя в результате появления в них большого количества микродефектов при
бомбардировке металла облучающими частицами (образование рыхлой пленки)
ухудшаются защитные свойства оксидных пленок на Al, Zr, Ti
Фоторадиационный эффект (Эф) - изменение полупроводниковых свойств оксидных пленок при
поглощении энергии излучения (может ускорять коррозию металлов в результате облегчения
катодного процесса или образования оксидов p-типа (на Cu, Ni, Fe), может замедлять коррозию
образованием оксидов n-типа, снижая перенапряжение кислорода.
Наибольшую устойчивость к влиянию облучения
проявляют хромоникелевые стали!
98.
Электрохимическая защитаЭлектрохимическая защита
анодная защита
(пассивация)
катодная защита
(изменение направления тока)
Катодная защита
Поляризующий ток
подавление анодного тока
(защита от коррозии)
+
Поляризация катода
↑Sк
Поляризационная диаграмма коррозии,
поясняющая катодную защиту
↑jприлож
анодный процесс
99.
Катодная защитаAl
Ca(OH)2
Схема катодной защиты внешним
током:
1 – защищаемая стальная конструкция;
2 – соединительные провода;
3 – источник постоянного тока;
4 – анод
Схема катодной протекторной защиты:
1 – стальная конструкция;
2 – протектор;
3 – наполнитель;
4 – электрический контакт с конструкцией;
5 – контрольно-измерительное устройство
(Iп.з – ток протекторной защиты)
Электронный и электролитический контакт!
Пример: металлические части и конструкции подземных и береговых сооружений, морских буровых
платформ, корпуса судов, трубопроводы, теплообменники, холодильники и т.д.
Протектор: Zn, Mg, Al
R (Zn/сталь):
дистиллированная вода - 0,1 см;
0,03%-м раствор NaCl – 15 см;
морская вода – 400 см.
Sп/S: от 1:200 до 1:1000
100.
Анодная защитаCl–, Br–, I–, F–
Углеродистые стали, легированные коррозионно-стойкие стали,
Ti, Zr и т.д.
К положительному полюсу!
Катод:
хромоникелевые стали – кислая среда;
кремнистый чугун – раствор неорганических солей;
Никель – щелочная среда.
Протектор:
углеграфит, диоксид марганца, диоксид свинца
Кислородная защита
Vкор
min
101.
Защита от коррозии на стадии проектирования и разработки конструкцийКоррозия и вопросы конструирования:
- правильный выбор материалов и средств противокоррозионной защиты;
- нахождение наиболее удачной конструктивной формы элементов и
конструкций;
- применение методов сборки элементов, исключающих по возможности
локальные виды коррозии (щелевую и питтинговую);
- рациональные методы сочетания разнородных материалов, исключающих
контактную коррозию.
102.
Выбор материалов и их совместимость в конструкцииЗащита деталей из несовместимых металлов диэлектрическими прокладками
Применение металлических прокладок для защиты деталей: а – в виде биметаллического пакета;
б – в виде металлизационного покрытия обоих металлов, образующих подвижное или фиксированное
соединение
103.
Защита деталей из несовместимых металлов: а – расположение нагревательного элемента дальше отстенок стальной ёмкости; б – трубки из разных металлов соединяются через удлинитель
Влияние соотношения площадей анодной и катодной поверхностей на коррозию в сварных и
заклёпочных соединениях
104.
Выбор рациональной формы элементов и конструкцийПримеры выбора рациональных форм изделий (деталей) и их сочетаний
Варианты форм конструктивных элементов, подлежащих защитным покрытиям
105.
Варианты соединения элементов металлоконструкций из листового материалаВлияние геометрии форм металлоконструкций на появление турбулентности в движущейся жидкости
106.
Рациональные способы сборки конструкцийГерметизация болтового соединения
Заклёпочные соединения: а – неудачное решение; б – удачное решение; в – изоляция
контактов; г – исключение щелевой коррозии
107.
Примеры сварных соединенийПримеры правильного и неправильного соединения с
помощью пайки: а – соблюдение и фиксация
равномерного зазора между соединяемыми деталями;
б – равномерность расположения припоя; в – пайка
внахлёстку – более предпочтительный вариант




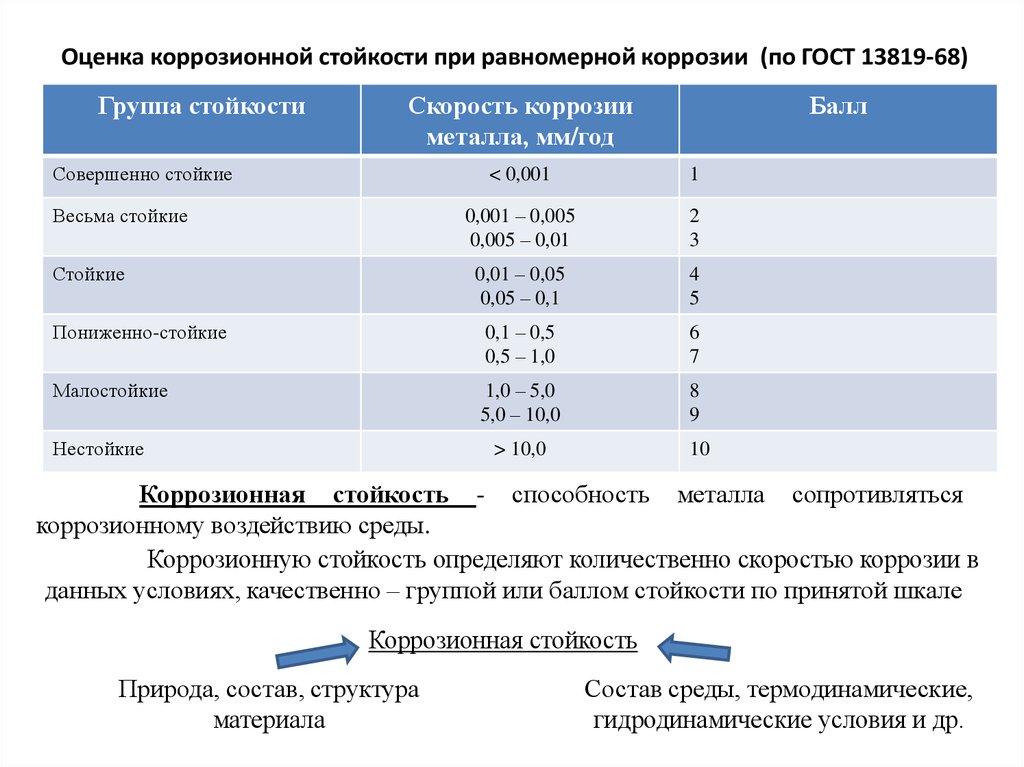





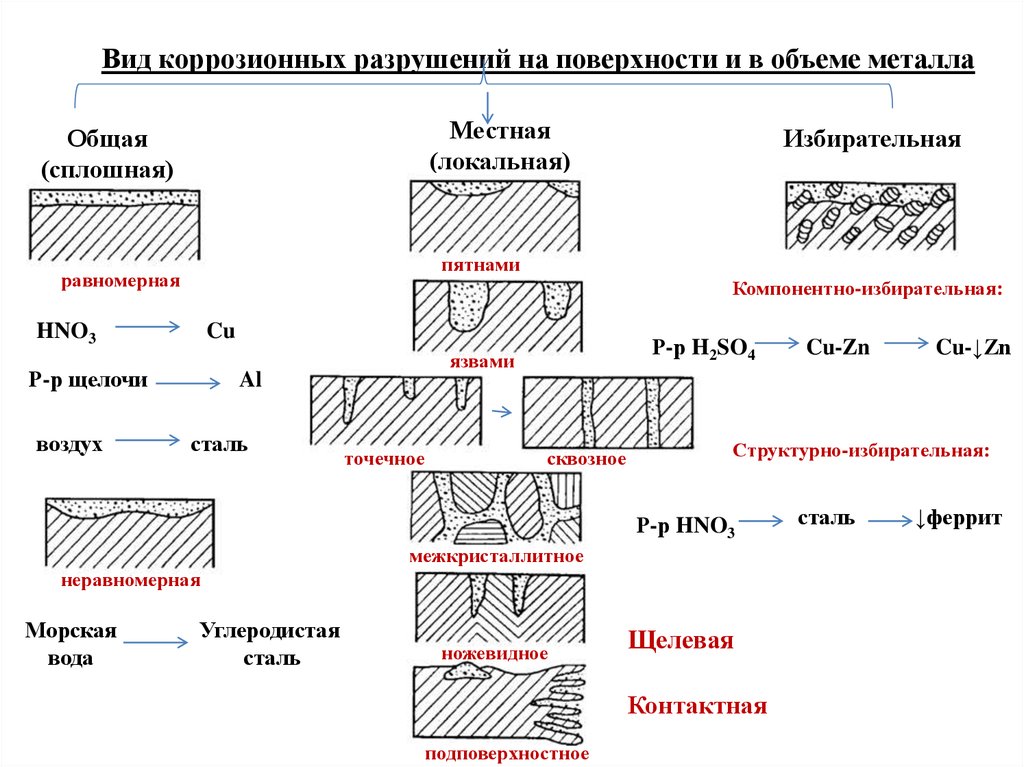
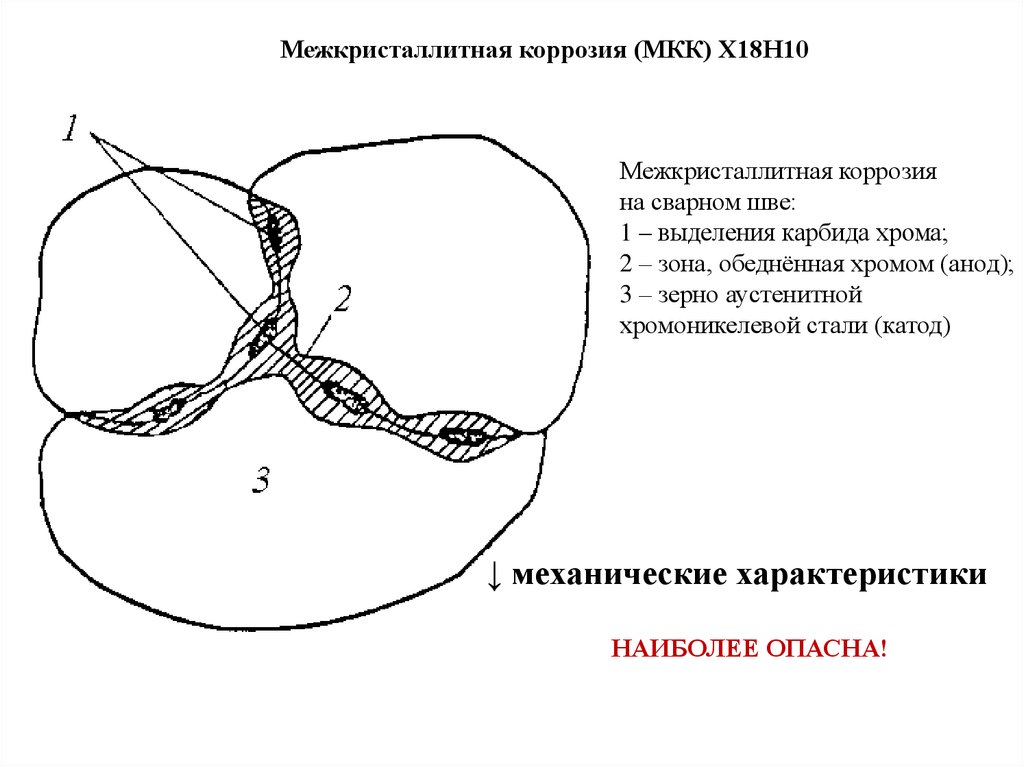
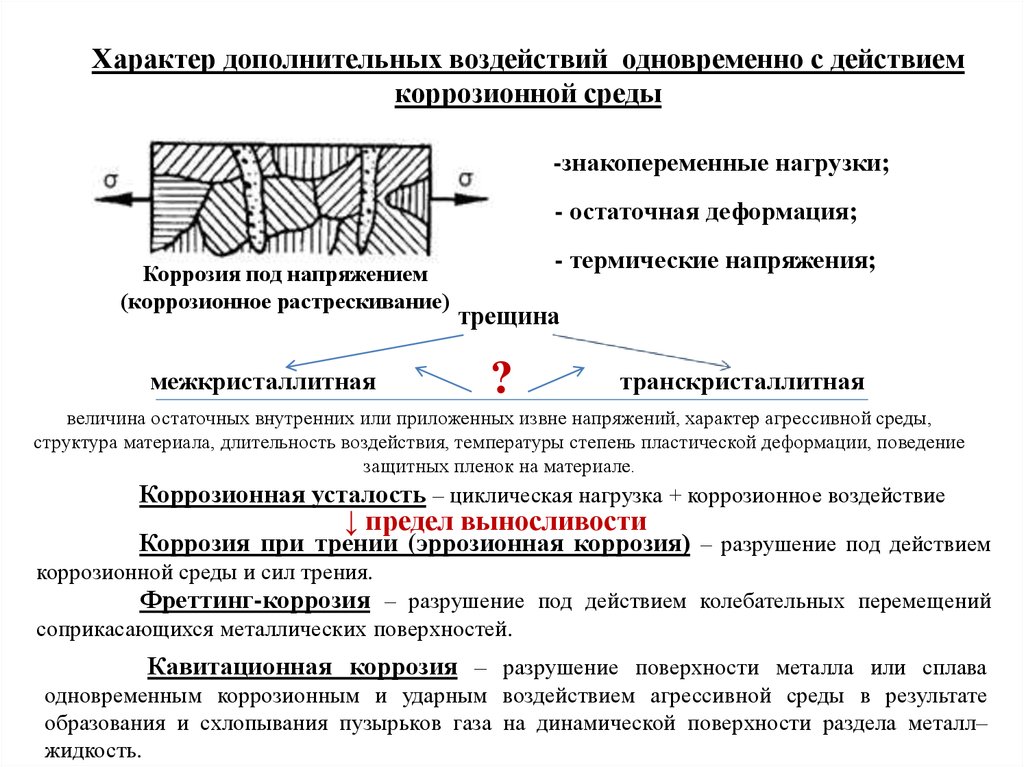
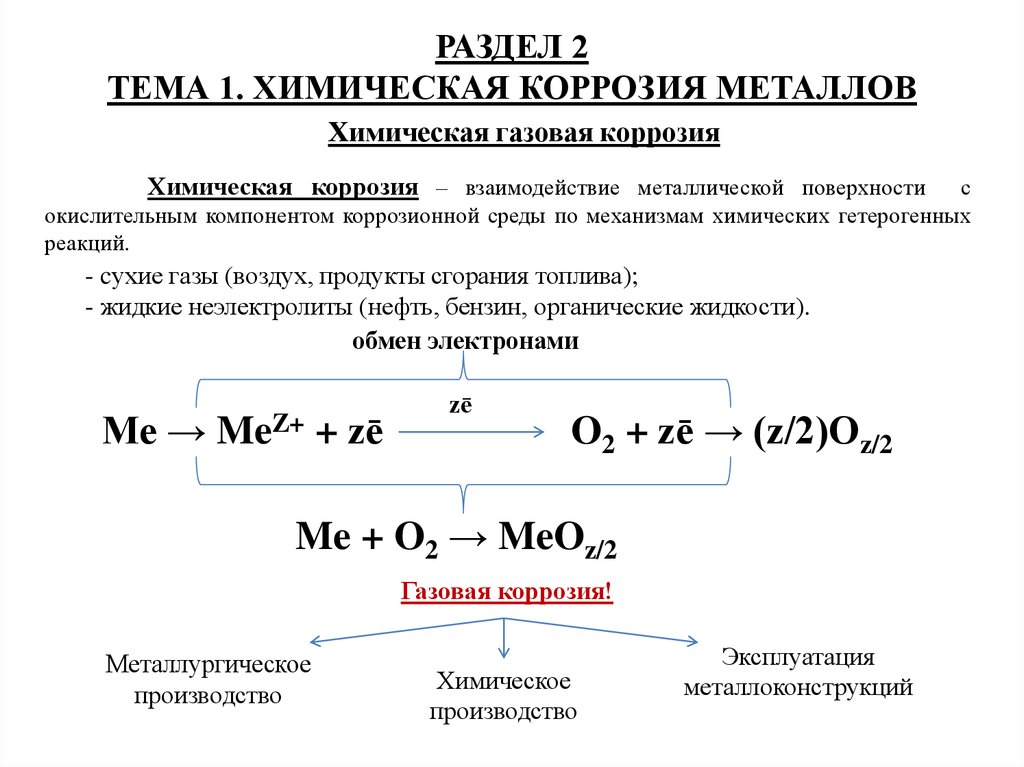







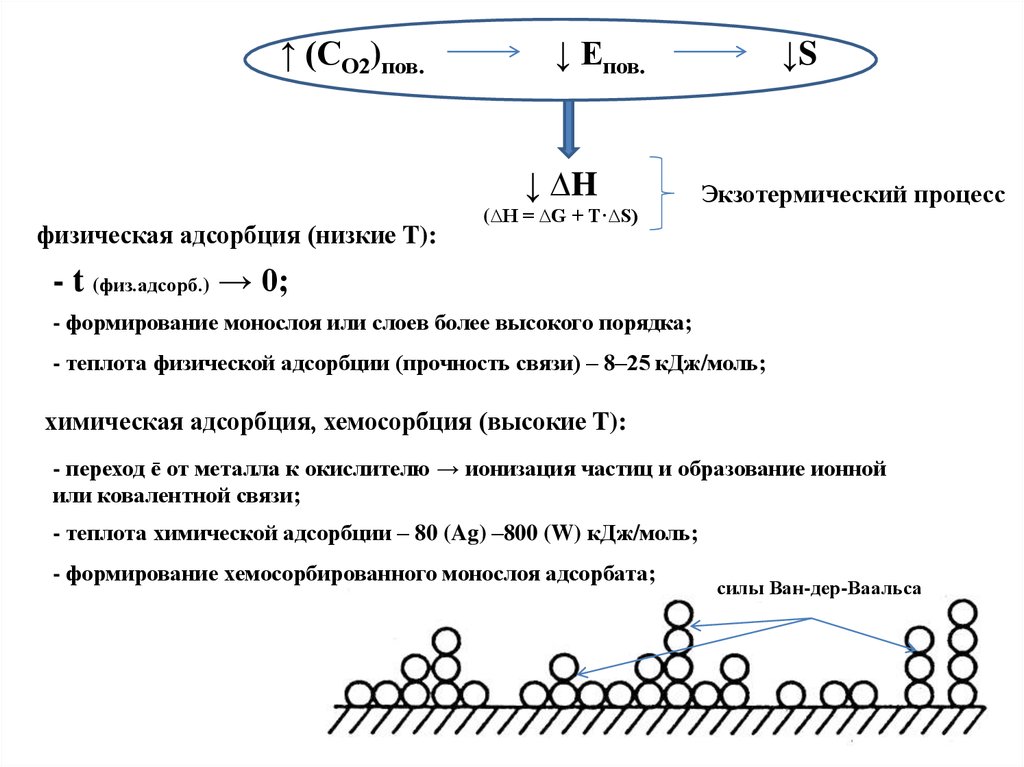

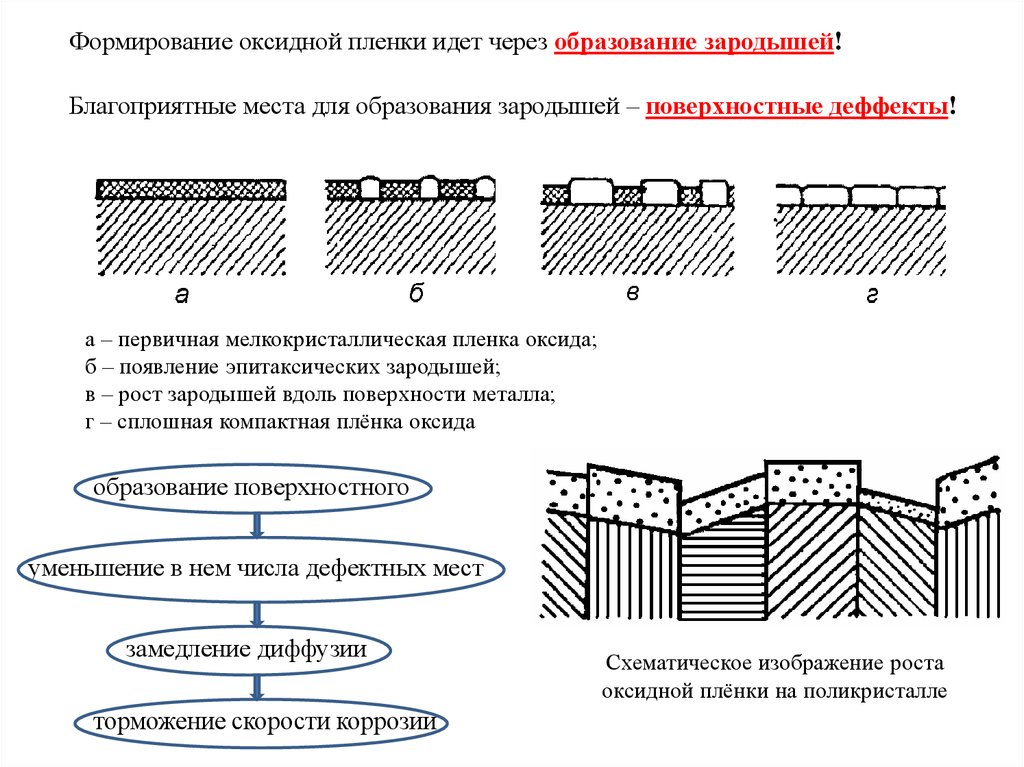
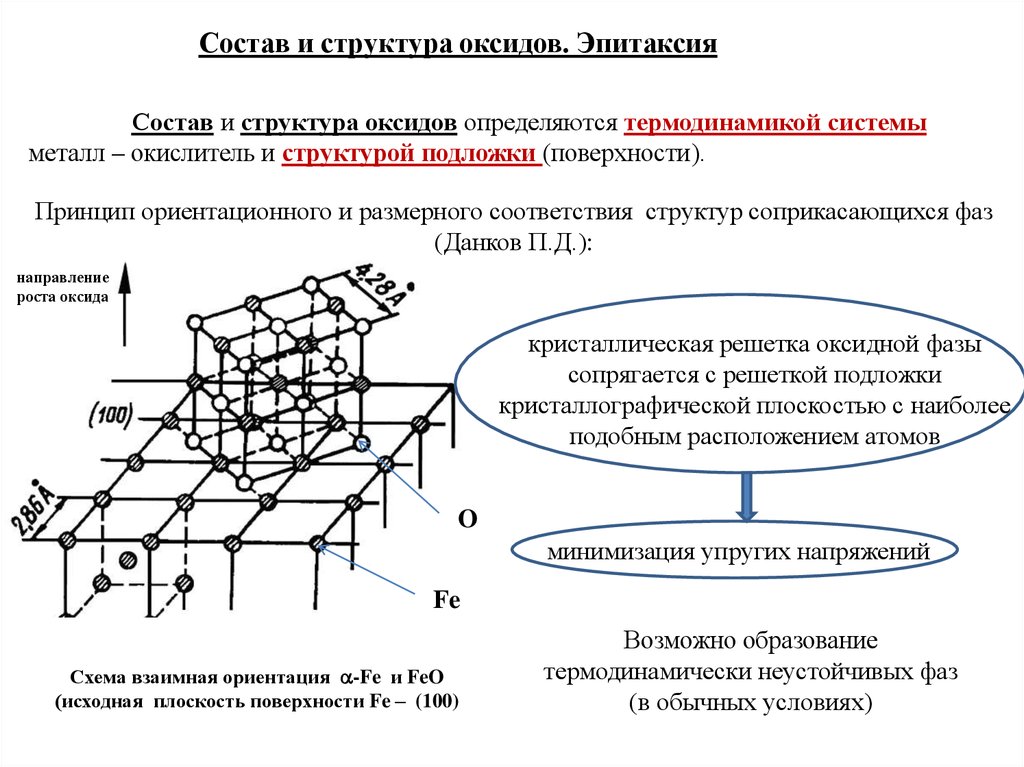


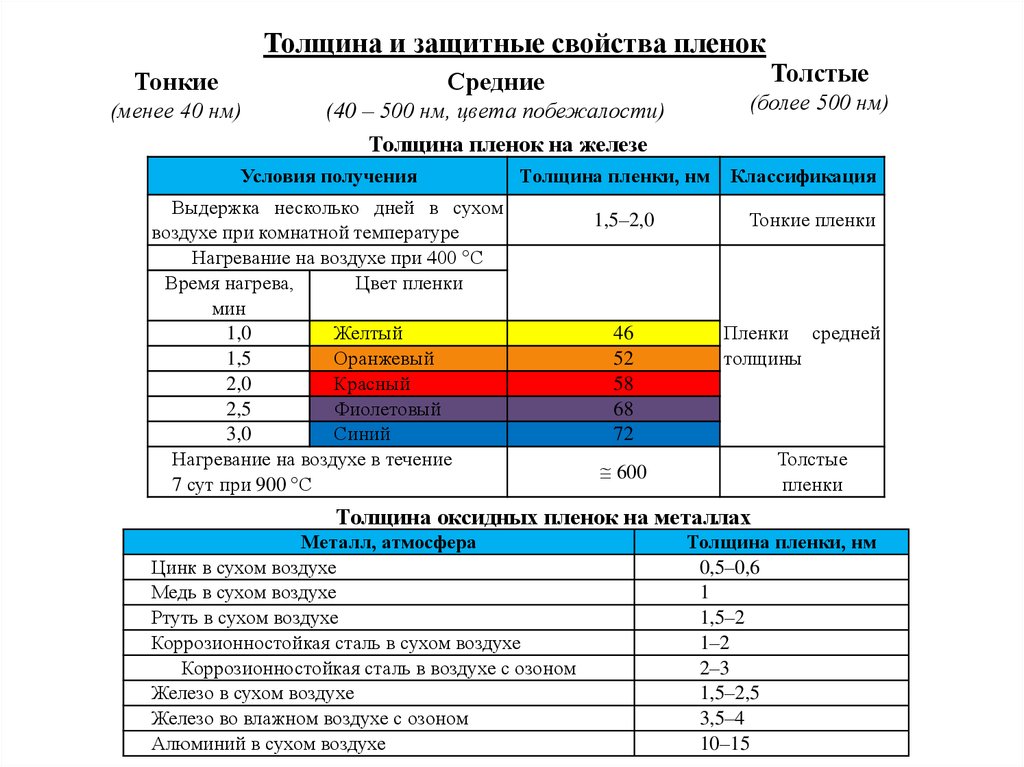

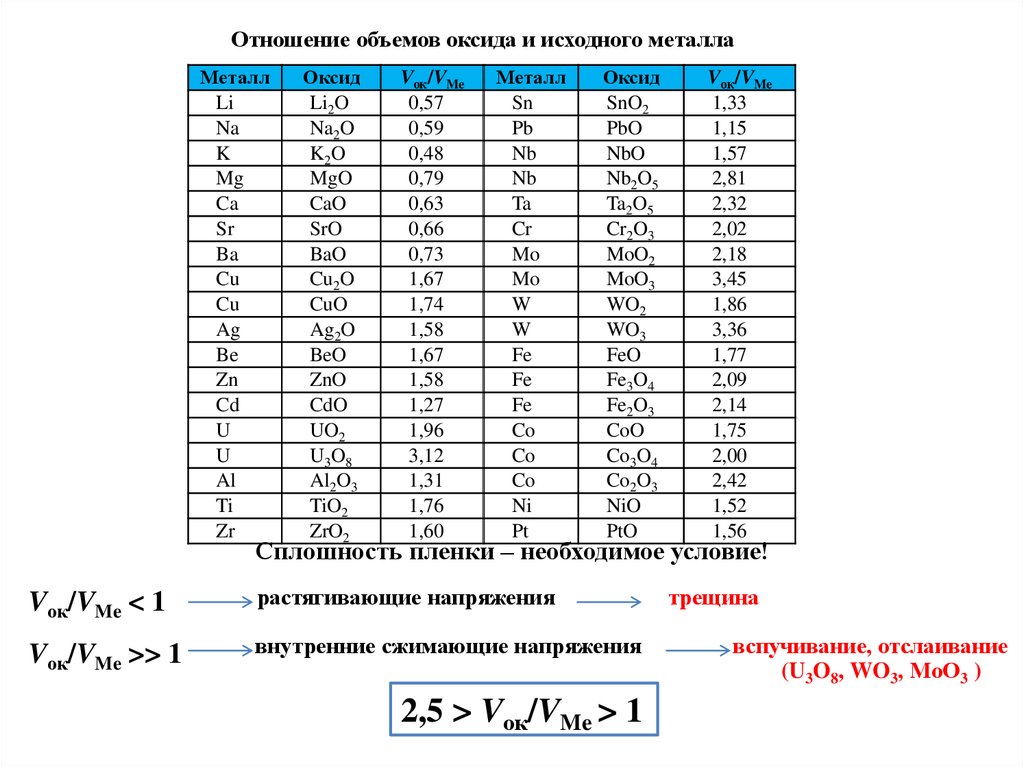
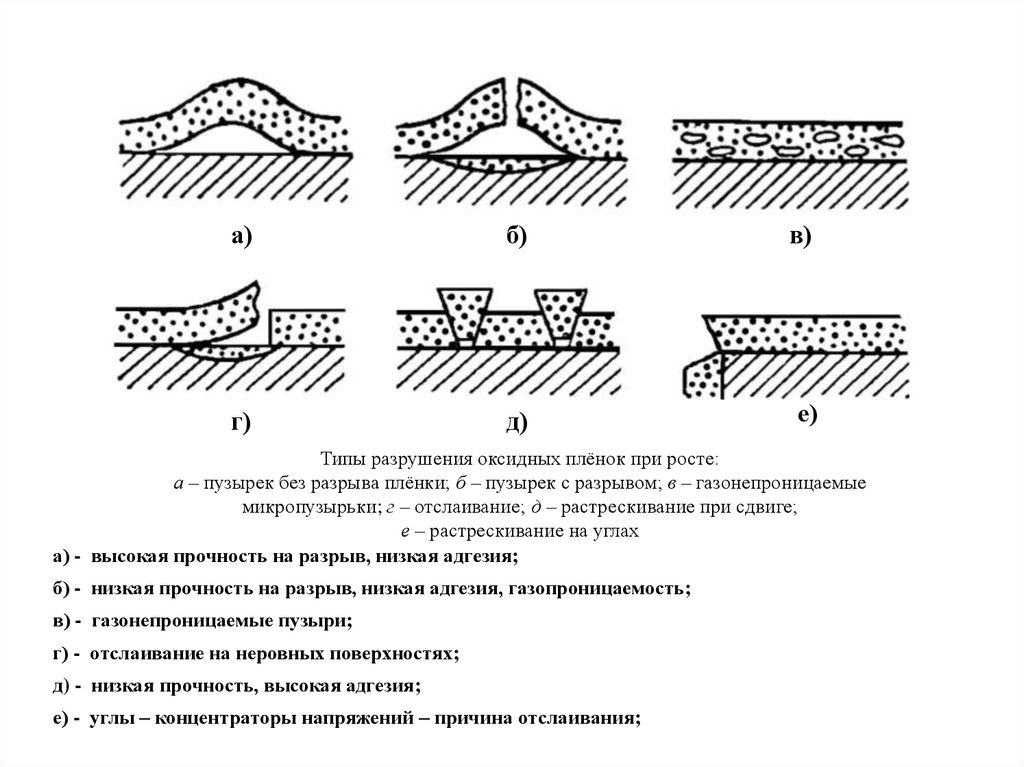



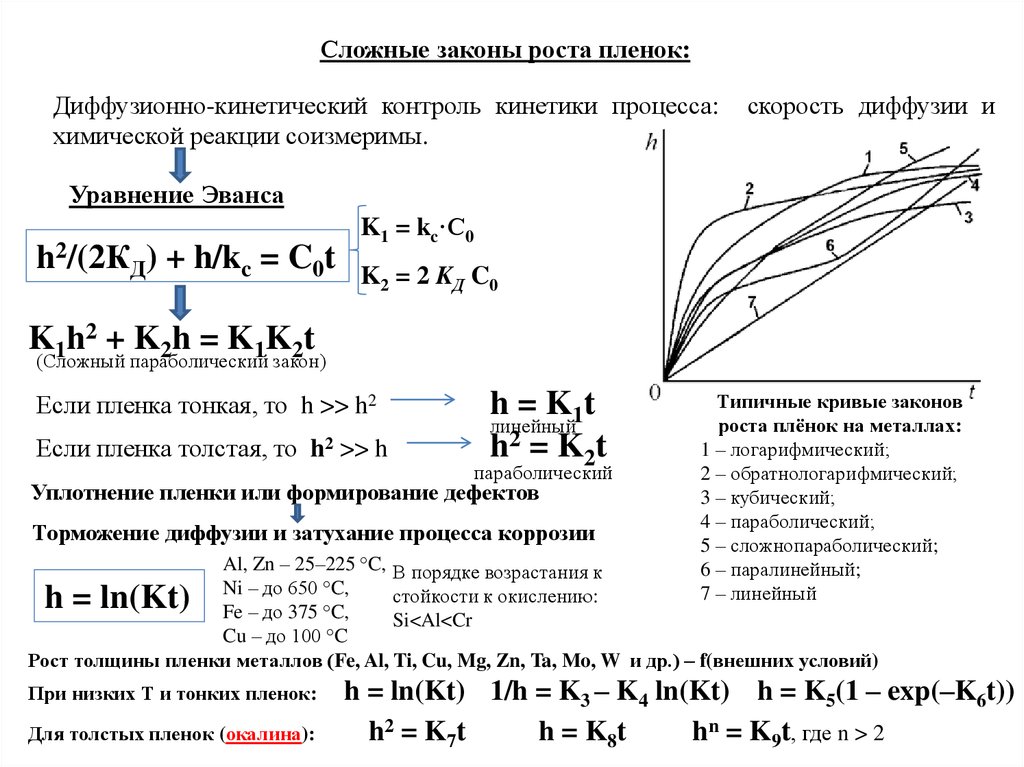
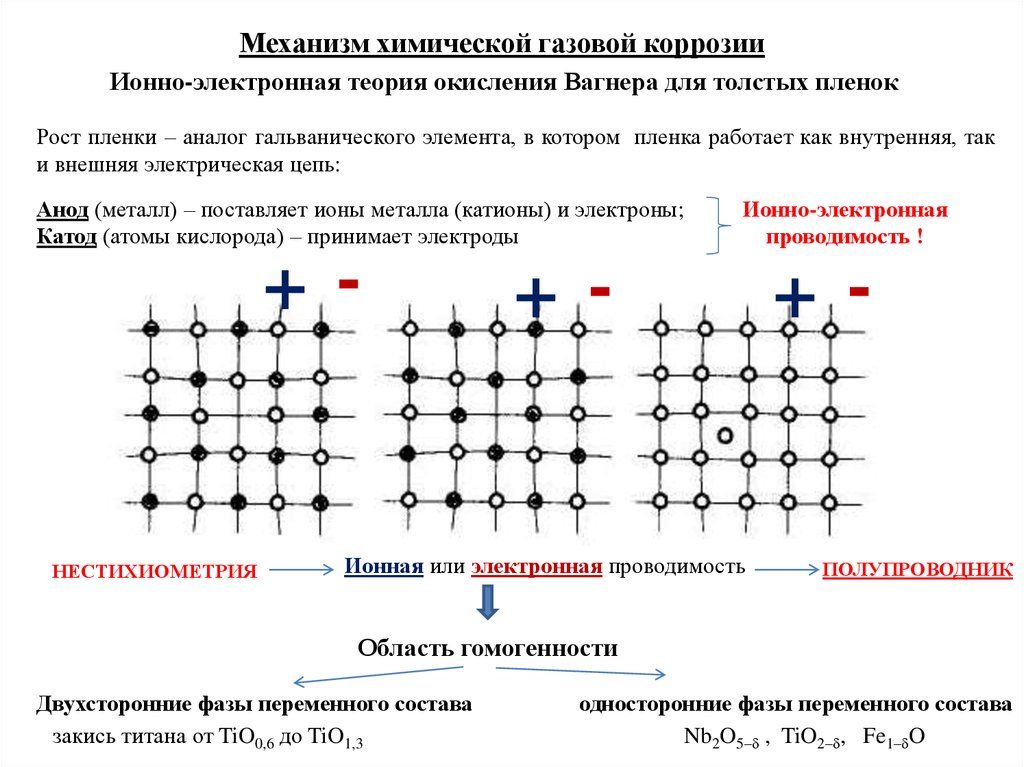

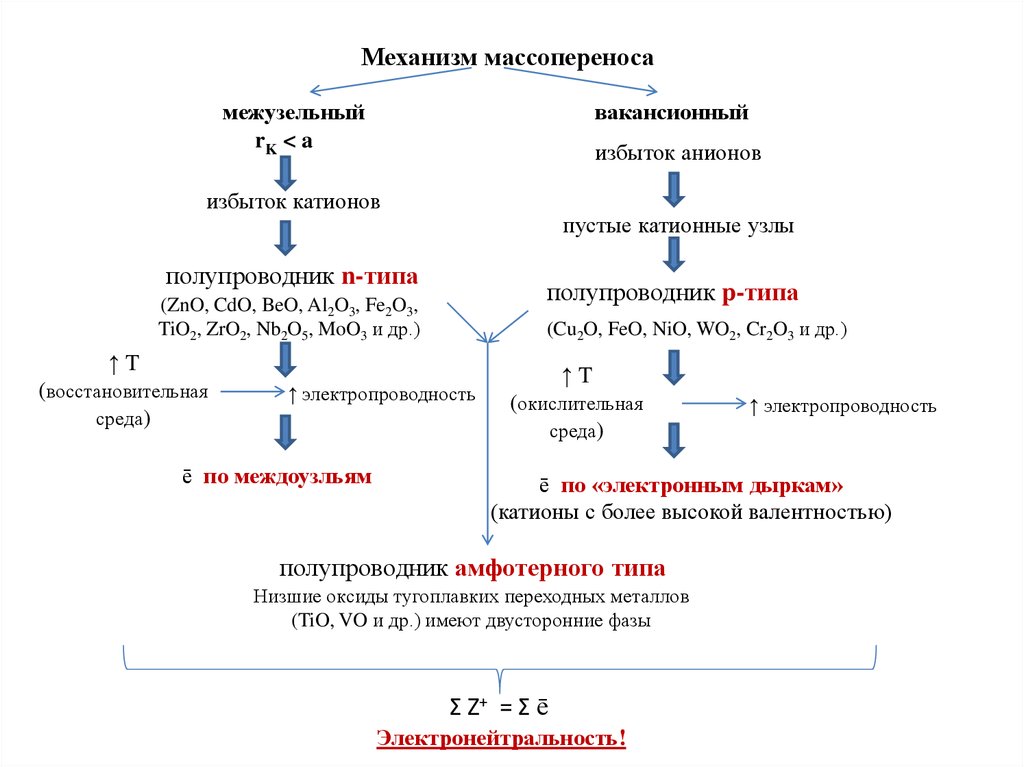
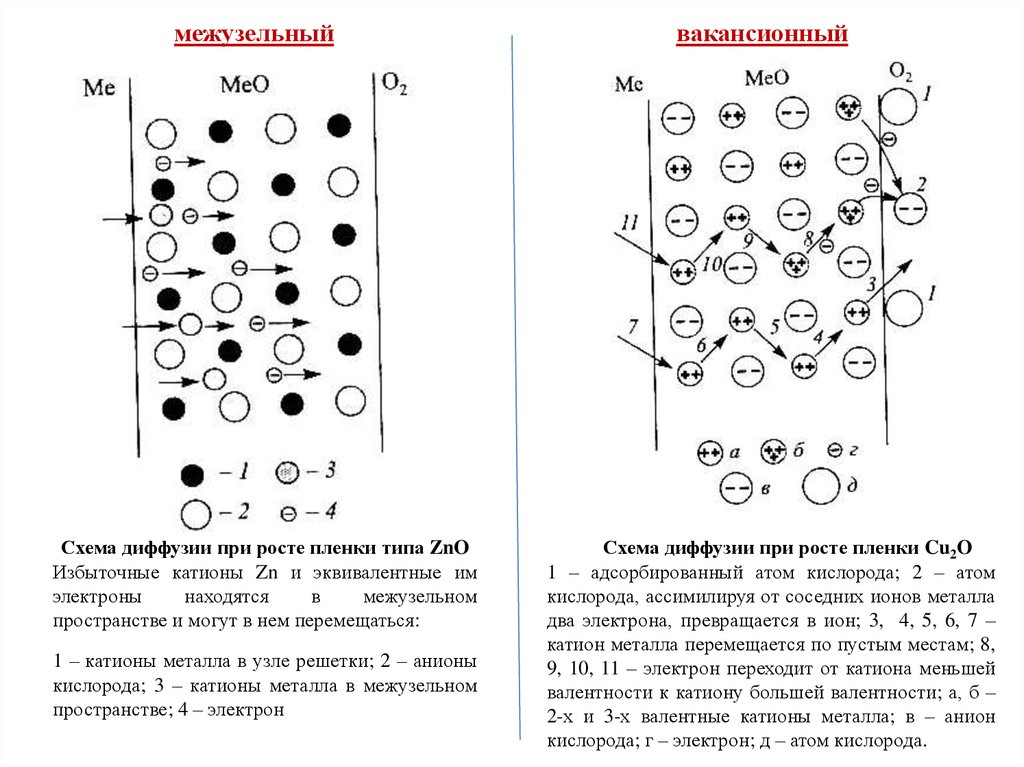




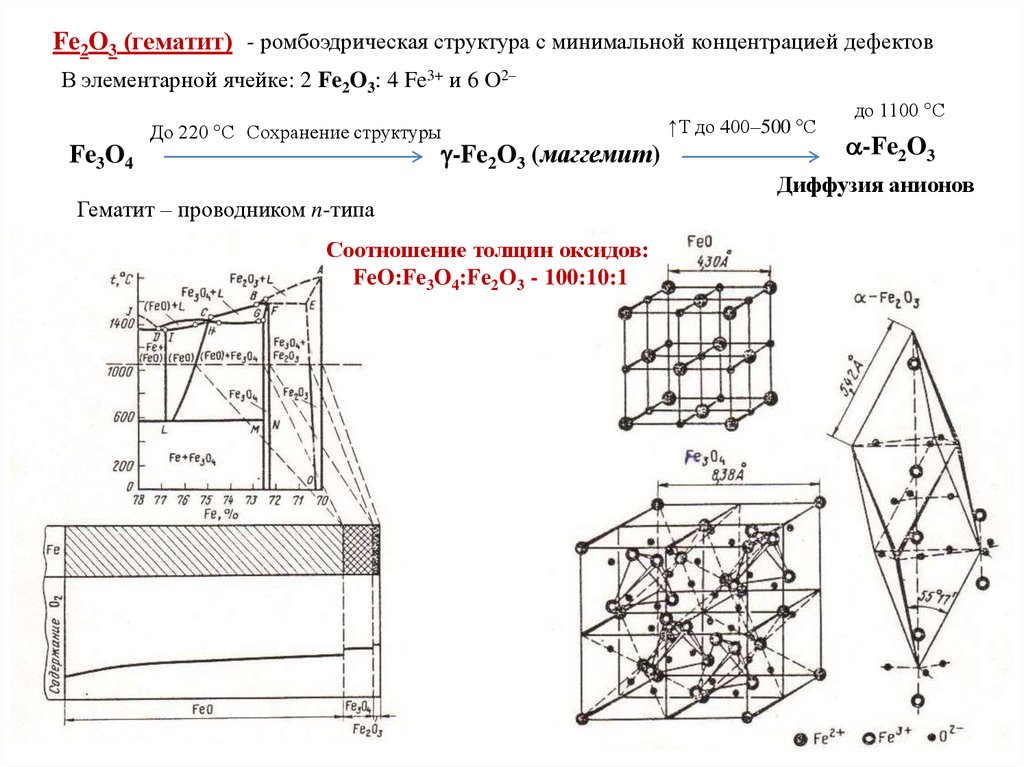






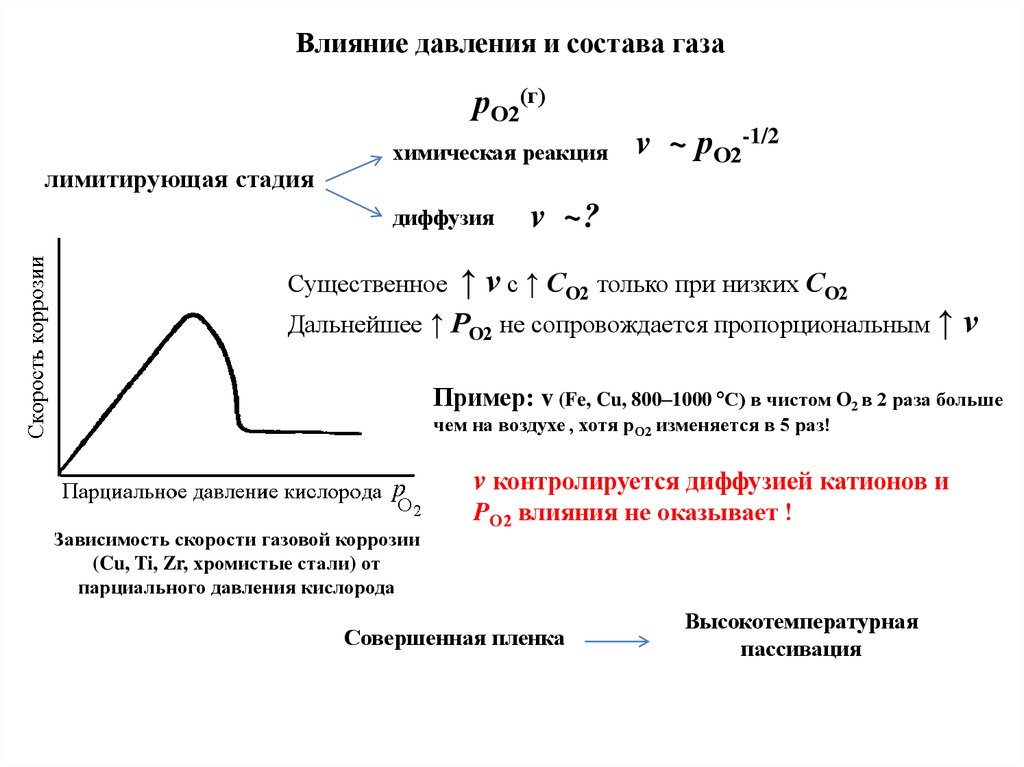








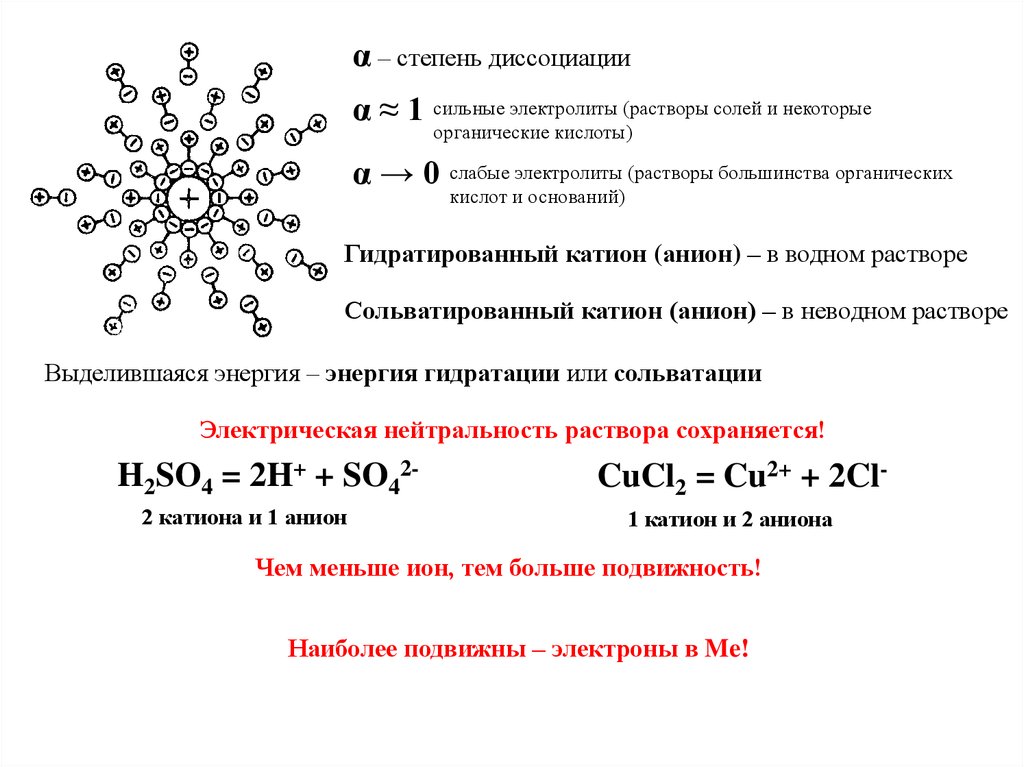
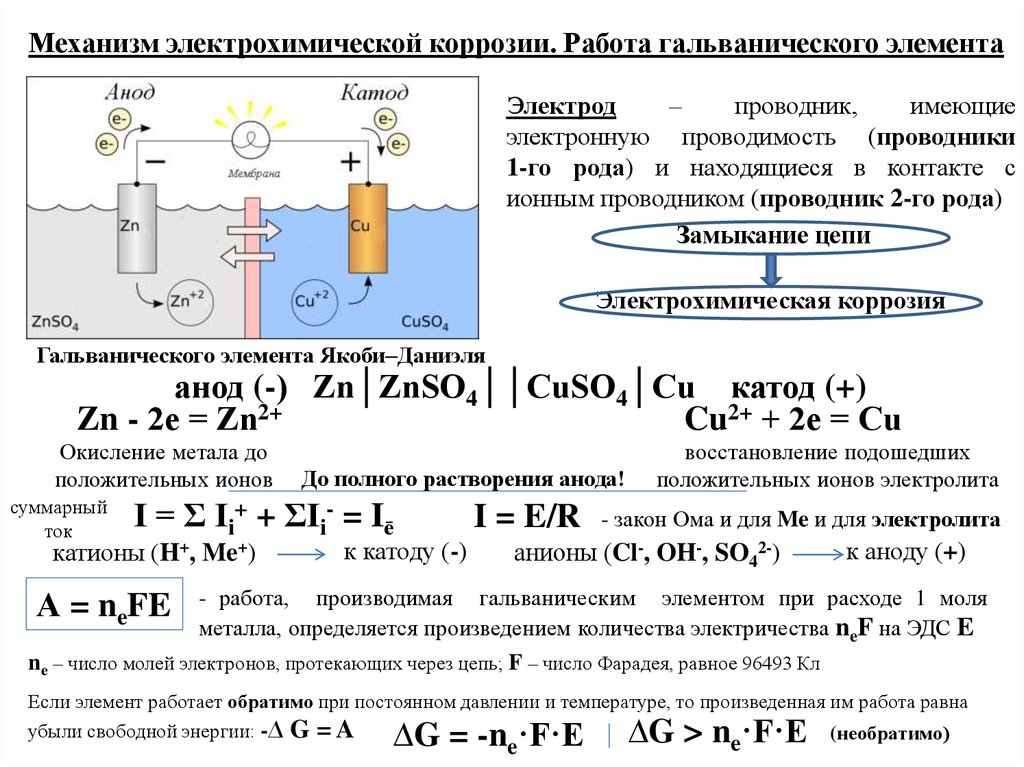













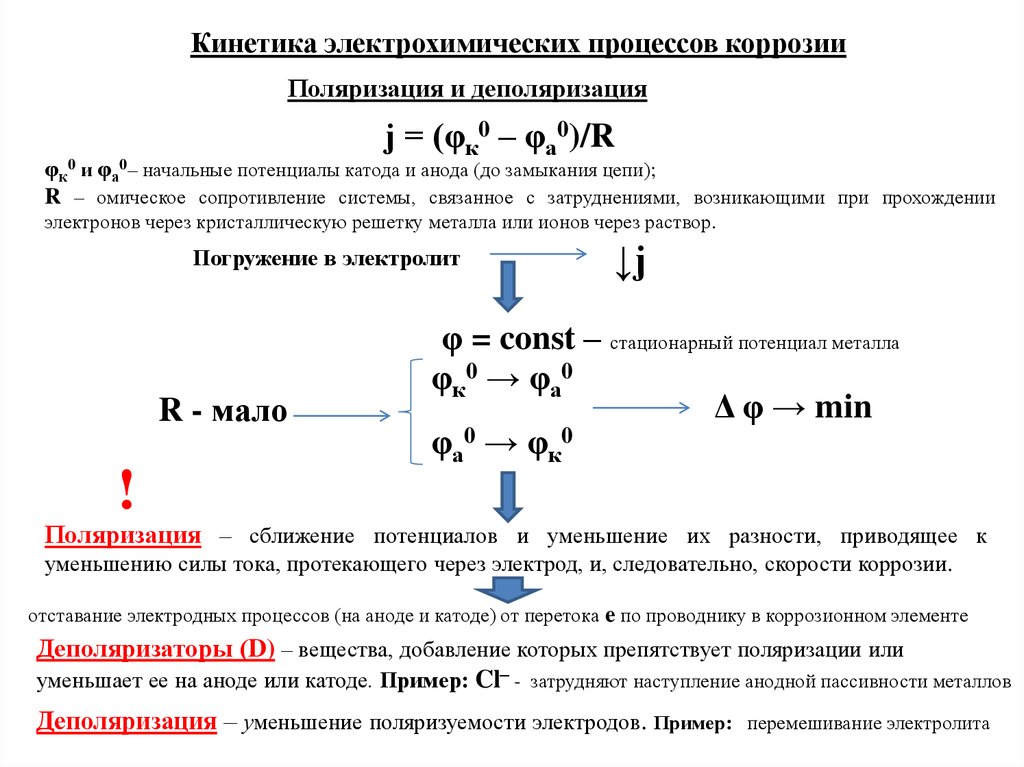



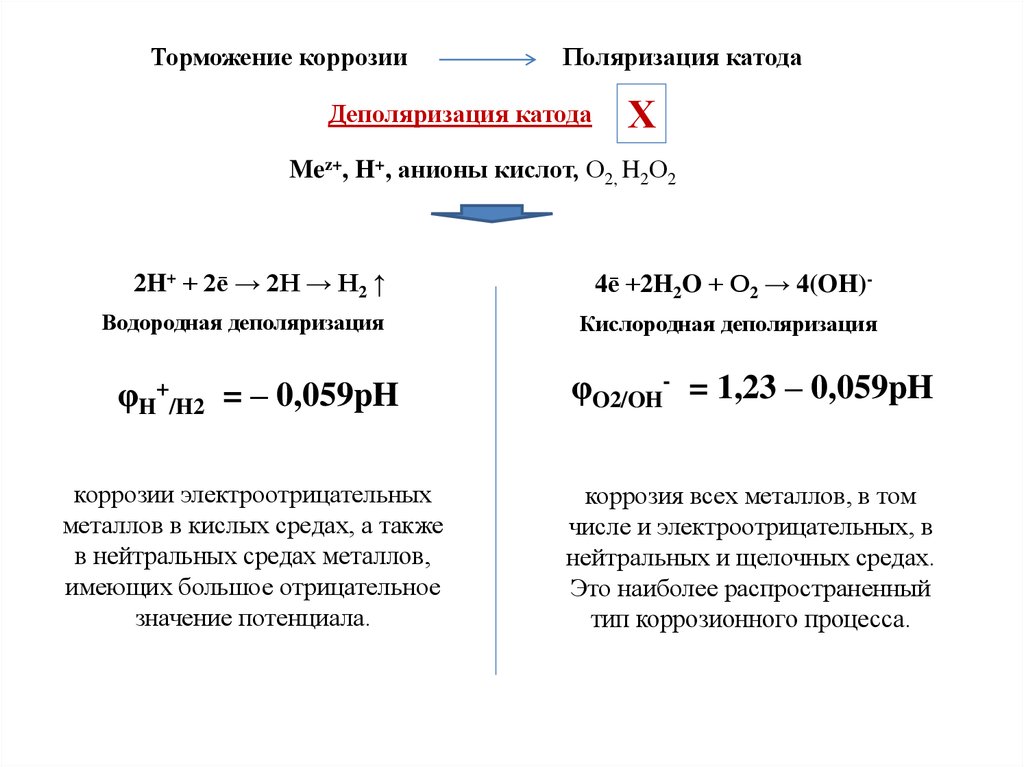
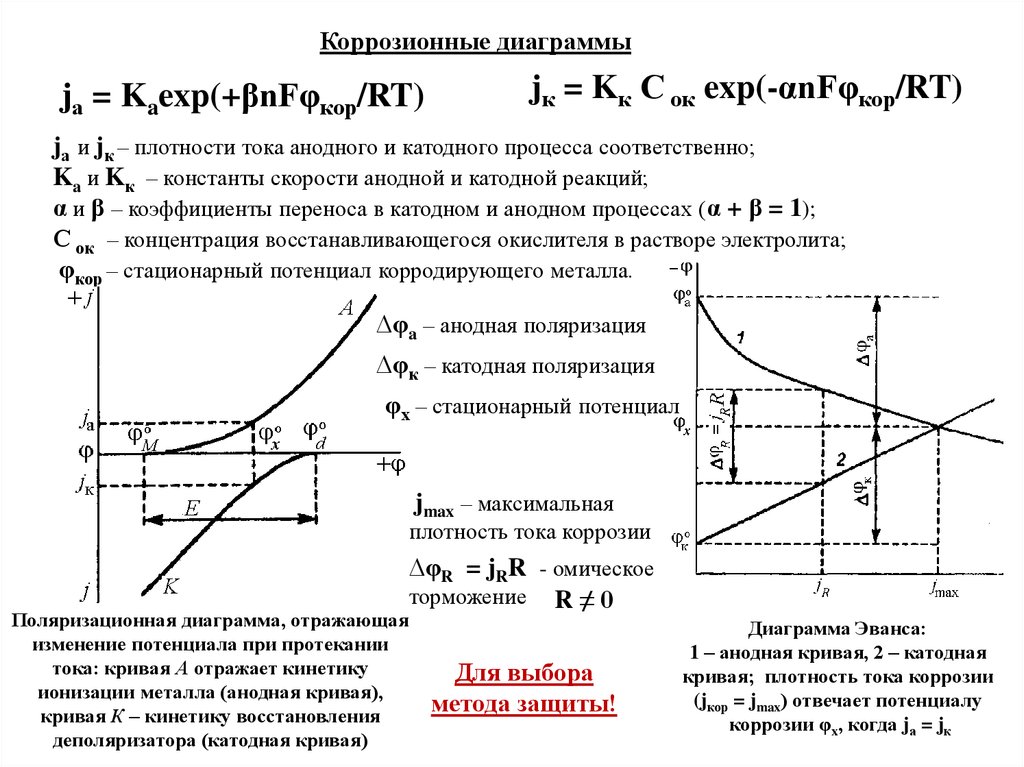

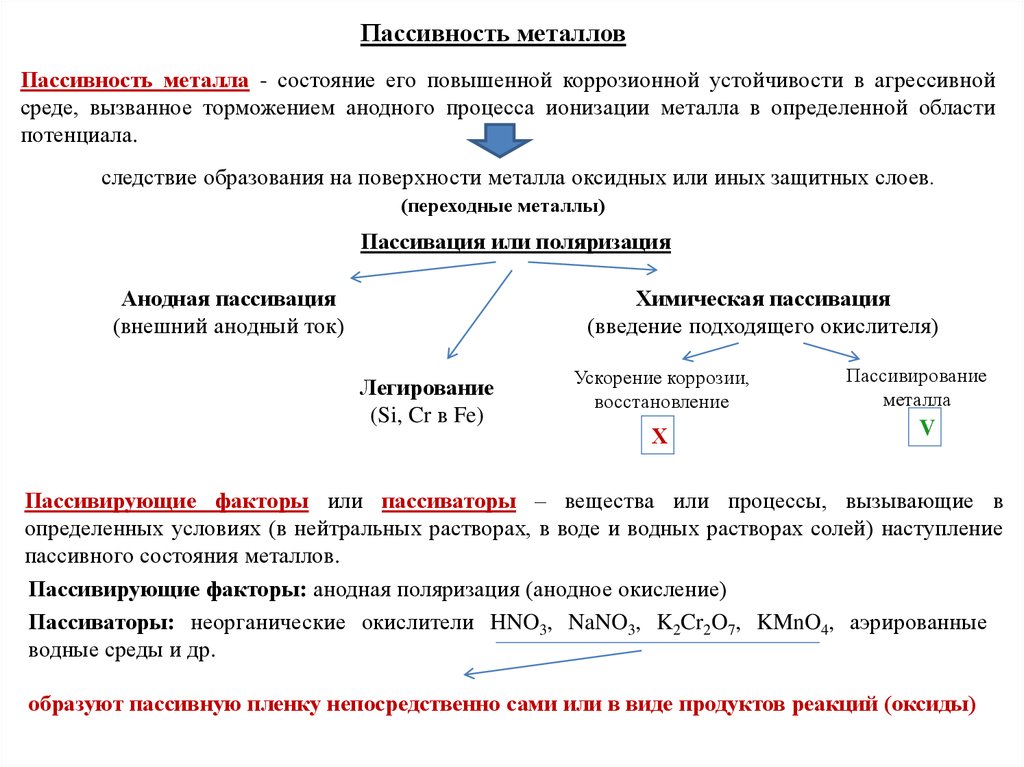


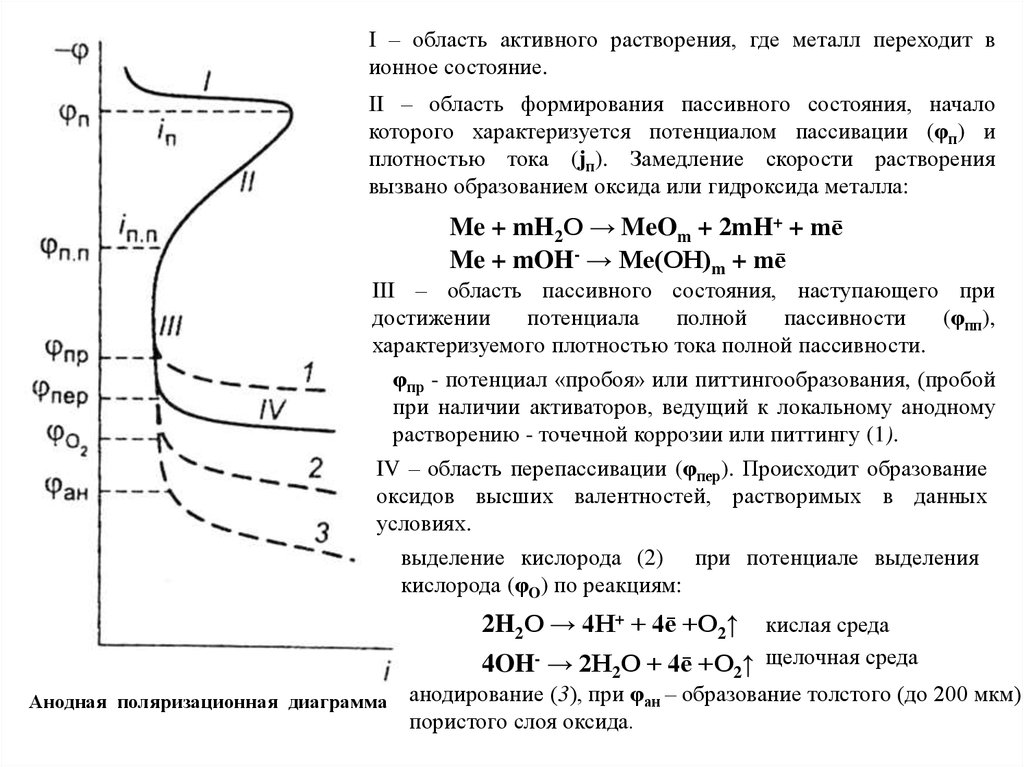

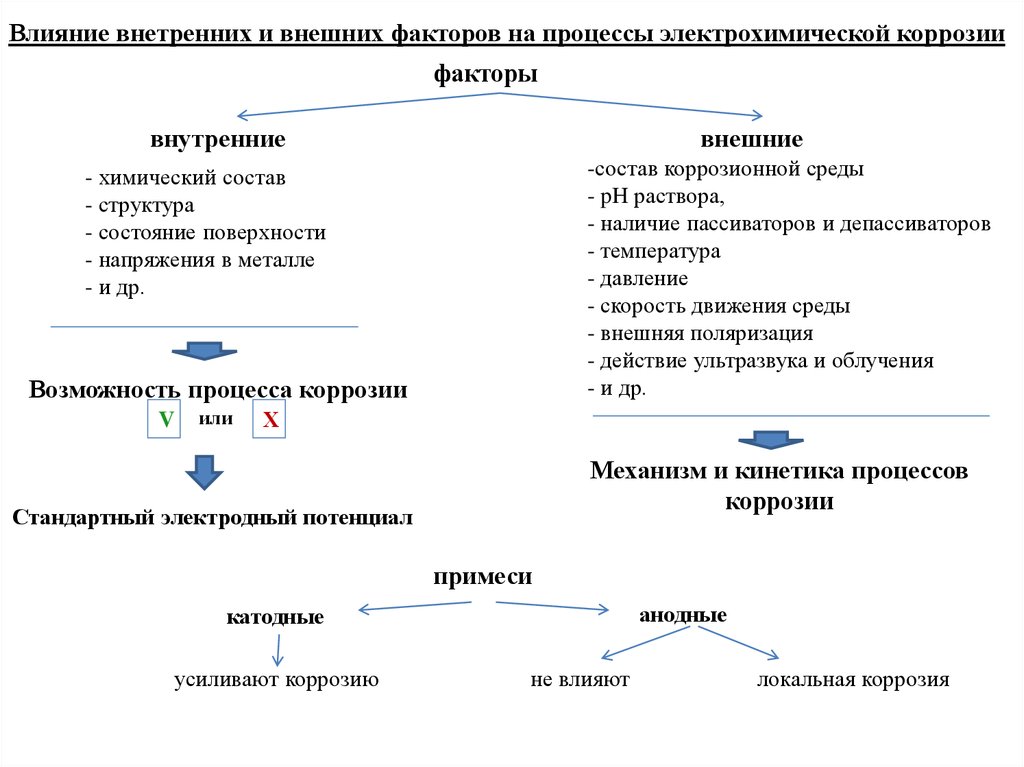
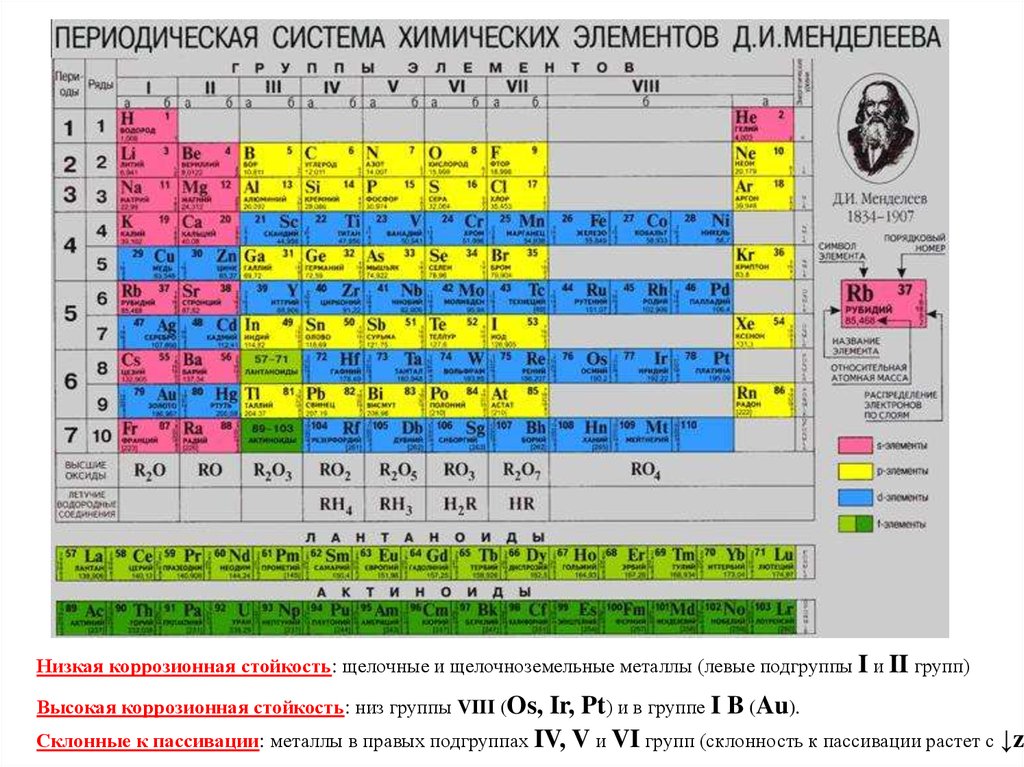
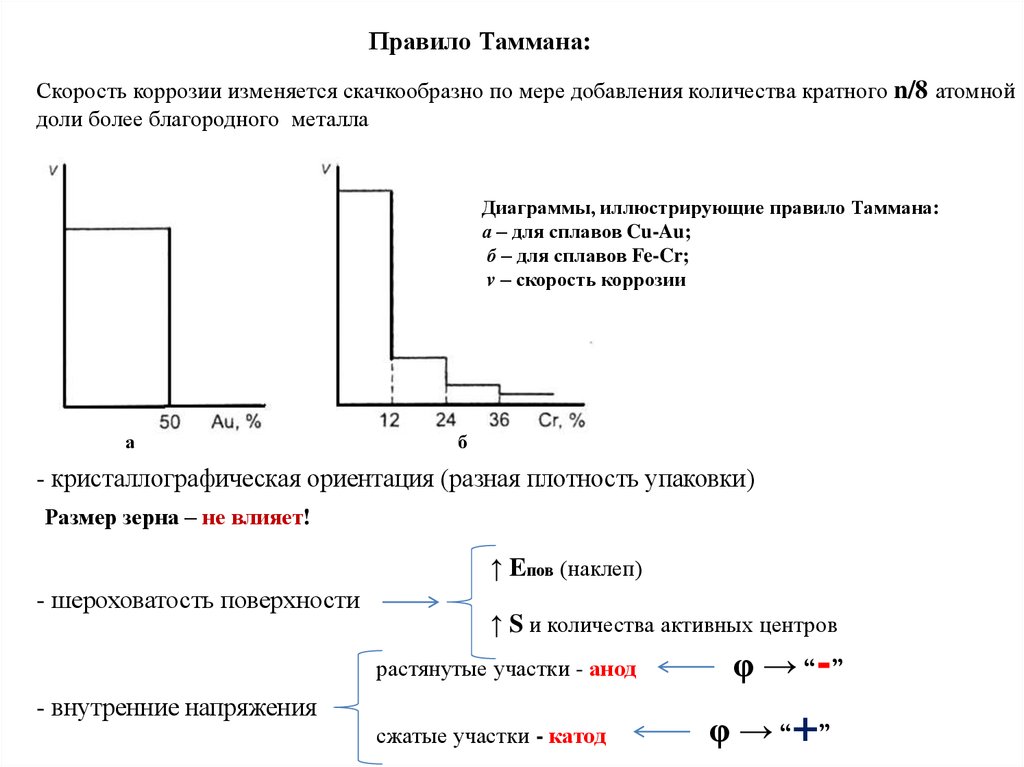


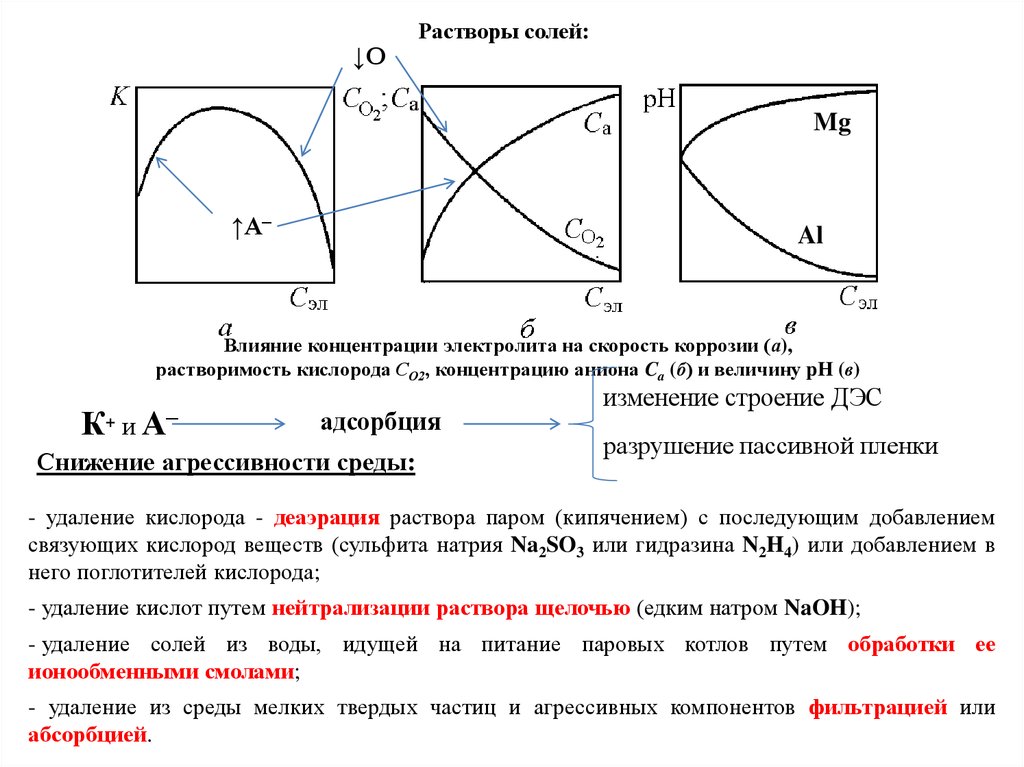
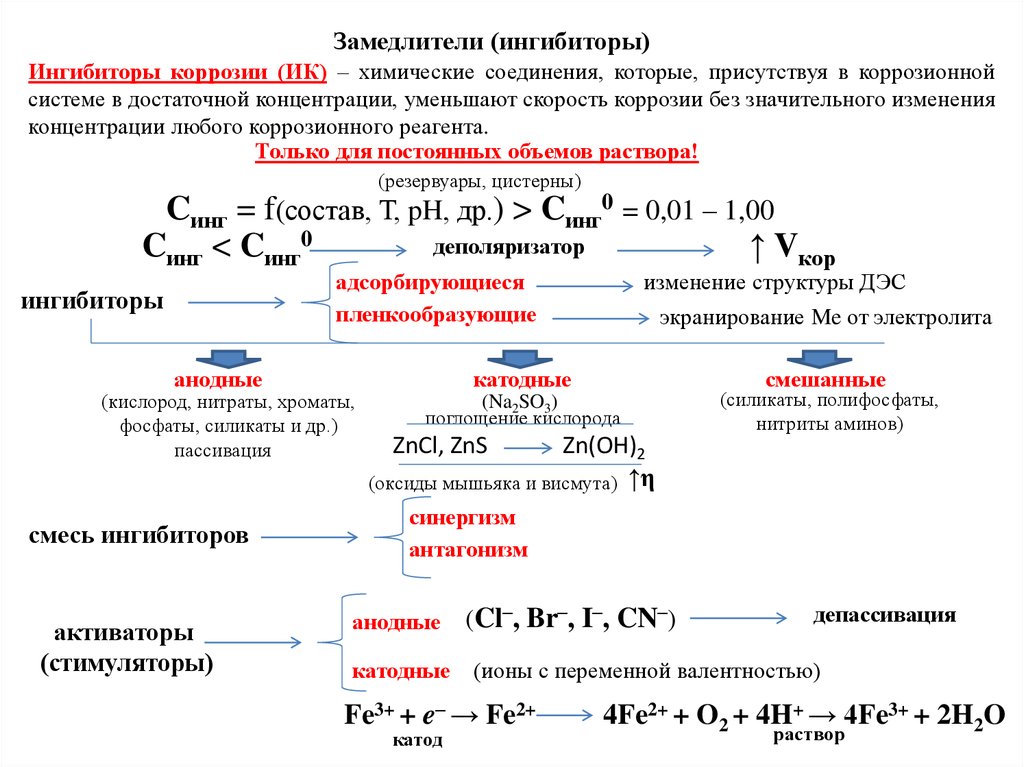
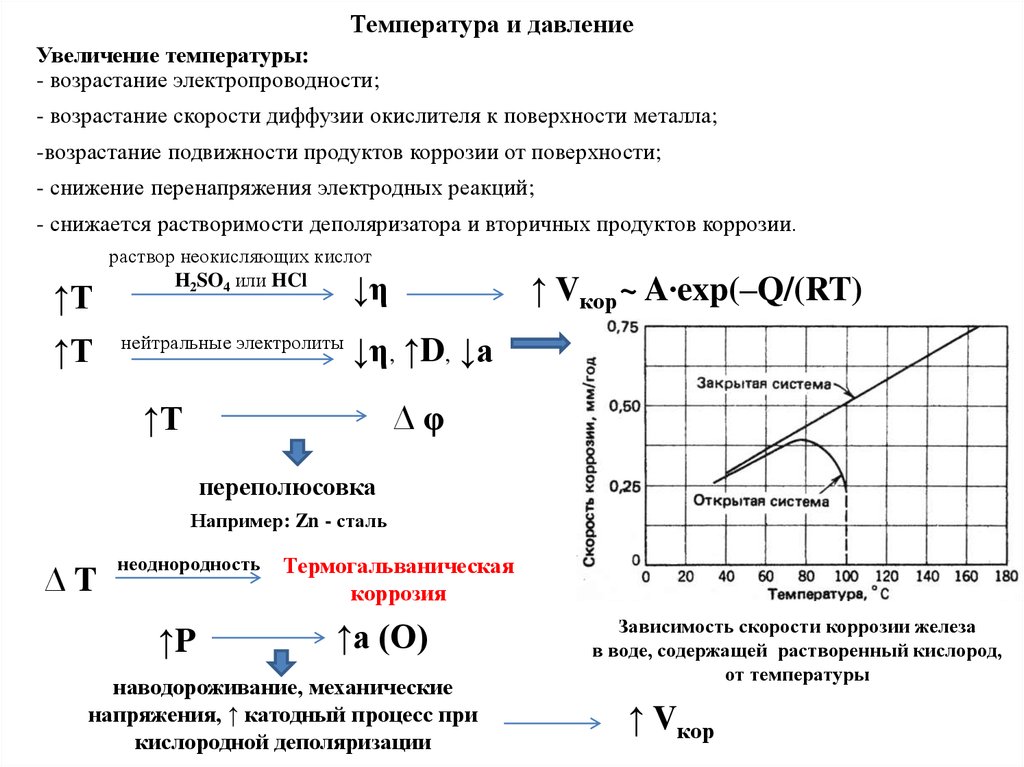

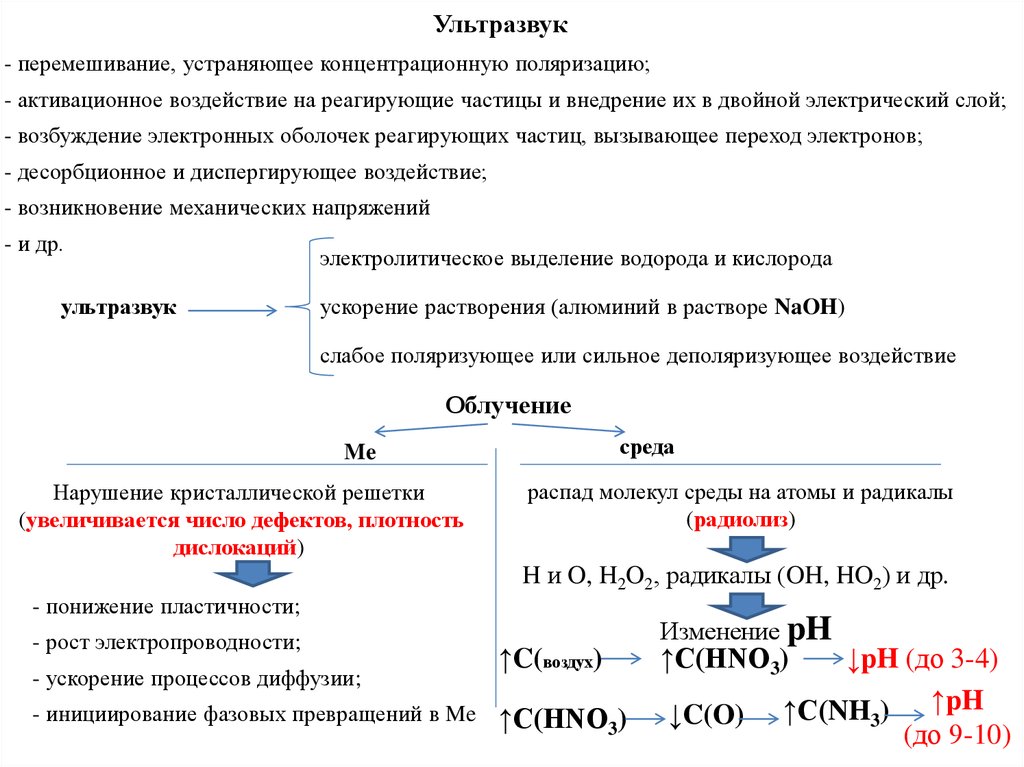

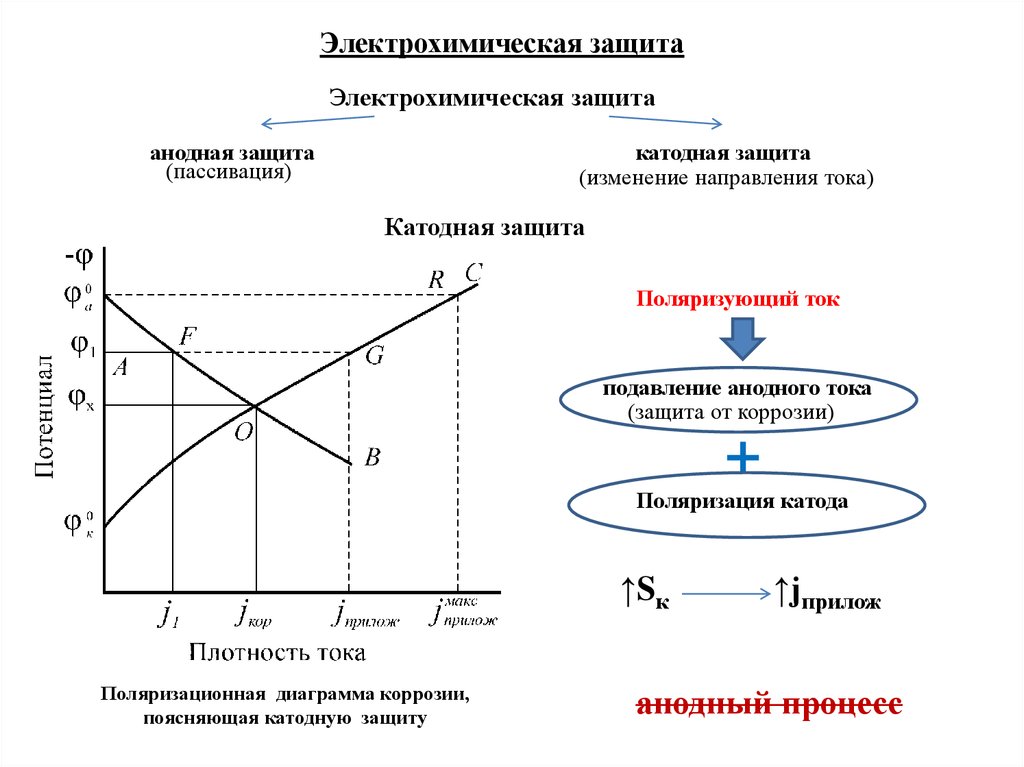
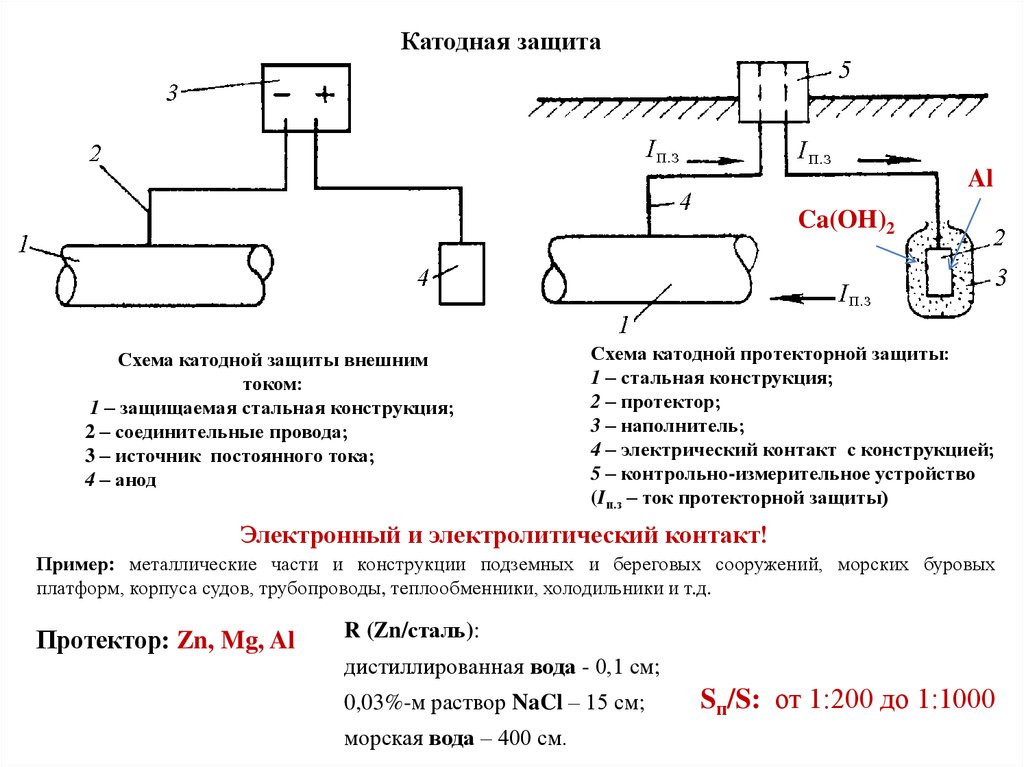
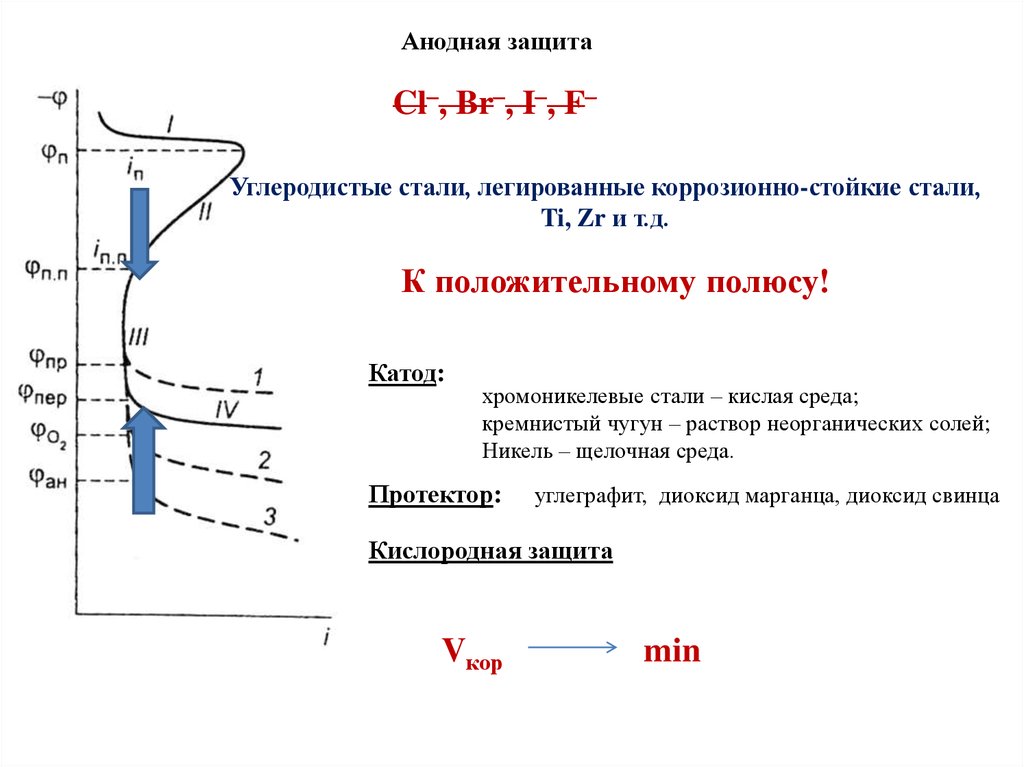


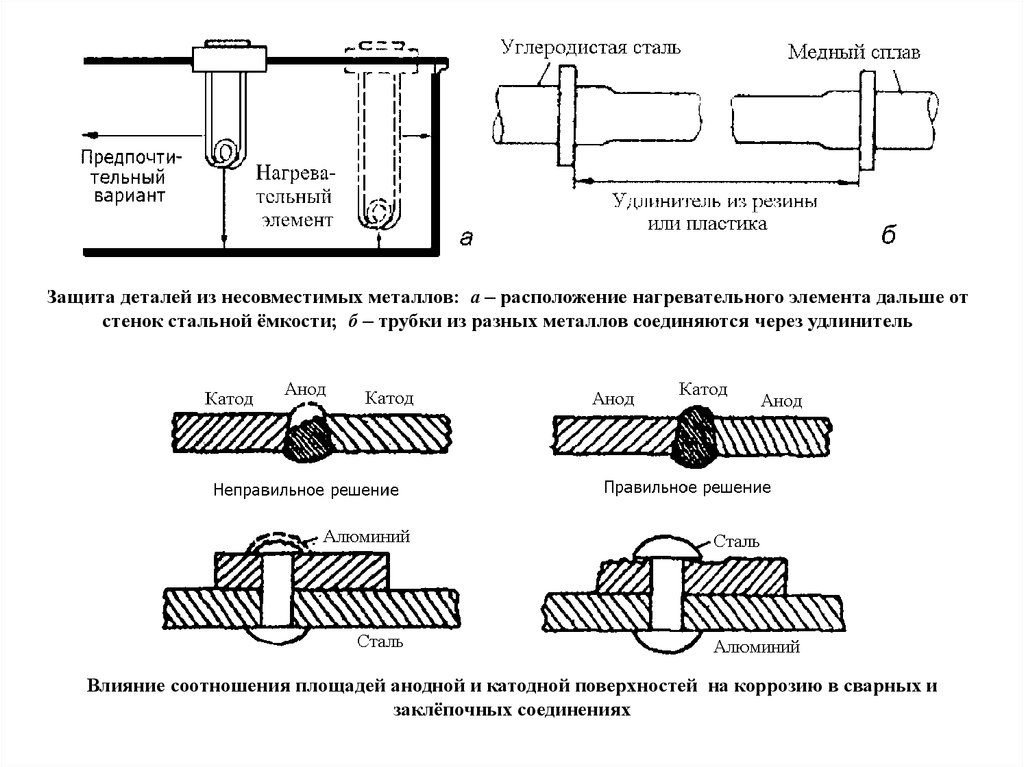


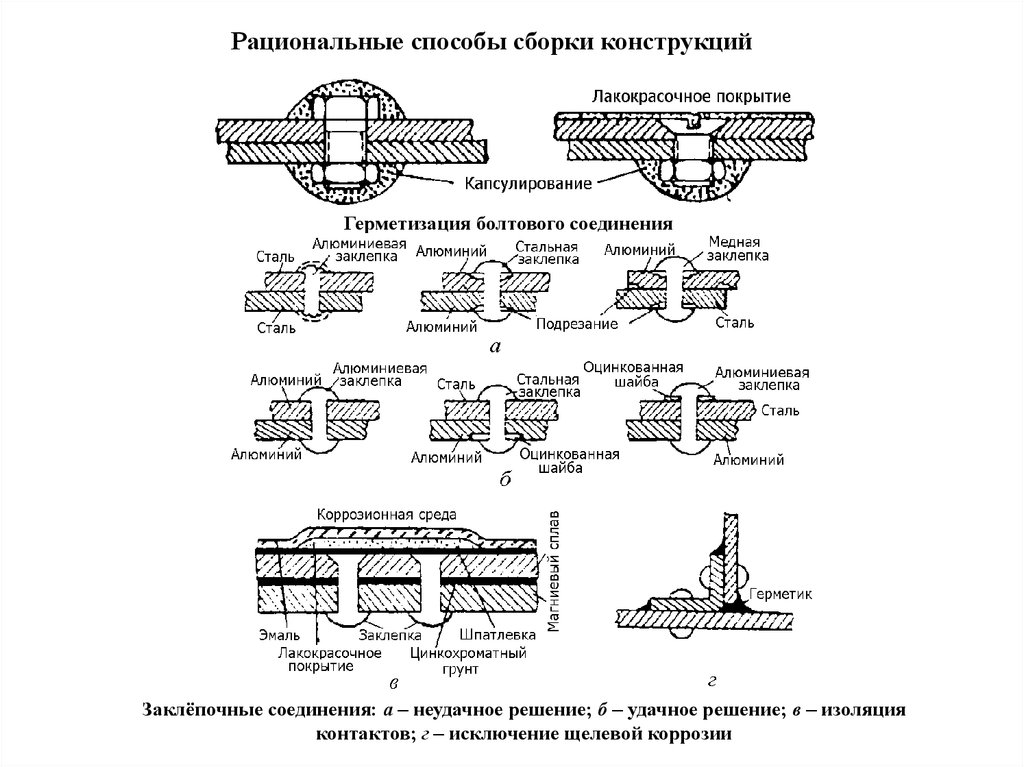

 chemistry
chemistry








