Similar presentations:
Основы строения органических соединений
1.
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯКАФЕДРА ХИМИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
Основы строения органических соединений
1. Предмет органической химии. Особенности строения
органических веществ
2. Классификация органических соединений.
Заместительная номенклатура ИЮПАК
3. Классификация органических реакций. Типы реагентов
Лектор: кандидат биологических наук, доцент
Атавина Ольга Васильевна
2. Цели лекции:
1. Обучающая - Сформировать знания остроении, номенклатуре и классификации
органических соединений.
2. Развивающая – Расширить кругозор
обучающихся на основе интеграции знаний;
развивать логическое мышление.
3. Воспитательная – Содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины
«Органическая химия»
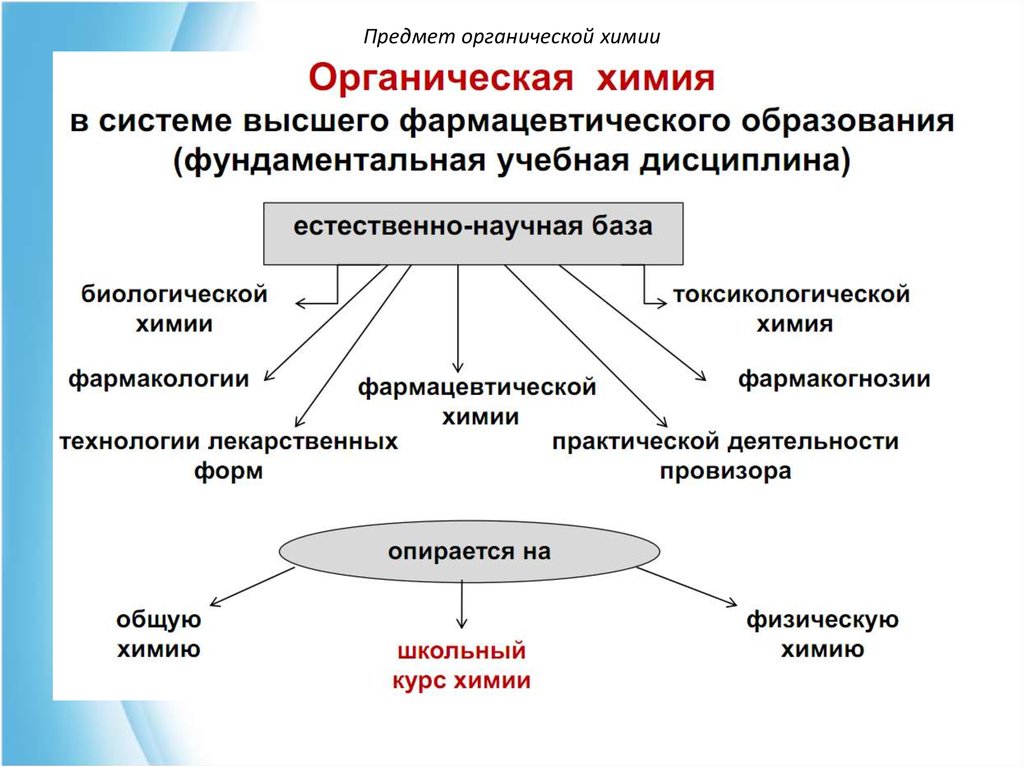
3. Предмет органической химии
Органическаяхимия
– научная дисциплина,
изучающая органические соединения.
Органические соединения – это углеводороды и их
производные.
Лекарственные препараты на ≈95% представлены
органическими веществами.
Органическая химия – базовая дисциплина в подготовке
провизора, т.к. позволяет понять важнейшие
процессы,
протекающие как in vitro, так и in vivo. Она формирует научнотеоретический и экспериментальный базис для усвоения
специальных
знаний
по
фармацевтической
химии,
фармакогнозии, фармакологии, токсикологической химии,
фармтехнологии.
4. Предмет органической химии
5.
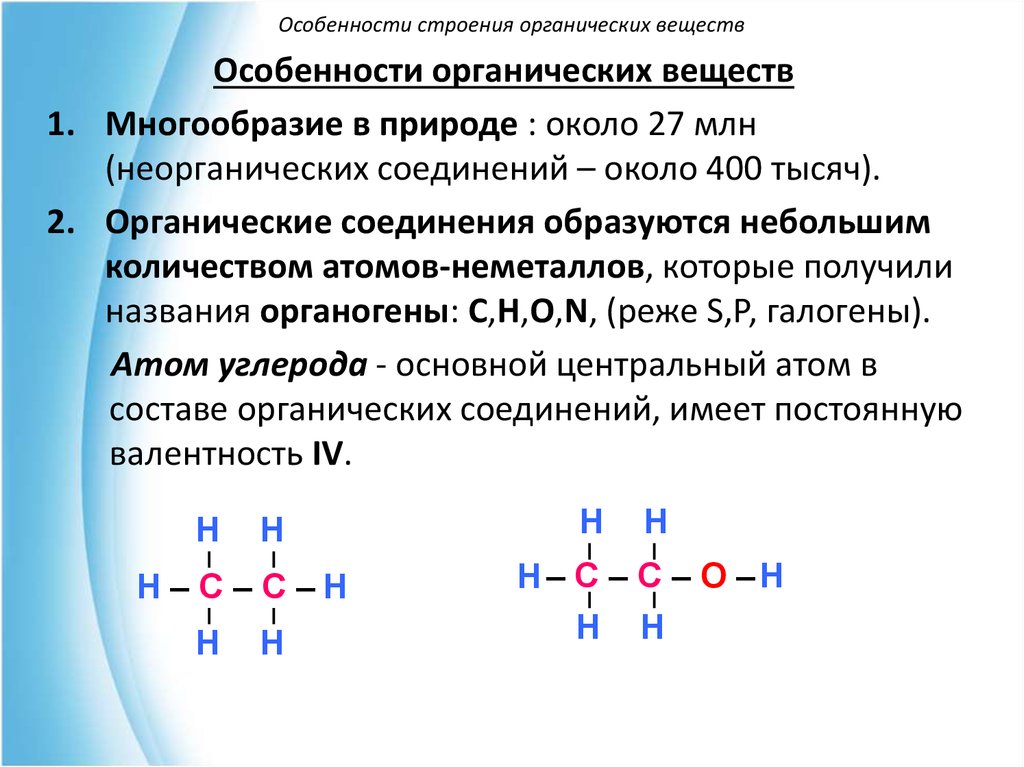
Особенности строения органических веществОсобенности органических веществ
1. Многообразие в природе : около 27 млн
(неорганических соединений – около 400 тысяч).
2. Органические соединения образуются небольшим
количеством атомов-неметаллов, которые получили
названия органогены: С,Н,О,N, (реже S,Р, галогены).
Атом углерода - основной центральный атом в
составе органических соединений, имеет постоянную
валентность IV.
Н
Н
Н–С–С–Н
Н
Н
Н
Н
Н– С – С – О –Н
Н Н
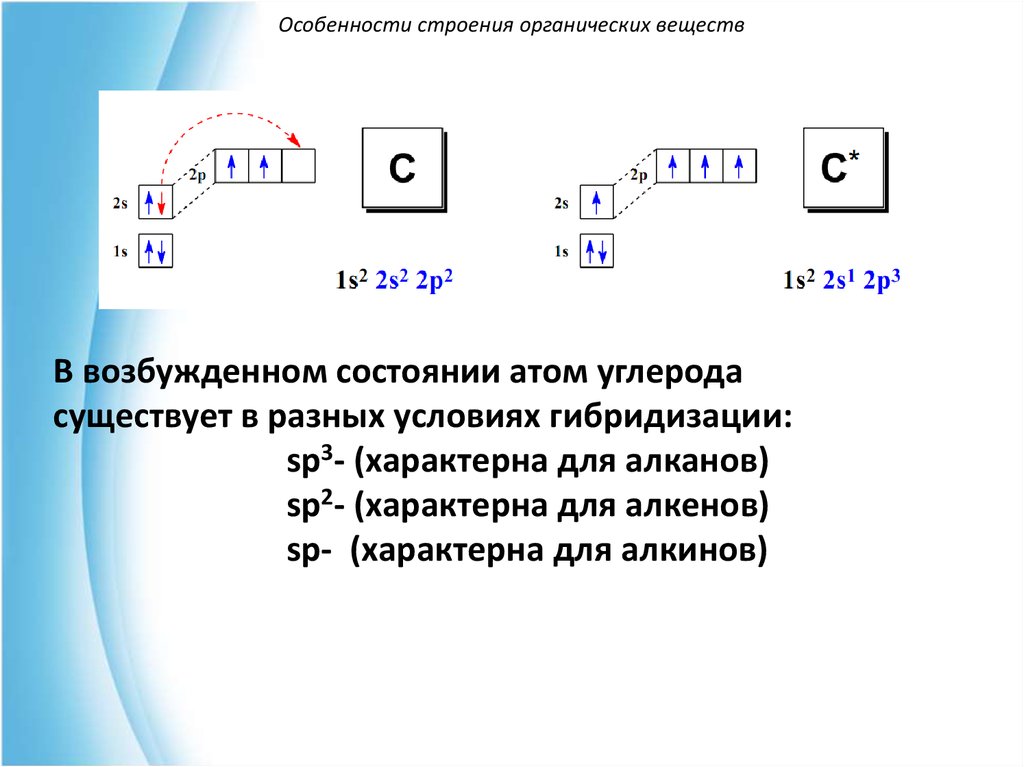
6.
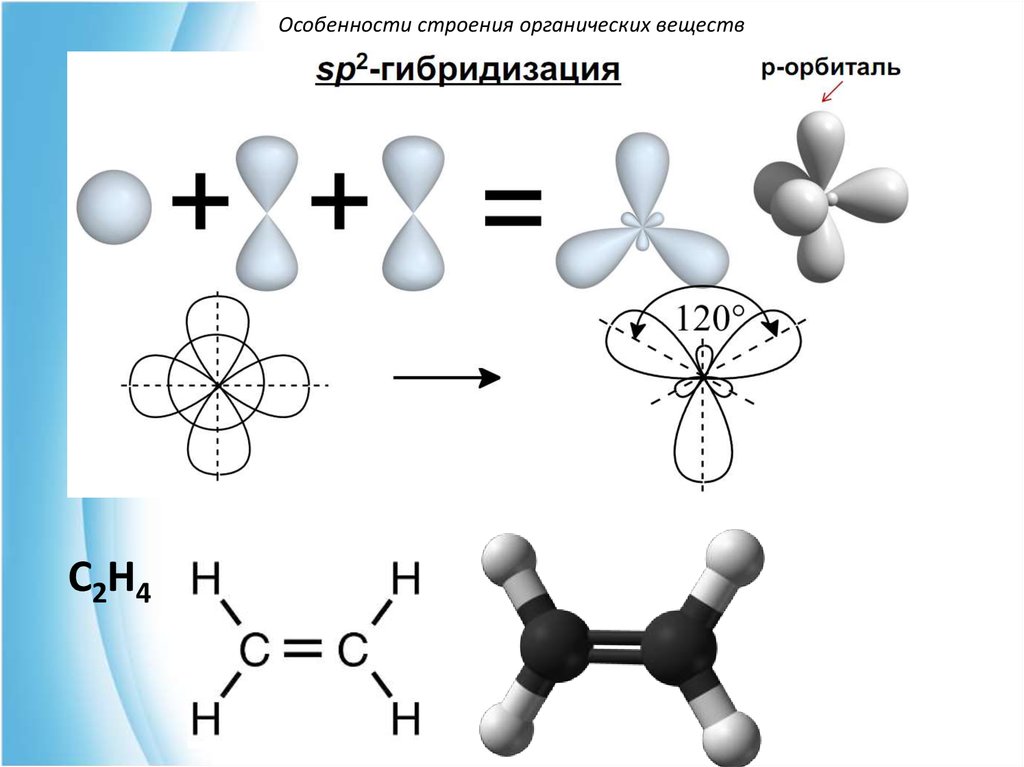
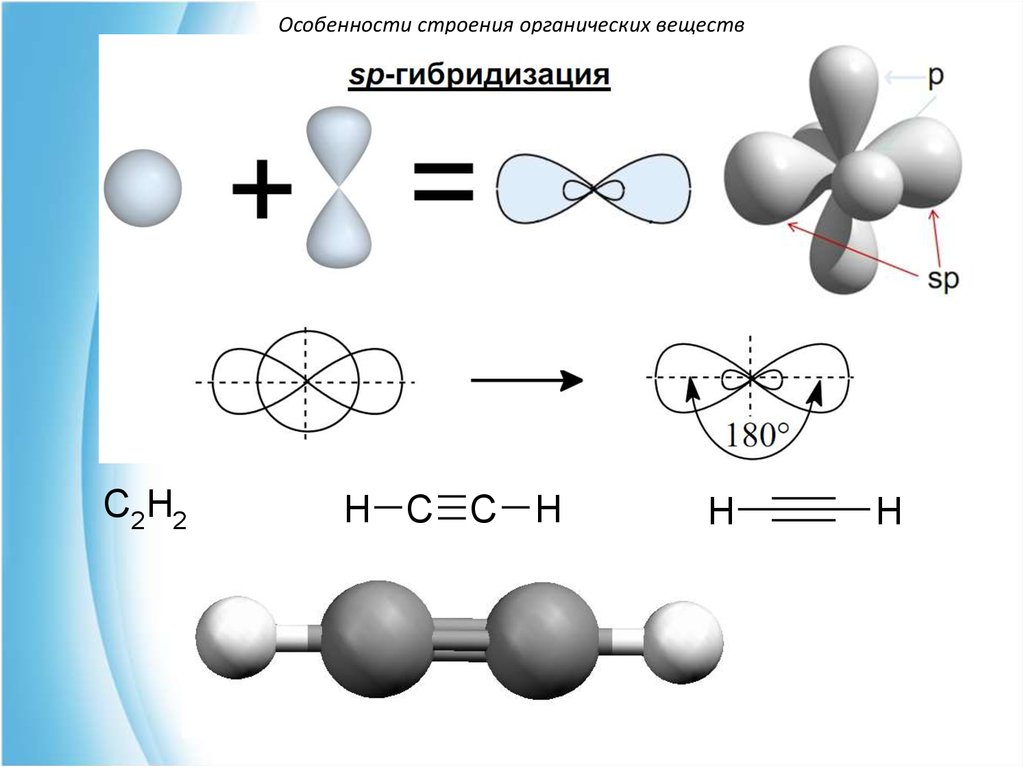
Особенности строения органических веществВ возбужденном состоянии атом углерода
существует в разных условиях гибридизации:
sp3- (характерна для алканов)
sp2- (характерна для алкенов)
sp- (характерна для алкинов)
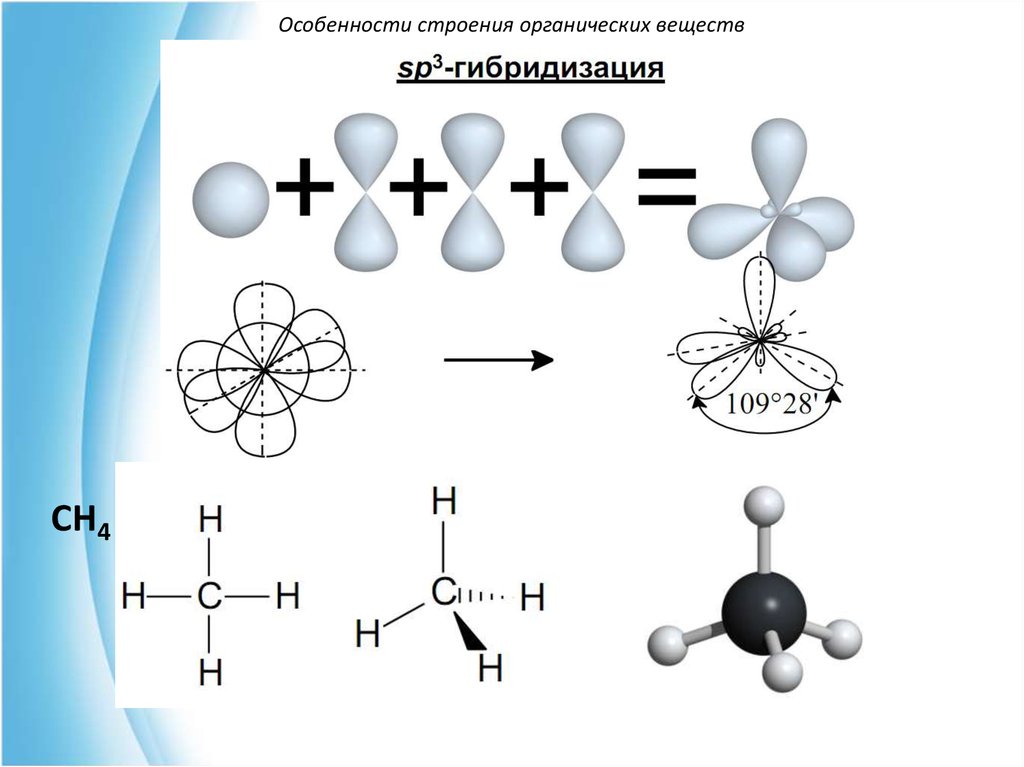
7.
Особенности строения органических веществСH4
8.
Особенности строения органических веществС2H4
9.
Особенности строения органических веществC2H2
H C C H
H
H
10.
Особенности строения органических веществ3.
Органические соединения имеют молекулярное
строение.
Основной тип химической связи – ковалентная:
• Неполярная (С-С)
• Слабополярная (С-H)
• Полярная (С-O)
11.
Особенности строения органических веществНеполярная ковалентная связь:
Образуется между атомами одного элемента;
Нет разности в электроотрицательности;
Общая электронная пара находится симметрично
относительно атомов, образующих связь.
Полярная ковалентная связь:
Образуется между атомами разных элементов;
Разница в электроотрицательности составляет не более
1,7 (по шкале Полинга);
Общая электронная пара смещена к наиболее
электроотрицательному атому.
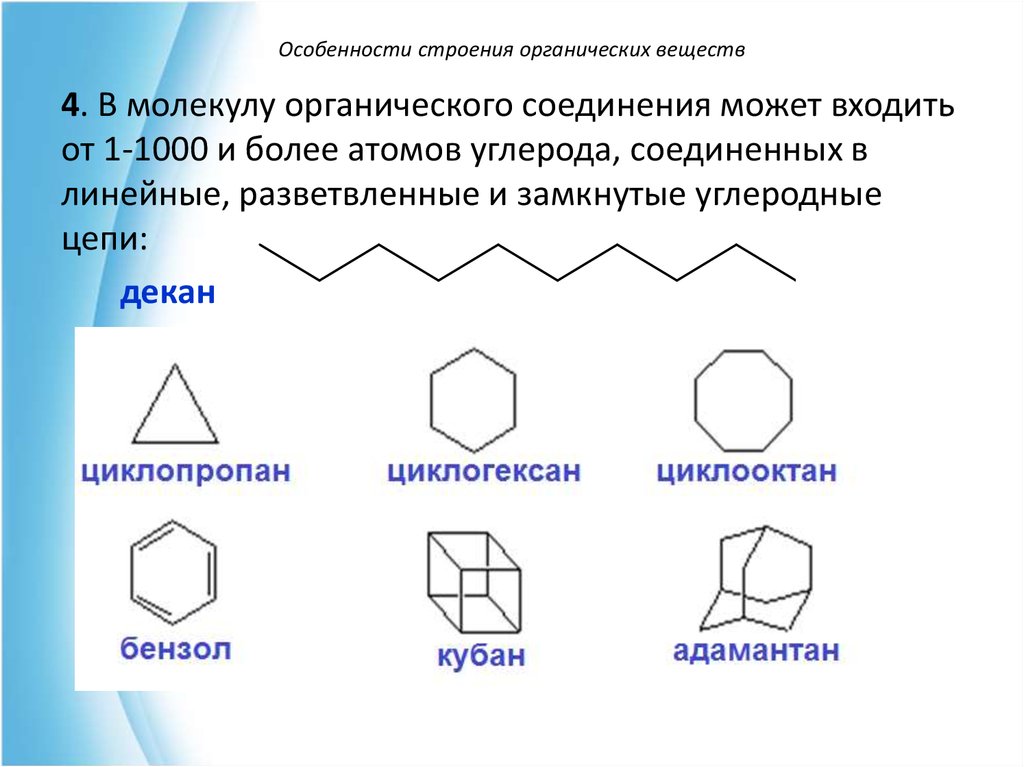
12. Особенности строения органических веществ
4. В молекулу органического соединения может входитьот 1-1000 и более атомов углерода, соединенных в
линейные, разветвленные и замкнутые углеродные
цепи:
декан
13.
Особенности строения органических веществ5. Для органических веществ характерна изомерия.
Изомеры – вещества имеющие одинаковый состав,
но разное химическое строение (структурная
изомерия) или различное расположение атомов
(групп атомов) в пространстве (стерео- или
пространственная изомерия).
14.
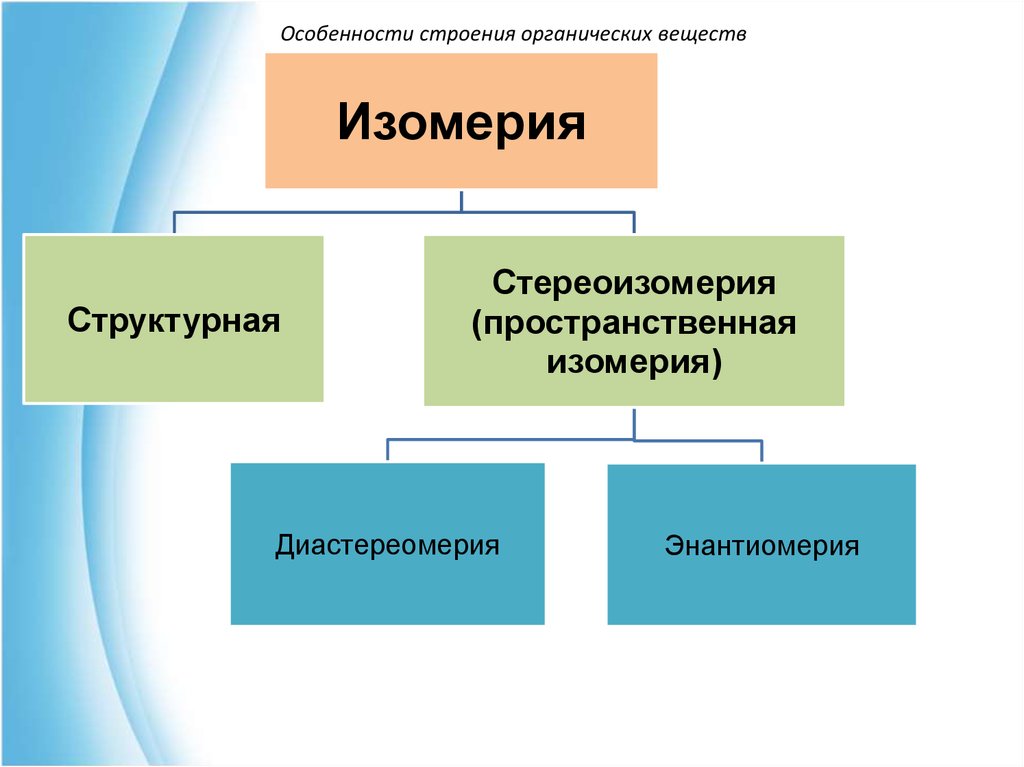
Особенности строения органических веществИзомерия
Структурная
Стереоизомерия
(пространственная
изомерия)
Диастереомерия
Энантиомерия
15.
Структурная изомерияСтруктурная изомерия
Структурные изомеры – изомеры, отличающиеся
химическим строением и, следовательно, химическими
свойствами.
Различают изомерию:
• углеродного скелета
• положения функциональной группы и кратной связи
• межклассовую изомерию
• валентную изомерию
16.
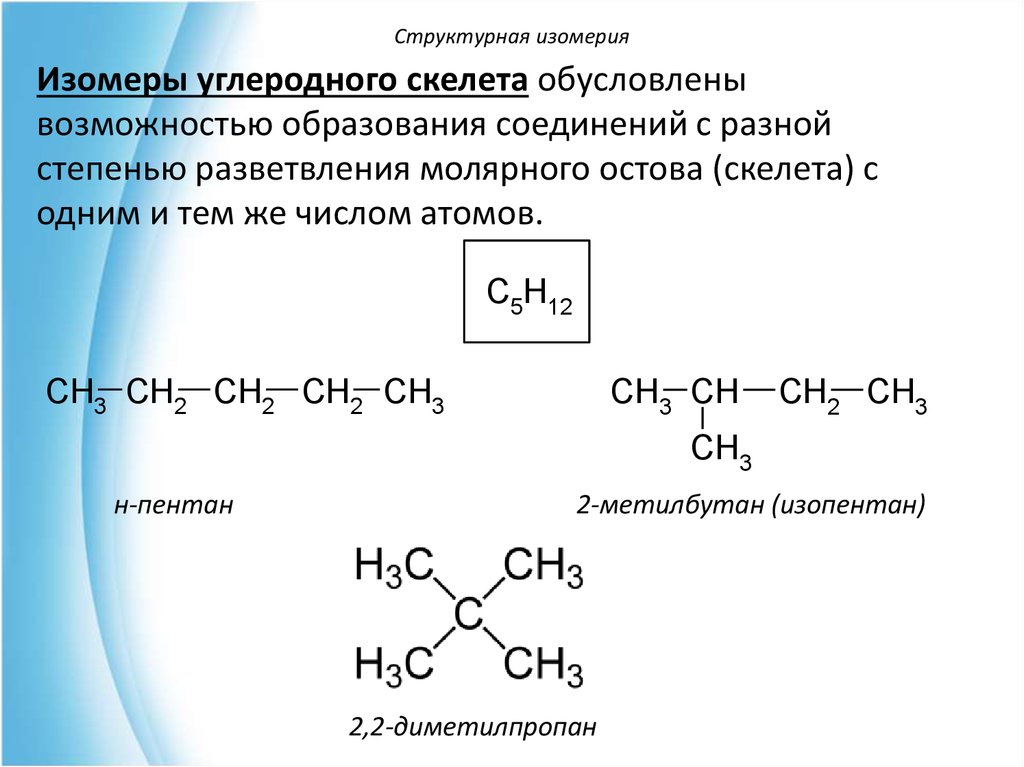
Структурная изомерияИзомеры углеродного скелета обусловлены
возможностью образования соединений с разной
степенью разветвления молярного остова (скелета) с
одним и тем же числом атомов.
C5H12
CH3 CH2 CH2 CH2 CH3
CH3 CH
CH2 CH3
CH3
н-пентан
2-метилбутан (изопентан)
2,2-диметилпропан
17.
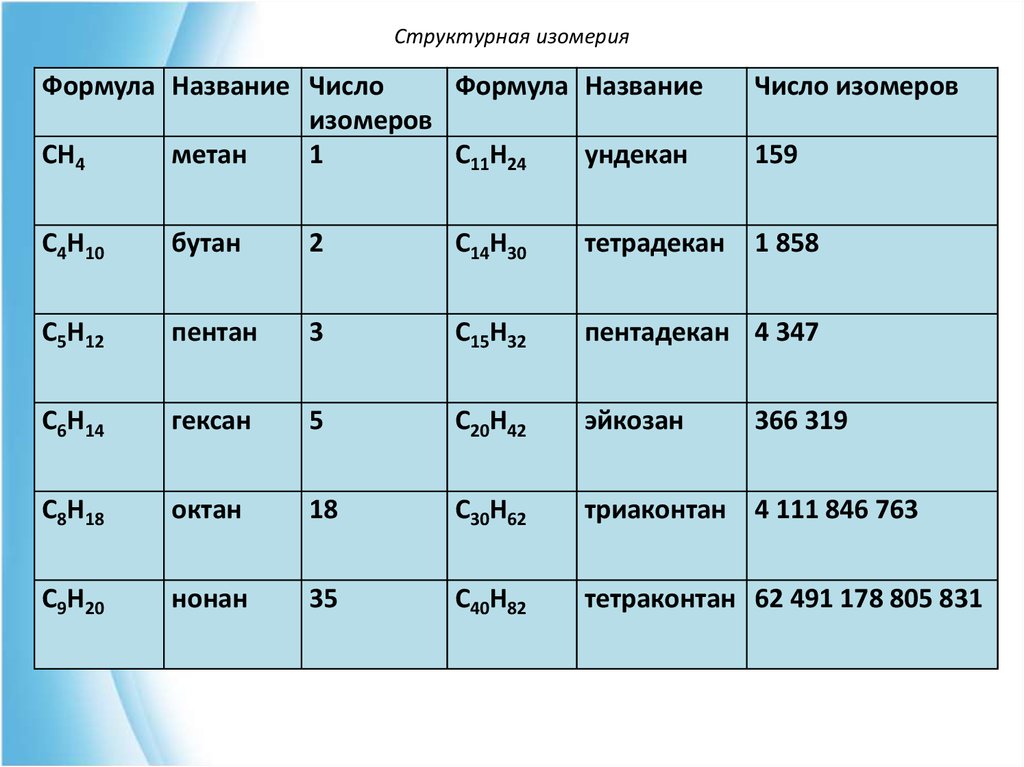
Структурная изомерияФормула Название Число
Формула Название
изомеров
СН4
метан
1
С11Н24
ундекан
Число изомеров
С4Н10
бутан
2
С14Н30
тетрадекан
1 858
С5Н12
пентан
3
С15Н32
пентадекан 4 347
С6Н14
гексан
5
С20Н42
эйкозан
С8Н18
октан
18
С30Н62
триаконтан 4 111 846 763
С9Н20
нонан
35
С40Н82
тетраконтан 62 491 178 805 831
159
366 319
18.
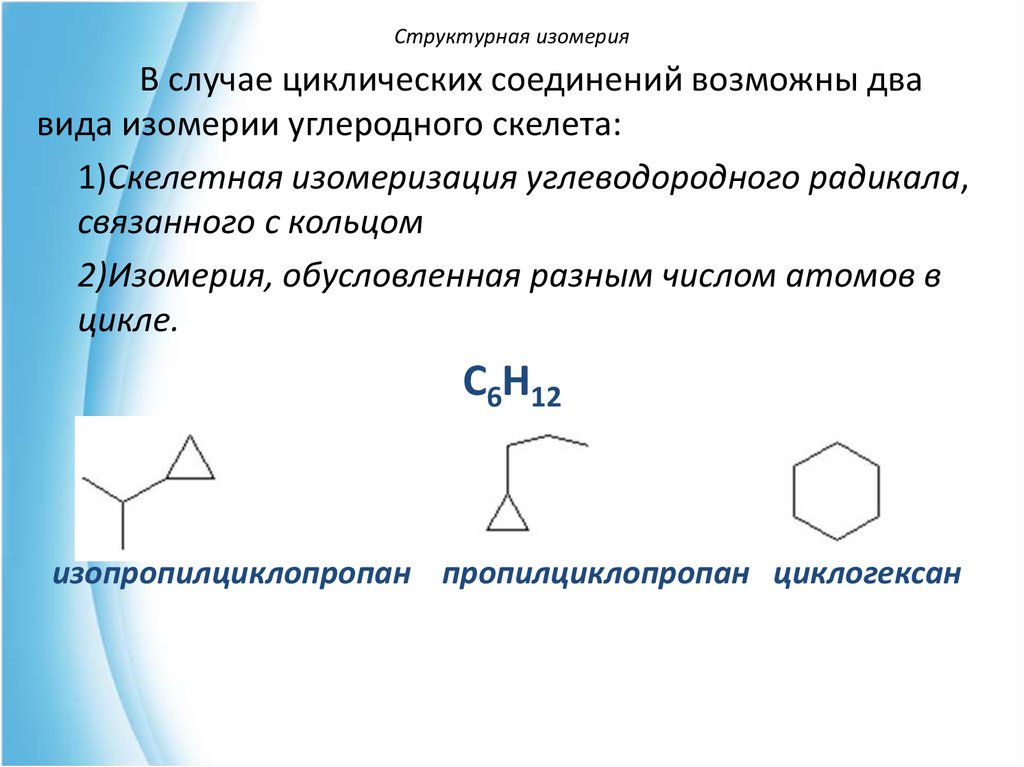
Структурная изомерияВ случае циклических соединений возможны два
вида изомерии углеродного скелета:
1)Скелетная изомеризация углеводородного радикала,
связанного с кольцом
2)Изомерия, обусловленная разным числом атомов в
цикле.
С6Н12
изопропилциклопропан пропилциклопропан циклогексан
19.
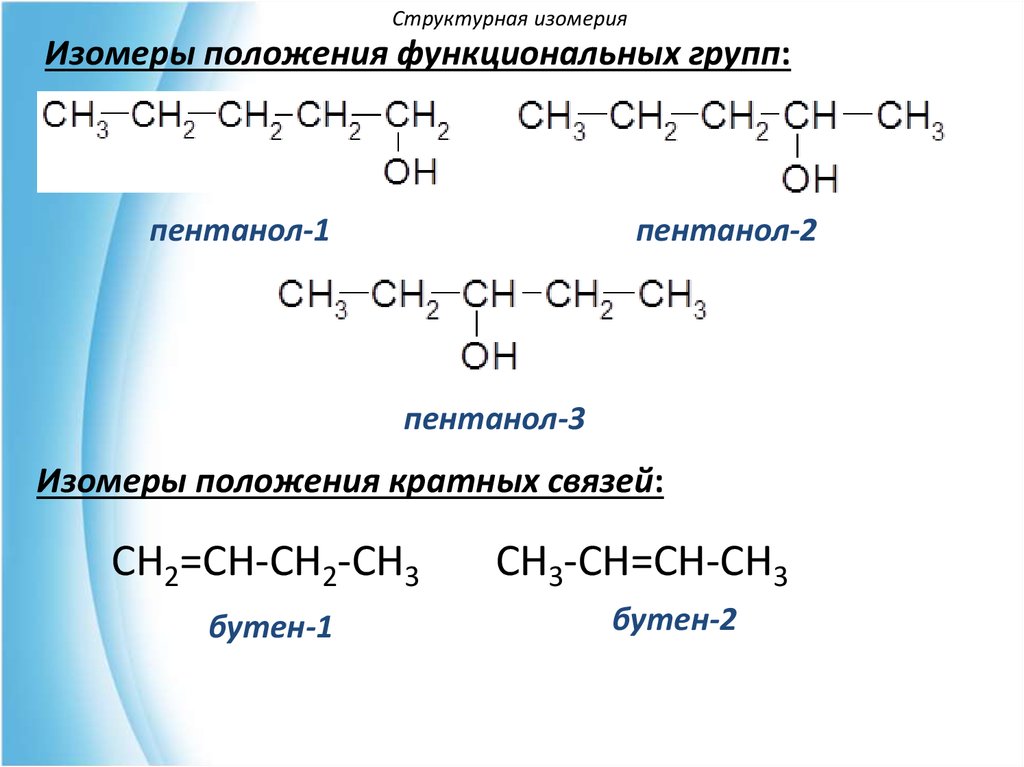
Структурная изомерияИзомеры положения функциональных групп:
пентанол-1
пентанол-2
пентанол-3
Изомеры положения кратных связей:
CH2=CH-CH2-CH3
бутен-1
CH3-CH=CH-CH3
бутен-2
20.
Структурная изомерияМежклассовая изомерия (изомерия функциональной
принадлежности) – изомерия веществ, принадлежащих к
разным классам органических соединений.
С2Н6О
этиловый спирт
диметиловый эфир
21.
Структурная изомерияВалентная изомерия - вид изомерии, при котором
изомеры можно превратить друг друга только
перераспределением связей.
Примером служит бензол и образующиеся при его УФоблучении изомеры:
бензол
бицикло[2.2.0]гексадиен-2,5
(бензол Дьюара)
бензвален
призман
(бензол Ланденбурга)
22.
Особенности строения органических веществ6. Для удобства изучения по свойствам и строению
органические вещества объединяют в
гомологические ряды.
Гомологи – вещества имеющие сходное строение и
свойства, отличающиеся между собой на
гомологическую разность CH2
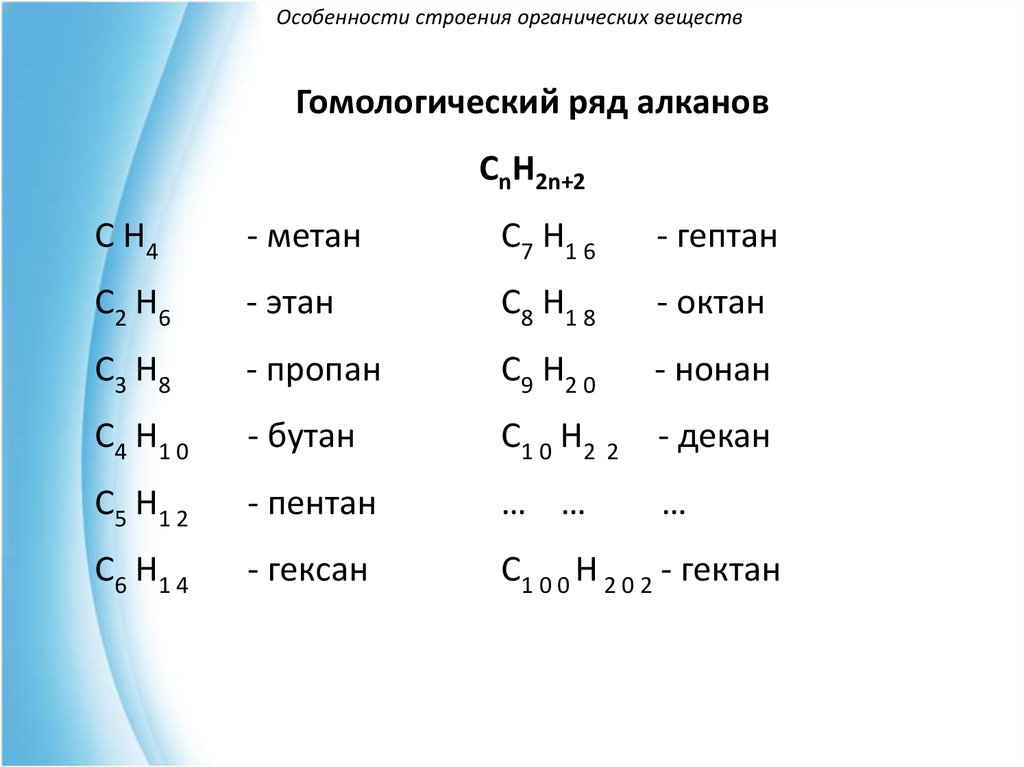
23. Особенности строения органических веществ
Гомологический ряд алкановСnH2n+2
C H4
- метан
C7 H1 6
- гептан
C2 H6
- этан
C8 H1 8
- октан
C3 H8
- пропан
C9 H2 0
- нонан
C4 H1 0
- бутан
C1 0 H2 2
- декан
C5 H1 2
- пентан
… …
…
C6 H1 4
- гексан
С1 0 0 H 2 0 2 - гектан
24. Особенности строения органических веществ
Гомологический ряд предельных одноосновныхкарбоновых кислот
СnH2n+1COOH
25.
Особенности строения органических веществ7. Атомы углерода (углеродные звенья) в углеродной
цепи могут быть первичными, вторичными,
третичными или четвертичными
• атом углерода, стоящий в начале цепи и связанный
только с одним соседним атомом углерода
называется первичным
• атом углерода, непосредственно связанный с двумя
соседними атомами углерода, называется вторичным
• с тремя – третичным
• с четырьмя - четвертичным
26.
Особенности строения органических веществ2,2,4-триметилпентан
27.
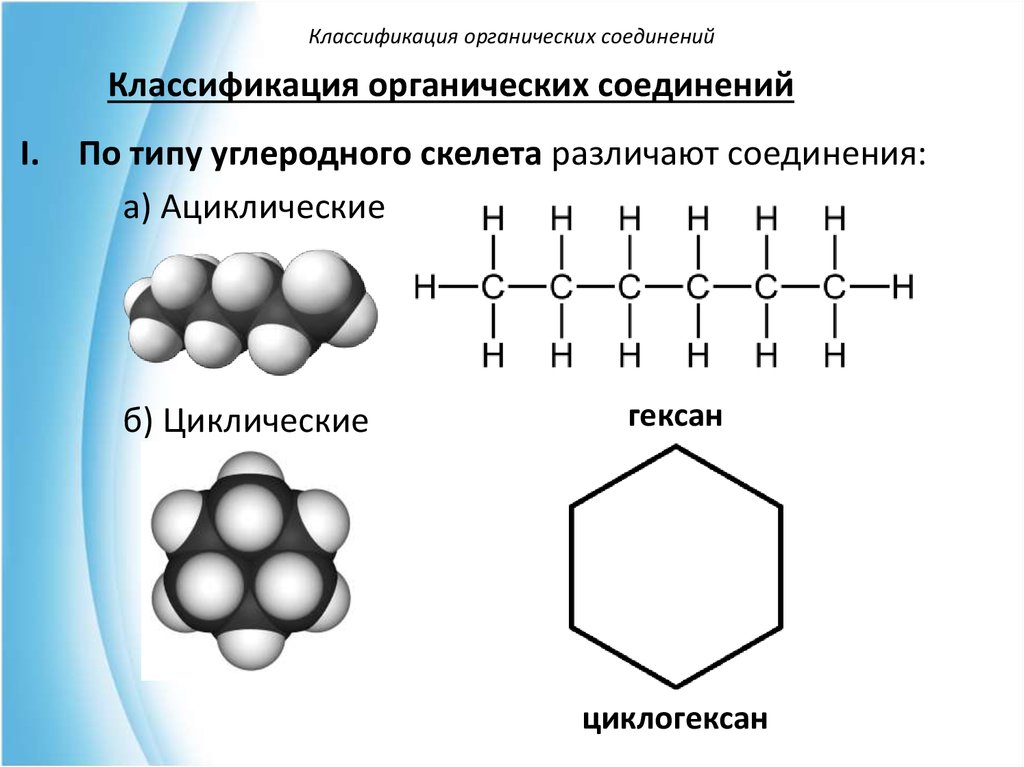
Классификация органических соединенийКлассификация органических соединений
I.
По типу углеродного скелета различают соединения:
а) Ациклические
б) Циклические
гексан
циклогексан
28.
Классификация органических соединенийII. По наличию углеводородного радикала:
а) Разветвленные
б) Неразветвленные
29.
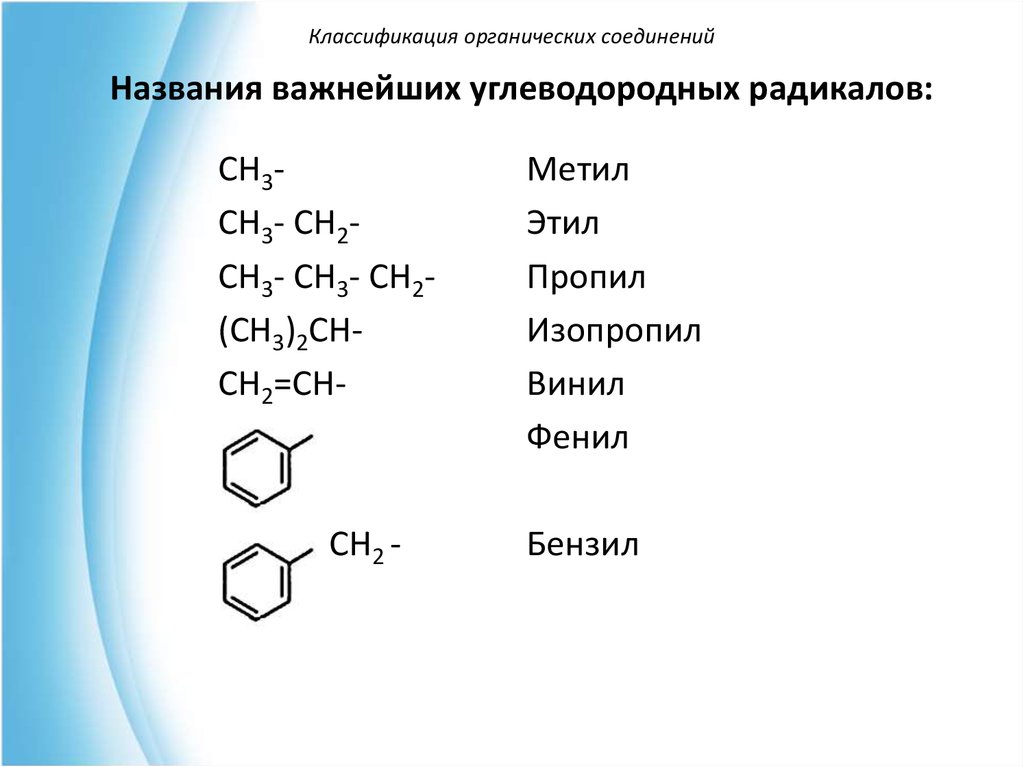
Классификация органических соединенийНазвания важнейших углеводородных радикалов:
CH3CH3- CH2CH3- CH3- CH2(CH3)2CHCH2=CH-
CH2 -
Метил
Этил
Пропил
Изопропил
Винил
Фенил
Бензил
30.
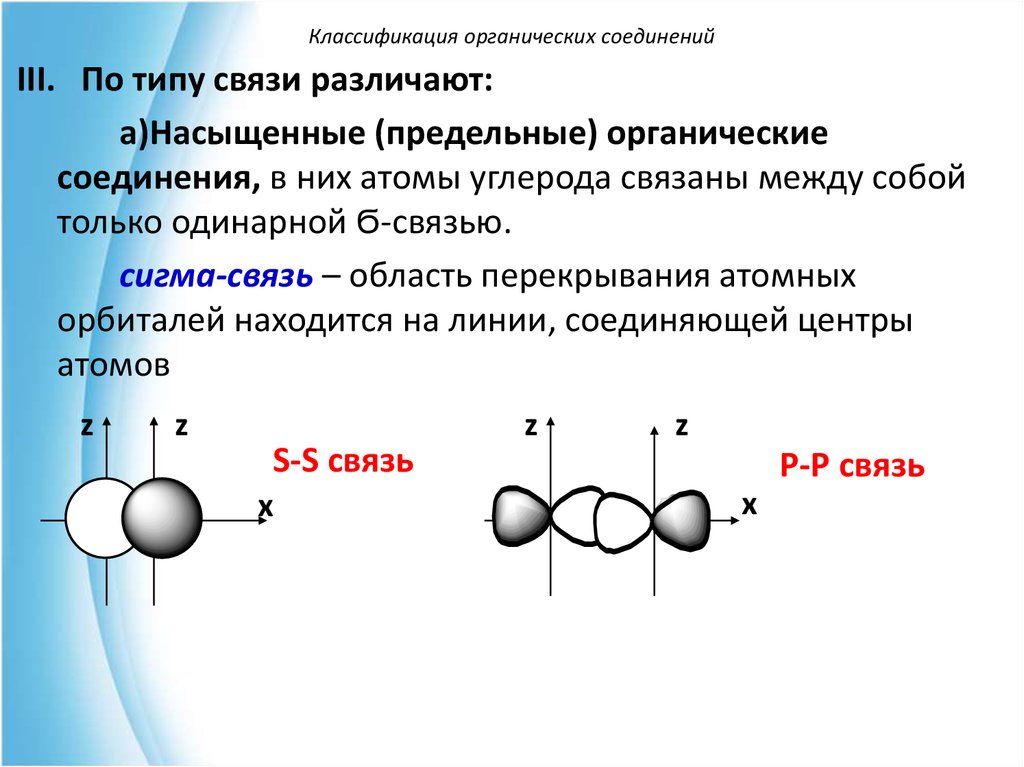
Классификация органических соединенийIII. По типу связи различают:
а)Насыщенные (предельные) органические
соединения, в них атомы углерода связаны между собой
только одинарной Ϭ-связью.
сигма-связь – область перекрывания атомных
орбиталей находится на линии, соединяющей центры
атомов
z
z
S-S связь
x
z
z
P-P связь
x
31.
Классификация органических соединенийб)Ненасыщенные ( непредельные) соединения –
атомы углерода связаны как Ϭ-, так и π- связями.
пи-связь – область перекрывания атомных
орбиталей располагается на линии, перпендикулярной
линии, соединяющей центры атомов
z
z
z
P-P связь
z
P-P связь
x
x
y
y
32.
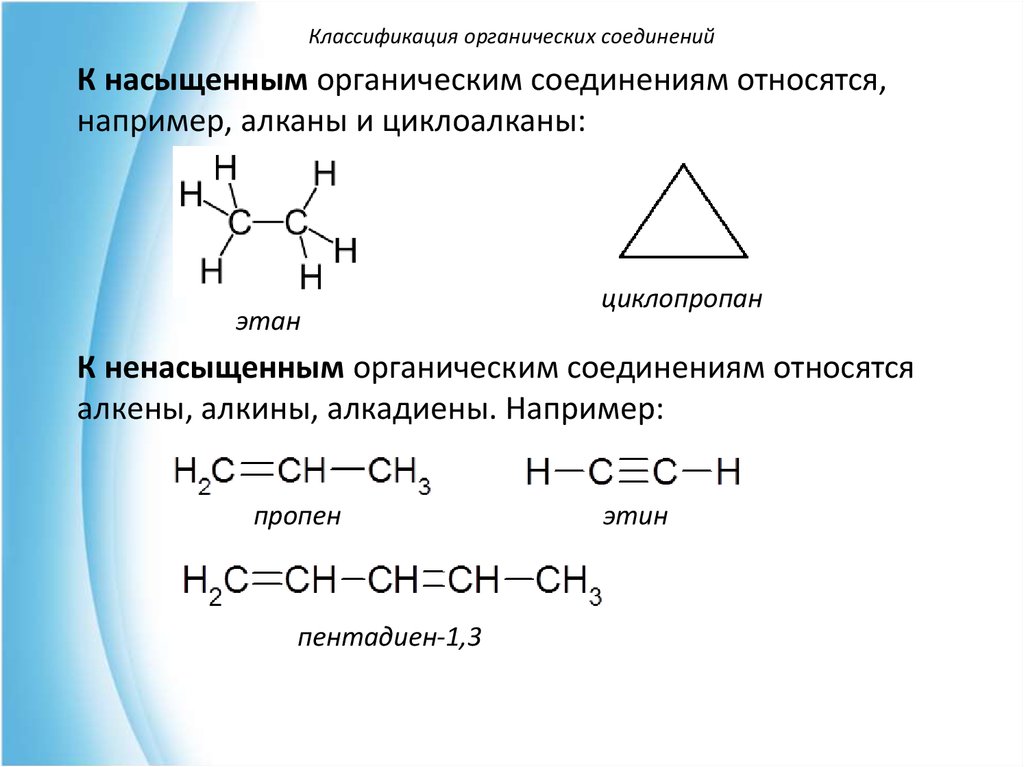
Классификация органических соединенийК насыщенным органическим соединениям относятся,
например, алканы и циклоалканы:
этан
циклопропан
К ненасыщенным органическим соединениям относятся
алкены, алкины, алкадиены. Например:
пропен
пентадиен-1,3
этин
33.
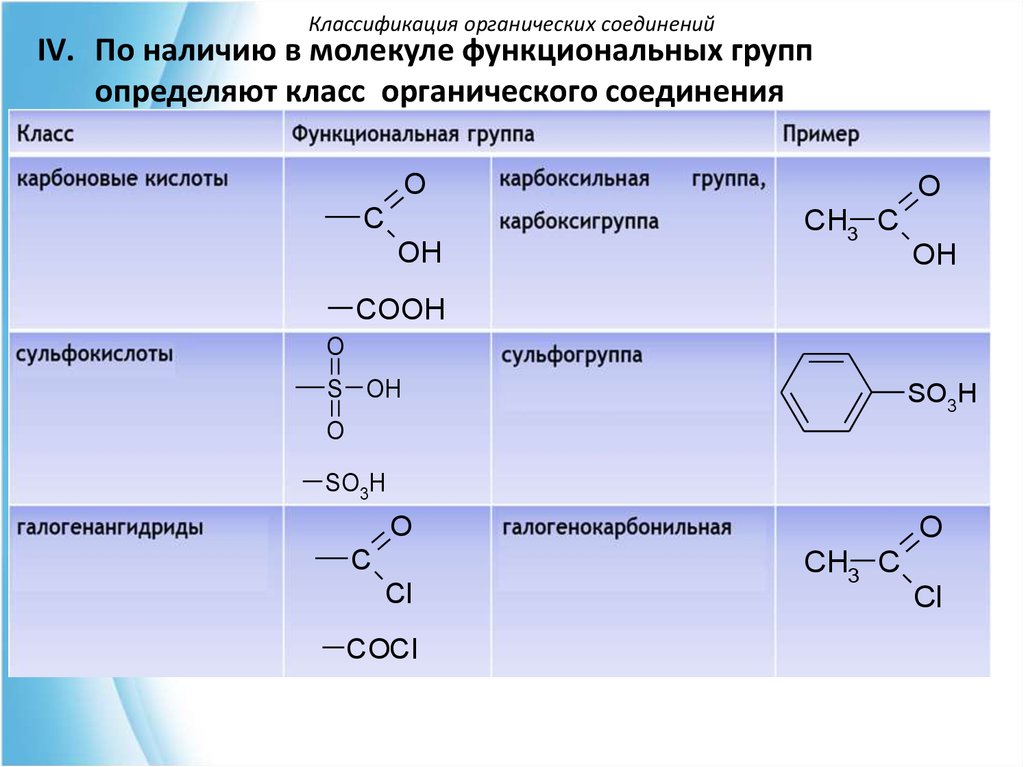
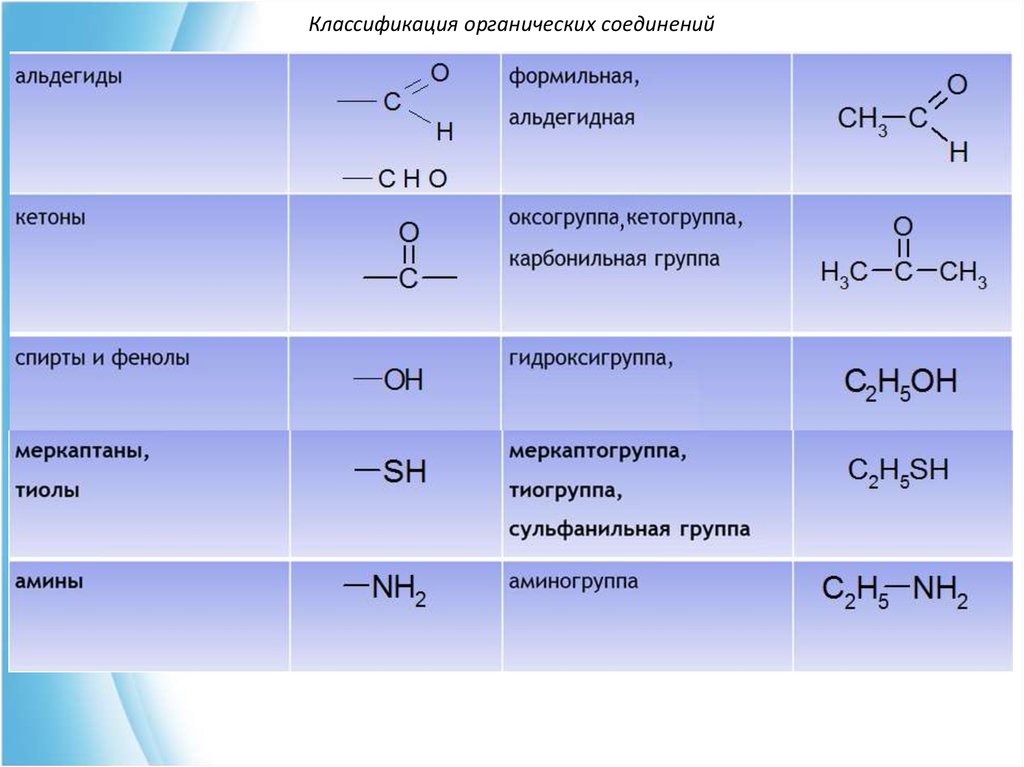
Классификация органических соединенийIV. По наличию в молекуле функциональных групп
определяют класс органического соединения
O
C
OH
O
CH3 C
OH
COOH
O
S OH
SO3H
O
SO3H
O
C
Cl
COCl
O
CH3 C
Cl
34.
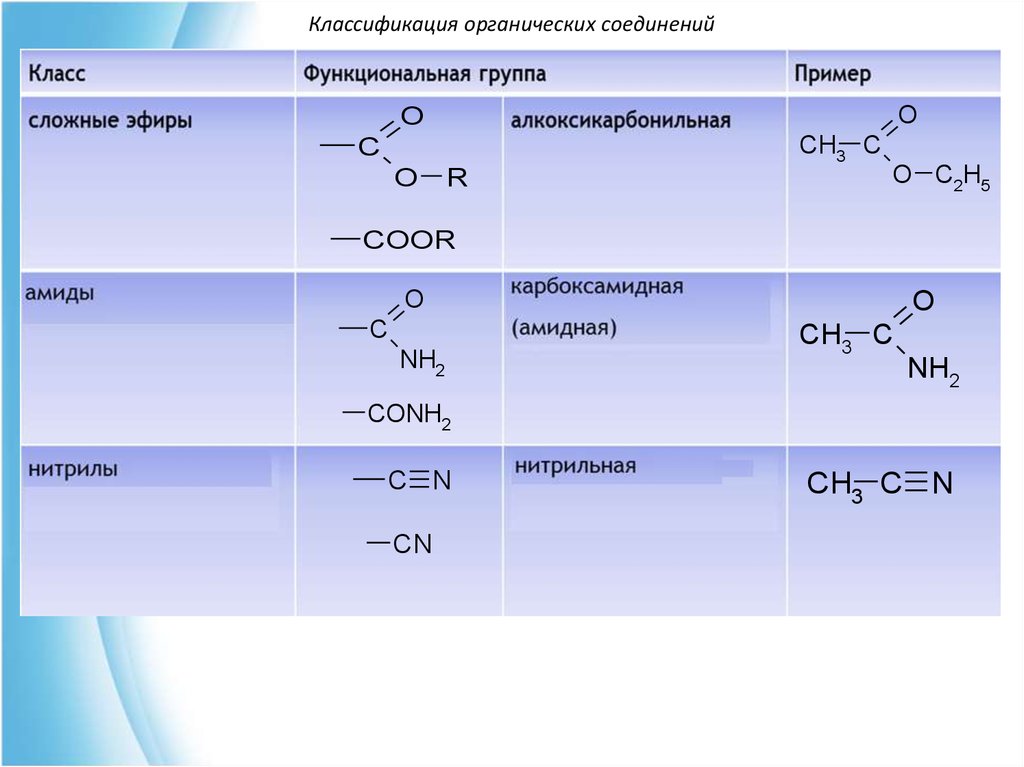
Классификация органических соединенийO
O
CH3 C
C
O
R
O C2H5
COOR
O
O
C
NH2
CH3 C
NH2
CONH2
C N
CN
CH3 C N
35.
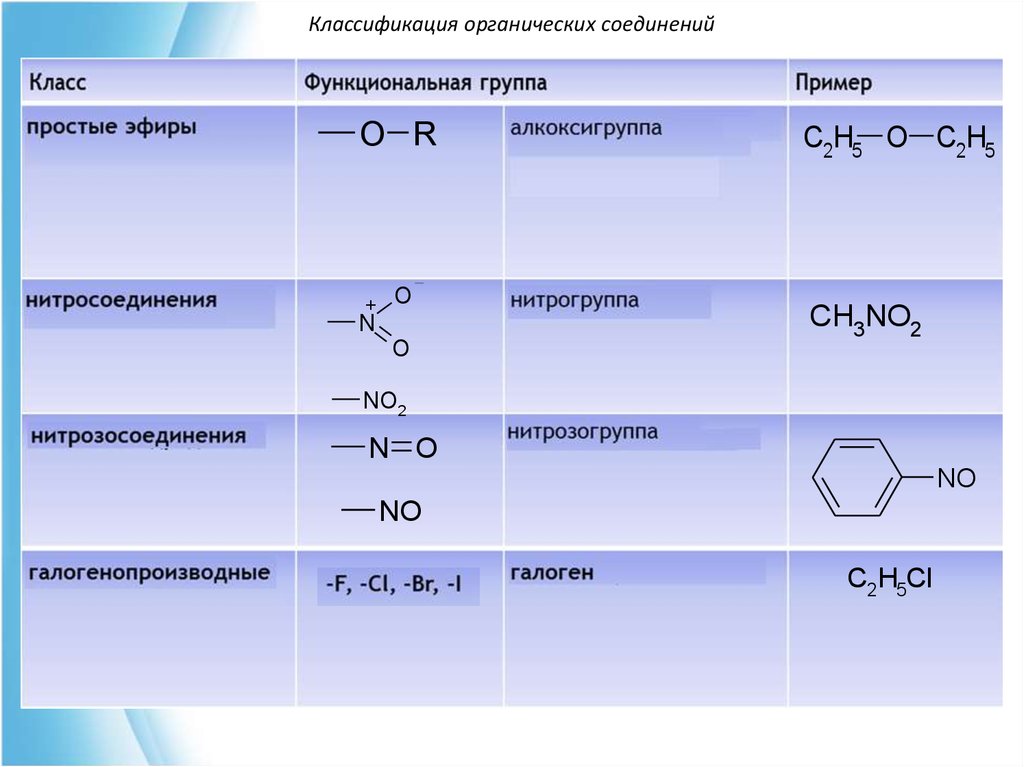
Классификация органических соединений36.
Классификация органических соединенийO R
+ O
N
O
C2H5 O C2H5
CH3NO2
NO2
N O
NO
NO
C2H5Cl
37.
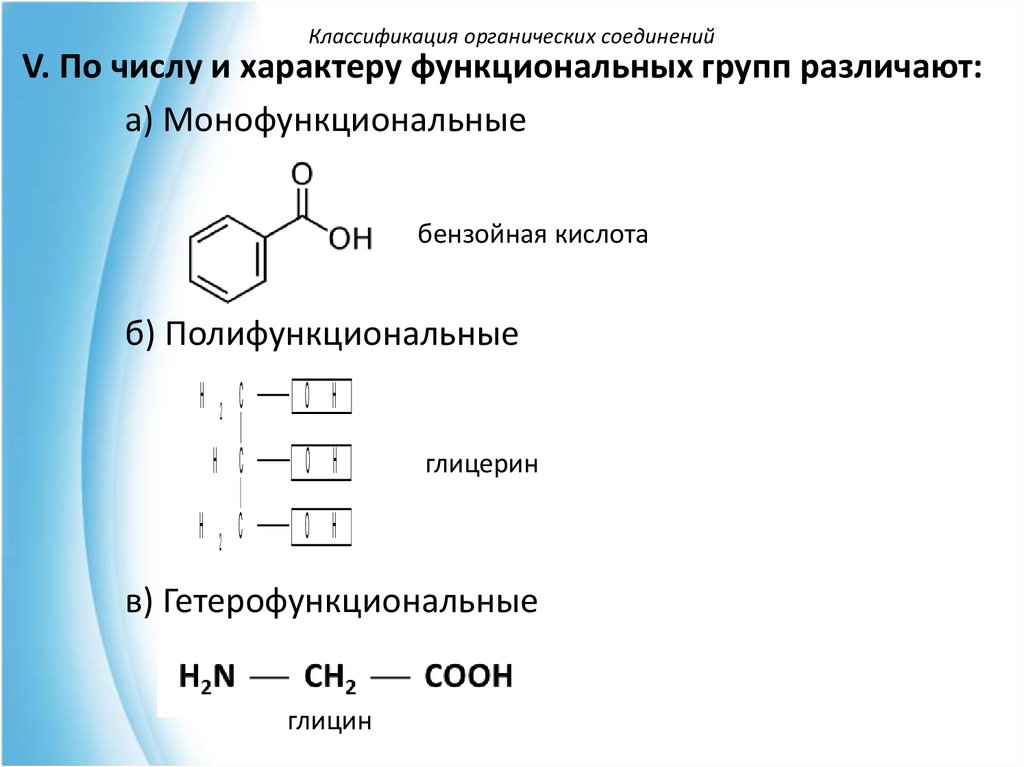
Классификация органических соединенийV. По числу и характеру функциональных групп различают:
а) Монофункциональные
бензойная кислота
б) Полифункциональные
H 2 C
O H
H C
O H
H 2 C
O H
глицерин
в) Гетерофункциональные
глицин
38.
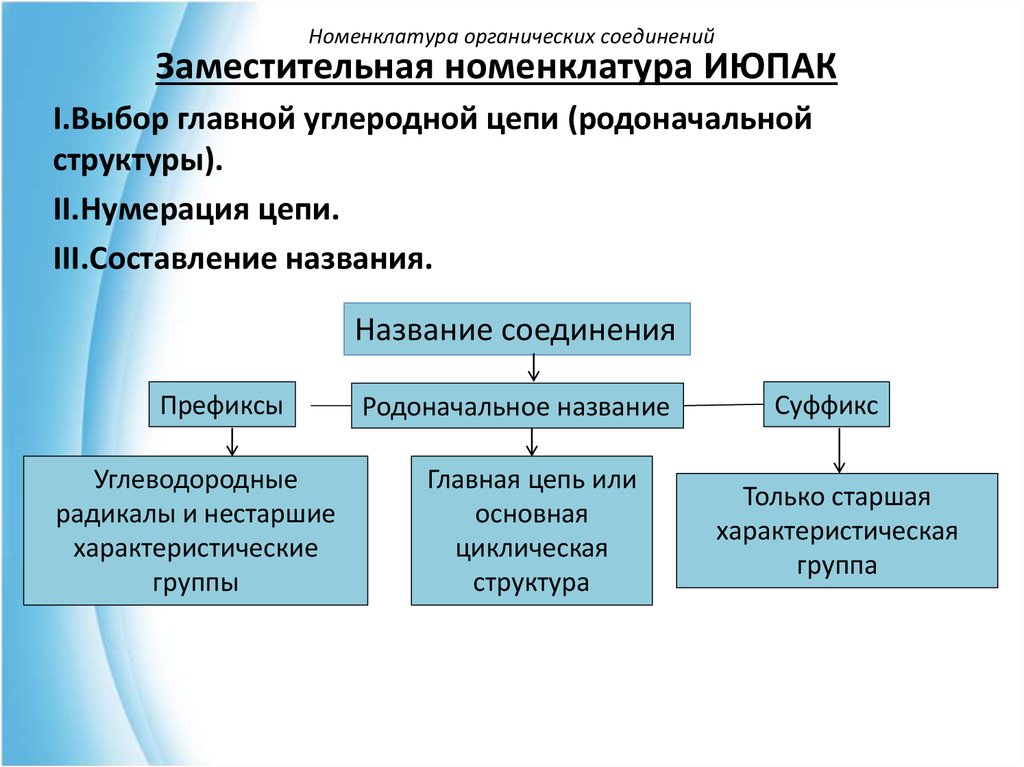
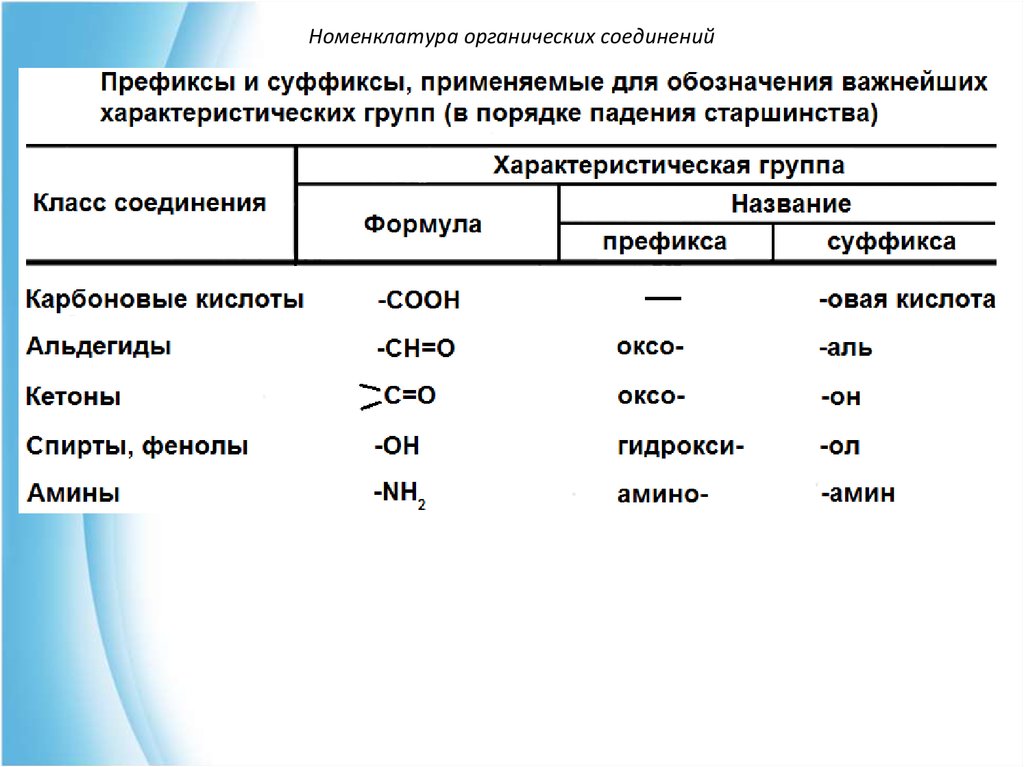
Номенклатура органических соединенийЗаместительная номенклатура ИЮПАК
I.Выбор главной углеродной цепи (родоначальной
структуры).
II.Нумерация цепи.
III.Составление названия.
Название соединения
Префиксы
Углеводородные
радикалы и нестаршие
характеристические
группы
Родоначальное название
Главная цепь или
основная
циклическая
структура
Суффикс
Только старшая
характеристическая
группа
39.
Номенклатура органических соединений40.
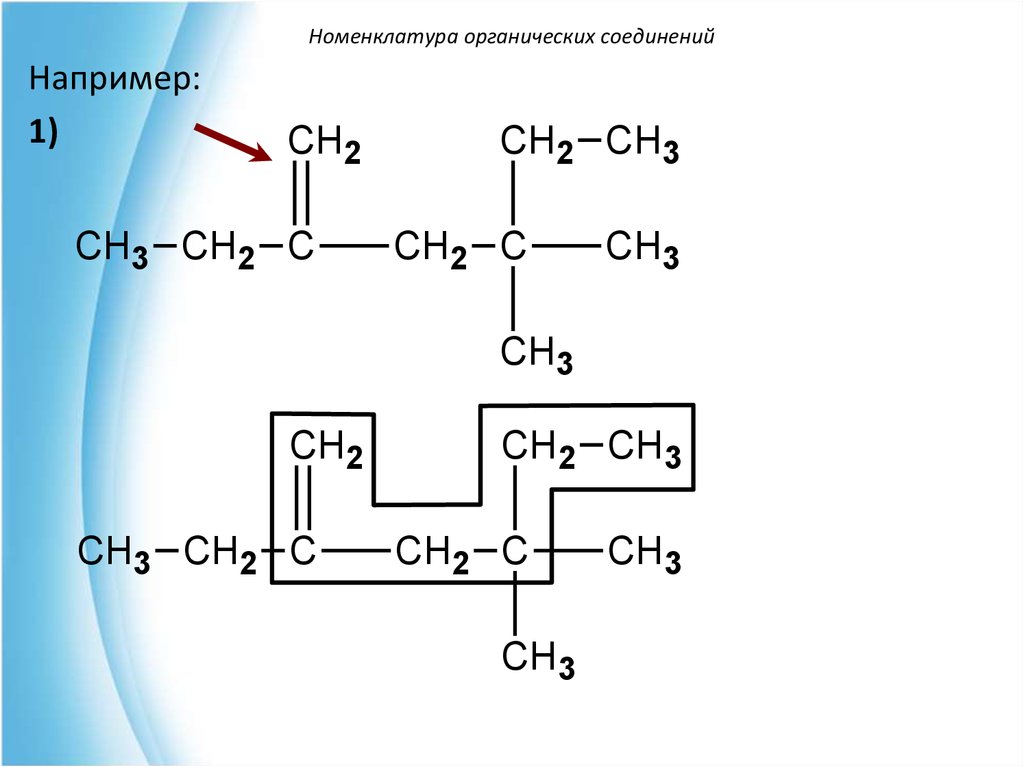
Номенклатура органических соединенийНапример:
1)
CH2
CH3 CH2 C
CH2 CH3
CH2 C
CH3
CH3
CH2
CH3 CH2 C
CH2 CH3
CH2 C
CH3
CH3
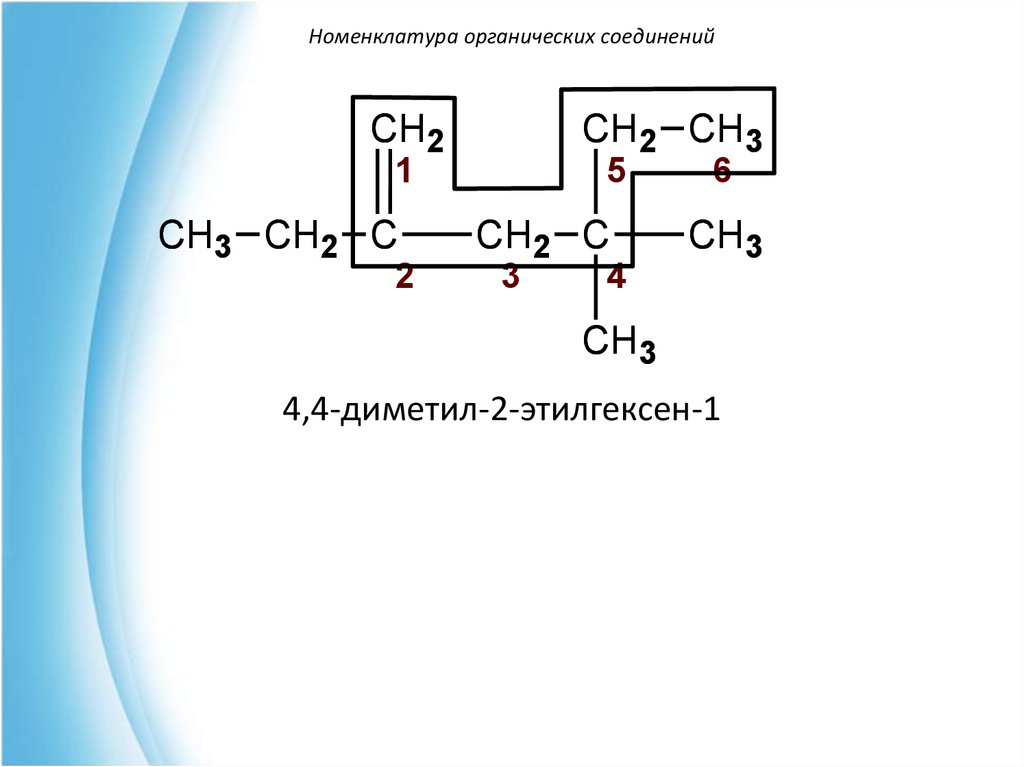
41.
Номенклатура органических соединенийCH2
CH2 CH3
1
CH3 CH2 C
2
5
CH2 C
3
4
6
CH3
CH3
4,4-диметил-2-этилгексен-1
42.
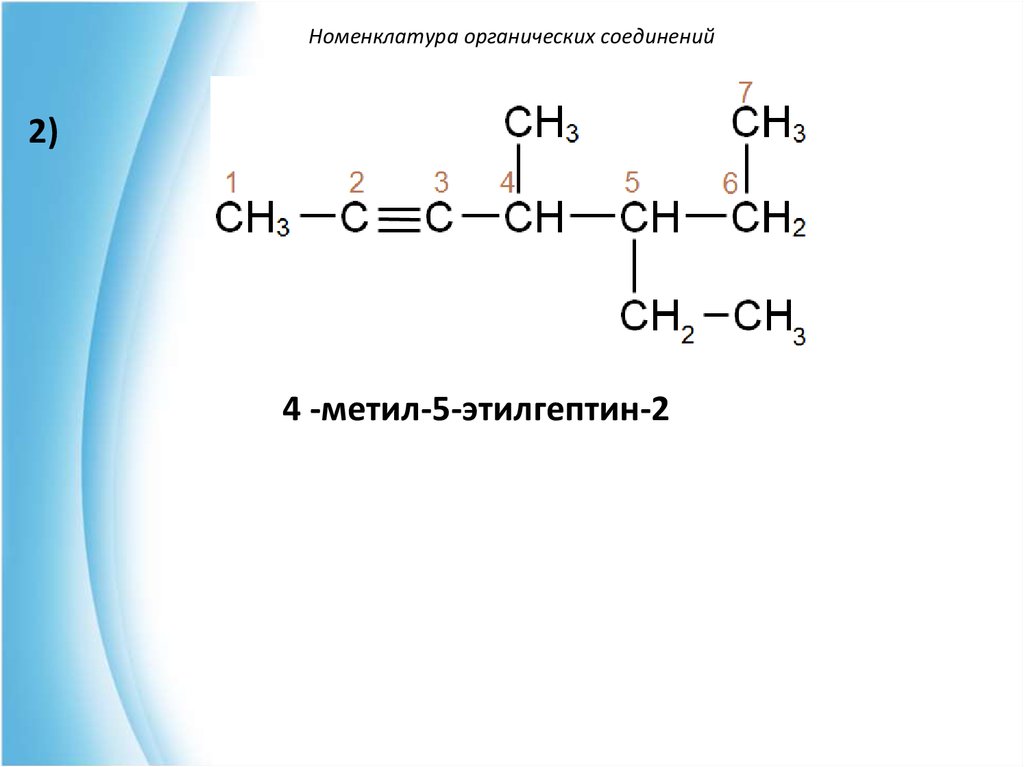
Номенклатура органических соединений2)
4 -метил-5-этилгептин-2
43.
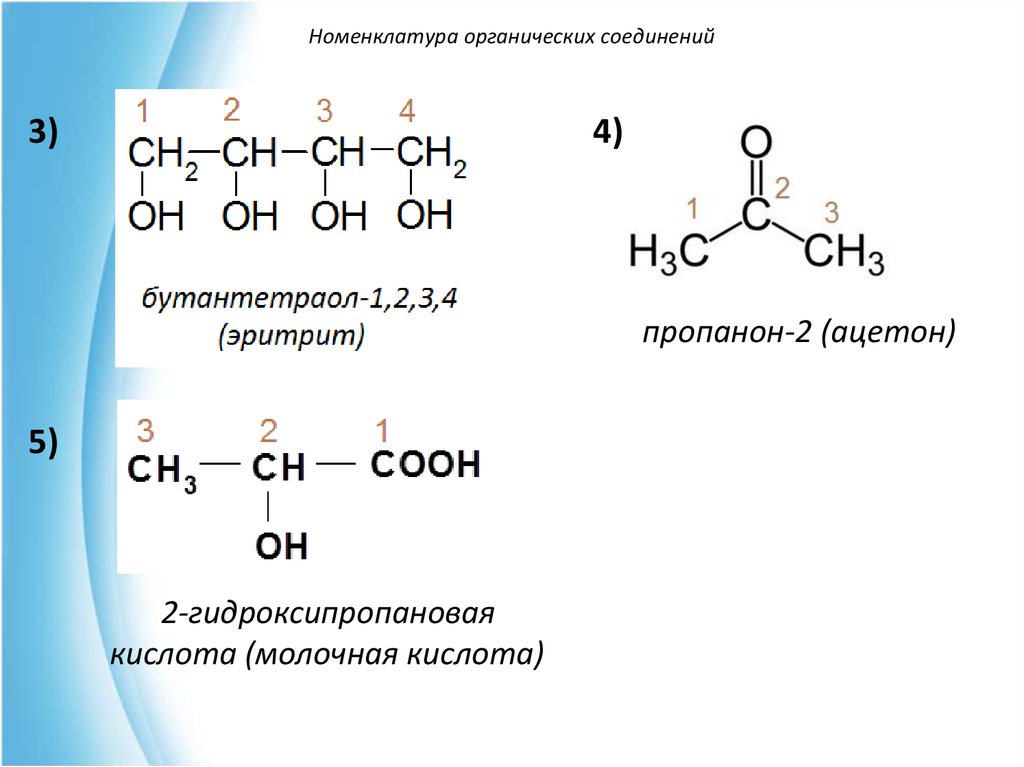
Номенклатура органических соединений3)
4)
пропанон-2 (ацетон)
5)
2-гидроксипропановая
кислота (молочная кислота)
44.
Номенклатура органических соединений6)
2 –оксобутандиовая кислота
(щавелевоуксусная кислота)
7)
8
7
6
5
4
3
2
1
(СН3)2С = СНСН2СН2С(СН3) = СНСНО
3,7-диметилоктадиен-2,6-аль
(цитраль)
45.
Классификация органических реакцийКлассификация органических реакций. Типы реагентов
Основными понятиями, характеризующими реакционную
способность органического вещества, являются:
Субстрат – вещество, на которое в ходе химической
реакции действует реагент. Как правило, это соединение,
молекула которого поставляет для образования новой связи
атом углерода.
Реагент - вещество, которым действуют на субстрат.
Реагентом может быть кислота, основание, окислитель,
восстановитель, а также радикал, электрофил или
нуклеофил.
46.
Классификация органических реакцийСвободный радикал (R·) – частица с неспаренным
электроном, очень реакционноспособная и короткоживущая.
Электрофил (E+, Е) – частица, «любящая электрон»,
несущая полный или частичный положительный заряд.
Нуклеофил (Nu-, :Nu) – частица, «любящая ядро»,
несущая полный или частичный отрицательный заряд.
47.
Классификация органических реакцийКлассификация реакций органических соединений
I. По характеру изменения связей в реагирующих
веществах различают реакции:
1) Радикальные (гомолитические):
свободные радикалы
2) Ионные (гетеролитические):
А |: В →
А+
+
Вионы
электрофил
нуклеофил
48.
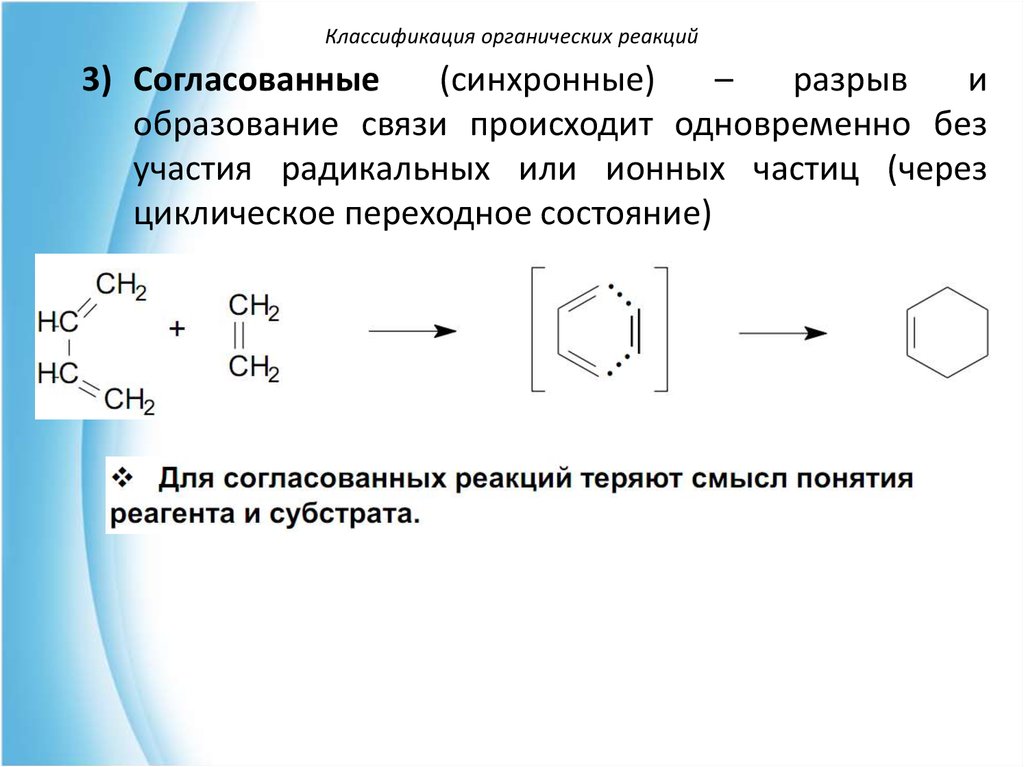
Классификация органических реакций3) Согласованные
(синхронные)
–
разрыв
и
образование связи происходит одновременно без
участия радикальных или ионных частиц (через
циклическое переходное состояние)
49.
Классификация органических реакцийII. По направлению (по конечному результату), т.е. по тем
изменениям, которые происходят в субстрате
различают:
1) Реакции замещения (S), характерны для многих
классов соединений.
R
X
субстрат
+
Y
R
Y + X
реагент
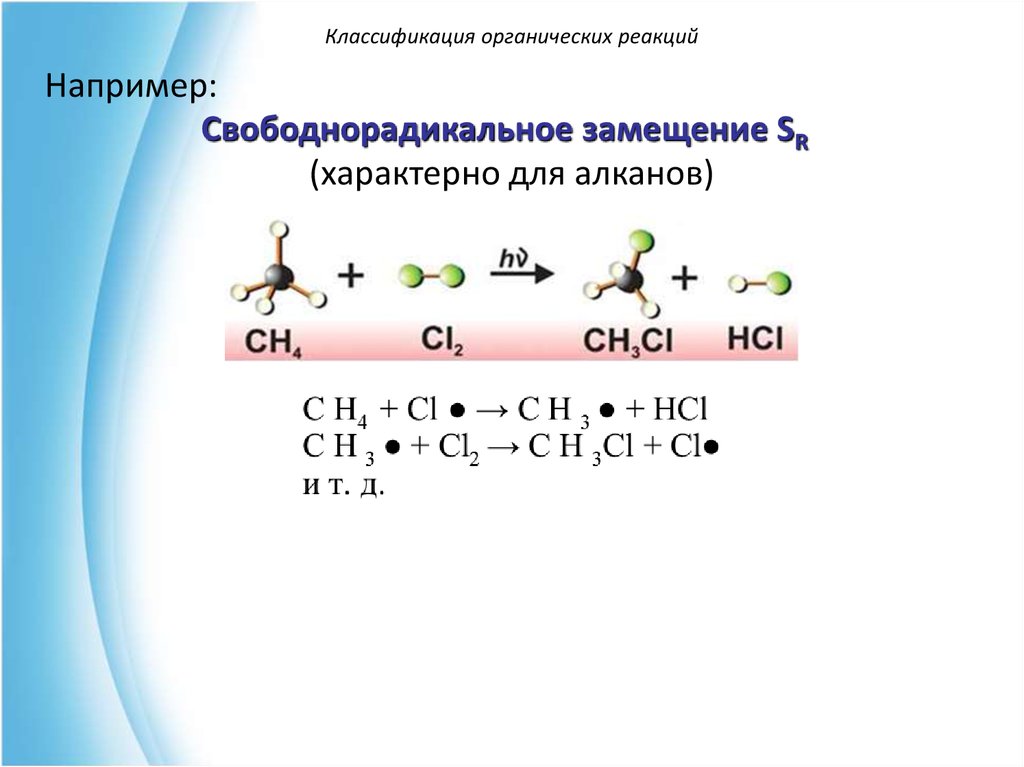
По типу действующего реагента реакции могут быть:
• Радикального замещения (SR)
• Электрофильного замещения (SE)
• Нуклеофильного замещения (SN)
50.
Классификация органических реакцийНапример:
Свободнорадикальное замещение SR
(характерно для алканов)
51.
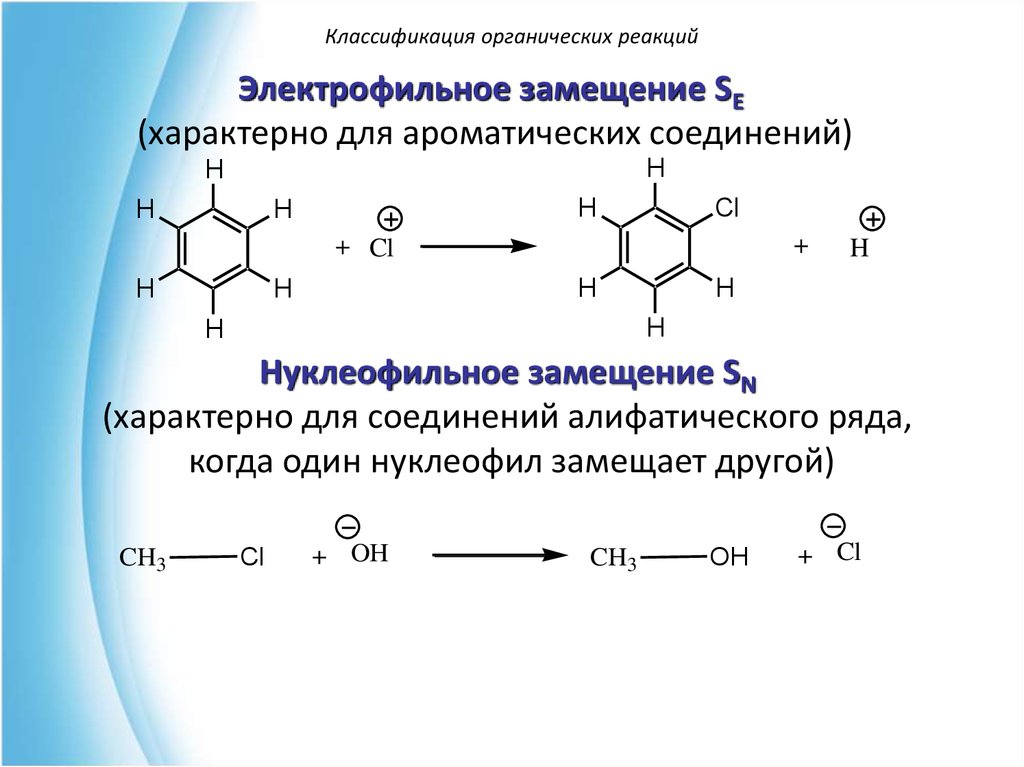
Классификация органических реакцийЭлектрофильное замещение SE
(характерно для ароматических соединений)
H
H
H
H
H
Cl
+
+ Cl
H
H
H
H
H
H
H
Нуклеофильное замещение SN
(характерно для соединений алифатического ряда,
когда один нуклеофил замещает другой)
CH3
Cl
+ OH
CH3
OH
+ Cl
52.
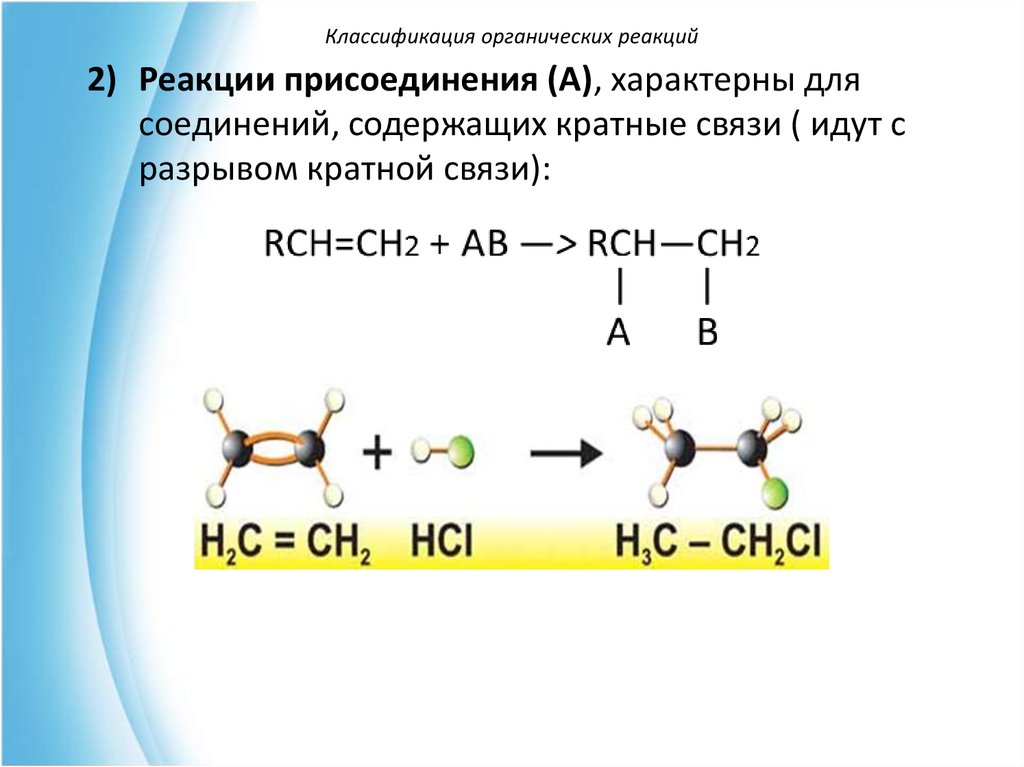
Классификация органических реакций2) Реакции присоединения (А), характерны для
соединений, содержащих кратные связи ( идут с
разрывом кратной связи):
53.
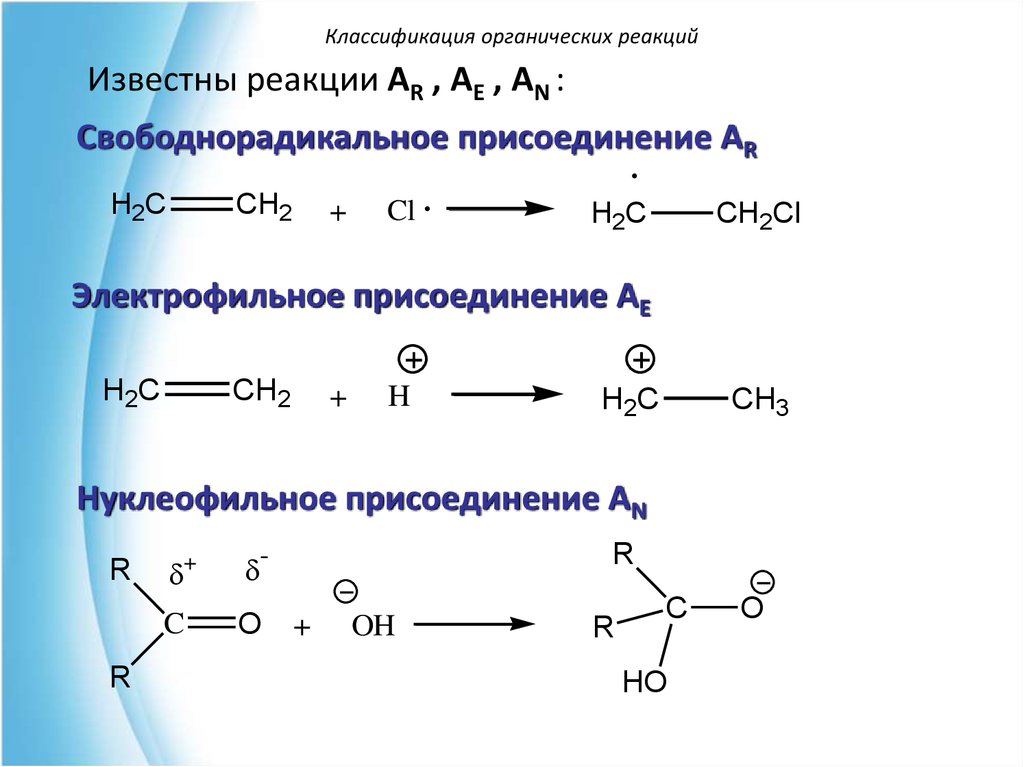
Классификация органических реакцийИзвестны реакции АR , АE , АN :
Свободнорадикальное присоединение AR
H2C
CH2
+
Cl
H2C
CH2Cl
Электрофильное присоединение AE
H2C
CH2
+
H
H2C
CH3
Нуклеофильное присоединение AN
R
R
R
-
C
O
+
+
OH
R
C
HO
O
54.
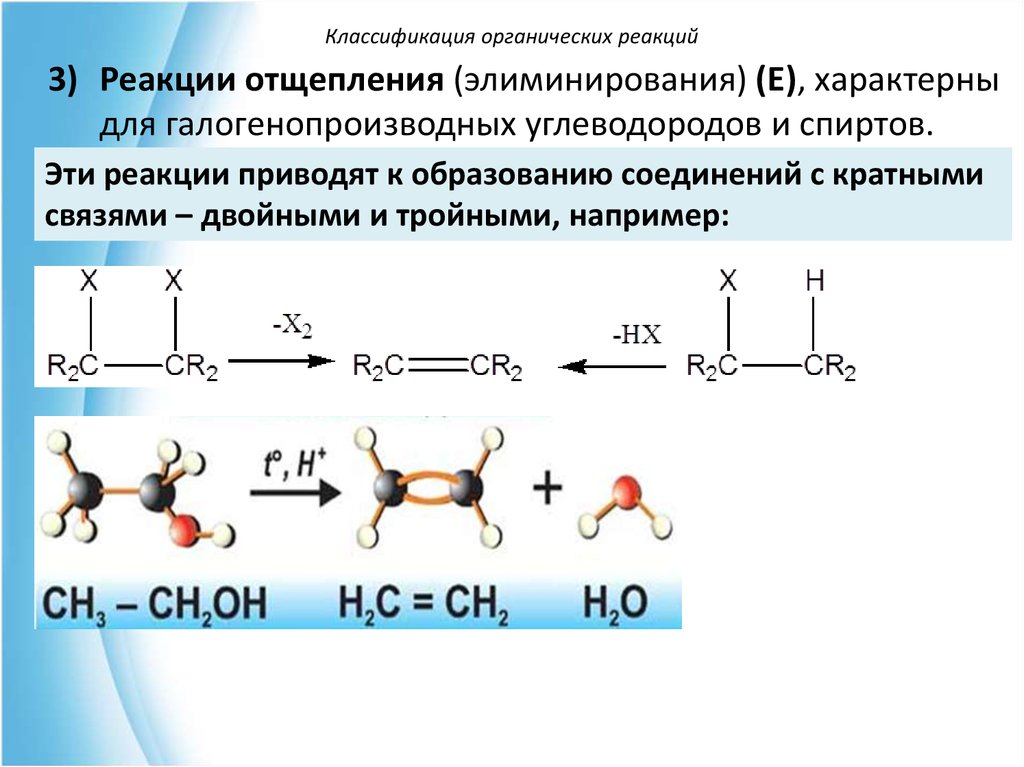
Классификация органических реакций3) Реакции отщепления (элиминирования) (Е), характерны
для галогенопроизводных углеводородов и спиртов.
Эти реакции приводят к образованию соединений с кратными
связями – двойными и тройными, например:
55.
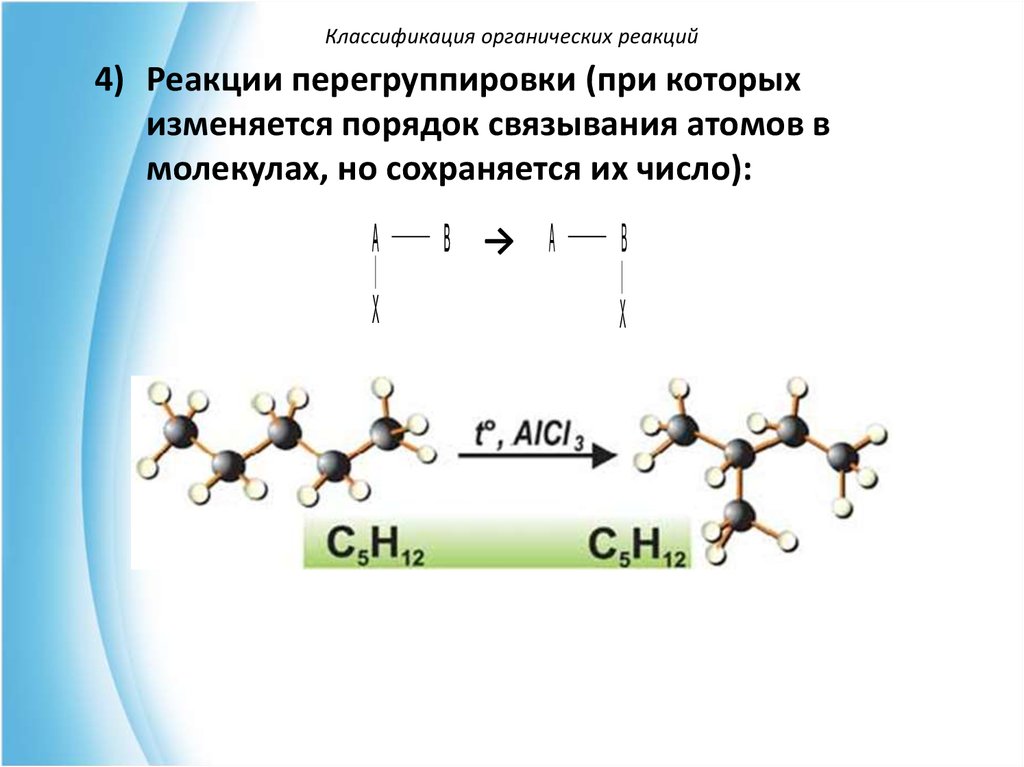
Классификация органических реакций4) Реакции перегруппировки (при которых
изменяется порядок связывания атомов в
молекулах, но сохраняется их число):
A
X
B → A
B
X
56.
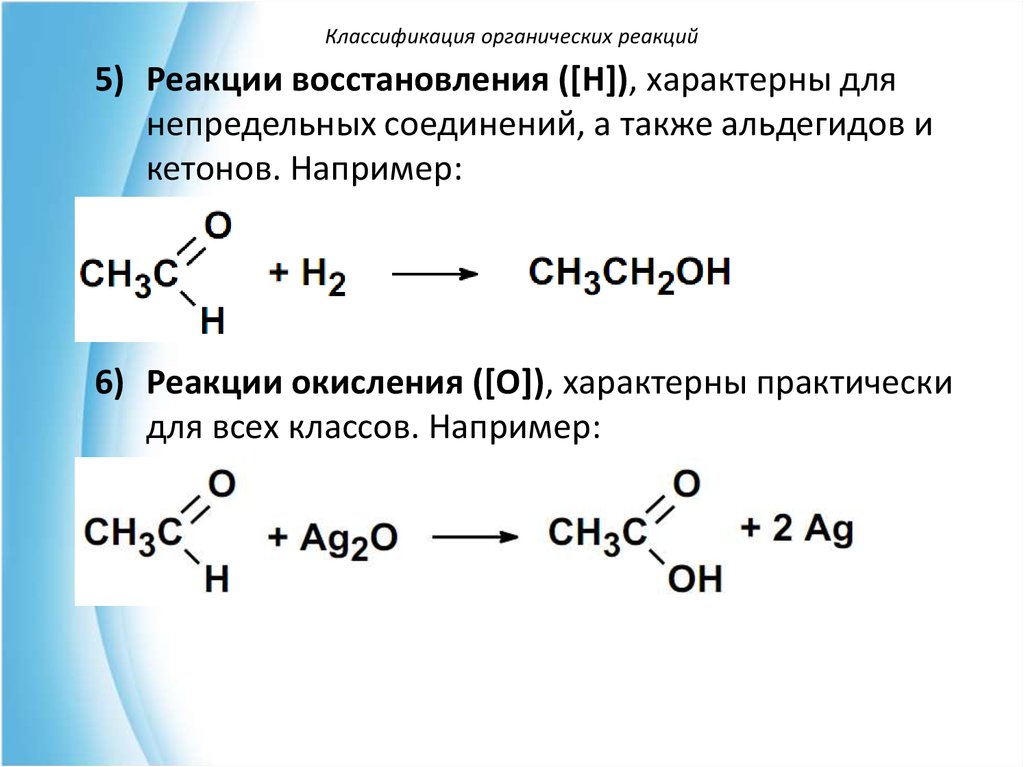
Классификация органических реакций5) Реакции восстановления ([Н]), характерны для
непредельных соединений, а также альдегидов и
кетонов. Например:
6) Реакции окисления ([O]), характерны практически
для всех классов. Например:
57.
Классификация органических реакцийIII. По числу молекул, принимающих участие в стадии,
определяющей скорость реакции различают:
1) Мономолекулярные реакции – участвуют молекулы
одного из реагирующих веществ.
Например, реакции:
• мономолекулярного замещения SN1
• мономолекулярного отщепления E1
2) Бимолекулярные – участвуют молекулы двух
реагирующих веществ.
Например: SN2, E2
58.
Классификация органических реакцийВ ходе химического превращения обычно затрагивается
не вся молекула, а только ее часть – реакционный центр.
Реакционный центр – атом или группа атомов,
непосредственно участвующая в данной химической
реакции. Различают нуклеофильные, электрофильные,
кислотные, основные центры.
59.
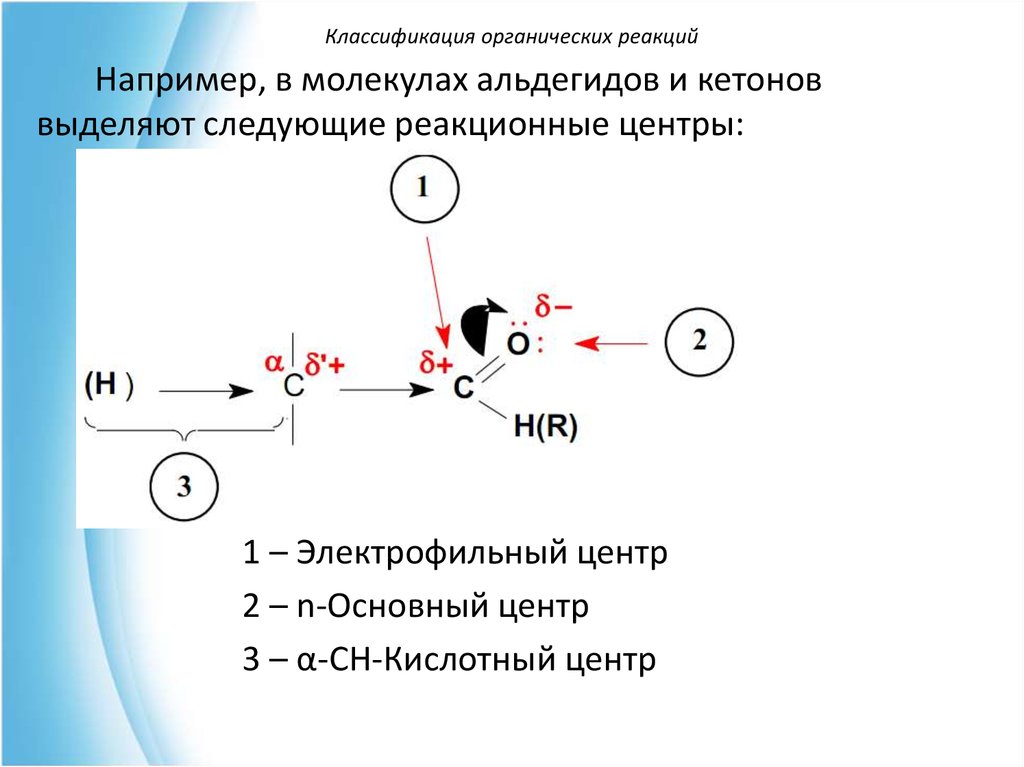
Классификация органических реакцийНапример, в молекулах альдегидов и кетонов
выделяют следующие реакционные центры:
1 – Электрофильный центр
2 – n-Основный центр
3 – α-СН-Кислотный центр






















 chemistry
chemistry








