Similar presentations:
Физико-химический процесс элелктролиз. (11 класс)
1.
ЭлектролизУрок Химии
11 класс
2.
«Все учение химии состоит в учении о свойствахэлементов - цель и задача - превратить один в
другой - это будет дальше.»
Дмитрий Менделеев.
3. Элелктролиз
• Это физико-химический процесс,протекающий в растворе или расплаве
электролита, при пропускании через
него электрического тока. Электролиз
является одним из важнейших
направлений в электрохимии.
4.
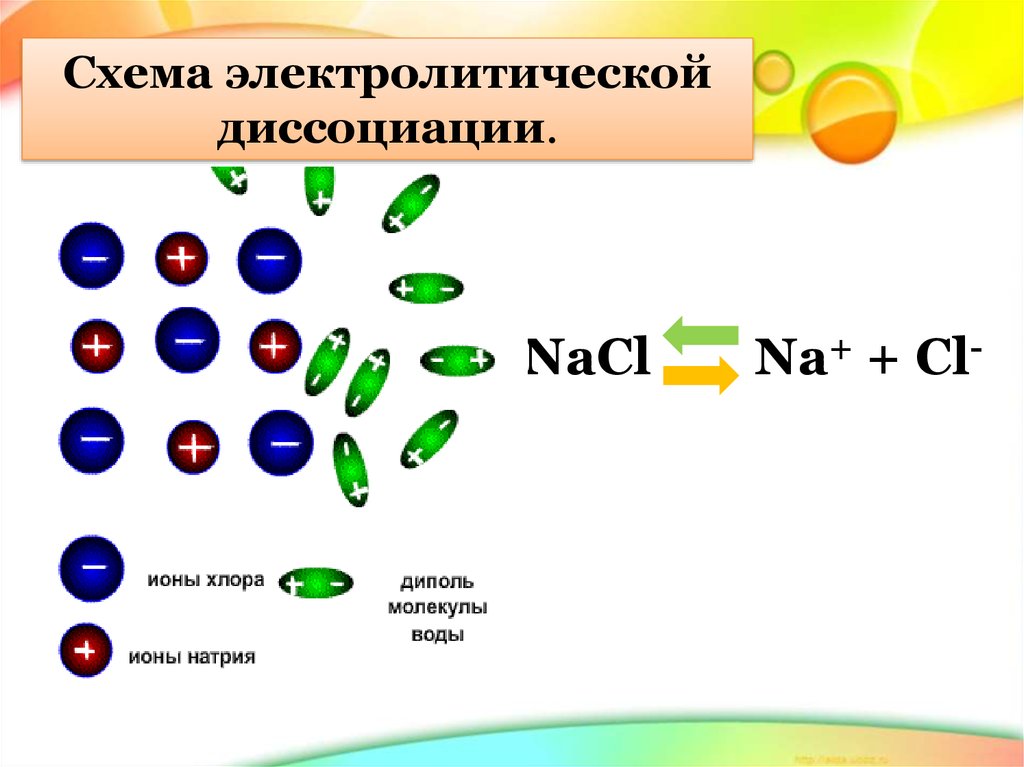
Схема электролитическойдиссоциации.
NaCl
Na+ + Cl-
5.
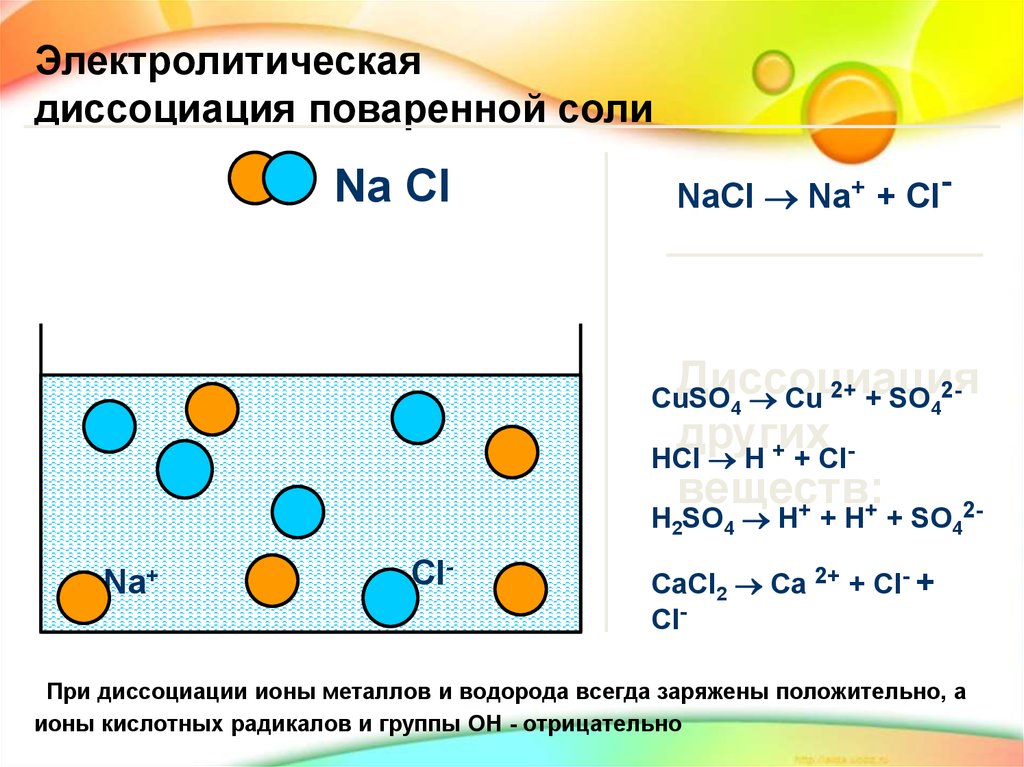
Электролитическаядиссоциация поваренной соли
Na Cl
NaCl Na+ + Cl-
Диссоциация
2+ + SO 2CuSO
Cu
4
4
других
HCl H + + Clвеществ:
+
+
H2SO4 H + H + SO42-
Na+
Cl-
CaCl2 Ca 2+ + Cl- +
Cl-
При диссоциации ионы металлов и водорода всегда заряжены положительно, а
ионы кислотных радикалов и группы ОН - отрицательно
6.
Положительные ионы (катионы)движутся к катоду, отрицательные
ионы (анионы) движутся к аноду
- (катод)
+ (анод)
-
+
+
-
+
-
+
Электролиз – это
процесс
выделения на
электродах
веществ,
связанный с
окислительно –
восстановительн
ыми реакциями.
7.
Электрохимический ряднапряжений металлов
Li→Rb→K→Ba→Sr→Ca→Na→
Mg→Al→Mn→Zn→Cr→Fe→Cd
→Co→Ni→Sn→Pb→H→Sb→Bi
→Cu→Hg→Ag→Pd→Pt→Au
8.
Исследовал электролиз и открыл его законыанглийский физик Майкл Фарадей в 1834 году
Первый закон электролиза
Масса вещества,
выделившегося на электродах
при электролизе, прямо
пропорциональна величине
заряда, прошедшего через
электролит
k – электрохимический эквивалент вещества
(равен массе вещества, выделившегося при
прохождении через электролит заряда 1 Кл)
Майкл Фарадей (1791 – 1867)
Открыл явление
электромагнитной индукции,
законы электролиза, ввел
представления об
электрическом и магнитном
поле
m kq
m k I t
9.
Второй закон электролизаПри одинаковом количестве электричества (электрическом
заряде, прошедшем через электролит) масса вещества,
выделившегося при электролизе, пропорциональна отношению
молярной массы вещества к валентности
M1 M 2
m1 : m2 k1 : k 2
:
z1 z 2
M – масса выделившегося вещества
k – электрохимический эквивалент
М – молярная масса вещества
z – валентность вещества
Заряд, необходимый для выделения 1 моля вещества,
одинаков для всех электролитов. Он называется
числом Фарадея F
4
F N A e 9.65 10 Кл / моль
Электрохимический
эквивалент и число Фарадея
связаны соотношением
M
k
zF
10.
Подведёмитоги
11.
ПРИМЕНЕНИЕЭЛЕКТРОЛИЗА
Получение химически
чистых веществ
Гальваностегия
Гальванопластика
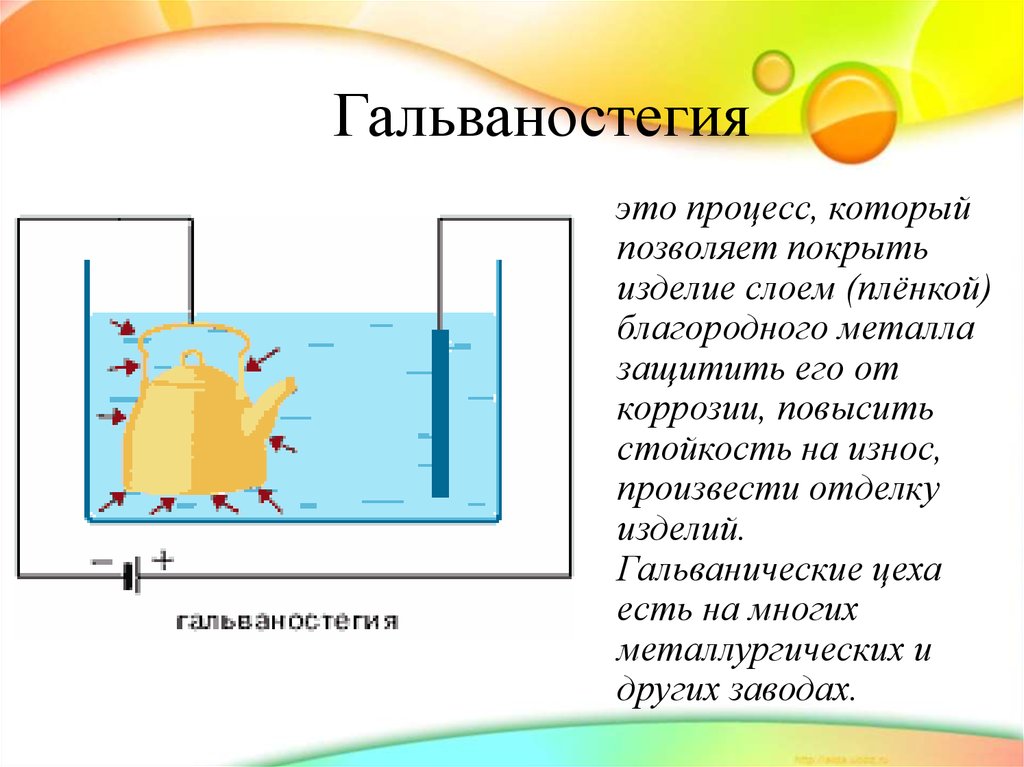
12. Гальваностегия
это процесс, которыйпозволяет покрыть
изделие слоем (плёнкой)
благородного металла
защитить его от
коррозии, повысить
стойкость на износ,
произвести отделку
изделий.
Гальванические цеха
есть на многих
металлургических и
других заводах.
13. Покрытие предметов слоем благородного металла
14.
15.
16. ГАЛЬВАНОПЛАСТИКА
это получение электролитическимспособом более толстых отложений (до
нескольких миллиметров).
Копия барельефа,
полученная методом
гальванопластики
17.
• Изготовление медалей, монет.18.
• Произведения искусства:Барельефы для:
Исаакиевского собора
19.
Петропавловского собора20.
Эрмитажа21.
Зимнего дворца22.
Большого театра23.
• Медные клише для типографии24.
• Пресс-формы из пластмассы, резины,металла























 chemistry
chemistry








