Similar presentations:
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепетеңдік
1.
LOGOСулы ерітінділер. Тірі ағза
сұйықтықтарындағы тепетеңдік
Дәріскер: доцент Э.К. Карлова
2. Дәріс жоспары
1. Су әмбебап еріткіш ретінде. Ағза тіршілігіндеерітінділердің маңызы
2. Ерітінділердің коллигативтік қасиеттері және
осмостық шиеленіс теориясы. Биологиялық
жүйелердегі осмос және осмостық қысымның рөлі
3. Протолиттік тепе-теңдік және қышқылдық-негіздік
гомеостазды бір қалпында ұстап тұру үшін
буферлік жүйелердің атқаратын рөлі
4. Биохимиялық тотығу-тотықсыздану процестерінің
ерекшеліктері. Тотықтырғыштар мен
тотықсыздандырғыштардың медициналық-санитарлық
тәжірибеде қолданылуы
3.
Судың рөлі–Ағзадағы барлық жасушалар мен ұлпалардың
құрамдас бөлігі
Роль Барлық
воды –
химиялық айналымдардың жүру ортасы
1. составная часть всех клеток и тканей организма.
Қореқтік
заттарвсемен
алмасу
өнімдерін
2. средой,
в которой протекают
химические
превращения.
3. Вода — источник минеральных солей, поступающих в организм.
тасымалдаушы
4. Транспортировка
элементов питания и продуктов обмена происходит по водным
магистралям.
Көптеген
реакцияларының
белсенді
5. Вода
— не только алмасу
индифферентный
растворитель, но и активный
участник
многих
реакций обмена [например, реакций гидролиза].
қатысушысы
6. Механическая роль — вода облегчает скольжение трущихся поверхностей
[суставов, связок, мышц и т.д.].
Терідеводы
судың
— ағза
жылулығын
7. Испарение
кожей булануы
— мощный фактор
терморегуляции
организма.
8. С водой
связаны осмотические
явления. зор факторы
реттеудің
ең
бір
орасан
9. Только в водной среде сохраняется коллоидное состояние протоплазмы.
Осмостық қысым сумен тығыз байланысты
Тек қана сулы ортада протоплазманың
коллоидты күйі сақталады
www.themegallery.com
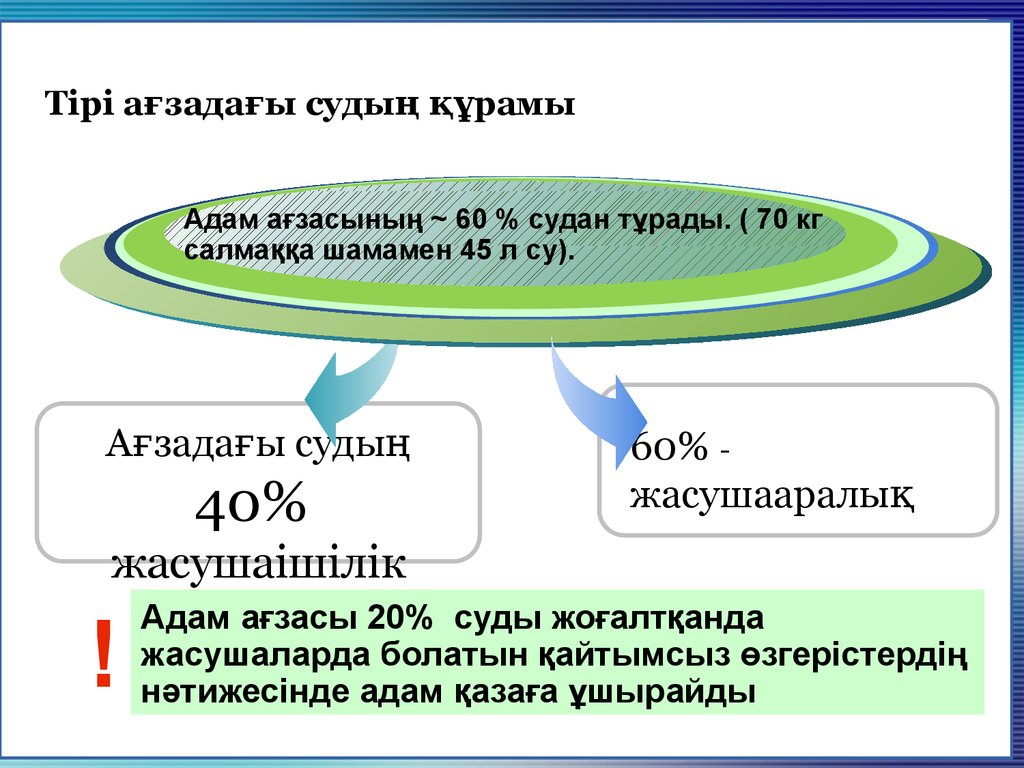
4. Тірі ағзадағы судың құрамы
Адам ағзасының ~ 60Title% судан тұрады. ( 70 кг
салмаққа шамаменAdd
45 your
л су).
text
Ағзадағы судың
40%
60% жасушааралық
жасушаішілік
!
Адам ағзасы 20% суды жоғалтқанда
жасушаларда болатын қайтымсыз өзгерістердің
нәтижесінде адам қазаға ұшырайды
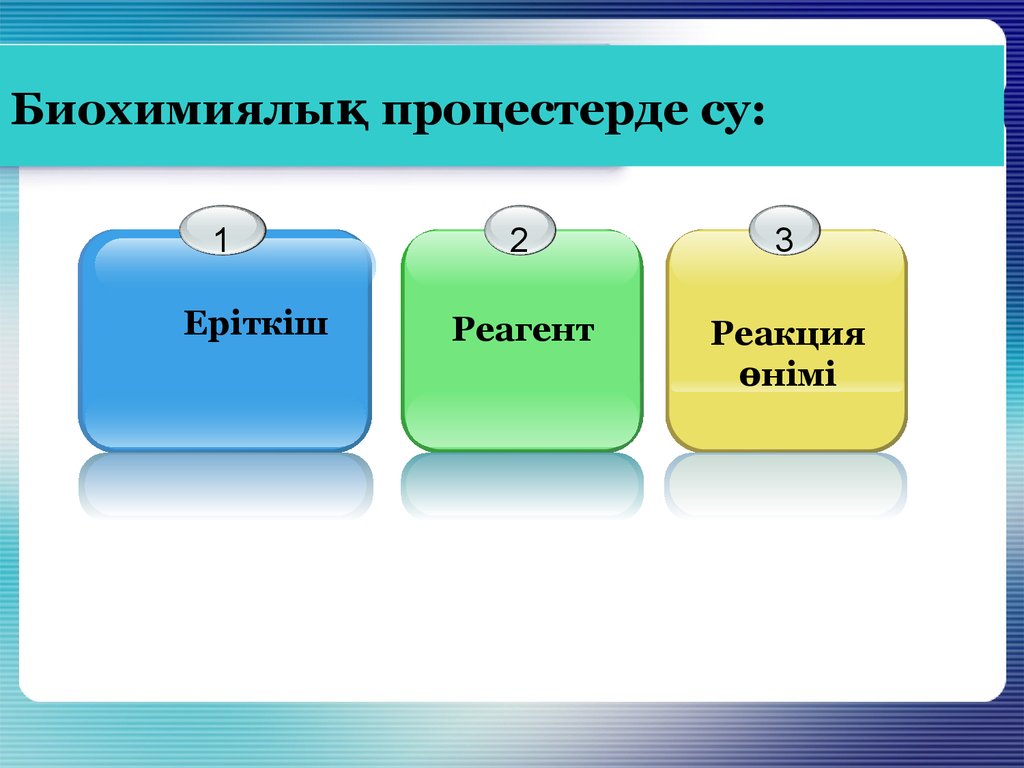
5. Биохимиялық процестерде су:
1Еріткіш
2
3
Реагент
Реакция
өнімі
6.
Ерітінді – екі немесе одан дакөп компоненттерден (жеке
заттардан) тұратын
гомогенді жүйе
www.themegallery.com
7. Ерітінділердің еріген заттың мөлшері бойынша жіктелуі
Қанықпаған ерітінді – концентрациясыканыққан ерітіндінің концентрациясынан
төмен болатын, берілген жағдайлар
өзгеріссіз болғанда еріген заттың
қосымша мөлшерін еріте алатын ерітінді
Қаныққан ерітінді –еритін зат тұнбасымен
динамикалық тепе-теңдік күйде болатын,
заттың еру жылдамдығы мен кристалдану
жылдамдығы тең болатын ерітінді
Аса қанық ерітінді - концентрациясы
каныққан ерітіндінің концентрациясынан
жоғары болатын, термодинамикалық
тұрақсыз ерітінді
8. Ерітінділердің электр тогын өткізу қабілетіне орай жіктелуі
Бейэлектролит ерітінділері –ерітіндісі өз бойынан электр тогын
өткізбейтін және еріген зат молекула
түрінде болатын заттар
Электролит ерітінділері –
ерітіндісі өз бойынан электр тогін
өткізетін, еру барысында молекулалары
оң және теріс зарядты иондарға
ыдырайтын заттар
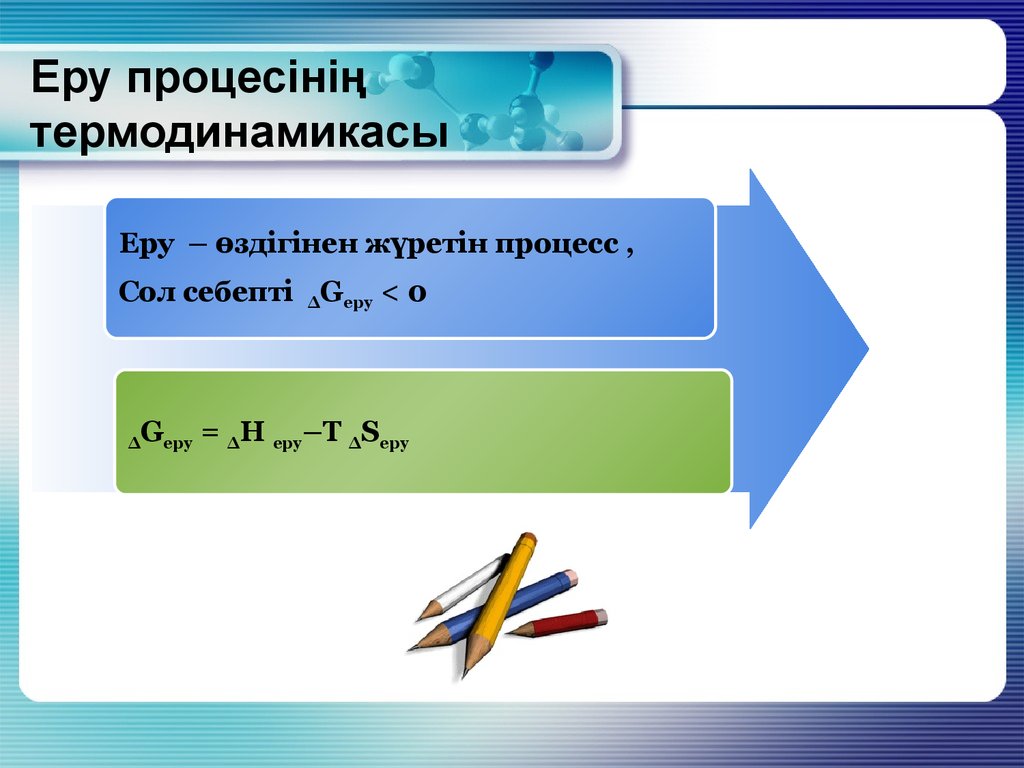
9. Еру процесінің термодинамикасы
Еру – өздігінен жүретін процесс ,Сол себепті ∆Gеру < 0
∆
Gеру = ∆Н еру–Т ∆Sеру
10.
Ерітінділердіңколлигативтік қасиеттері
- салыстырмалы сипаттамалары
еріген заттың табиғатына
тәуелсіз, тек бөлшектерінің
санына ғана тәуелді қасиеттері
11.
осмос және осмостық қысымЕрітінділердің
коллигативтік
қасиеттері
ерітіндінің бетіндегі еріткіштің
қаныққан бу қысымының таза
еріткіштің бетіндегі қаныққан
бу қысымына қарағанда
салыстырмалы төмендеуі
ерітіндінің қату температурасының
таза еріткіштің қату
температурасына қарағанда
салыстымалы төмендеуі
ерітіндінің қайнау
температурасының таза еріткіштің
қайнау температурасына қарағанда
салыстымалы жоғарылауы
12. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері
LOGOСұйылтылған бейэлектролит
ерітінділерінің коллигативтік
қасиеттері
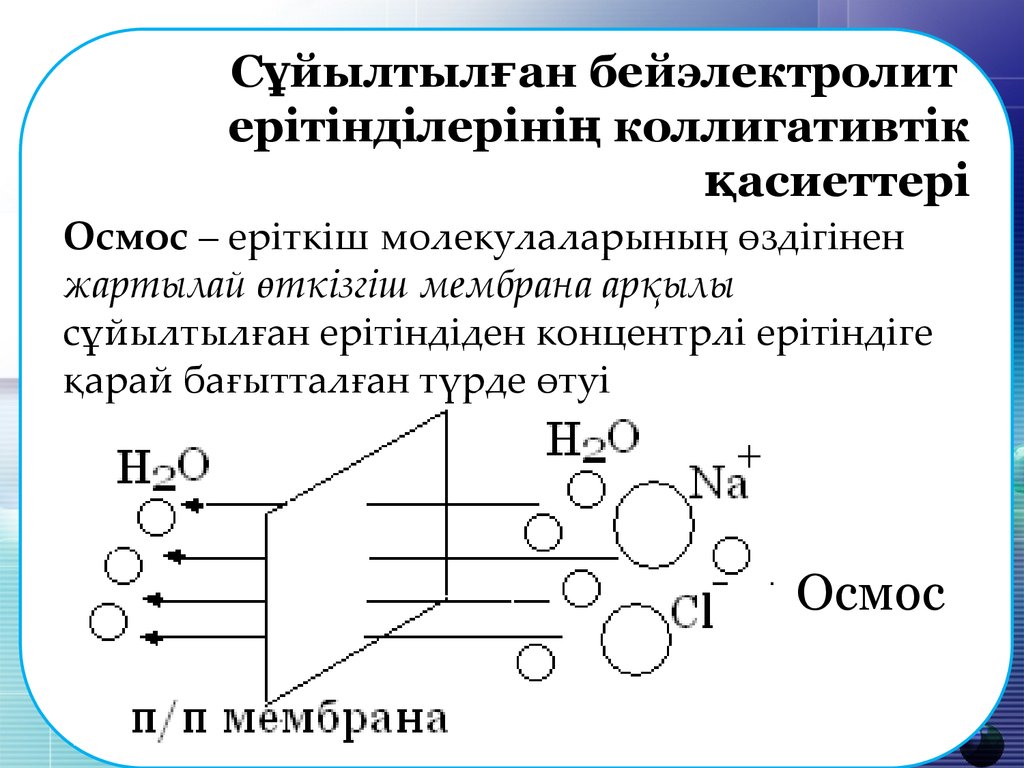
Осмос – еріткіш молекулаларының өздігінен
жартылай өткізгіш мембрана арқылы
сұйылтылған ерітіндіден концентрлі ерітіндіге
қарай бағытталған түрде өтуі
Осмос
13. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері
LOGOСұйылтылған
бейэлектролит ерітінділерінің
коллигативтік қасиеттері
Осмостық қысым ( ) – осмосты тоқтату үшін
ерітіндіге қажет қысым, яғни, осмос құбылысын
туғызатын күш
14.
Росм (адам қанының) = const және 370С-та740 – 780 кПа-ға немесе 7,4-7,8 атм –ға тең
Ағзадағы биологиялық сұйықтықтардығы
жоғары молекулалық компоненттердің
(мысалға ақуыз) осмостық қысымы
онкотикалық қысым (2,5 – 4 кПа) деп аталады
15.
Сұйылтылғанбейэлектролит ерітінділерінің
коллигативтік қасиеттері
p
( x)
p0
или
Тқату=К b(x)
Тқайнау=Е b(x)
p0 p
n
p0
n N
Тек қана бейэлектролит
ерітінділері үшін
16.
Изотондыкоэффициент – i
Изотонды коэффициент (i) - идеал емес
ерітінділердегі молекулааралық әрекеттесулерді
ескеру үшін енгізілген эмпирикалық коэффициент
Ni
i
N0
мұндағы N - ерітіндідегі еріген зат бөлшектерінің
i
(молекулалардың, иондардың,
қауымдасқан бөлшектердің) саны
N0 - ерітінді көлеміндегі еріген зат
молекулаларының бастапқы саны
17.
Изотондыкоэффициент – i
(i) концентрациялары бірдей
= i С R T
Тқайнау= i Е b(x)
Тқату= i К b(x)
Электролит
ерітінділері
үшін
болғанда электролиттердің
осмостық қысымы
бейэлектролиттердің осмостық
қысымынан қаншалықты үлкен
екендігін көрсететін
коэффициент
i = α (n – 1) +1,
мұндағы α – электролиттің
диссоциациялану дәрежесі
n – электролиттің бір
молекуласының
ыдырауынан туындайтын
иондар саны
18. Ортаның изотондылығы бұзылған жағдайда эритроциттер
Н2ОРосм ер-ді > Росм қан,
гипертонды ерітінді
Жасушаның
жиырылуы - плазмолиз
Н2О
Росм ер-ді < Росм қан,
гипотонды ерітінді
Протоплазманың
жарылуы, жасушаларда
лизис - гемолиз
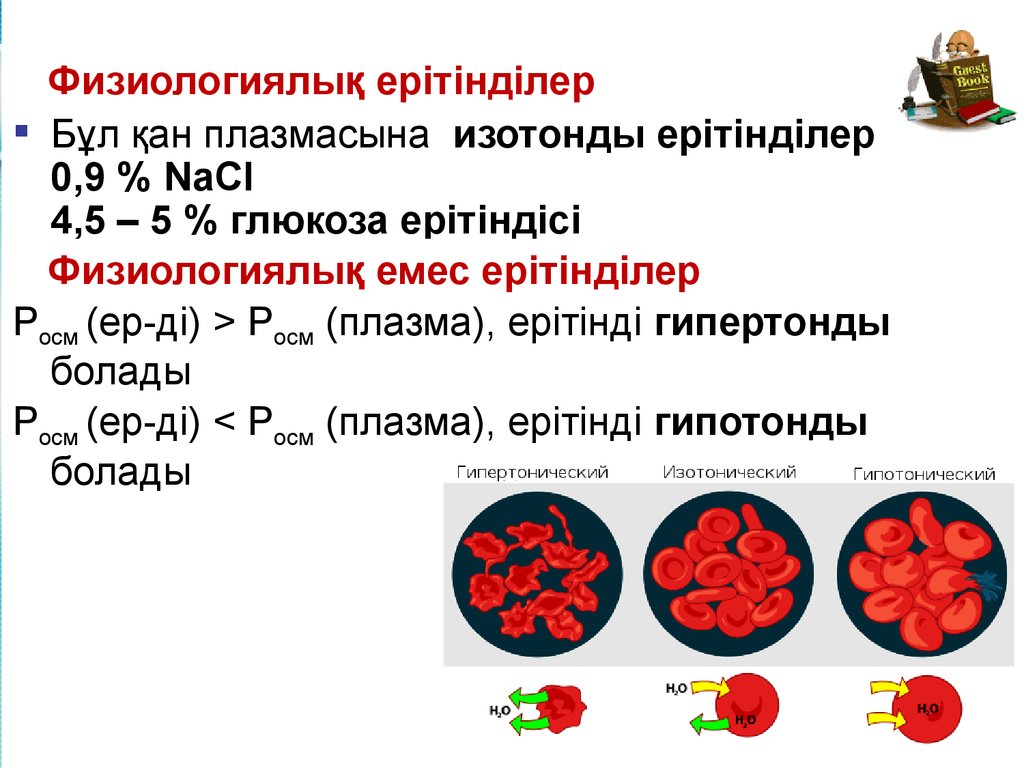
19.
Физиологиялық ерітінділерБұл қан плазмасына изотонды ерітінділер
0,9 % NaCl
4,5 – 5 % глюкоза ерітіндісі
Физиологиялық емес ерітінділер
Росм (ер-ді) > Росм (плазма), ерітінді гипертонды
болады
Росм (ер-ді) < Росм (плазма), ерітінді гипотонды
болады
www.themegallery.com
20.
Сутектік көрсеткіш рН –сутек иондарының концентрациясының
теріс таңбамен алынған ондық логарифміне
тең болатын, ортаның қышқылдығының
сандық сипаттамасы:
рН = - lg СН+ немесе рН = -lg [Н+]
рН
11 22 33 44 55 66
қышқыл
77
88 99 10
10 11
11 12
12 13
13 14
14
бейтарап
сілтілік
21.
Маңызды биологиялықсұйықтықтардың рН-ң мәні
Суретте ағзаның кейбір сұйықтықтары мен мүшелерінің
қалыпты жағдайдағы қышқылдық-негіздік күйі (рН) келтірілген
22.
Защитные мех-мы поддержанияпострН-ң
оянства
рН:
рН-ң
тұрақтылығын
бір қалпында ұстап
тұратын қорғаушы механизмдер:
физиологиялық – бұл тыныс алу және зәр
шығару, метаболизм процестері
физикалық-химиялық ағзаның буферлік
жүйелерінің көмегімен қышқылдықнегіздік тепе-теңдікті реттеп тұратын
механизмдер
23. БУФЕРЛІК ЖҮЙЕЛЕР
LOGOБУФЕРЛІК ЖҮЙЕЛЕР
Буферлік жүйелер – сырттан әсер
болғанда өзінің қандай да бір параметрінің
шамасын өзгертпей, тұрақты қалпында
сақтайтын жүйелер
24. Қанның буферлік жүйелері
LOGOАтауы
Гидрокарбонатты
Қанның буферлік жүйелері
Құрамы
Н2СО3; НСО3-
Буферлік әсерді
сипаттайтын тепе-теңдік
НСО3 Н Н 2 СО3
Н 2СО3 ОН НСО3 Н 2О
СО 2 Н 2 О Н 2 СО3
Фосфатты
Н2РО4-; НРО42-
СО 2 Н 2 О Н 2 СО3
Н 2 РО 4 ОН НРО24 Н 2 О
Гемоглобинді
(окси
гемоглобинді)
ННb; Нb(ННbО2; НbО2-)
Hb H HHb
HHb OH Hb- H 2O
HbO-2 H HHbO2
HHbO2 OH HbO 2 H 2 O
ақуызды
PtCOОH;
PtСOONa
HHb O 2 HHbO2
PtCOO- H PtCOOH
PtCOOH OH PtCOO- H 2O
25.
Буферлік ерітінділердің әсер ету механизміНА Н+ + А–
а/ А– + Н+ НА [күшті қышқыл қосқанда]
б/ НА + ОН– Н2О + А– [сілті қосқанда]
26.
Буферлік сиымдылық,
Ерітіндінің буферлік сиымдылығы (В) - бір литр
мұндағы Сa– күшті қышқыл эквивалентінің молярлық концентрациясы,
буферлік ерітіндінің рН-ң мәнін бір бірлікке өзгерту үшін
моль/л;
қосылатын
күшті
қышқылдың
немесе
күшті негіздің молVa– қосылған
күшті
қышқыл көлемі,
мл;
Vб – буферліксандық
ерітіндініңмәніне
көлемі, мл;
эквивалентінің
тең болатын шама
ΔрН Буферлік
– күшті қышқыл
қосқан кездегі буферлік
ерітіндінің
сутектің көрсеткішінің
сиымдылықты
қышқыл
бойынша
анықтау
өзгерісі. мұндағы Сa– күшті қышқыл эквивалентінің молярлық
(Ва)
концентрациясы, С
моль/л;
a Va
Ва
Vб ΔpH
мұндағы Сa– күшті қышқыл эквивалентінің молярлық концентрациясы,
моль/л;
Va– қосылған күшті қышқыл көлемі, мл;
Vб – буферлік ерітіндінің көлемі, мл;
ΔрН – күшті қышқыл қосқан кездегі буферлік ерітіндінің
сутектің
көрсеткішінің
өзгерісі.
Буферлік
сиымдылықты
негіз бойынша анықтау
(Вb)
С b Vb
Вb
Vб ΔpH
27.
Механизм действия гидрокарбонатнойбуферной
Қанның сілтілік
резервісистемы
Действие гидрокарбонатного буфера при попадании в него
сильной
кислоты
или щелочи можно
записать
реакциями:
100
мл қан
плазмасындағы
химиялық
байланысқан
(гидрокарбонат түріндегі) көміртегі диоксидінің
H 2O
СО2 миллилитрмен
көлемі
болып
HCl + NaHCO3 алынған
NaCl + H
2CO3
CO2
табылады;
NaOH + H2состояние
CO3
NaHCO
Кислотно-основное
организма
3 + иHего
2O нарушенияКислотноосновное
состояние
организма и его нарушения
көлемдік
% өлшенеді;
При добавлении к системе сильной кислоты ионы Н+
қалыпты жағдайда
50-70
% (25-30 ммоль/л)
взаимодействуют
с анионами
соли,көлемдік
образуя слабодиссоциирующую
Н2СО
құрайды
3. Сильная кислота заменяется эквивалентным количеством
слабой кислоты, диссоциация которой подавлена.
При добавлении щелочи гидроксил-ионы (ОН-) взаимодействуют с
ионами Н+ угольной кислоты.Щелочь заменяется эквивалентным
количеством соли, почти не изменяющей величину рН раствора.
28.
Механизм действия гидрокарбонатнойбуферной
системы
Ацидоз – физиологиялық
жүйенің
қышқылдық-сілтілік
тепе-теңдігінің сутек иондарының
Действие гидрокарбонатного буфера при попадании в него
концентрацияларының
өсуіне
(рН-тың
кемуіне)
және
сильной кислоты или щелочи
можно
записать
реакциями:
сілтілік резервінің кемуіне қарай ығысуы
H 2O
HCl + NaHCO3
NaCl + H2CO3
CO2
Алкалоз – физиологиялық
жүйенің қышқылдық-сілтілік
тепе-теңдігінің
иондарының
NaOH + Hсутек
NaHCO3 + H2O
2CO3
Ағза
тіршілігі үшін қанның рН-ңкемуіне
өзгеру шегі
концентрацияларының
(рН-тың өсуіне) және
При резервінің
добавлении картуына
системе қарай
сильнойығысуы
кислоты ионы Н+
сілтілік
взаимодействуют с анионами соли, образуя слабодиссоциирующую
Н2СО3. Сильная кислота заменяется эквивалентным количеством
Ағза
тіршілігі
үшінподавлена.
қанның рН-ң
слабой кислоты,
диссоциация
которой
При добавлении щелочи гидроксил-ионы
(ОН-) взаимодействуют с
өзгеру
шегі
ионами Н+ угольной кислоты.Щелочь заменяется эквивалентным
количеством соли, почти не изменяющей величину рН раствора.
29.
30.
• Тотығу-тотықсыздану электроды –редокс жүйемен үйлескен инертті
металл, бұл электродта пайда болатын
потенциал редокс потенциал деп
аталады. Инертті металл
тотықсызданған түрден (Red) тотыққан
түрге (Ox) электрондардың
тасымалдану кезінде делдалдық қызмет
атқарады
31.
Ұлпалар мен мүшелердегі редоксжүйелер:
1. Пирожүзім қышқылы/сүт қышқылы,
2. гем/гематин,
3. цитохромдар,
4. Аскорбин қышқылы/дегидроаскорбин
қышқылы,
5. цистин-цистеин,
6. Алма қышқылы/қымыздықсірке қышқылы
[ҚСҚ] және басқалар
32.
Тыныс алу тізбегі–органикалық субстраттардан
оттекке (митохондрияда)
электрон тасымалдау арқылы
жүретін тотығу-тотықсыздану
реакцияларының жүйелілігі
33.
Ағзадағы тотығу-тотықсыздану процестердіңсипаттамасы:
биологиялық тотығу – ағзаның тіршілігіне керекті
энергия АТФ-ң макроэргиялық байланыстарында
нәтижесінде бөлініп, от алады;
тотығатын субстраттан оттекке қарай
электрондардың және протондардың
тасымалдануы әрқайсысы белгілі бір редокспотенциал мәнімен сипатталатын редоксжүйелердің тізбегі бойынша жүзеге асырылады;
тізбектегі редокс-жүйелердің қатаң реттілігі
потенциалдар арасында үлкен айырмашылықты
болдырмау нәтижесінде тотығу энергиясы үнемі
бөлініп отырады .
34.
Тотықтырғыштар мен тотықсыздандырғыштардыңмедициналық-санитарлық тәжірибеде қолданылуы
Хлор, озон (суды озондау), сутегі асқын тотығы, йод
ерітіндісі тәрізді көптеген тотықтырғыштар
микроорганизмдерді жою үшін бактериялық құрал
ретінде қолданылады;
Тотықтырғыштармен уланғанда (мысалы броммен),
аммиакты, яғни, тотықсыздандырғышты қолданады;
Тотықсыздандырғыштармен уланғанда (мысалы
күкіртсутекпен) хлорлы әктің дымқыл буын
қолданады;
Фосфор ағзаға енгенде асқазанда калий
перманганатымен немесе мыс сульфатымен жуады;
Тотығу-тотықсыздану реакциялары диагностика үшін
де қолданылады. Алкоголь ішкен-ішпегендігін білу үшін
этил спиртін тотықтыратын хром (VI) оксидін
пайдаланады.
35.
LOGOНазар аударып
ғандарыңызға рахмет!






























 biology
biology








