Similar presentations:
Получение ЛС неорганической природы
1.
Получение ЛСнеорганической природы
2. Препараты соединений магния
s-элементы, II группаПРЕПАРАТЫ СОЕДИНЕНИЙ МАГНИЯ
Магнезит MgCO3, доломит MgCa(CO3)2, кизерит MgSO4·H2O,
эпсомит MgSO4·7H2O, тальк 3MgO·4SiO2 ·H2O
МАГНИЯ ОКСИД MgO
MgCl2 + 2Са(OH)2 → СаCl2 + 2 Mg (OH)2
500◦C
Mg(OH)2 → MgO + H2O
Mg(OH)2+ 2CO2 → Mg(НCO3)2
45-50◦C
4Mg(НCO3)2 → 3MgCO3·Mg(OH)2·3H2O + 5CO2
70-80◦C
4MgSO4+ 4Na2CO3+4H2O → 3MgCO3·Mg(OH)2·3H2O
Magnesium oxydatum
мелкий легкий пушистый
порошок
белого цвета. М.р. в воде, спирте.
Р. в соляной, серной и уксусной
кислотах.
+ 4 Na2SO4+ CO2
300◦C
5MgCO3·2Mg(OH)2·7H2O → 7MgO + 5CO2 + 9H2O
900◦C
3MgCO3·Mg(OH)2·3H2O → 4MgO + 3CO2 + 4H2O
MgCl2 + H2O → MgO + 2 HCl
МАГНИЯ СУЛЬФАТ MgSO4
MgCO3+ H2SO4 → MgSO4 + CO2 + H2O
Magnesium sulfas
Бесцветные
призматические
кристаллы,
выветривающиеся на
воздухе. Л.р.в воде, м.р.в
спирте.
3. Препараты соединений кальция
ПРЕПАРАТЫ СОЕДИНЕНИЙ КАЛЬЦИЯКальцит (мнл, известняк, мрамор) СаCO3, ангидрит СаSO4,
гипс СаSO4·2H2O, доломит MgCa(CO3)2 ,фосфорит Са3(PO4 )2
апатит Са5F(PO4 )3, плавиковый шпат CaF2
КАЛЬЦИЯ ХЛОРИД СаCl2·6H2O.
СаCO3 + 2HCl → CaCl2+ CO2 + H2O
2 FeCl3 + 3Са(OH)2 → 3СаCl2 + 2 Fe(OH)3
MgCl2+ Са(OH)2 → СаCl2 + Mg(OH)2
Calcii chloridum
Бесцветные кристаллы
без запаха, горькосоленого вкуса, очень
гигроскопичные,
расплываются на
воздухе, переходя при
34°С в дигидрат.
ПРЕПАРАТЫ СОЕДИНЕНИЙ БАРИЯ
Барит (тяжелый шпат) ВаSO4 и Витерит ВаCO3
БАРИЯ СУЛЬФАТ ВаSO4
прокаливание
ВаSO4 + 4С → BaS + 4CO
Barii sulfas
Белый рыхлый
BaS +2HCl → BaCl2 + H2S
тонкий порошок, без
вкуса и запаха. ВаCO3+2HCl → BaCl2 + H2О+ CO2
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Исходные растворы должны
быть подогретыми и
разбавленными.
Реакция проводится
медленно. Раствор хлорида
бария вливается в раствор
сульфата натрия.
рН - нейтральная
4. Препараты йода
р-элементы, VII группаПРЕПАРАТЫ ЙОДА
Природные материалы йода – лаутарит Ca(IO3)2 и йодаргирит AgI,
чилийская селитра (содержит NaIO3), морские водоросли
2NaI + 2NaNO2 + 2H2SO4 → I2 + 2NO + 2H2O + 2Na2SO4
I2 +6 NaOH → 5NaI + NaIO3 + 3 H2O
I2 + Na2SO3+H2O → 2HI + Na2SO4
5NaI +Сl2 → I2 +2NaCl
Iodum
Кристаллическое
вещество серочерного цвета с
фиолетовым
металлическим
блеском.
Очистка буровых вод от примеси
нефти и нафтеновых кислот,
отстаивания от химических
примесей, окисление йодид-ионов
до свободного йода нитритом
натрия в присутствии серной
кислоты.
Йодоформ
Йодинол
Йодопирон
5.
КИСЛОТА ХЛОРИСТОВОДОРОДНАЯ HClNaCl↔Na+ + Cl─
Катод:
2Na+ + 2e → 2Na
2Na + 2H2O → 2NaOH + H2
Анод:
2Cl─ - 2e → 2Cl
Acidum hydrochloricum
Прозрачная , бесцветная
летучая жидкость со
своеобразным запахом.
2Cl→Cl2
Суммарно:
NaCl + 2H2O → Cl2 + 2NaOH + H2
ИЗВЕСТЬ ХЛОРНАЯ
Calcaria chlorata
Белый или слегка
сероватый порошок с
запахом хлора.
Реакцию проводят в особых полочных камерах при постоянном перемешивании, пропуская
противотоком
через тонкоизмельченный гидроксид кальция («пушонку») разбавленный
воздухом газообразный хлор (30-60%) хлора. Насыщение хлором ведут до получения извести
хлорной с содержанием активного хлора не менее 32%. Изб гидрокисда кальция делает ее боле
устойчивой. Сушат ее при t 150-200◦С или под вакуумом 60-70◦С
6. Препараты галогенидов
ПРЕПАРАТЫ ГАЛОГЕНИДОВНАТРИЯ ХЛОРИД – это единственный галогенид, который широко распространен в природе виде
каменной соли. Его получают из воды озер и морей выпариванием. Однако при этом остаются
примеси. Очистку от них производят последовательно. Вначале раствором хлорида бария осаждают
сульфаты и фосфаты:
Источники получения КАЛИЯ ХЛОРИДА –
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Na2HPO4 + BaCl2 → BaHPO4 + 2NaCl
минералы
сильвинит
(KCl·NaCl)
KCl·MgCl2·6H2O карналлит.
MgCl2 + Na2CO3→ MgCO3 + 2NaCl
CaCl2 + Na2CO3→ CaCO3 + 2NaCl
BaCl2 + Na2CO3→ BaCO3 + 2NaCl
Na2CO3+HCl → CO2 +2NaCl+ H2O
Natrii chloridum
Белые кристаллы
или порошок без
запаха, соленого
вкуса.
3Fe + 4Br2 → Fe3Br8 (FeBr2 ·2FeBr3)
Fe3Br8 + 4Na2CO3 + 4H2O → 8NaBr + 2Fe(OH)3 ↓+ 2Fe(OH)2 ↓+ 4CO2↑
3Fe + 4I2 → Fe3I8
Fe3I8 + 4Na2CO3 + 4H2O → 8NaI + 2Fe(OH)3 ↓+ 2Fe(OH)2 ↓+ 4CO2↑
Na2CO3 +2HCOONa + 2Br2 → 4NaBr + 2 CO2 + H2O
Kalii chloridum
Бесцветные
кристаллы или
белый
кристаллический
порошок без запаха,
соленого вкуса.
Natrii bromidi
Белые
кристаллический
порошок без запаха,
соленого вкуса.
Гигроскопичен.
Kalii bromidi
Бесцветные
кристаллы или
белый
кристаллический
порошок без запаха,
соленого вкуса.
7.
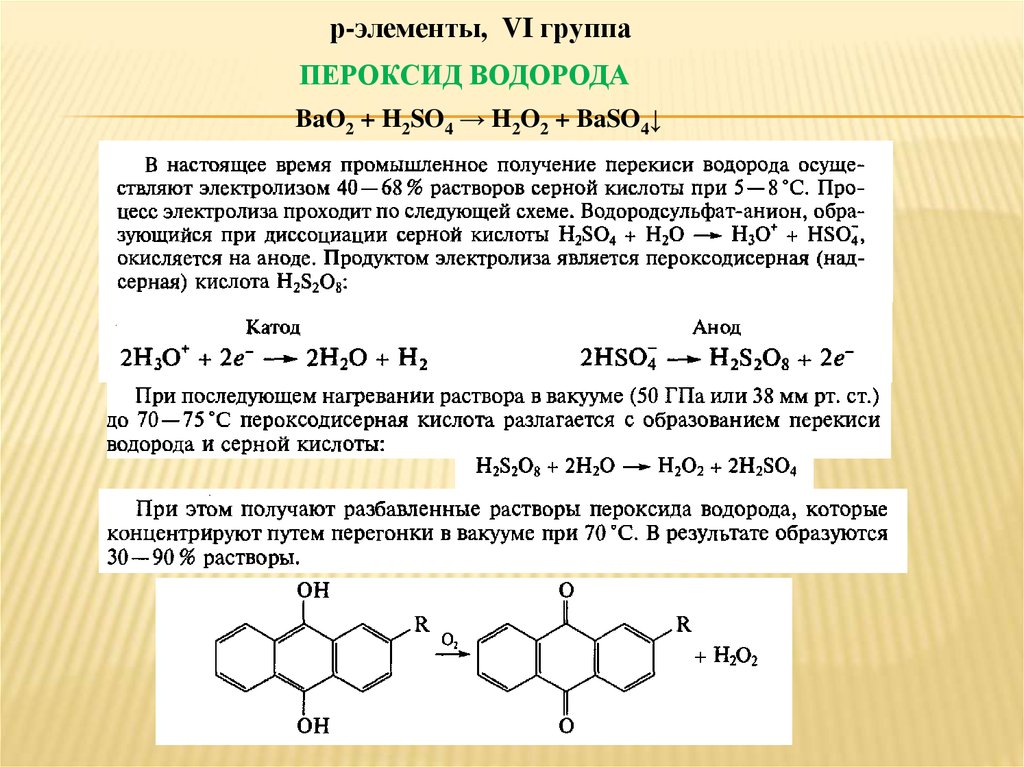
р-элементы, VI группаПЕРОКСИД ВОДОРОДА
BaO2 + H2SO4 → H2O2 + BaSO4↓
8.
ПЕРЕКИСЬ МАГНИЯ MgO2 ·MgOГИДРОПЕРИТ
7-8◦C
MgO + H2O2 → MgO2 + H2O
СO(NH2)2 + H2O2 → СO(NH2)2 · H2O2
500◦C
2MgO + O2 → 2MgO2
НАТРИЯ ТИОСУЛЬФАТ
Впервые был получен в 1799 г кипячением смеси раствора
сульфита натрия с серой:
Na2SO3 + S → Na2S2O3
2Na2S + 3SO2 → 2Na2S2O3 + S↓
2CaS2 + 3O2→ 2CaS2O3
CaS2O3 + Na2SO4→Na2S2O3 + CaSO4
9.
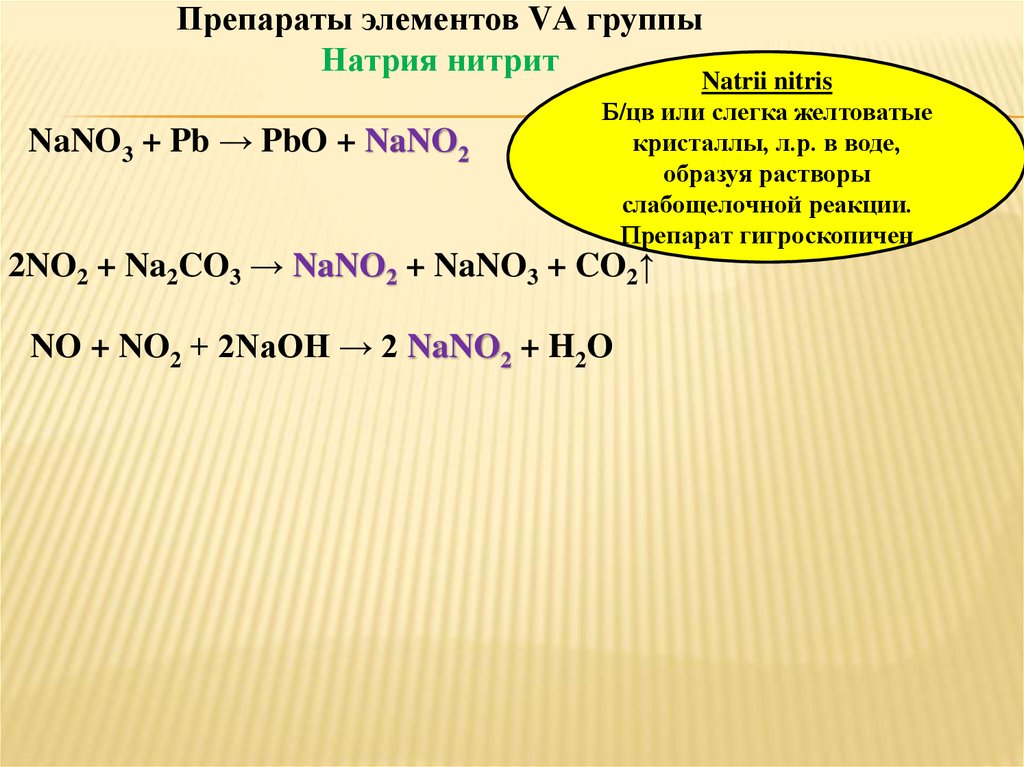
Препараты элементов VА группыНатрия нитрит
NaNO3 + Pb → PbO + NaNO2
Natrii nitris
Б/цв или слегка желтоватые
кристаллы, л.р. в воде,
образуя растворы
слабощелочной реакции.
Препарат гигроскопичен
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑
NO + NO2 + 2NaOH → 2 NaNO2 + H2O
10. Препараты соединений висмута висмута нитрат основной
ПРЕПАРАТЫ СОЕДИНЕНИЙ ВИСМУТАВИСМУТА НИТРАТ ОСНОВНОЙ
Bismuthi subnitras – белый аморфный
или мелкокристаллический порошок
белого цвета. Пр. нер. в воде и спирте.
Л.р. в минеральных кислотах.
О=Bi─O─Bi
OH
NO3
4BiOCl + 2Na2CO3 + 3C → 4Bi + 4NaCl + 5CO2↑
Bi + 4HNO3 → 4Bi(NO3)3 +NO↑ + 2 H2O
4Bi(NO3)3 ·5H2O
2Bi(NO3)3+ 3H2O → 5HNO3 + О=Bi─O─Bi
BiONO3
Bi(OH)2(NO3)↓
OH
NO3
11. Активированный уголь
р-элементы, IV группаАКТИВИРОВАННЫЙ УГОЛЬ
Carbo activatus - легкий черный порошок
высокой степени дисперсности, без запаха и
вкуса. Пр. нер. в воде и других
растворителях. Не изменяется при
нагревании без доступа воздуха.
НИТРИЯ ГИДРОКАРБОНАТ
Na2CO3·10H2O + CO2 → 2NaHCO3 + 9 H2O
Natrii hydrocarbonas белый
кристаллический
порошок без запаха,
солено-щелочного
вкуса.
NH3+ H2O + CO2→ NH4HCO3
NH4HCO3 + NaCl → NH4Cl + NaHCO3
12.
р-элементы, III группаПрепараты соединений БОРА
Бура или тинкал Na2B4O7·10H2O, кернит Na2B4O7·4H2O , борацит
2Mg3B8O15·MgCl2, дермит Ca2B6O11·3H2O , борокальцит CaB4O7·4H2O,
ашарит B2O3·2MgO·H2O , сассолин H3BO3
Кислота борная и натрия тетраборат
100-110◦C
B2O3·2MgO·H2O + 2H2SO4→ 2 Mg SO4 + 2H3BO3
Na2B4O7·10H2O + 2HCl →4H3BO3 + 2NaCl + 5H2O
CaB4O7·4H2O + 2HCl+ H2O→4H3BO3 + CaCl2
4H3BO3 + Na2CO3 → Na2B4O7 + CO2 + 6H2O
CaB4O7 + Na2CO3 → Na2B4O7 + CaCO3↓
13.
d-элементы, II группаПрепараты соединений цинка
Сфалерит (цинковая обманка) ZnS
Другие минералы считаются продуктами окисления сфалерита: цинкит
(ZnO), госларит ZnSO4·7H2O, смитсонит (цинковый шпат) ZnCO3
Цинка оксид и цинка сульфат
Zn + H2SO4(разв) → ZnSO4 + H2↑
ZnO+ H2SO4 → ZnSO4 + H2O
5 ZnSO4 +5 Na2CO3 + 3H2O → 2ZnCO3·3Zn(OH)2 ↓ + 5 Na2SO4 + 3CO2↑
300◦C
2ZnCO3·3Zn(OH)2 → 5ZnO + 2CO2↑+ 3H2O
ZnCO3→ ZnO + CO2↑
14.
d-элементы, I группаПРЕПАРАТЫ СОЕДИНЕНИЙ МЕДИ
Медный колчедан (халькопирит) CuFeS2 ,
медный блеск Cu2S(халькозин), малахит CuCO3·Cu(OH)2,
азурит CuCO3·2Cu(OH)2
МЕДИ СУЛЬФАТ
CuSO4 · 5H2O
2Cu + H2SO4(разб) + O2 → 2CuSO4 + 2H2O
3Cu + 3H2SO4 + 2HNO3 → 3CuSO4 + 4H2O + 2NO↑
ПРЕПАРАТЫ СОЕДИНЕНИЙ СЕРЕБРА
Аргентит Ag2S, кераргирит AgCl, бромаргирит AgBr, йодаргирит AgI
СЕРЕБРА НИТРАТ, КОЛЛАРГОЛ, ПРОТАРГОЛ
3Ag + 4HNO3 → 3AgNO3 + 2H2O + NO↑
AgNO3 +HCl → 3AgCl↓ + HNO3
3AgCl + Zn + H2SO4 → 2Ag↓ + ZnSO4 + 2HCl
AgNO3 + NaOH →AgOH + NaNO3
AgOH → Ag2O↓ + H2O
15.
d-элементы, VIII группаПРЕПАРАТЫ СОЕДИНЕНИЙ ЖЕЛЕЗА
Магнитный железняк Fe3O4 (магнетит), красный железняк Fe2O3
(гематит), железный шпат FeCO3(сидерит), железный колчедан
FeS2(пирит)
ВОССТАНОВЛЕННОЕ ЖЕЛЕЗО и ЖЕЛЕЗА (II) СУЛЬФАТ
FeSO4 ·7H2O
80◦C
Fe + H2SO4 → FeSO4 + H2↑
Ferrum reductum
Мелкий серого или темно-серого цвета
блестящий или матовый порошок.
Притягивается магнитом
Ferri (II) sulfas
Светло-зеленый
кристаллический порошок
или прозрачные кристаллы
светло-зеленого цвета. Л.р.
в воде, пр.нер. в спирте.
Окисляется на воздухе,
приобретая бурую окраску













 chemistry
chemistry








