Similar presentations:
Термодинамика. Работа в термодинамике
1. Презентация По теме Термодинамика
Санкт-Петербургское государственное бюджетное профессиональноеобразовательное учреждение «ПОЖАРНО-СПАСАТЕЛЬНЫЙ КОЛЛЕДЖ «Санктпетербургский центр подготовки спасателей»»
Презентация
По теме
ТЕРМОДИНАМИКА
Выполнил студент группы 671 Киселёв М.И.
Руководитель преподаватель физики Захарова О.А.
2. Работа в термодинамике.
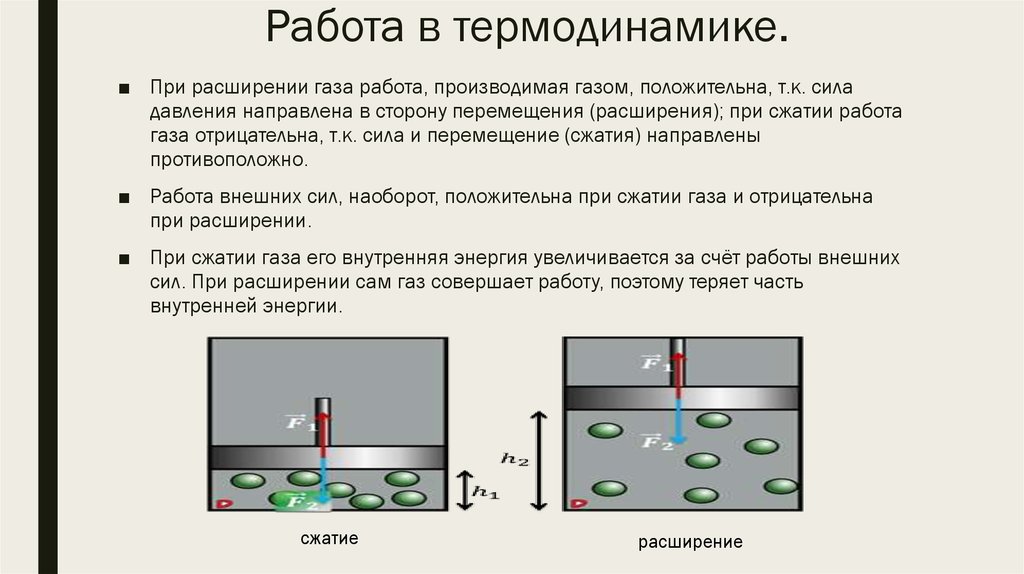
■ При расширении газа работа, производимая газом, положительна, т.к. силадавления направлена в сторону перемещения (расширения); при сжатии работа
газа отрицательна, т.к. сила и перемещение (сжатия) направлены
противоположно.
■ Работа внешних сил, наоборот, положительна при сжатии газа и отрицательна
при расширении.
■ При сжатии газа его внутренняя энергия увеличивается за счёт работы внешних
сил. При расширении сам газ совершает работу, поэтому теряет часть
внутренней энергии.
сжатие
расширение
3.
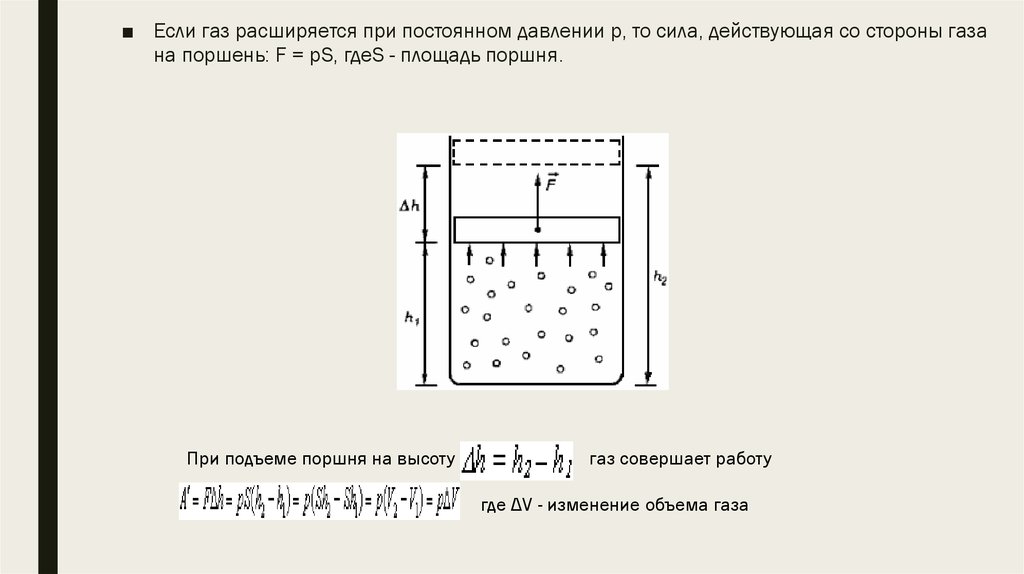
■ Если газ расширяется при постоянном давлении р, то сила, действующая со стороны газана поршень: F = рS, гдеS - площадь поршня.
При подъеме поршня на высоту
газ совершает работу
где ΔV - изменение объема газа
4.
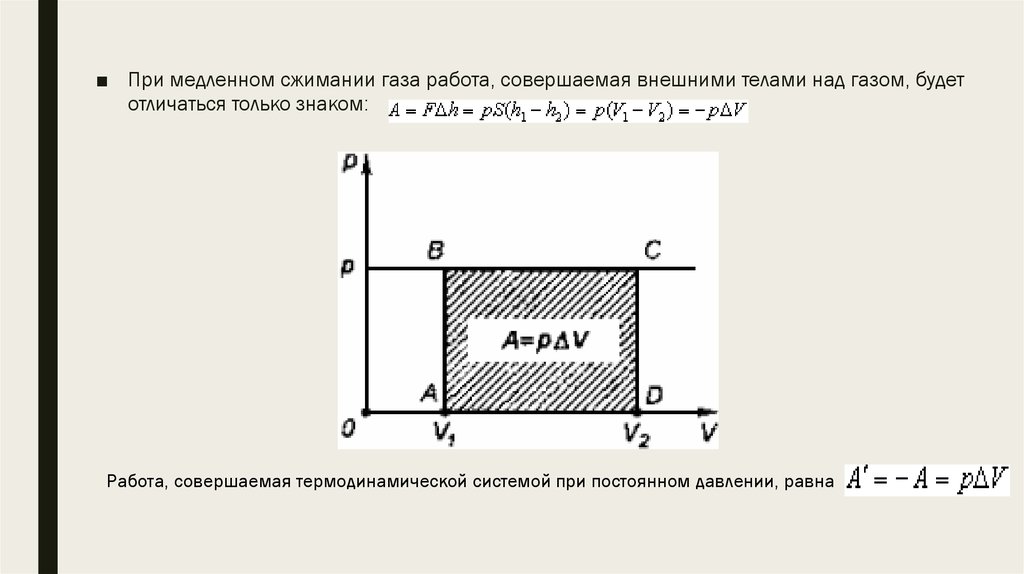
■ При медленном сжимании газа работа, совершаемая внешними телами над газом, будетотличаться только знаком:
Работа, совершаемая термодинамической системой при постоянном давлении, равна
5. Геометрическое истолкование работы.
■ Работе A' газа для случая постоянного давления можно дать простоегеометрическое истолкование.
■ Построим график зависимости давления газа от объема (рис. 41) . Здесь площадь
прямоугольника abcd, ограниченная графиком p1 = const, осью V и отрезками ab
и cd, равными давлению газа, численно равна работе.
6.
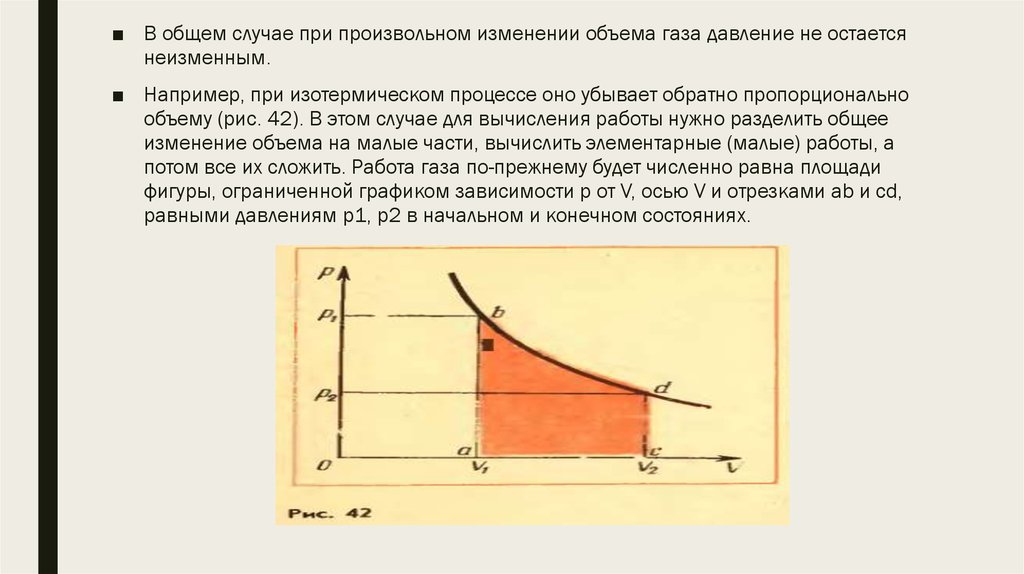
■ В общем случае при произвольном изменении объема газа давление не остаетсянеизменным.
■ Например, при изотермическом процессе оно убывает обратно пропорционально
объему (рис. 42). В этом случае для вычисления работы нужно разделить общее
изменение объема на малые части, вычислить элементарные (малые) работы, а
потом все их сложить. Работа газа по-прежнему будет численно равна площади
фигуры, ограниченной графиком зависимости p от V, осью V и отрезками ab и cd,
равными давлениям p1, p2 в начальном и конечном состояниях.
7. Закон сохранения энергии
■Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно,
она только переходит из одной в формы в другую.
• Под внутренней энергией термодинамической системы понимают кинетическую энергию
теплового движения ее молекул и потенциальную энергию их взаимодействия. Она зависит от
параметров состояния V,T . Внутренняя энергия идеального одноатомного газа прямо
пропорциональна его абсолютной температуре:
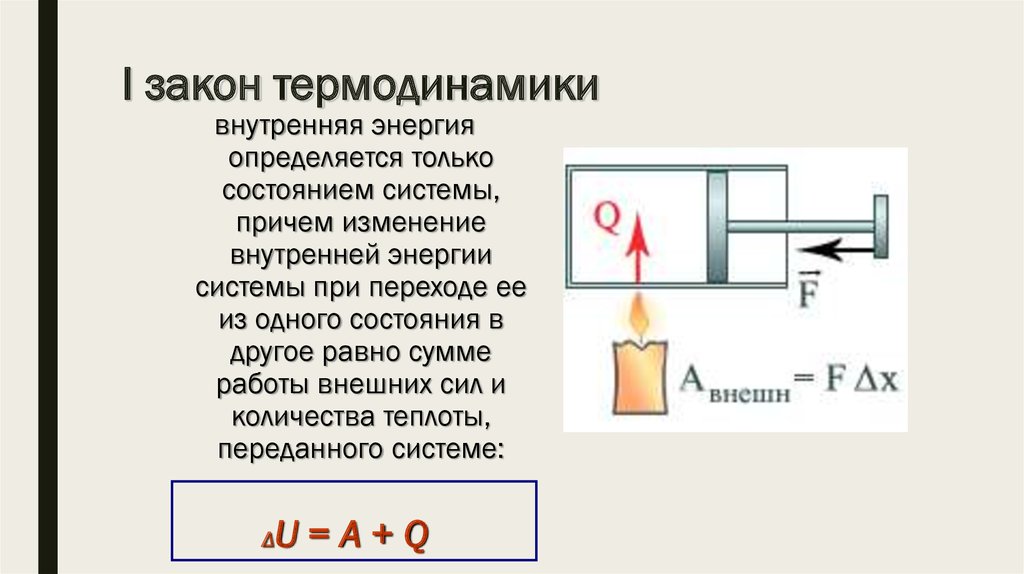
8. I закон термодинамики
внутренняя энергияопределяется только
состоянием системы,
причем изменение
внутренней энергии
системы при переходе ее
из одного состояния в
другое равно сумме
работы внешних сил и
количества теплоты,
переданного системе:
Δ
U=A+Q
9. Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно сформулировать
подругому:Q = Δ U + AI
Количество теплоты, переданное газу, равно сумме
изменения его внутренней энергии и работы,
совершенной газом.
Так как работа газа и работа внешних сил вследствие 3го закона Ньютона равны по модулю и имеют
противоположный знак:
A = –AI
10. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ИЗОТЕРМ.
СЖАТИЕ
ГРАФИК
ΔU
0
р 2
AI
Q
АI<0 Q<0
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
1
V
ИЗОБАРИЧ.
СЖАТИЕ
р
2
1
ΔU<0 АI<0 Q<0
Q = АI+ ΔU
ΔU<0 АI=0 Q<0
Q = ΔU
V
ИЗОХОРНОЕ
ОХЛАЖДЕНИЕ
р
1
2
V
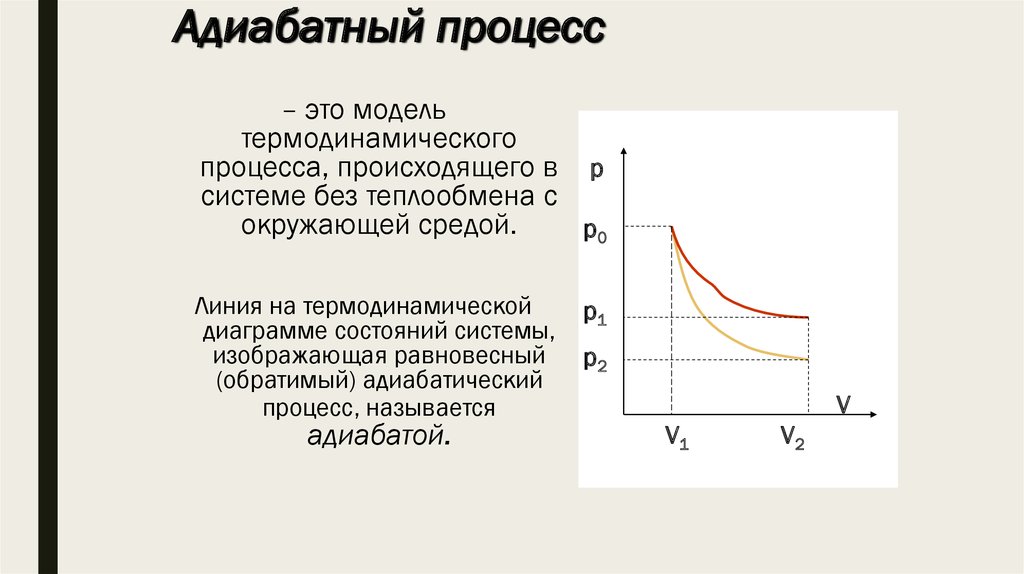
11. Адиабатный процесс
– это модельтермодинамического
процесса, происходящего в р
системе без теплообмена с
окружающей средой.
р0
Линия на термодинамической
диаграмме состояний системы,
изображающая равновесный
(обратимый) адиабатический
процесс, называется
адиабатой.
р1
р2
V
V1
V2
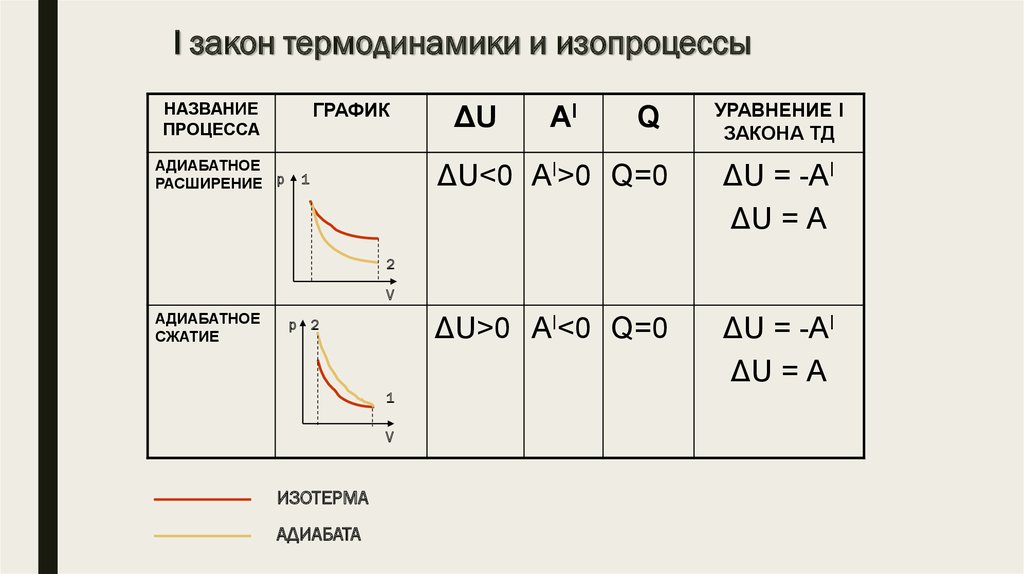
12. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ГРАФИК
АДИАБАТНОЕ
РАСШИРЕНИЕ р
1
ΔU
AI
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
ΔU<0 АI>0 Q=0
ΔU = -АI
ΔU = А
ΔU>0 АI<0 Q=0
ΔU = -АI
ΔU = А
2
V
АДИАБАТНОЕ
СЖАТИЕ
р 2
1
V
ИЗОТЕРМА
АДИАБАТА
13. источники
■ http://www.physbook.ru/index.php/%D0%A2._%D0%90%D0%B4%D0%B8%D0%B0%D0%B1%D0%B0%D1%82%D0%BD%D1%8B%D0%B9_%D0%BF%D1%80%D0%BE
%D1%86%D0%B5%D1%81%D1%81
■ http://www.yaklass.ru/materiali?mode=lsntheme&themeid=128
■ http://www.eduspb.com/node/1746
■ http://www.eduspb.com/node/1744






 physics
physics








