Similar presentations:
I закон термодинамики
1. I закон термодинамики
2. Закон сохранения энергии
Энергия в природе не возникаетиз ничего и не исчезает:
количество энергии неизменно,
она только переходит из одной
формы в другую.
3.
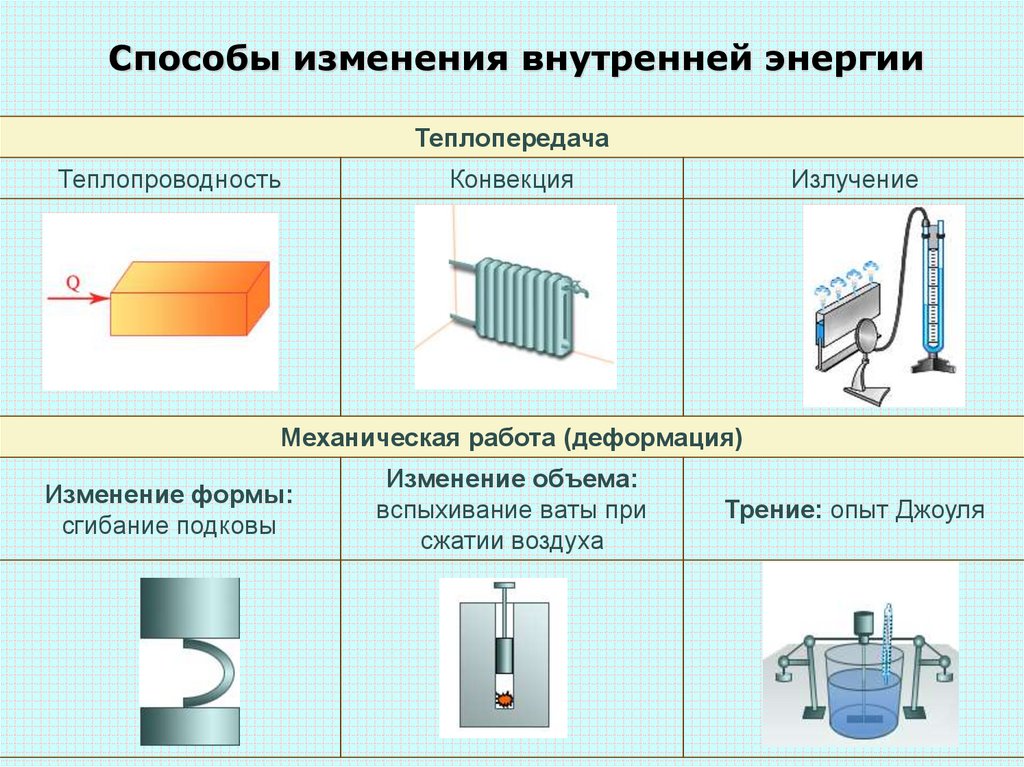
Способы изменения внутренней энергииТеплопередача
Теплопроводность
Конвекция
Излучение
Механическая работа (деформация)
Изменение формы:
сгибание подковы
Изменение объема:
вспыхивание ваты при
сжатии воздуха
Трение: опыт Джоуля
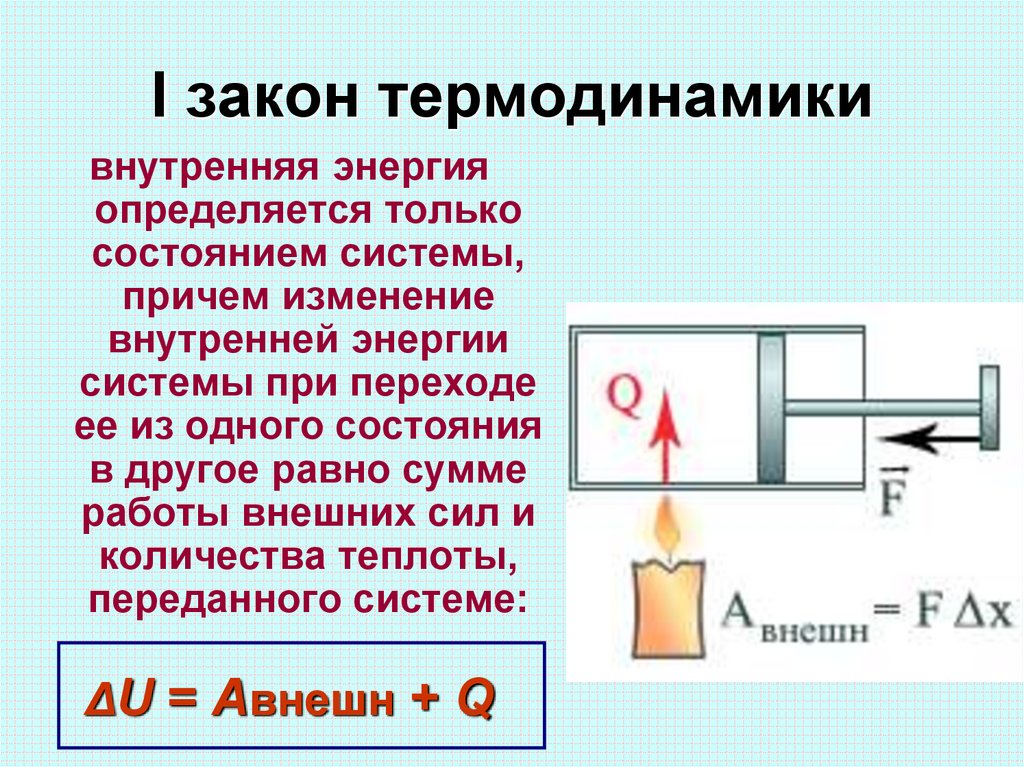
4. I закон термодинамики
внутренняя энергияопределяется только
состоянием системы,
причем изменение
внутренней энергии
системы при переходе
ее из одного состояния
в другое равно сумме
работы внешних сил и
количества теплоты,
переданного системе:
ΔU = Aвнешн + Q
5. Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно сформулировать
по-другому:Q = ΔU + A I
Количество теплоты, переданное газу, равно
сумме изменения его внутренней энергии и
работы, совершенной газом.
Так как работа газа и работа внешних сил
вследствие 3-го закона Ньютона равны по
модулю и имеют противоположный знак:
Aвнешн = –AI
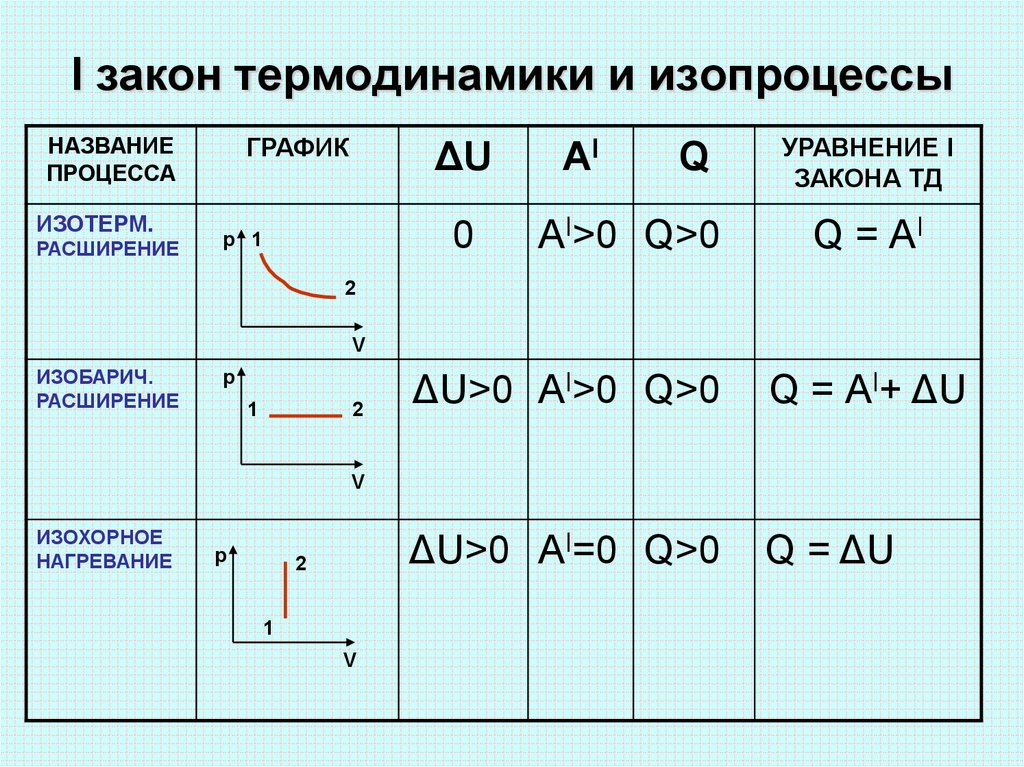
6. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ИЗОТЕРМ.
РАСШИРЕНИЕ
ГРАФИК
ΔU
0
р 1
AI
Q
АI>0 Q>0
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
2
V
ИЗОБАРИЧ.
РАСШИРЕНИЕ
р
1
2
ΔU>0 АI>0 Q>0
Q = АI+ ΔU
ΔU>0 АI=0 Q>0
Q = ΔU
V
ИЗОХОРНОЕ
НАГРЕВАНИЕ
р
2
1
V
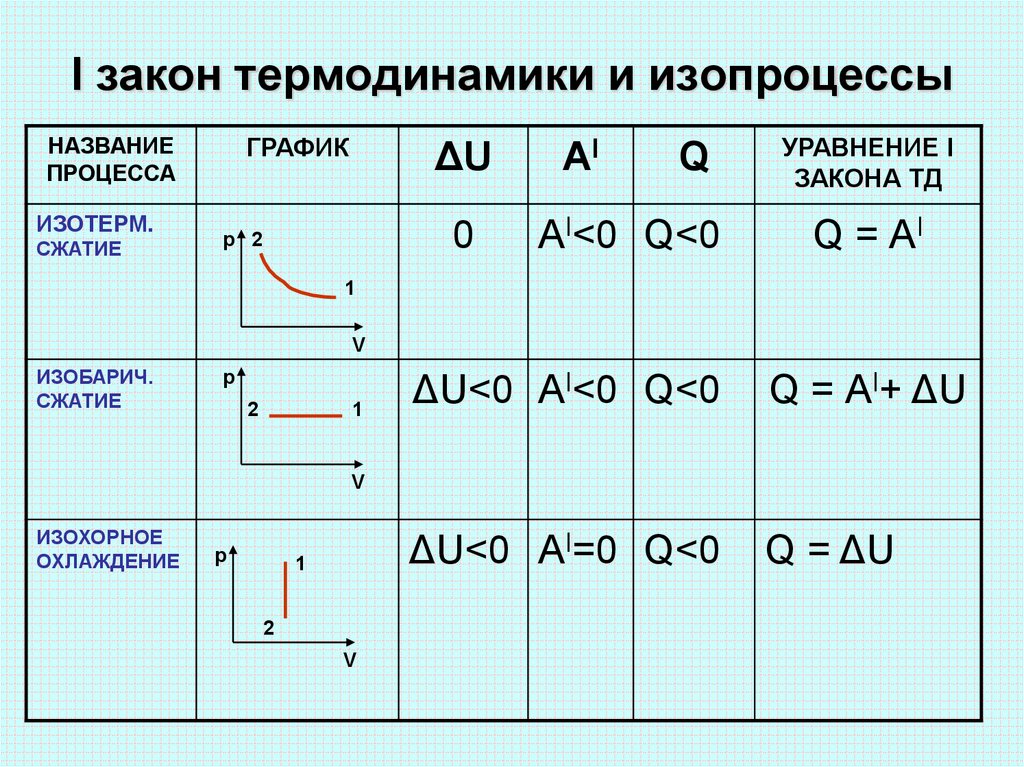
7. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ИЗОТЕРМ.
СЖАТИЕ
ГРАФИК
ΔU
0
р 2
AI
Q
АI<0 Q<0
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
1
V
ИЗОБАРИЧ.
СЖАТИЕ
р
2
1
ΔU<0 АI<0 Q<0
Q = АI+ ΔU
ΔU<0 АI=0 Q<0
Q = ΔU
V
ИЗОХОРНОЕ
ОХЛАЖДЕНИЕ
р
1
2
V
8. Адиабатный процесс
– это модельтермодинамического
процесса,
р
происходящего в
системе без теплообмена р0
с окружающей средой.
Линия на термодинамической
диаграмме состояний
системы, изображающая
равновесный (обратимый)
адиабатический процесс,
называется адиабатой.
р1
р2
V
V1
V2
9. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ГРАФИК
АДИАБАТНОЕ
РАСШИРЕНИЕ р
1
ΔU
AI
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
ΔU<0 АI>0 Q=0
ΔU = -АI
ΔU = А
ΔU>0 АI<0 Q=0
ΔU = -АI
ΔU = А
2
V
АДИАБАТНОЕ
СЖАТИЕ
р 2
1
V
ИЗОТЕРМА
АДИАБАТА
10. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
11. НЕОБРАТИМОСТЬ ТЕПЛОВЫХ ПРОЦЕССОВ
ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ УТВЕРЖДАЕТ, ЧТОКОЛИЧЕСТВО
ЭНЕРГИИ
ПРИ
ЛЮБЫХ
ЕЕ
ПРЕВРАЩЕНИЯХ ОСТАЕТСЯ НЕИЗМЕННЫМ.
НО!
ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ НИЧЕГО НЕ
ГОВОРИТ О ТОМ, КАКИЕ ПРЕВРАЩЕНИЯ ВОЗМОЖНЫ.
Заметьте, многие процессы, которые возможны с
точки зрения закона сохранения энергии, никогда не
протекает в действительности.
12.
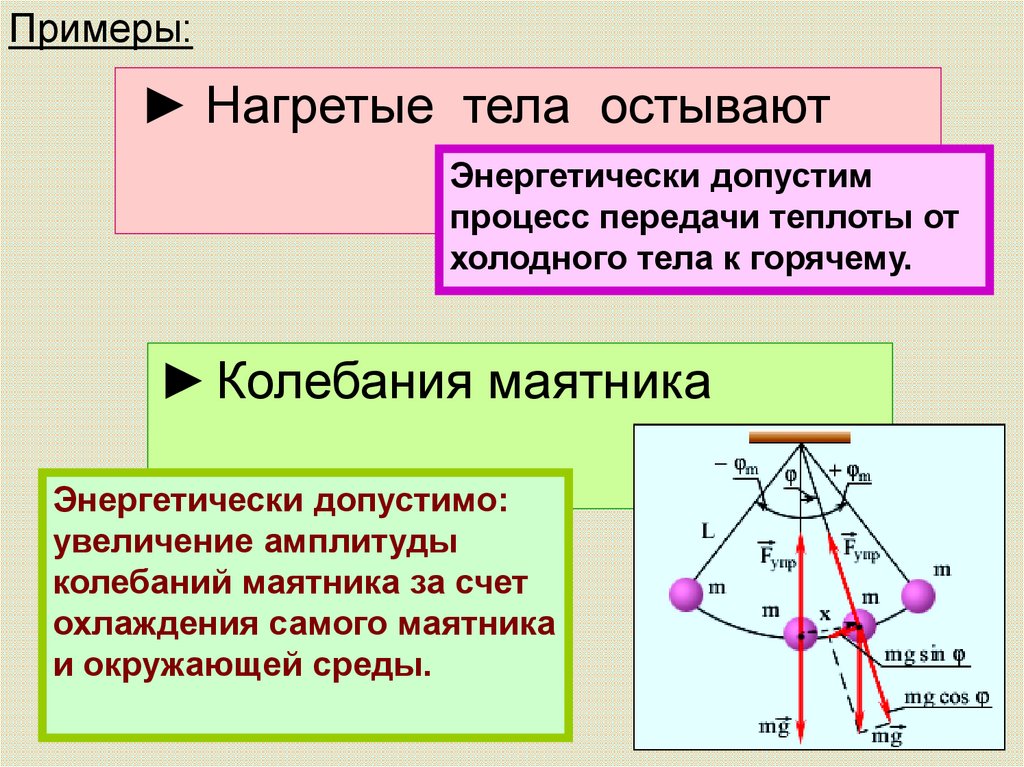
Примеры:► Нагретые тела остывают
Энергетически допустим
процесс передачи теплоты от
холодного тела к горячему.
► Колебания маятника
Энергетически допустимо:
увеличение амплитуды
колебаний маятника за счет
охлаждения самого маятника
и окружающей среды.
13.
НЕОБРАТИМЫМ называетсяпроцесс, обратный которому
может протекать только как одно
из звеньев более сложного
процесса.
Увеличение амплитуды маятника в
результате более сложного процесса,
включающего толчок рукой
Передача тепла от холодного тела к
горячему используя холодильную
установку, потребляющую энергию.
14.
ИЛЛЮСТРАЦИЯ НЕОБРАТИМОСТИ ЯВЛЕНИЙ В ПРИРОДЕ«ПАДЕНИЕ
ХРУСТАЛЬНОЙ
ВАЗЫ
ПРОСМОТР
КИНОФИЛЬМА
В ОБРАТНОМ
НАПРАВЛЕНИИИ
СО СТОЛА
»
Соединение лежащих на полу осколков
и восстановление ВАЗЫ
ПРОЦЕСС ВОССТАНОВЛЕНИЯ ВАЗЫ ИЗ ОСКОЛКОВ
НЕ ПРОТИВОРЕЧИТ ЗАКОНАМ СОХРАНЕНИЯ
ЭНЕРГИИ, ЗАКОНАМ МЕХАНИКИ, НИ ВООБЩЕ КАКИМ
ЛИБО ЗАКОНАМ,
КРОМЕ
15. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Указывает направление возможныхэнергетических превращений, выражая
необратимость процессов в природе
Установлен путем обобщения
опытных фактов
16.
ФОРМУЛИРОВКА КЛАУЗИУСАНевозможен
процесс, тепло
Невозможно перевести
единственным
результатом
от более холодной
системы к
которого
былапри
быотсутствии
передача
более горячей
энергии
путем теплообмена
одновременных
изменений в
от
тела
с низкой
обеих
системах
или
температурой
к телу с более
окружающих телах
высокой температурой.
17.
ФОРМУЛИРОВКА КЕЛЬВИНА 1851 гВ циклически действующей
Невозможно осуществить
тепловой машине невозможен
такой периодический процесс,
процесс, единственным
единственным
результатом
результатом которого было бы
которого было бы
преобразование
в получение
работы за счет
теплоты,
механическую
работу
всего
взятой от одного
источника.
количества
теплоты,
полученного от единственного
теплового резервуара.
18.
Самопроизвольныепроцессы в изолированной
системе всегда происходят
направлении перехода от
маловероятного состояния
в более вероятное
19.
КЛАУЗИУС (Clausius) РудольфЮлиус Эмануэль ( 1822 - 1888), немецкий
физик, один из основателей термодинамики
и молекулярно-кинетической теории теплоты.
Окончил в Берлинский университет. Первым
понял и проанализировал идеи С. Карно и
оценил их значение для теории теплоты и
тепловых машин. Развивая эти идеи,
Клаузиус в 1850 (одновременно с У.
Кельвином) дал первую формулировку
второго начала термодинамики, в которой
содержалось утверждение о необратимости
процесса передачи теплоты: "Теплота не
может сама собою перейти от более
холодного тела к более тёплому". Ввёл
понятие энтропии, длины свободного
пробега молекул. Количественно объяснил
явления в газах, как внутреннее трение,
теплопроводность и диффузия.
Иностранный член Лондонского королевского общества
(1868), член-корреспондент Парижской АН (1865).
20.
ТОМСОН Уильям (1824-1907)(с 1892 за научные заслуги получил титул
лорда КЕЛЬВИНа - Kelvin)
английский физик, один из
основоположников термодинамики
президент Лондонского королевского
общества, иностранный членкорреспондент (1877) и иностранный
почетный член (1896) Петербургской АН.
Труды по многим разделам физики
(термодинамика, теория электрических и
магнитных явлений и др.).
Ввел абсолютную шкалу температур (шкала Кельвина),
дал одну из формулировок второго начала
термодинамики, Активный участник осуществления
телеграфной связи по трансатлантическому кабелю,
установил зависимость периода колебаний контура от
его емкости и индуктивности. Изобрел многие
электроизмерительные приборы, усовершенствовал
ряд мореходных инструментов.
21.
На основании любой из формулировок второго законатермодинамики могут быть доказаны следующие
утверждения, которые называются теоремами Карно:
►Коэффициент полезного действия тепловой машины,
работающей при данных значениях температур
нагревателя и холодильника, не может быть больше,
чем коэффициент полезного действия машины,
работающей по обратимому циклу Карно при тех же
значениях температур нагревателя и холодильника.
►Коэффициент полезного действия тепловой машины,
работающей по циклу Карно, не зависит от рода
рабочего тела, а только от температур нагревателя и
холодильника.
22.
Любой участок цикла Карно и весь цикл в целом можетбыть пройден в обоих направлениях.
Обход цикла по часовой стрелке соответствует
тепловому двигателю, когда полученное
рабочим телом тепло частично превращается в
полезную работу.
Обход против часовой стрелки соответствует
холодильной машине, когда некоторое
количество теплоты отбирается от холодного
резервуара и передается горячему резервуару за
счет совершения внешней работы.
Поэтому идеальное устройство, работающее по циклу
Карно, называют обратимой тепловой машиной.
23.
Работа А совершаетсяпри приведении машины
в действие. Количество
теплоты Q1 передается
рабочим телом
нагревателю более
высокой температуры, а
количество теплоты Q2
поступает от рабочего
тела к холодильнику.
Энергетическая схема
холодильной машины.
Q1 < 0, A < 0, Q2 > 0, T1 > T2.
Теплота передается от
холодного тела к
горячему →
холодильная машина
24.
Если полезным эффектом является отборнекоторого количества тепла |Q2| от
охлаждаемых тел (например, от продуктов в
камере холодильника), то такое устройство
является обычным холодильником.
Эффективность работы холодильника βх можно
охарактеризовать отношением
Эффективность работы холодильника – это
количество тепла, отбираемого от охлаждаемых
тел на 1 джоуль затраченной работы.
25.
Если полезным эффектом являетсяпередача некоторого количества тепла |Q1|
нагреваемым телам (например, воздуху в
помещении), то такое устройство называется
тепловым насосом.
Эффективность βТ теплового насоса может быть
определена как отношение
Эффективность работы теплового насоса – это
количеством теплоты, передаваемое более
теплым телам на 1 джоуль затраченной работы.
26.
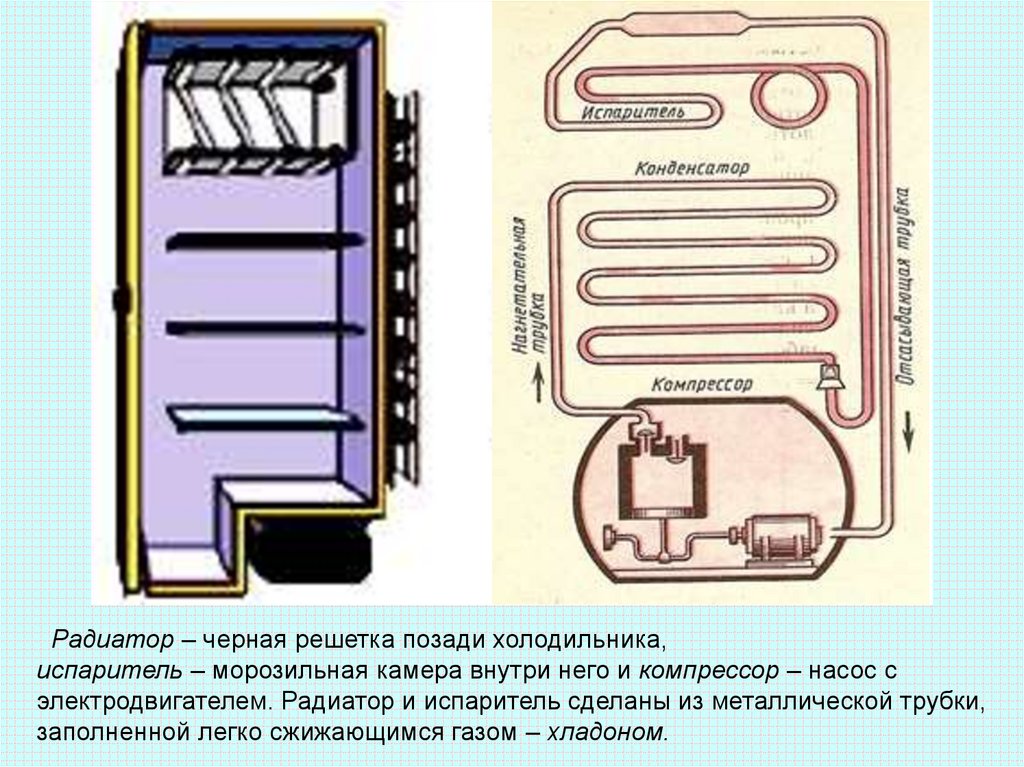
Радиатор – черная решетка позади холодильника,испаритель – морозильная камера внутри него и компрессор – насос с
электродвигателем. Радиатор и испаритель сделаны из металлической трубки,
заполненной легко сжижающимся газом – хладоном.
27.
«Науку все глубже постигнуть стремись,Познанием вечного жаждой тянись.
Лишь первых познаний блеснет тебе свет,
Узнаешь: предела для знания нет.»
Фирдоуси
( Персидский и таджикский поэт 940–1030 г.г)





















 physics
physics








