Similar presentations:
Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах
1. Спецификация КИМ ОГЭ химия 2016
Задание 17. Первоначальные сведения оборганических веществах: предельных и
непредельных углеводородах и
кислородсодержащих веществах: спиртах,
карбоновых кислотах.
2. В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических
В 1860-х гг. А. М. Бутлеровсформулировал основные положения,
ставшие впоследствии фундаментом
теории строения органических
соединений. Согласно этой теории:
• атомы в органических молекулах соединены друг с
другом в соответствии с валентностью, при этом углерод
всегда четырехвалентен;
Поскольку углерод в органических соединениях всегда
четырехвалентен, то каждый атом углерода может
образовывать четыре связи (четыре черточки).
3.
Другие атомы в молекулах органическихвеществ тоже соединены друг с другом в
соответствии с валентностью:
• водород - I
• кислород - II
• азот - III
• сера - II;
С2 Н6 О
4.
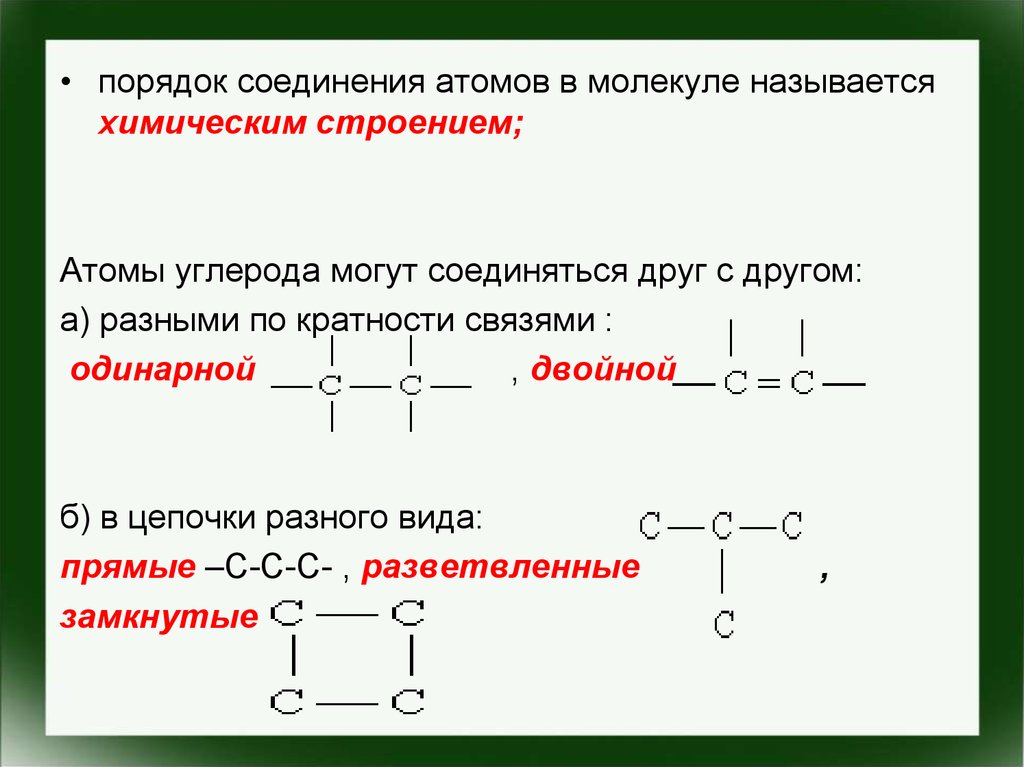
• порядок соединения атомов в молекуле называетсяхимическим строением;
Атомы углерода могут соединяться друг с другом:
а) разными по кратности связями :
одинарной
, двойной
б) в цепочки разного вида:
прямые –С-С-С- , разветвленные
замкнутые
,
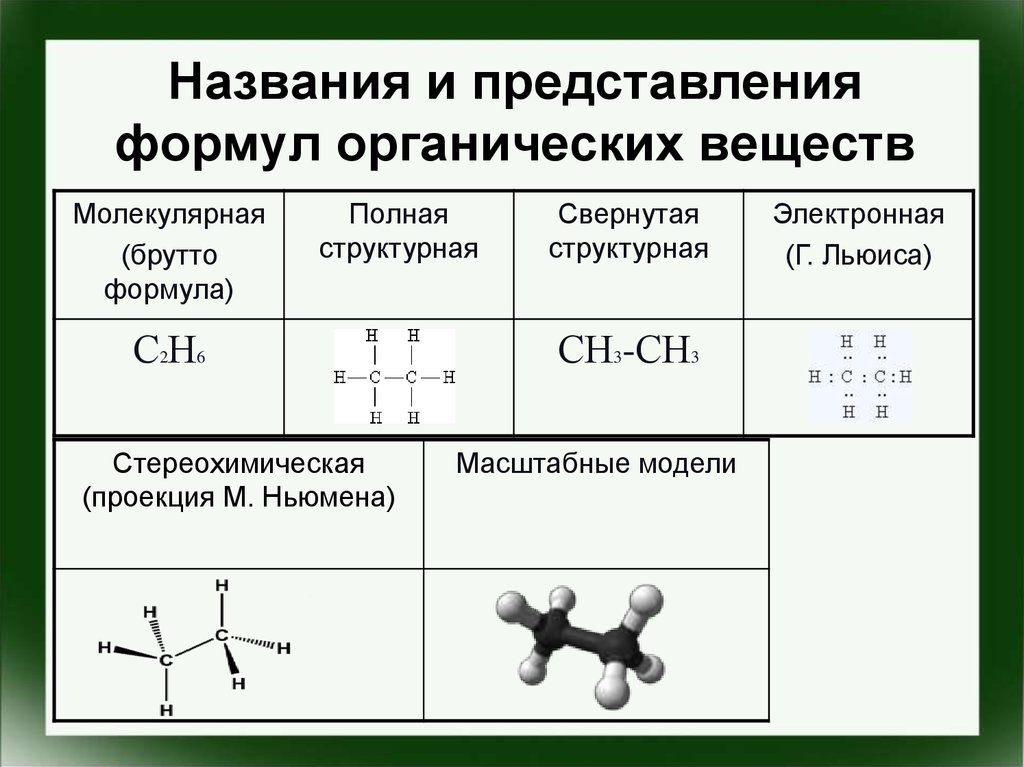
5. Названия и представления формул органических веществ
Молекулярная(брутто
формула)
Полная
структурная
С2Н6
Стереохимическая
(проекция М. Ньюмена)
Свернутая
структурная
СН3-СН3
Масштабные модели
Электронная
(Г. Льюиса)
6.
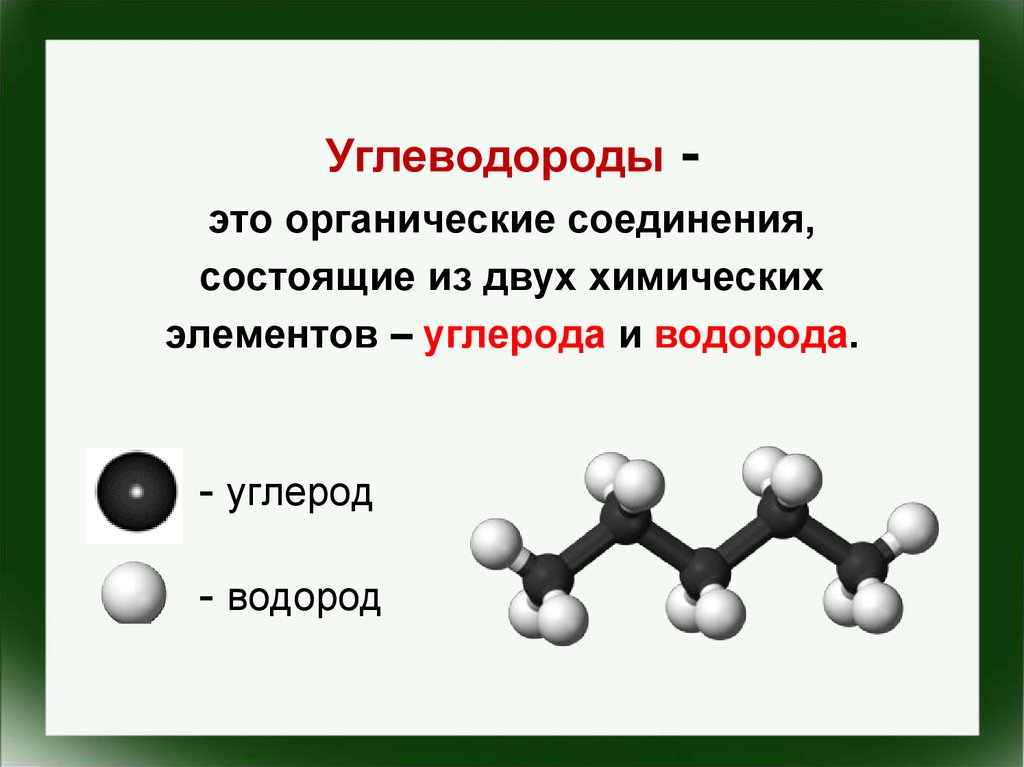
Углеводороды-
это органические соединения,
состоящие из двух химических
элементов – углерода и водорода.
- углерод
- водород
7. Своеобразное отношение к нагреванию.
Температура плавленияорганических веществ
очень низкая. Имея
молекулярное строение
они хорошо горят.
CxHy+O2=xCO2+y/2H2O
8.
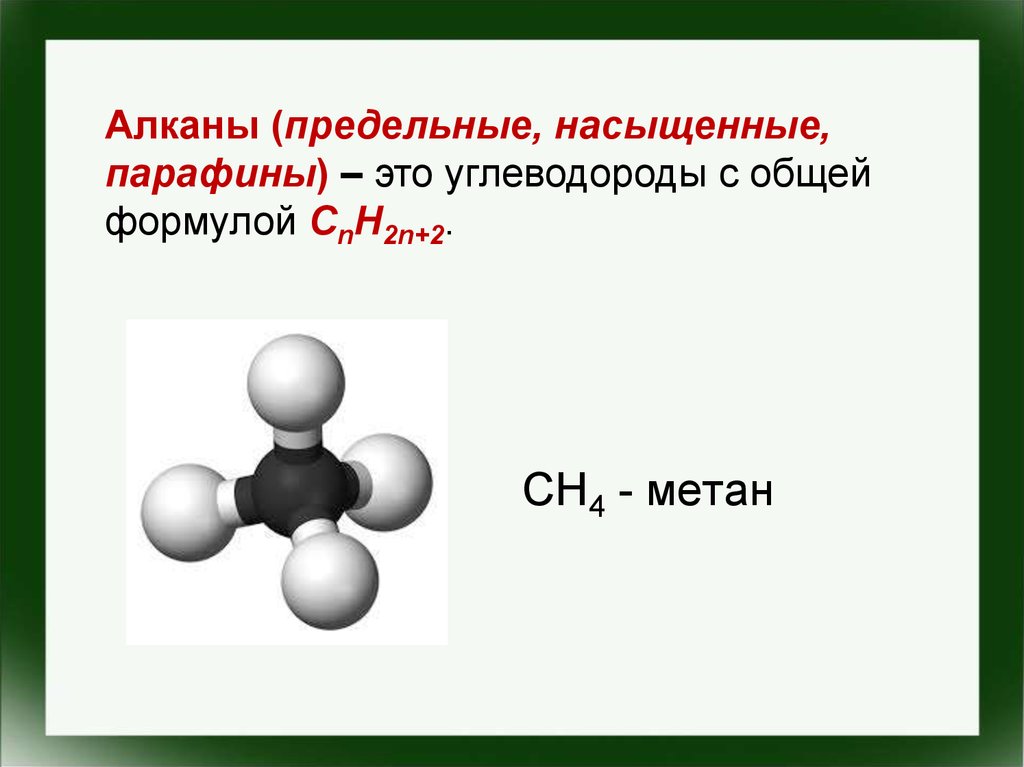
Алканы (предельные, насыщенные,парафины) – это углеводороды с общей
формулой CnH2n+2.
СН4 - метан
9. Гомологический ряд алканов
Гомологи – это вещества со схожимистроением и свойствами, но
различающиеся по составу на одну или
несколько групп CH2 (гомологическая
разность).
10.
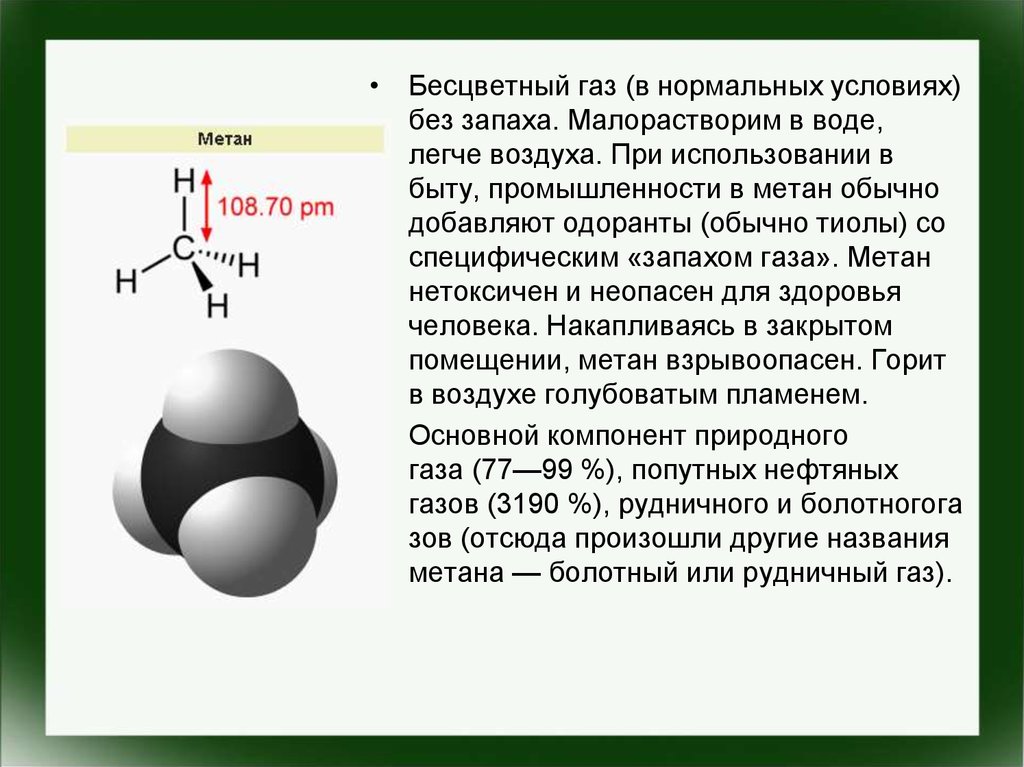
• Бесцветный газ (в нормальных условиях)без запаха. Малорастворим в воде,
легче воздуха. При использовании в
быту, промышленности в метан обычно
добавляют одоранты (обычно тиолы) со
специфическим «запахом газа». Метан
нетоксичен и неопасен для здоровья
человека. Накапливаясь в закрытом
помещении, метан взрывоопасен. Горит
в воздухе голубоватым пламенем.
• Основной компонент природного
газа (77—99 %), попутных нефтяных
газов (3190 %), рудничного и болотногога
зов (отсюда произошли другие названия
метана — болотный или рудничный газ).
11. Химические свойства
• Реакция замещенияСН4 + Cl2 hv CH3Cl + HCl
• Дегидрирование
2CH4 (1500°C) → HC≡CH + 3H2 (кат. Ni)
ацетилен
C2H6 (500-600°C) → Н2С=CH2 + H2 (кат. Pt)
этилен
12.
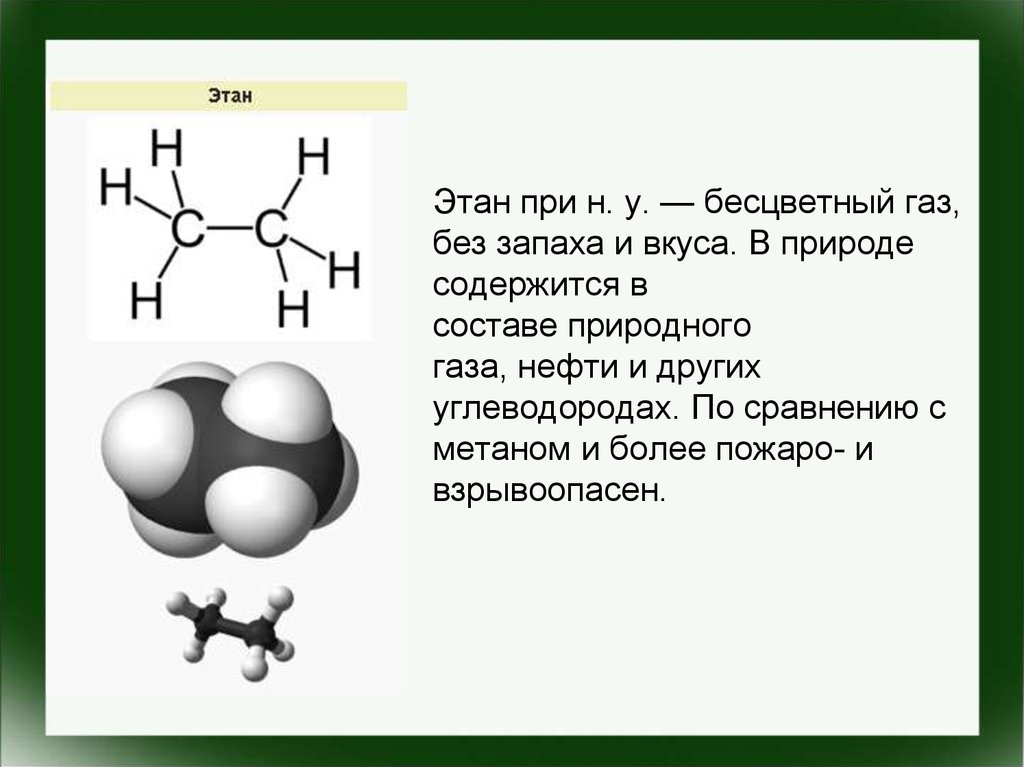
• Этан при н. у. — бесцветный газ,без запаха и вкуса. В природе
содержится в
составе природного
газа, нефти и других
углеводородах. По сравнению с
метаном и более пожаро- и
взрывоопасен.
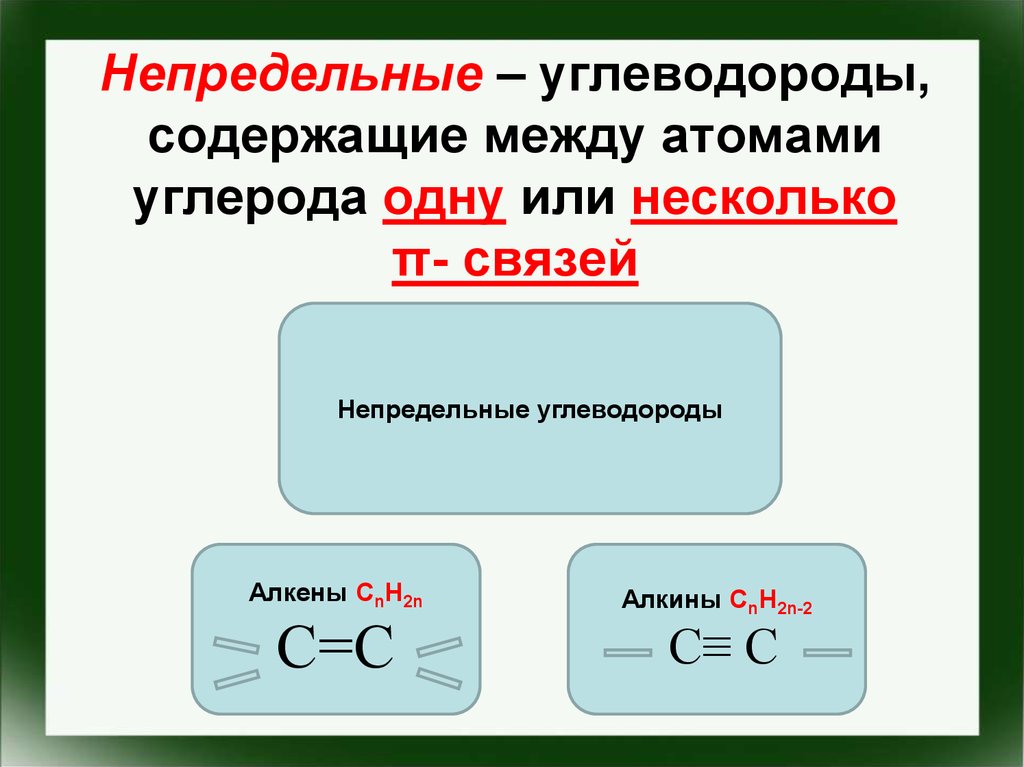
13. Непредельные – углеводороды, содержащие между атомами углерода одну или несколько π- связей
Непредельные углеводородыАлкены CnH2n
С=С
Алкины CnH2n-2
С≡ С
14.
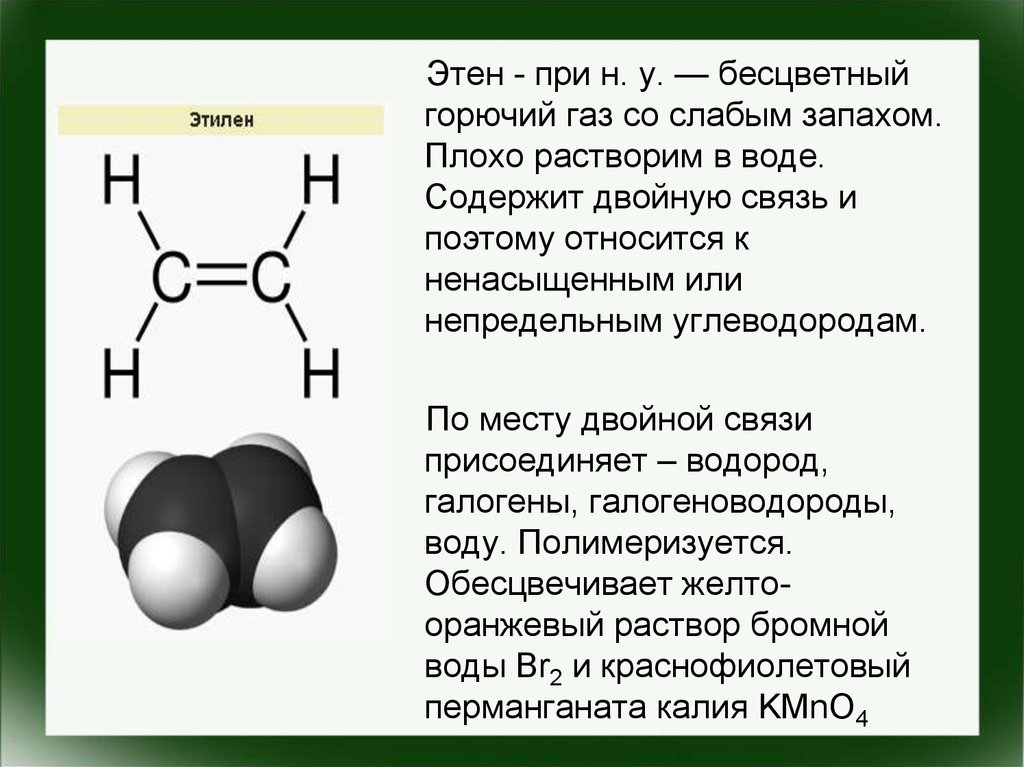
Этен - при н. у. — бесцветныйгорючий газ со слабым запахом.
Плохо растворим в воде.
Содержит двойную связь и
поэтому относится к
ненасыщенным или
непредельным углеводородам.
По месту двойной связи
присоединяет – водород,
галогены, галогеноводороды,
воду. Полимеризуется.
Обесцвечивает желтооранжевый раствор бромной
воды Br2 и краснофиолетовый
перманганата калия KMnO4
15.
Этин - при нормальных условиях —бесцветный газ, легче воздуха. Чистый
100 % ацетилен не обладает запахом,
однако технический ацетилен содержит
примеси, которые придают ему резкий
запах. Малорастворим в воде, может
взрываться от удара, горит
красноватым пламенем 3150 С0.
По месту тройной связи присоединяет –
водород, галогены, галогеноводороды,
воду до уксусного альдегида (р-я
Кучерова). Полимеризуется до бензола.
Обесцвечивает желто-оранжевый
раствор бромной воды Br2 и краснофиолетовый перманганата калия
KMnO4. Реагирует с аммиачным
раствором оксида серебра Ag2O.
16. Спирты́ (устаревшее алкого́ли)
— органические соединения, содержащиеодну или несколько гидроксильных групп
(гидроксил, OH), непосредственно
связанных с атомом углерода в
углеводородном радикале.
Общая формула спиртов СxHy(OH)n
Общая формула одноатомных предельных
спиртов СnН2n+1ОН
17. Физические свойства
• Низшие спирты (С1-C11)-летучиежидкости с резким запахом.
• Высшие спирты (C12- и выше)твердые вещества с приятным
запахом.
18.
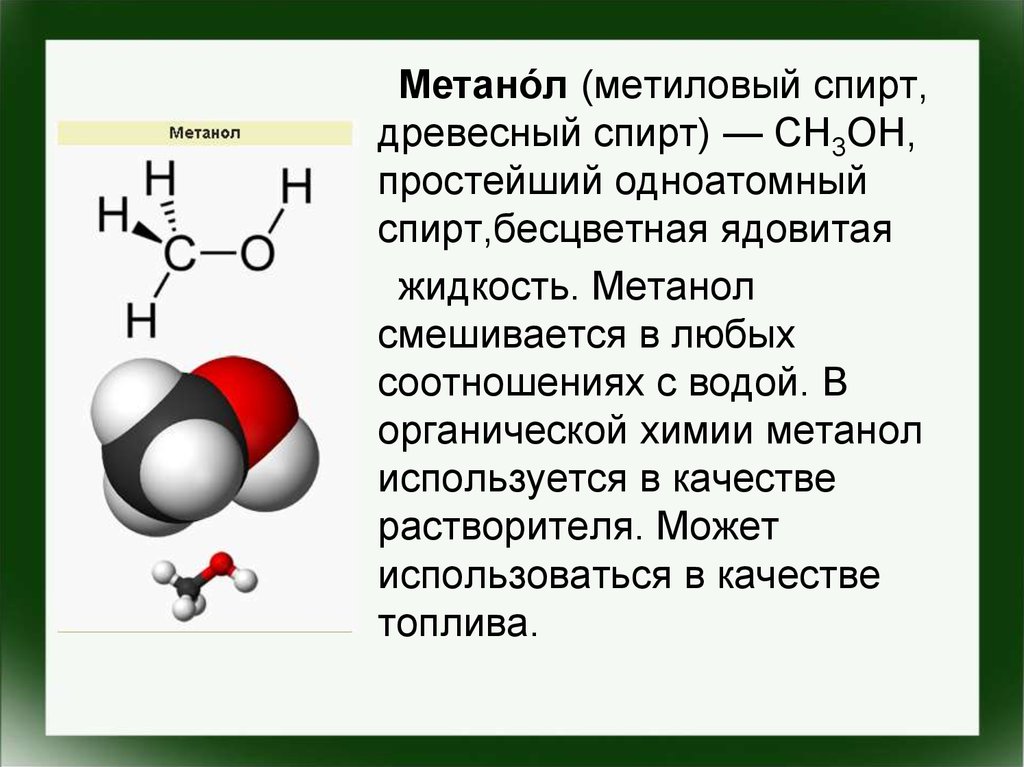
Метано́л (метиловый спирт,древесный спирт) — CH3OH,
простейший одноатомный
спирт,бесцветная ядовитая
жидкость. Метанол
смешивается в любых
соотношениях с водой. В
органической химии метанол
используется в качестве
растворителя. Может
использоваться в качестве
топлива.
19.
Этано́л (эти́ловый спирт,ви́нный спирт или алкого́ль,
часто в просторечии просто
«спирт») — одноатомный спирт.
Летучая, горючая (синеватое
пламя), бесцветная прозрачная
жидкость. Хорошо растворяется
в воде Действующий компонент
алкогольных напитков.
Этиловый спирт также
используется как топливо, в
качестве растворителя как
наполнитель в спиртовых
термометрах и как
дезинфицирующее средство.
20. Химические свойства
• Обладает слабыми кислотнымисвойствами, поэтому способны вступать
в реакцию с щелочными металлами с
замещением атома водорода в
гидроксильной группе. Также возможна
реакция с галогеноводородами с
замещением всего гидроксила.
21. Многоатомные спирты
органические соединения, в молекулахкоторых содержится несколько
гидроксильных групп, соединенных с
углеводородным радикалом.
Общую формулу многоатомных спиртов
можно записать как R-(OH)n.
СН2 – СН2
ОН
ОН
Этандиол-1,2
(этиленгликоль)
СН2 – СН
ОН
– СН2
ОН
ОН
Пропантриол-1,2,3
(глицерин)
22.
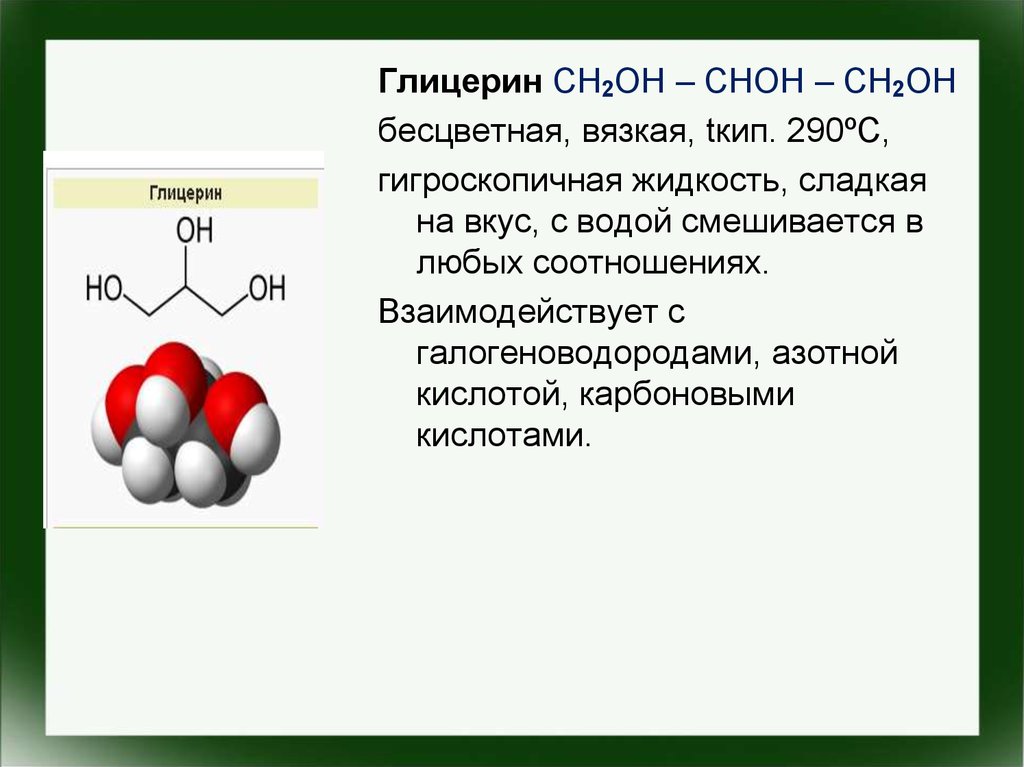
Глицерин CH2OH – CHOH – CH2OHбесцветная, вязкая, tкип. 290ºС,
гигроскопичная жидкость, сладкая
на вкус, с водой смешивается в
любых соотношениях.
Взаимодействует с
галогеноводородами, азотной
кислотой, карбоновыми
кислотами.
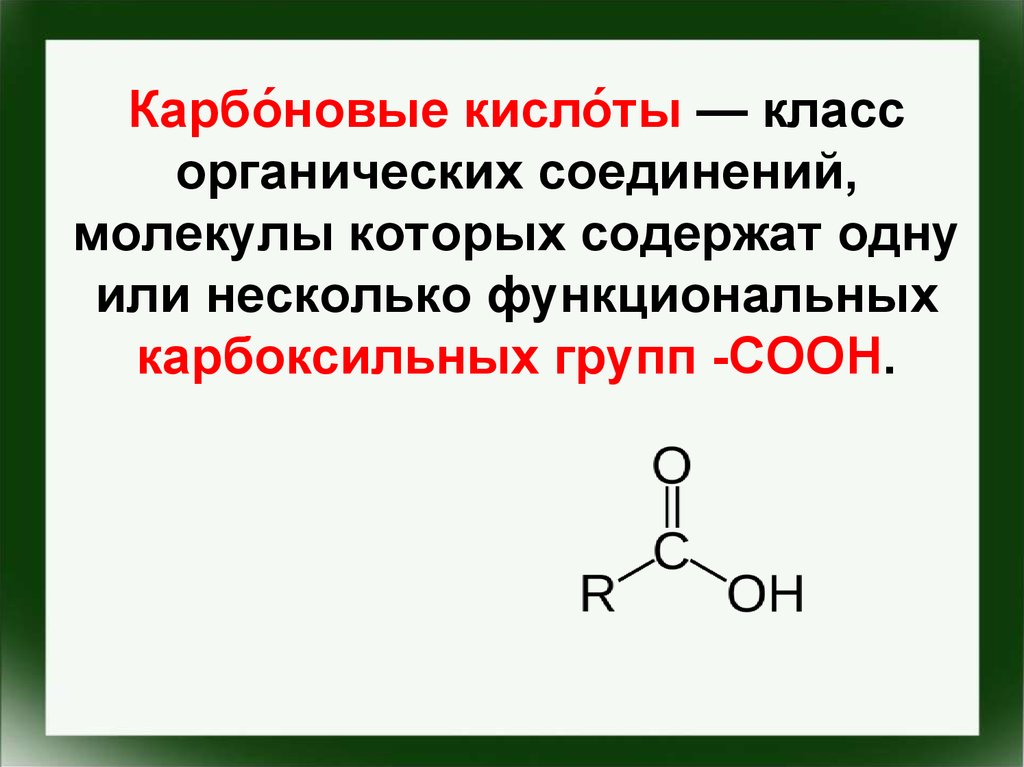
23. Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных
Карбо́новые кисло́ты — классорганических соединений,
молекулы которых содержат одну
или несколько функциональных
карбоксильных групп -COOH.
24.
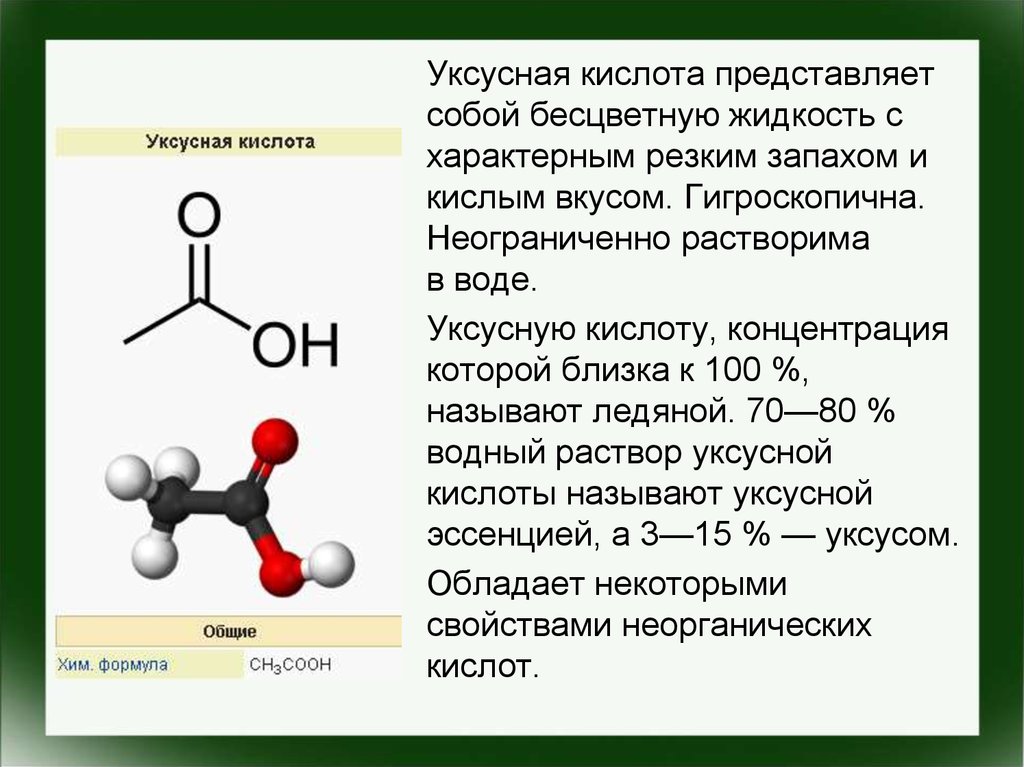
Уксусная кислота представляетсобой бесцветную жидкость с
характерным резким запахом и
кислым вкусом. Гигроскопична.
Неограниченно растворима
в воде.
Уксусную кислоту, концентрация
которой близка к 100 %,
называют ледяной. 70—80 %
водный раствор уксусной
кислоты называют уксусной
эссенцией, а 3—15 % — уксусом.
Обладает некоторыми
свойствами неорганических
кислот.
25.
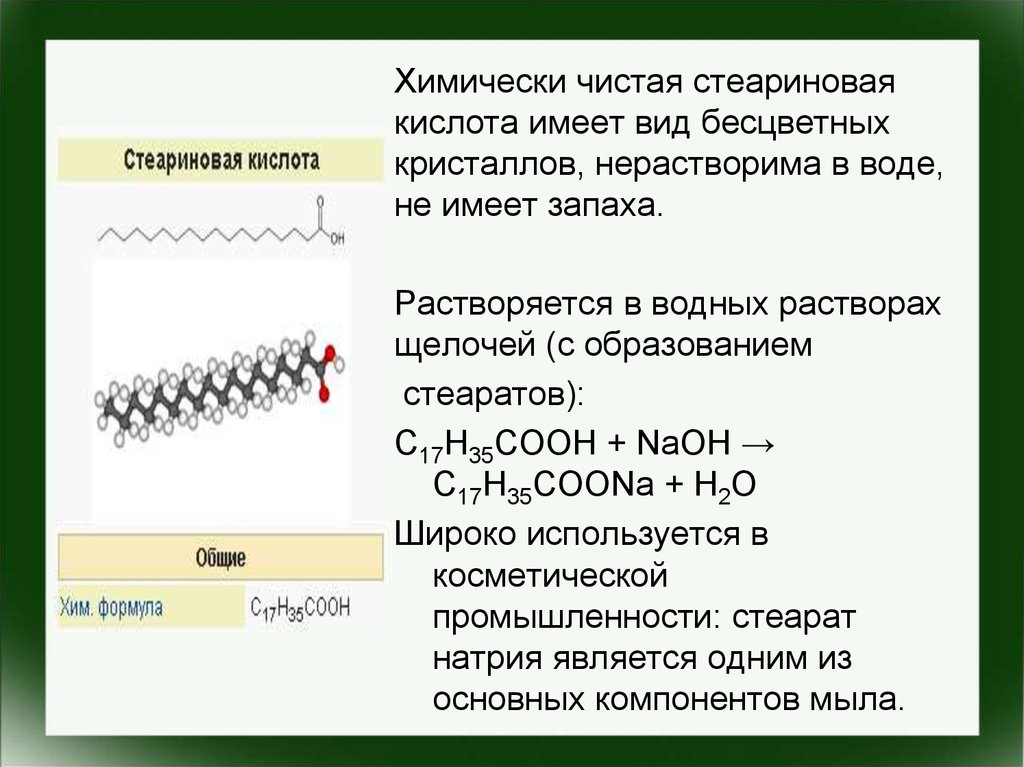
Химически чистая стеариноваякислота имеет вид бесцветных
кристаллов, нерастворима в воде,
не имеет запаха.
Растворяется в водных растворах
щелочей (с образованием
стеаратов):
C17H35COOH + NaOH →
C17H35COONa + H2O
Широко используется в
косметической
промышленности: стеарат
натрия является одним из
основных компонентов мыла.
26.
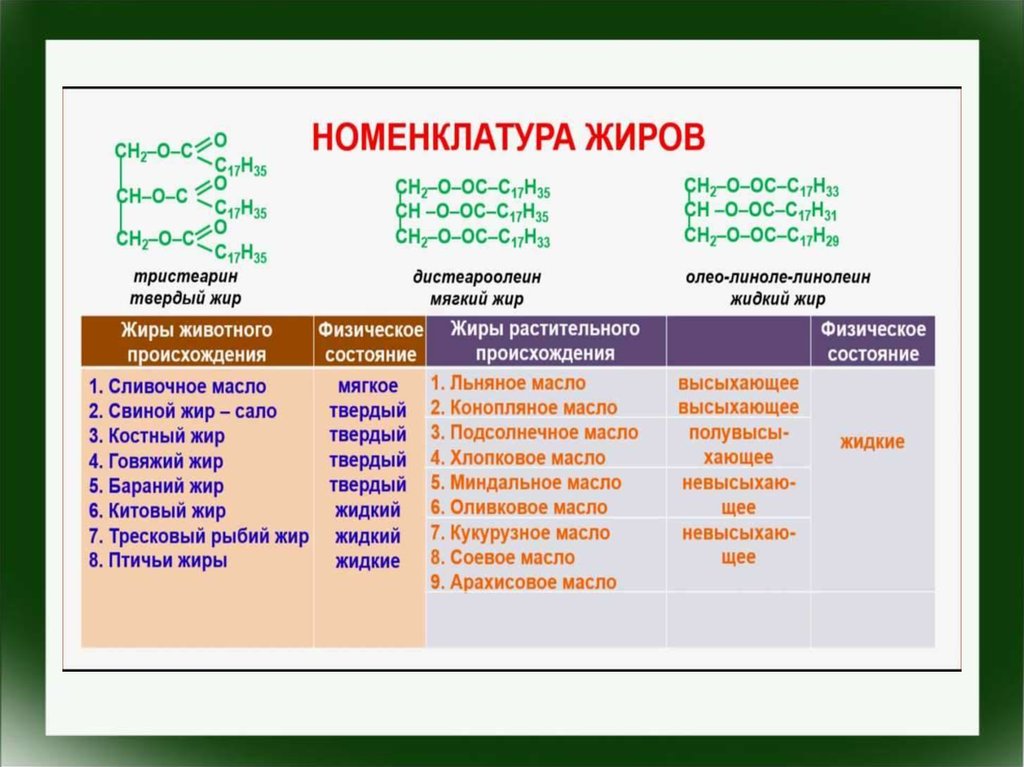
Жиры,или триглицериды —
природные органические
соединения,
образованные
глицерином и
одноосновными
жирными кислотами.
27.
28.
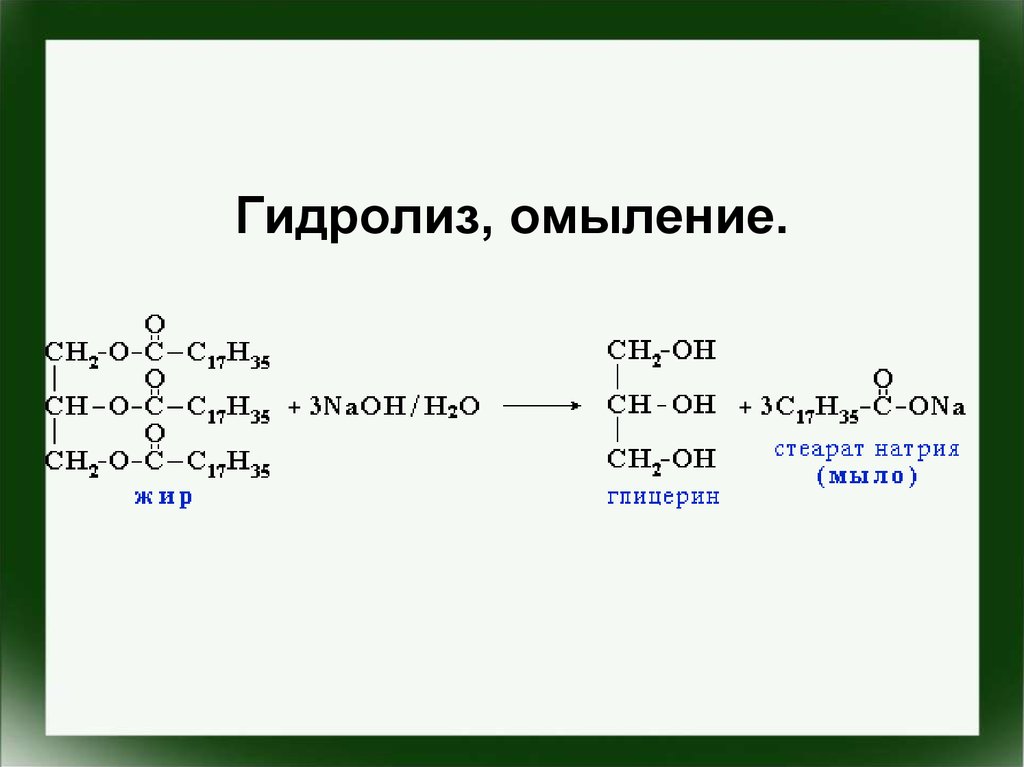
Гидролиз, омыление.29.
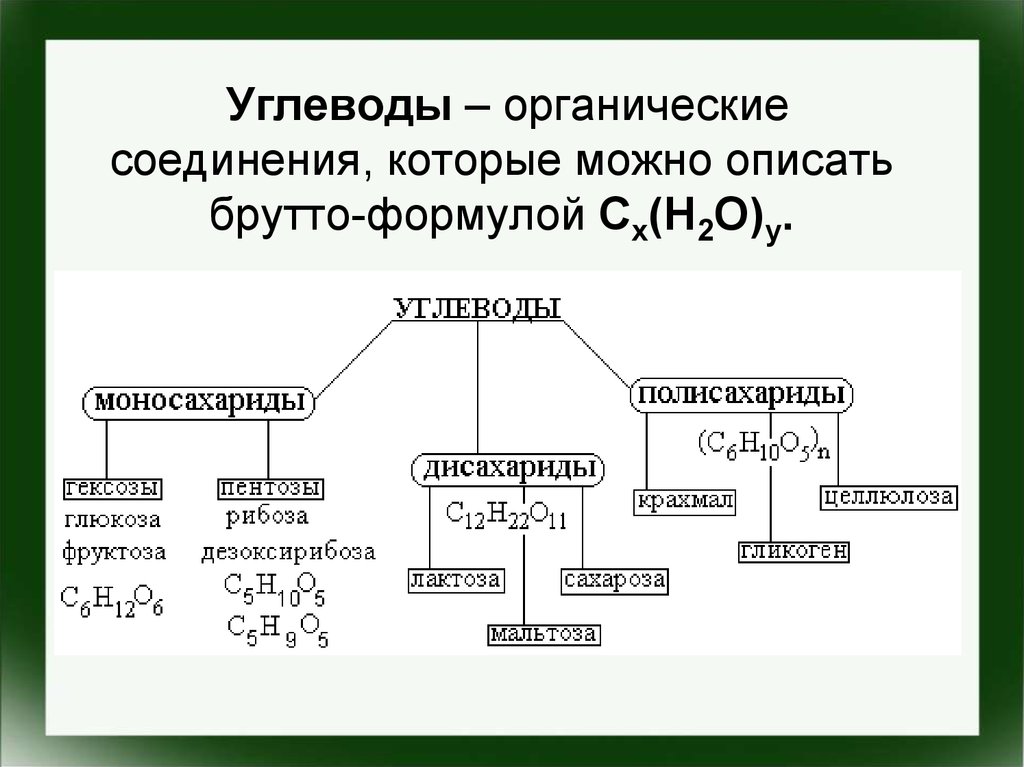
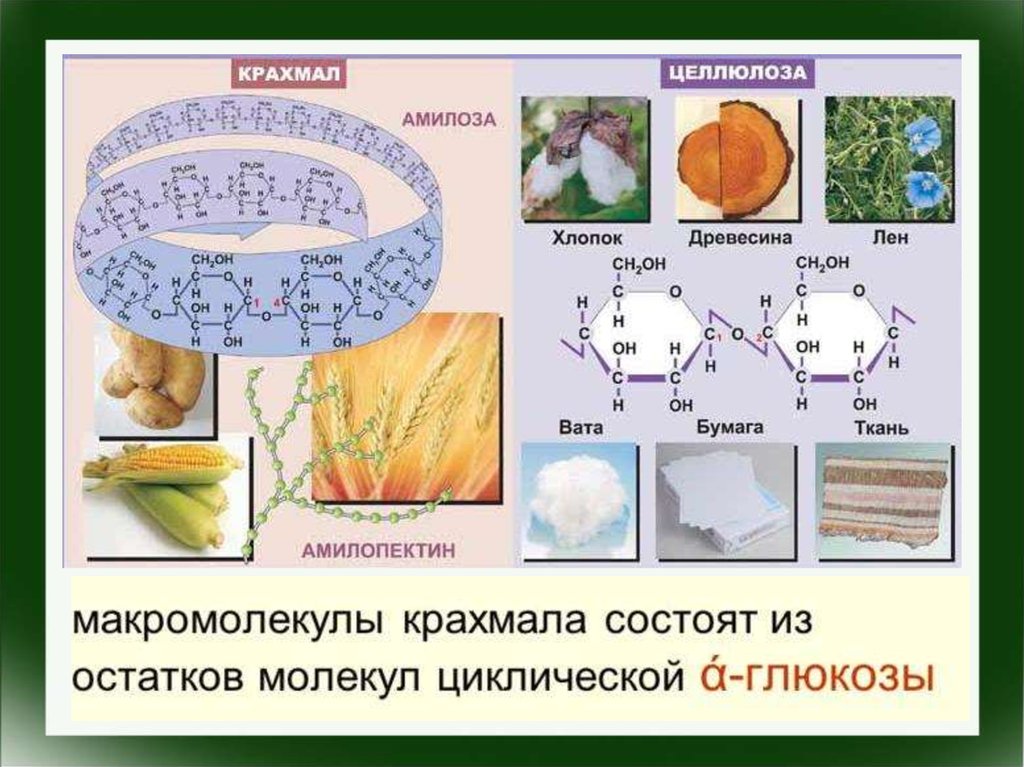
Углеводы – органическиесоединения, которые можно описать
брутто-формулой Cx(H2O)y.
30.
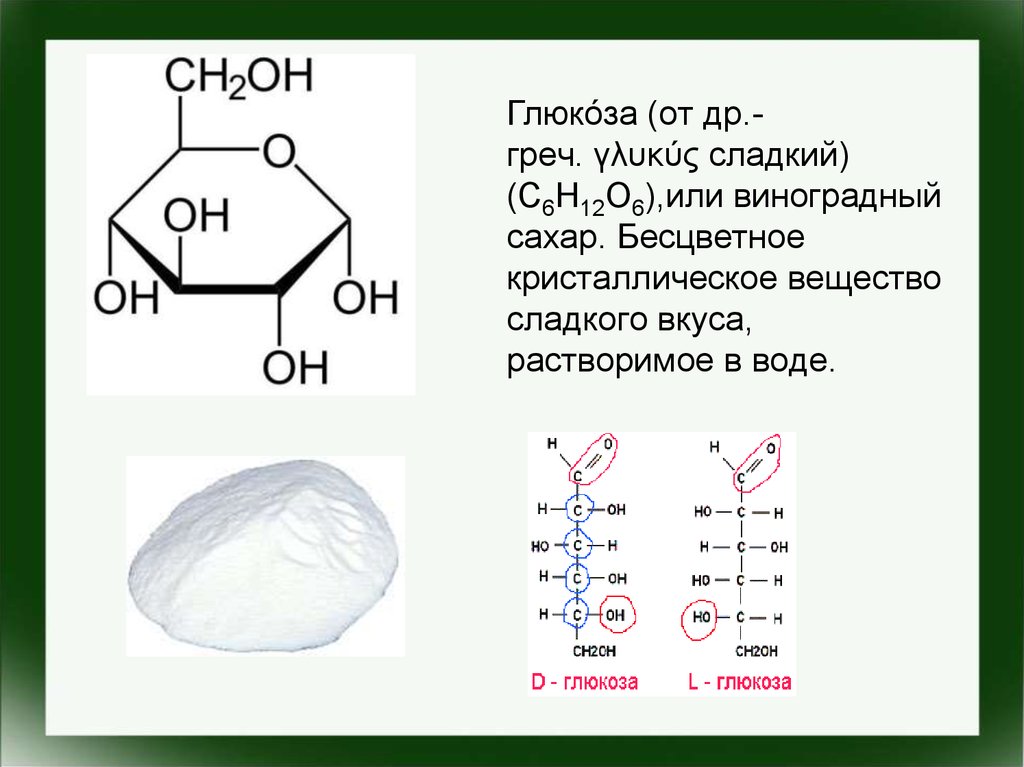
Глюко́за (от др.греч. γλυκύς сладкий)(C6H12O6),или виноградный
сахар. Бесцветное
кристаллическое вещество
сладкого вкуса,
растворимое в воде.
31.
Сахароза C12H22O11,свекловичныйили тростниковый сахар, в быту
просто сахар — дисахарид, состоящий
из двух моносахаридов — глюкозы и
фруктозы.
32.
33. Белки- биополимеры, в состав которых входит более 20 аминокислот.
Группа атомов -СО-NH-, образующаяся привзаимодействии молекул аминокислот,
называется пептидной, или амидной группой, а
связь между атомами углерода и азота в ней –
пептидной, или амидной.
34.
Цветные реакции белковКсантопротеиновая. С азотной
кислотой белки дают желтое
окрашивание, переходящее при
действии аммиака в оранжевое.
Биуретовая. С солями меди и щелочами
белки дают фиолетовую окраску.
















 chemistry
chemistry








