Similar presentations:
Моторные белки
1.
МОТОРНЫЕ БЕЛКИ1
2.
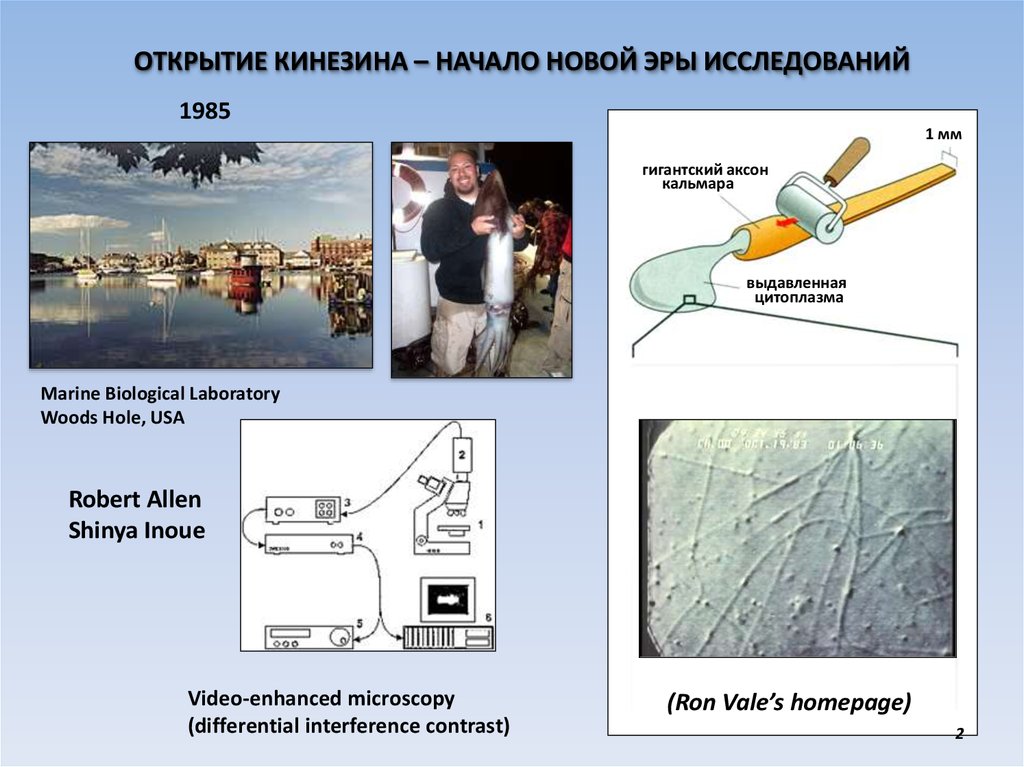
ОТКРЫТИЕ КИНЕЗИНА – НАЧАЛО НОВОЙ ЭРЫ ИССЛЕДОВАНИЙ1985
1 мм
гигантский аксон
кальмара
выдавленная
цитоплазма
Marine Biological Laboratory
Woods Hole, USA
Robert Allen
Shinya Inoue
Video-enhanced microscopy
(differential interference contrast)
(Ron Vale’s homepage)
2
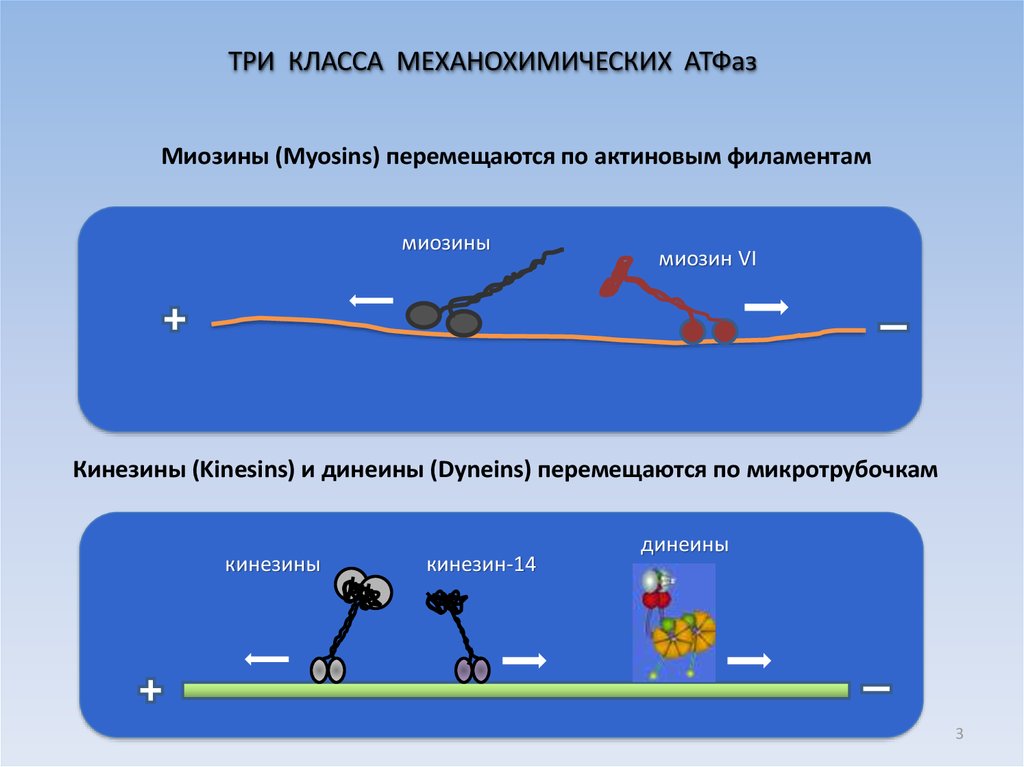
3.
ТРИ КЛАССА МЕХАНОХИМИЧЕСКИХ АТФазМиозины (Myosins) перемещаются по актиновым филаментам
миозины
миозин VI
Кинезины (Kinesins) и динеины (Dyneins) перемещаются по микротрубочкам
кинезины
кинезин-14
динеины
3
4.
МИОЗИН II ИЗ СКЕЛЕТНЫХ МЫШЦМоторные головки
Легкие цепи
Coiled coil - хвост
2 нм
шея
150 нм
Тяжелые цепи ~200 кДа
Легкие цепи ~ 20 кДа
R-LC
E-LC
Область антипараллельного
перекрывания хвостов
500 нм
Миозиновые головки
4
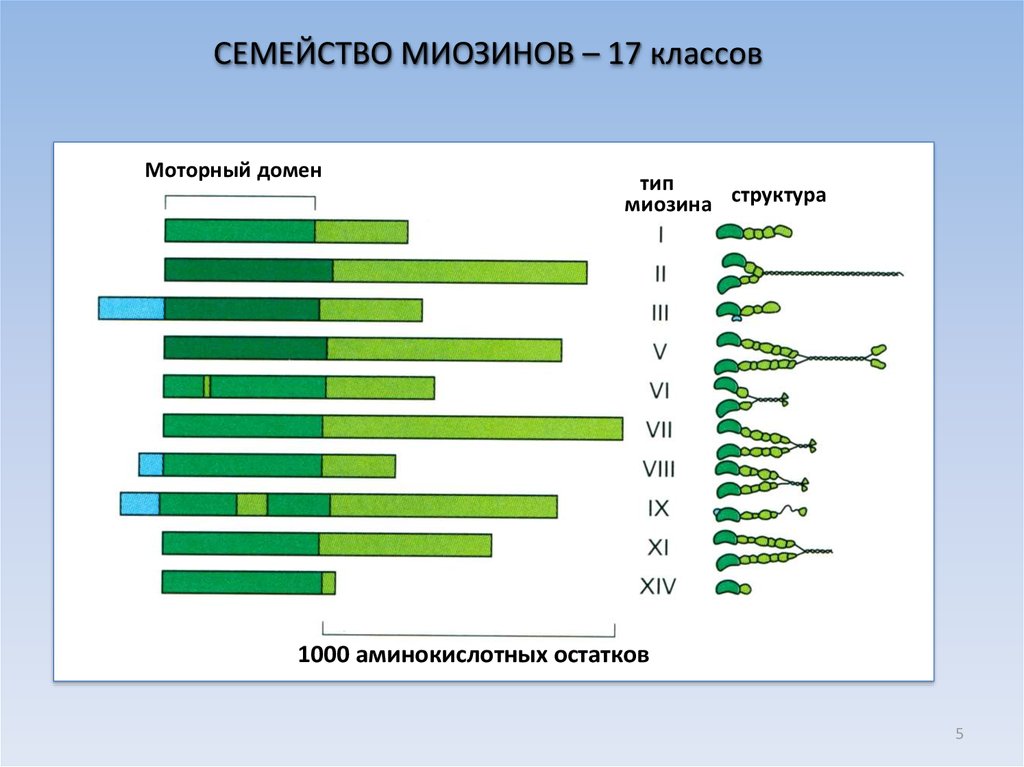
5.
СЕМЕЙСТВО МИОЗИНОВ – 17 классовМоторный домен
тип
миозина структура
1000 аминокислотных остатков
5
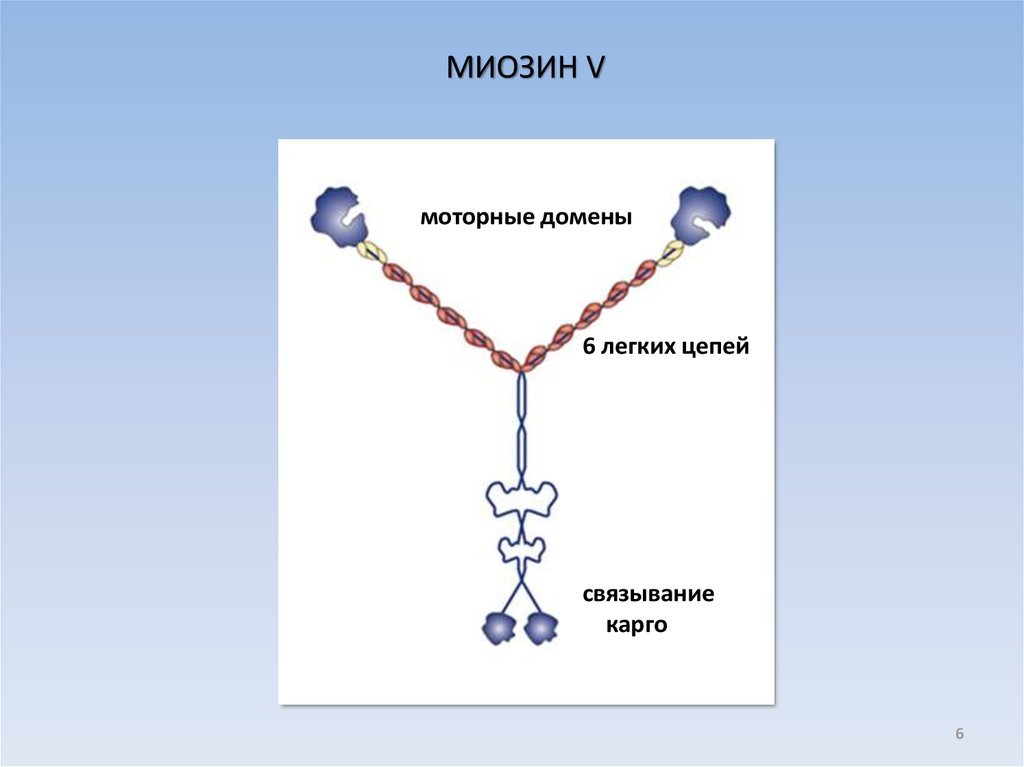
6.
МИОЗИН Vмоторные домены
6 легких цепей
связывание
карго
6
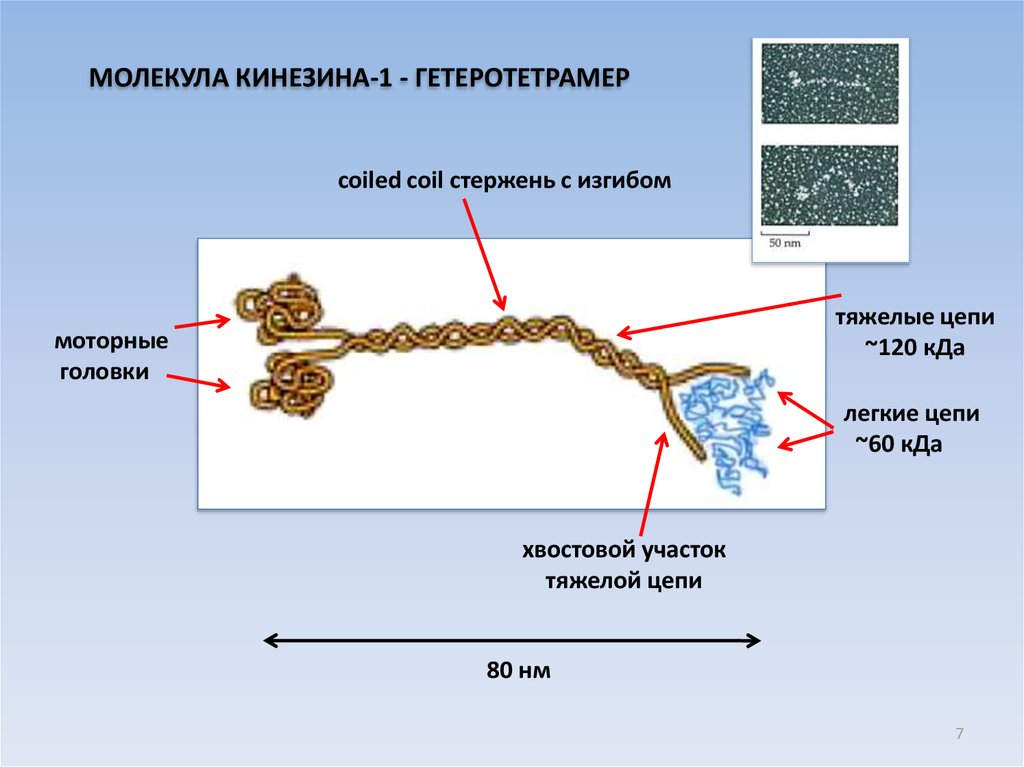
7.
МОЛЕКУЛА КИНЕЗИНА-1 - ГЕТЕРОТЕТРАМЕРcoiled coil стержень с изгибом
тяжелые цепи
~120 кДа
моторные
головки
легкие цепи
~60 кДа
хвостовой участок
тяжелой цепи
80 нм
7
8.
89.
Кинезины, идентифицированные в мышиКИНЕЗИНЫ: ДОМЕННАЯ СТРУКТУРА
кинезин-3
Моторный домен:
• 360 аминокислотных остатков
• АТФазный центр
• участок связывания с
микротрубочкой
кинезин-2
кинезин -4
кинезин-1
Coiled coil домен:
• параллельная димеризация
• разнесение в пространстве
моторного домена и участка
связывания карго
Хвостовой домен:
• связывание аксессорных
субъединиц
• взаимодействие с карго
• регуляторные участки
кинезин-3
кинезин-2
кинезин-4
кинезин-13
кинезин-14
(Hirokawa et al., 2009)
9
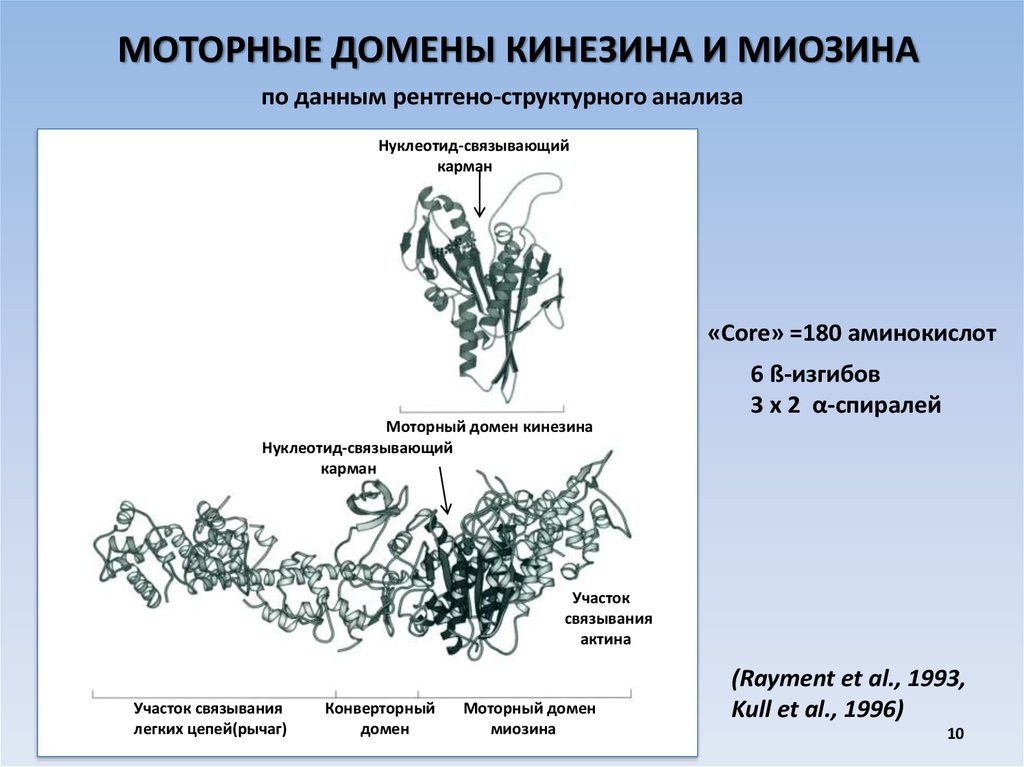
10.
МОТОРНЫЕ ДОМЕНЫ КИНЕЗИНА И МИОЗИНАпо данным рентгено-структурного анализа
Нуклеотид-связывающий
карман
«Core» =180 аминокислот
6 ß-изгибов
3 х 2 α-спиралей
Моторный домен кинезина
Нуклеотид-связывающий
карман
Участок
связывания
актина
Участок связывания
легких цепей(рычаг)
Конверторный
домен
Моторный домен
миозина
(Rayment et al., 1993,
Kull et al., 1996)
10
11.
МЕХАНОХИМИЧЕСКИЙ ЦИКЛМЫШЕЧНОГО МИОЗИНА
ATP
активация полимерным актином
АТФазной активности = 200х
ADP+Pi
1. Связывание АТФ – диссоциация от актина
2. Гидролиз АТФ – подъем плеча рычага
Pi
3. Связывание с актином – освобождение фосфата
ADP
ATP
4. Освобождение фосфата - прочное связывание
с актином с последующим поворотом рычага
5. Освобождение АДФ – обмен на АТФ в связанном
с актином состоянии
11
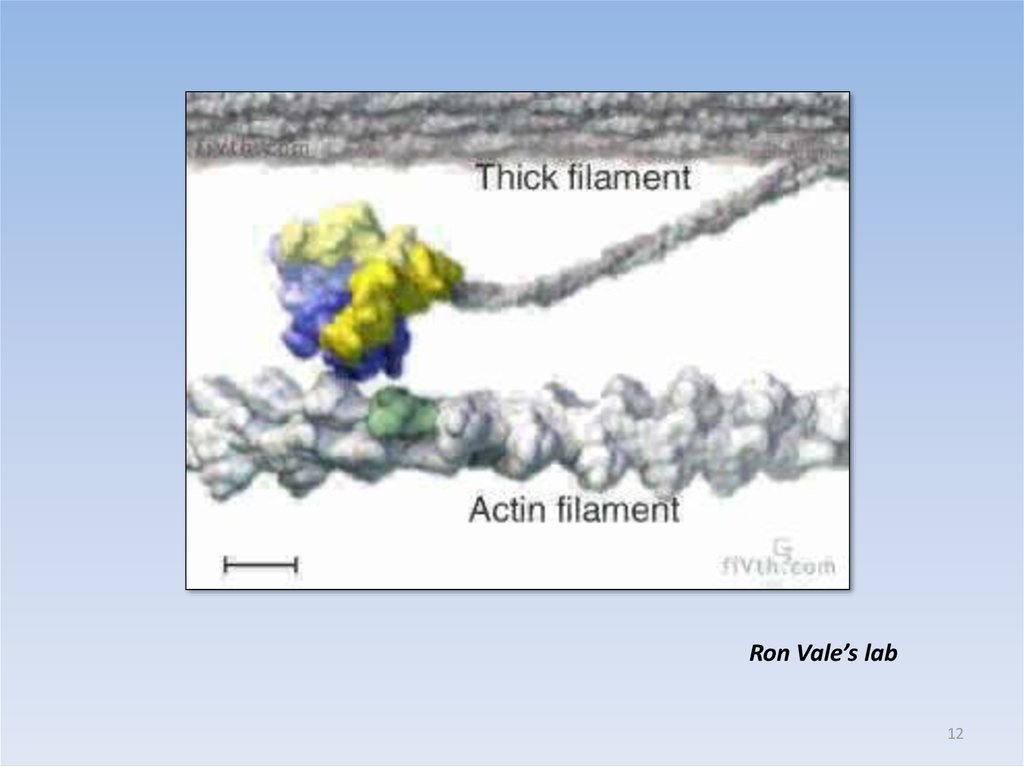
12.
Ron Vale’s lab12
13.
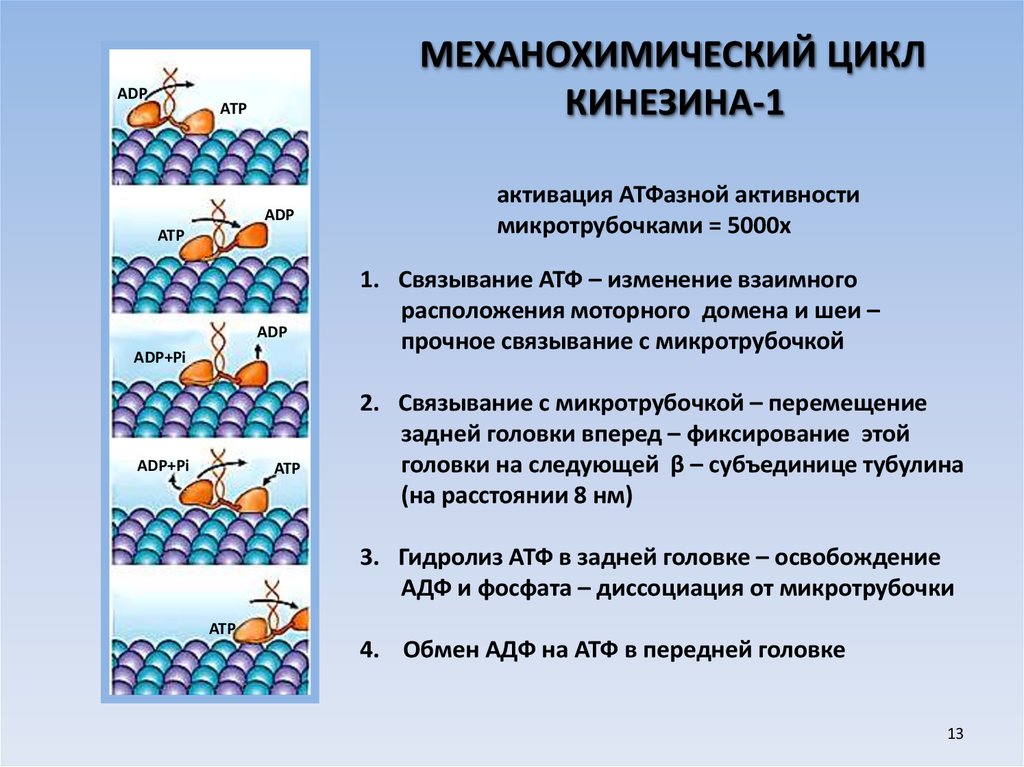
ADPМЕХАНОХИМИЧЕСКИЙ ЦИКЛ
КИНЕЗИНА-1
ATP
ADP
ATP
ADP
ADP+Pi
ADP+Pi
ATP
активация АТФазной активности
микротрубочками = 5000х
1. Связывание АТФ – изменение взаимного
расположения моторного домена и шеи –
прочное связывание с микротрубочкой
2. Связывание с микротрубочкой – перемещение
задней головки вперед – фиксирование этой
головки на следующей β – субъединице тубулина
(на расстоянии 8 нм)
3. Гидролиз АТФ в задней головке – освобождение
АДФ и фосфата – диссоциация от микротрубочки
ATP
4. Обмен АДФ на АТФ в передней головке
13
14.
(Ron Vale’s lab)14
15.
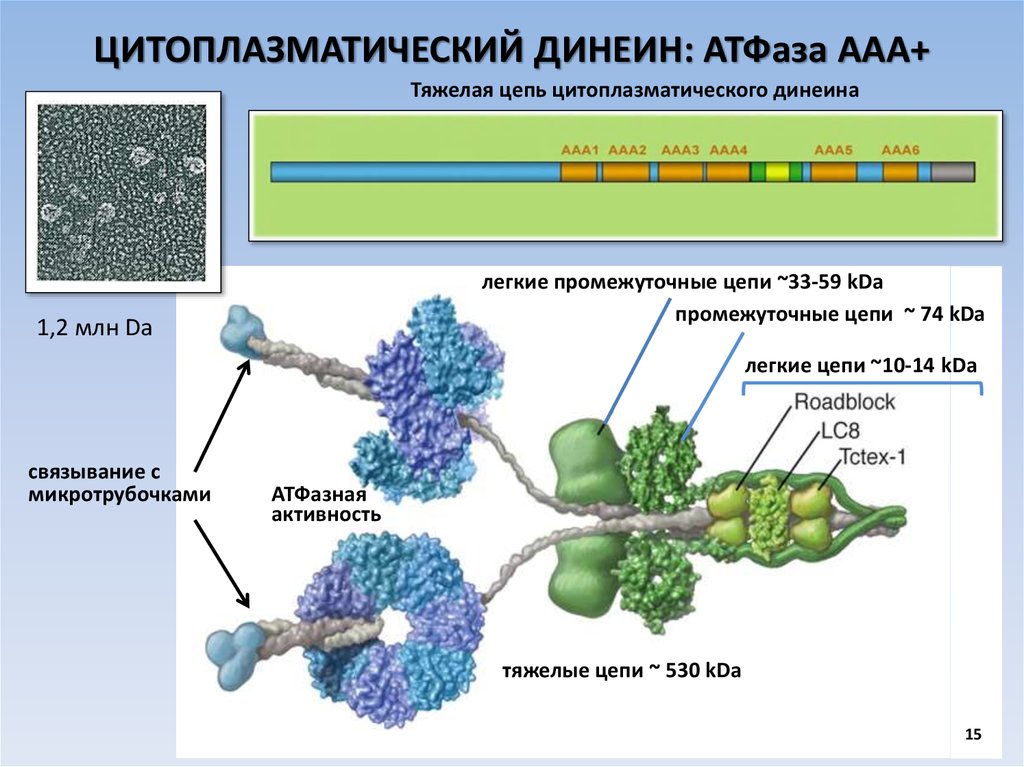
ЦИТОПЛАЗМАТИЧЕСКИЙ ДИНЕИН: АТФаза ААА+Тяжелая цепь цитоплазматического динеина
легкие промежуточные цепи ~33-59 kDa
промежуточные цепи ~ 74 kDa
1,2 млн Da
легкие цепи ~10-14 kDa
связывание с
микротрубочками
АТФазная
активность
тяжелые цепи ~ 530 kDa
15
16.
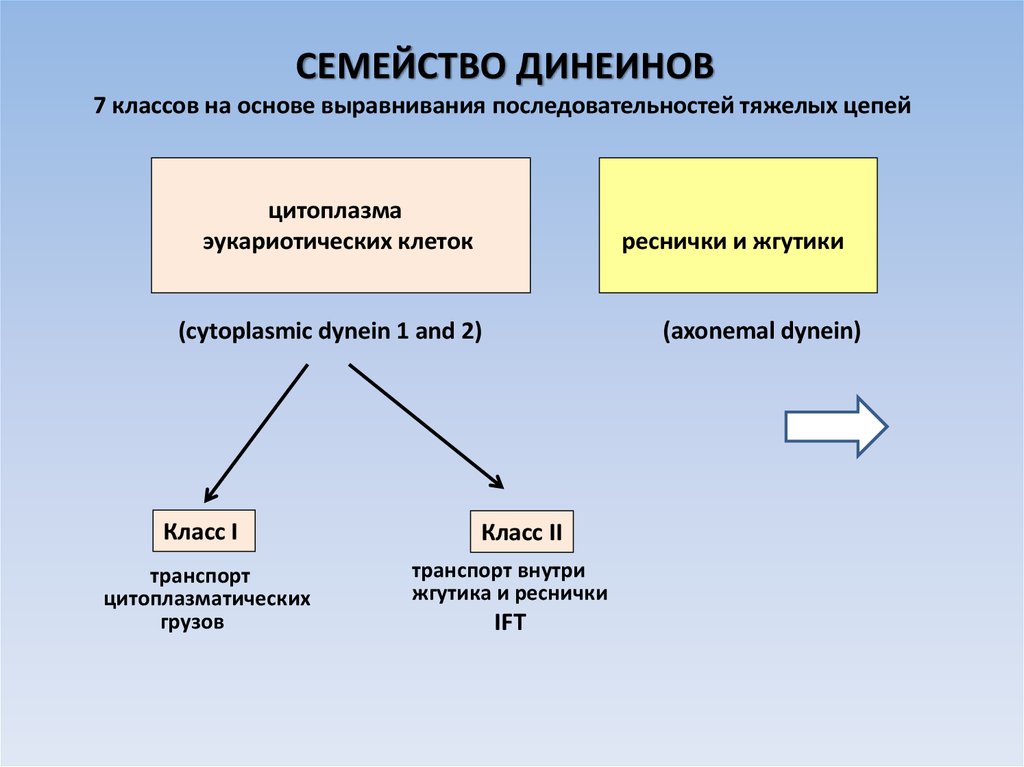
СЕМЕЙСТВО ДИНЕИНОВ7 классов на основе выравнивания последовательностей тяжелых цепей
цитоплазма
эукариотических клеток
реснички и жгутики
(axonemal dynein)
(cytoplasmic dynein 1 and 2)
Класс I
транспорт
цитоплазматических
грузов
Класс II
транспорт внутри
жгутика и реснички
IFT
17.
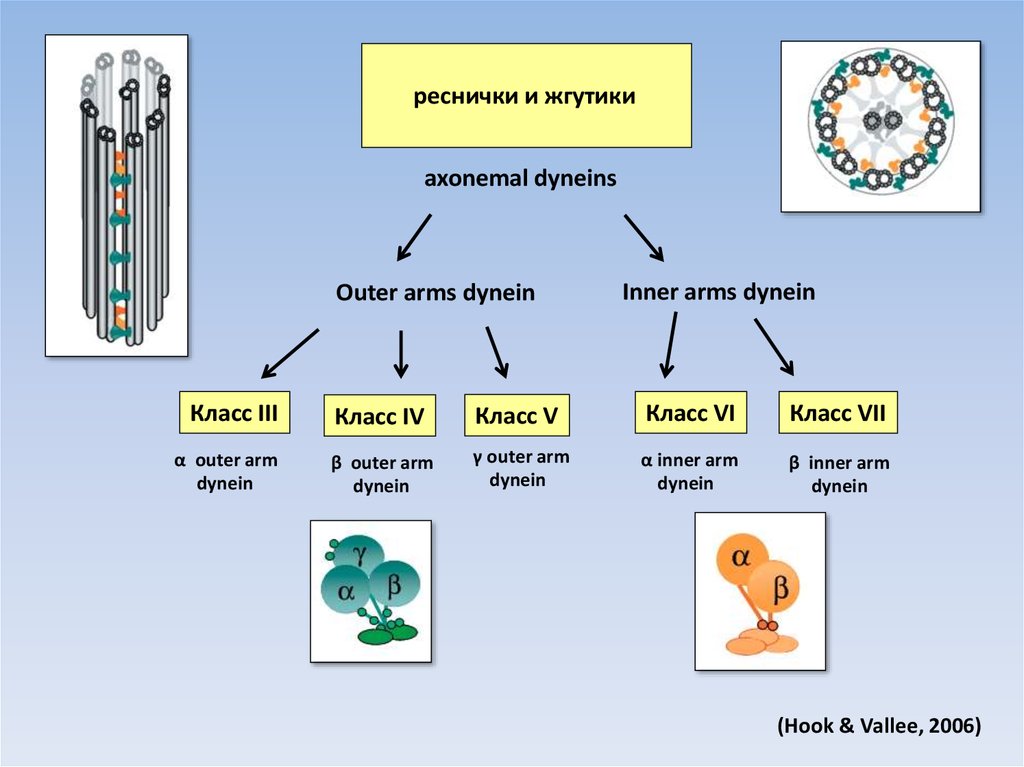
реснички и жгутикиaxonemal dyneins
Outer arms dynein
Класс III
α outer arm
dynein
Inner arms dynein
Класс IV
Класс V
Класс VI
Класс VII
β outer arm
dynein
γ outer arm
dynein
α inner arm
dynein
β inner arm
dynein
(Hook & Vallee, 2006)
18.
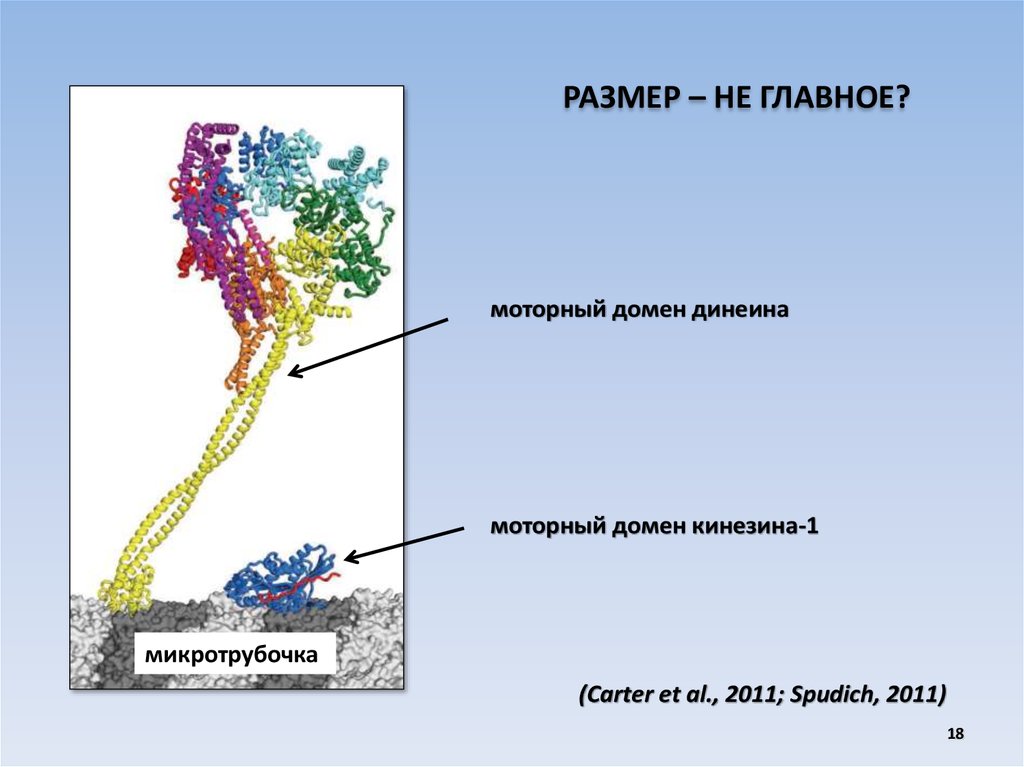
РАЗМЕР – НЕ ГЛАВНОЕ?моторный домен динеина
моторный домен кинезина-1
микротрубочка
(Carter et al., 2011; Spudich, 2011)
18
19.
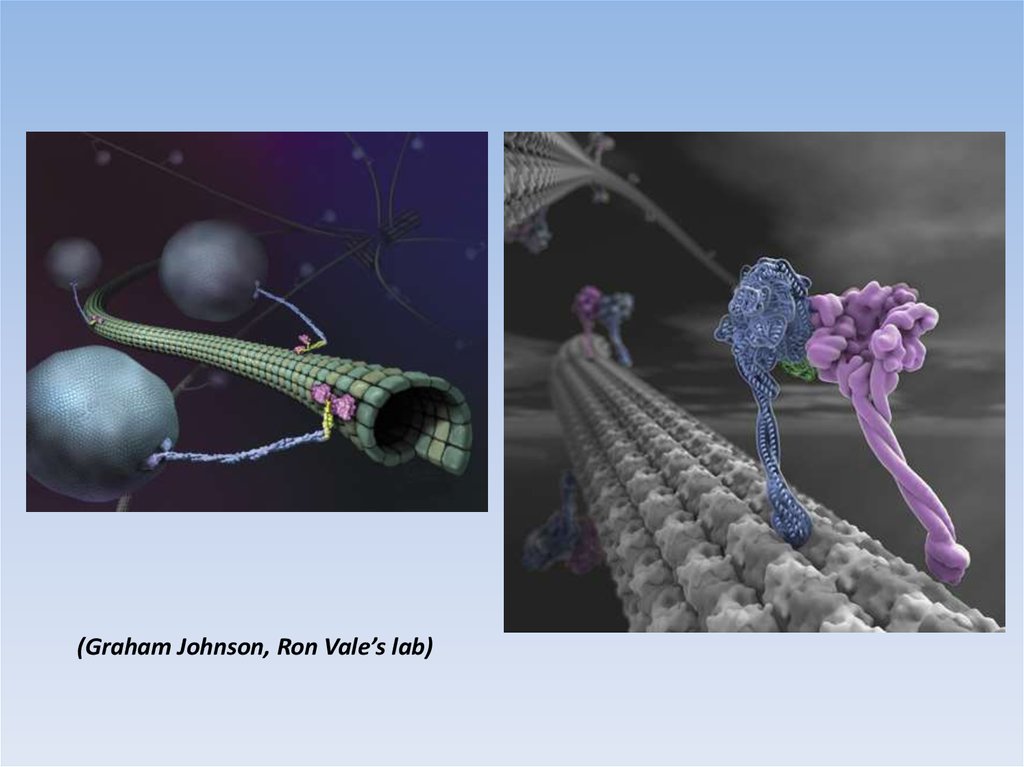
(Graham Johnson, Ron Vale’s lab)20.
СПОСОБЫ ИЗУЧЕНИЯ МОТОРНЫХ БЕЛКОВ• Электронная микроскопия отдельных молекул с напылением металлом
• Рентгеноструктурный анализ: трехмерная структура молекул
• Криоэлектронная микроскопия: докинг моторных белков на треке
• Атомно-силовая микроскопия: динамика взаимодействия мотора с треком
•Генетические манипуляции: идентификация важных участков белковых цепей
•In vitro motility assay + оптические ловушка и пинцет: измерение скоростей и сил
20
21.
КАК РАБОТАЮТ МОЛЕКУЛЯРНЫЕ МОТОРЫ?Происходит ли изменение конформации при гидролизе АТФ?
Как определяется направление?
От чего зависит процессивность мотора?
Какова скорость движения мотора вдоль трека ?
Какую силу развивают моторные белки?
Шаги: как и на какое расстояние?
Траектория ?
-----------------------------------------Взаимодействие с треком?
Взаимодействие с карго?
22.
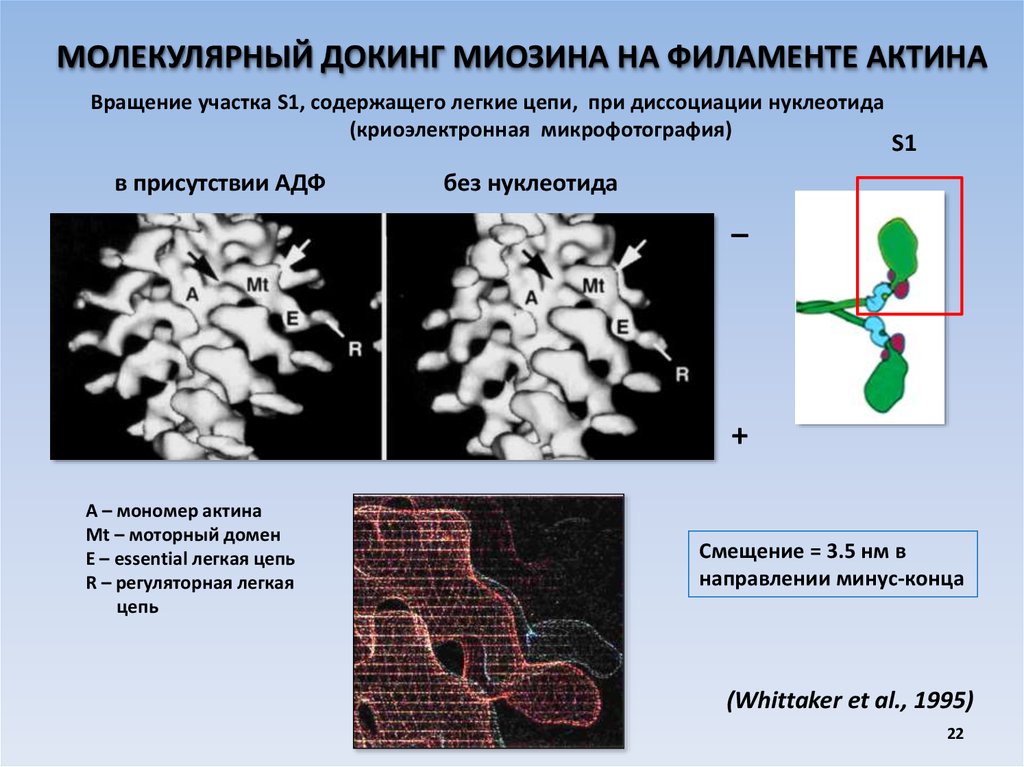
МОЛЕКУЛЯРНЫЙ ДОКИНГ МИОЗИНА НА ФИЛАМЕНТЕ АКТИНАВращение участка S1, содержащего легкие цепи, при диссоциации нуклеотида
(криоэлектронная микрофотография)
в присутствии АДФ
S1
без нуклеотида
_
+
А – мономер актина
Mt – моторный домен
Е – essential легкая цепь
R – регуляторная легкая
цепь
Смещение = 3.5 нм в
направлении минус-конца
(Whittaker et al., 1995)
22
23.
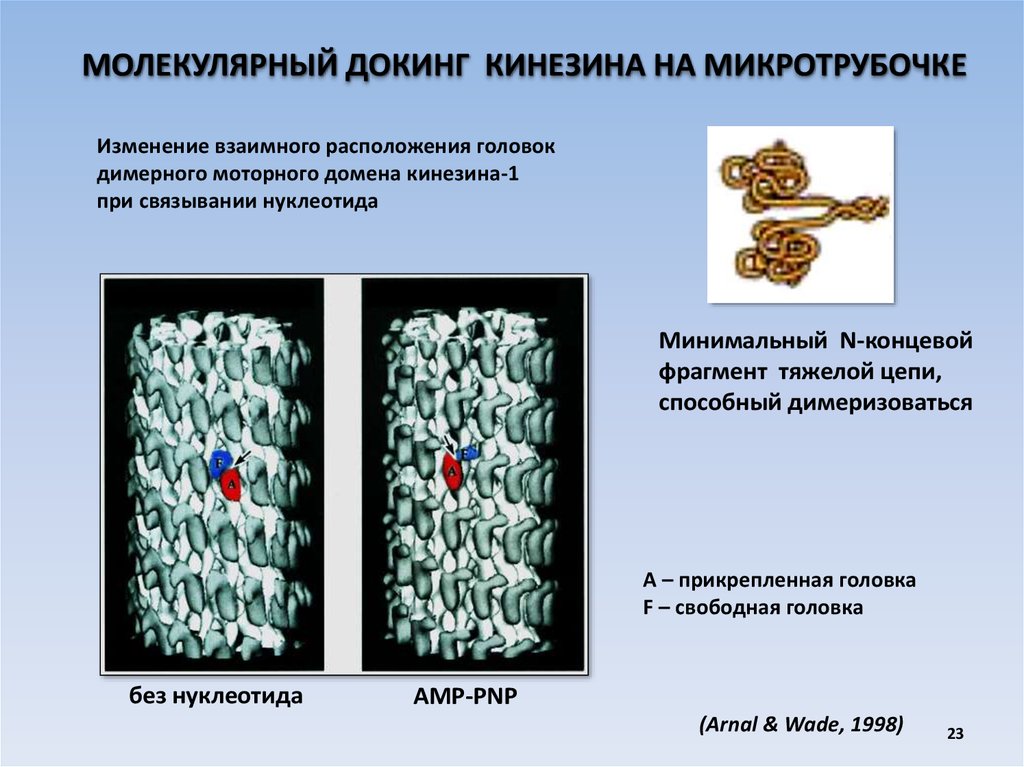
МОЛЕКУЛЯРНЫЙ ДОКИНГ КИНЕЗИНА НА МИКРОТРУБОЧКЕИзменение взаимного расположения головок
димерного моторного домена кинезина-1
при связывании нуклеотида
без нуклеотида
AMP-PNP
Минимальный N-концевой
фрагмент тяжелой цепи,
способный димеризоваться
А – прикрепленная головка
F – свободная головка
без нуклеотида
AMP-PNP
(Arnal & Wade, 1998)
23
24.
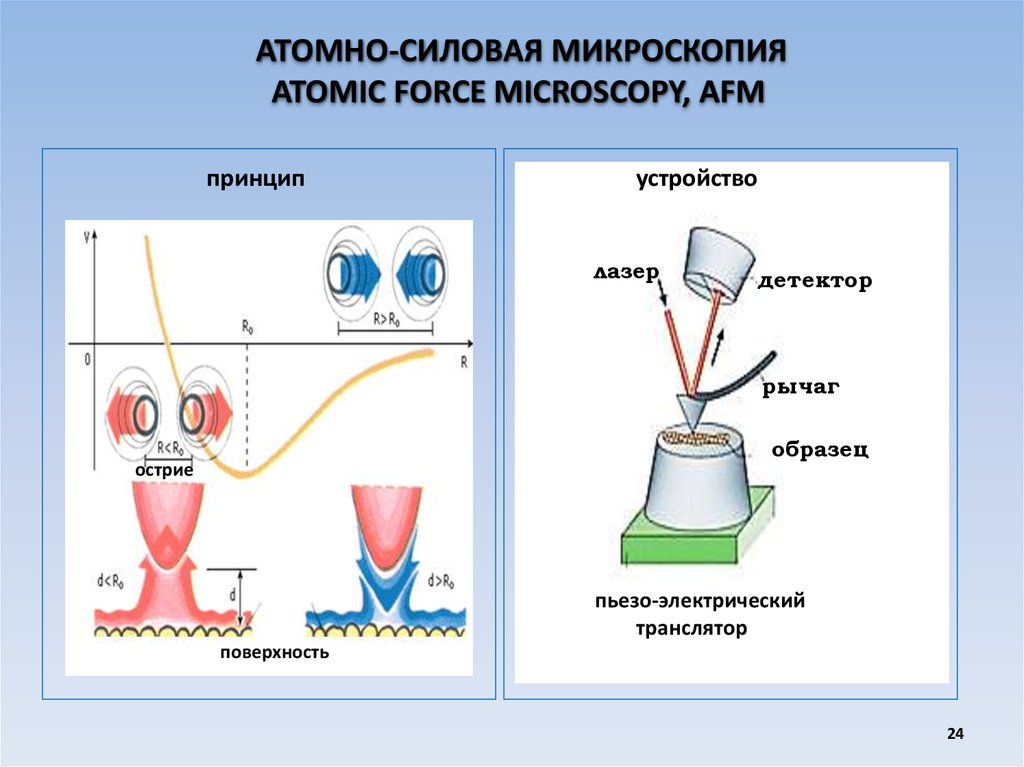
АТОМНО-СИЛОВАЯ МИКРОСКОПИЯATOMIC FORCE MICROSCOPY, AFM
принцип
устройство
лазер
детектор
рычаг
образец
острие
пьезо-электрический
транслятор
поверхность
24
25.
ПО СРАВНЕНИЮ С ЭЛЕКТРОННОЙ МИКРОСКОПИЕЙ AFM:• имеет близкое и даже большее разрешение
• дает трехмерное изображение объекта
• не требует фиксирования образца
• работает в водной или воздушной среде
----------------------------------------------------------------------------• маленькая площадь сканирования –
всего 150 х 150 мкм2 при глубине в несколько мкм
• низкая скорость сканирования
25
26.
ИЗОБРАЖЕНИЯ, ПОЛУЧЕННЫЕ С ПОМОЩЬЮАТОМНО-СИЛОВОЙ МИКРОСКОПИИ
Кинезин-1 на микротрубочке
in vitro в присутствии AMPPNP
(из обзора Veigel & Schmidt, 2011)
Миозин V шагает по актиновому
филаменту
26
27.
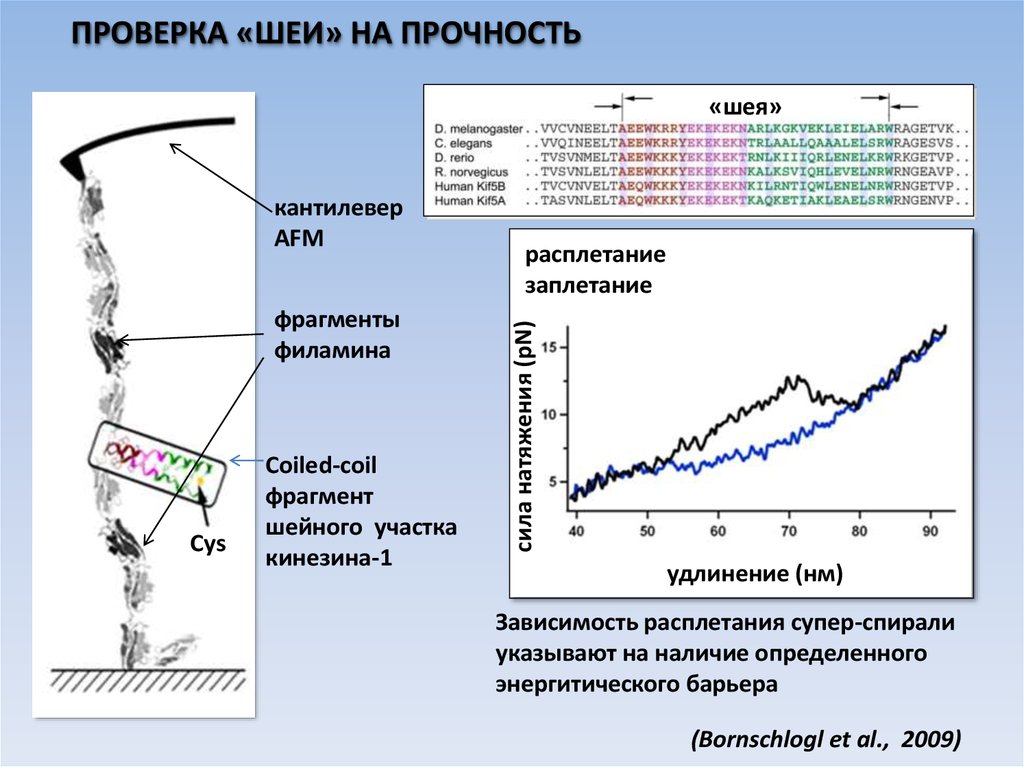
ПРОВЕРКА «ШЕИ» НА ПРОЧНОСТЬ«шея»
фрагменты
филамина
Cys
Coiled-coil
фрагмент
шейного участка
кинезина-1
расплетание
заплетание
cила натяжения (pN)
кантилевер
AFM
удлинение (нм)
Зависимость расплетания супер-спирали
указывают на наличие определенного
энергитического барьера
(Bornschlogl et al., 2009)
28.
НАПРАВЛЕННОСТЬ МОТОРА ОПРЕДЕЛЯЕТСЯНА ГРАНИЦЕ МОТОРНОГО ДОМЕНА И «ШЕИ»
полярность
1 13
моторный домен
шея
327 338
Coiled-coil stalk
хвост
975
Kin 1
1
хвост
шея
Coiled-coil stalk
моторный домен
329 349
700
Kin 14
13
326
ХИМЕРНЫЙ БЕЛОК 1
194
348
13
ХИМЕРНЫЙ БЕЛОК 2
194
326
346
(Endow & Waligora, 1998)
28
29.
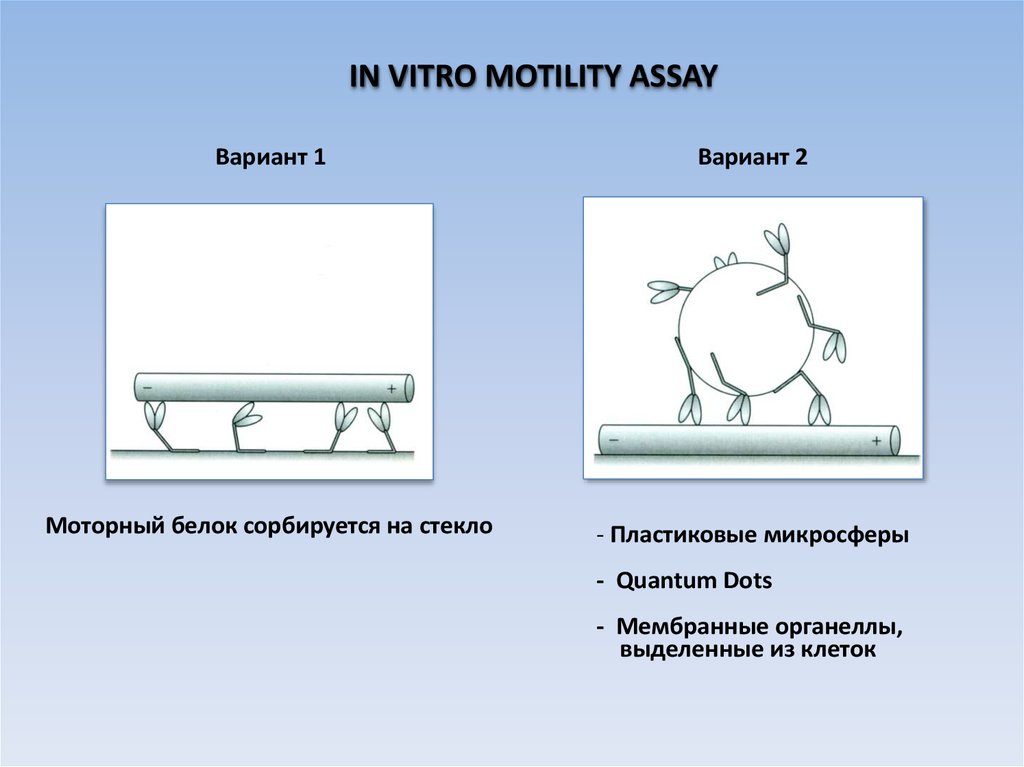
IN VITRO MOTILITY ASSAYВариант 1
Вариант 2
Моторный белок сорбируется на стекло
- Пластиковые микросферы
- Quantum Dots
- Мембранные органеллы,
выделенные из клеток
30.
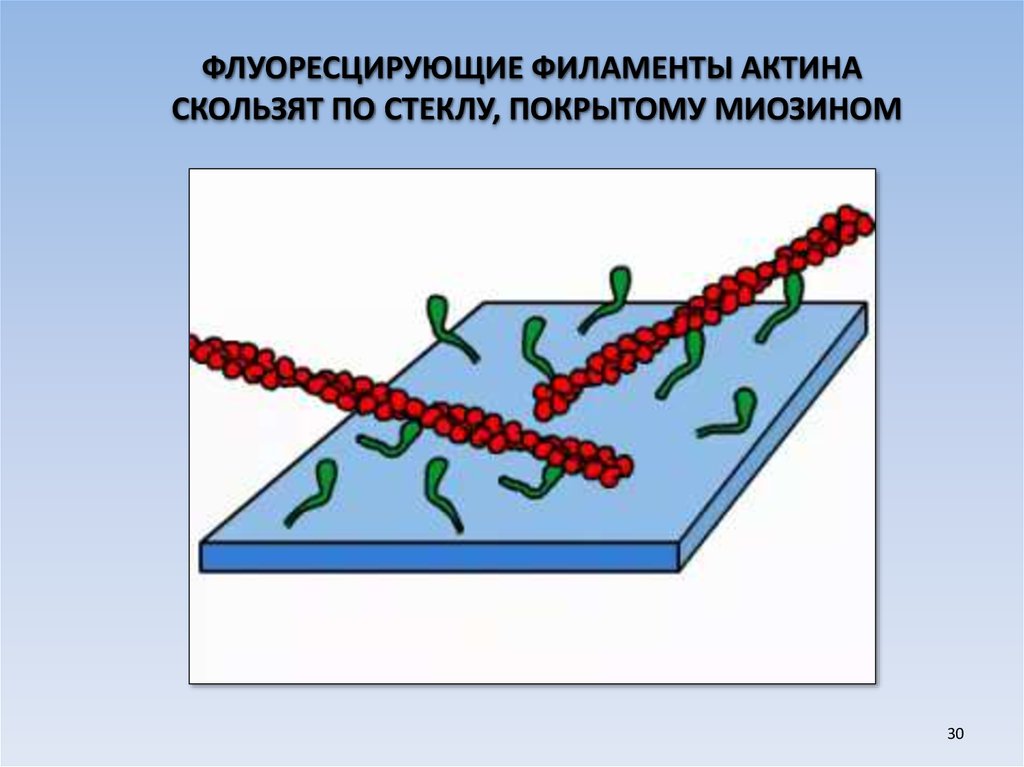
ФЛУОРЕСЦИРУЮЩИЕ ФИЛАМЕНТЫ АКТИНАСКОЛЬЗЯТ ПО СТЕКЛУ, ПОКРЫТОМУ МИОЗИНОМ
30
31.
дифференциальныйинтерференционный
контраст
32.
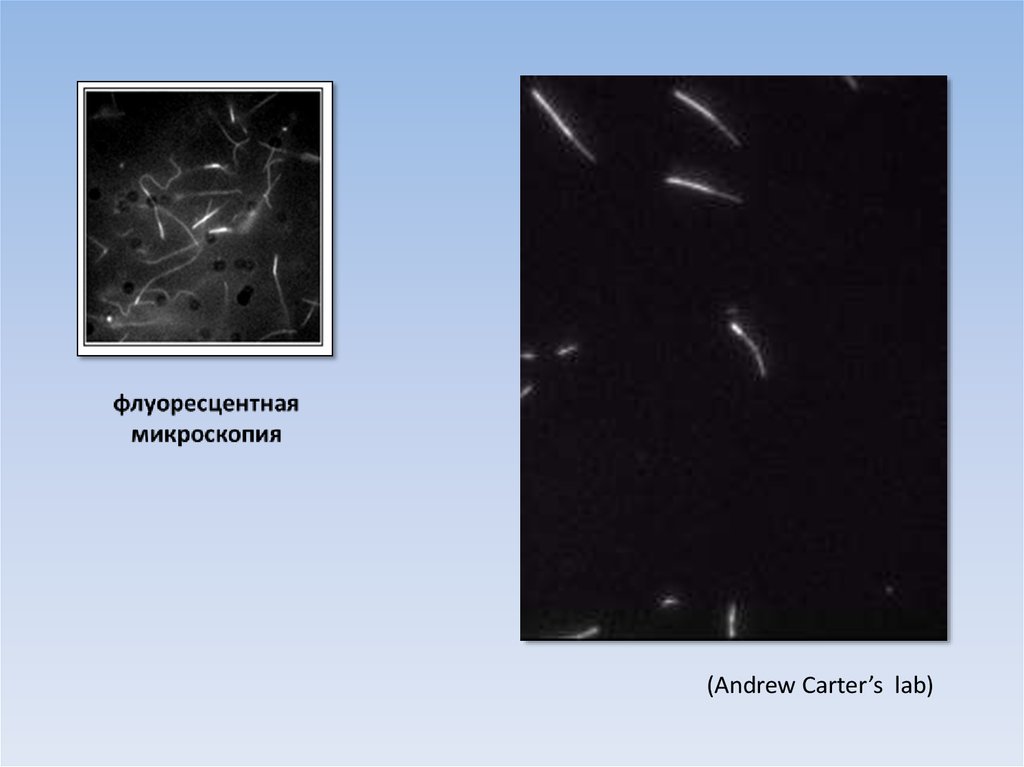
(Andrew Carter’s lab)33.
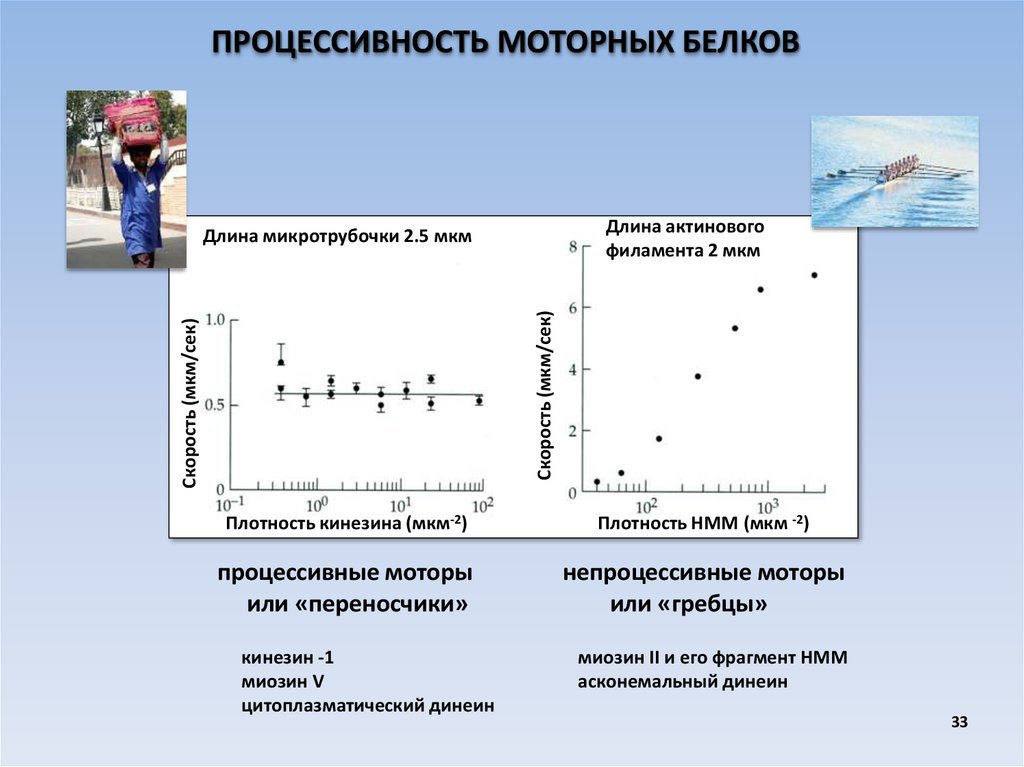
ПРОЦЕССИВНОСТЬ МОТОРНЫХ БЕЛКОВДлина актинового
филамента 2 мкм
Скорость (мкм/сек)
Скорость (мкм/сек)
Длина микротрубочки 2.5 мкм
Плотность кинезина (мкм-2)
Плотность НММ (мкм -2)
процессивные моторы
или «переносчики»
непроцессивные моторы
или «гребцы»
кинезин -1
миозин V
цитоплазматический динеин
миозин II и его фрагмент НММ
асконемальный динеин
33
34.
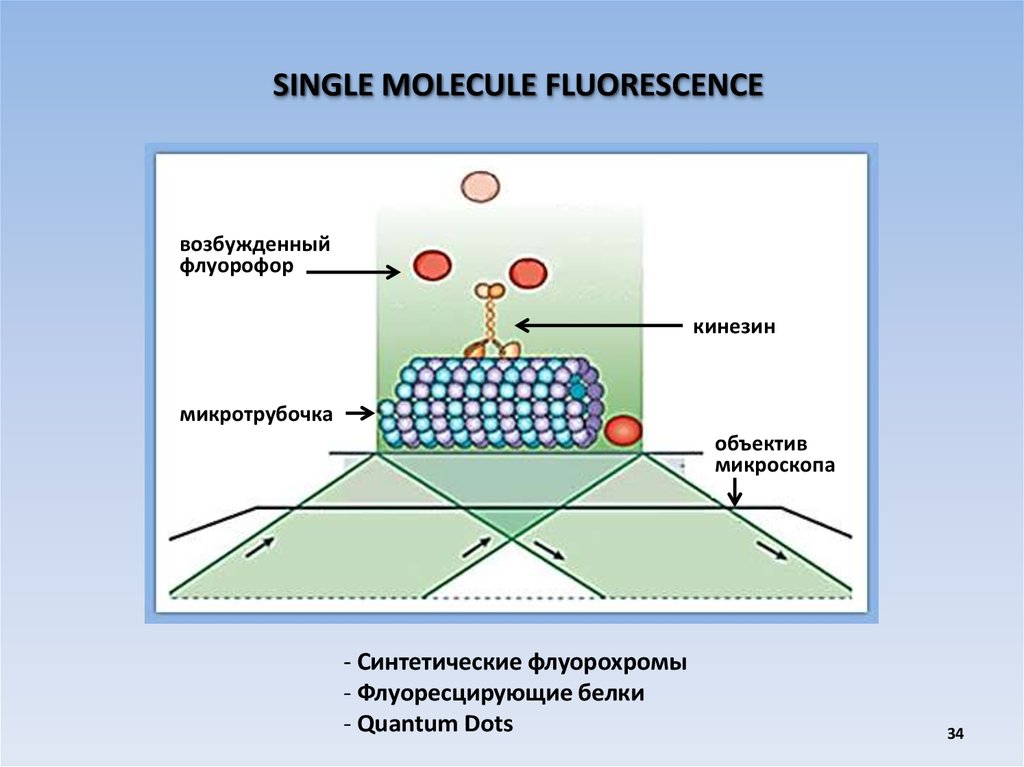
SINGLE MOLECULE FLUORESCENCEвозбужденный
флуорофор
кинезин
микротрубочка
объектив
микроскопа
- Синтетические флуорохромы
- Флуоресцирующие белки
- Quantum Dots
34
35.
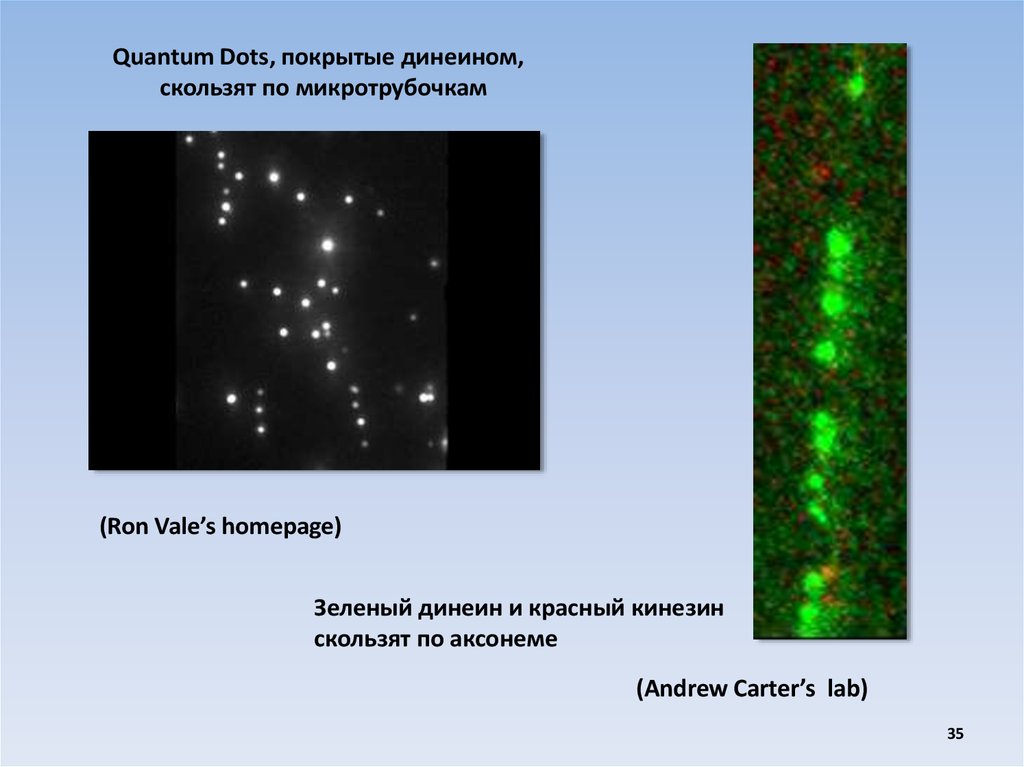
Quantum Dots, покрытые динеином,скользят по микротрубочкам
(Ron Vale’s homepage)
Зеленый динеин и красный кинезин
скользят по аксонеме
(Andrew Carter’s lab)
35
36.
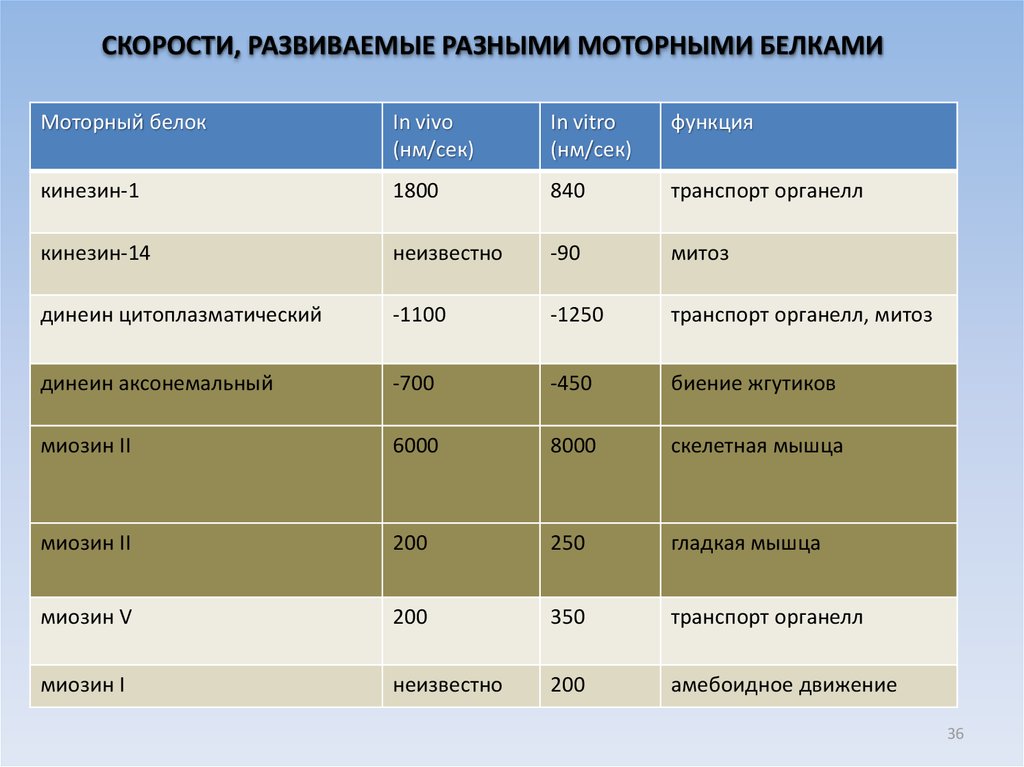
СКОРОСТИ, РАЗВИВАЕМЫЕ РАЗНЫМИ МОТОРНЫМИ БЕЛКАМИМоторный белок
In vivo
(нм/сек)
In vitro
(нм/сек)
функция
кинезин-1
1800
840
транспорт органелл
кинезин-14
неизвестно
-90
митоз
динеин цитоплазматический
-1100
-1250
транспорт органелл, митоз
динеин аксонемальный
-700
-450
биение жгутиков
миозин II
6000
8000
скелетная мышца
миозин II
200
250
гладкая мышца
миозин V
200
350
транспорт органелл
миозин I
неизвестно
200
амебоидное движение
36
37.
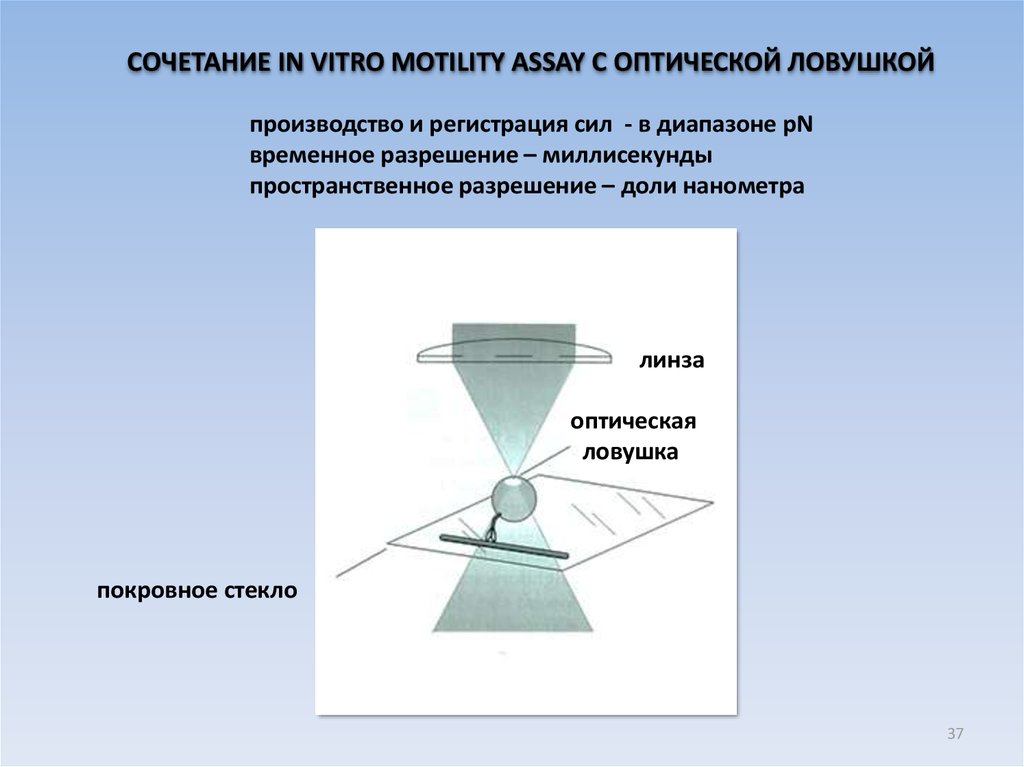
СОЧЕТАНИЕ IN VITRO MOTILITY ASSAY С ОПТИЧЕСКОЙ ЛОВУШКОЙпроизводство и регистрация сил - в диапазоне pN
временное разрешение – миллисекунды
пространственное разрешение – доли нанометра
линза
оптическая
ловушка
покровное стекло
37
38.
КИНЕЗИН-1 НЕСЕТ МИКРОСФЕРУ ПО МИКРОТРУБОЧКЕСвободное движение
Движение в оптической ловушке
(S. Block’s lab)
38
39.
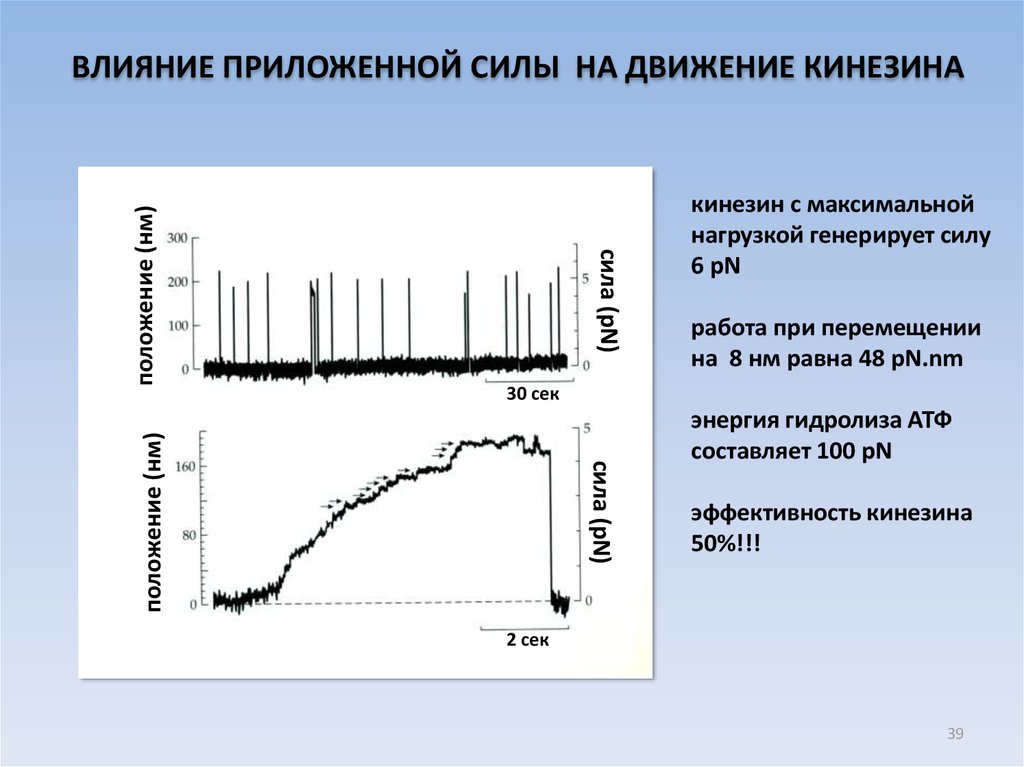
сила (pN)кинезин с максимальной
нагрузкой генерирует силу
6 pN
работа при перемещении
на 8 нм равна 48 pN.nm
30 сек
сила (pN)
положение (нм)
положение (нм)
ВЛИЯНИЕ ПРИЛОЖЕННОЙ СИЛЫ НА ДВИЖЕНИЕ КИНЕЗИНА
энергия гидролиза АТФ
составляет 100 pN
эффективность кинезина
50%!!!
2 сек
39
40.
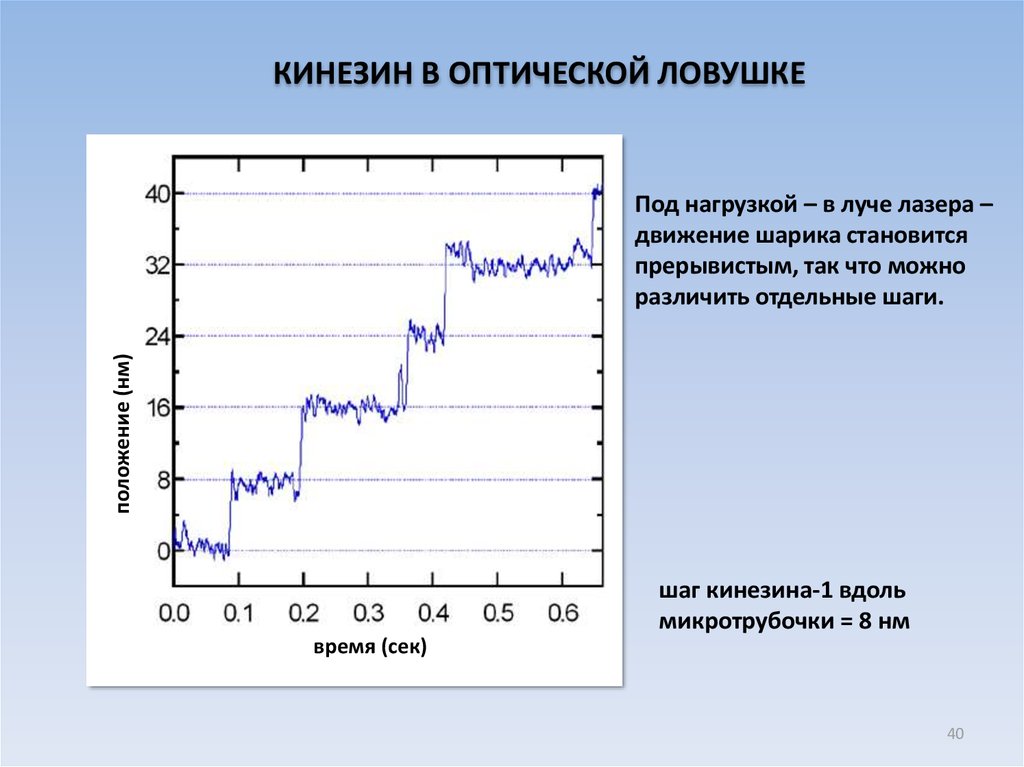
КИНЕЗИН В ОПТИЧЕСКОЙ ЛОВУШКЕположение (нм)
Под нагрузкой – в луче лазера –
движение шарика становится
прерывистым, так что можно
различить отдельные шаги.
шаг кинезина-1 вдоль
микротрубочки = 8 нм
время (сек)
40
41.
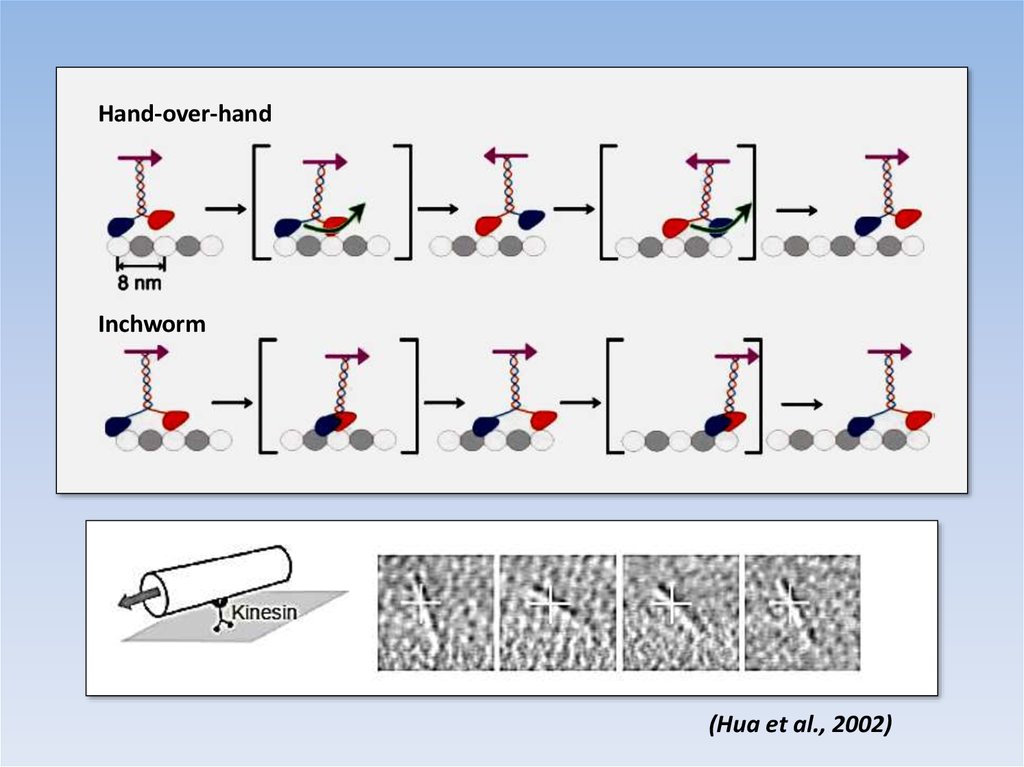
Hand-over-handInchworm
(Hua et al., 2002)
42.
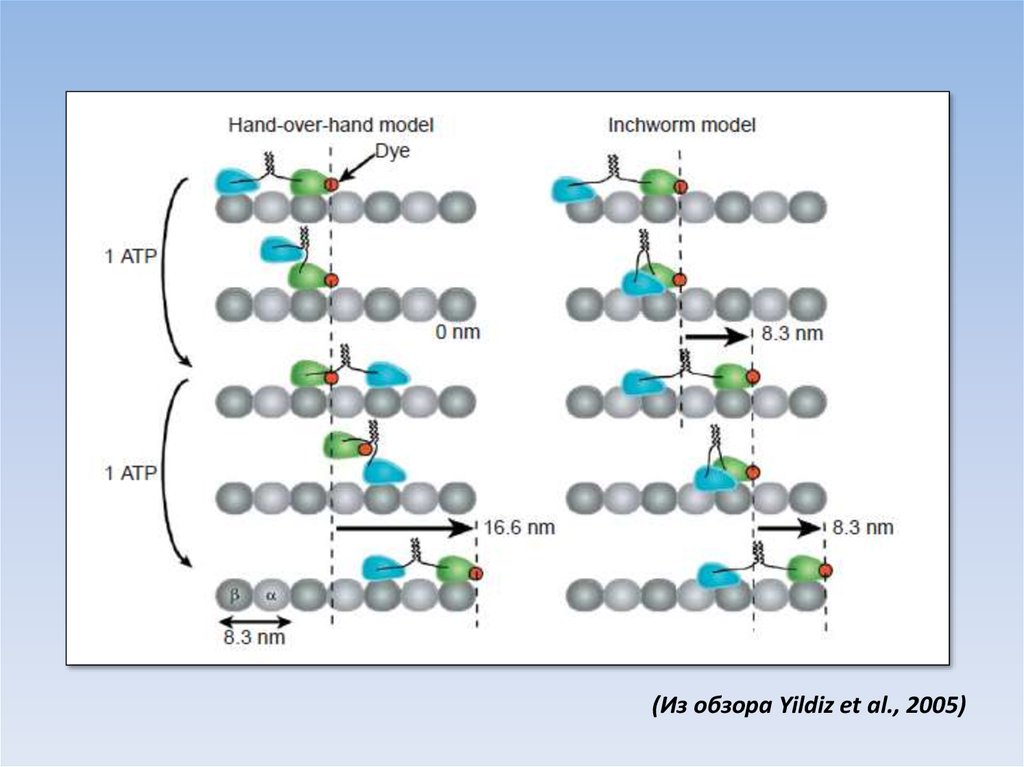
(Из обзора Yildiz et al., 2005)43.
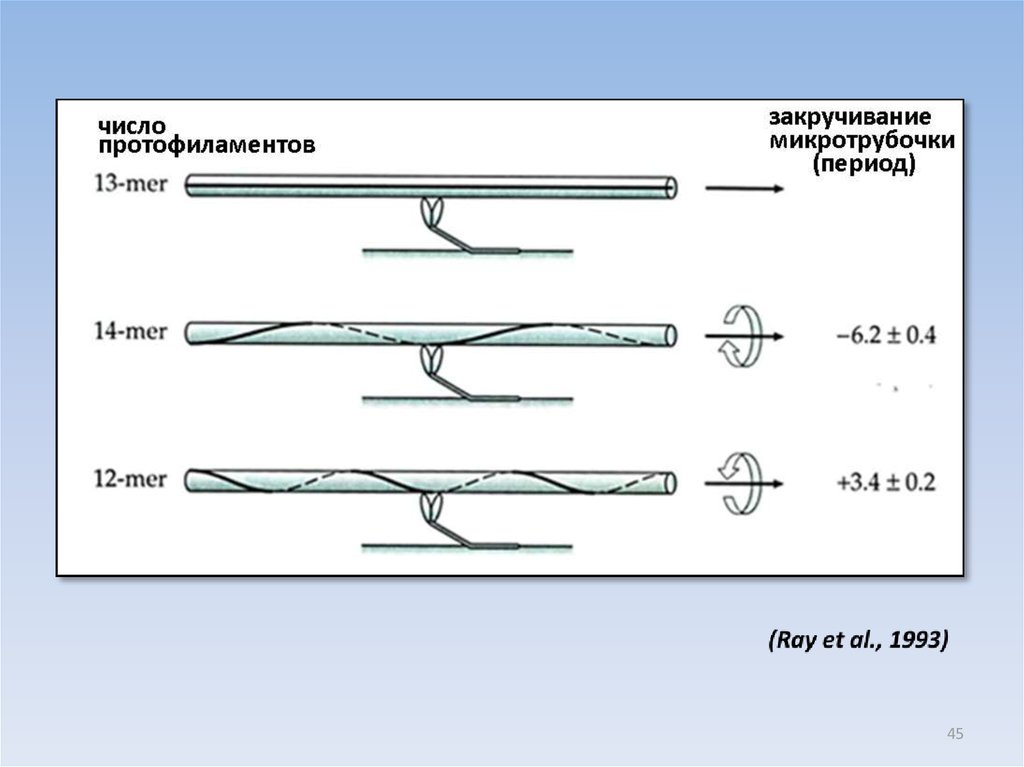
МИКРОТРУБОЧКИ, СОБРАННЫЕ ИЗ ЧИСТОГО ТУБУЛИНА IN VITRO,МОГУТ СОДЕРЖАТЬ РАЗНОЕ ЧИСЛО ПРОТОФИЛАМЕНТОВ
12 13 14
Процентное содержание микротрубочек
---------------------------------------------------------12
13
14
cобранные на
аксонемах
1
90
9
Фосфат - таксол
77
11
2
PIPES -глицерин
6
39
53
PIPES-DMSO
0
14
72
MES-глицерин
4
78
15
43
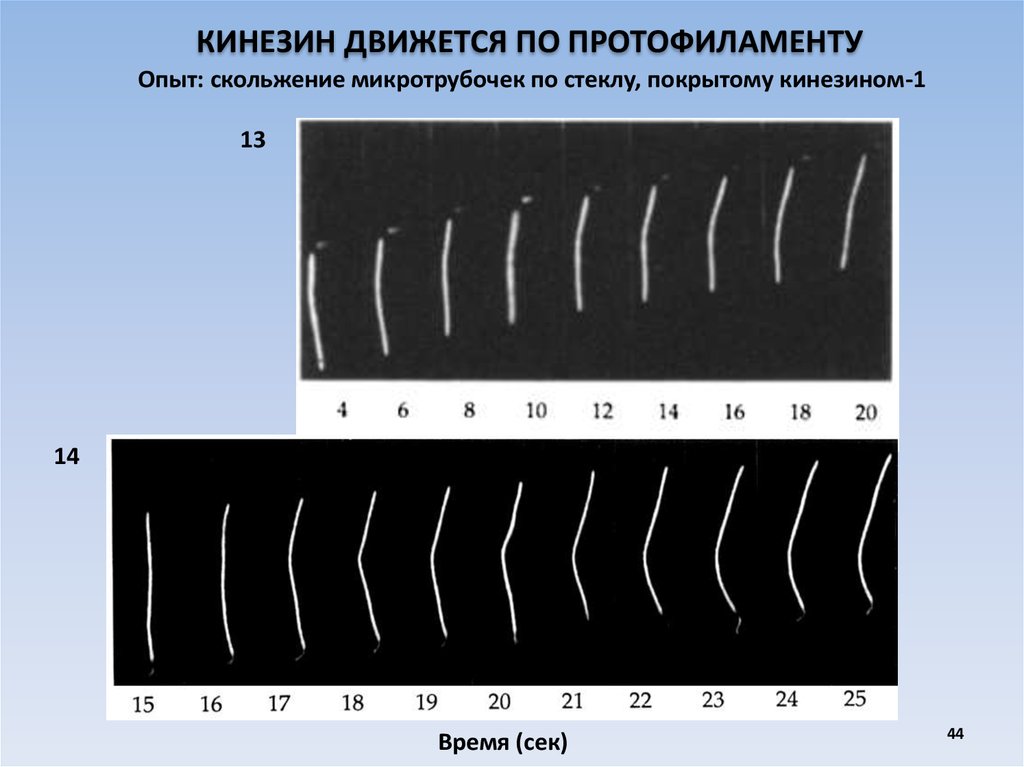
44.
КИНЕЗИН ДВИЖЕТСЯ ПО ПРОТОФИЛАМЕНТУОпыт: скольжение микротрубочек по стеклу, покрытому кинезином-1
13
14
Время (сек)
44
45.
4546.
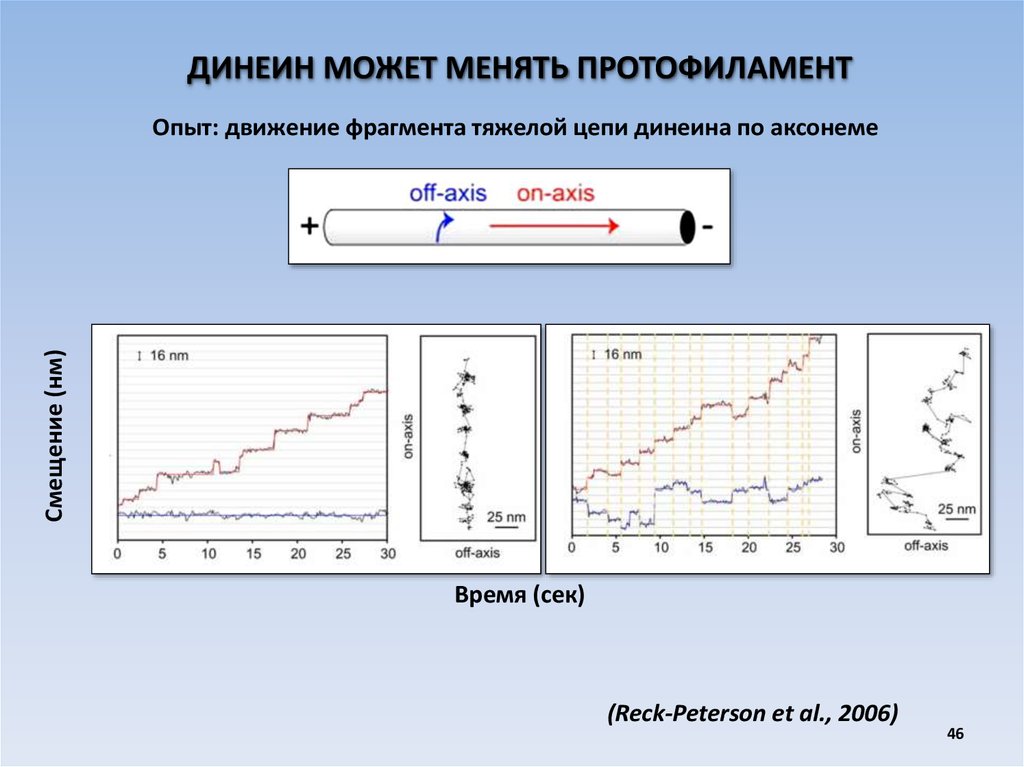
ДИНЕИН МОЖЕТ МЕНЯТЬ ПРОТОФИЛАМЕНТСмещение (нм)
Опыт: движение фрагмента тяжелой цепи динеина по аксонеме
Время (сек)
(Reck-Peterson et al., 2006)
46














 biology
biology