Similar presentations:
Рецепторная функция. Постоянные межклеточные контакты. Цитоскелет
1. Рецепторная функция. Постоянные межклеточные контакты. Цитоскелет
2.
Этапы проведения сигнала1) Прием сигнала (рецепция)
2) Обработка и передача сигнала
(системы сигнальных путей /
вторичных мессенджеров)
3) Ответ клетки
3.
Стимулы(информация, приходящая к клетке)
1) Высокоаффинные лиганды (связываются с
рецептором высокоаффинно и высокоселективно)
2) Малоспецифичные химические соединения
(например, вызывающие денатурацию белков
или повреждение ДНК)
3) Физические стимулы (ионизирующее облучение
(IR – гамма или рентгеновское облучение),
ультрафиолет (UV), изменение температуры
(heat shock/cold shock), гипер- или гипоосмолярность,
электрический импульс, тряска)
4.
Ответы клетки1. Влияние на пролиферацию
(стимуляция
деления клеток / блок клеточного цикла);
2. Влияние на апоптоз (стимуляция апоптоза /
стимуляция выживания (супрессия апоптоза) )
3. Влияние на адгезию, миграцию и структуры
актинового цитоскелета;
4. Дифференцировка;
5. Cпециализированные
быстрые
ответы
(сокращение,
секреция,
проведение
электрического импульса и т.д.)
5.
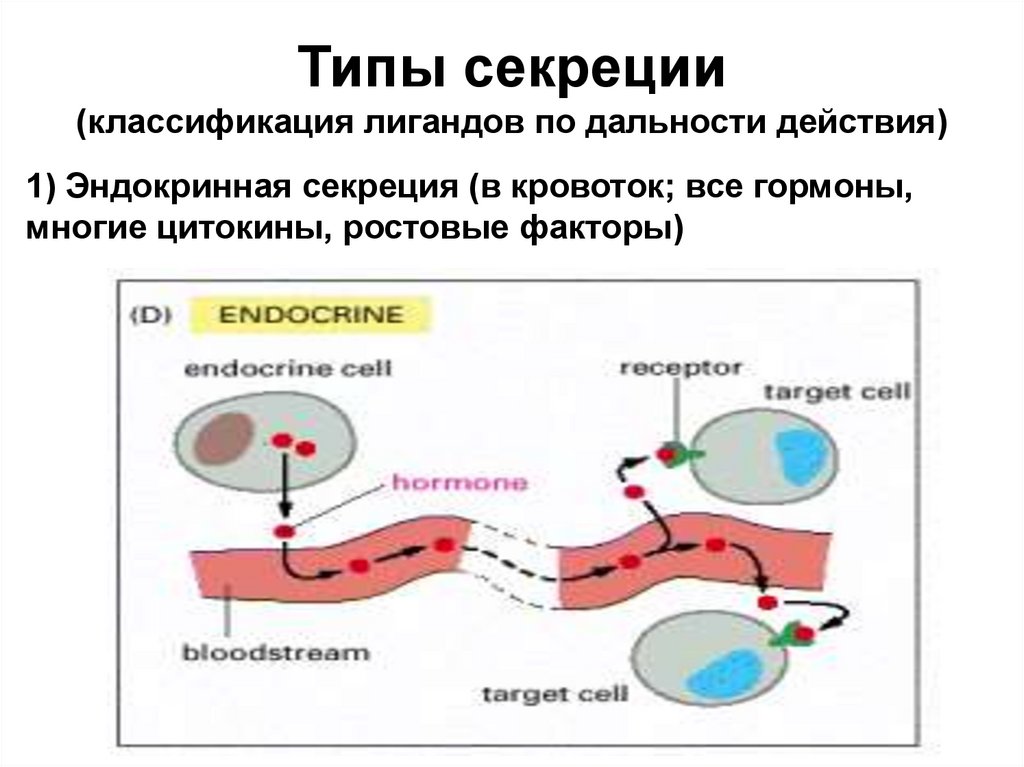
Типы секреции(классификация лигандов по дальности действия)
1) Эндокринная секреция (в кровоток; все гормоны,
многие цитокины, ростовые факторы)
6.
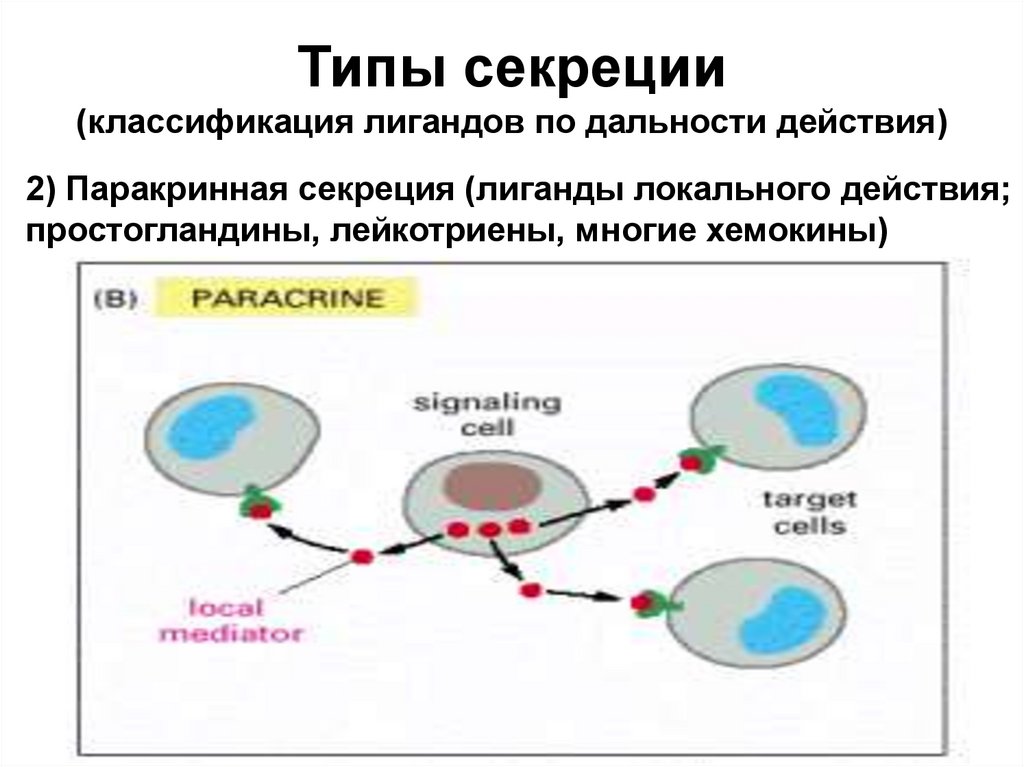
Типы секреции(классификация лигандов по дальности действия)
2) Паракринная секреция (лиганды локального действия;
простогландины, лейкотриены, многие хемокины)
7.
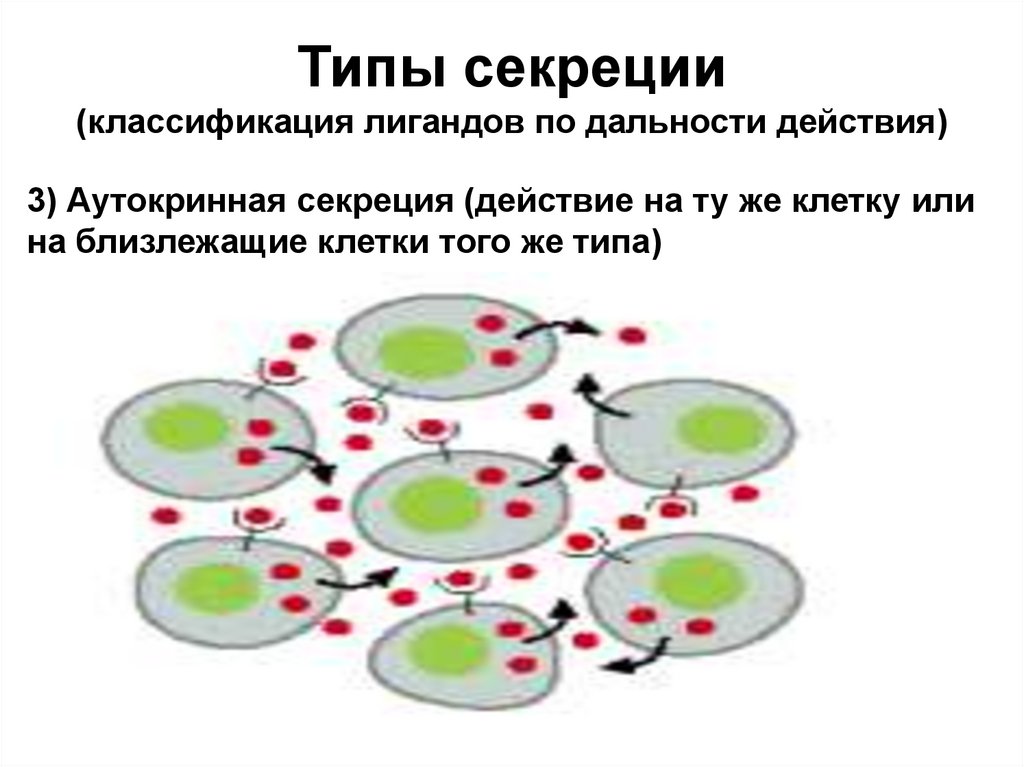
Типы секреции(классификация лигандов по дальности действия)
3) Аутокринная секреция (действие на ту же клетку или
на близлежащие клетки того же типа)
8.
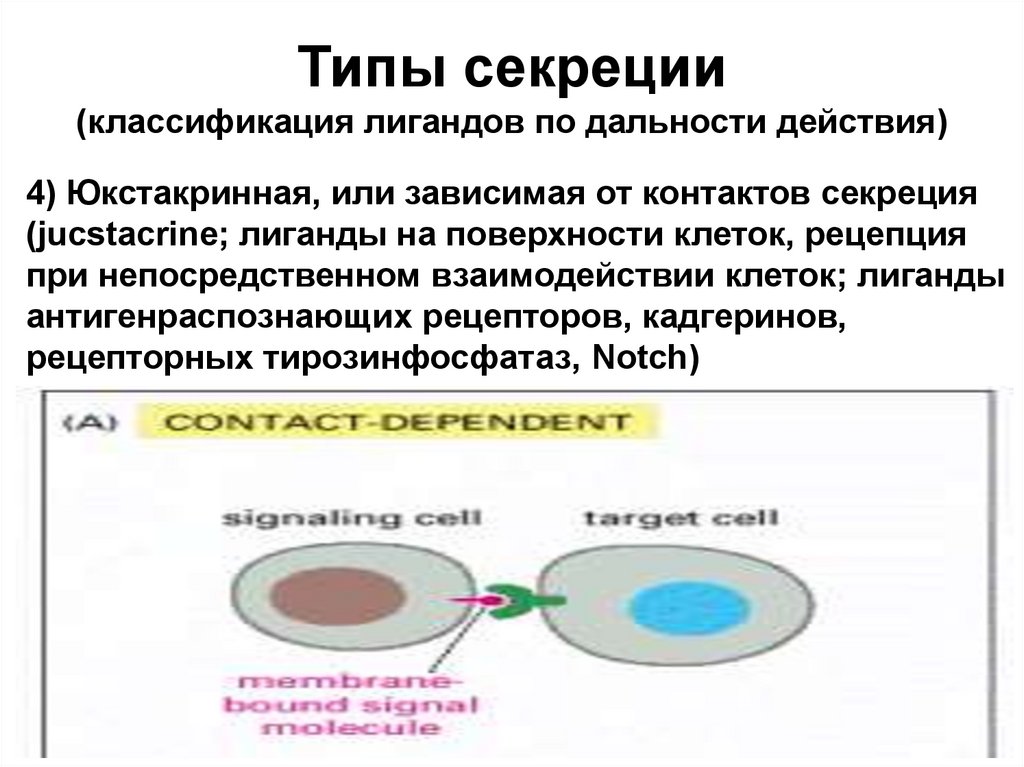
Типы секреции(классификация лигандов по дальности действия)
4) Юкстакринная, или зависимая от контактов секреция
(jucstacrine; лиганды на поверхности клеток, рецепция
при непосредственном взаимодействии клеток; лиганды
антигенраспознающих рецепторов, кадгеринов,
рецепторных тирозинфосфатаз, Notch)
9.
Типы секреции(классификация лигандов по дальности действия)
5) Секреция компонентов внеклеточного матрикса
(нерастворимые лиганды рецептируются контактами
клетка-матрикс; лиганды интегринов)
10.
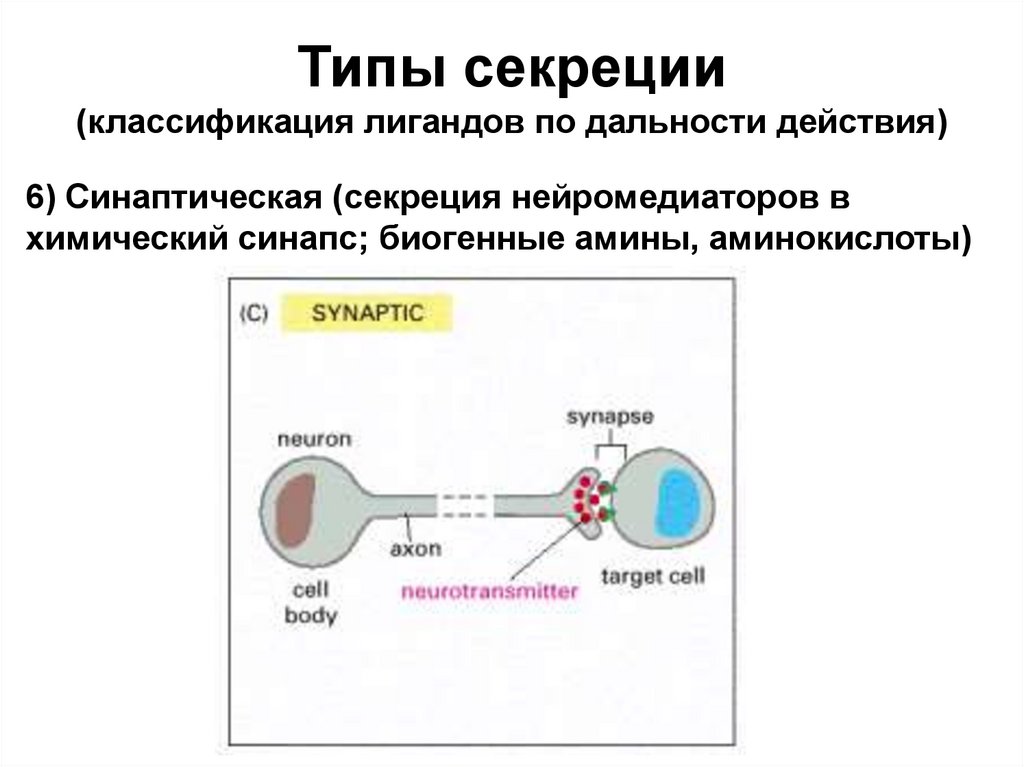
Типы секреции(классификация лигандов по дальности действия)
6) Синаптическая (секреция нейромедиаторов в
химический синапс; биогенные амины, аминокислоты)
11.
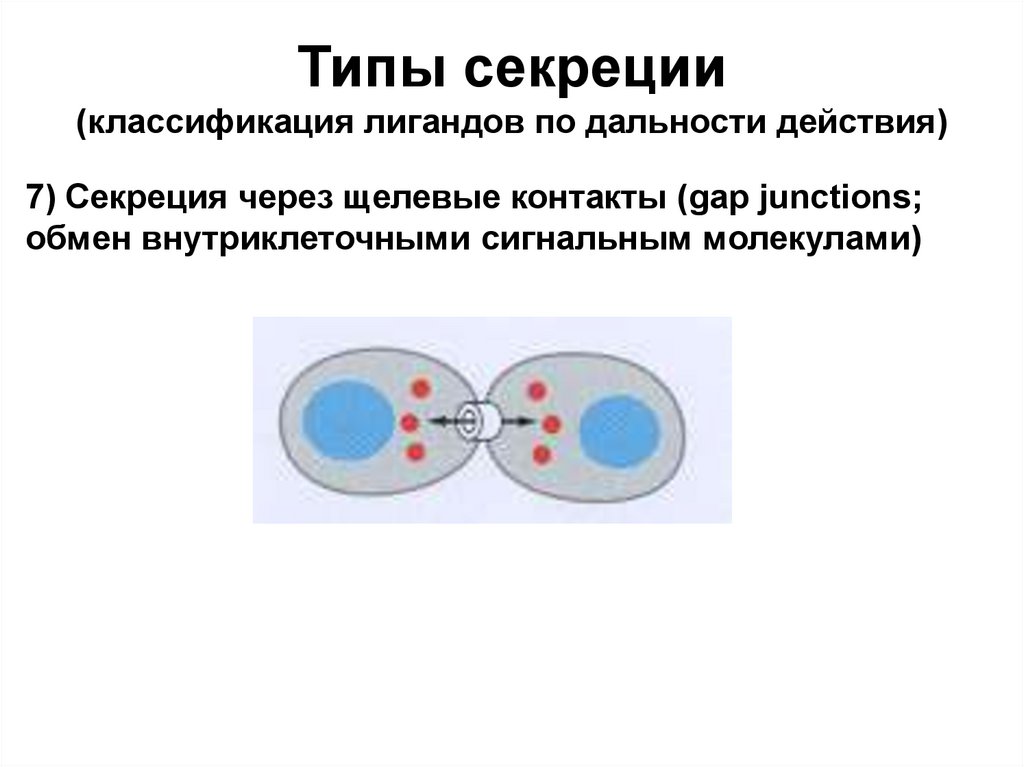
Типы секреции(классификация лигандов по дальности действия)
7) Секреция через щелевые контакты (gap junctions;
обмен внутриклеточными сигнальным молекулами)
12.
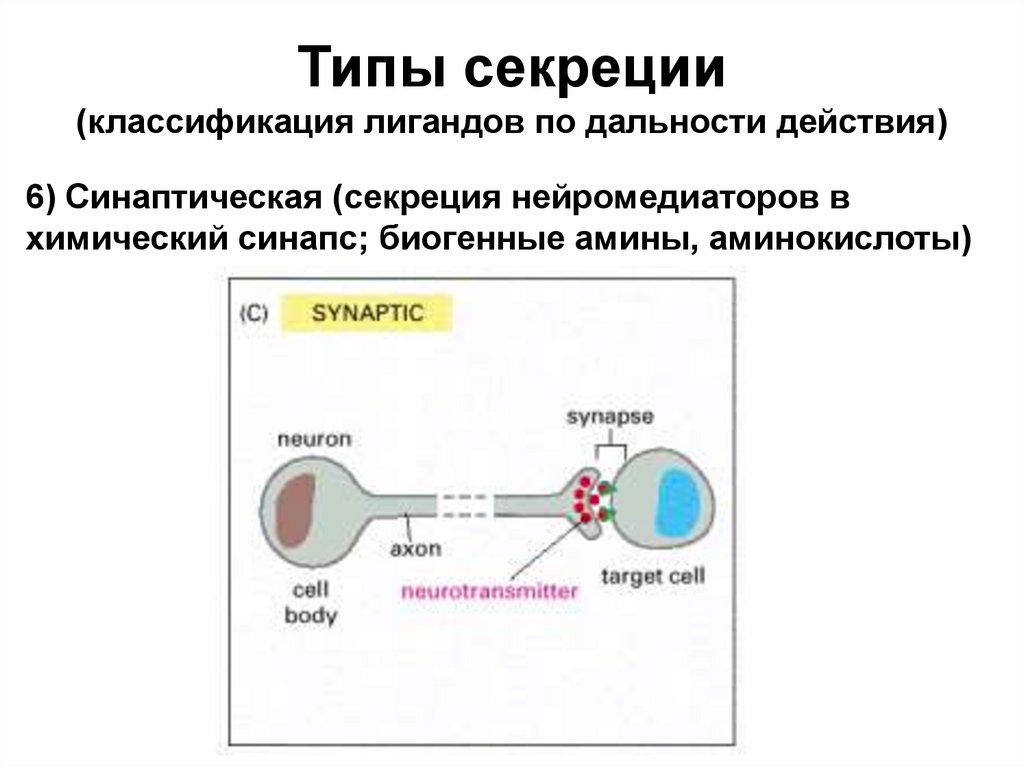
Типы секреции(классификация лигандов по дальности действия)
6) Синаптическая (секреция нейромедиаторов в
химический синапс; биогенные амины, аминокислоты)
13.
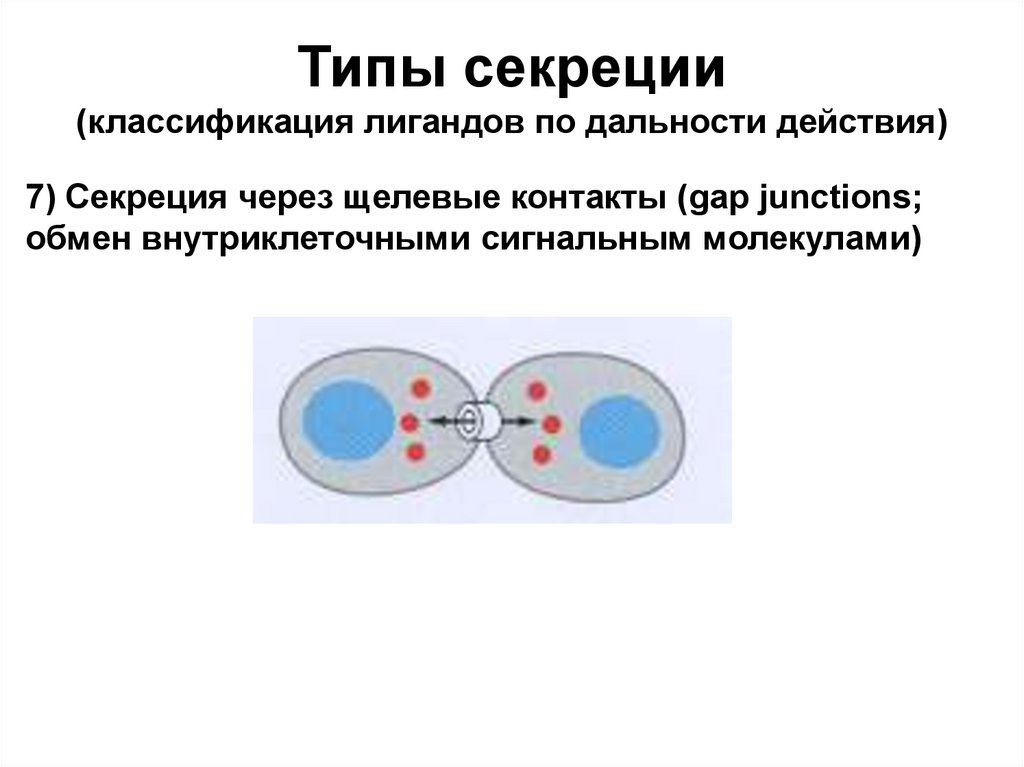
Типы секреции(классификация лигандов по дальности действия)
7) Секреция через щелевые контакты (gap junctions;
обмен внутриклеточными сигнальным молекулами)
14.
•Клетки могут взаимодействовать друг сдругом по средствам:
1. На расстоянии через секрецию
определенных веществ;
2. Через сигнальные молекулы на их
поверхности при непосредственном
контакте;
3. Через щелевые контакты-обмен
малыми молекулами.
15.
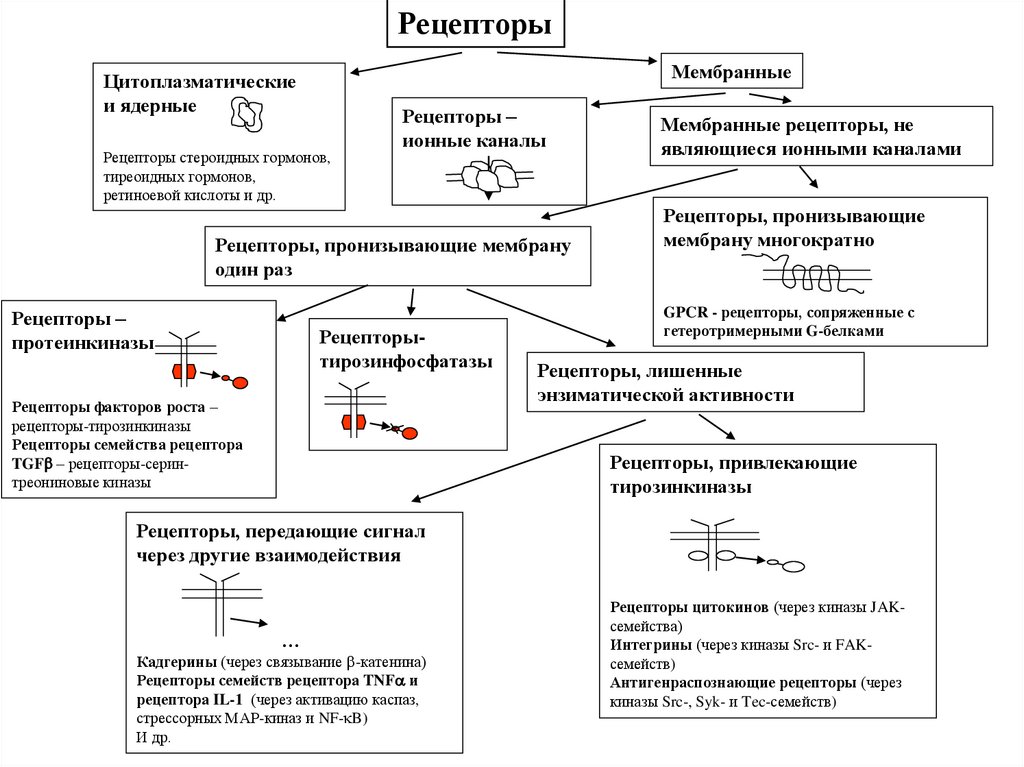
РецепторыМембранные
Цитоплазматические
и ядерные
Рецепторы стероидных гормонов,
тиреоидных гормонов,
ретиноевой кислоты и др.
Рецепторы –
ионные каналы
Рецепторы, пронизывающие мембрану
один раз
Рецепторы –
протеинкиназы
Рецепторытирозинфосфатазы
Рецепторы факторов роста –
рецепторы-тирозинкиназы
Рецепторы семейства рецептора
TGF – рецепторы-серинтреониновые киназы
Мембранные рецепторы, не
являющиеся ионными каналами
Рецепторы, пронизывающие
мембрану многократно
GPCR - рецепторы, сопряженные с
гетеротримерными G-белками
Рецепторы, лишенные
энзиматической активности
Рецепторы, привлекающие
тирозинкиназы
Рецепторы, передающие сигнал
через другие взаимодействия
…
Кадгерины (через связывание -катенина)
Рецепторы семейств рецептора TNF и
рецептора IL-1 (через активацию каспаз,
стрессорных МАР-киназ и NF- B)
И др.
Рецепторы цитокинов (через киназы JAKсемейства)
Интегрины (через киназы Src- и FAKсемейств)
Антигенраспознающие рецепторы (через
киназы Src-, Syk- и Tec-семейств)
16.
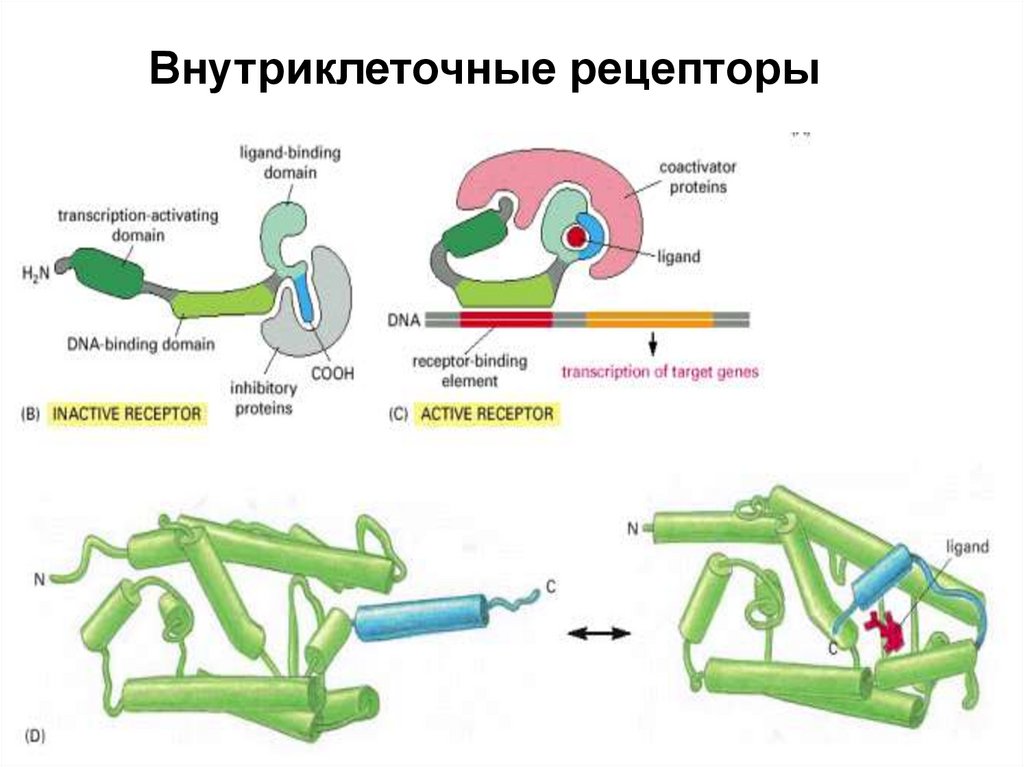
Внутриклеточные рецепторы17.
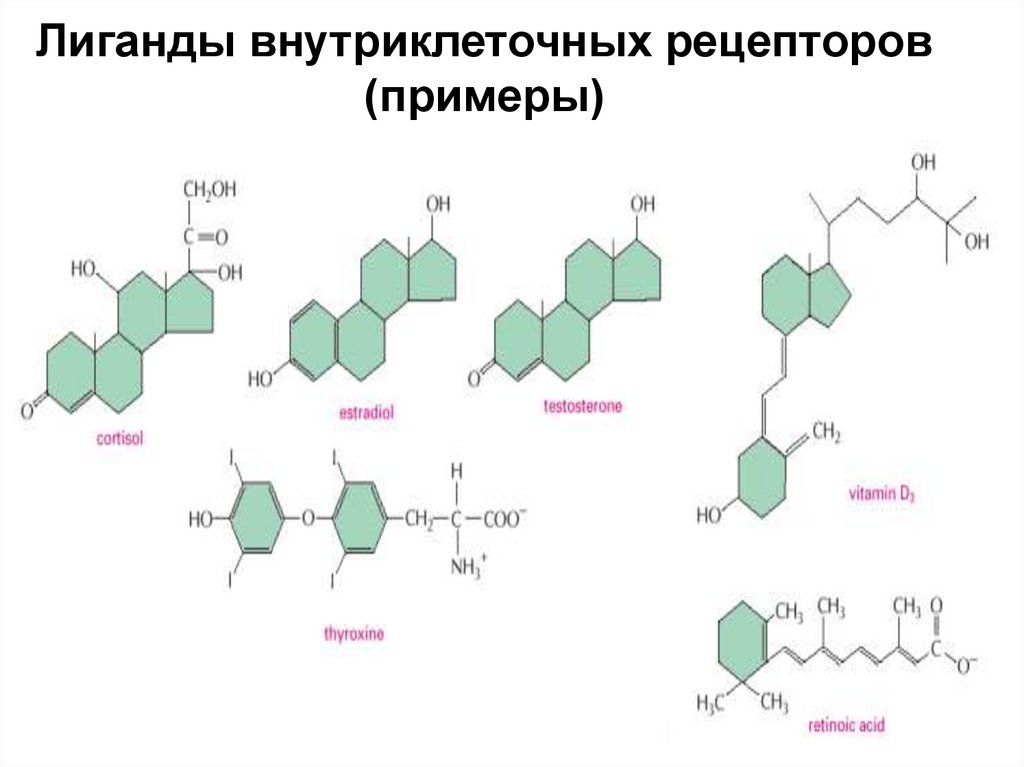
Лиганды внутриклеточных рецепторов(примеры)
18.
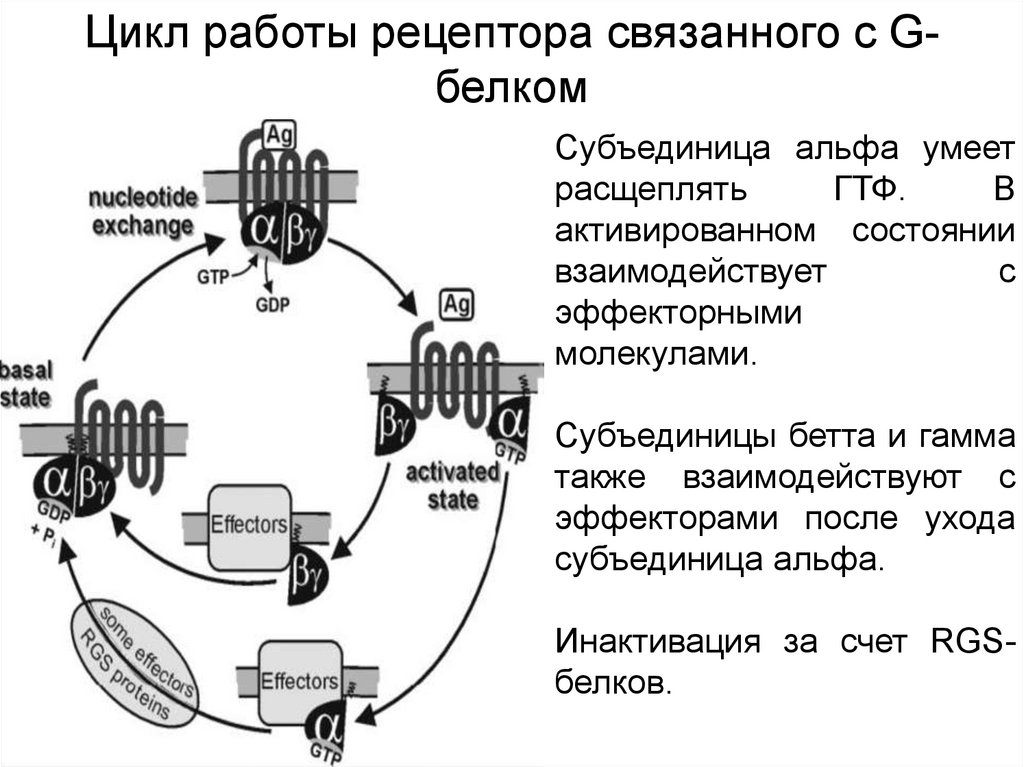
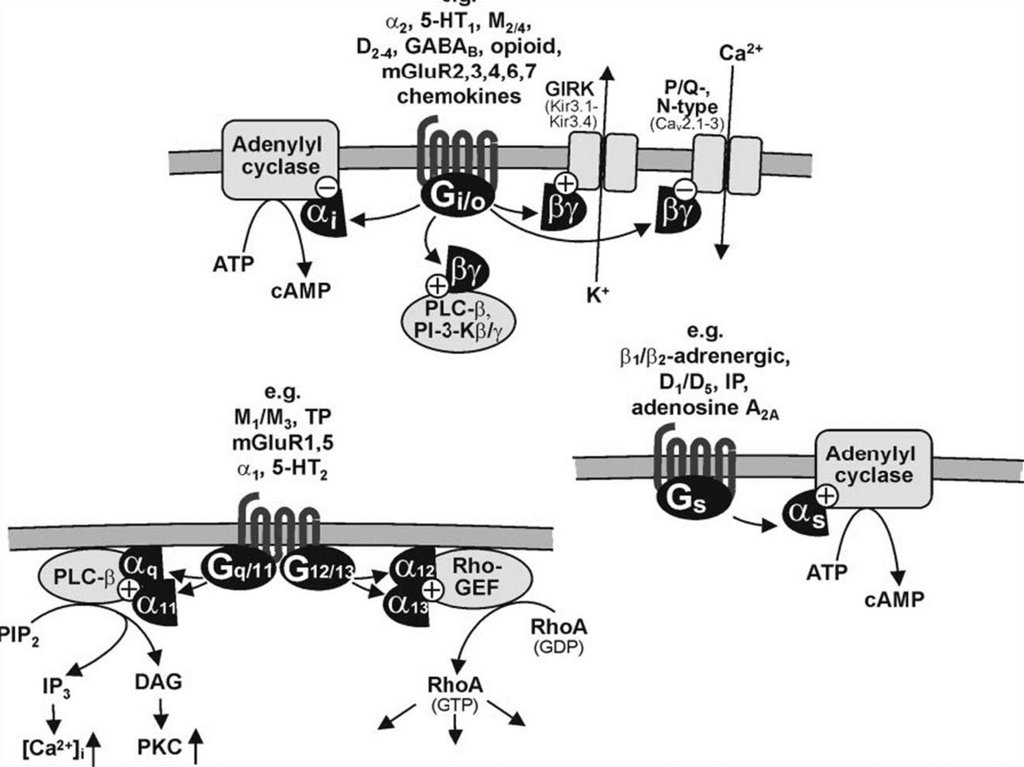
Цикл работы рецептора связанного с GбелкомСубъединица альфа умеет
расщеплять
ГТФ.
В
активированном состоянии
взаимодействует
с
эффекторными
молекулами.
Субъединицы бетта и гамма
также взаимодействуют с
эффекторами после ухода
субъединица альфа.
Инактивация за счет RGSбелков.
19.
20. Мембранно-внутриклеточный механизм Вторичные посредники
цАМФ - циклический аденозинмонофосфат;цГМФ - циклический гуанозинмонофосфат;
ИФ3 - инозитол-3-фосфат;
ДАГ - диацилглицерол;
Са++
Образуются в реакциях, катализируемых
мембранносвязанными ферментами соответственно:
аденилатциклазой, гуанилатциклазой, фосфолипазой С (флС).
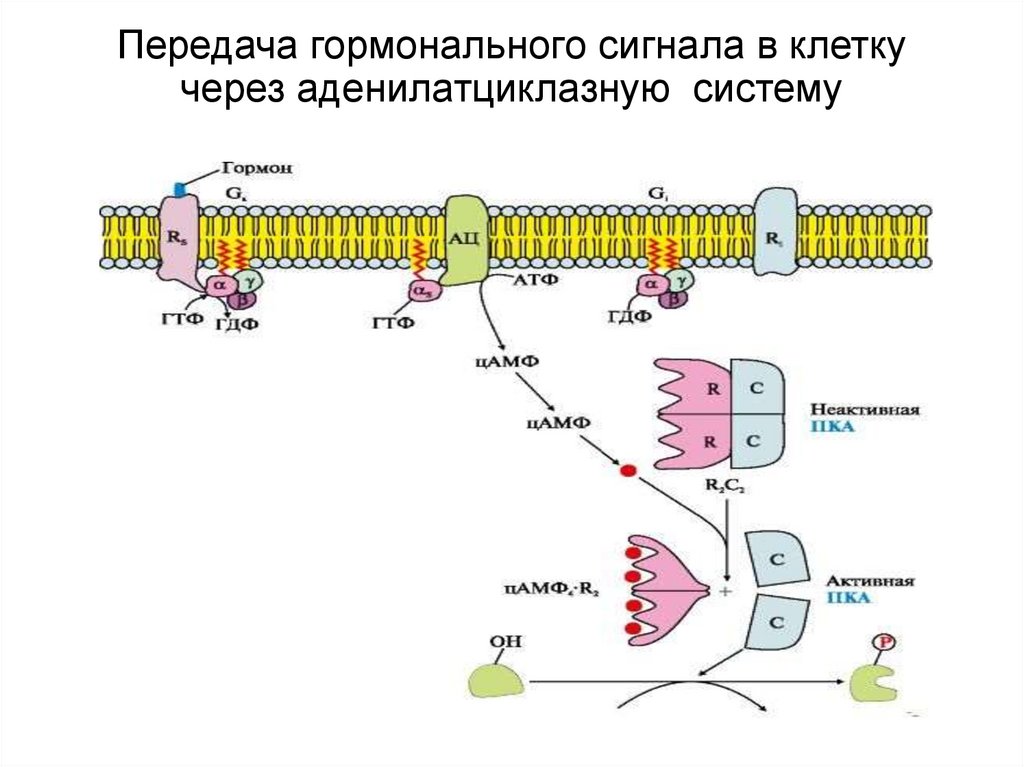
21. Вариант 1. (с участием аденилатциклазной системы)
Вторичный посредник - цАМФ;Мембранно-связанный фермент - аденилатциклаза
1. Гормон связывается с мембранным рецептором, образуется комплекс
при изменении конформации белка-рецептора;
2. Увеличивается сродство к G –белку;
3. Изменение конформации G-белка, сопряженного с рецептором;
4. Активация аденилатциклазы субъединицами G-белка;
5. Образование в клетке из АТФ цАМФ (вторичный посредник) ;
6. цАМФ активирует в цитозоле протеинкиназу А за счет диссоциации
протомеров
7. Протеинкиназы
фосфорилируют
регуляторные
ферменты
метаболических путей в следствии чего
меняется активность
ферментов.
8. Меняется скорость метаболических путей.
22. Передача гормонального сигнала в клетку через аденилатциклазную систему
23.
• Прекращение влияния цАМФ на процесс активациипротеинкиназы А и, следовательно,
фосфорилирования белков происходит под действием
фосфодиэстеразы –разрушает цАМФ.
• активирует фосфодиэстеразу – инсулин
• Препараты, ингибирующие фосфодиэстеразу –
кофеин, теофилин усиливают эффект гормонов,
которые действуют через цАМФ
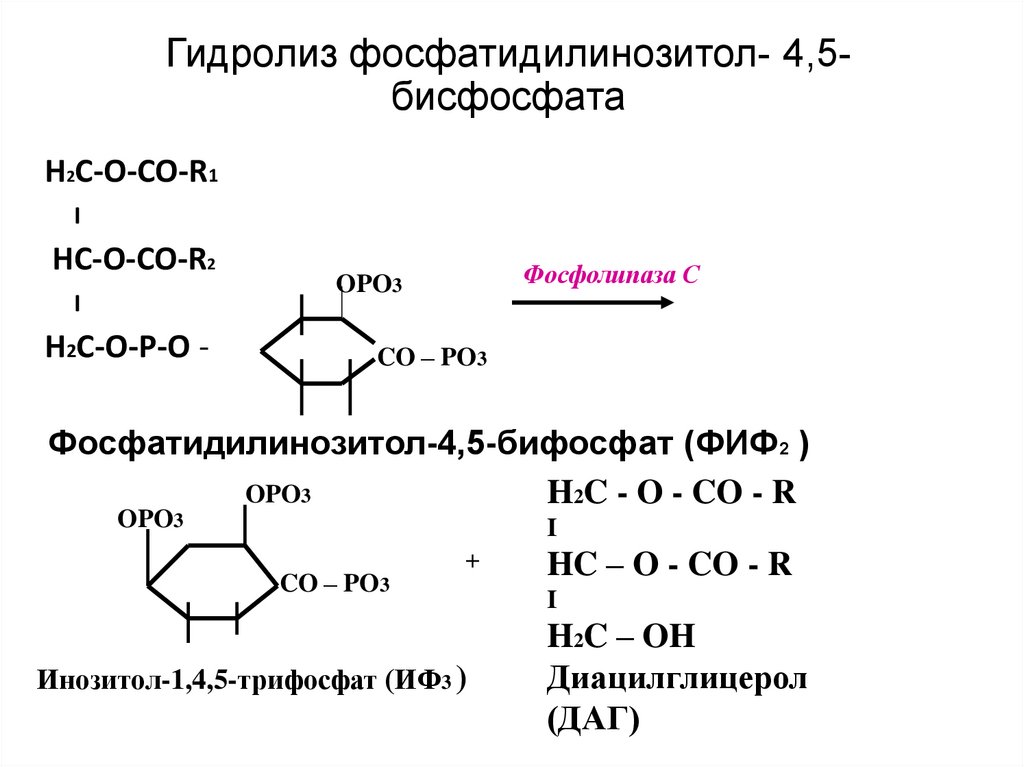
24. Вариант 2. (с участием инозитолфосфатной системы)
• Вторичные посредники- инозитол-3-фосфат (ИФ3),ДАГ
• Образуются путем гидролиза фосфолипида
клеточной
мембраны
фосфотидилинозитолбисфосфата (ФИФ2).
• Гидролиз
катализирует
мембрано-связанный
фермент-фосфолипаза С
25. Гидролиз фосфатидилинозитол- 4,5-бисфосфата
Гидролиз фосфатидилинозитол- 4,5бисфосфатаH2С-O-CO-R1
I
HС-O-CO-R2
I
H2С-O-P-O -
Фосфолипаза С
OPO3
CO – PO3
Фосфатидилинозитол-4,5-бифосфат (ФИФ2 )
OPO3
H2C - O - CO - R
OPO3
I
CO – PO3
+
Инозитол-1,4,5-трифосфат (ИФ3 )
HC – O - CO - R
I
H2C – OH
Диацилглицерол
(ДАГ)
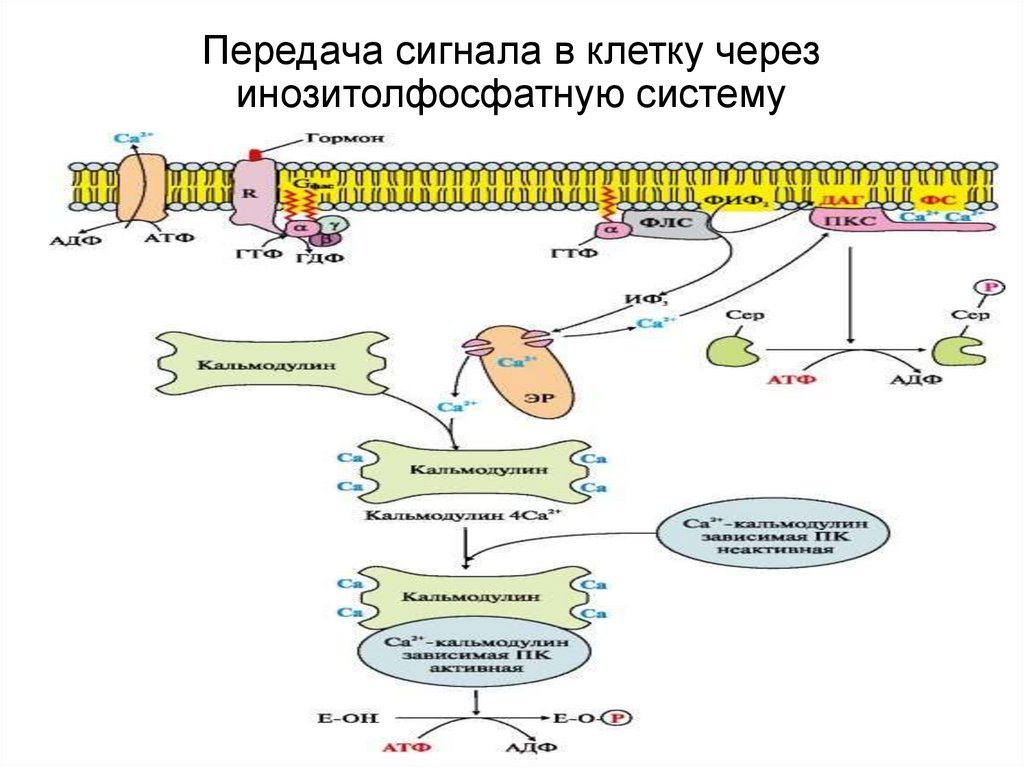
26. Основные этапы передачи гормонального сигнала
1.Связывание гормона с рецептором меняется конформация рецептора.2.Изменение конформации соответствующего G-белка, сопряженного с
рецептором.
3.Активация мембранного фермента фосфолипазыС субъединицами Gбелка;
4. Образование в цитозоли двух вторичных посредников путем гидролиза
ФИФ2.- ДАГ и ИФ3 Сигнал раздваивается:
А. ДАГ активирует в цитозоле
протеинкиназу С, которая
катализирует
фосфорилирование
регуляторного фермента и
меняется активность
фермента
Б. ИФ3 в клетке связывается с Са++
каналами ЭР, каналы открываются, и
Са++ поступает в цитозоль, связывается
с белком- кальмодулином и этот
комплекс активирует Са++ кальмодулинзависимую протеинкиназу
которая фосфорилирует ферменты и
меняется их активность
27. Передача сигнала в клетку через инозитолфосфатную систему
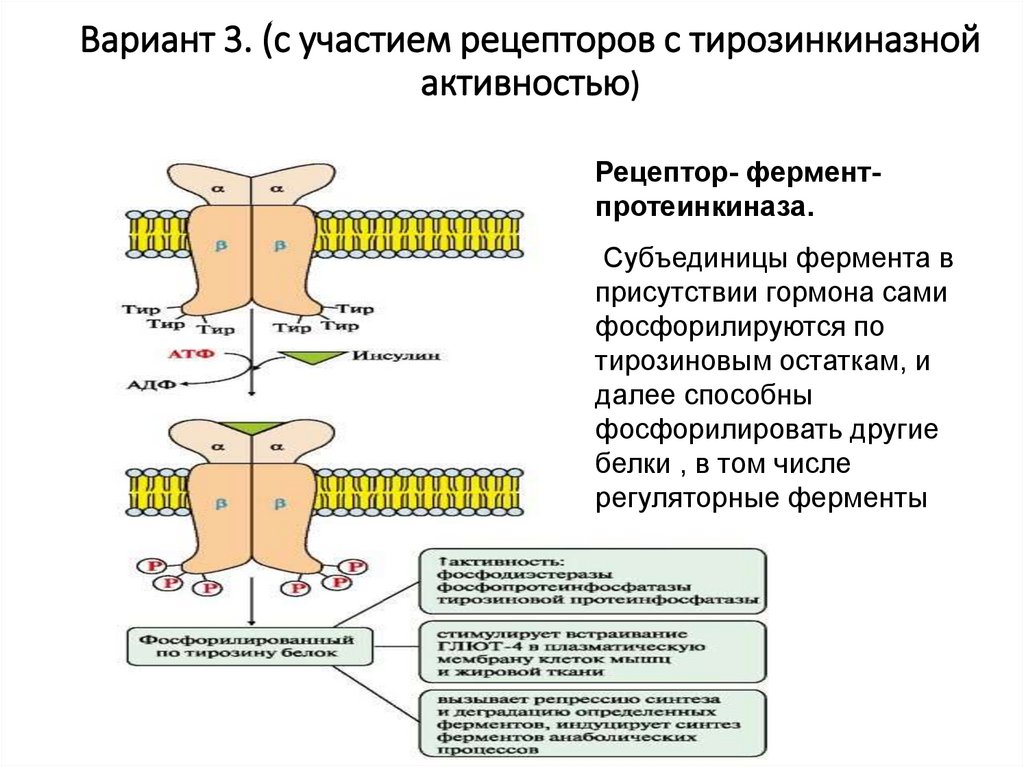
28. Вариант 3. (с участием рецепторов с тирозинкиназной активностью)
Рецептор- ферментпротеинкиназа.Субъединицы фермента в
присутствии гормона сами
фосфорилируются по
тирозиновым остаткам, и
далее способны
фосфорилировать другие
белки , в том числе
регуляторные ферменты
29.
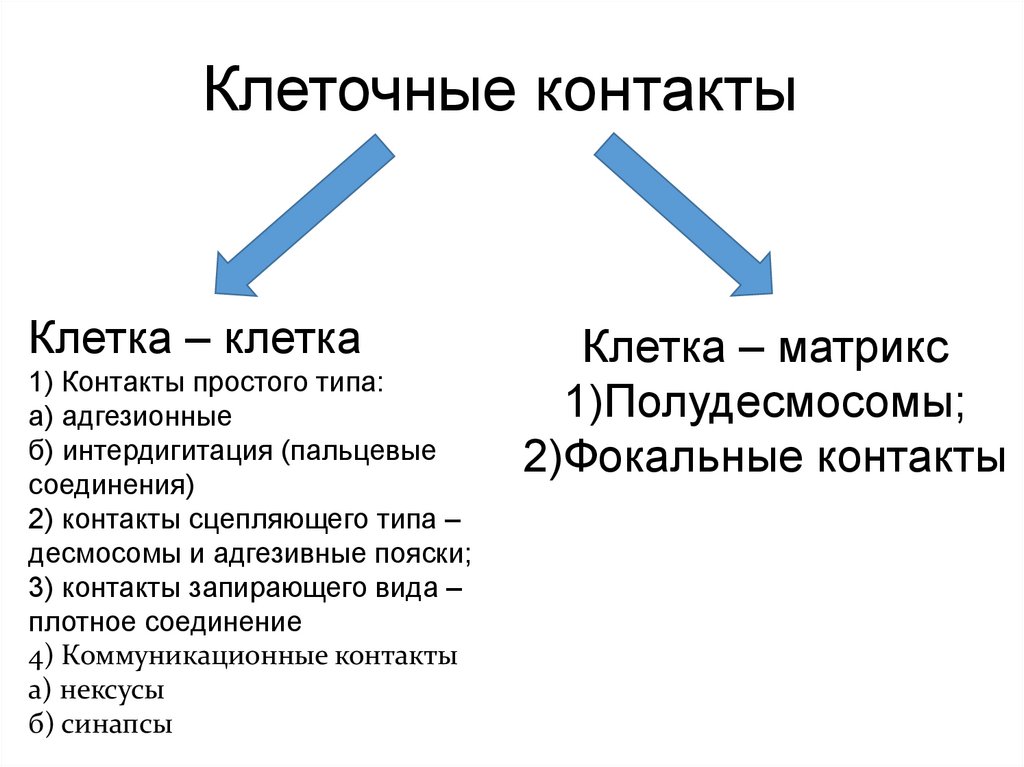
Клеточные контактыКлетка – клетка
1) Контакты простого типа:
а) адгезионные
б) интердигитация (пальцевые
соединения)
2) контакты сцепляющего типа –
десмосомы и адгезивные пояски;
3) контакты запирающего вида –
плотное соединение
4) Коммуникационные контакты
а) нексусы
б) синапсы
Клетка – матрикс
1)Полудесмосомы;
2)Фокальные контакты
30.
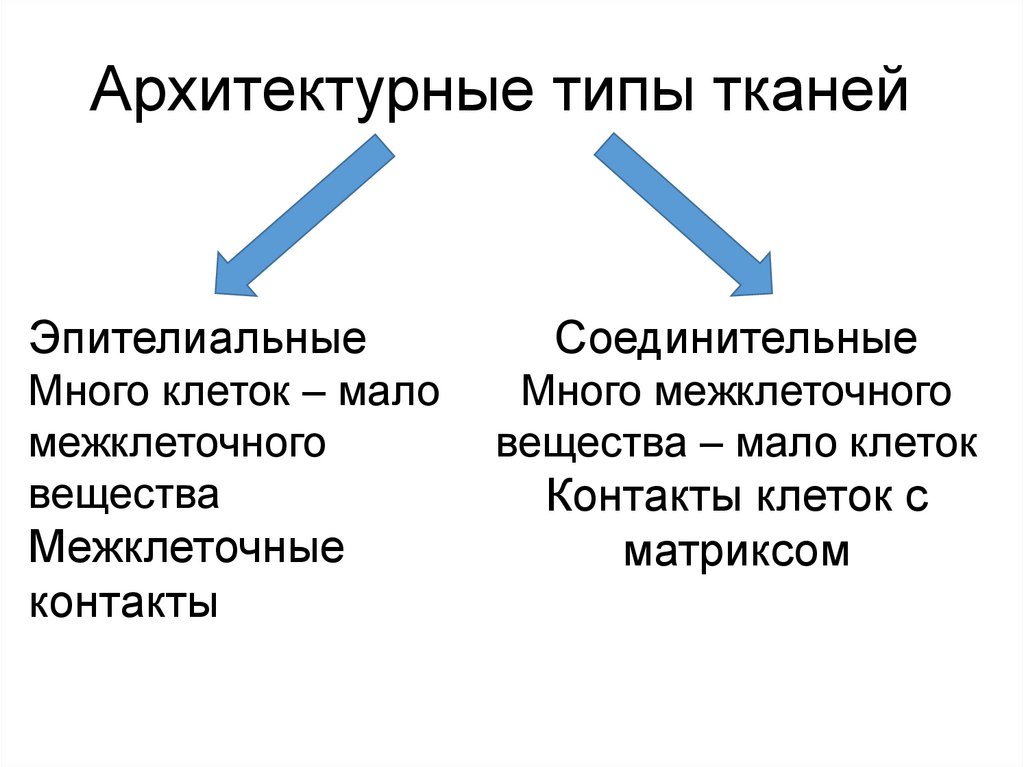
Архитектурные типы тканейЭпителиальные
Много клеток – мало
межклеточного
вещества
Межклеточные
контакты
Соединительные
Много межклеточного
вещества – мало клеток
Контакты клеток с
матриксом
31.
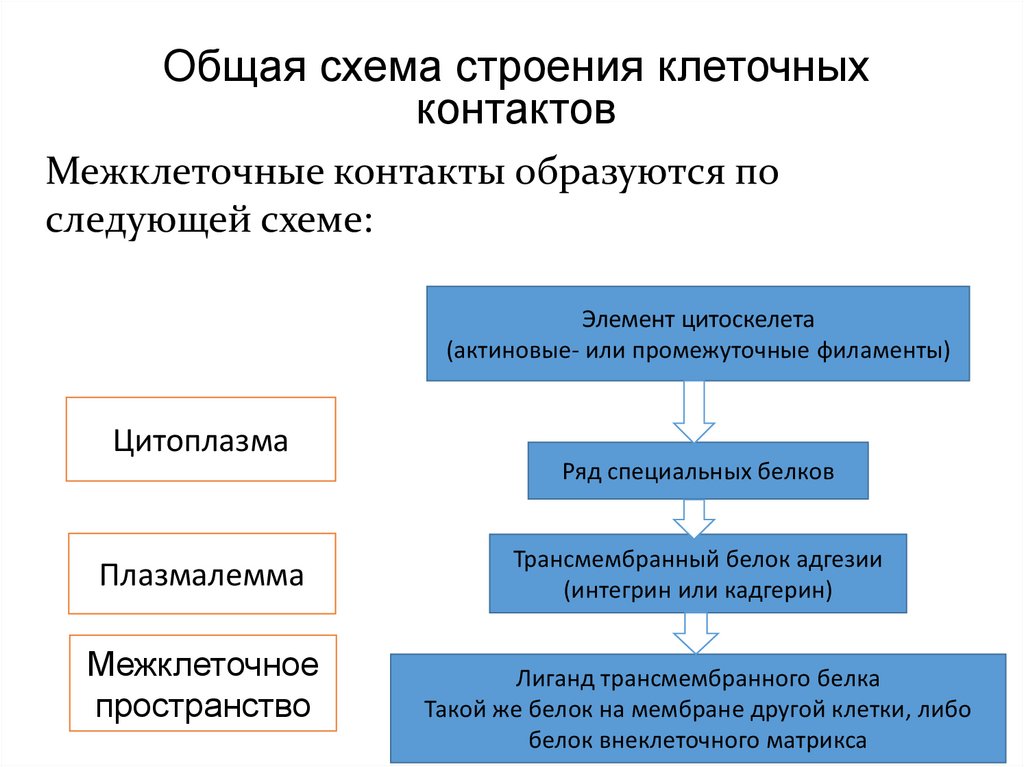
Общая схема строения клеточныхконтактов
Межклеточные контакты образуются по
следующей схеме:
Элемент цитоскелета
(актиновые- или промежуточные филаменты)
Цитоплазма
Ряд специальных белков
Плазмалемма
Межклеточное
пространство
Трансмембранный белок адгезии
(интегрин или кадгерин)
Лиганд трансмембранного белка
Такой же белок на мембране другой клетки, либо
белок внеклеточного матрикса
32.
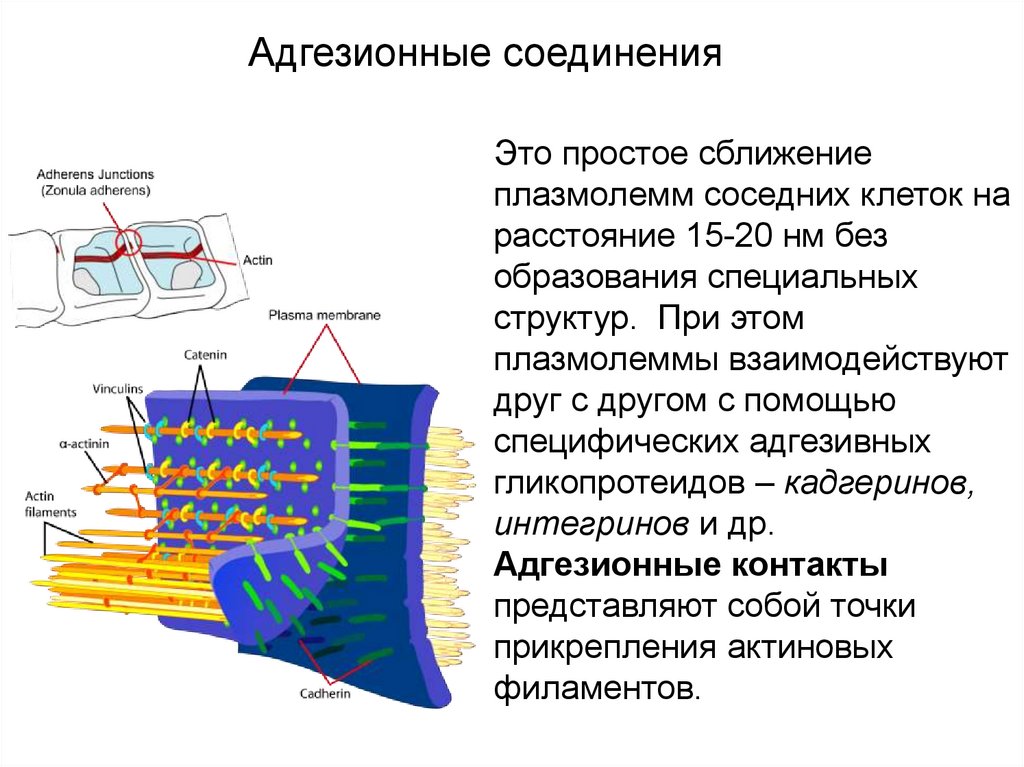
Контакты простого типаАдгезионные соединения
Это простое сближение
плазмолемм соседних клеток на
расстояние 15-20 нм без
образования специальных
структур. При этом
плазмолеммы взаимодействуют
друг с другом с помощью
специфических адгезивных
гликопротеидов – кадгеринов,
интегринов и др.
Адгезионные контакты
представляют собой точки
прикрепления актиновых
филаментов.
33.
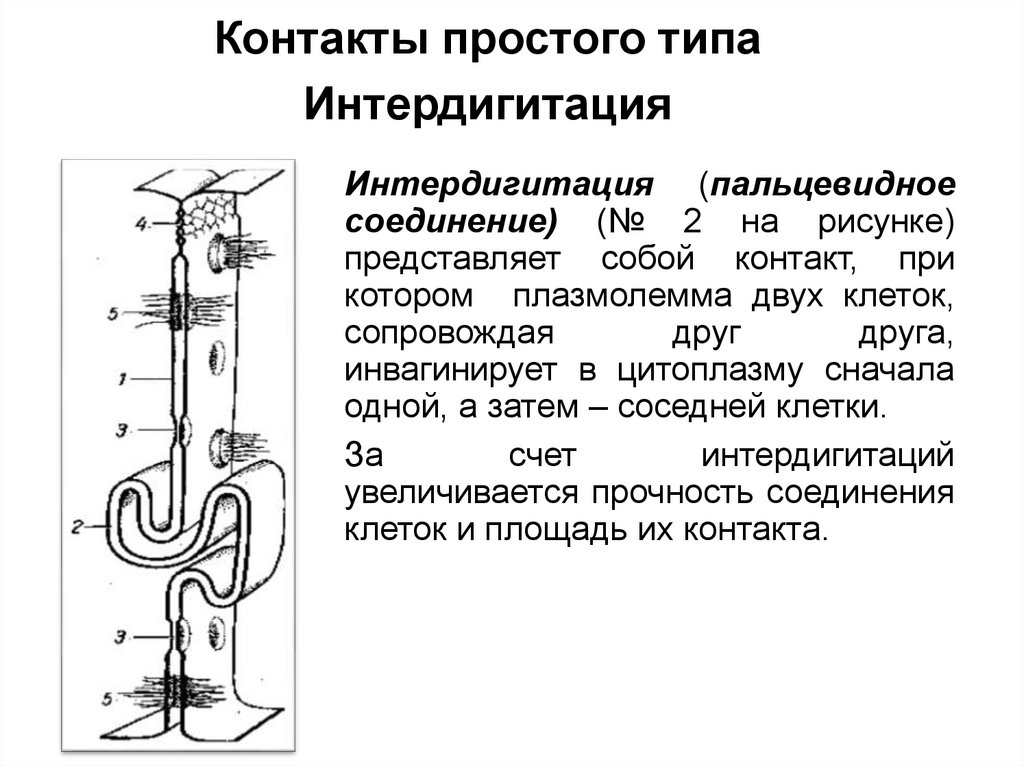
Контакты простого типаИнтердигитация
Интердигитация (пальцевидное
соединение) (№ 2 на рисунке)
представляет собой контакт, при
котором плазмолемма двух клеток,
сопровождая
друг
друга,
инвагинирует в цитоплазму сначала
одной, а затем – соседней клетки.
За
счет
интердигитаций
увеличивается прочность соединения
клеток и площадь их контакта.
34.
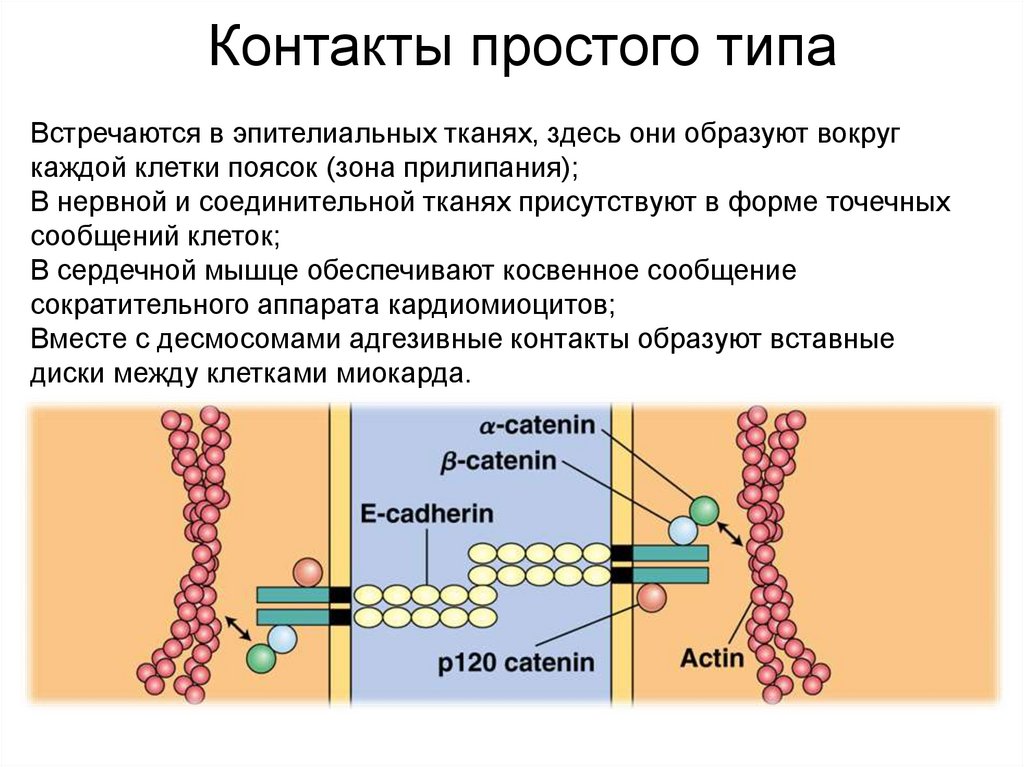
Контакты простого типаВстречаются в эпителиальных тканях, здесь они образуют вокруг
каждой клетки поясок (зона прилипания);
В нервной и соединительной тканях присутствуют в форме точечных
сообщений клеток;
В сердечной мышце обеспечивают косвенное сообщение
сократительного аппарата кардиомиоцитов;
Вместе с десмосомами адгезивные контакты образуют вставные
диски между клетками миокарда.
35.
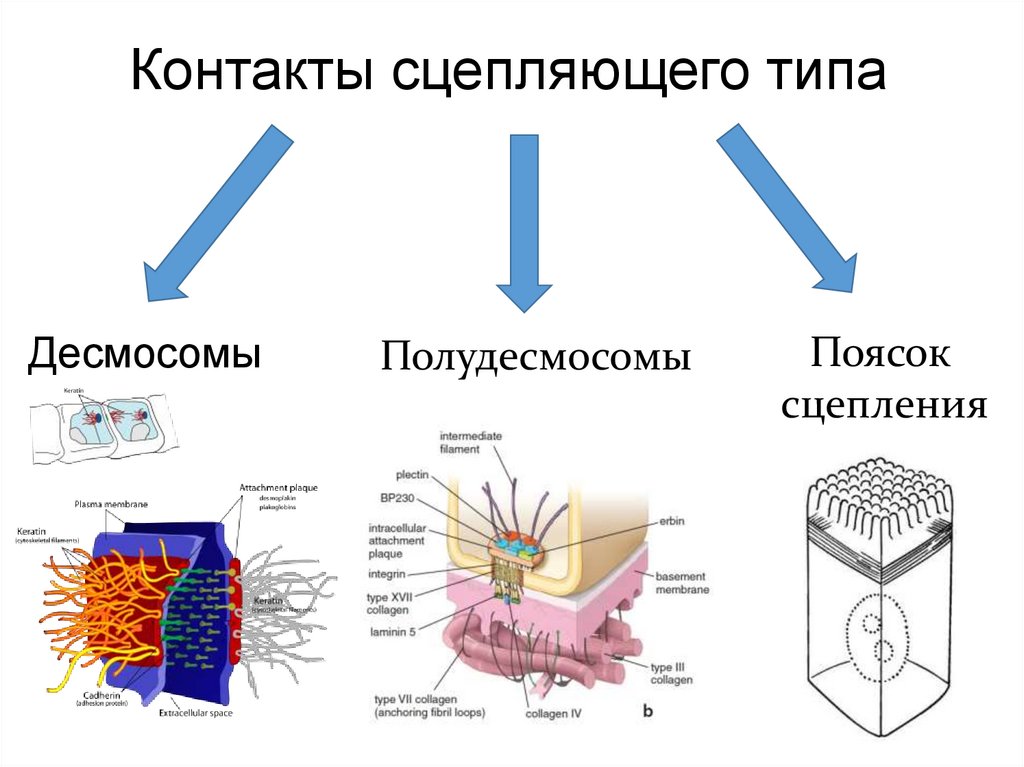
Контакты сцепляющего типаДесмосомы
Полудесмосомы
Поясок
сцепления
36.
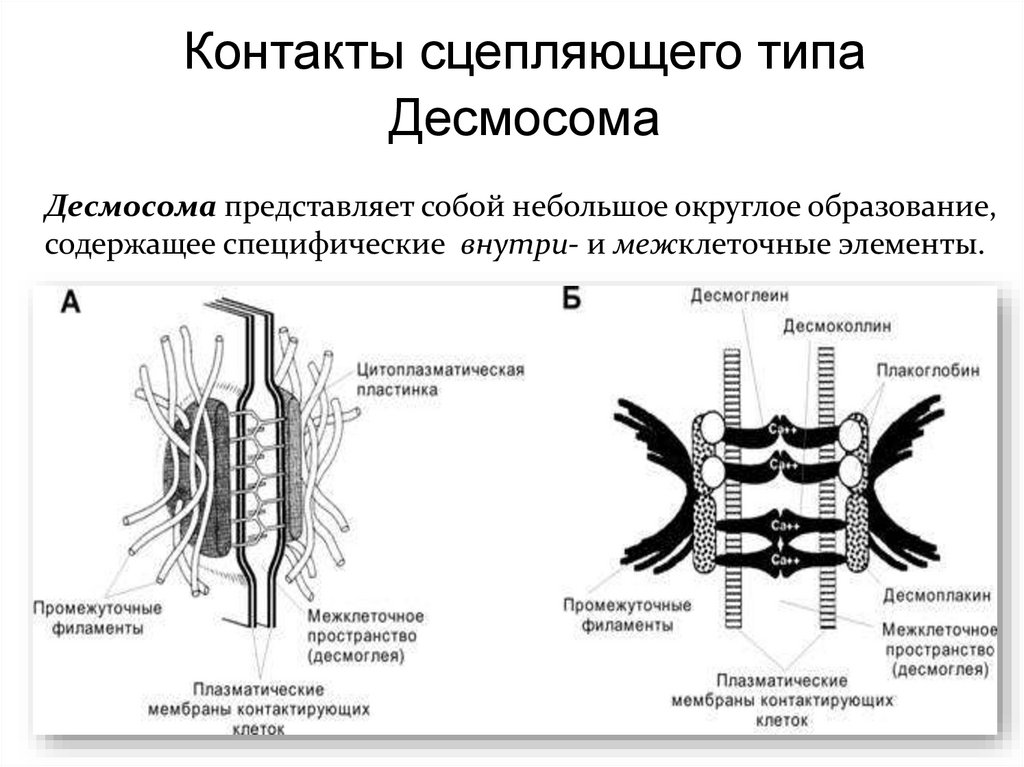
Контакты сцепляющего типаДесмосома
Десмосома представляет собой небольшое округлое образование,
содержащее специфические внутри- и межклеточные элементы.
37.
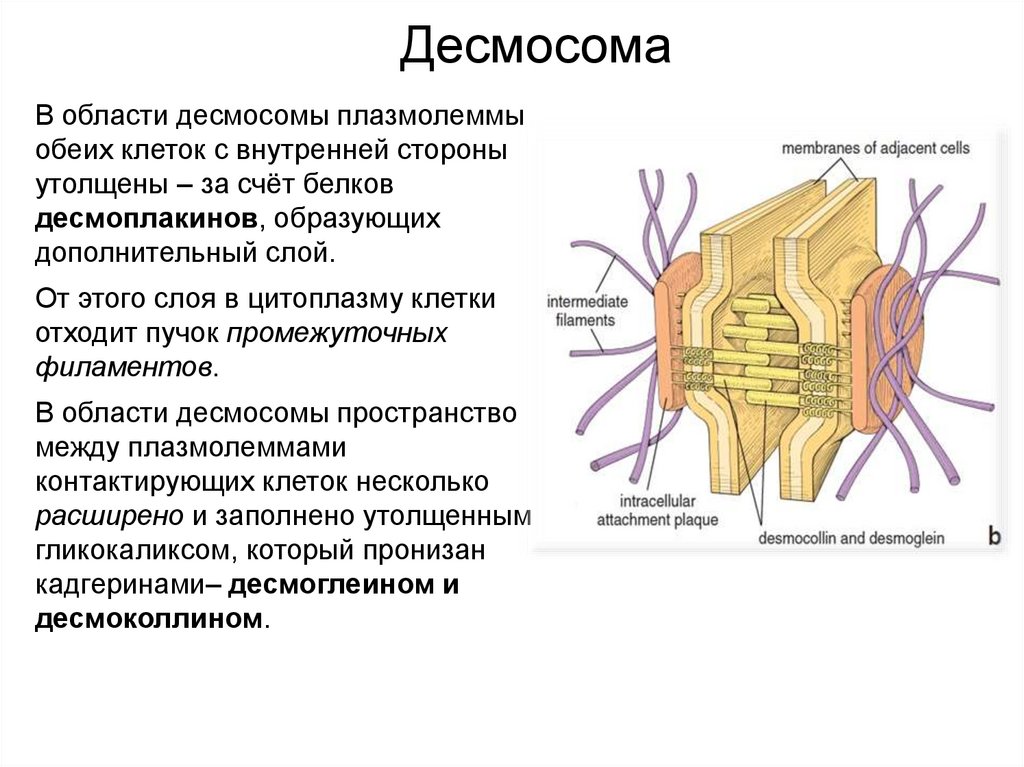
ДесмосомаВ области десмосомы плазмолеммы
обеих клеток с внутренней стороны
утолщены – за счёт белков
десмоплакинов, образующих
дополнительный слой.
От этого слоя в цитоплазму клетки
отходит пучок промежуточных
филаментов.
В области десмосомы пространство
между плазмолеммами
контактирующих клеток несколько
расширено и заполнено утолщенным
гликокаликсом, который пронизан
кадгеринами– десмоглеином и
десмоколлином.
38.
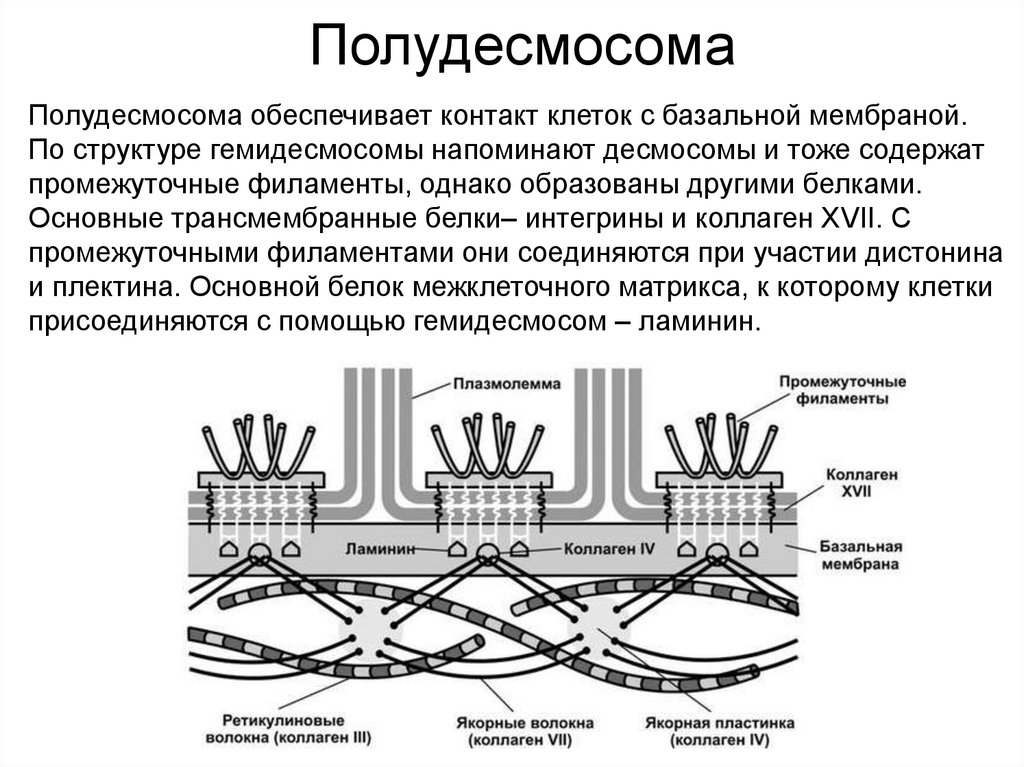
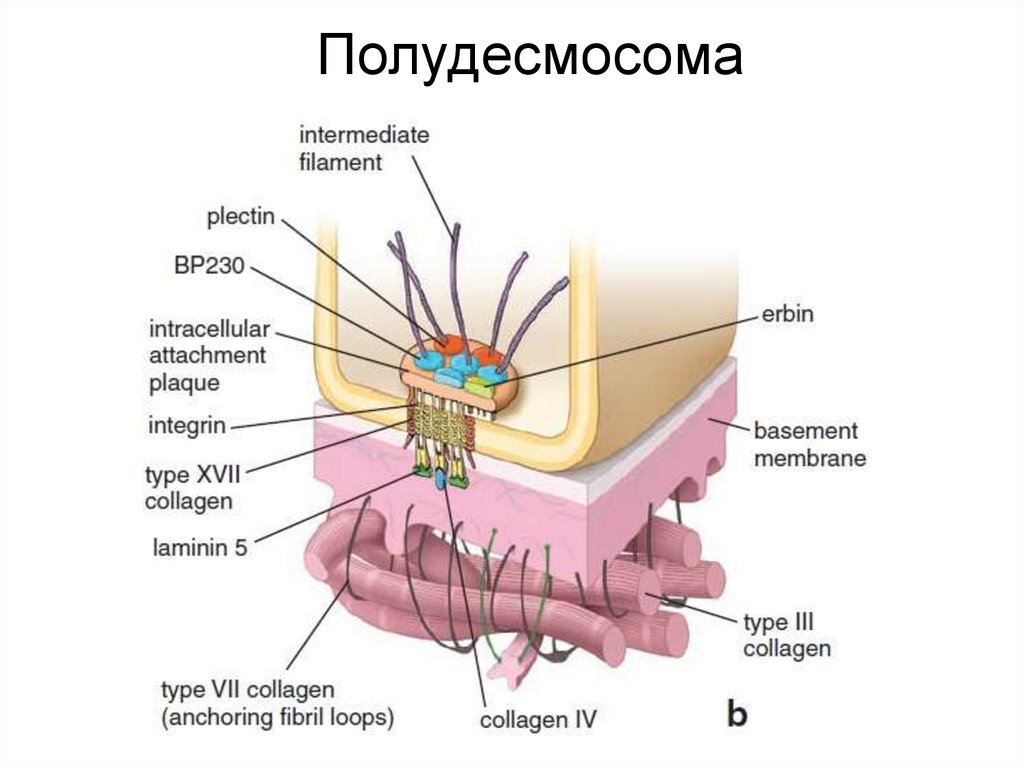
ПолудесмосомаПолудесмосома обеспечивает контакт клеток с базальной мембраной.
По структуре гемидесмосомы напоминают десмосомы и тоже содержат
промежуточные филаменты, однако образованы другими белками.
Основные трансмембранные белки– интегрины и коллаген XVII. С
промежуточными филаментами они соединяются при участии дистонина
и плектина. Основной белок межклеточного матрикса, к которому клетки
присоединяются с помощью гемидесмосом – ламинин.
39.
Полудесмосома40.
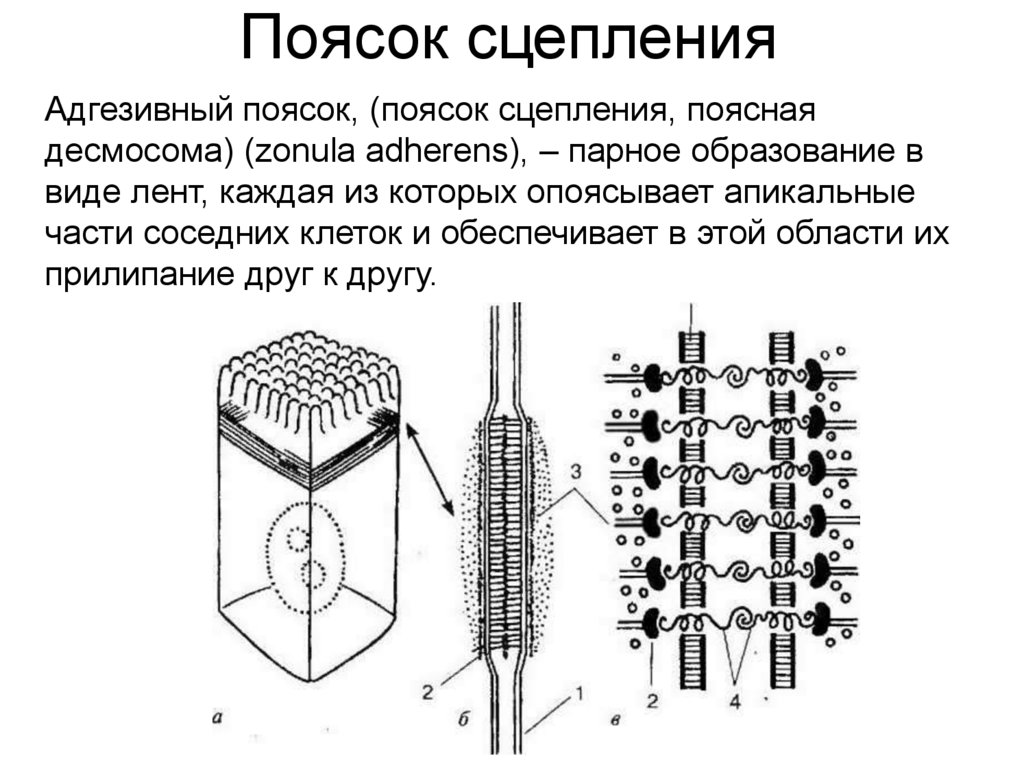
Поясок сцепленияАдгезивный поясок, (поясок сцепления, поясная
десмосома) (zonula adherens), – парное образование в
виде лент, каждая из которых опоясывает апикальные
части соседних клеток и обеспечивает в этой области их
прилипание друг к другу.
41.
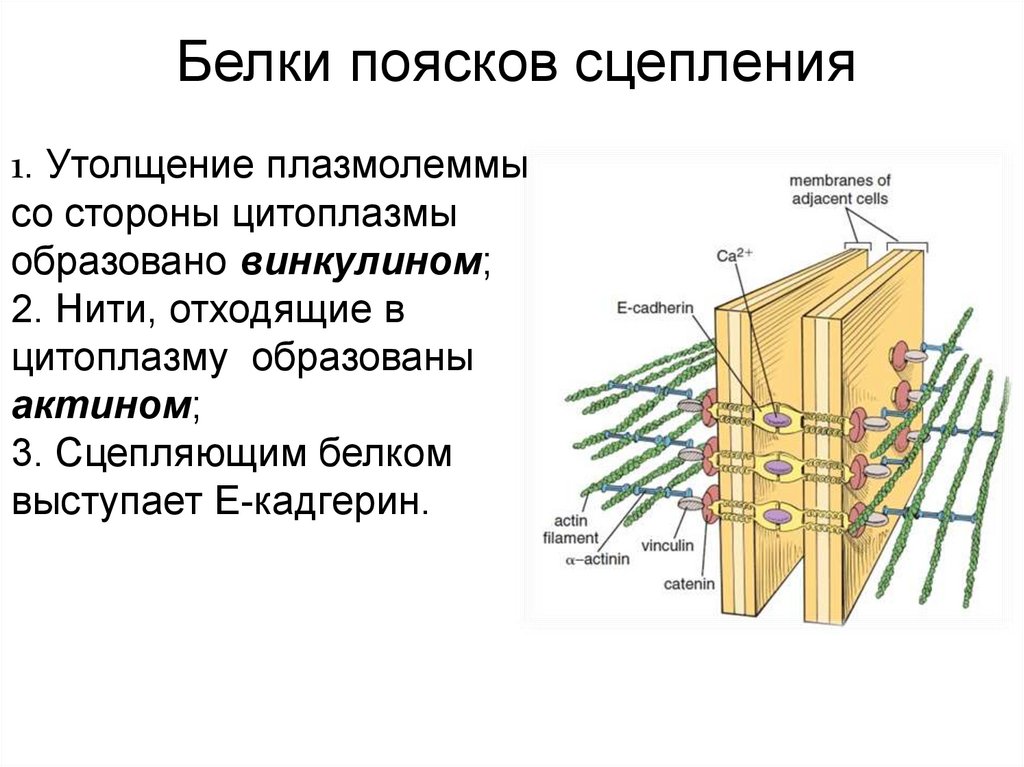
Белки поясков сцепления1. Утолщение плазмолеммы
со стороны цитоплазмы
образовано винкулином;
2. Нити, отходящие в
цитоплазму образованы
актином;
3. Сцепляющим белком
выступает E-кадгерин.
42.
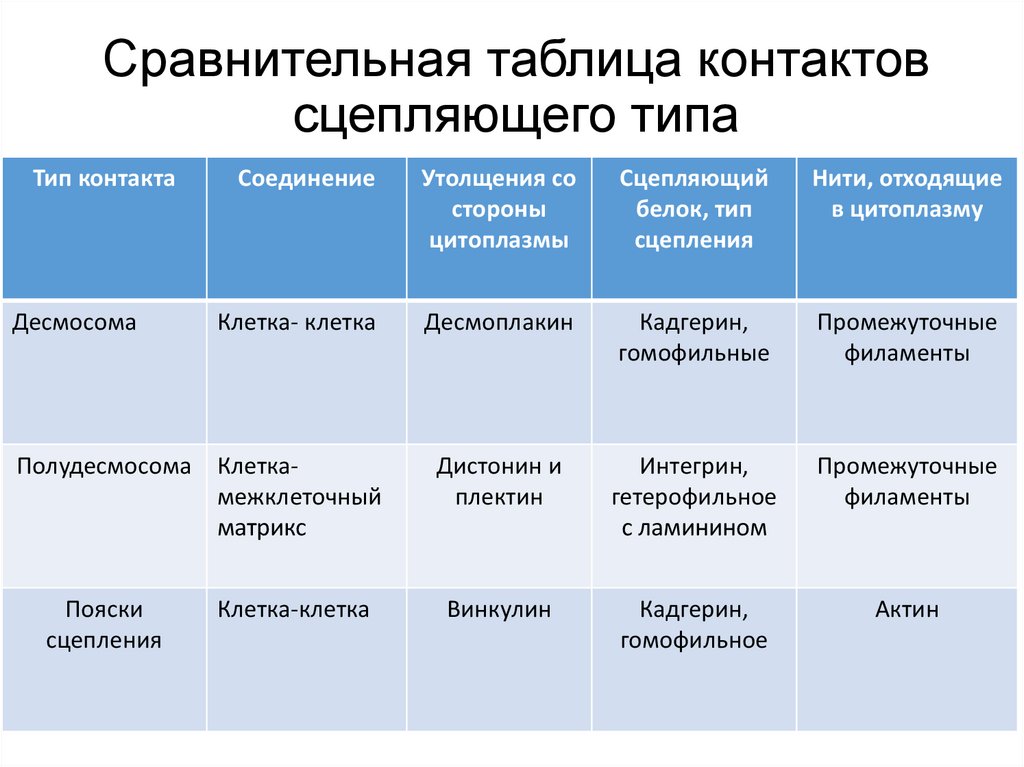
Сравнительная таблица контактовсцепляющего типа
Тип контакта
Соединение
Утолщения со
стороны
цитоплазмы
Сцепляющий
белок, тип
сцепления
Нити, отходящие
в цитоплазму
Клетка- клетка
Десмоплакин
Кадгерин,
гомофильные
Промежуточные
филаменты
Полудесмосома Клеткамежклеточный
матрикс
Дистонин и
плектин
Интегрин,
гетерофильное
с ламинином
Промежуточные
филаменты
Винкулин
Кадгерин,
гомофильное
Актин
Десмосома
Пояски
сцепления
Клетка-клетка
43.
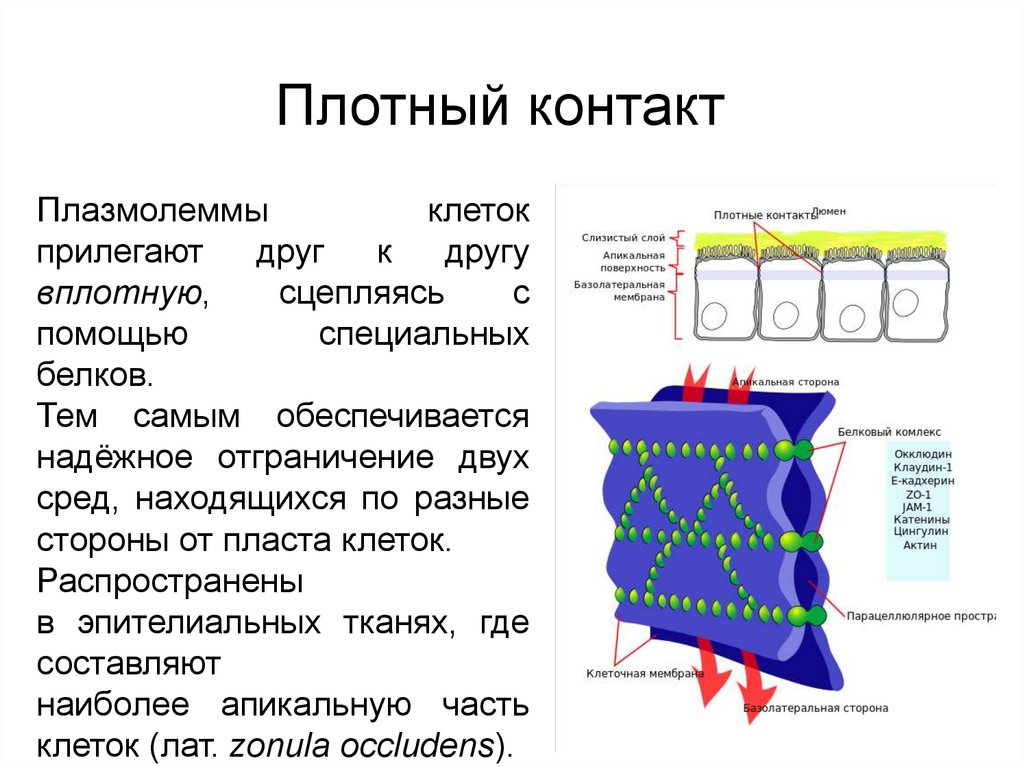
Контакт запирающего типаПлотный контакт
Плазмолеммы
клеток
прилегают
друг
к
другу
вплотную,
сцепляясь
с
помощью
специальных
белков.
Тем самым обеспечивается
надёжное отграничение двух
сред, находящихся по разные
стороны от пласта клеток.
Распространены
в эпителиальных тканях, где
составляют
наиболее апикальную часть
клеток (лат. zonula occludens).
44.
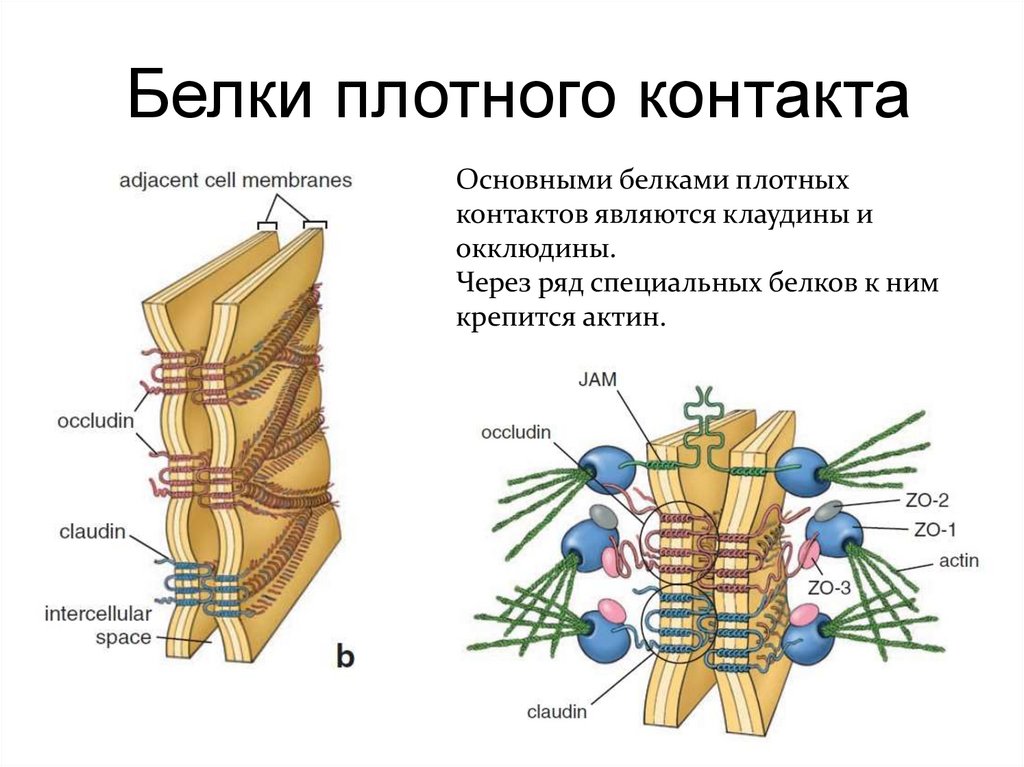
Белки плотного контактаОсновными белками плотных
контактов являются клаудины и
окклюдины.
Через ряд специальных белков к ним
крепится актин.
45.
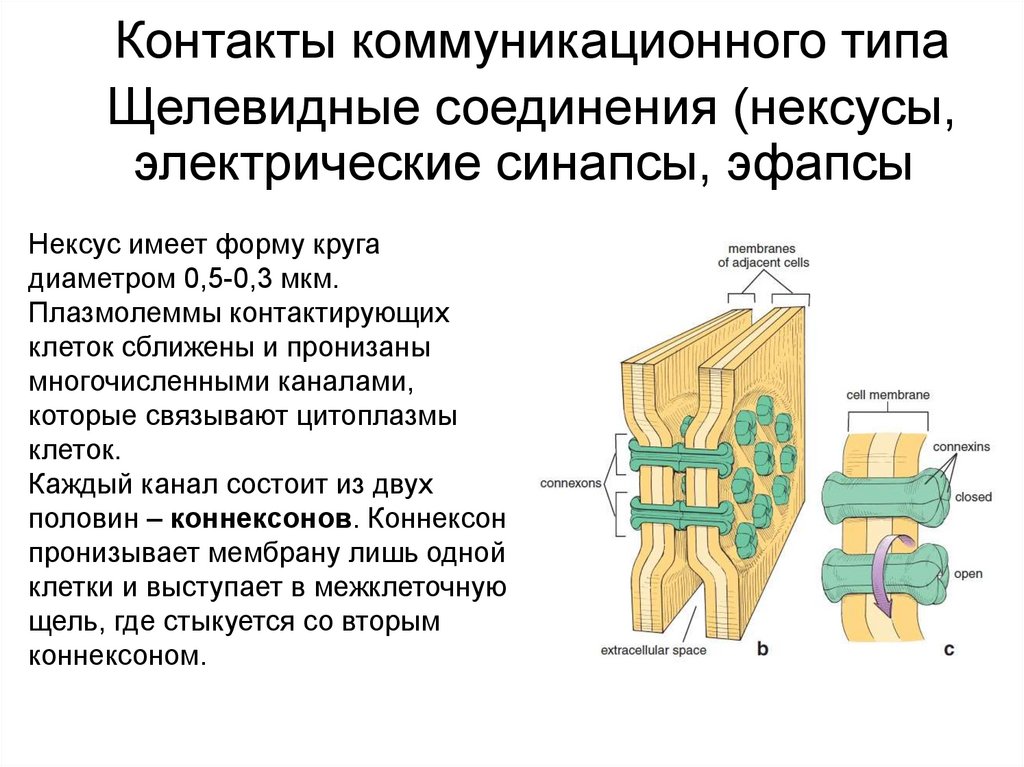
Контакты коммуникационного типаЩелевидные соединения (нексусы,
электрические синапсы, эфапсы)
Нексус имеет форму круга
диаметром 0,5-0,3 мкм.
Плазмолеммы контактирующих
клеток сближены и пронизаны
многочисленными каналами,
которые связывают цитоплазмы
клеток.
Каждый канал состоит из двух
половин – коннексонов. Коннексон
пронизывает мембрану лишь одной
клетки и выступает в межклеточную
щель, где стыкуется со вторым
коннексоном.
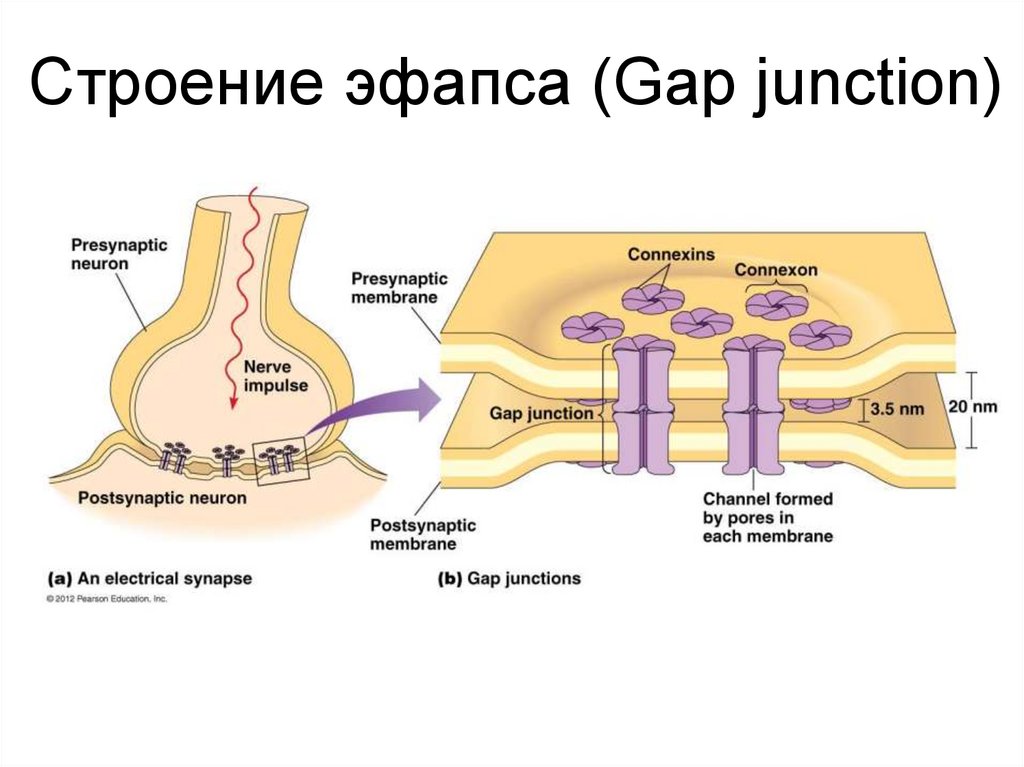
46.
Строение эфапса (Gap junction)47.
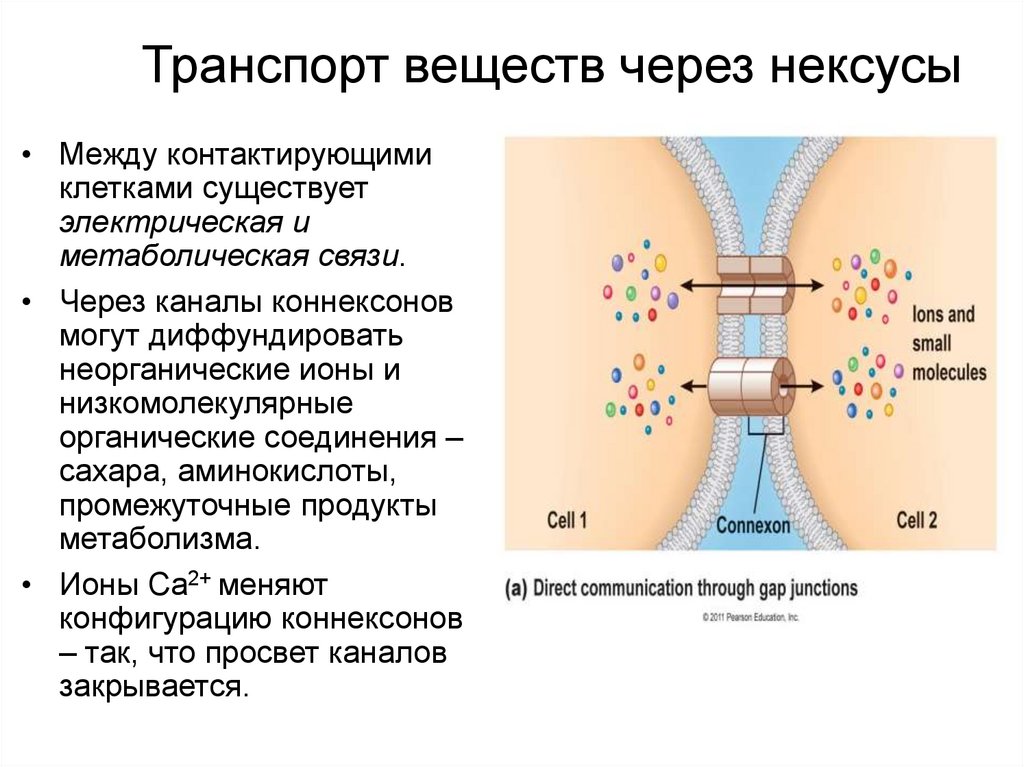
Транспорт веществ через нексусы• Между контактирующими
клетками существует
электрическая и
метаболическая связи.
• Через каналы коннексонов
могут диффундировать
неорганические ионы и
низкомолекулярные
органические соединения –
сахара, аминокислоты,
промежуточные продукты
метаболизма.
• Ионы Ca2+ меняют
конфигурацию коннексонов
– так, что просвет каналов
закрывается.
48.
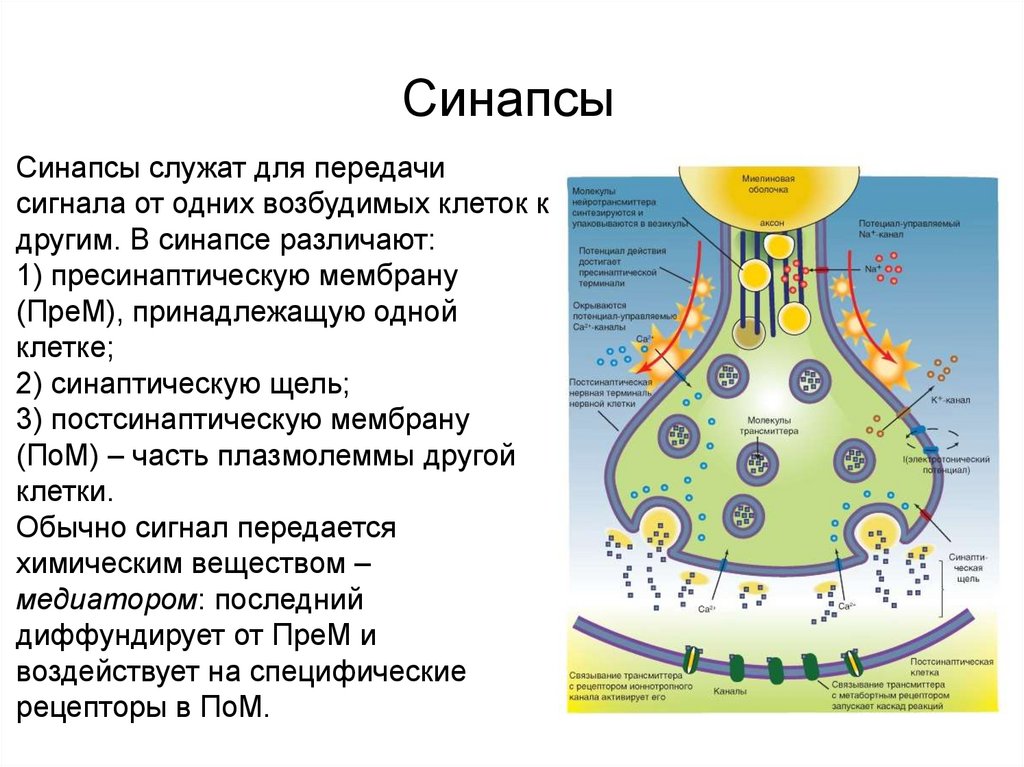
Контакты коммуникационного типаСинапсы
Синапсы служат для передачи
сигнала от одних возбудимых клеток к
другим. В синапсе различают:
1) пресинаптическую мембрану
(ПреМ), принадлежащую одной
клетке;
2) синаптическую щель;
3) постсинаптическую мембрану
(ПоМ) – часть плазмолеммы другой
клетки.
Обычно сигнал передается
химическим веществом –
медиатором: последний
диффундирует от ПреМ и
воздействует на специфические
рецепторы в ПоМ.
49.
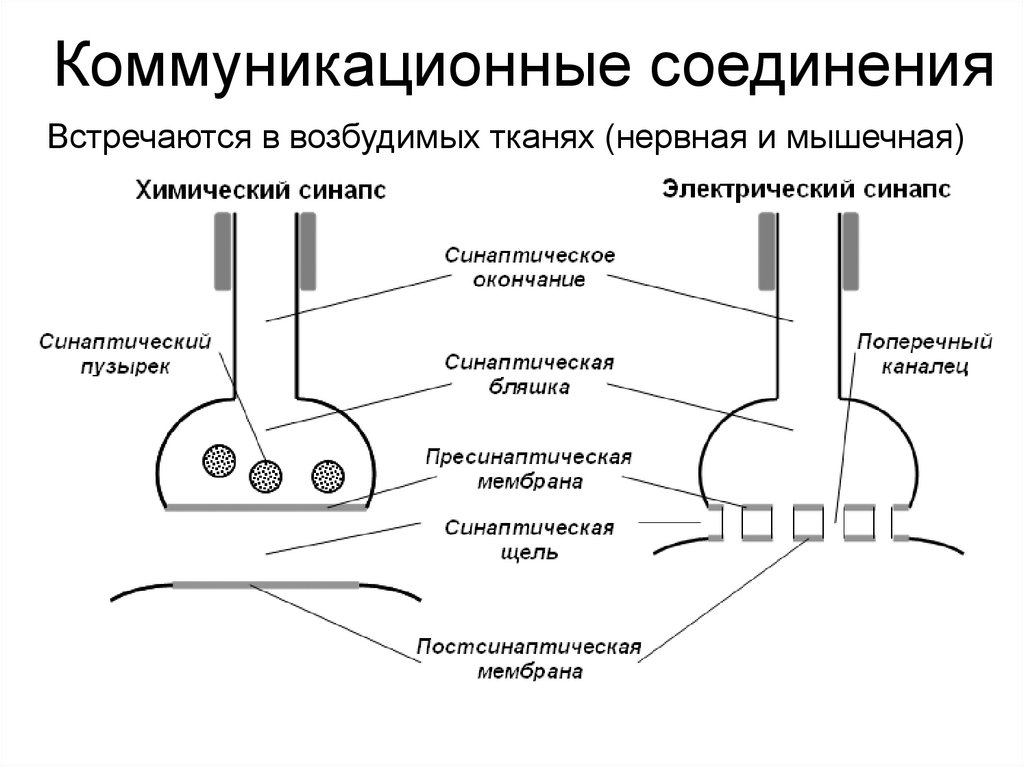
Коммуникационные соединенияВстречаются в возбудимых тканях (нервная и мышечная)
50.
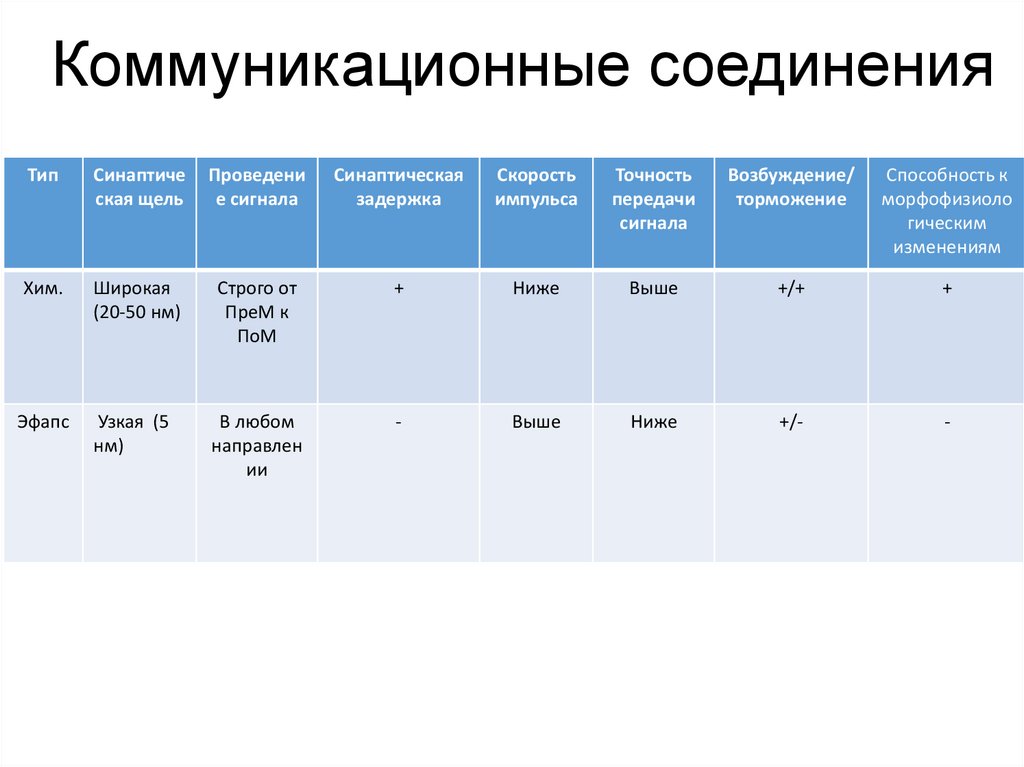
Коммуникационные соединенияТип
Синаптиче
ская щель
Проведени
е сигнала
Синаптическая
задержка
Скорость
импульса
Точность
передачи
сигнала
Возбуждение/
торможение
Способность к
морфофизиоло
гическим
изменениям
Хим.
Широкая
(20-50 нм)
Строго от
ПреМ к
ПоМ
+
Ниже
Выше
+/+
+
Эфапс
Узкая (5
нм)
В любом
направлен
ии
-
Выше
Ниже
+/-
-
51.
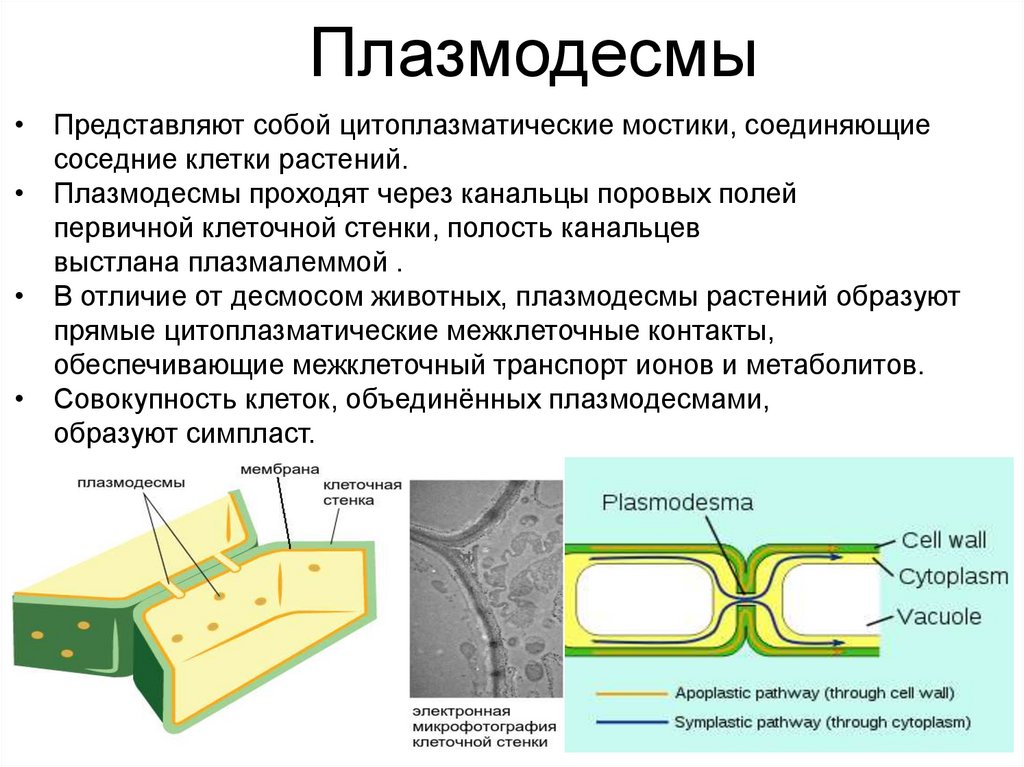
Плазмодесмы• Представляют собой цитоплазматические мостики, соединяющие
соседние клетки растений.
• Плазмодесмы проходят через канальцы поровых полей
первичной клеточной стенки, полость канальцев
выстлана плазмалеммой .
• В отличие от десмосом животных, плазмодесмы растений образуют
прямые цитоплазматические межклеточные контакты,
обеспечивающие межклеточный транспорт ионов и метаболитов.
• Совокупность клеток, объединённых плазмодесмами,
образуют симпласт.
52.
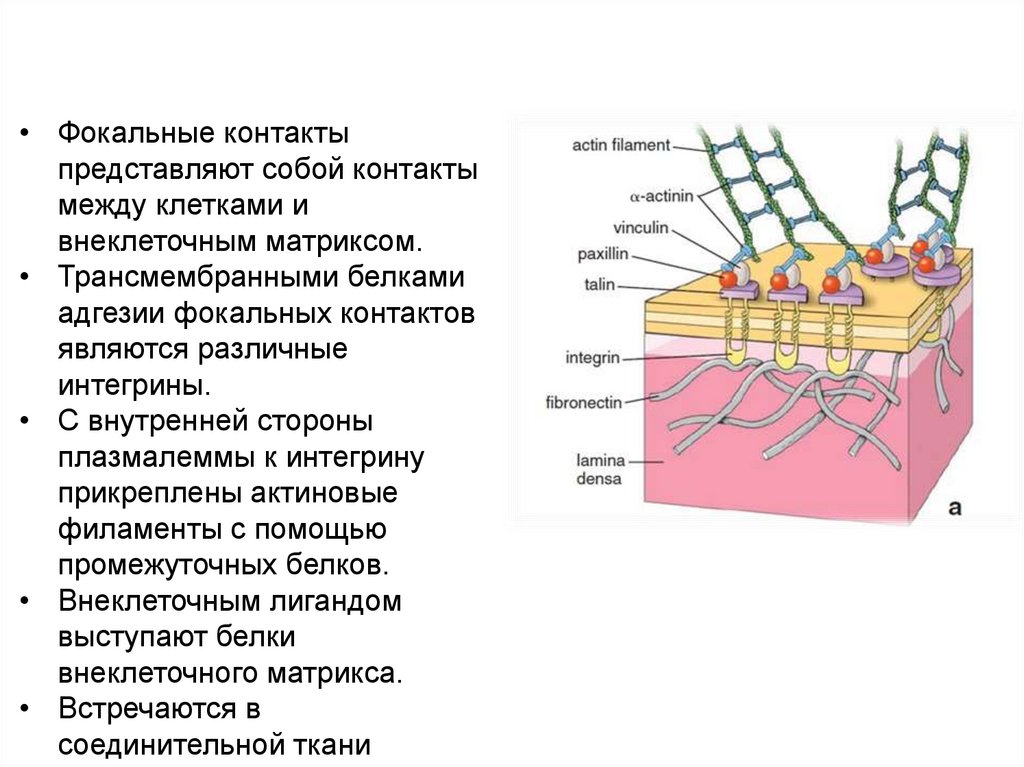
Фокальные контакты клеток• Фокальные контакты
представляют собой контакты
между клетками и
внеклеточным матриксом.
• Трансмембранными белками
адгезии фокальных контактов
являются различные
интегрины.
• С внутренней стороны
плазмалеммы к интегрину
прикреплены актиновые
филаменты с помощью
промежуточных белков.
• Внеклеточным лигандом
выступают белки
внеклеточного матрикса.
• Встречаются в
соединительной ткани
53.
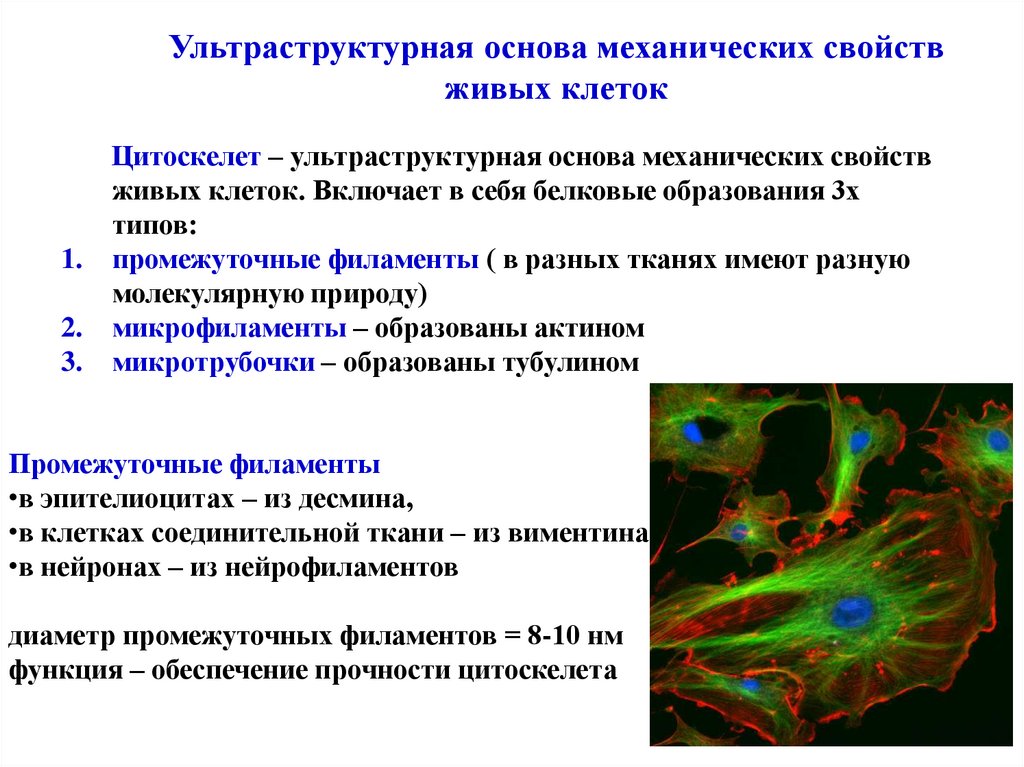
Ультраструктурная основа механических свойствживых клеток
Цитоскелет – ультраструктурная основа механических свойств
живых клеток. Включает в себя белковые образования 3х
типов:
1. промежуточные филаменты ( в разных тканях имеют разную
молекулярную природу)
2. микрофиламенты – образованы актином
3. микротрубочки – образованы тубулином
Промежуточные филаменты
•в эпителиоцитах – из десмина,
•в клетках соединительной ткани – из виментина
•в нейронах – из нейрофиламентов
диаметр промежуточных филаментов = 8-10 нм
функция – обеспечение прочности цитоскелета
54.
Строение промежуточных филаментов. Доменная структура белковыхмолекул промежуточных филаментов консервативна. Полипептид
обычно имеет 2 глобулярных домена на N- и C-концах, которые
соединены протяженным суперскрученным палочковидным доменом,
состоящим из альфа-спиралей. Основной строительный блок
филамента — димер, а не мономер. Он образован двумя
полипептидными цепями, обычно двух разных белков, которые
взаимодействуют между собой своими палочковидными доменами,
образующими двойную суперскрученную спираль.
55.
Кератины – семейство, содержащее более 30 белков,богатых серой. Содержится в коже, волосах, ногтях
человека, шкурах и копытах животных. В каждой
клетке сосредоточено по 2 типа кератина. Кератины
образуют левозакрученную альфа-спираль из 3х
полипептидных цепей. Шаг спирали составляет 6,5
нм при длине 60-90 нм. Диаметр такого филамента
– 8 нм.
Кератины формируют рыхлую 3х мерную сеть,
образующую десмосомы.
56.
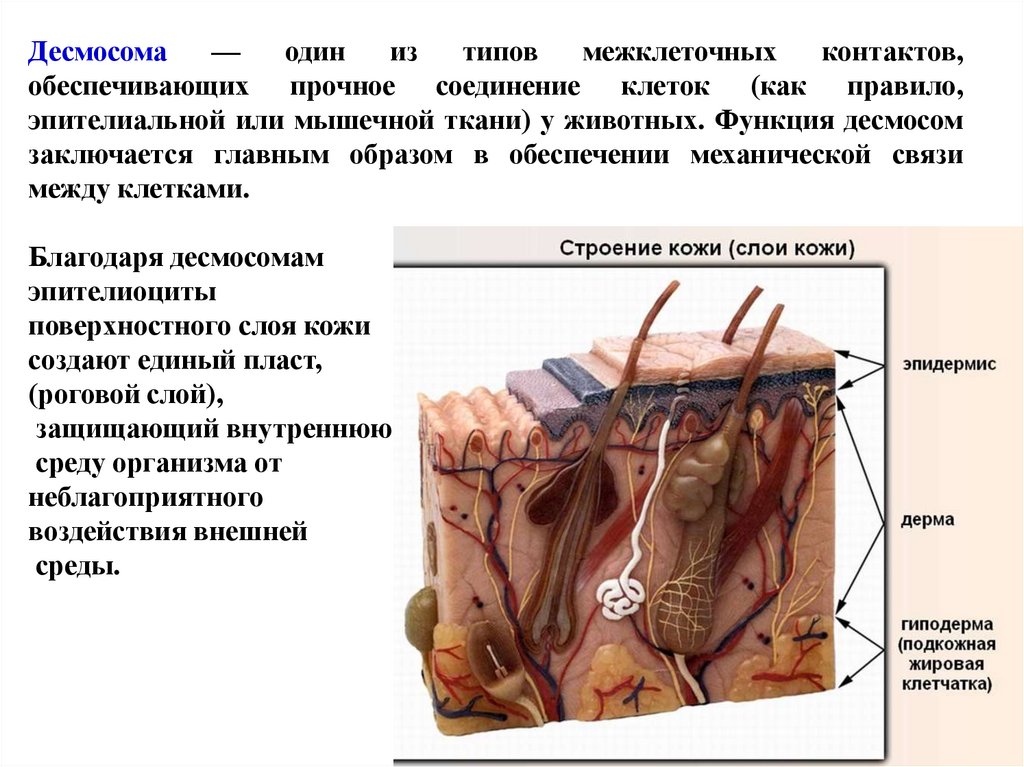
Десмосома—
один
из
типов
межклеточных
контактов,
обеспечивающих прочное соединение клеток (как правило,
эпителиальной или мышечной ткани) у животных. Функция десмосом
заключается главным образом в обеспечении механической связи
между клетками.
Благодаря десмосомам
эпителиоциты
поверхностного слоя кожи
создают единый пласт,
(роговой слой),
защищающий внутреннюю
среду организма от
неблагоприятного
воздействия внешней
среды.
57.
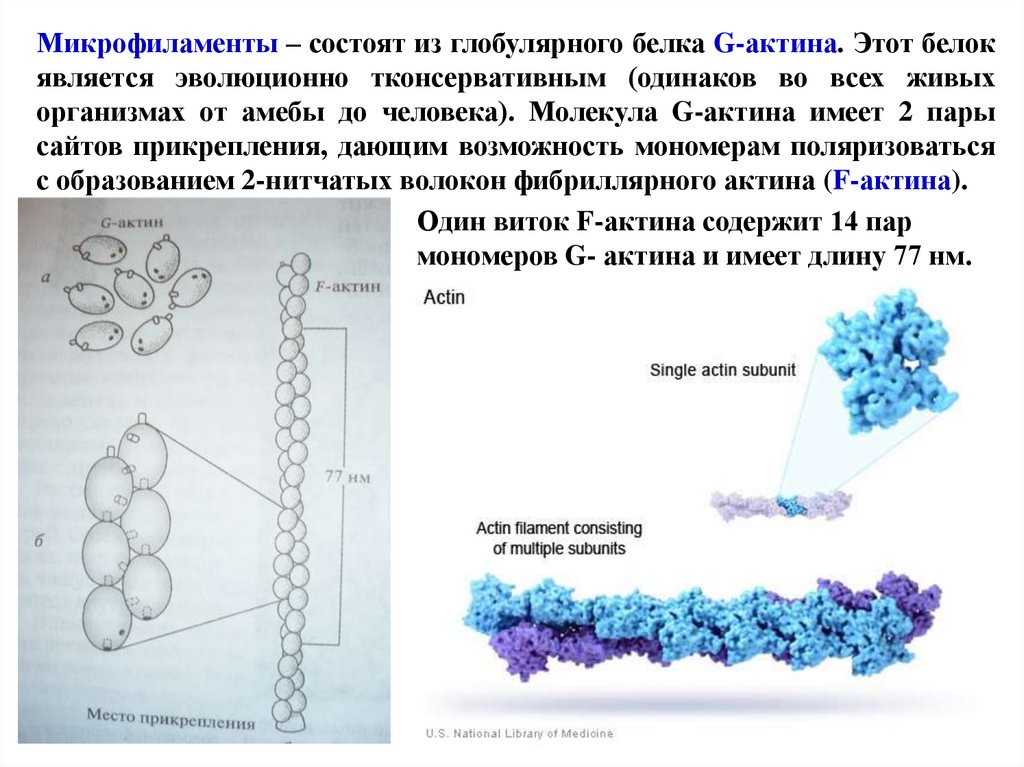
Микрофиламенты – состоят из глобулярного белка G-актина. Этот белокявляется эволюционно тконсервативным (одинаков во всех живых
организмах от амебы до человека). Молекула G-актина имеет 2 пары
сайтов прикрепления, дающим возможность мономерам поляризоваться
с образованием 2-нитчатых волокон фибриллярного актина (F-актина).
Один виток F-актина содержит 14 пар
мономеров G- актина и имеет длину 77 нм.
58.
На положительном полюсе актинового микрофиламента происходитполимеризация (присоединение молекул G-актина), а на отрицательном
полюсе – деполимеризация. Полимеризация актина происходит за счет
гидролиза АТФ.
Актиновые олигомеры прикрепляются к плоским дискообразным
структурам на внутренней поверхности мембраны, образуя актинспектриновую сеть. Помимо спектрина функцию «якорного белка»
могут выполнять винкулин, анкерин и спектрин.
цитоскелет эритроцита
59.
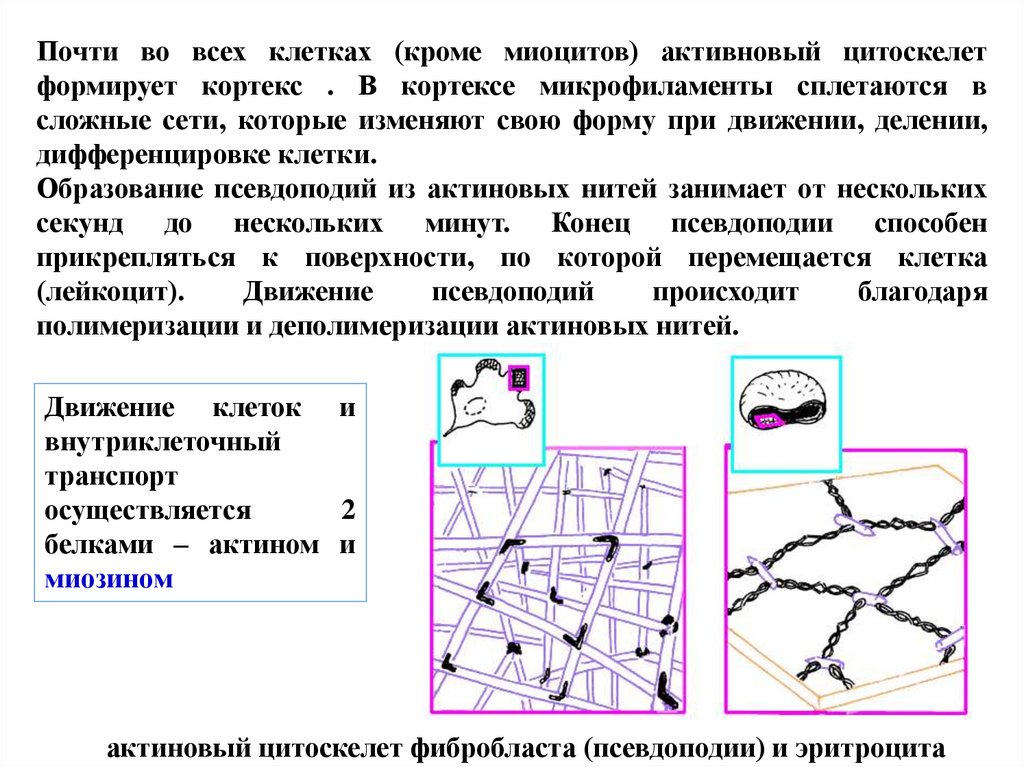
Почти во всех клетках (кроме миоцитов) активновый цитоскелетформирует кортекс . В кортексе микрофиламенты сплетаются в
сложные сети, которые изменяют свою форму при движении, делении,
дифференцировке клетки.
Образование псевдоподий из актиновых нитей занимает от нескольких
секунд до нескольких минут. Конец псевдоподии способен
прикрепляться к поверхности, по которой перемещается клетка
(лейкоцит).
Движение
псевдоподий
происходит
благодаря
полимеризации и деполимеризации актиновых нитей.
Движение клеток и
внутриклеточный
транспорт
осуществляется
2
белками – актином и
миозином
актиновый цитоскелет фибробласта (псевдоподии) и эритроцита
60.
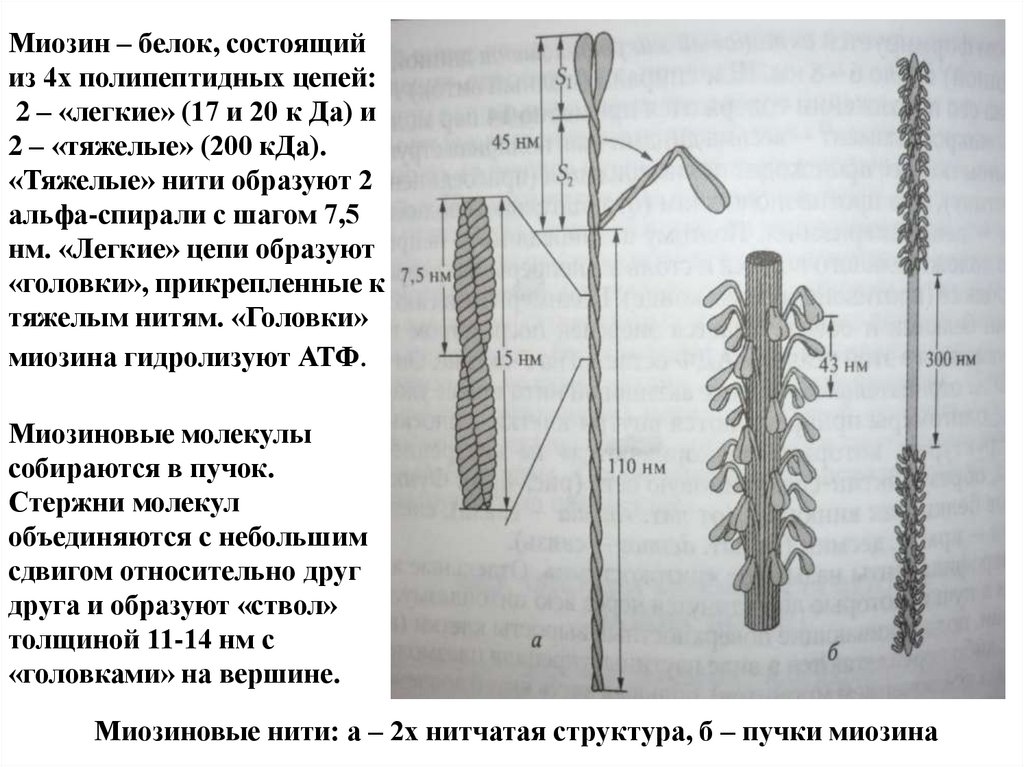
Миозин – белок, состоящийиз 4х полипептидных цепей:
2 – «легкие» (17 и 20 к Да) и
2 – «тяжелые» (200 кДа).
«Тяжелые» нити образуют 2
альфа-спирали с шагом 7,5
нм. «Легкие» цепи образуют
«головки», прикрепленные к
тяжелым нитям. «Головки»
миозина гидролизуют АТФ.
Миозиновые молекулы
собираются в пучок.
Стержни молекул
объединяются с небольшим
сдвигом относительно друг
друга и образуют «ствол»
толщиной 11-14 нм с
«головками» на вершине.
Миозиновые нити: а – 2х нитчатая структура, б – пучки миозина
61.
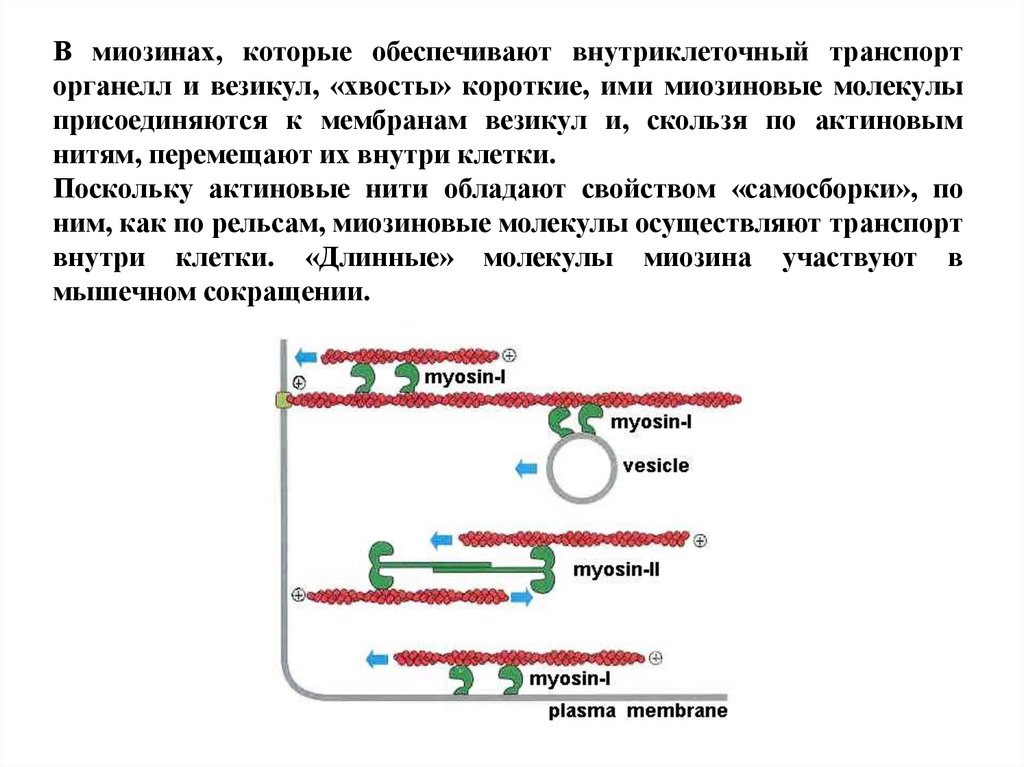
В миозинах, которые обеспечивают внутриклеточный транспорторганелл и везикул, «хвосты» короткие, ими миозиновые молекулы
присоединяются к мембранам везикул и, скользя по актиновым
нитям, перемещают их внутри клетки.
Поскольку актиновые нити обладают свойством «самосборки», по
ним, как по рельсам, миозиновые молекулы осуществляют транспорт
внутри клетки. «Длинные» молекулы миозина участвуют в
мышечном сокращении.
62.
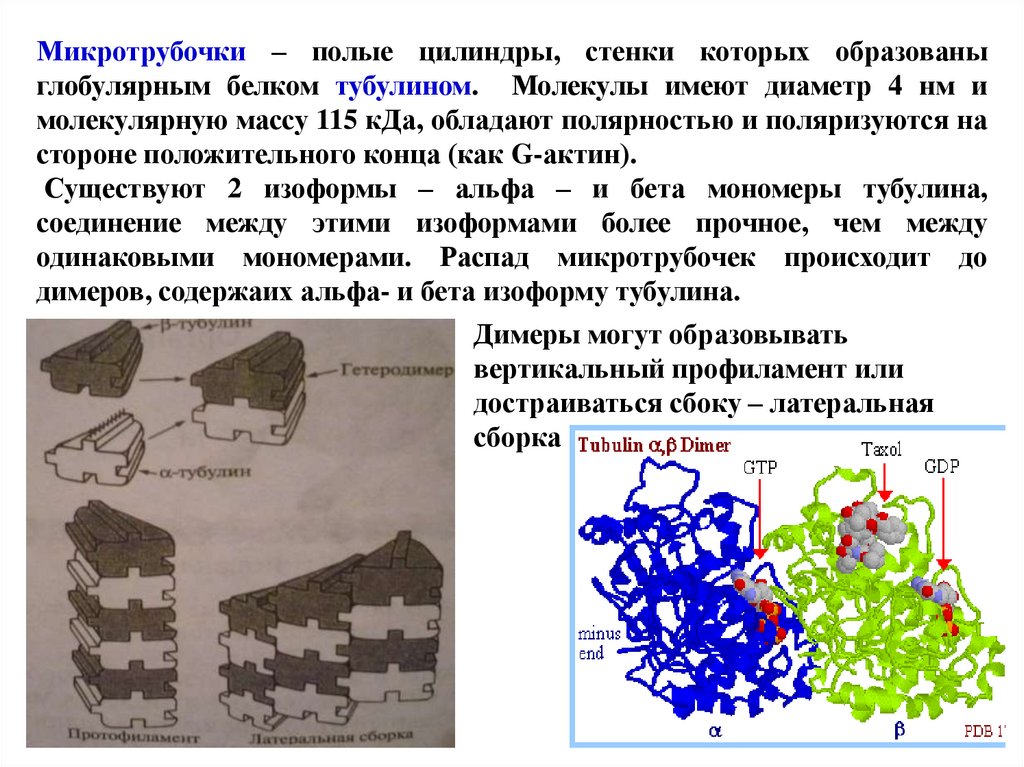
Микротрубочки – полые цилиндры, стенки которых образованыглобулярным белком тубулином. Молекулы имеют диаметр 4 нм и
молекулярную массу 115 кДа, обладают полярностью и поляризуются на
стороне положительного конца (как G-актин).
Существуют 2 изоформы – альфа – и бета мономеры тубулина,
соединение между этими изоформами более прочное, чем между
одинаковыми мономерами. Распад микротрубочек происходит до
димеров, содержаих альфа- и бета изоформу тубулина.
Димеры могут образовывать
вертикальный профиламент или
достраиваться сбоку – латеральная
сборка
63.
При латеральной сборке образуется полый цилиндр с наружнымдиаметром 28 нм и внутренним – 14 нм. Энергетическрое обеспечение
сборки микротрубочек осуществляется при гидролизе ГТФ, а не АТФ.
В аксонах нейронов по каналам их микротрубочек осуществляется
транспорт веществ от тела нейрона на периферию – аксональный
транспорт.
По
наружной
поверхности
микротрубочек,
подобно
актину,
осуществляется транспорт веществ белками динеинами и кинезинами.
Они одним концом контактируют с наружной поверхностью
микротрубочки и при гидролизе АТФ могут двигаться по ней. Другой их
конец прикрепляется к транспортируемым органоидам или
цитоплазме. Прикрепление к цитоплазме необходимо для перемещения
частей клетки относительно друг друга.
64.
Кинезины – семейство белков, представляющих собой гетеродимерывытянутой формы. Имеет 2 «тяжелые» цепи (120 кДа) – образуют
«хвост» и 2 «легкие» полипептидные цепи по 70 кДа – образуют
«головки». Строение похоже на миозин. «Хвост» кинезина
прикрепляется к структурам, которые он транспортирует, а «головки» –
к микротрубочкам. «Головки» содержат активные центры для
гидролиза ГТФ.
Кинезины обеспечивают изменение формы клеток, участвуют в работе
ЭПС по синтезу макромолекул, подтягивая мономеры по
микротрубочке к месту сборки полимеров.
65.
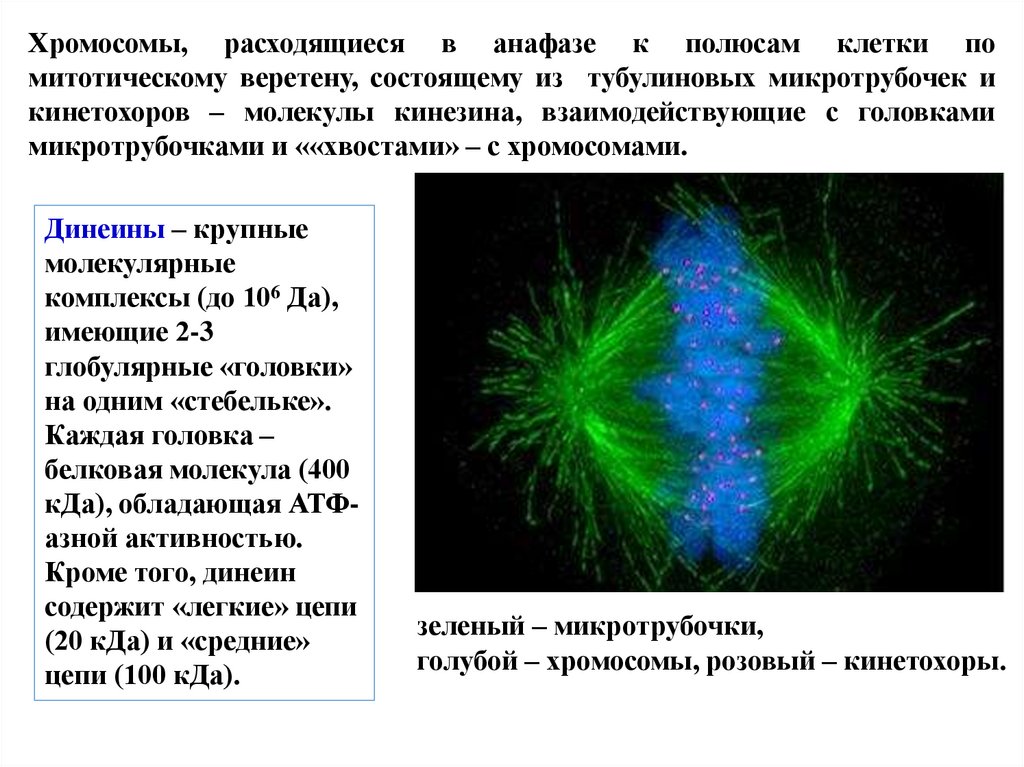
Хромосомы, расходящиеся в анафазе к полюсам клетки помитотическому веретену, состоящему из тубулиновых микротрубочек и
кинетохоров – молекулы кинезина, взаимодействующие с головками
микротрубочками и ««хвостами» – с хромосомами.
Динеины – крупные
молекулярные
комплексы (до 106 Да),
имеющие 2-3
глобулярные «головки»
на одним «стебельке».
Каждая головка –
белковая молекула (400
кДа), обладающая АТФазной активностью.
Кроме того, динеин
содержит «легкие» цепи
(20 кДа) и «средние»
цепи (100 кДа).
зеленый – микротрубочки,
голубой – хромосомы, розовый – кинетохоры.
66.
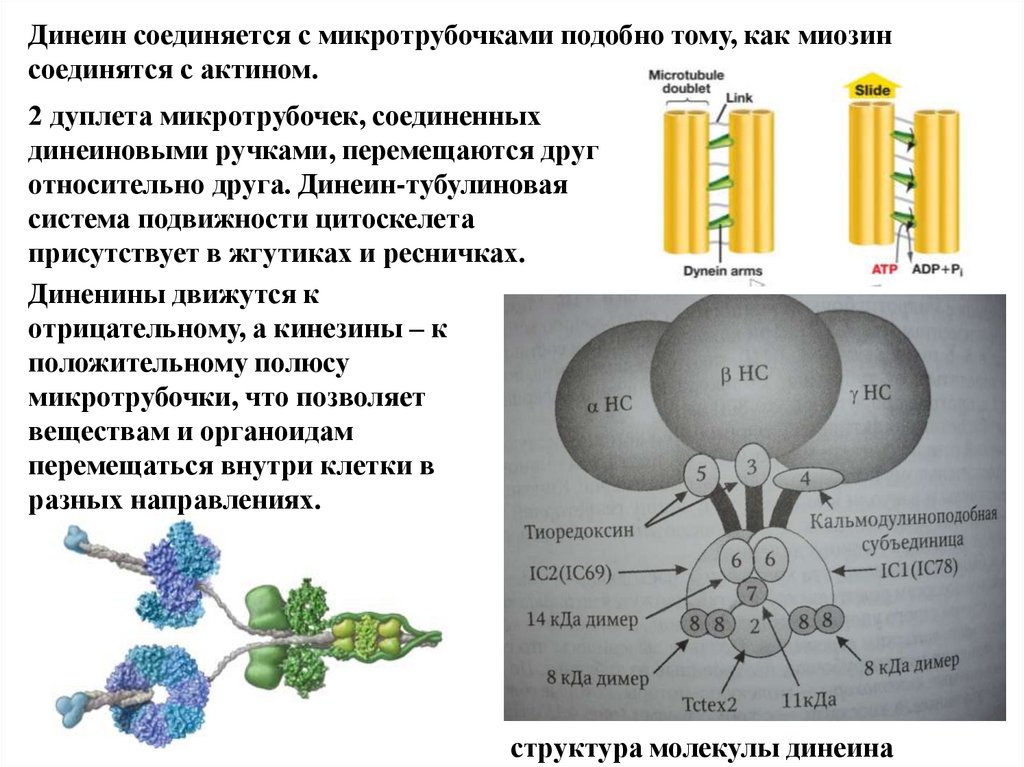
Динеин соединяется с микротрубочками подобно тому, как миозинсоединятся с актином.
2 дуплета микротрубочек, соединенных
динеиновыми ручками, перемещаются друг
относительно друга. Динеин-тубулиновая
система подвижности цитоскелета
присутствует в жгутиках и ресничках.
Диненины движутся к
отрицательному, а кинезины – к
положительному полюсу
микротрубочки, что позволяет
веществам и органоидам
перемещаться внутри клетки в
разных направлениях.
структура молекулы динеина
67.
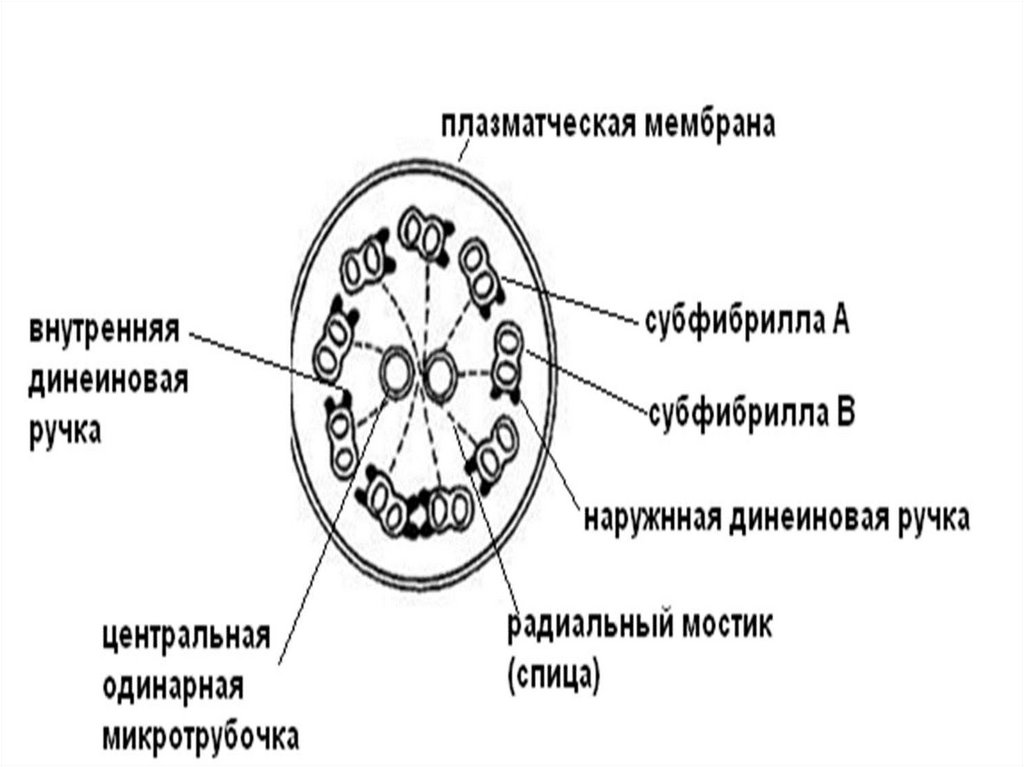
68.
Под плазмолеммой реснички находится аксонема (9 пар микротрубочек,связанных динеиновыми ручками). В центре реснички находятся
одинарные микротрубочки, заключенные в общую капсулу.
Периферические пары микротрубочек соединены с центральными
радиальными мостиками.
Периферические дуплеты состоят из одной полной (А), содержащей 13
тубулиновых филаментов и неполной (В), содержащей 10 тубулиновых
филаментов. Прикрепленные к ним динеиновые ручки способствую
перемещению микротрубочек относительно друг друга.
Изгибание ресничек происходит за счет гидролиза АТФ головками
динеиновых ручек. Благодаря прочно связанной структуре ресничка не
распадается при движении на отдельные микротрубочки, а только
изгибается.
69.
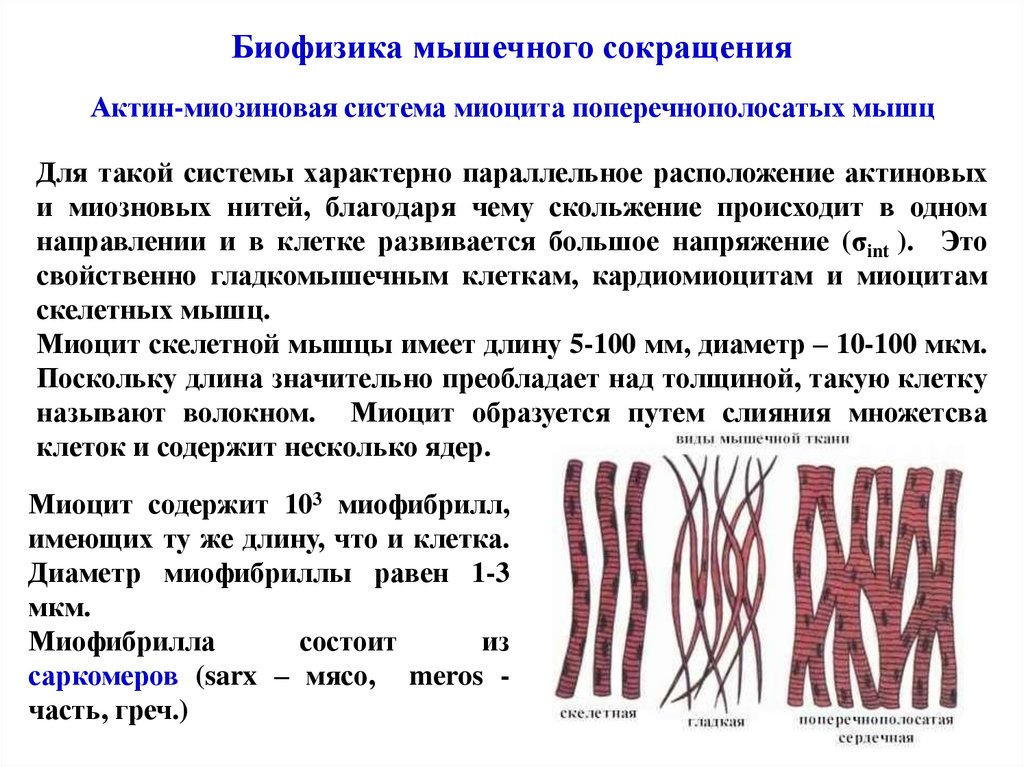
Биофизика мышечного сокращенияАктин-миозиновая система миоцита поперечнополосатых мышц
Для такой системы характерно параллельное расположение актиновых
и миозновых нитей, благодаря чему скольжение происходит в одном
направлении и в клетке развивается большое напряжение (σint ). Это
свойственно гладкомышечным клеткам, кардиомиоцитам и миоцитам
скелетных мышц.
Миоцит скелетной мышцы имеет длину 5-100 мм, диаметр – 10-100 мкм.
Поскольку длина значительно преобладает над толщиной, такую клетку
называют волокном. Миоцит образуется путем слияния множетсва
клеток и содержит несколько ядер.
Миоцит содержит 103 миофибрилл,
имеющих ту же длину, что и клетка.
Диаметр миофибриллы равен 1-3
мкм.
Миофибрилла
состоит
из
саркомеров (sarx – мясо, meros часть, греч.)
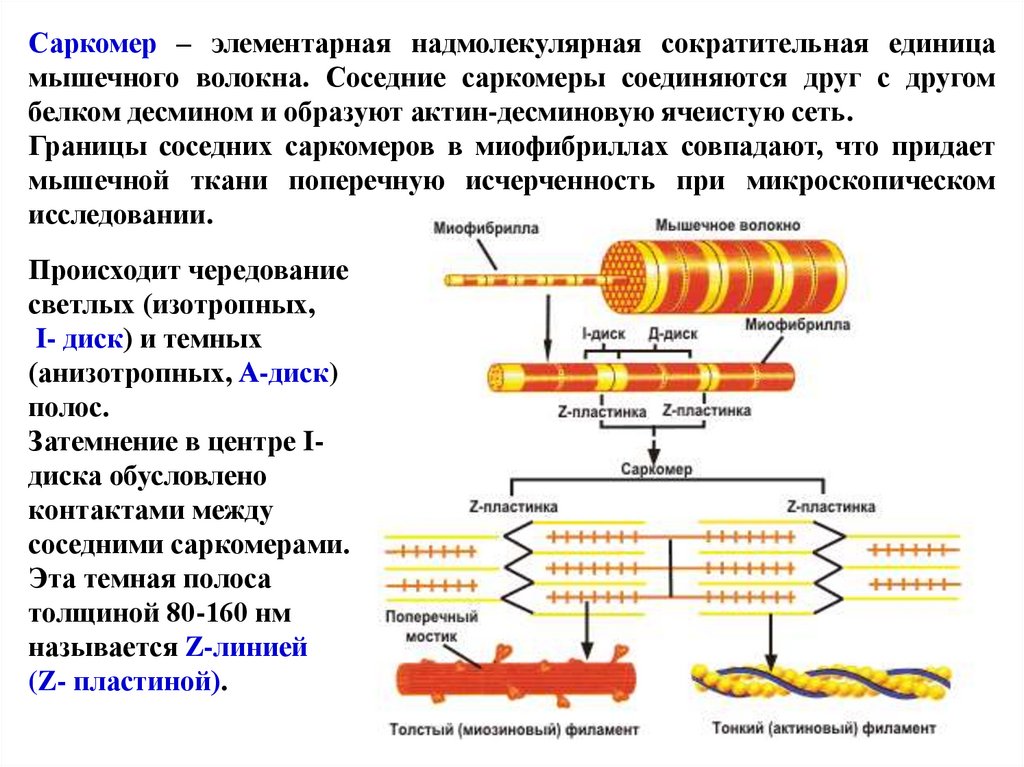
70.
Саркомер – элементарная надмолекулярная сократительная единицамышечного волокна. Соседние саркомеры соединяются друг с другом
белком десмином и образуют актин-десминовую ячеистую сеть.
Границы соседних саркомеров в миофибриллах совпадают, что придает
мышечной ткани поперечную исчерченность при микроскопическом
исследовании.
Происходит чередование
светлых (изотропных,
I- диск) и темных
(анизотропных, А-диск)
полос.
Затемнение в центре Iдиска обусловлено
контактами между
соседними саркомерами.
Эта темная полоса
толщиной 80-160 нм
называется Z-линией
(Z- пластиной).
71.
Саркомер состоит из тонких (актиновых) и толстых (миозиновых)филаментов, которые называют протофибриллами. В 1 миофибрилле
содержится 2500 протофибрилл.
I-диск соответствует участку, где расположены только актиновые нити,
а в А-диске происходит перекрывание актиновых и миозиновых
филаментов. В центре А-диска есть светлый участок – Н-зона, в которой
присутствуют только миозиновые нити.
72.
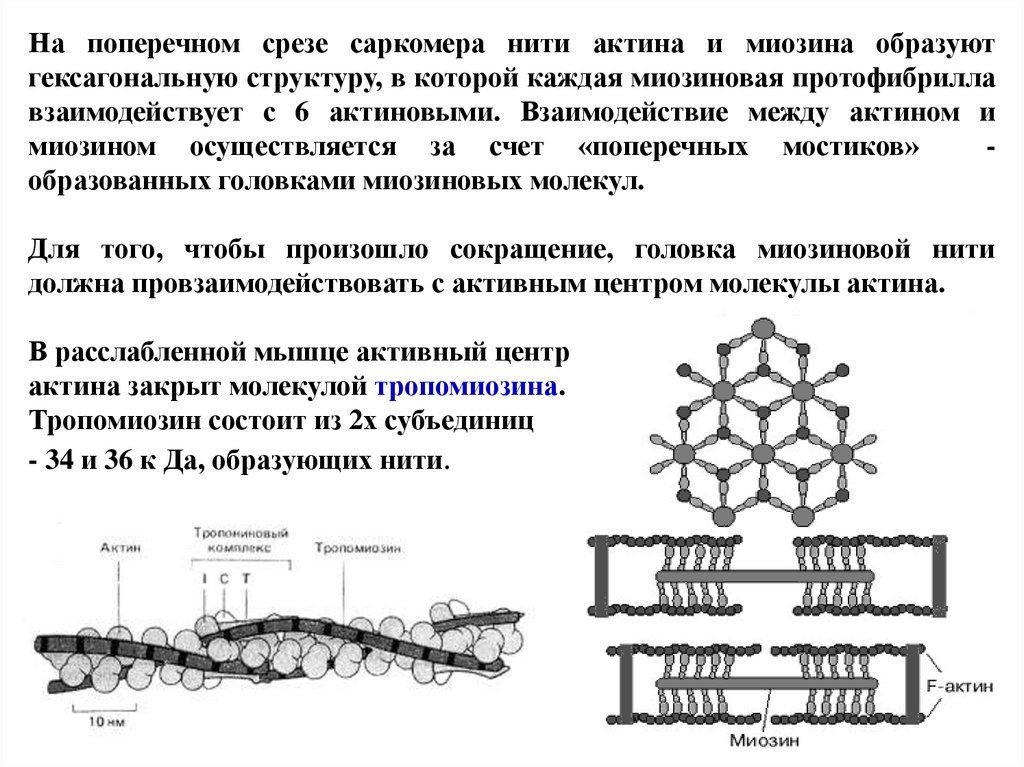
На поперечном срезе саркомера нити актина и миозина образуютгексагональную структуру, в которой каждая миозиновая протофибрилла
взаимодействует с 6 актиновыми. Взаимодействие между актином и
миозином осуществляется за счет «поперечных мостиков»
образованных головками миозиновых молекул.
Для того, чтобы произошло сокращение, головка миозиновой нити
должна провзаимодействовать с активным центром молекулы актина.
В расслабленной мышце активный центр
актина закрыт молекулой тропомиозина.
Тропомиозин состоит из 2х субъединиц
- 34 и 36 к Да, образующих нити.
73.
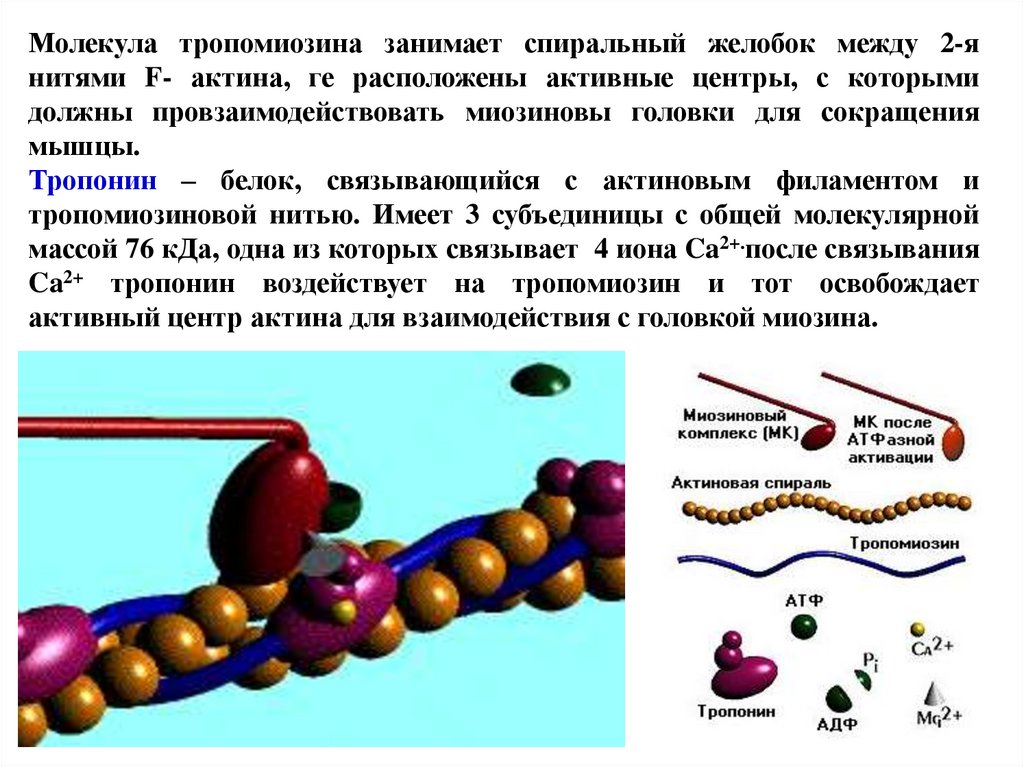
Молекула тропомиозина занимает спиральный желобок между 2-янитями F- актина, ге расположены активные центры, с которыми
должны провзаимодействовать миозиновы головки для сокращения
мышцы.
Тропонин – белок, связывающийся с актиновым филаментом и
тропомиозиновой нитью. Имеет 3 субъединицы с общей молекулярной
массой 76 кДа, одна из которых связывает 4 иона Ca2+.после связывания
Ca2+ тропонин воздействует на тропомиозин и тот освобождает
активный центр актина для взаимодействия с головкой миозина.
74.
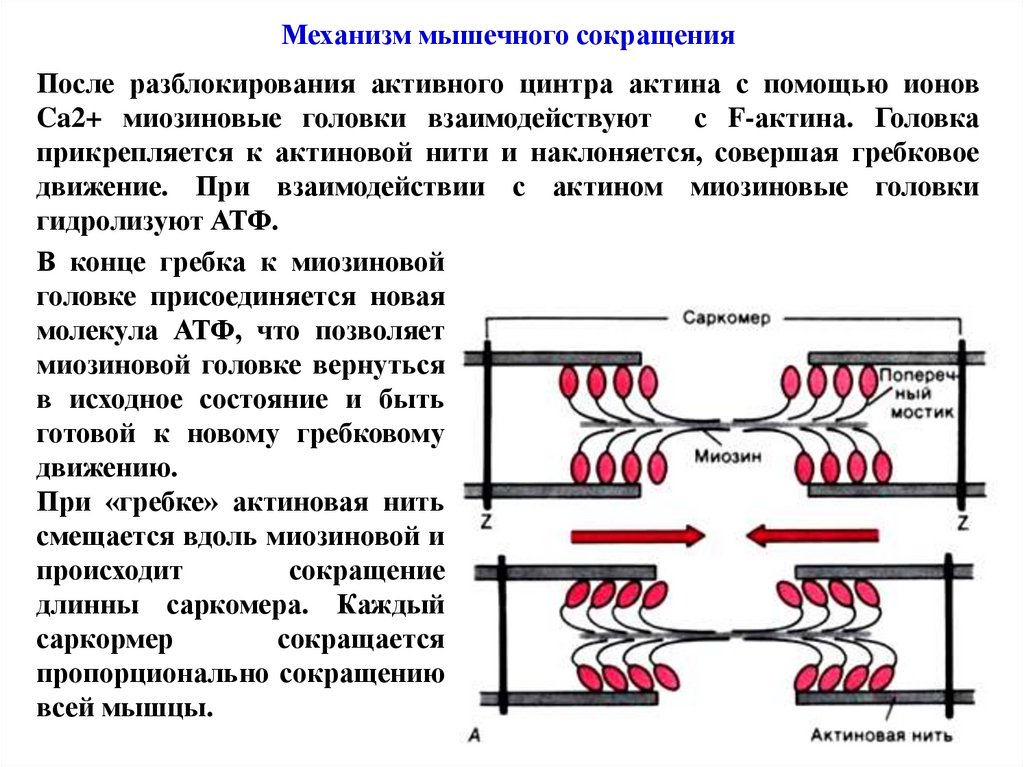
Механизм мышечного сокращенияПосле разблокирования активного цинтра актина с помощью ионов
Ca2+ миозиновые головки взаимодействуют с F-актина. Головка
прикрепляется к актиновой нити и наклоняется, совершая гребковое
движение. При взаимодействии с актином миозиновые головки
гидролизуют АТФ.
В конце гребка к миозиновой
головке присоединяется новая
молекула АТФ, что позволяет
миозиновой головке вернуться
в исходное состояние и быть
готовой к новому гребковому
движению.
При «гребке» актиновая нить
смещается вдоль миозиновой и
происходит
сокращение
длинны саркомера. Каждый
саркормер
сокращается
пропорционально сокращению
всей мышцы.
75.
Максимальнаясила
сокращения
пропорциональна
мышцы
пропорциональна взаимного перекрытия актиновых и миозиновых
нитей. При уменьшении длины саркомера укорачивается только I-диск, а
длина А-диска не изменяется. Для максимального сокращения саркомера
миозиновые мостики должны совершить примерно 50 гребков. При
сокращении 20% энергии, полученной при гидролизе АТФ, переходит в
механическую работу и 80% - в тепло.
Субстраты клеточного
дыхания и кислород
поступают в мышцы из
крови. При тренировке
выносливости
необходимо хорошее
кровоснабжение мышц,
при тренировке силы –
необходимо увеличение
числа миозиновых
мостиков.
расслабление
сокращение
76.
При повышении физической нагрузки происходит гипертрофиямиоцитов, т.к. это дифференцированные клетки, не способные к
делению.
Для сокращения ионы кальция должны поступить к миофибриллам из
саркоплазматической сети (СПС), т.к. концентрация ионов кальция в
покое составляет 10-7 моль, а для сокращения необходима концентрация
5х10-6 моль. СПС занимает 10% объема мышечного волокна и является
депо кальция (концентрация кальция в СПС равна 10-2 моль).
СПС расположена вблизи Z-дисков.
Здесь же находятся выпячивания
сарколеммы, имеющие форму
трубочек (Т).
СПС +Т образуют Т-систему,
реализующую электромеханическое
сопряжение и мышечное
сокращение. Трубочки необходимы
для передачи потенциала действия
от концевых мотонейронов,
который открывает кальциевые
потенциалзависимые L-каналы.
77.
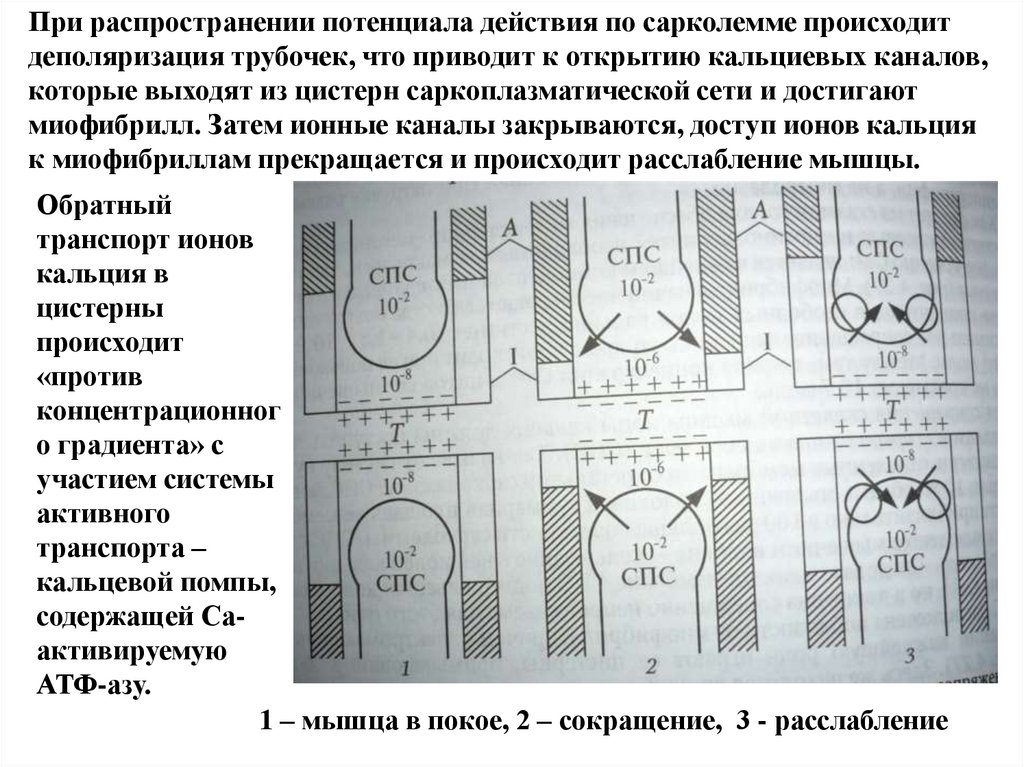
При распространении потенциала действия по сарколемме происходитдеполяризация трубочек, что приводит к открытию кальциевых каналов,
которые выходят из цистерн саркоплазматической сети и достигают
миофибрилл. Затем ионные каналы закрываются, доступ ионов кальция
к миофибриллам прекращается и происходит расслабление мышцы.
Обратный
транспорт ионов
кальция в
цистерны
происходит
«против
концентрационног
о градиента» с
участием системы
активного
транспорта –
кальцевой помпы,
содержащей Саактивируемую
АТФ-азу.
1 – мышца в покое, 2 – сокращение, 3 - расслабление
78.
Схема нервно-мышечного сокращениянервные импульсы, поступающие их спинного
или головного мозга к к нервно-мышечному синапсу
Синаптическая передача с участием АХ и холинорецепторов
генерация ПД на сарколемме и его распространение на Т-трубочки
выход ионов кальция из саркоплазматической сети
скольжение миозина по актиновой цепи и сокращение саркомера
79.
Механические процессы в опорно-двигательном аппаратечеловека
Биомеханические свойства скелетных мышц
содержащихся в ней волокон. Обычно измеряют
поперечное
сечение
мышцы,
которое
пропорционально числу волокон и
по нему
определяют силу мышцы.
Для этого определяют физиологическое поперечное
сечение – сумму поперечных сечений всех волокон,
образующих мышцу.
В скелетных мышцах, где поперечные волокна идут
параллельно продольной оси и прикрепляются к
костям, анатомическое и физиологическое сечение
мышц совпадают. Сильно уменьшаются в длине при
сокращении (проигрыш в силе и выигрыш в
расстоянии)
В перистых мышцах волокна располагаются косо по отношению к
продольной оси и прикрепляются к сухожилию. При сокращении
происходит малое перемещение мышцы и развивается большая сила
(выигрыш в силе и проигрыш в расстоянии)
80.
Соотношение сил, развиваемых мышцами с параллельными волокнамии перистыми мышцами рассчитывают по формуле:
F1 2l
sin n 2 sin 2
F2 nb
F1 – сила сокращения перистой мышцы
F2 – сила сокращения мышцы с параллельным расположением волокон
l - длина мышцы в покое
n – доля этой длины при сокращении
b - средняя толщина мышцы
α – угол между сухожилием и волокнами перистой мышцы
Для скелетных мышц обычно n<0,7, т.е. они сокращаются меньше, чем
на 70% от первоначальной длины
Для перистных мышц α<30º, часто они сильнее мышц с параллельным
ходом волокон. Перистые мышцы практически не утолщаются.
81.
Абсолютная мышечная сила – отношение абсолютного веса груза,который может поднять мышца, к ее физиологическому поперечному
сечению. У человека скелетные мышцы имеют силу около 106 Па, а
гладкие - 105 Па.
Функции скелетных мышц:
1. Поддержание определенной позы (противостояние притяжению
Земли)
2. Перемещение частей тела относительно друг друга
3. Передвижение человека в пространстве.
Типы мышечных сокращений:
1.
2.
Изометрическое – длина мышцы практически не изменяется, вся
сила затрачивается на совершение статической работы
Изотоническое – мышечные волокна сокращаются в условиях
постоянной внешней нагрузки. Происходит быстрое сокращение
мышцы, сменяющееся ее расслаблением.
82.
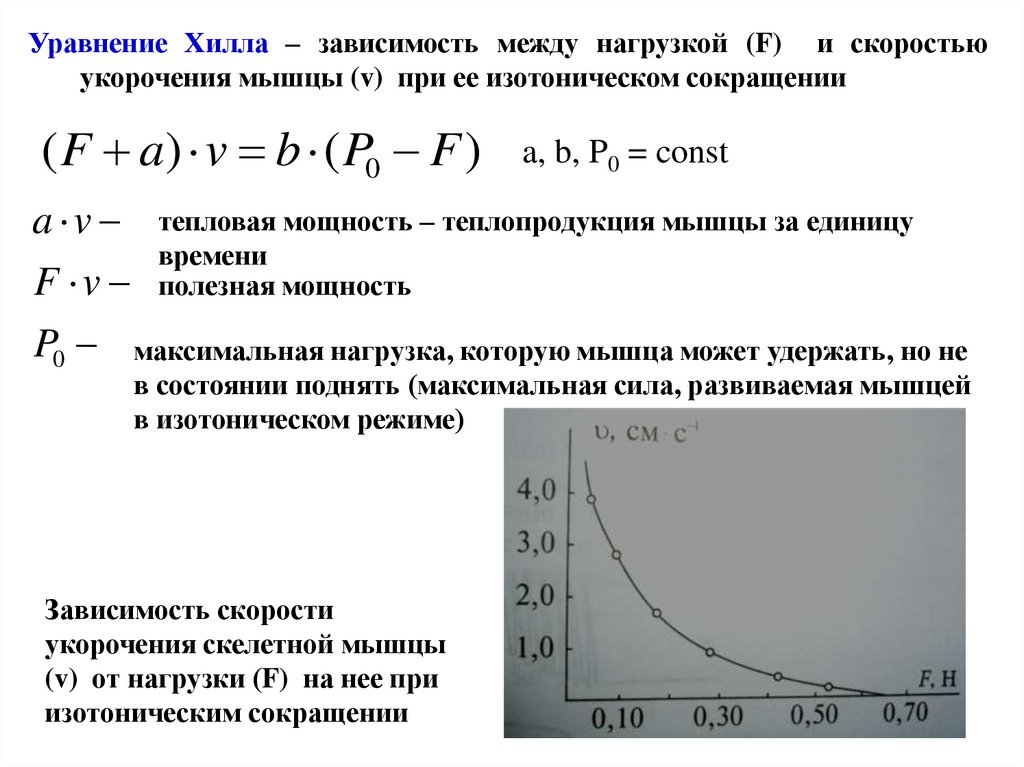
Уравнение Хилла – зависимость между нагрузкой (F) и скоростьюукорочения мышцы (v) при ее изотоническом сокращении
( F a) v b ( P0 F )
a, b, P0 = const
a v тепловая мощность – теплопродукция мышцы за единицу
времени
F v полезная мощность
P0 максимальная нагрузка, которую мышца может удержать, но не
в состоянии поднять (максимальная сила, развиваемая мышцей
в изотоническом режиме)
Зависимость скорости
укорочения скелетной мышцы
(v) от нагрузки (F) на нее при
изотоническим сокращении
83.
Обычно наблюдается сочетание изотонического и изометрическогосокращения мышц.
Миокард желудочков - преимущественно изометрическое сокращение
Бицепс плеча – преимущественно изотоническое сокращение
Перемещение тела в пространстве – сочетание примерно в равных
долях изотонического и изометрического сокращения - ауксотонической
тип мышечных сокращений
режимы сокращения скелетных мышц
одиночное
Возникает в ответ на однократную
стимуляцию
и
имеет
2
фазы
напряжение
(укорочение)
и
расслабление
(удлиннение).
Соотношение продолжительности фаз
=1,618 («золотое сечение»).
быстрые мышцы – глазного яблока –
стадия сокащения 7-10 мс, медленные
мышцы – камбаловидная – 50-100 мс.
тетаническое
Возникает
в
ответ
на
ритмическую
стимуляцию,
сила сокращения в 2-4 раза
сильнее, чем при одиночном
сокращении.
Их амплитуда увеличивается
благодаря
наложению
следующих друг за другом
одиночных сокращений.
84.
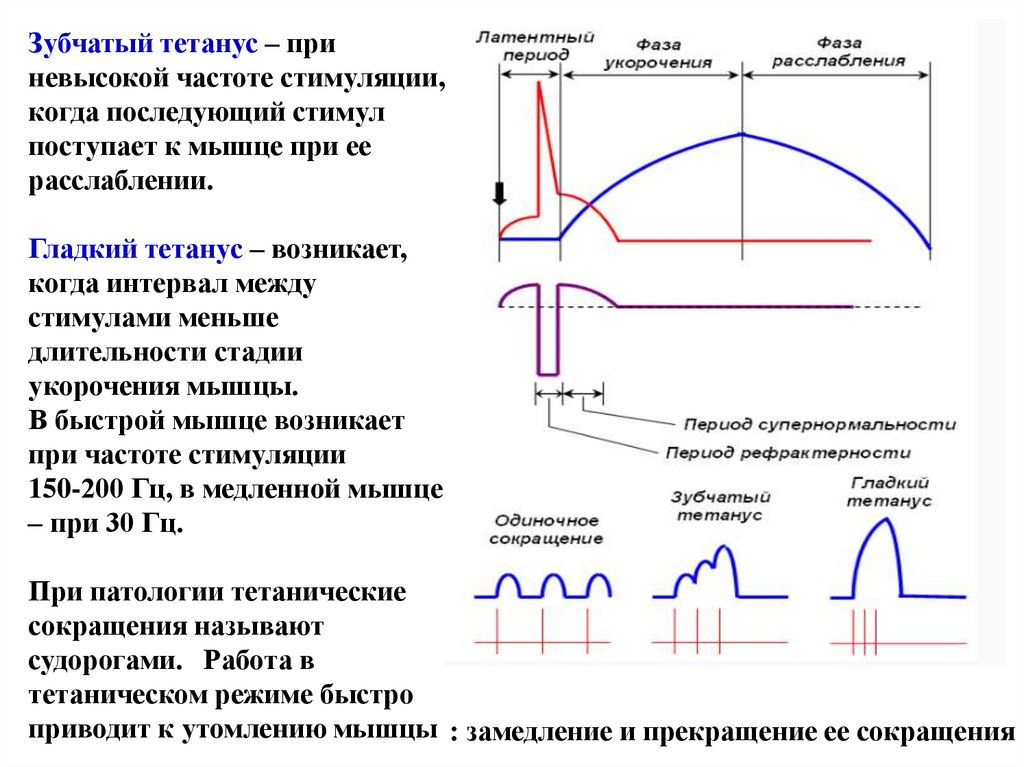
Зубчатый тетанус – приневысокой частоте стимуляции,
когда последующий стимул
поступает к мышце при ее
расслаблении.
Гладкий тетанус – возникает,
когда интервал между
стимулами меньше
длительности стадии
укорочения мышцы.
В быстрой мышце возникает
при частоте стимуляции
150-200 Гц, в медленной мышце
– при 30 Гц.
При патологии тетанические
сокращения называют
судорогами. Работа в
тетаническом режиме быстро
приводит к утомлению мышцы : замедление и прекращение ее сокращения
























 biology
biology








