Similar presentations:
Методы лал-теста. (Часть 3)
1. Методы ЛАЛ-теста
Часть 31
2. Признанные методы ЛАЛ-теста
Признанные методы ЛАЛтестаГель-тромб
Полуколичественный гель-тромб
Хромогенный
Турбидиметрический
Кинетический хромогенный
Кинетический турбидиметрический
2
3. Какой метод лучше?
• У каждого метода есть свои преимущества• Выбор метода зависит от:
– Требуемого результата
• количественный
• полуколичественный
– Имеющегося в наличии оборудования
– Типа образца
3
4. Выбор метода
• У каждого метода свое назначение• Для выбора метода необходимо оценить
тип и объемы тестирования
• В некоторых случаях имеет смысл
применять более одного метода,
например, для тестирования воды –
кинетический хромогенный и
кинетический турбидиметрический
4
5. Механизм реакции
Образованиегеля и
турбидиметриче
ский тип
ИЛИ
Хромогенный
тип
5
6. Гель-тромб метод
Механизм и суть метода6
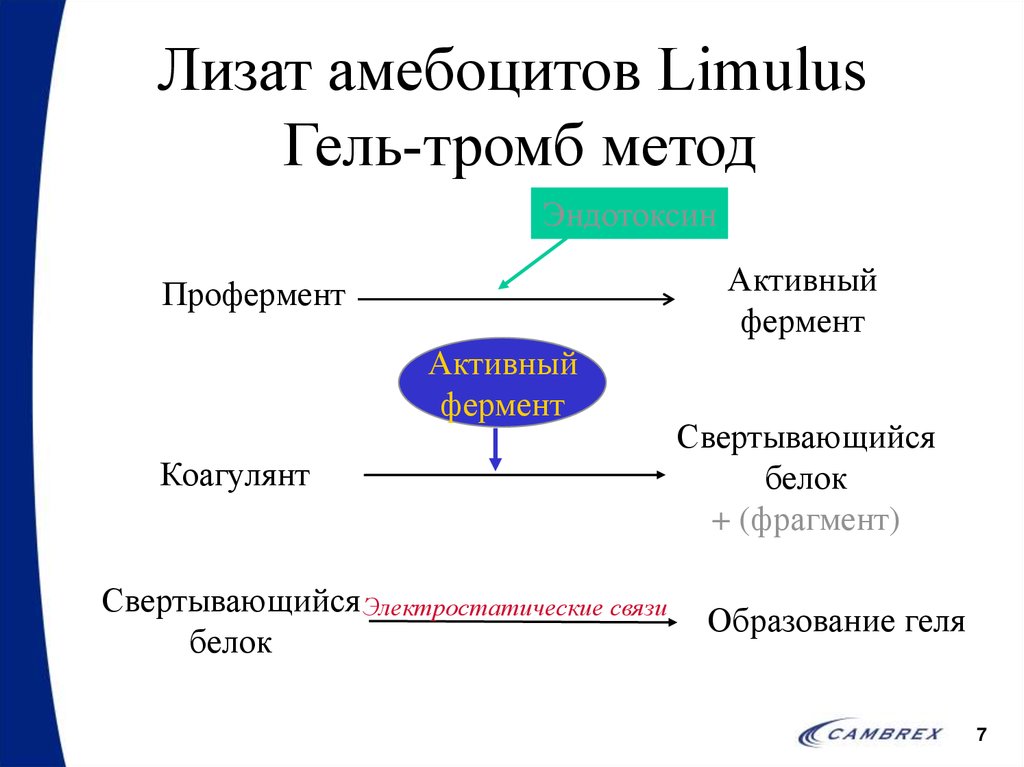
7. Лизат амебоцитов Limulus Гель-тромб метод
ЭндотоксинАктивный
фермент
Профермент
Активный
фермент
Коагулянт
Свертывающийся Электростатические связи
белок
Свертывающийся
белок
+ (фрагмент)
Образование геля
7
8. Постановка гель-тромб теста
Шаг за шагом8
9. Подготовка образцов и правильное разведение, дозирование в пробирки
910. Приготовьте стандарт или серии стандартов и дозируйте в пробирки
1011. Добавьте положительные контроли
1112. Восстановите ЛАЛ-реактив ЛАЛ-реагентной водой
Восстановите ЛАЛ-реактив ЛАЛреагентной водой12
13. Добавьте лизат в пробирки для постановки реакции
1314. Поместите в инкубатор на 60 минут
1415. Медленно переверните пробирку
Гель-тромб(Положительный)
15
16. Интерпретация результатов гель-тромб теста
Интерпретация результатов гельтромб теста• Очень простой тест
• Результат интерпретируется субъективно
Следовательно, результат зависит от лаборанта
• Метод считается недорогим, однако все
зависит от количества образцов
• Наиболее доступный метод по начальным
инвестициям
16
17. Возможные проблемы гель-тромб метода
Возможные проблемы гельтромб метода• Результаты считываются на-глаз после
переворачивания пробирки вручную
• На образование геля влияют различные
факторы
вибрация
pH
температура
другие белки
• Трудоемкий метод для средних и больших
партий
• Трудоемкий для валидации продукта метод
17
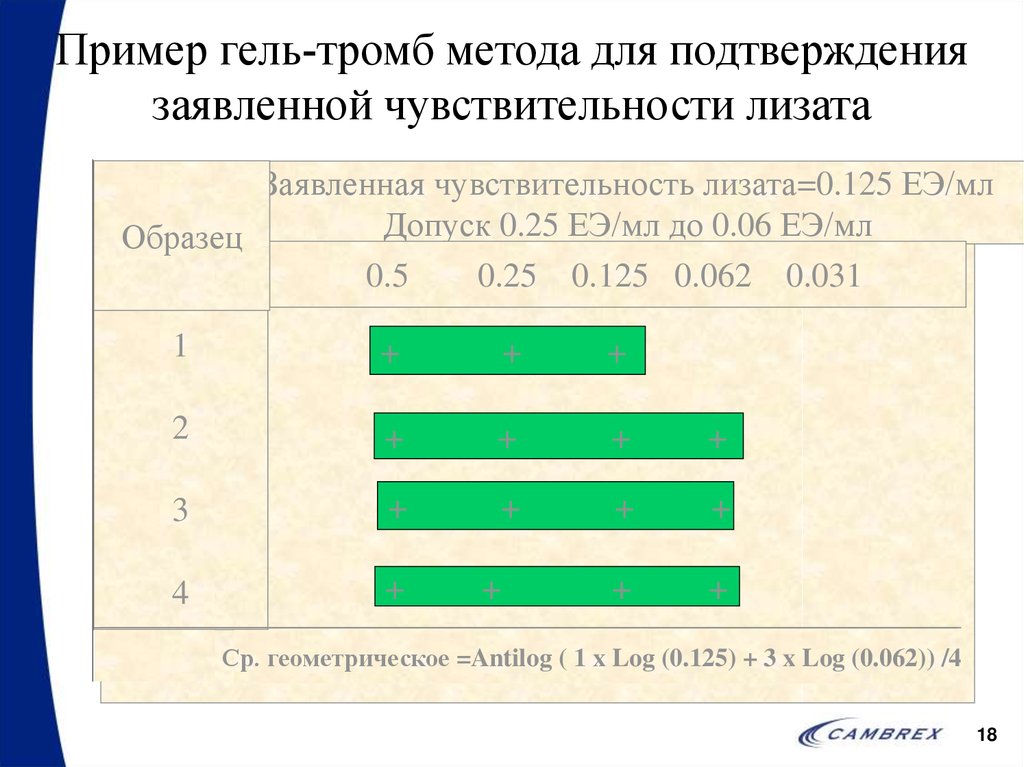
18. Пример гель-тромб метода для подтверждения заявленной чувствительности лизата
Заявленная чувствительность лизата=0.125 ЕЭ/млДопуск 0.25 ЕЭ/мл до 0.06 ЕЭ/мл
Образец
0.5
0.25 0.125 0.062 0.031
1
+
+
+
2
+
+
+
+
3
+
+
+
+
4
+
+
+
+
Ср. геометрическое =Antilog ( 1 x Log (0.125) + 3 x Log (0.062)) /4
18
19. Виды гель-тромб метода
• Два вида гель-тромб метода– предел
– Полуколичественный
• Предел
– Дает ответ ДА/НЕТ при определенной
чувствительности реактива
• Полуколичественный
– Можно определить концентрацию эндотоксина в
образце путем серии разведений
19
20. Методы конечной точки
Механизм и суть метода20
21. Методы конечной точки
• Теоретически существует два метода– Хромогенный метод конечной точки
– Турбидиметрический метод конечной точки
• На практике применяется только
хромогенный метод конечной точки
21
22. Хромогенный метод конечной точки
• Первый разработанный количественный метод• Диапазон чувствительности зависит от времени
инкубирования
– Типичный диапазон: 1.0 ЕЭ/мл до 0.1 ЕЭ/мл
– Расширенный диапазон:0.1 ЕЭ/мл до 0.01 ЕЭ/мл
• Линейная зависимость от уровня эндотоксинов
• Пониженная чувствительность к интерферентным
факторам благодаря применению хромогенного
субстрата
22
23. Замещение хромогенным субстратом коагулянта
2324. Постановка хромогенного теста конечной точки
Шаг за шагом24
25. Дозируйте стандарт и образец
2526. Добавьте 50 л лизата и инкубируйте
Добавьте 50 л лизата иинкубируйте
26
27. Добавьте 100л субстрата и инкубируйте
Добавьте 100 л субстрата иинкубируйте
27
28. Добавьте 100 л реактива для остановки реакции
Добавьте 100 л реактива дляостановки реакции
28
29. Результаты считываются через 405 нм фильтр
2930. Характеристики хромогенного метода конечной точки
• Требует многоразового добавления реактивов– Добавить лизат в стандарт и образец и
инкубировать
– Добавить субстрат и инкубировать
– Добавить реактив для остановки реакции (10%
уксусная кислота или 10% SDS)
– Считывание результатов на волне 405 нм
• Соответствие температуры инкубации (37oC)
является критичным фактором
30
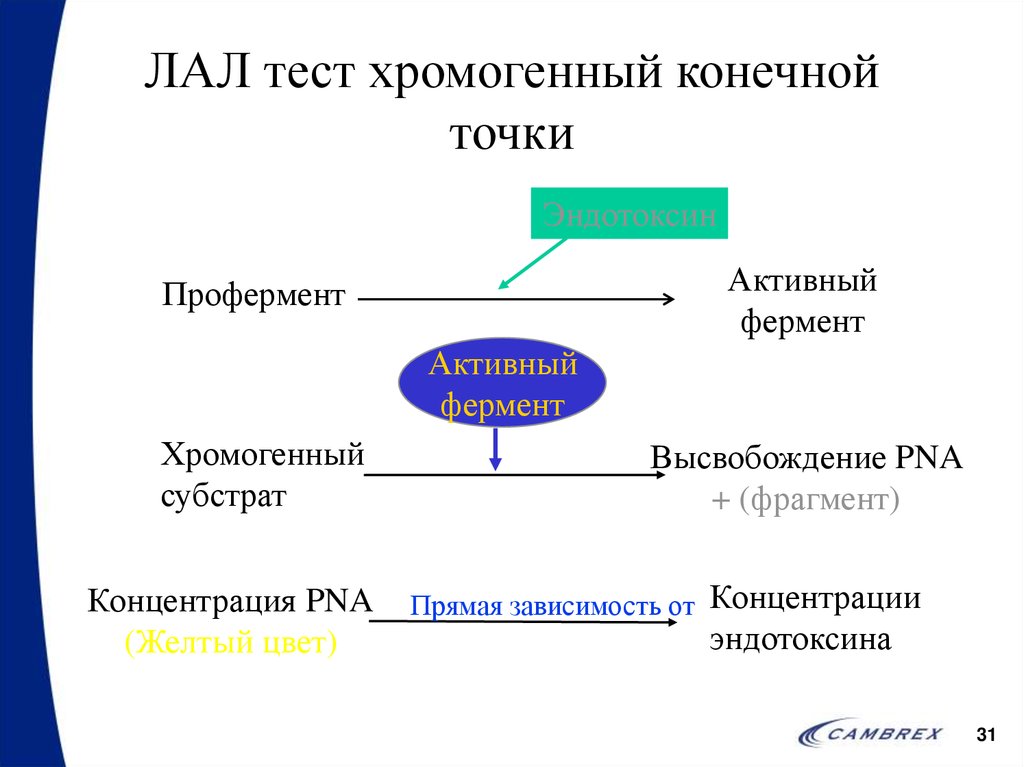
31. ЛАЛ тест хромогенный конечной точки
ЭндотоксинАктивный
фермент
Профермент
Активный
фермент
Хромогенный
субстрат
Концентрация PNA
(Желтый цвет)
Высвобождение PNA
+ (фрагмент)
Прямая зависимость от Концентрации
эндотоксина
31
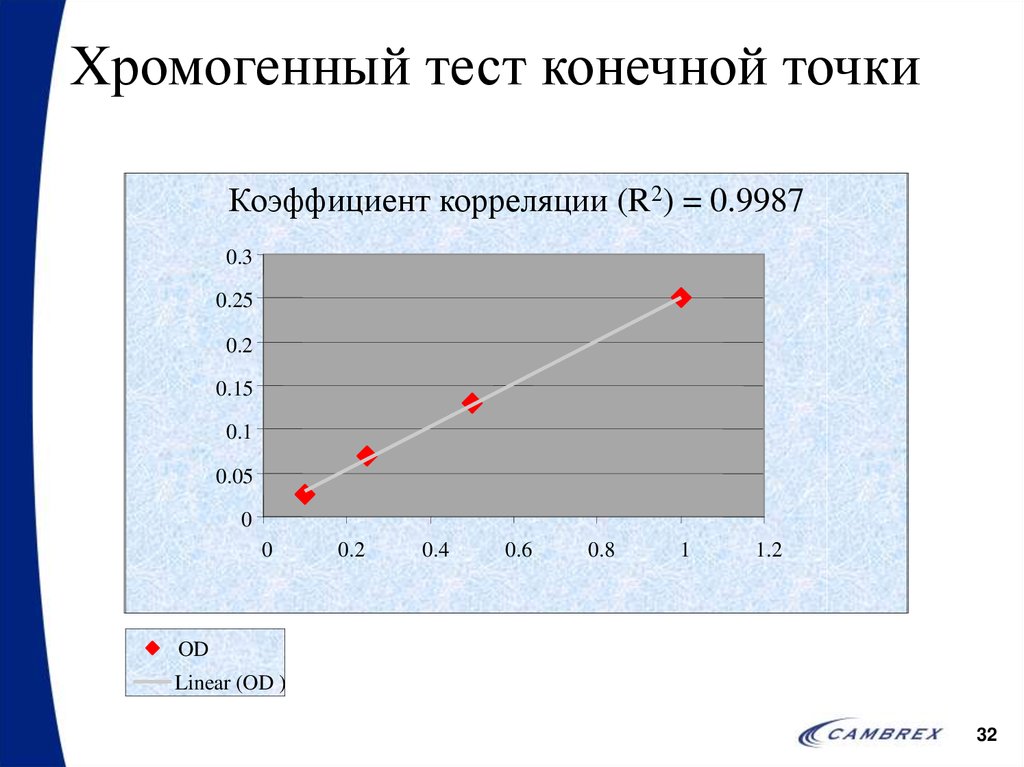
32. Хромогенный тест конечной точки
Коэффициент корреляции (R2) = 0.99870.3
0.25
0.2
0.15
0.1
0.05
0
0
0.2
0.4
0.6
0.8
1
1.2
OD
Linear (OD )
32
33. Оценка хромогенного теста конечной точки
• Дает количественный результат, интерпретациярезультатов объективная, результаты стабильны в
течение 30 мин
• Хромогенный субстрат снижает влияние
интерферентных факторов
• Трудоемкий процесс, в ходе которого возможны
ошибки оператора
• Процесс можно автоматизировать
33
34. Возможные проблемы хромогенного метода конечной точки
• Короткое время инкубирования обусловливаетсложность поддержания равномерности
поддержания температуры микропланшет
• Узкий диапазон может требовать дополнительных
разведений для получения результатов
• Трудоемкий метод
• Реагент для остановки реакции может вызвать
выпадение осадка
34
35. Кинетические методы
Механизм и суть методов35
36. Кинетические методы
• Наиболее недавние методы• Наиболее объективные методы
• Два вида кинетических методов
– Кинетический турбидиметрический
– Кинетический хромогенный
36
37. Кинетический турбидиметрический метод
• Первый из разработанных кинетических методов• Широкий стандартный диапазон
– 10.0-0.01 ЕЭ/мл
• Первые методики были неточными на всем
диапазоне измерений
• Современные реактивы дают меньшую
погрешность
37
38. Кинетический турбидиметрический метод
• Добавление реактива только один раз– Добавить реактив в стандарт
– Добавить положительные контроли продукта (обычно
по 10 л)
– Подогрейте планшет
– Добавьте лизат и начните тест
– Определите результаты
• Микропланшеты также требуют обработки в
шейкере
38
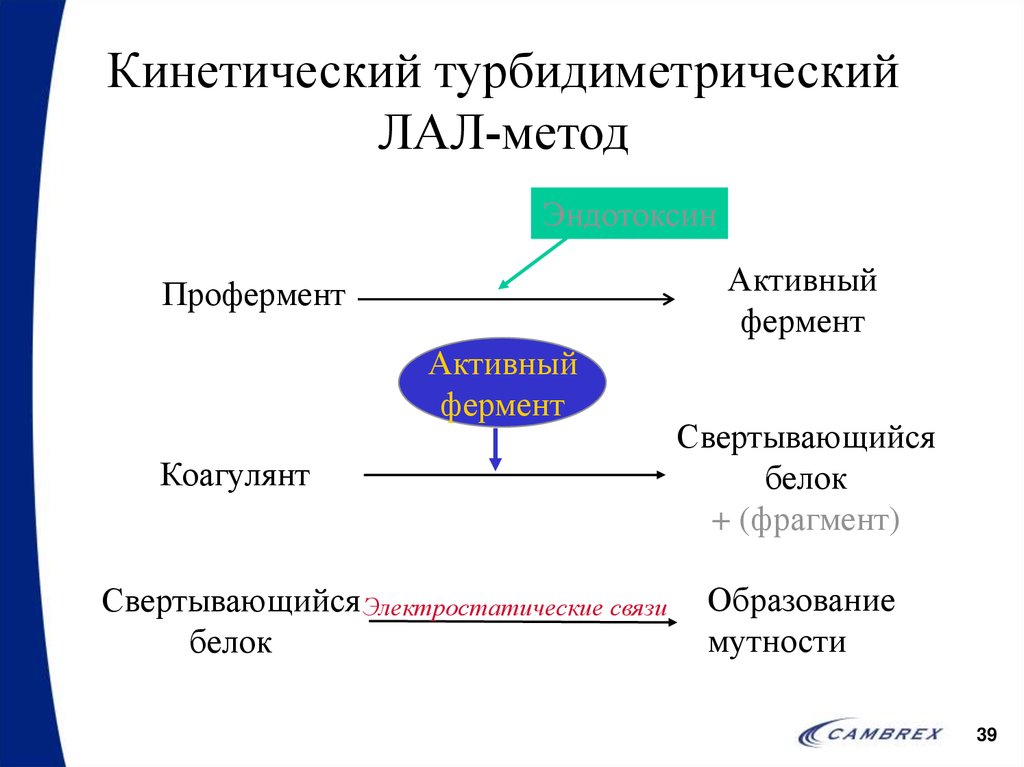
39. Кинетический турбидиметрический ЛАЛ-метод
ЭндотоксинАктивный
фермент
Профермент
Активный
фермент
Коагулянт
Свертывающийся Электростатические связи
белок
Свертывающийся
белок
+ (фрагмент)
Образование
мутности
39
40. Кинетический турбидиметрический метод
• Более быстрый метод, чем количественныйконечной точки
• Широкий диапазон
• Очень хорошо подходит для тестирования
воды, но могут быть сложности с
концентрированными сложными продуктами
• Менее дорогостоящие реагенты, чем для
кинетического хромогенного метода
• Менее стабильный в процессе исполнения
метод, чем кинетический хромогенный метод
40
41. Кинетический турбидиметрический метод – возможные трудности
• Слабое отношение сигнал-шум, наличиепузырьков могут затруднять анализ
• Влияние таких же интерферентных факторов
как и для гель-тромб теста:
вибрация
pH
температура
другие белки
• Наличие пузырьков может затруднить анализ
• Не подходит для вязких и мутных продуктов
41
42. Кинетический хромогенный метод
• Наиболее поздний из кинетических методоввследствие трудности создания комбинированного
реактива
– Лизат и синтетический субстрат
• Отличное отношение сигнал-шум по сравнению с
турбидиметрическим методом
– Кинетический хромогенный - Delta OD 200 milliOD
– Кинетический турбидиметрический - Delta OD 30 milliOD
• Менее подвержен влиянию интерферентных факторов
42
43. Кинетический хромогенный метод
• Широкий стандартный диапазон– До 4 log диапазона (50-0.005 ЕЭ/мл)
• Реактив добавляется один раз, что
минимизирует вероятность ошибки оператора
• Применение синтетического субстрата облегчает
валидацию комплексных продуктов
• Позволяет анализировать мутные и вязкие
образцы
43
44. Проведение кинетического хромогенного метода
Шаг за шагом44
45. Дозируйте стандарты и образцы
4546. Добавьте положительный контроль продукта (ПКП)
Pre-warm the Plate in the incubating reader for 10 minutes46
47. Добавьте лизат и начните анализ
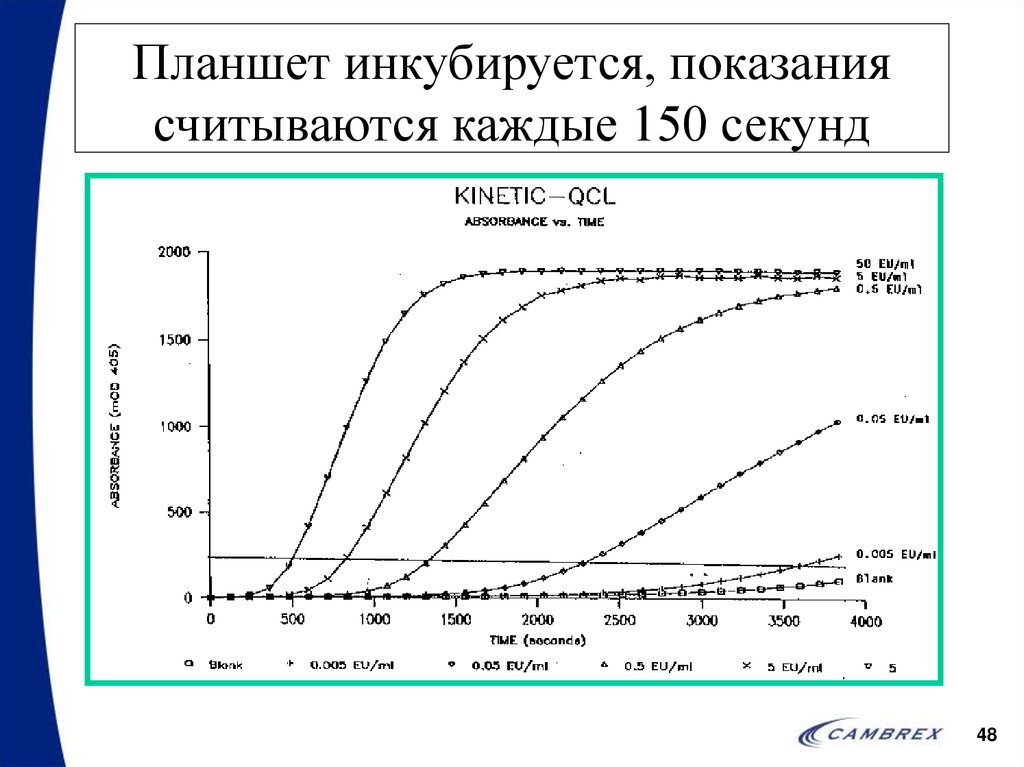
4748. Планшет инкубируется, показания считываются каждые 150 секунд
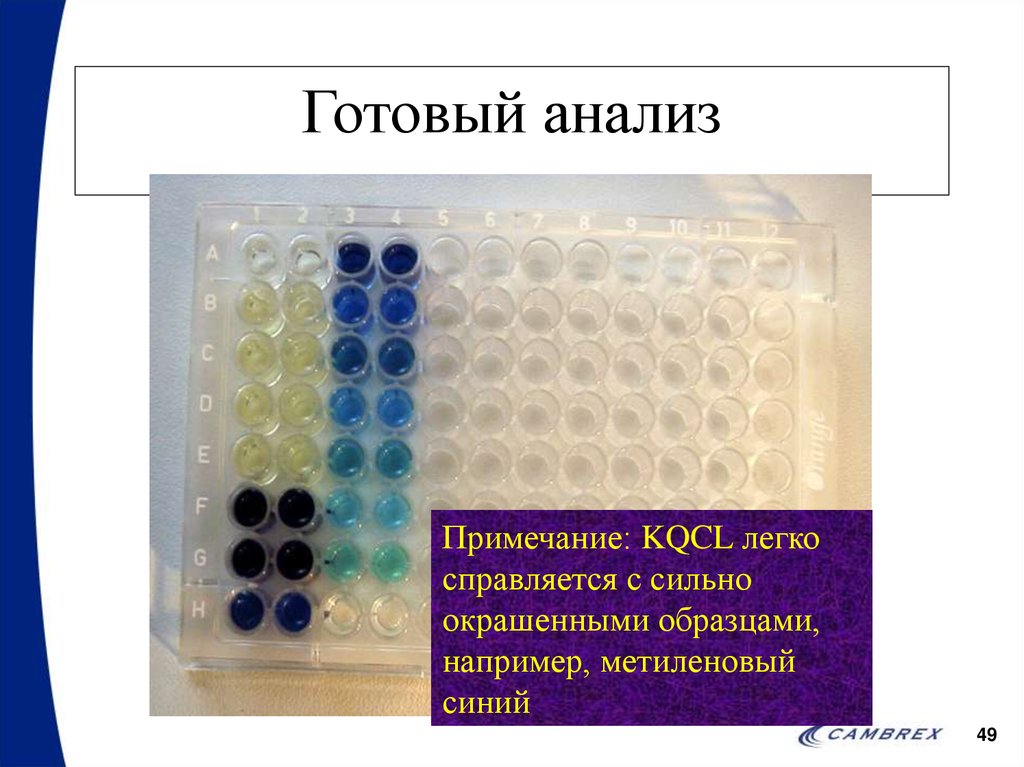
4849. Готовый анализ
Примечание: KQCL легкосправляется с сильно
окрашенными образцами,
например, метиленовый
синий
49
50. Кинетический хромогенный метод
• Реагент добавляется только один раз– Дозируйте стандарты и образцы
– Добавьте положительный контроль продукта (как
правило по 10 л)
– Подогрейте планшет
– Добавьте лизат и начните анализ
– Collect Results
• Микропланшеты также требуют обработки в
шейкере
50
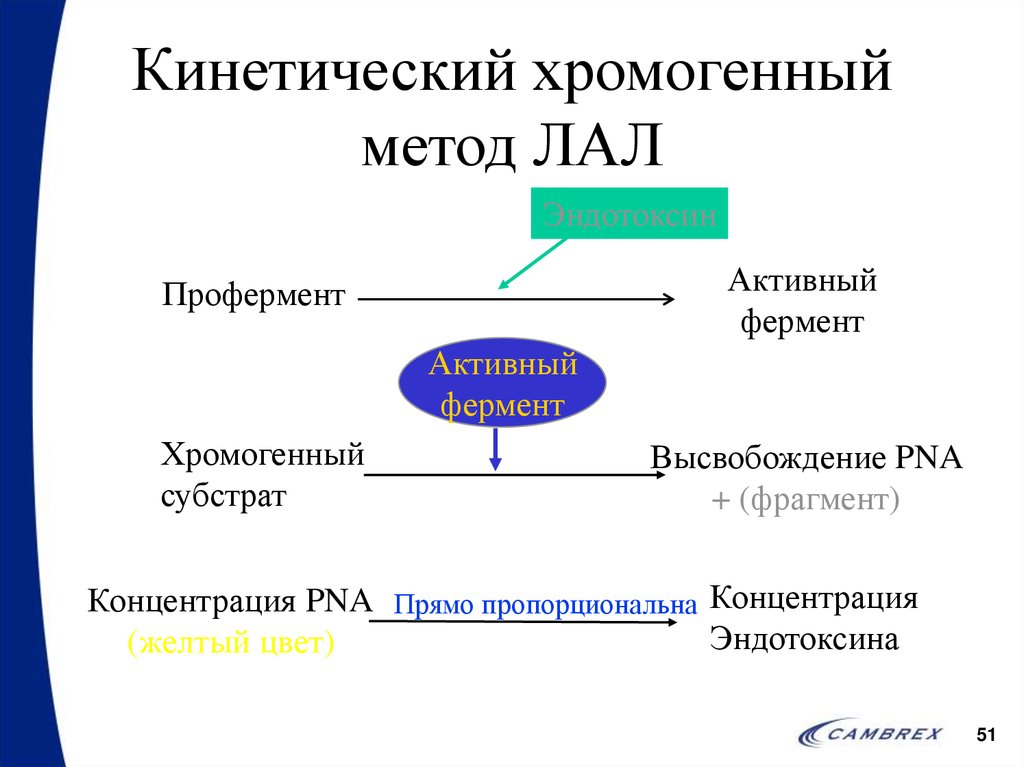
51. Кинетический хромогенный метод ЛАЛ
ЭндотоксинАктивный
фермент
Профермент
Активный
фермент
Хромогенный
субстрат
Высвобождение PNA
+ (фрагмент)
Концентрация PNA Прямо пропорциональна Концентрация
Эндотоксина
(желтый цвет)
51
52. Суть кинетического хромогенного метода
• В начале теста считывается оптическая плотность• Результаты первого считывания принимаются за
базовую линию – цвет, прозрачность, др.
• Прибор измеряет оптическую плотность через
фиксированные промежутки времени и
определяет изменение оптической плотности на
OD 30 для кинетического турбидиметрического и
OD 200 для кинетического хромогенного метода
• Анализ считается завершенным когда
достигается нижняя стандартная точка
52
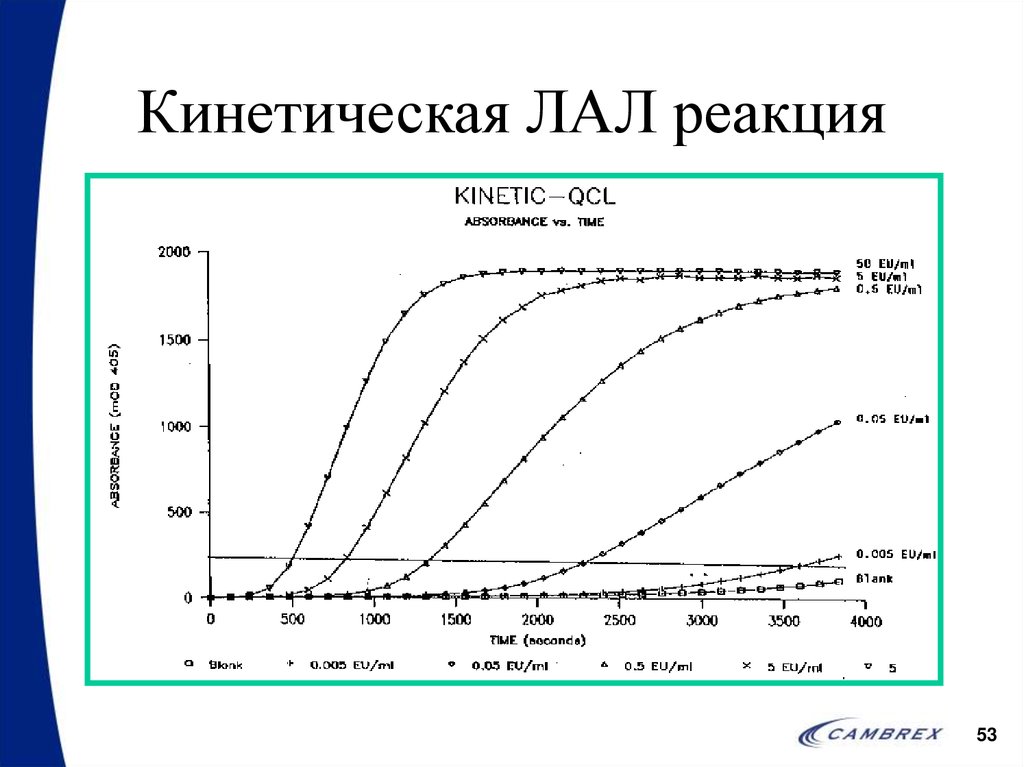
53. Кинетическая ЛАЛ реакция
5354. Кинетическая хромогенная реакция
• Время затраченное на достижение точки 200mOD зависит от концентрации эндотоксина
• Для создания стандартной кривой
используется стандарт
• Т.к. результаты теста носят нелинейный
характер, для создания стандартной кривой
необходимо производить log-log
преобразования
54
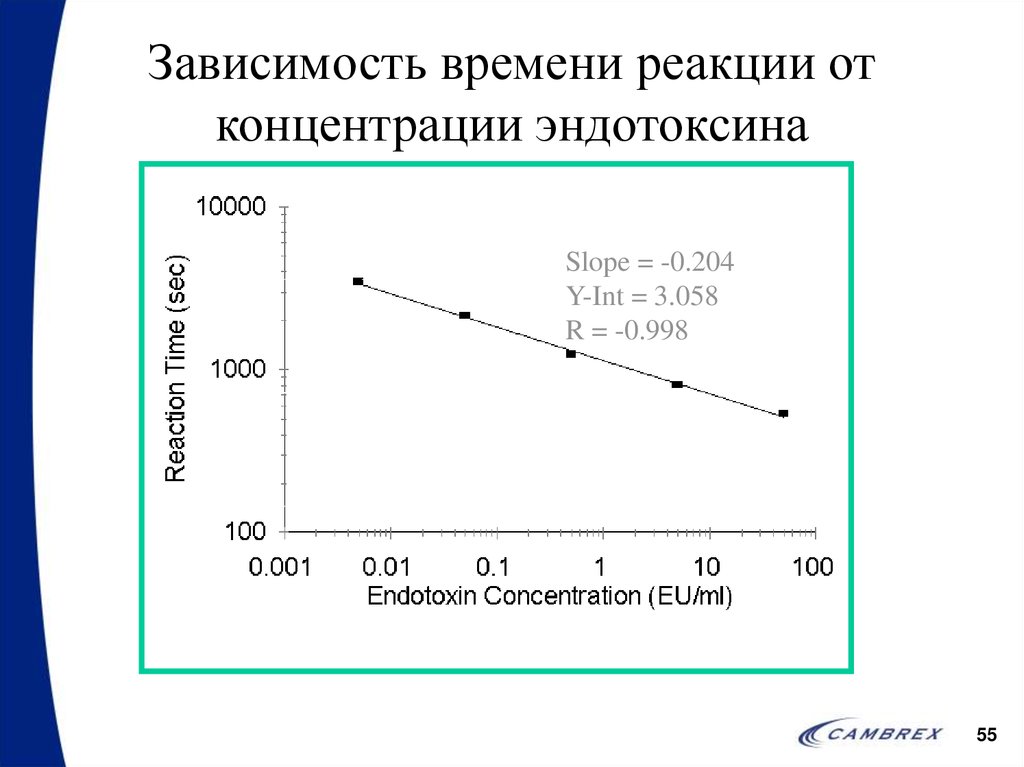
55. Зависимость времени реакции от концентрации эндотоксина
Slope = -0.204Y-Int = 3.058
R = -0.998
55
56. Кинетические методы
• Нестандартная кинетика ферментов даетнелинейные результаты
• Первоначальные методы не принимали в
расчет данную особенность
• Новые методы вносят соответствующие
коррективы
56
57. Кинетика реакции
• Классическая кинетика Michaelis Menton– При определенных условиях скорость
ферментной реакции линейно зависит от
исходной концентрации фермента
– Изменение абсорбции в течение времени
находится в линейной зависимости от
концентрации эндотоксина
57
58. Кинетика реакции
• Но не все ферментные реакции носятлинейный характер
• Кинетические ЛАЛ методы:
– В начале анализа отсутствует активный
фермент
– Фермент образуется в результате
присутствия эндотоксина и его реакции на
первой стадии каскадной реакции
58
59. Что измеряется?
• Реальные измерения учитывают времязадержки до появления фермента
• Зависимость этой задержки или времени
реакции и концентрацией эндотоксина
нелинейная
59
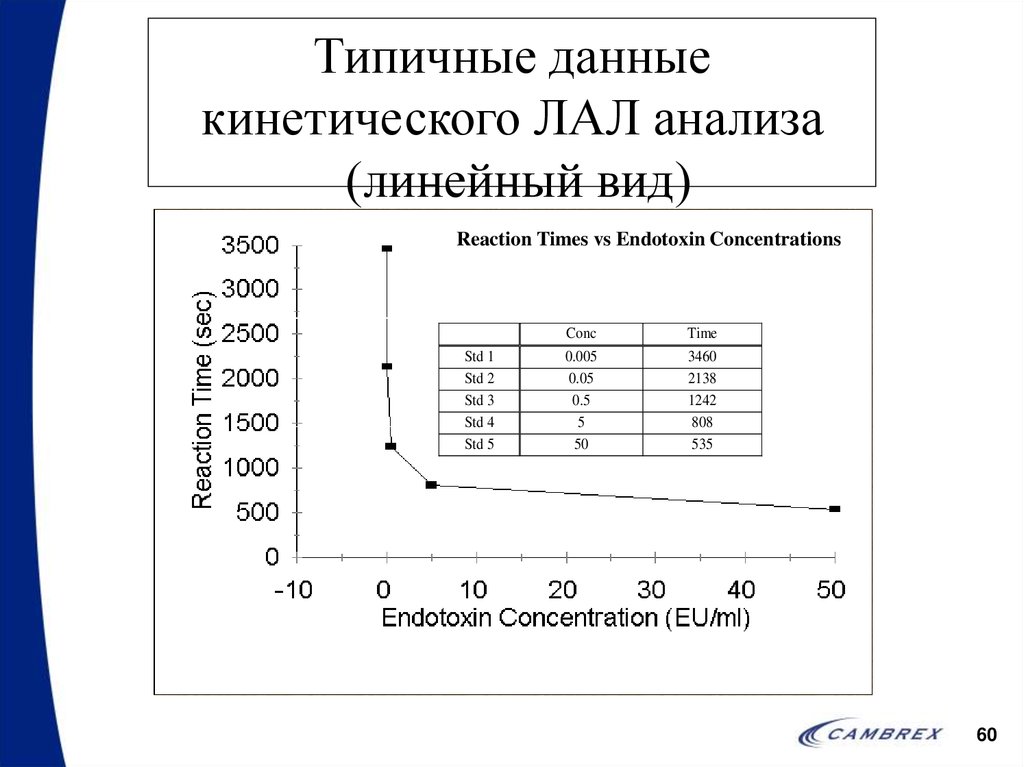
60. Типичные данные кинетического ЛАЛ анализа (линейный вид)
Reaction Times vs Endotoxin ConcentrationsStd 1
Std 2
Std 3
Std 4
Std 5
Conc
0.005
0.05
0.5
5
50
Time
3460
2138
1242
808
535
60
61. Линейные кинетические результаты
• Такие данные не могут применяться дляанализа неизвестных, в особенности с
применением линейной регрессии
• Как можно линеаризировать данные?
• По предыдущим данным можно
сократить диапазон
61
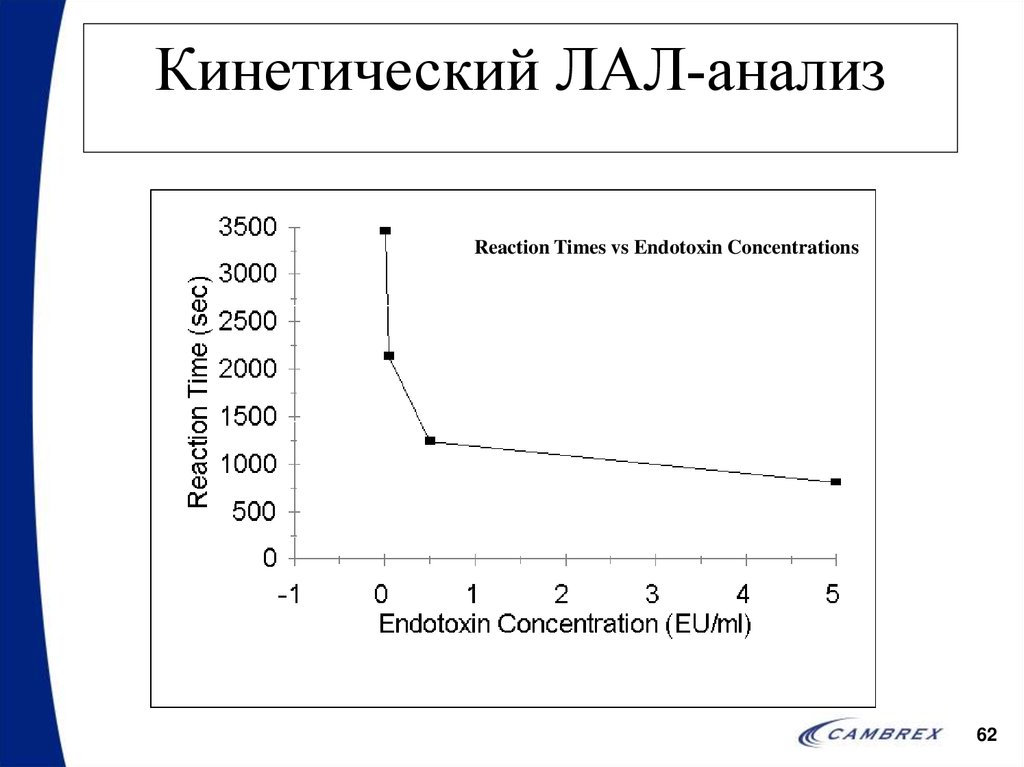
62. Кинетический ЛАЛ-анализ
Reaction Times vs Endotoxin Concentrations62
63. Кинетические данные
• Сокращение диапазона не улучшаетформу кривой
• Шаг 1: Log ось эндотоксина
– Расширение интервала малых значений
– Сокращение интервала высоких значений
63
64. Кинетический ЛАЛ - 1 Log
Reaction Times vs Endotoxin Concentrations64
65. Кинетические результаты
• Одноразовое логарифмированиенедостаточно для улучшения
стандартной кривой
• Следующий шаг:
– Log ось времени (ось Y)
• По-новому нанесите кривую
65
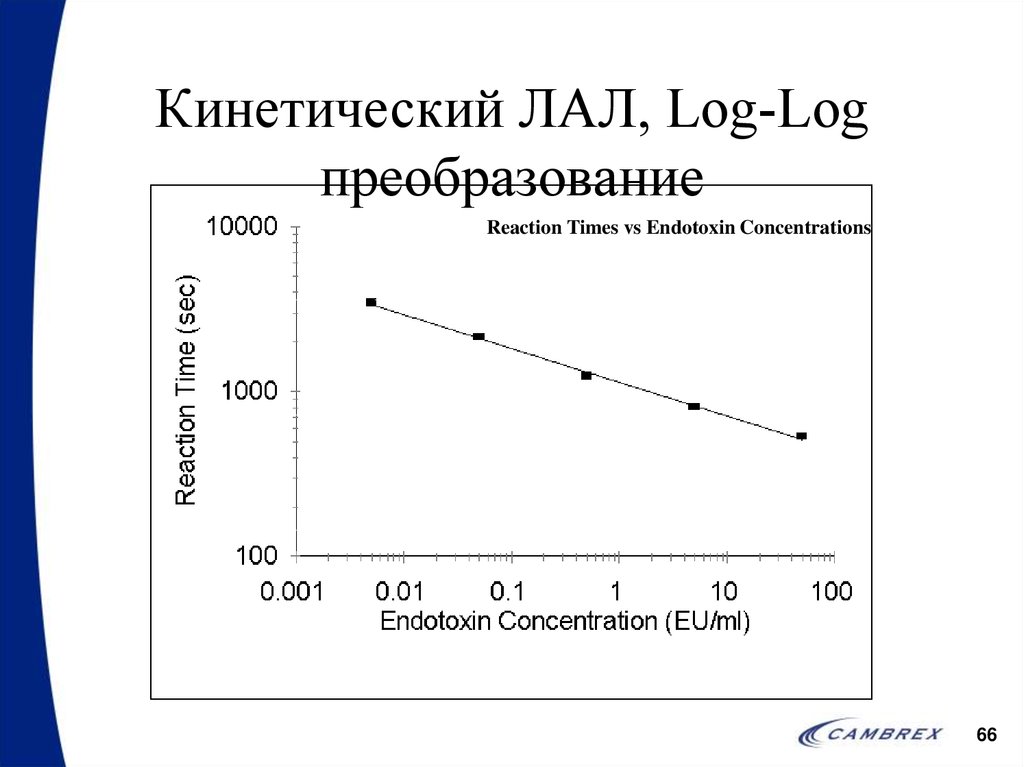
66. Кинетический ЛАЛ, Log-Log преобразование
Reaction Times vs Endotoxin Concentrations66
67. Кинетические результаты
• Практически линейные• Но не совсем
– На примере видно корреляционный коэффициент 0.997
– Тем не менее, наблюдается отклонение
– Это может привести к неточностям при
определении неизвестных
67
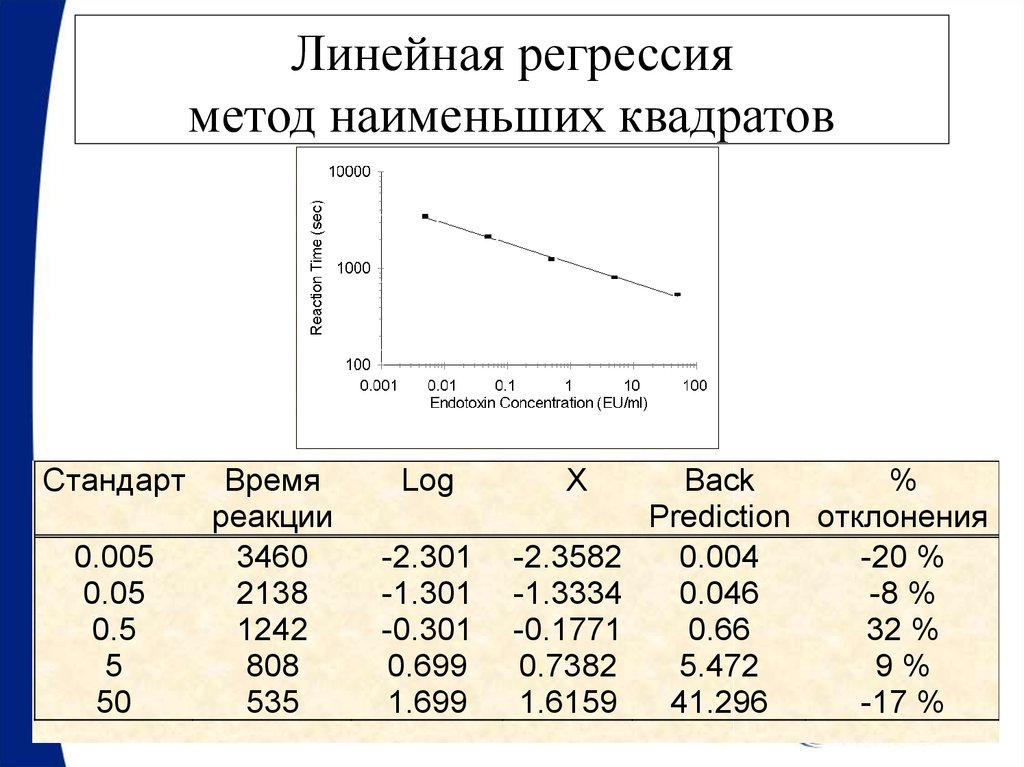
68. Линейная регрессия метод наименьших квадратов
Стандарт0.005
0.05
0.5
5
50
Время
реакции
3460
2138
1242
808
535
Log
X
-2.301
-1.301
-0.301
0.699
1.699
-2.3582
-1.3334
-0.1771
0.7382
1.6159
Back
%
Prediction отклонения
0.004
-20 %
0.046
-8 %
0.66
32 %
5.472
9%
41.296
-17 %
68
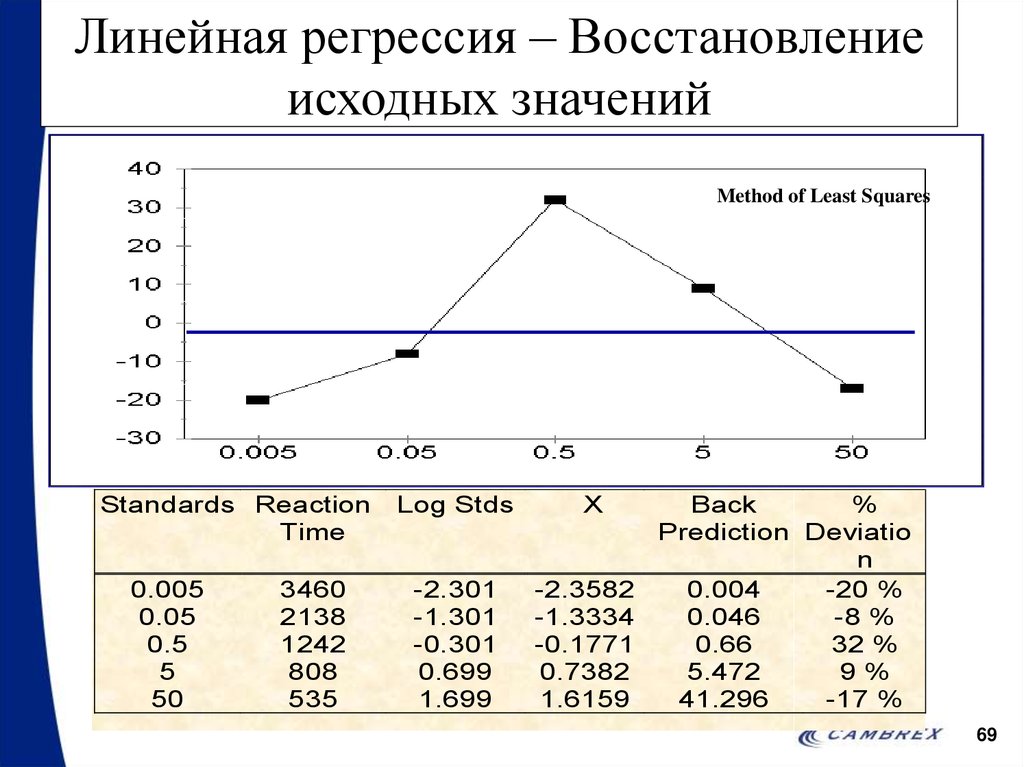
69. Линейная регрессия – Восстановление исходных значений
Method of Least SquaresStandards Reaction
Time
0.005
0.05
0.5
5
50
3460
2138
1242
808
535
Log Stds
-2.301
-1.301
-0.301
0.699
1.699
X
Back
%
Prediction Deviatio
n
-2.3582
0.004
-20 %
-1.3334
0.046
-8 %
-0.1771
0.66
32 %
0.7382
5.472
9%
1.6159
41.296
-17 %
69
70. Источник неточностей
• Самое большое отклонение зачастуюнаходится в середине линии регрессии
– В этой точке как правило проявляется
положительный контроль
• Влияет на расчет ЕЭ для различных
разведений одного образца
70
71. Альтернативные методы расчетов
• В идеале нужно придать кривой формурегрессионной линии
• Формула линейной регрессии
– Y=A+BX
• Определения уравнения
– Расширенный анализ включает 4
определения………..
71
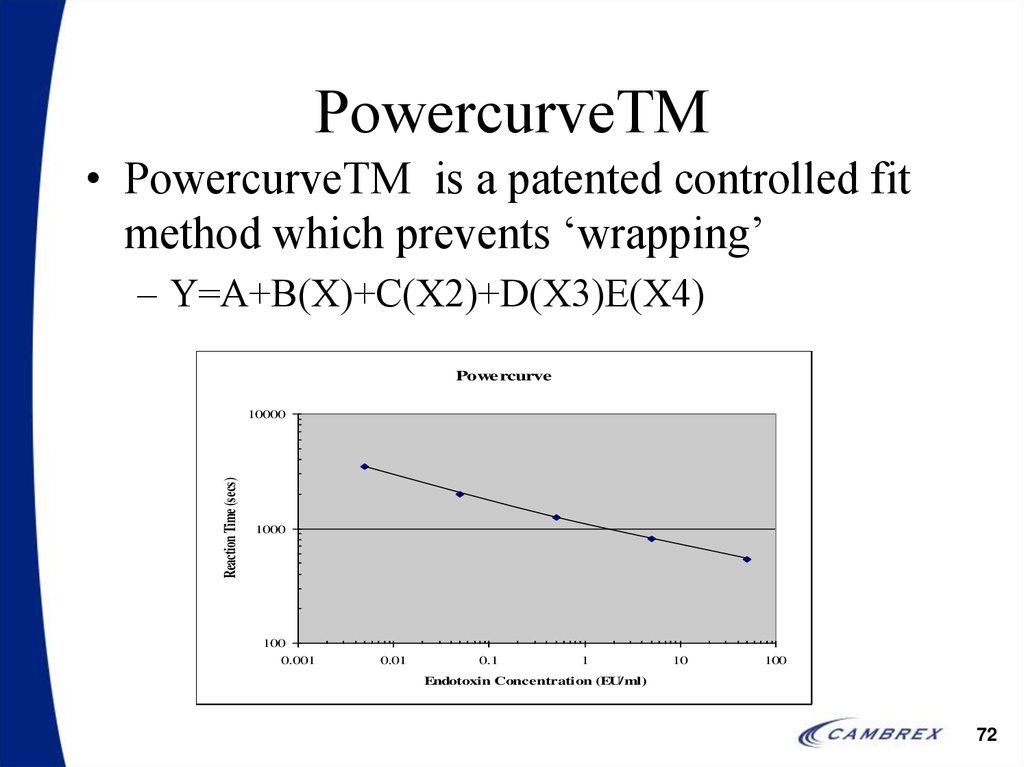
72. PowercurveTM
• PowercurveTM is a patented controlled fitmethod which prevents ‘wrapping’
– Y=A+B(X)+C(X2)+D(X3)E(X4)
Powercurve
Reaction Time (secs)
10000
1000
100
0.001
0.01
0.1
1
10
100
Endotoxin Concentration (EU/ml)
72
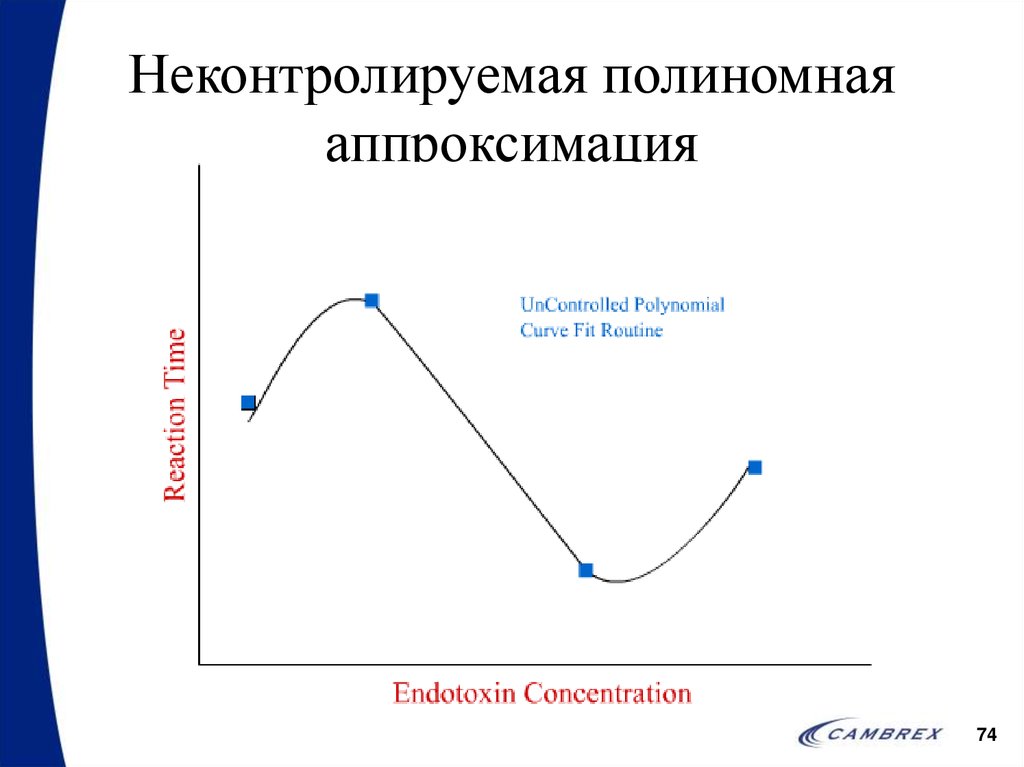
73. Аппроксимация полиномной кривой
• Аппроксимация полиномной кривойшироко применяется в клинических
исследованиях
• В данном методе есть потенциальная
проблема – если не достаточно жестко
контролировать расчеты, то кривую
можно «подогнать» под любые
результаты!!
73
74. Неконтролируемая полиномная аппроксимация
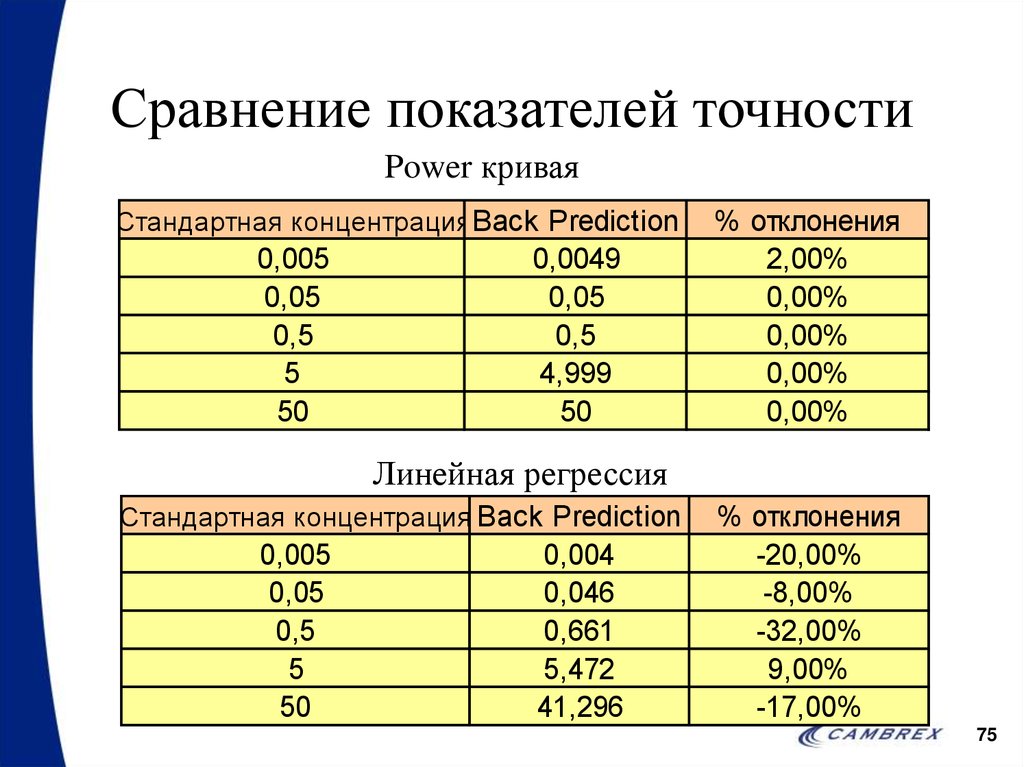
7475. Сравнение показателей точности
Power криваяСтандартная концентрация Back Prediction
0,005
0,05
0,5
5
50
0,0049
0,05
0,5
4,999
50
% отклонения
2,00%
0,00%
0,00%
0,00%
0,00%
Линейная регрессия
Стандартная концентрация Back Prediction
0,005
0,05
0,5
5
50
0,004
0,046
0,661
5,472
41,296
% отклонения
-20,00%
-8,00%
-32,00%
9,00%
-17,00%
75
76. Power Curve
• Power Curve признана контролирующимиорганами
• Улучшает точность результатов
• Сниженное количество повторений теста
• Устраняет проблему плавающих значений при
разведении образца
76
77. Обзор методов
• Выбор метода зависит от:– Количества образцов
– Типа образцов
– Доступного оборудования
• или
– Бюджет
– Необходимость количественных результатов
77
78. ……………
• Как будут развиваться методики?• Человеческий фактор будет присутствовать и в
дальнейшем
• Данную проблему могут решить только роботы
• В 1998 BioWhittaker представил на рынок
автоматический AutoLAL
78
79. AutoLAL
• Сочетание системы дозирования жидкостейBeckman Biomek и ридера Biotek и программного
обеспечения BioWhittaker
• Автоматическое приготовление
стандарта и образца
• Автоматическое дозирование
образцов, стандартов
и положительных контролей
• Автоматическое добавление
лизата, инкубирование и
чтение результатов
79
80. Преимущества AutoLAL
Сниженное количество ручного труда
Сниженное количество повторений
Улучшенная воспроизводимость
Отсутствие отклонений при
Работе разных операторов
80






























































 medicine
medicine








