Similar presentations:
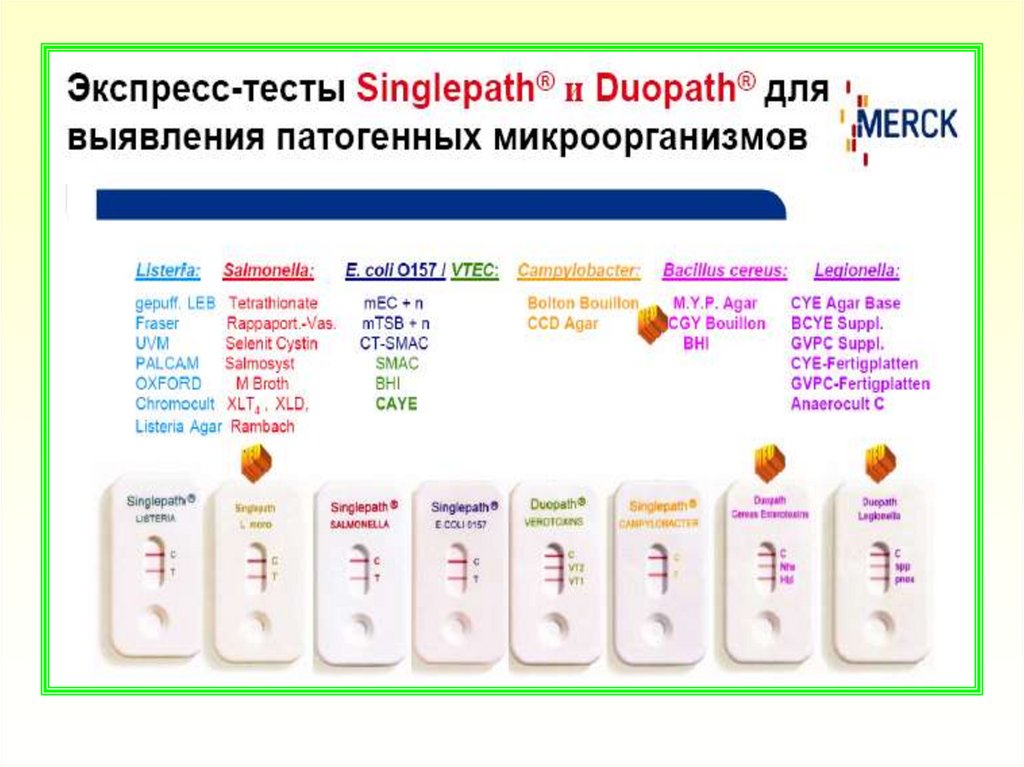
Ускоренные методы санитарно-микробиологических исследований
1. Ускоренные методы санитарно-микробиологических исследований
Ускоренные методысанитарномикробиологических
исследований
2.
3.
4.
5. Общие колиформные бактерии
-микроорганизмы
семейства
Enterobacteriaceae,
характеризующиеся
наличием
фермента
β-галактозидазы,
способного
расщеплять
специфические
хромогенные
субстраты, входящие в состав
селективных индикаторных сред
6. E.coli
- колиформные бактерии, характеризующиесяналичием
фермента
β-глюкуронидазы,
способного расщеплять специфические
хромогенные или флюорогенные субстраты,
входящие
в
состав
селективных
индикаторных
сред,
и
фермента
триптофаназы, расщепляющей триптофан
-
E.coli - как индикатор фекального
загрязнения
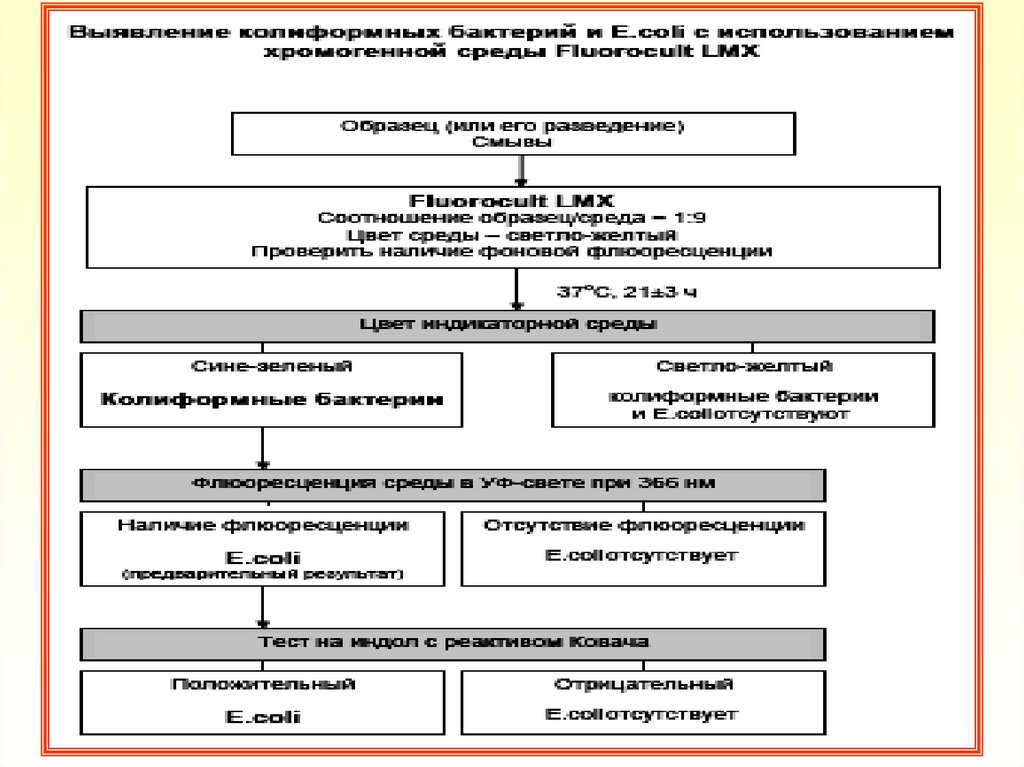
регламентирован
Директивой
ЕС
98/83
взамен
термотолерантных бактерий
7. Метод одновременного определения КБ и E.coli с использованием хромогенных и флюорогенных питательных сред является
высокочувствительным,специфичным,
позволяет
сократить время исследования до
24 часов
8.
9. 1. Входящие в состав индикаторных сред качественные пептоны и фосфатный буфер обеспечивают оптимальные условия роста КБ 2.
Достоинства хромогенных сред1. Входящие в состав индикаторных сред
качественные пептоны и фосфатный буфер
обеспечивают оптимальные условия роста КБ
2. Триптофан дает возможность проведения
индольного
теста
для
окончательного
подтверждения
E.coli
3. Пируват натрия восстанавливает поврежденные
клетки КБ и повышает чувствительность метода
4.
Использование
селективных
агентов
с
различным ингибирующим эффектом позволяет
дифференцировано подходить к определению КБ и
E.coli в зависимости от уровня микробной
контаминации пробы воды
10. Принцип действия хромогенных и флюорогенных питательных сред
• Основан на выявлении специфическихферментов - β-галактозидазы колиформных
бактерий; β-глюкуронидазы и триптофаназы
E.coli
• Специфическая
активность
ферментов
проявляется в результате расщепления
хромогенных и флюорогенных субстратов,
входящих в состав индикаторных сред, с
образованием
флюоресцирующих
или
имеющих
окраску
продуктов,
которые
изменяют цвет (вызывают флюоресценцию)
жидких сред или характерно окрашивают
колонии на агаризованных средах
11.
УТВЕРЖДАЮЗаместитель Главного государственного санитарного врача
Российской Федерации - Главный врач Федерального центра
Госсанэпиднадзора Минздрава России
Е.Н.Беляев
10 февраля 2004 г.
№24ФЦ/513
Дата введения: 01 марта 2004 г.
Определение колиформных бактерий и Е.соМ с
использованием хромогенных и флюорогенных
индикаторных сред производства Merck (Германия)
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Раздел 2. Определение общих колиформных бактерий и Е.соli
в воде
12. Раздел 2. Определение ОКБ и E.coli в воде. Общие положения и область применения
МРустанавливают
методы
проведения
лабораторных
исследований
по
ускоренному
качественному
и
количественному определению ОКБ и Е.соli с
использованием
хромогенных
и
флюорогенных индикаторных сред в пробах
продукции безалкогольного производства,
воды
питьевого
и
хозяйственнобытового водоснабжения, водных объектов
рекреации, сточных вод и др.
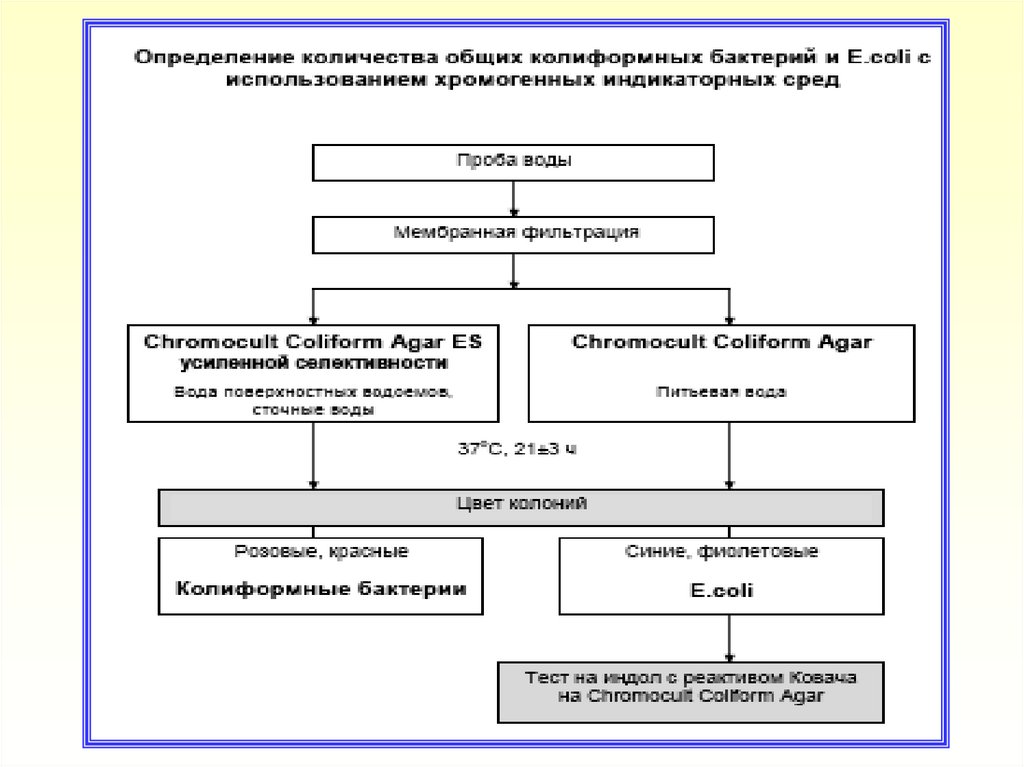
13. Определение количества ОКБ и E.coli ММФ
метод
основан
на
фильтрации
нормируемого объема воды через
мембранные
фильтры,
инкубации
посевов
на
агаризованных
хромогенных индикаторных средах,
последующем выявлении и подсчете
характерно
окрашенных
колоний,
выросших на фильтре
14. Техника определения КБ и Е.соli ММФ
1.2.
3.
4.
5.
6.
Объем воды, установленный в соответствии с НД, фильтровать
через МФ с соблюдением требований ГОСТ 30712, МУК 4.2.1018-01
МФ поместить на поверхность среды:
- Chromocult Coliform Agar - при исследовании проб воды с низким
уровнем микробной контаминации (питьевая вода)
- или на поверхность среды усиленной селективности Chromocult
Coliform Agar ES - при исследовании проб воды с высоким уровнем
микробной контаминации (вода поверхностных водоемов, сточные
воды)
Посевы инкубировать при температуре (37±1 )°С в течение 21±3
часов
После инкубирования подсчитать характерно окрашенные колонии,
выросшие на фильтре:
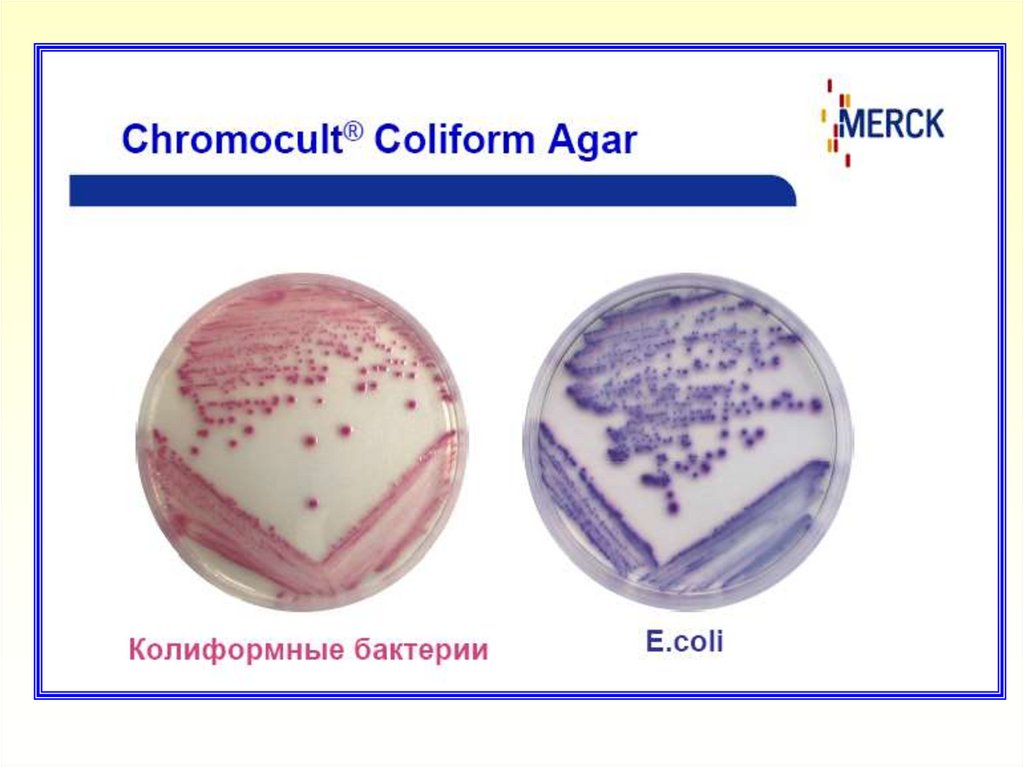
- Колиформные бактерии (за исключением E.coli) образуют
колонии розового (до красного) цвета
- E.coli образуют колонии темно-синего (до фиолетового) цвета
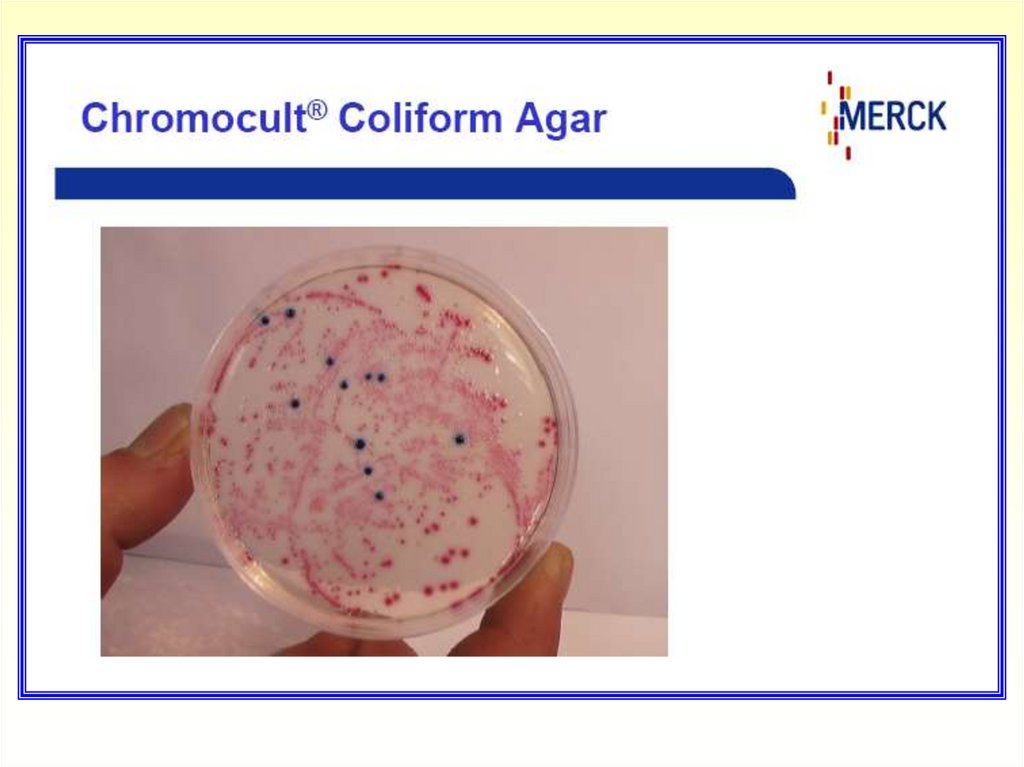
Для подтверждения E.coli на среде Chromocult Coliform Agar нанести
каплю реактива Ковача на характерно окрашенные колонии
(индольный тест). Изменение цвета реагента до розово-красного в
течение нескольких секунд подтверждает наличие E.coli.
Для подсчета количества ОКБ сложить количество характерно
окрашенных колоний
15.
16. Состав ср. Chromocult Coliform Agar (г/дм3)
Пептоны - 3,0
Хлорид натрия - 5,0
Дигидрофосфат натрия однозамещенный - 2,2
Гидрофосфат натрия двузамещенный - 2,7
Пируват натрия -1,0
Триптофан -1,0
Агар-агар -10,0
Сорбитол -1,0
Тергитол-7 - 0,15
1-изопропил-β-D-1-тио-галактопиранозид (IPTG) - 0,1
хромогенные субстраты:
- 6-хлор-3-индолил-β-D-галактопиранозид (Salmon-GAL) 0,15
- 5-бром-4-хлор-3-индолил-β-D-глюкуронид (X-GLUC) - 0,1
17. Состав ср. Chromocult Coliform Agar ES (г/дм3)
Пептоны - 5,0
хлорид калия - 7,5
MOPS -10,0
Соли желчных кислот -1,15
Пропионовая кислота - 0,5
Агар-агар -10,0
1-изопропил-β-D-1-тио-галактопиранозид (IPTG) - 0,1
хромогенные субстраты:
- 6-хлор-3-индолил-β-D-галактопиранозид (SalmonGAL) - 0,15
- 5-бром-4-хлор-3-индолил-β-D-глюкуронид (X-GLUC)
- 0,1
18.
19.
20.
21.
22.
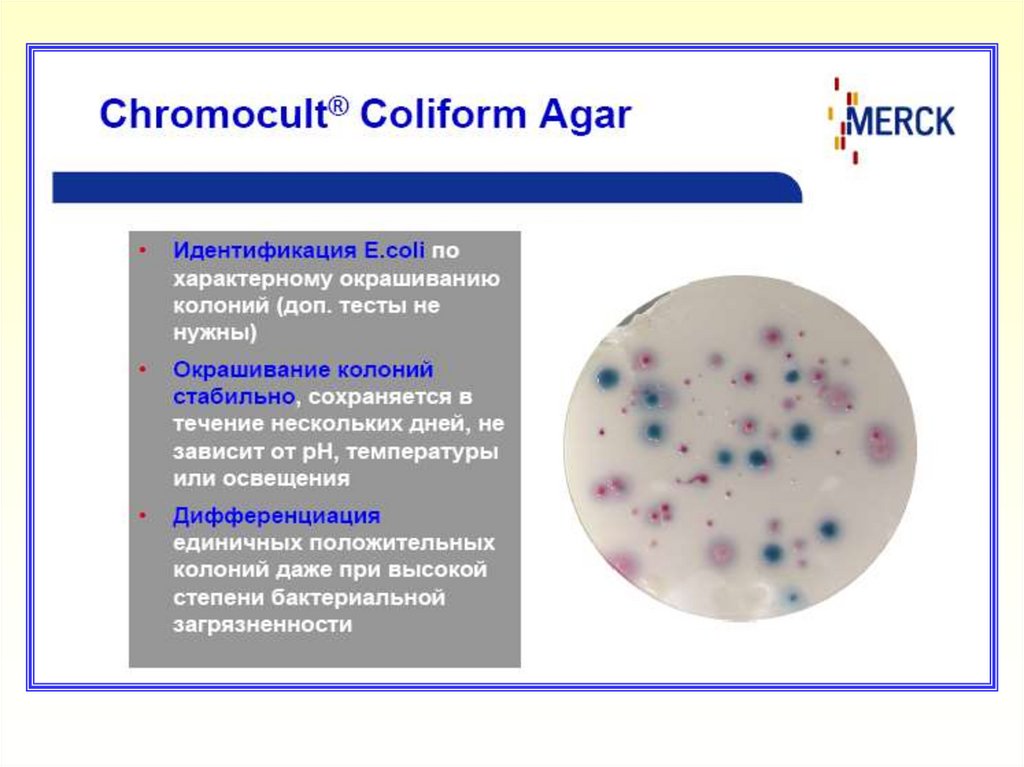
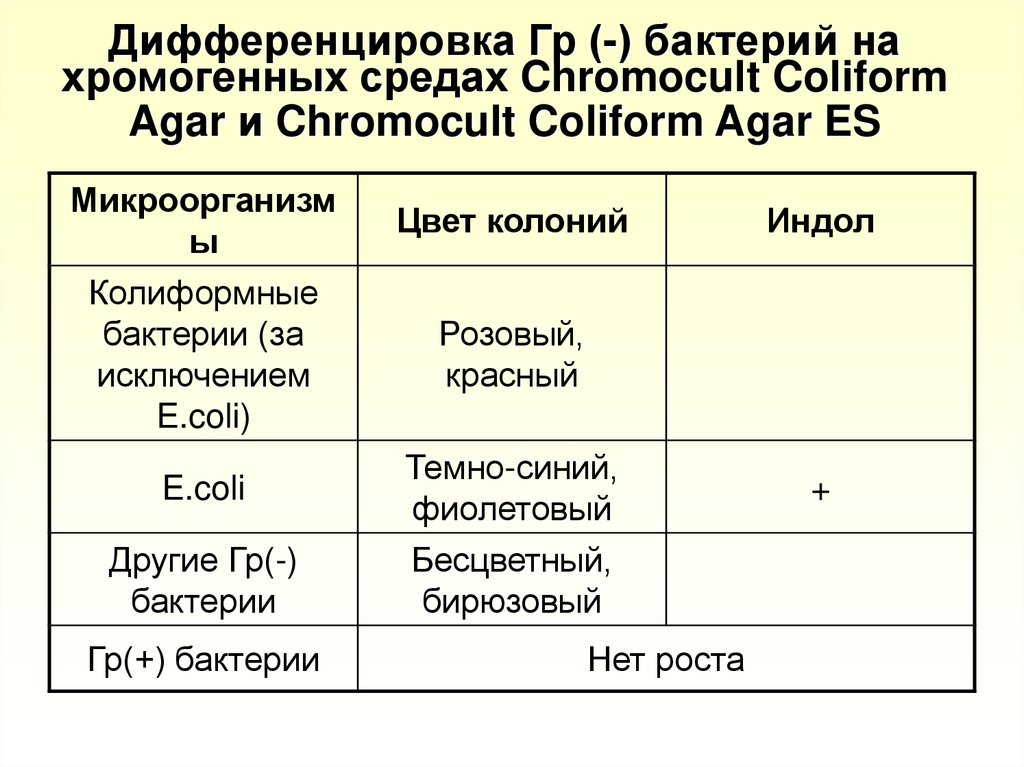
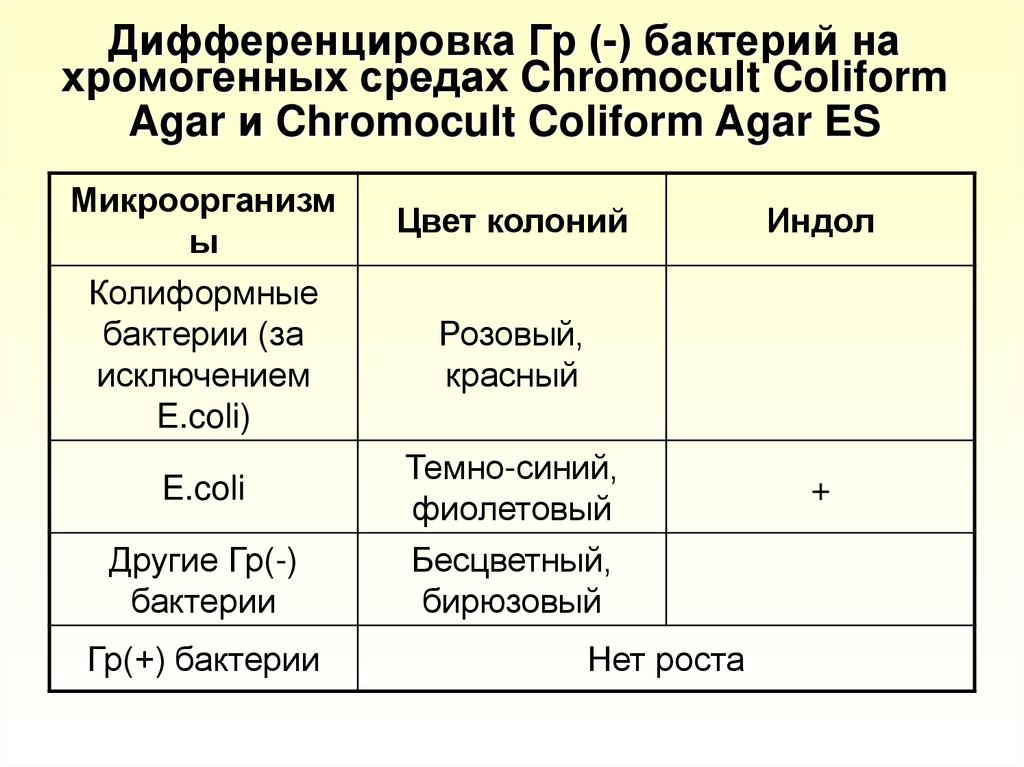
23. Дифференцировка Гр (-) бактерий на хромогенных средах Chromocult Coliform Agar и Chromocult Coliform Agar ES
Микроорганизмы
Колиформные
бактерии (за
исключением
E.coli)
E.coli
Другие Гр(-)
бактерии
Гр(+) бактерии
Цвет колоний
Индол
Розовый,
красный
Темно-синий,
фиолетовый
Бесцветный,
бирюзовый
Нет роста
+
24.
25.
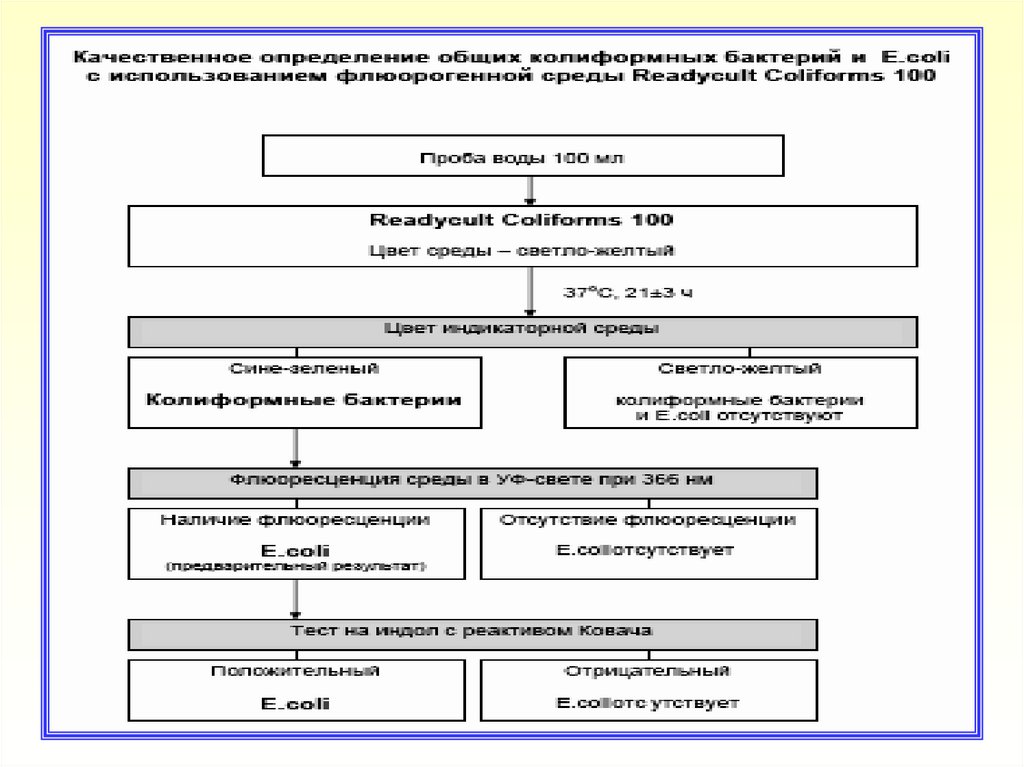
26. Качественное определение ОКБ и E.coli
проводят методом прямого посева
(метод
основан
на
внесении
стерильной
гранулированной
индикаторной среды в нормируемый
объем воды, инкубации посевов, учете
изменения цвета и флюоресценции
среды с образцами
27. Readycult Conforms 100
• Всреде
β-галактозидаза
КБ
расщепляет хромогенный субстрат (XGAL) с образованием окрашенного
продукта, который изменяет цвет среды
со светло-желтого на сине-зеленый.
Фермент
β-глюкуронидаза
E.coli
расщепляет флюорогенный субстрат
(MUG)
с
образованием
флюоресцирующего (при воздействии
УФ) продукта
28. Техника качественного определения ОКБ и E.coli методом прямого посева
1.2.
3.
4.
5.
6.
7.
К 100 мл пробы воды (при необходимости исследуют 3
объема по 100 мл) добавить среду Readycult Conforms 100.
Закрыть
флакон
и
перемешать
до
полного
растворения гранулированной среды. Проба окрашивается в
светло-желтый цвет
Посев инкубировать при температуре (37±1 )°С в течение
21±3 часов или при комнатной температуре (20-25)°С до 48
часов
После инкубации отметить наличие изменения цвета среды с
пробами
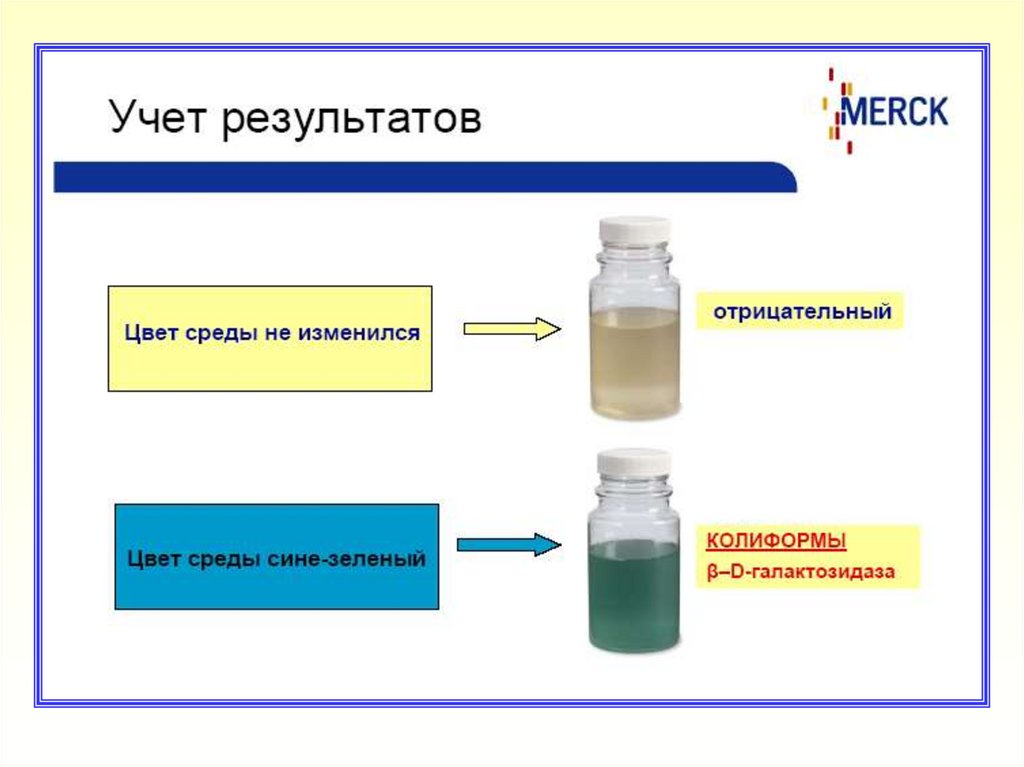
Отсутствие изменения цвета среды указывает на отсутствие
в исследуемых пробах воды КБ и E.coli
Изменение цвета среды со светло-желтого на синезеленый подтверждает наличие КБ
Для проб, в которых среда изменила свой цвет проверить
наличие флюоресценции при облучении УФ лампой.
Флюоресценция среды указывает на возможное наличие
E.coli
Для подтверждения E.coli к флюоресцирующей среде
добавить 2,5 см3 реактива Ковача (индольный тест).
Образование красного слоя на поверхности культуральной
жидкости указывает на образование индола и подтверждает
наличие E.coli
29.
30.
31. Состав ср. Readycult Conforms 100 (гр./пакет/100 мл пробы)
Пептоны - 0,5
Хлорид натрия - 0,5
Сорбитол - 0,1
Триптофан - 0,1
Гидрофосфат калия двузамещенный - 0,27
Дигидрофосфат калия - 0,2
Лаурилсульфат натрия - 0,1
1-изопропил-β-D-1-тио-галактопиранозид (IPTG) 0,01
• хромогенный субстрат:
- 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (XGAL) - 0,008 флюорогенный субстрат:
- 4-метилумбеллиферил-β-D-глюкуронид (MUG) 0,005
32.
33. Дифференцировка Гр (-) бактерий на хромогенной среде Readycult Conforms 100
Микроорга- Цвет средынизмы
Колиформн
ые бактерии
Синезеленый
E.coli
Синезеленый
Светложелтый
Другие Гр(-)
бактерии
Флюоресценция
Индольный
тест
+
+
34.
35. Учет и оценка результатов
• по определению ОКБ и E.coli внормируемом объеме воды методом
мембранно фильтрации или методом
прямого посева проводят по МУК
4.2.1018-01, МУ 2.1.5.800-99, ГОСТ
30712, МУ 2.1.4.1184-03 в зависимости
от типа воды
36.
37.
38.
УТВЕРЖДАЮЗаместитель Главного государственного санитарного врача
Российской Федерации -Главный врач Федерального центра
Госсанэпиднадзора Минздрава России
Е.Н.Беляев
10 февраля 2004 г.
№24ФЦ/513
Дата введения: 01 марта 2004 г.
Определение колиформных бактерий и Е.соli с
использованием хромогенных и флюорогенных
индикаторных сред производства Merck (Германия)
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Раздел 1. Определение колиформных бактерий и Е.соli в
пищевых продуктах, продовольственном сырье, смывах с
объектов внешней среды
39. Общие положения и область применения
МР устанавливают методы проведения
исследований по ускоренному определению
и выявлению КБ и Е.соli с использованием
хромогенных
и
флюорогенных
индикаторных сред в образцах пищевых
продуктов
(кроме
кисломолочных
продуктов,
заквасок,
бактериальных
концентратов и бактериальных препаратов
молочнокислых
бактерий),
продовольственного сырья, смывов с
объектов внешней среды
40. Сущность методов
1. Метод выявления КБ и E.coli основан навысеве
определенного
количества
исследуемого образца или его разведений в
жидкие селективные хромогенные среды,
инкубации посевов и учете изменения цвета
и флюоресценции среды с образцами,
подтверждении образования индола для
E.coli
2. Метод определения количества КБ и E.coli
основан
на
высеве
определенного
количества образца или его разведений на
агаризованные хромогенные селективные
среды, инкубации посевов, выявлении и
подсчете характерно окрашенных колоний
41. Принцип работы ср. Fluorocult LMX Broth
• насреде
β-галактозидаза
КБ
расщепляет хромогенный субстрат (XGAL) с образованием окрашенного
продукта, который изменяет цвет среды
со светло-желтого на сине-зеленый.
Фермент
β-глюкуронидаза
E.coli
расщепляет флюорогенный субстрат
(MUG)
с
образованием
флюоресцирующего (при воздействии
УФ) продукта
42. Техника выявления КБ и E.coli в определенной навеске образца
1. Навеску образца (или ряд десятикратных разведений) в массе/объемекоторой предусматривается отсутствие КБ и E.coli в соответствии с
СанПиН 2.3.2.1078-01, внести в среду Fluorocult LMX Brot
2. Соотношение между количеством/массой высеваемого образца или его
эквивалентным разведением и питательной средой -1:9 по объему.
Жидкие образцы можно не разводить. Твердые образцы измельчить в
гомогенизаторе
3. Тампоны со смывами, взятые с объектов окружающей среды погрузить
в пробирку с 5 см3 среды Fluorocult LMX Broth
4. Проверить наличие фоновой флюоресценции образца (особенно для
проб, содержащих морепродукты) при облучении УФ-лампой
5. Посевы инкубировать при температуре (37±1 )°С в течение 21±3 часов
6. После инкубации отметить наличие изменения цвета среды с
образцами (смывами)
7. Отсутствие изменения цвета среды учитывать как отсутствие в
исследуемых образцах (смывах) КБ и E.coli
8. Изменение цвета среды со светло-желтого на сине-зеленый
подтверждает наличие КБ
9. Для образцов, в которых среда изменила свой цвет, проверить наличие
флюоресценциии при облучении УФ лампой. Флюоресценция среды
указывает на возможное наличие E.coli
10. Для подтверждения E.coli к флюоресцирующей среде добавить 1 см3
реактива Ковача (индольный тест). Образование красного слоя на
поверхности культуральной жидкости указывает на образование
индола и подтверждает наличие E.coli
43.
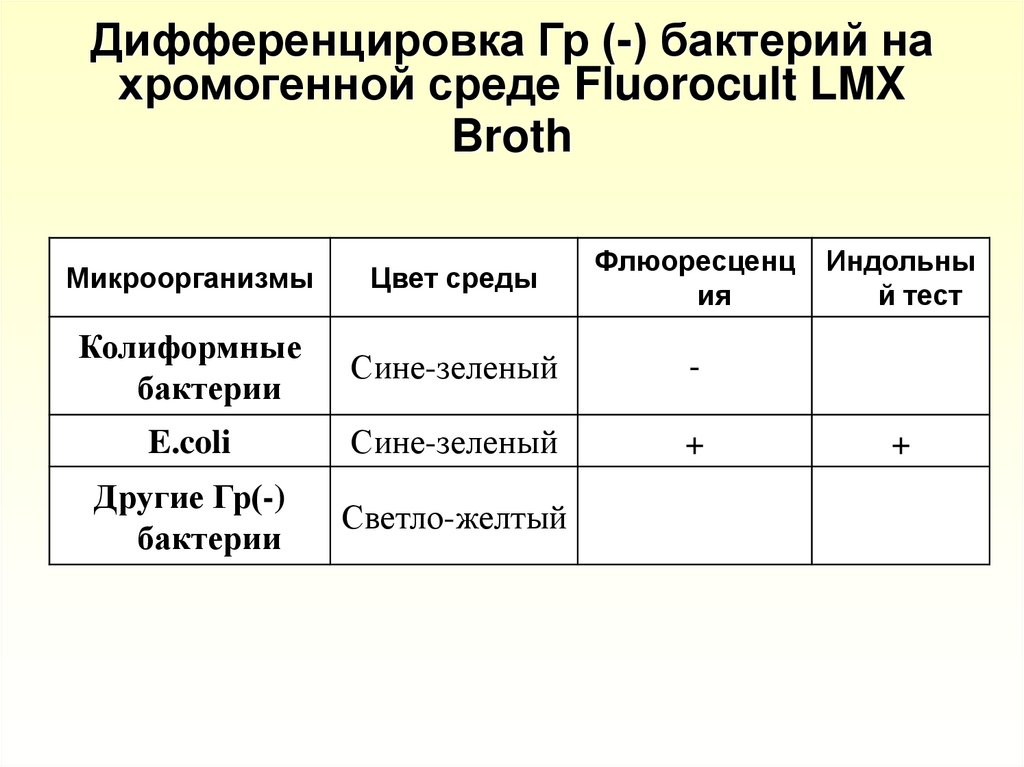
44. Дифференцировка Гр (-) бактерий на хромогенной среде Fluorocult LMX Broth
МикроорганизмыЦвет среды
Флюоресценц
ия
Колиформные
бактерии
Сине-зеленый
-
E.coli
Сине-зеленый
+
Другие Гр(-)
бактерии
Светло-желтый
Индольны
й тест
+
45. Состав среды Fluorocult LMX Broth (в г/дм3)
Пептоны - 5,0Хлорид натрия - 5,0
Сорбитол -1,0
Триптофан - 1,0
Гидрофосфат калия двузамещенный - 2,7
Дигидрофосфат калия - 2,0
Лаурилсульфат натрия -1,0
1-изопропил-β-D-1-тио-галактопиранозид (IPTG) - 0,1
хромогенный субстрат:
- 5-бром-4-хлор-3-индолил- β-D-галактопиранозид (X-GAL) 0,008
10. флюорогенный субстрат:
- 4-метилумбеллиферил- β-D-глюкуронид (MUG) - 0,005
1.
2.
3.
4.
5.
6.
7.
8.
9.
46.
• Приисследовании
продовольственного
сырья и пищевых продуктов (в том числе
кисломолочных, заквасок, бактериальных
концентратов
и
бактериальных
препаратов молочнокислых бактерий) в
соответствии с ГОСТ 30518, ГОСТ 30726
для
подтверждения
принадлежности
микроорганизмов к КБ и E.coli, пересеять
образцы с жидких селективных сред на
поверхность хромогенных сред Chromocult
Coliform Agar или Chromocult Coliform Agar ES
с последующей их идентификацией
47.
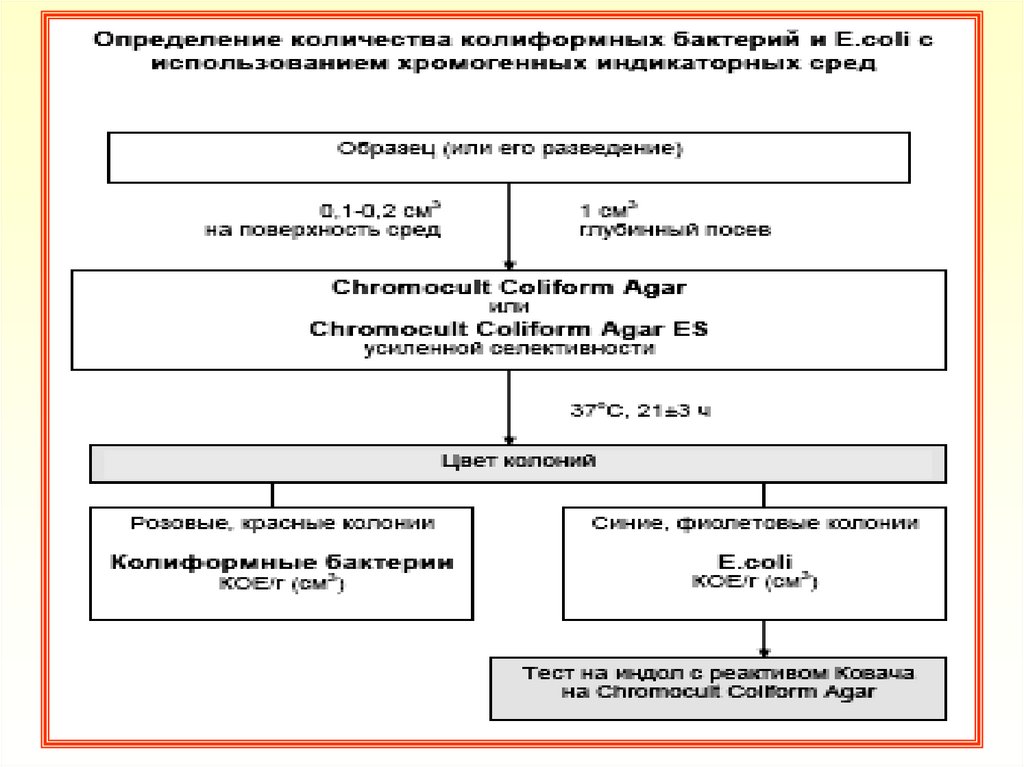
48. Техника определения количества КБ и E.coli
1. При определении количества КБ и E.coli в 1г/см3образца в соответствии с ГОСТ 30518, ГОСТ 30726 проводить
посев навески образца (или его разведения) в объеме 0,1 или
0,2 см3 поверхностным методом, а в объеме 1 см3 - глубинным
методом на агаризованные среды Chromocult Coliform Agar или
Chromocult Coliform Agar ES
2. Подготовку чашек Петри со средой к посеву и посевы
поверхностным и глубинным методами провести по ГОСТ
26670. Жидкие образцы можно не разводить. Твердые образцы
измельчить в гомогенизаторе
3. Посевы инкубировать при температуре (37±1 )°С в течение 21±
3 часов
4. После инкубации подсчитать характерно окрашенные колонии,
выросшие на чашках Петри. КБ (за исключением E.coli)
образуют колонии розового (до красного) цвета. E.coli образуют
колонии темно-синего (до фиолетового) цвета
5. Для подтверждения E.coli на среде Chromocult Coliform Agar
нанести каплю реактива Ковача непосредственно на характерно
окрашенные колонии (индольный тест). Изменение цвета
реагента до розово-красного в течение нескольких секунд
подтверждает наличие E.coli
6. Для
подсчета
количества
КБ
бактерий
сложить
количество характерно окрашенных колоний
49. Дифференцировка Гр (-) бактерий на хромогенных средах Chromocult Coliform Agar и Chromocult Coliform Agar ES
Микроорганизмы
Колиформные
бактерии (за
исключением
E.coli)
E.coli
Другие Гр(-)
бактерии
Гр(+) бактерии
Цвет колоний
Индол
Розовый,
красный
Темно-синий,
фиолетовый
Бесцветный,
бирюзовый
Нет роста
+
50. Учет и оценка результатов
1. Учет и оценку результатов по выявлению иколичественному определению КБ и E.coli
в определенной навеске образца провести
по ГОСТ 26670
2. Учет и оценку результатов смывов провести
в соответствии с НД по контролю за
микробиологической
обсемененностью
окружающей
среды
на
предприятиях
торговли, общественного питания и лечебнопрофилактических учреждений
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
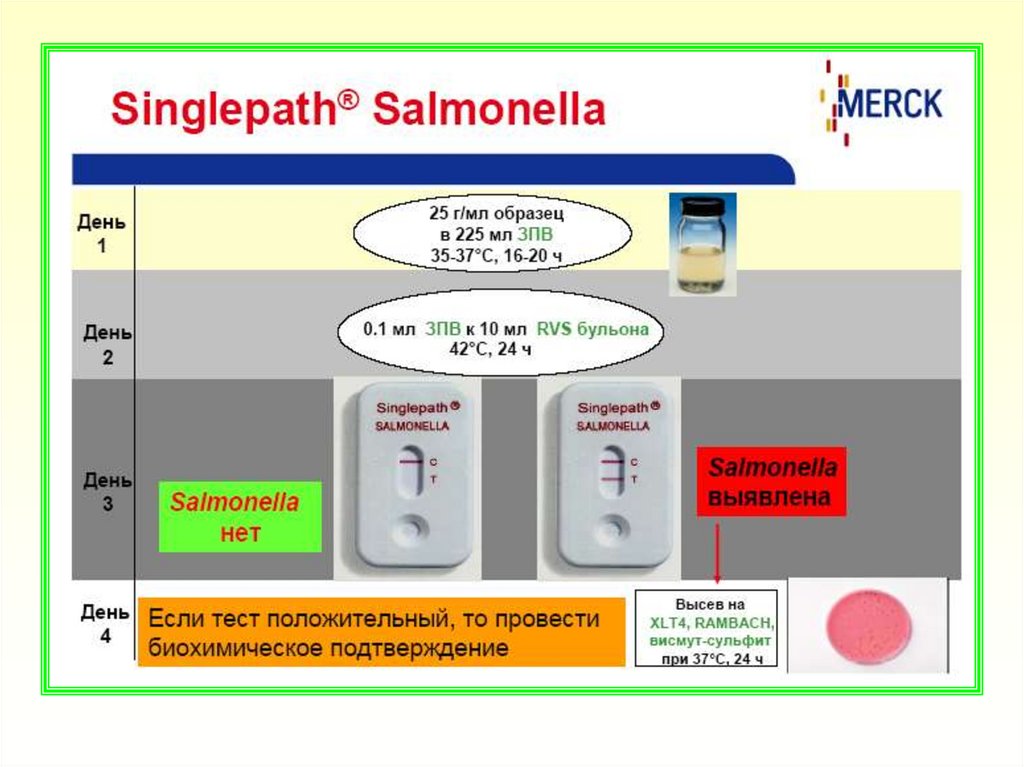
ФЕДЕРАЛЬНЫЙ ЦЕНТР ГИГИЕНЫ И ЭПИДЕМИОЛОГИИРОСПОТРЕБНАДЗОРА
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В СФЕРЕ
ЗАЩИТЫ ПРАВ ПОТРЕБИТЕЛЕЙ И БЛАГОПОЛУЧИЯ
ЧЕЛОВЕКА
Ускоренный метод выявления бактерий рода
Salmonella с использованием среды MSRV
производства Merck KGaA (Германия)
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Москва 2006
63.
МРустанавливают
методы
проведения
лабораторных
исследований
по
ускоренному
выявлению
бактерий
рода
Salmonella в пищевых продуктах,
продовольственном
сырье
и
объектах окружающей среды с
использованием
модифицированной
среды
Раппопорта-Василиадиса (MSRV)
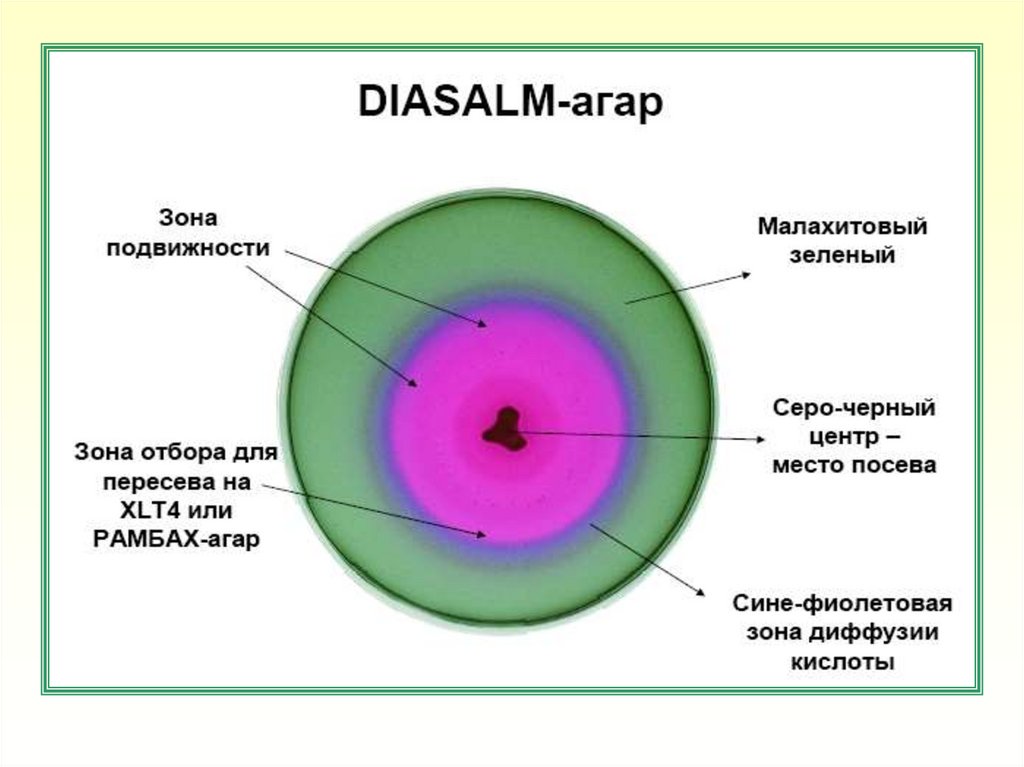
64. Принцип действия среды MSRV
• Селективнаяполужидкая
среда
MSRV
с
новобиоцином предназначена для ускоренного
выявления бактерий рода Salmonella в пищевых
продуктах, продовольственном сырье и объектах
окружающей среды; является модификацией среды
Раппопорта-Василиадиса
• В полужидкой среде MSRV происходит диффузный
рост подвижных штаммов бактерий рода Salmonella в
агаре, с образованием непрозрачных зон роста. Рост
и подвижность других микроорганизмов подавляются
селективными агентами (новобиоцин, хлористый
магний, малахитовый зеленый) и повышенной
температурой инкубации (41оС)
65. Принцип метода
Метод выявления бактерий рода Salmonellaоснован
на
высеве
определенного
количества исследуемого образца или его
разведений в жидкую неселективную среду,
инкубировании посевов и последующем
выявлении подвижных штаммов бактерий
рода Salmonella, образующих светлый ореол
при диффузном росте в селективной
полужидкой среде MSRV с новобиоцином,
имеющих
типичные
биохимические
и
серологические характеристики
66. Техника определения
Навеску анализируемого образца в массе/объеме которойпредусматривается отсутствие бактерий рода Salmonella
в
соответствии с СанПиН 2.3.2. 1078-01, внести в забуференную ПВ.
Соотношение массы (объема) образца и питательной средой 1:9 по
объему. Тампоны со смывами, взятые с объектов окружающей
среды погрузить в пробирки с 5 см3 забуференной ПВ
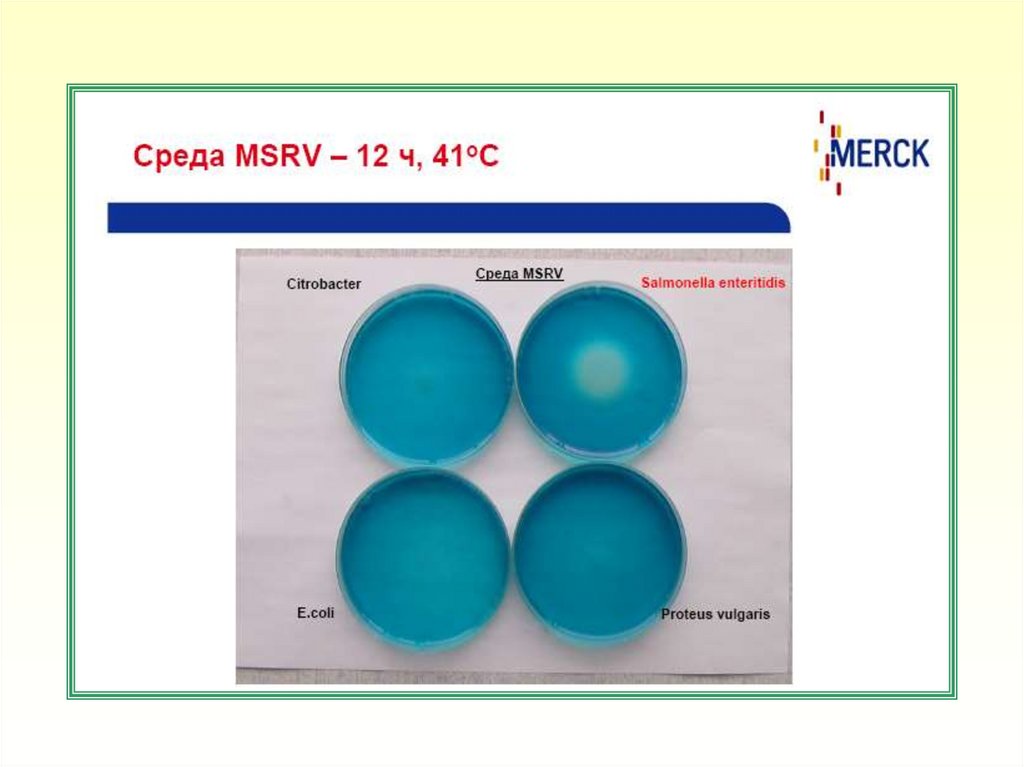
2. Посевы инкубировать при температуре (37±1)ºС в течение 18±2 ч.
3. После инкубирования обогащенную культуру в количестве 0,1 см3
наносят в центр чашки Петри со средой MSRV
4. Посевы в чашках (не переворачивая, крышка сверху) инкубируют в
аэробных условиях при температуре (41±1)ºС в течение 15±3 ч.
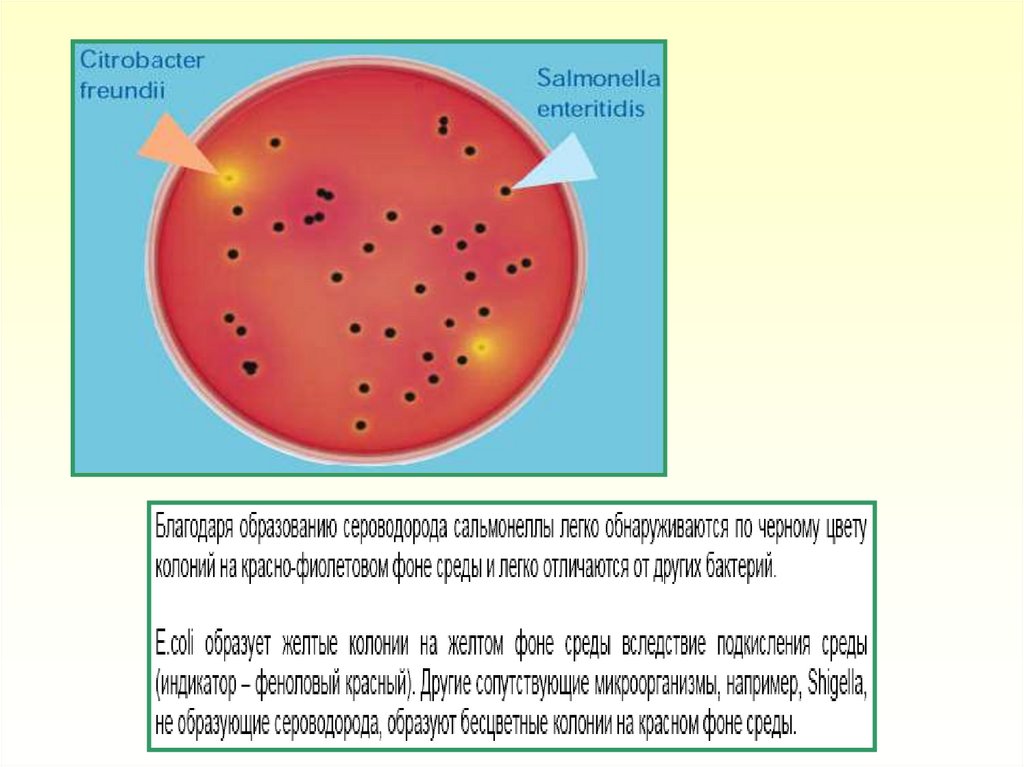
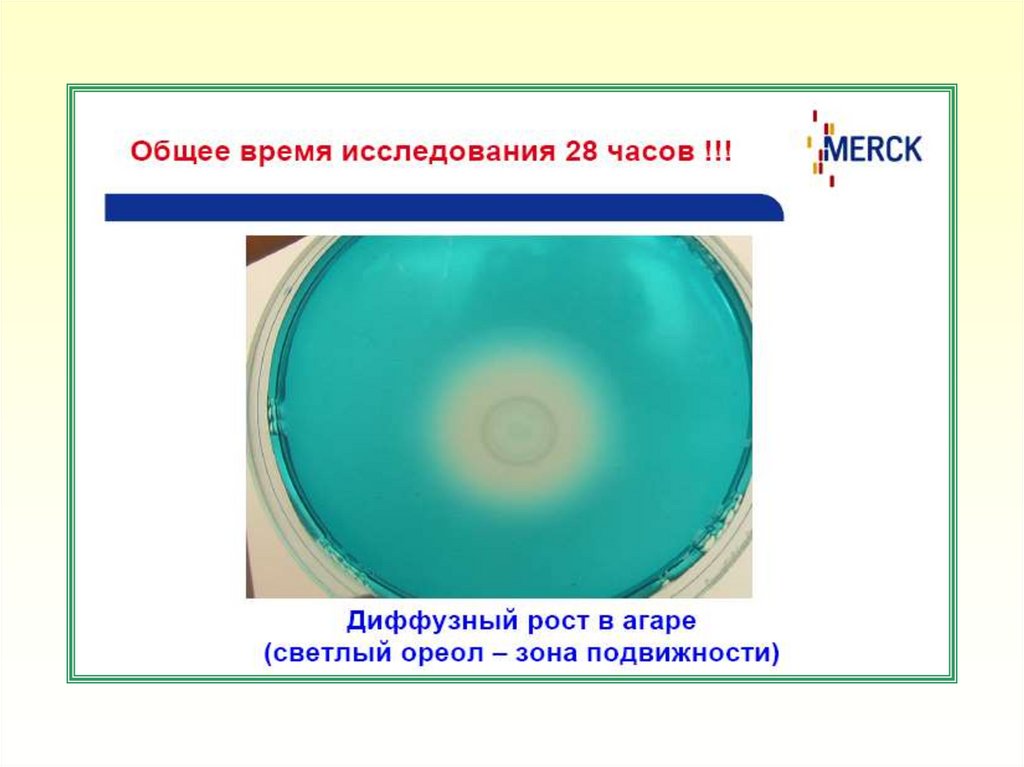
5. Диффузный рост подвижных культур в агаре с образованием светлого
ореола (зоны подвижности) указывает на наличие бактерий рода
Salmonella. Рост микроорганизмов в месте посева без диффузного
роста в агаре указывает на наличие неподвижных штаммов
бактерий рода Salmonella или других энтеробактерий
6. Бохимическое и серологическое подтверждение принадлежности
выделенных культур к бактериям рода Salmonella проводят по
ГОСТ 30519 (культуру для биохимического и серологического
подтверждения берут с края зоны подвижности)
1.
67. Забуференная пептонная вода – Peptone Water (Buffered)
Состав (г/л):
Пептон - 10,0 г
Хлористый натрий - 5,0 г
Натрий
фосфорнокислый
двузамещенный - 9,0 г
Калий
фосфорнокислый
однозамещенный - 1,5 г
68. Модифицированная среда Раппопорта-Василиадиса (MSRV)
Модифицированная среда РаппопортаВасилиадиса (MSRV)Состав (г/л):
Триптоза - 4,59 г
Гидролизат казеина - 4,59 г
Хлористый натрий - 7,34 г
Калий фосфорнокислый однозамещенный 1,47 г
Хлористый магний безводный - 10,93 г
Малахитовый зеленый - 0,037 г
Новобиоцин - 20,0 мг
Агар-агар - 2,7 г


























































 medicine
medicine








