Similar presentations:
Химия актиноидов
1.
ХИМИЯАКТИНОИДОВ
2. ЛИТЕРАТУРА
• 1. Химия актиноидов: в 3-х т. Пер. с англ./Под ред. Дж.Каца, Г. Сиборга, Л.Морсса - М.: Мир, 1997.
• 2. Бессонов, В. А. Основы радиохимии. Учебное пособие
по курсу «Радиохимия»/ В. А. Бессонов - ОГТУАЭ,
Обнинск 2004.
• 3. Гергалов, В.И. Радиохимия. Учебно-методическое
пособие в 2-х частях. Мн., БГУ, 2015
• 4. Давыдов, Ю. П. Основы радиохимии/ Ю.П. Давыдов.Мн.: Вышэйшая школа, 2014.
• 5. Бекман Н.Н. Радиохимия. Курс лекций. М., 2006
• 6. Бекман Н Н. Уран.
3. ЛИТЕРАТУРА
• 7. Несмеянов, Ан. Н. Радиохимия/ Ан. Н. Несмеянов. М.: Химия. 1985.• 8. Несмеянов, Ан. Н. Прошлое и настоящее радиохимии/
Ан. Н. Несмеянов - Л.: Химия , 1985.
• 9. Нефедов, В. Д. Радиохимия. Уч. пособие/ В. Д.
Нефедов, Е. Н. Текстер, М. А. Тропова. - М.: Высшая
школа, 1987.
• 10. Фридлендер, Г. Ядерная химия и радиохимия/ Г.
Фридлендер, Дж. Кеннеди, Дж. Миллер - М.: Мир, 1967.
• 11. Гринвуд, Н., Эрншо, А. Химия элементов. (лучший
зарубежный учебник) в 2-х т. (т.2) Пер. с агл. М.,
БИНОМ. Лаборатория знаний, 2008.
4. ЛИТЕРАТУРА
12. Аменицкая, Р. В. Сборник задач по радиохимии/ Р. В.Аменицкая и [др] - М.: Высшая школа, 1969.
13. Вдовенко, В. Н. Современная радиохимия/ В.Н.
Вдовенко. - М.: Атомиздат, 1969.
14. Жерин И.И., Амелина Г.Н. Основы радиохимии,
методы выделения и разделения радиоактивных
элементов. Учеб. пособ.-Изд-во Томского политех. Ун-та,
2009
15. Макаров, Л. Л. Прикладная радиохимия/ Л. Л. Макаров.
- Л.: Изд. ЛГУ, 1966.
16. Старик, И. Е. Основы радиохимии/ И. Е. Старик. – Л.:
Наука, 1969.
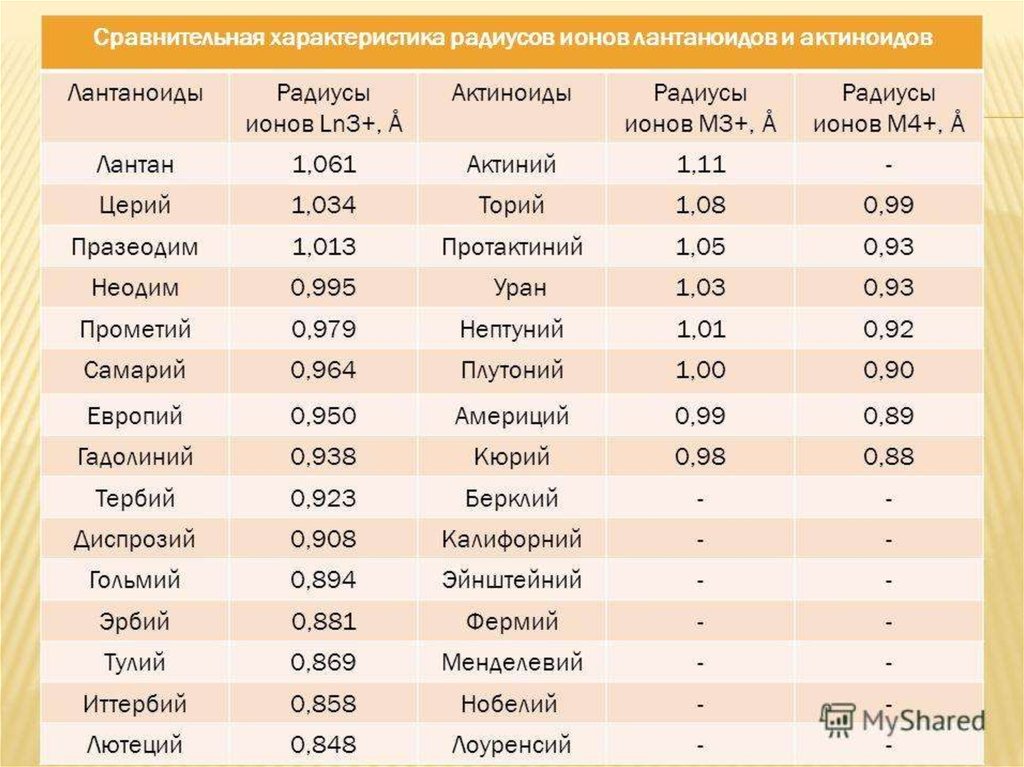
5. Актиноиды. История открытия.
Период открытия: XVIII век (U)- ХХ век (Lr)U, Th – природные радиоактивные элементы
Ac, Pa – продукты распада урана и тория
Трансурановые элементы:
1. Облучение урана или другого актиноида нейтронами в ядерном
реакторе.
2. Облучение урана или другого актиноида импульсным потоком
нейтронов при термоядерном взрыве.
(Открытие эйнштейния и фермия - результат исследований продуктов взрыва
термоядерного устройства, произведенного США в Тихом океане в ноябре 1952
г., операция "Майк").
3. Облучение элементов 7 периода p, d, , 13C, 18O и т.д.
6. Трансурановые элементы
• 1. Происходитпоследовательный захват
нескольких нейтронов и
последующий β- -распад
получившихся ядер с
образованием тяжелых
актиноидов.
Облучение урана или другого
актиноида нейтронами в ядерном
реакторе.
2. Происходит
многократный захват
нейтронов ядром и
образование тяжелых
актиноидов при
последующем β--распаде
Облучение урана или другого
актиноида импульсным потоком
нейтронов при термоядерном взрыве
7. Трансурановые элементы
• 3. Облучением элементов 7 периода р, d, α, 13 6С,18 О, 22 Ne
8
10
8. Актиноиды. Попытки размещения в ПС
Первая попытка размещения 5f-элементов –гипотеза М. Гайсинского (принцип аналогии
химических свойств - неоднозначен)
Концепция А.А.Чайхорского (проявление
степени окисления +4 у 9 из 13 актиноидов,
родоначальник – торий)
Концепции В.Г. Григоровича (1963 г.), И.А.
Лебедева (1972 г.): размещение f-элементов по
группам
9. Актиноиды. Попытки размещения в ПС
Актиноидная гипотеза Г. Сиборга (1944 г.)Элементы с порядковыми номерами 90-103 образуют 5fсемейство и по аналогии с лантаноидами размещаются в
виде отдельной группы.
Актиноиды – промежуточное положение
между элементами f и d-серий.
Энергии связи 5f и 6d-электронов
очень близки.
10. Строение
11. Электронная структура и степени окисления Ас и актиноидов
12.
13.
14. Общие свойства. Физические.
15.
16. Общие свойства. Химические.
Активные металлы, легко вступающие в реакции практически со всемихимическими элементами.
Растворимы в разбавленных минеральных кислотах, в
концентрированных HNO3 и H2SO4 – пассивируются.
17. АКТИНОИДЫ. ПРОСТЫЕ ВЕЩЕСТВА
18.
19. СОЕДИНЕНИЯ АКТИНОИДОВ
Оксиды обладают полиморфизмом, более высоких,чем +4 степеней окисления – малоустойчивы
(исключение оксиды урана и Pa2O5).
Гидриды при повышении температуры выше 300
С разлагаются с выделением металлов в виде
пирофорных порошков.
Стабильность галогенидов падает с ростом
атомного номера галогена и числа атомов галогена в
соединении. Трифториды и тетрафориды не
растворимы в воде, хлориды, бромиды и иодиды –
растворимы.
20. СОЕДИНЕНИЯ АКТИНОИДОВ
Карбиды MeC легко гидролизуются водой собразованием углеводородов, мелкоизмельченные пирофорны. Me2C3 и MeC2 более устойчивы.
Мононитриды: нагревание металлов или карбидов
в токе азота или аммиака.
Силициды: взаимодействие металлов с кремнием
при высоких температурах. Соляная кислота
разлагает до SiH4.
21. Актиноиды в растворах
Гидратированныеионы
Me2+, Me3+, Me4+
MeO22+(«ил»),
MeO2+(«оил»), MeO53-
Диспропорционирован
ие
2 MeO2+ +4Н+ MeO22+
+ Me4+
Гидролиз,
Комплексообразование:
Me4+ > Me3+>MeO22+>MeO2+
Для оксалат и ацетат-ионов:
Me4+ > MeO22+ > Me3+ >MeO2+
Полимеризация с
образованием
полиядерных продуктов
гидролиза
Координационное число
6-12.
22. СОЕДИНЕНИЯ АКТИНОИДОВ по степеням окисления
23. СОЕДИНЕНИЯ АКТИНОИДОВ по степеням окисления
24. СОЕДИНЕНИЯ АКТИНОИДОВ по степеням окисления
25. СОЕДИНЕНИЯ АКТИНОИДОВ по степеням окисления
26. СОЕДИНЕНИЯ АКТИНОИДОВ по степеням окисления
27. СОЕДИНЕНИЯ АКТИНОИДОВ по степеням окисления
28. ОРИЕНТИРОВОЧНЫЕ ЦВЕТА ИОНОВ В ВОДНЫХ РАСТВОРАХ
Ориентировочные (приблизительные) цвета актинидных ионов в водном растворе[24]Степе
нь
окисл
ения
89
90
91
92
93
94
95
96
97
98
99
+3
Ac3+
Th3+
Pa3+
U3+
Np3+
Pu3+
Am3+
Cm3+
Bk3+
Cf3+
Es3+
Th4+
Pa4+
U4+
Np4+
Pu4+
Am4+
Cm4+
Bk4+
Cf4+
PaO2+
UO2+
NpO2+
PuO2+
AmO2+
UO22+
NpO22+ PuO22+
+4
+5
+6
+7
NpO23+ PuO23+
AmO22
+
[AmO6
]5−



























 chemistry
chemistry








