Similar presentations:
Химия переходных элементов IV – V группы
1. Химия переходных элементов
IV – V группы2. Происхождения названий
• Ti – титаны, персонажи древнегреч.мифологии, дети Геи; название дал Мартин
Клапрот.
• Zr – происхождение вероятно от араб.
Zarkûn (киноварь) или от перс. zargun
(золотистый цвет)
• Hf – в честь Копенгагена (лат. название
города - Hafnia). Был предсказан с
помощью квантов Бором.
3. IV группа
TiZr
Hf
Число
стабильных
изотопов
5
5
6
Электронная
конфигурация
атома
[Ar]3d24s2
[Kr] 4d25s2
[Xe]4f145d26s2
4
0.18
105
0.146
0.160
0.159
1.54
(-1), 0, (2), 3,
4
1.33
(-1), 0, (1),
(2), (3), 4
1.30
(-1), 0, (1),
(2), (3), 4
Сечение
захвата
тепловых
нейтронов
Металлически
й радиус
ЭО
СО
4.
Природа сходства Zr и Hf (лантанидное сжатие)Устойчивость высших степеней окисления
Ti
Zr
Hf
TiO, Ti2O3, TiO2,но только ZrO2, HfO2
TiF2, TiF3, TiF4,но только ZrF4, HfF4
Координационные числа у Ti (6, реже 4),
у Zr и Hf (6, 7, 8, 9)
5.
СОЭК
КЧ
соединения
Ti
Zr, Hf
-1
d5
6
[M(bipy)3]-
0
d4
6
Ti(CO)6
+2
d2
6
TiO, TiCl2
+3
d1
6
[Ti(H2O)6]3+
ZrI3
+4
d0
4
TiCl4
ZrCl4 (г)
6. Природные формы, получение
• Ti (0.6 %), 10-й элемент пораспространенности (7-ой среди металлов)
FeTiO3 – ильменит
TiO2 – рутил, анатаз, брукит
CaTiO3 – перовскит
7. Природные формы, получение
• Zr (0.02%), 21-й элемент пораспространенности
ZrSiO4 – циркон
ZrO2 – бадделит
8. Природные формы, получение
• Hf (4·10-4 %, сопутствует Zr), 52-й элементпо распространенности
• Th (2·10-3 %), 232Th имеет период
полураспада ~ 14 млрд лет
9.
TiO2 + 2C + 2Cl2→ TiCl4 + 2COДистилляция TiCl4 (283ºC) – FeCl3 (317 ºC)
TiCl4 + 2Mg
900º
2MgCl2 + Ti (тоже Zr и Hf)
K2[ZrF6] + 4Na → 4NaF + 2KF + Zr (тоже Hf)
1000ºC
MI4
400 ºC
M + 2I2 (очень чистый)
ХТР
10.
Ti открыт в рутиле 200 лет назад КлапротомZr открыт более 150 лет назад в цирконе
Hf – открыт 75 лет назад, X-ray спектры
Zr – малое сечение захвата нейтронов
ТВЭЛы, контейнеры для U
Hf – большое сечение захвата нейтронов
ТплºС
Ti
Zr
Hf
Th
1668
1857
2227
1845
11.
Tiлегкий конструкционный материал ( в 3-5 раз
прочнее Al и Mg)
ферротитан ( 0,1% Ti к стали - эластичность)
Ti – Al сплавы (интерметаллиды TiAl и TiAl3)
подлодки – немагнитность (коррозия 20 мкм за
1000 лет)
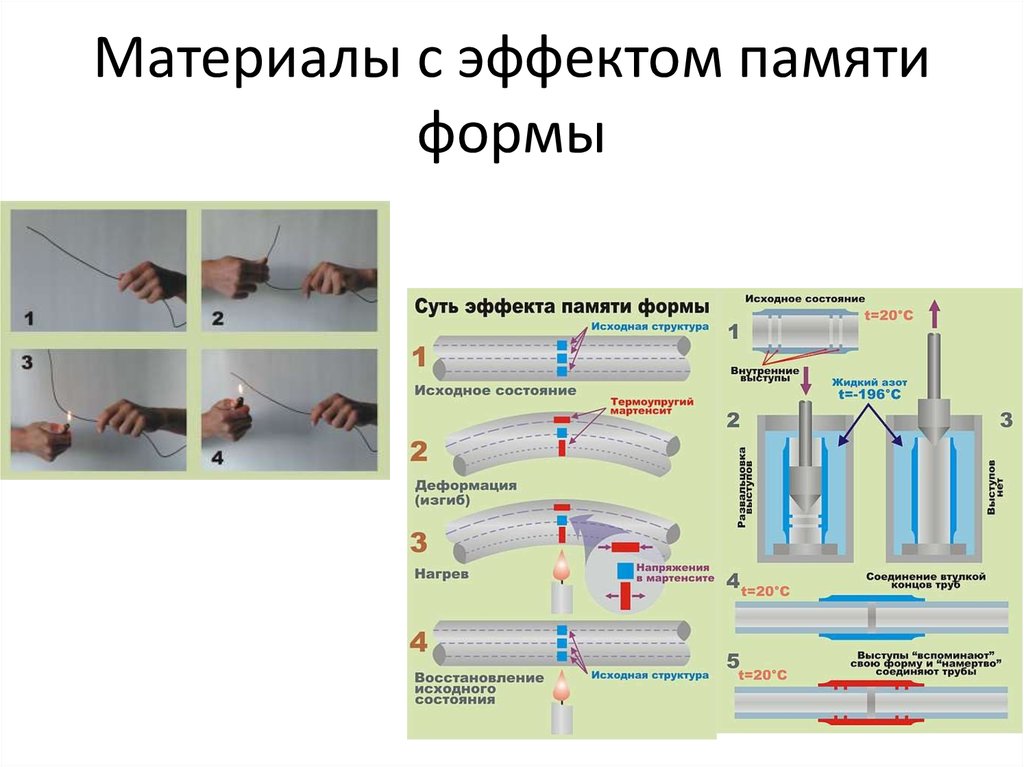
NiTi – nitinol – NiTi Navel Ordnance Lab.
Zr
сплавы, отражатель нейтронов
Hf
поглотитель нейтронов
12. Материалы с эффектом памяти формы
13. Химические свойства
• Восстановители, пассивация• С водородом МНх (обратимость,
аккумуляторы, 1 г Ti → 2 л Н2)
14.
• с кислородом ЭО2 – фианитыTiO2
ZrO2 HfO2
ThO2
• ΔΗfкДж/моль 944
1080 1136
1190
• Tпл, ºС
1825 2680 2812
3050
• Химическая инертность, Ti – белила, не
взаимодействуют с H2O, HNO3(р), NaOH(р)
сплав
• МО2 + КОН (К2СО3)
К2МО3
• К2TiO3 + H2O → TiO2·H2O + KOH
15.
“TiN” ~ Au (коронки)—
MO2 + 6HF → H2[ЭF6] + 2H2O
MO2 + 3 H2C2O4 → H2[M(C2O4)3] + 2H2O
или
M + 6HF → H2[ЭF6] + 2H2↑
M + 3 H2C2O4 → H2[M(C2O4)3] + 3H2O
M + N2→ MN
16.
• M + 2Г2→ МГ4• МО2 + 2Г2 = МГ4 + О2 (ΔG>0)
• 2C + О2 = 2СО (ΔG<< 0)
• МО2 + 2С + 2Сl2→ MCl4 + 2CO (ΔG<0)
17.
Фотокатализ (нанопроволока TiO2)Гидротермальная обработка геля TiO2·nH2O (T = 110 – 250 ºC; t = 20 ч)
OH
hν
UV
TiO2
OH
h+
e-
H2O
Ti4+
O2
HO2
H2O
CO2
18. Фотонный кристалл TiO2
19.
• МГ4 – бесцветные, твердые вещества(исключение TiCl4)
• Молекулярные решетки TiCl4 ZrCl4 HfCl4 ThCl4
• tплºC
-23 437 432 770
• Устойчивость в парах, КЧ = 4, ковалентная связь, в
кристаллическом состоянии – бесконечные цепи
октаэдров ЭХ6
• π – связывание: вакантные d-АО металла +
неподеленные электронные пары галогена
• Катализаторы Циглера – Натта (гигроскопичность)
TiCl4 + H2O → TiO2· nH2O + HCl
аэрозоль
20.
3 TiCl4 +4H2O → 2H2TiCl6 + Ti(OH)4[TiCl6]2-+H2O→[TiCl5(H2O)]1- H2O
[TiCl4(H2O)2] 2H2O [TiCl2(H2O)4]2+ →
[Ti(OH)Cl2(H2O)3]1+ →
→ [Ti(OH)4(H2O)2]
21.
H2OH2O
H2O
OH
OH
Ti
Ti
H2O
OH
OH
OH
OH
OH
OH
-2H2O
H2O
OH
H
O
Ti
H2O
OH
Ti
OH
OH
O
H
OH
OH
22.
Оловые мостики2-
OH
OH
O
OH
HO
Ti
+ 2H+
Ti
OH
HO
O
OH
OH
Оксоловые мостики
23.
Э4+ + H2O = ЭО2+ + 2H+Солеобразующий характер МОГ2, МО(NO3)2
Соли титанила, цирконила
TiOCl2, ZrOBr2
TiOSO4 + H2O2 + H2SO4 = H2[TiO2(SO4)3] + H2O
пероксотитанил ион
24.
Соединения М (+3)2TiOSO4 + Zn + 2H2SO4 = Ti2(SO4)3 + ZnSO4 +2H2O
[Ti(H2O)6]3+
[Ti(H2O)6]3+ Δ = 17·103см-1 сиреневый
[TiCl6]3Δ = 21·103см-1 фиолетовый
Ti2(SO4)3 + KMnO4 + H2O → Ti(OH)2SO4 + K2SO4 +
MnSO4 + H2SO4
25.
26. Место в п.с.э.
V –“ванадис” – богиня радости, красотыNb – “ниобея” – полубогиня, дочь Тантала
Ta – “тантал” – греческий полубог Тантал
26
27.
AP, Å ИР, Э5+23V
…3d34s2
1.36
0.40
41Nb
…4d45s1
1.46
0.70
СО
+5, +4, +3, (+2),
0, (-1), (-3)
+5, +4, (+3), (+2),
0, (-1)
Лантанидное сжатие
73Ta
…5d36s2
1.46
0.73
91Pa
.5f16d27s2
1.62
1.02
243
95
+5, (+4), (+3),
(+2), 0, (-1)
Am Ne Db 4 n
22
10
261
105
1
0
Флеров, Дубна
28.
Сходство V5+ (0.40 Å) и P5+ (0.37 Å)Оксоанионы ЭО3- (NaVO3, NaPO3)
В высших степенях окисления – сходство с
неметаллами, в низших – с металлами.
В форме простых веществ – типичные
металлы
Катионные формы Э2+, Э3+ (нестабильны)
V2O5 + 6HCl(конц) = Cl2 + 2VOCl2 + 3H2O
ванадилхлорид
29.
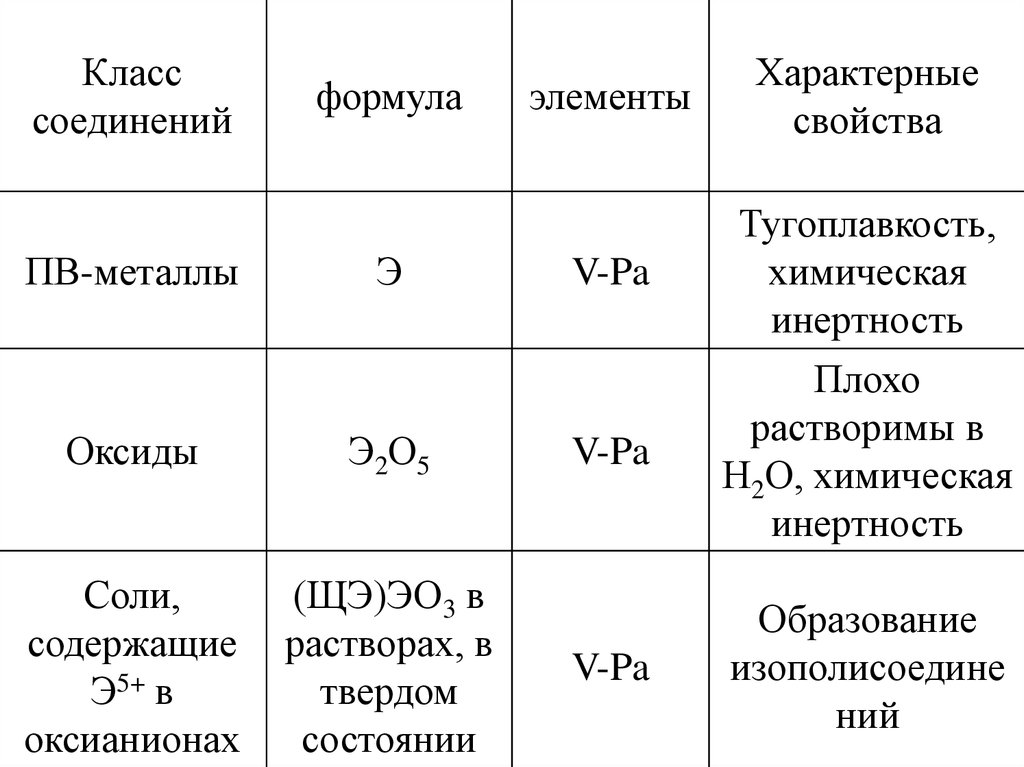
Класссоединений
формула
элементы
ПВ-металлы
Э
V-Pa
Оксиды
Э2О5
V-Pa
Соли,
содержащие
Э5+ в
оксианионах
(ЩЭ)ЭО3 в
растворах, в
твердом
состоянии
V-Pa
Характерные
свойства
Тугоплавкость,
химическая
инертность
Плохо
растворимы в
Н2О, химическая
инертность
Образование
изополисоедине
ний
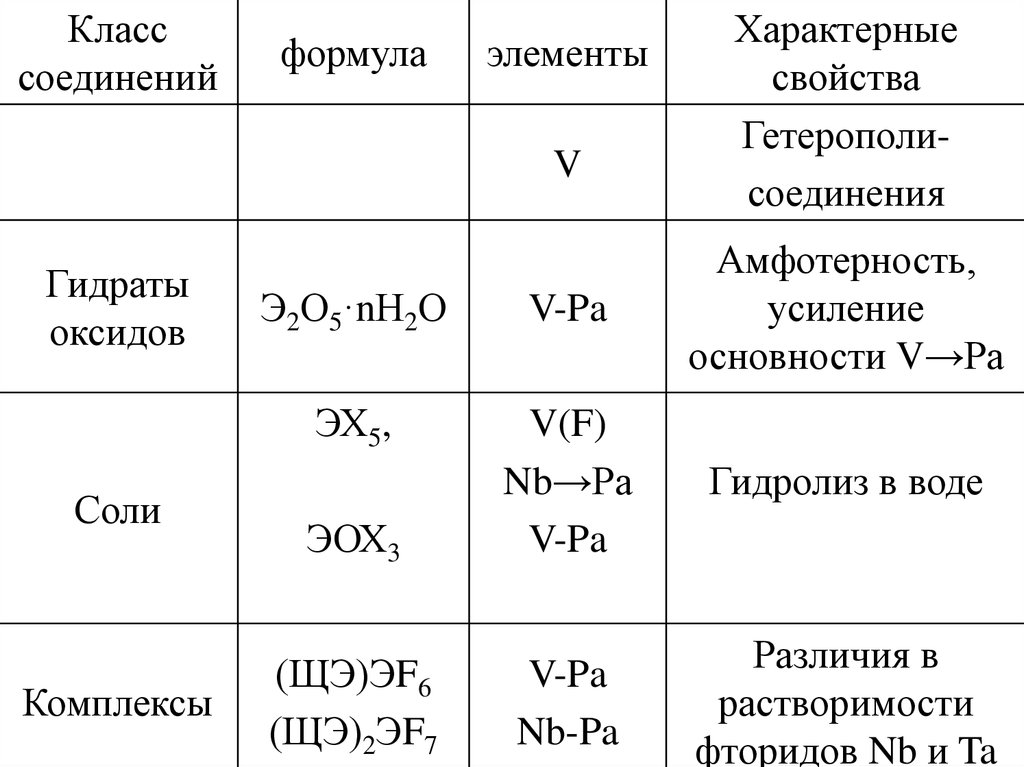
30.
Класссоединений
формула
элементы
V
Гидраты
оксидов
Соли
Комплексы
Характерные
свойства
Гетерополисоединения
Э2О5·nН2О
V-Pa
Амфотерность,
усиление
основности V→Pa
ЭХ5,
Гидролиз в воде
ЭОХ3
V(F)
Nb→Pа
V-Pa
(ЩЭ)ЭF6
(ЩЭ)2ЭF7
V-Pa
Nb-Pa
Различия в
растворимости
фторидов Nb и Ta
31. Степени окисления и стереохимия
32. Степени окисления и стереохимия
33.
• V – 0.02% (22 место), сопутствуетFe (Fe3+ - 0.67 Å, V3+ - 0.65 Å)
Mn (V2+ - 1.0 Å, Mn2+ - 0.91 Å)
7·10 т/год
P (V5+ - 0.40 Å, P5+ - 0.37 Å)
Из шлаков, Спицын В.И., танки Т-34
2V2O5 + 5Si = 5SiO2 + 4V
(феррованадий)
• Nb~ 10-4% (64 место)
1,5·10 т/год
колумбит(Fe, Mn)(NbO3)2
3
3
34.
•Ta~ 10-5 % (65 место)танталит(Fe, Mn)(TaO3)2
Лопарит (Хибины) (Ca, Sr, Ce, Na, K)[(Nb, Ta,
Ti)O3]
Хлорирование в присутствии углерода
летучие хлориды
нелетучие хлориды
Ti, Nb, Ta
РЗЭ, ЩЗЭ, ЩЭ
Фракционная разгонка
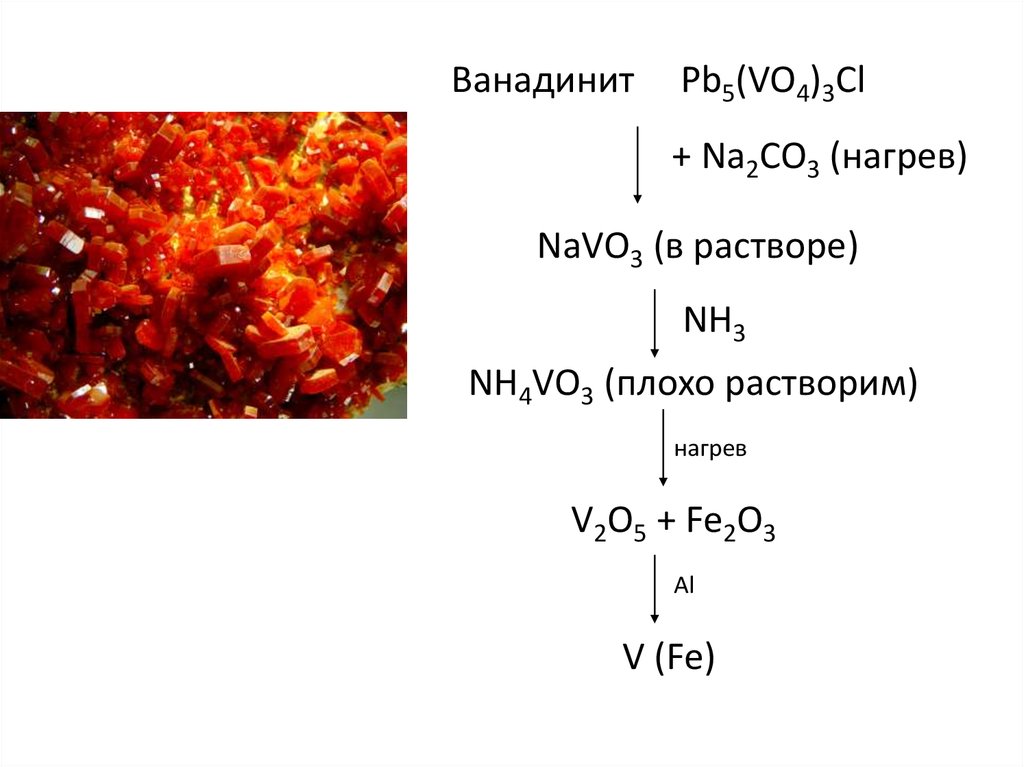
35.
ВанадинитPb5(VO4)3Cl
+ Na2CO3 (нагрев)
NaVO3 (в растворе)
NH3
NH4VO3 (плохо растворим)
нагрев
V2O5 + Fe2O3
Al
V (Fe)
36.
При выплавке стали V переходит в шлаки вформе FeV2O4 (структура шпинели)
Далее обжигают смесь
2 FeV2O4 + 8NaCl +
800ºC
7O2
8NaVO3 + 2Fe2O3 + 4Cl2↑
2 FeV2O4 + 9Cl2 = 4VOCl3 + 2FeCl3 + 2O2↑
2VOCl3 + 3H2O = V2O5↓ + 6HCl
V2O5 + 5Ca = 2V + 5CaO
(восстановление инициируют йодом)
37.
VNb
Ta
Pa
TплºC
1920
2500
2996
1570
TкипºC
3400
4930
~5500
4500
ОЦК
ОЦК
ОЦК
< 1170
+194
+221
структура
ОЦК
TплºC ЭCl5 -20 (VCl4)
TплºCЭС
2830
3500
3900
D, г/см3
6,1
8,6
16,6
15,4
38.
• Высокаяхимическая
инертность
V,
особенно Nb и Ta
• V
–
растворяется
только
в
концентрированных HNO3, H2SO4, царской
водке
при
высоких
температурах
взаимодействие с O2, N2, S, Si – раскислитель
• Nb и Ta – высокая коррозийная стойкость,
только HF или HF + HNO3, инертность к
щелочам, металлотермия в Ta тиглях,
химическая аппаратура, геттеры
VI4↔ V + 2I2
K2TaF4 + 5Na = 2KF + 7NaF + Ta
39.
t5
2V O2
V2O5
2
V2O5( р в ) VO2 VO3
V2O5 2VO2 1 O2
2
V(5) → V(4)
VnO2n+1,
Катализ: SO2 → SO3,
нафталин → фталевый ангидрид
40. Оксиды ванадия
V2O5 – структура из тригональных бипирамид· · ·VnO2n+1 (V3O7, V4O9, V6O13) · · ·
VO2 – рутил (искаженный/неискаженный)
· · ·VnO2n-1 (V4O7, V5O9, V6O11, V7O13, V8O15) · · ·
V2O3 – структура корунда
· · · VO1.35 · · ·
VO – структура NaCl
· · · VO0.8
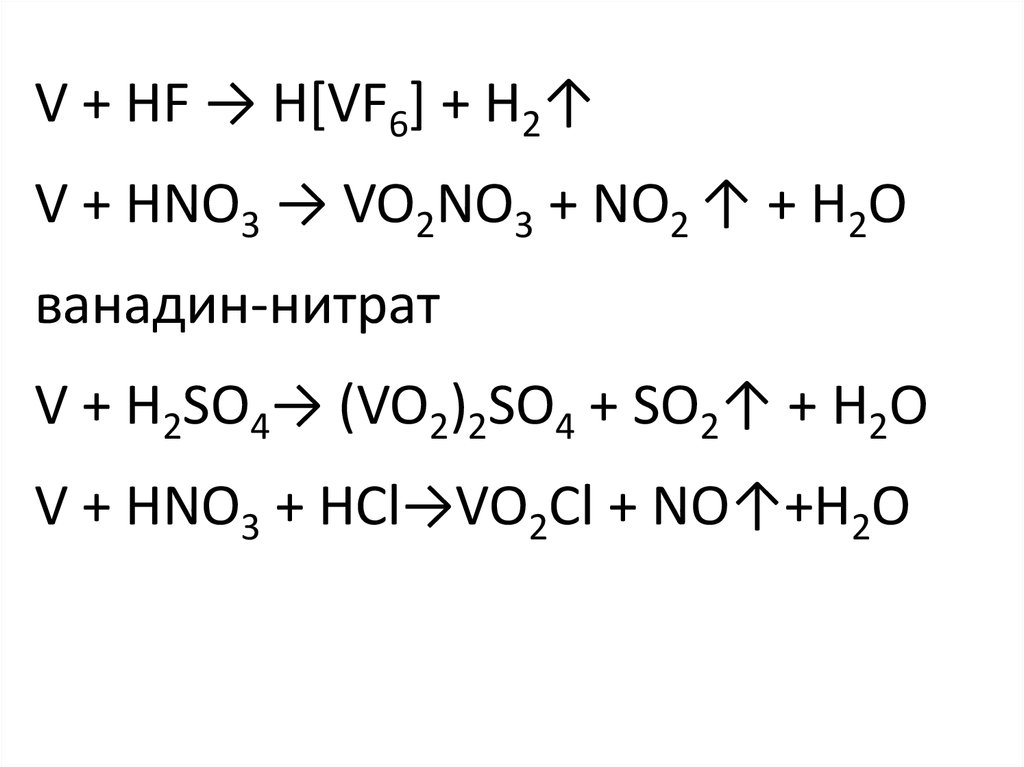
41.
V + HF → H[VF6] + H2↑V + HNO3 → VO2NO3 + NO2 ↑ + H2O
ванадин-нитрат
V + H2SO4→ (VO2)2SO4 + SO2↑ + H2O
V + HNO3 + HCl→VO2Cl + NO↑+H2O
42.
Э + HF → H[ЭF6] + H2↑, Э = Nb, TaЭ + HNO3 + HF→H2[ЭF7] +NO2↑+H2O
Э + O2 + KOH → K3ЭO4 + H2O
Э = V, Nb, Ta
43.
V2O5 + Na2CO3 → 2NaVO3 + 2H2O+
V2O5 + H2SO4→ HVO3 + VO2 HSO4
OH
+
OH
HVO
+
H
3
H+
VO3
VO2
метаванадат- ион
V2O5 + NH3→ VO2 + N2 + H2O
V2O5 + 6HClконц→ 2VOCl2 + Cl2 + 3H2O
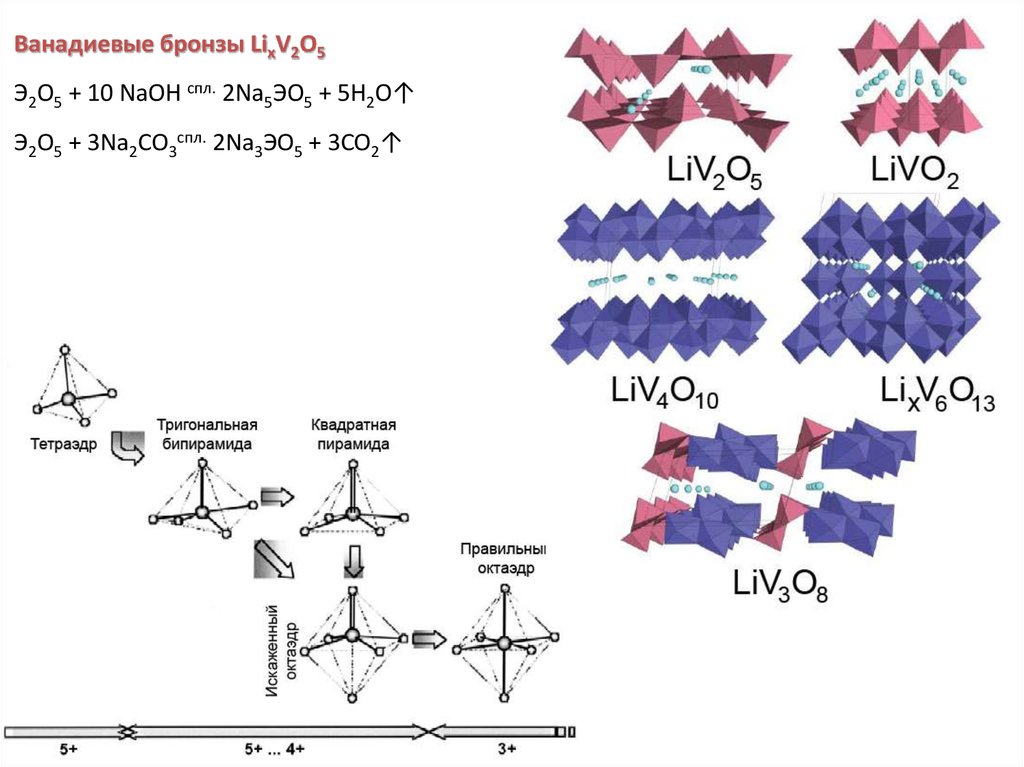
44.
Ванадиевые бронзы LixV2O5Э2O5 + 10 NaOH спл. 2Na5ЭO5 + 5H2O↑
Э2O5 + 3Na2CO3спл. 2Na3ЭO5 + 3CO2↑
45.
Катионные и анионные формы V5+в водномрастворе
• В сильнощелочной среде VO433-
• Аналогия VO4 и
2-tº
n• HPO4 (PO3)n в
22HVO4
= H2O +
3РO4 ,
тетраэдр sp3
жестких условиях
4V2O7 при
слабых кислотах
46.
• Изополисоединения23HVO4
(б/цв)+
3H+ =
3V3O9 (ж)+
Дальнейшее подкисление дает
4V4O12 ,
6V10O28 ,
V2O5
3H2O
47. Изополиванадаты
48. Закономерности (по мере уменьшения pH)
• Повышение КЧ от 4 до 6• Усиление окраски
• Усиление способности к полимеризации
• Усиление кислотных свойств
49. Пероксидные соединения
• V2O5 + 4H2O2 + 6NaOH = 2Na3VO6 + 3H2Oпероксоанион
фиолетовый (pH > 12), желтая (pH = 7-9)
• 2NaVO3 + 2H2O2 + 2H2SO4 = (VO3)2SO4 + Na2SO4 +
4H2O
пероксокатион
красно-коричневый (рН < 7)
50.
→V(V)
желтокрасный
V(IV)
синий
→
V(III)
→
зеленый
V(II)
фиолетовый
Na3VO4 H 2 SO4 Zn V синий
OSO4
IV
желтый
V
III
2
( SO4 ) 3 V SO4
зеленый
II
фиолетовый
VSO4·7H2O – ванадиевый купорос
51.
52.
• Nb (Ta) + O2tº
Nb2(Ta2)O5
• Э2O5 – химически инертны, не реагируют с
H2O, водными растворами кислот и оснований
• Nb2O5 + 10 NaOH спл.2Na5NbO5 + 5H2O↑
• Nb2O5 + 3Na2CO3спл.2Na3NbO5 + 3CO2↑
53. Галогениды ванадия
V5+образует только фторидV4+образует все галогениды, кроме йодида
Для V3+и V2+известны все галогениды
54. Ванадий (V) в растворах
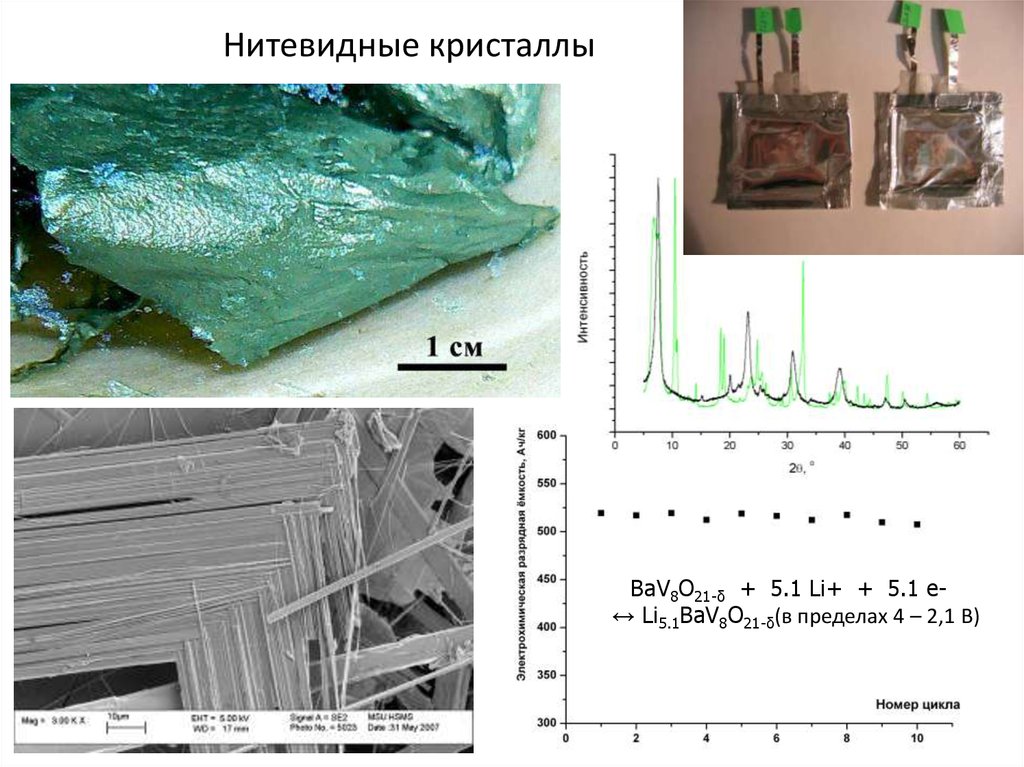
55. Нитевидные кристаллы
BaV8O21-δ + 5.1 Li+ + 5.1 e↔ Li5.1BaV8O21-δ(в пределах 4 – 2,1 В)55
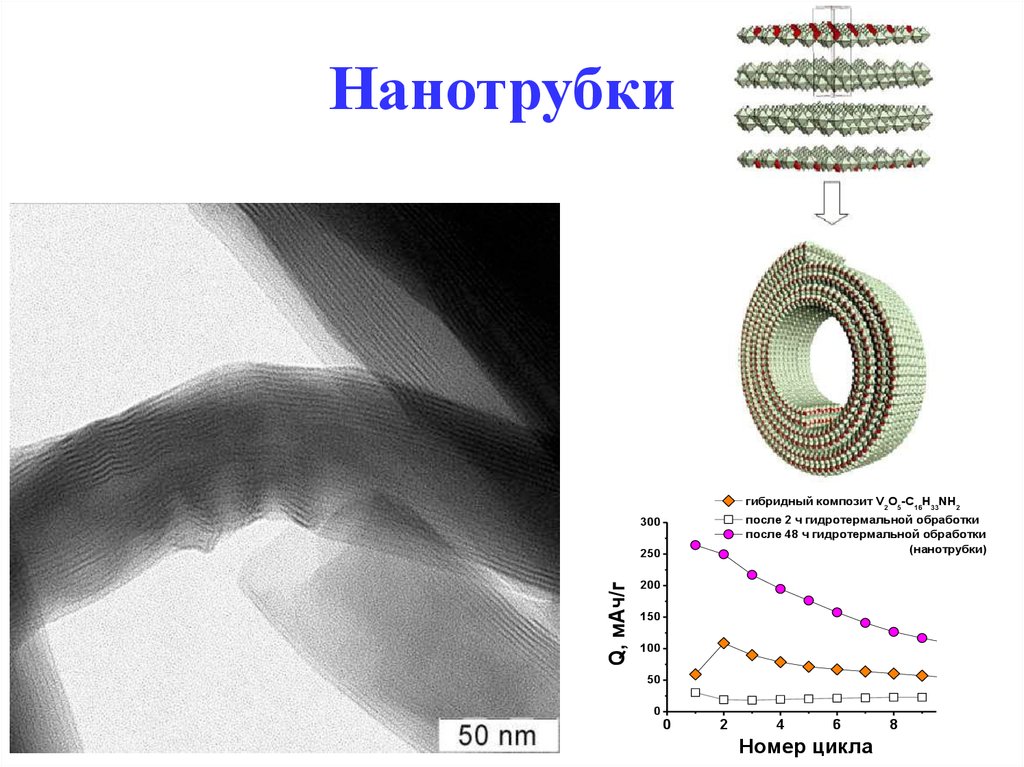
56. Нанотрубки
гибридный композит V2O5-С16Н33NH2после 2 ч гидротермальной обработки
после 48 ч гидротермальной обработки
(нанотрубки)
300
Q, мАч/г
250
200
150
100
50
0
0
2
4
6
Номер цикла
8
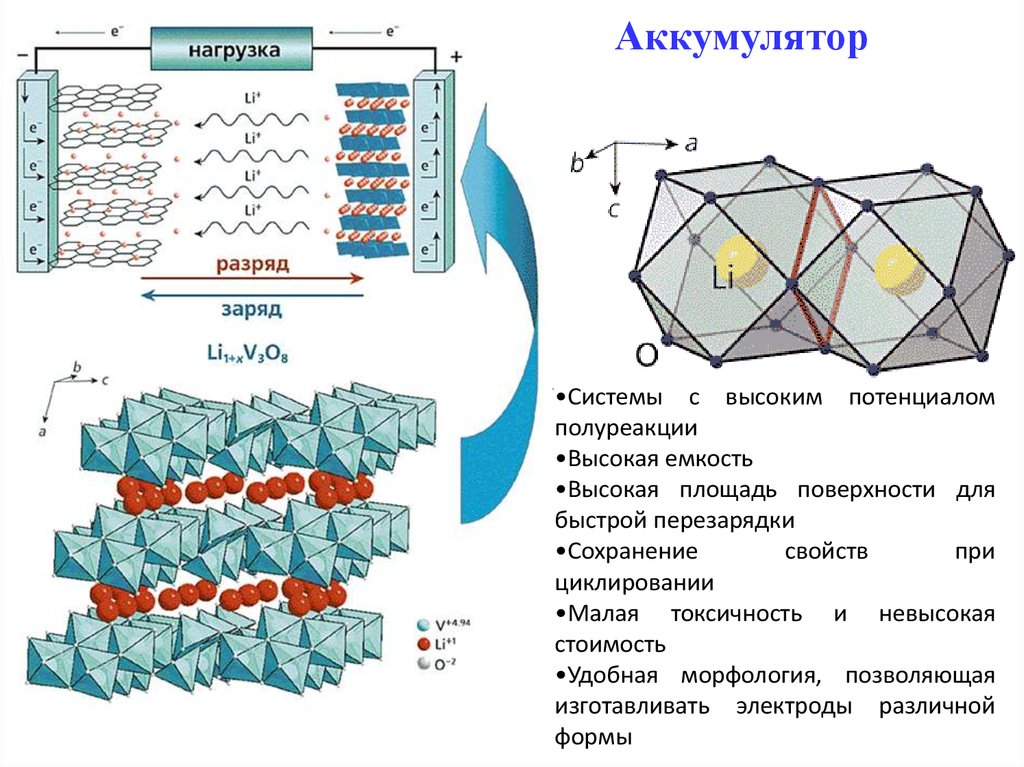
57. Аккумулятор
•Системы с высоким потенциаломполуреакции
•Высокая емкость
•Высокая площадь поверхности для
быстрой перезарядки
•Сохранение
свойств
при
циклировании
•Малая токсичность и невысокая
стоимость
•Удобная морфология, позволяющая
изготавливать электроды различной
формы
58. Заключение
1. Максимальная степень окисления V, Nb, Ta +5, однако втаких соединениях велик вклад ковалентной связи
2. Для ванадия характерно образование оксо-анионов и
изополикислот
3. Химическая активность элементов в форме металлов низка,
оксиды Nb2O5 и Ta2O5 инертны
4. Nb и Ta – элементы – близнецы, для V характерны
окислительно-восстановительные
реакции
и
слабо
выраженные кислотные свойства высшего оксида
5. Использование V, Nb, Ta – металлургия, V – катализ и
химические источники тока
6. Биологическая роль V – фиксация азота растениями, для
человека соединения ванадия токсичны.













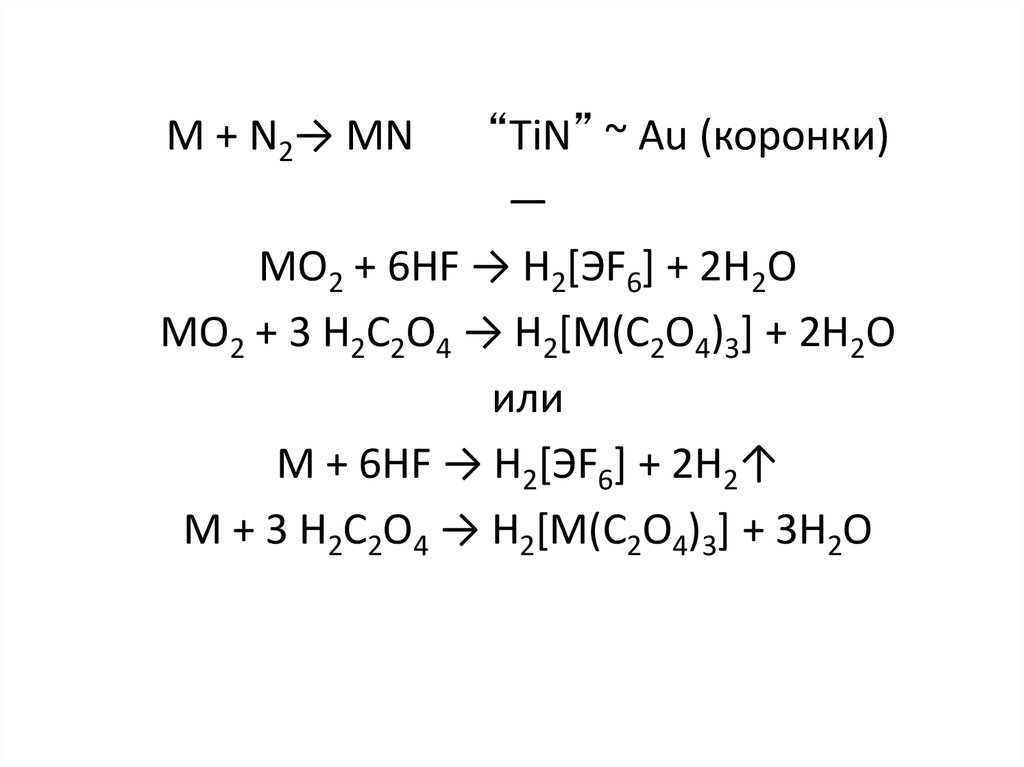




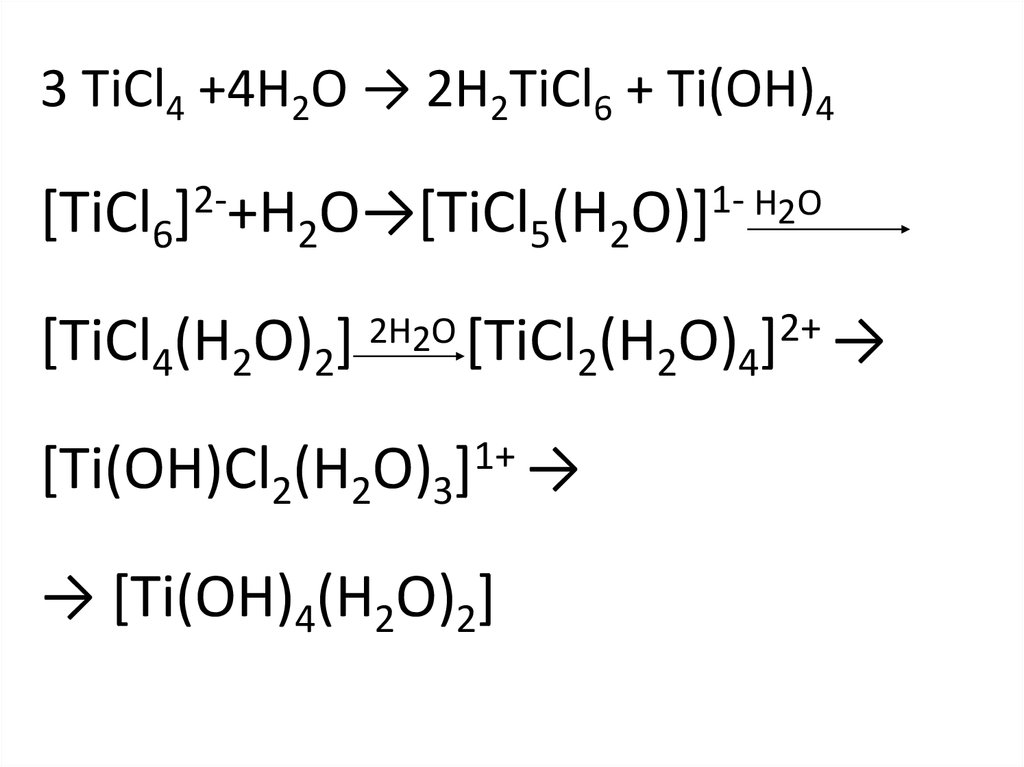






























 chemistry
chemistry








