Similar presentations:
Биополимеры. Классификация полисахаридов (гликаны)
1.
Кафедра общей и медицинской химииЛекция 6-II
Биополимеры
1
2.
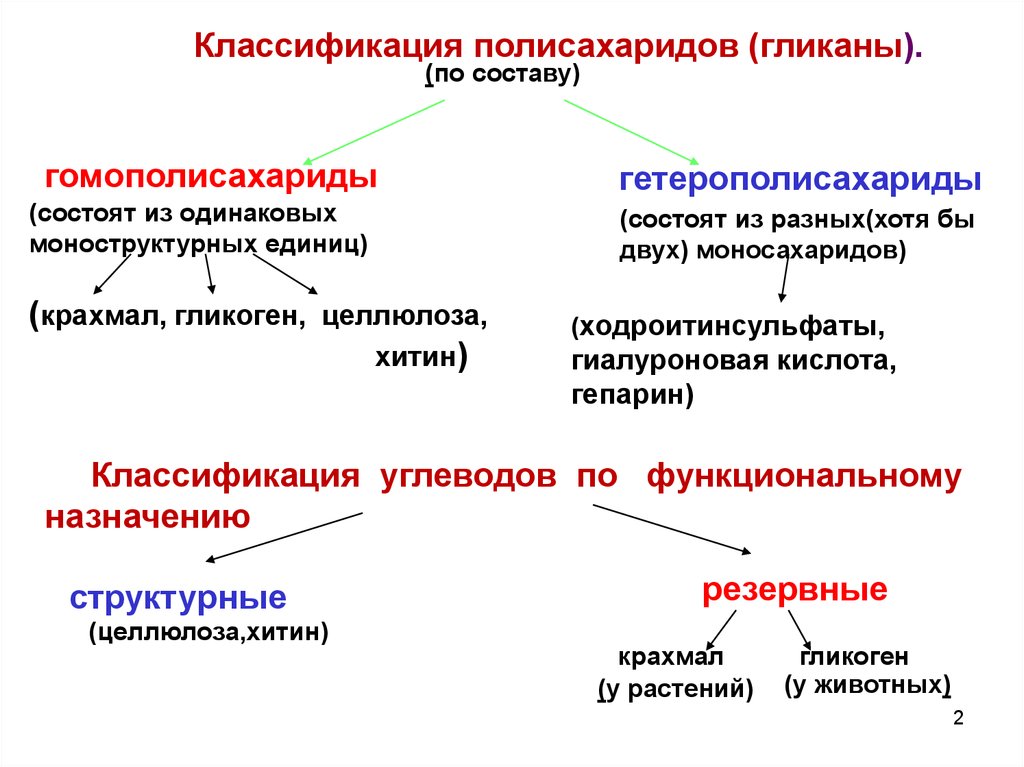
Классификация полисахаридов (гликаны).(по составу)
гомополисахариды
(состоят из одинаковых
моноструктурных единиц)
(крахмал, гликоген, целлюлоза,
хитин)
гетерополисахариды
(состоят из разных(хотя бы
двух) моносахаридов)
(ходроитинсульфаты,
гиалуроновая кислота,
гепарин)
Классификация углеводов по функциональному
назначению
структурные
(целлюлоза,хитин)
резервные
крахмал
(у растений)
гликоген
(у животных)
2
3.
Крахмал:Крахмал: Мм – 106
- 107,
(С6Н10О5)n
состоит из
моносахаридных звеньев -D-- глюкопиранозы. Включает 2
фракции: амилоза (линейная 10 – 20 %) и разветвленная –
амилопектин (80-90%).
Образуется в результате фотосинтеза в растениях и
накапливается в клубнях, семенах, корнях
3
4.
Крахмал:В горячей воде набухает и подвергается гидролизу, в результате
образуются более мелкие полисахариды, конечным продуктом
является глюкоза.
(С6Н10О5)n
гидролиз
декстрины
олигосахариды
(С6Н10О5)m
m<n
Мальтоза
глю.
В пищеварительном тракте (основная цепь) происходит
гидролиз крахмала – ферментативный и расщепляются (1
4)
и (1
6) связи. Конечный продукт
мальтоза
и
глюкоза.
4
5.
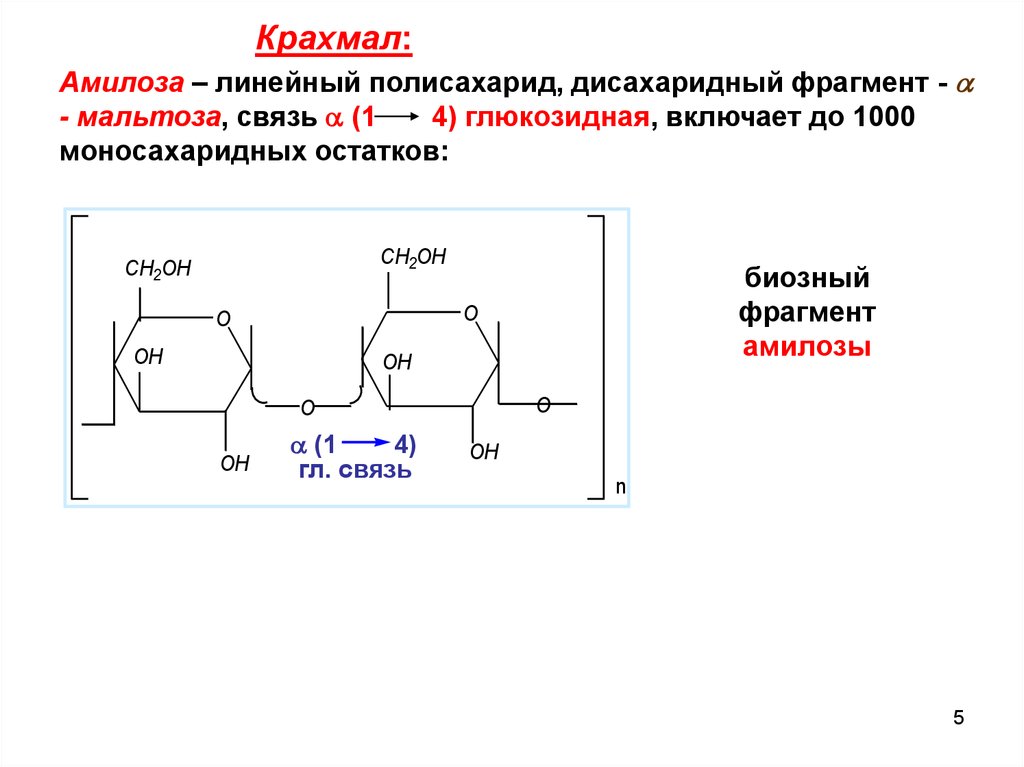
Крахмал:Амилоза – линейный полисахарид, дисахаридный фрагмент -
- мальтоза, связь (1
4) глюкозидная, включает до 1000
моносахаридных остатков:
CH2OH
CH2OH
биозный
фрагмент
амилозы
O
O
OH
OH
O
O
OH
(1
4)
гл. связь
OH
n
5
6.
Крахмал:Неразветвленная макромолекула свернута в спираль, на
каждый виток приходится 6 моносахаридных звеньев. Внутри
спирали могут проходить молекулы, если их размеры
позволяют, и образуются соединения включения, так,
качественная реакция на I2 - образование адсорбционного
комплекса синего цвета (соединения включения).
Амилоза
6
7.
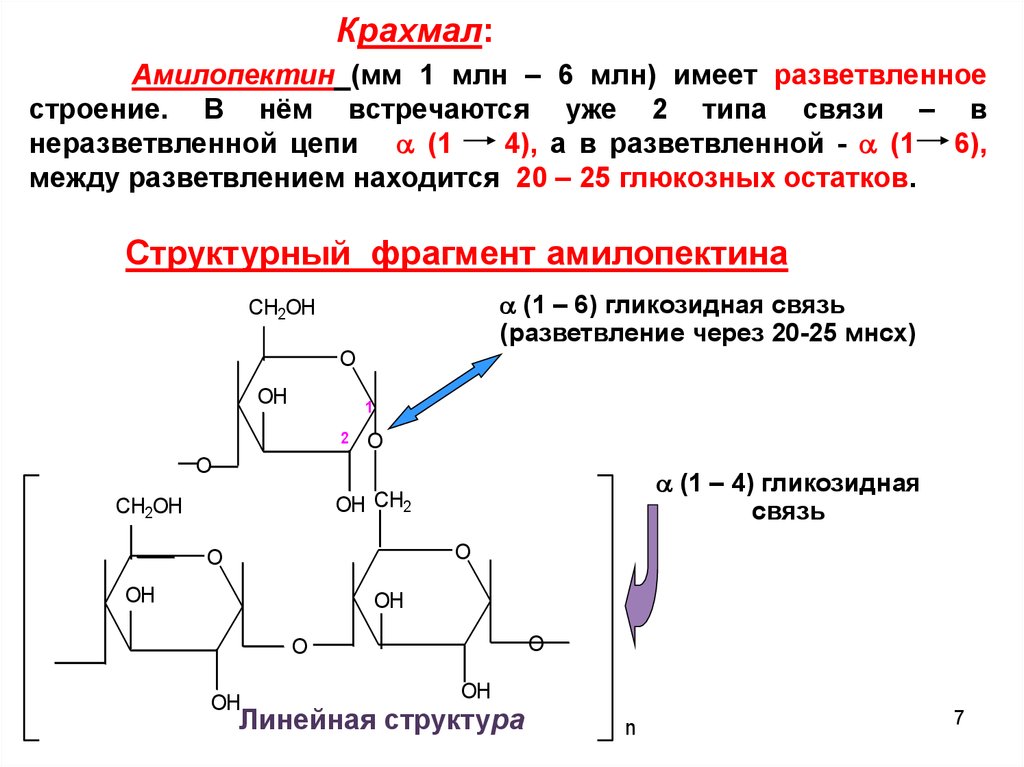
Крахмал:Амилопектин (мм 1 млн – 6 млн) имеет разветвленное
строение. В нём встречаются уже 2 типа связи – в
неразветвленной цепи (1
4), а в разветвленной - (1 6),
между разветвлением находится 20 – 25 глюкозных остатков.
Структурный фрагмент амилопектина
(1 – 6) гликозидная связь
(разветвление через 20-25 мнсх)
CH2OH
O
OH
1
2
O
O
(1 – 4) гликозидная
связь
OH CH2
CH2OH
O
O
OH
OH
O
O
OH
OH
Линейная структура
n
7
8.
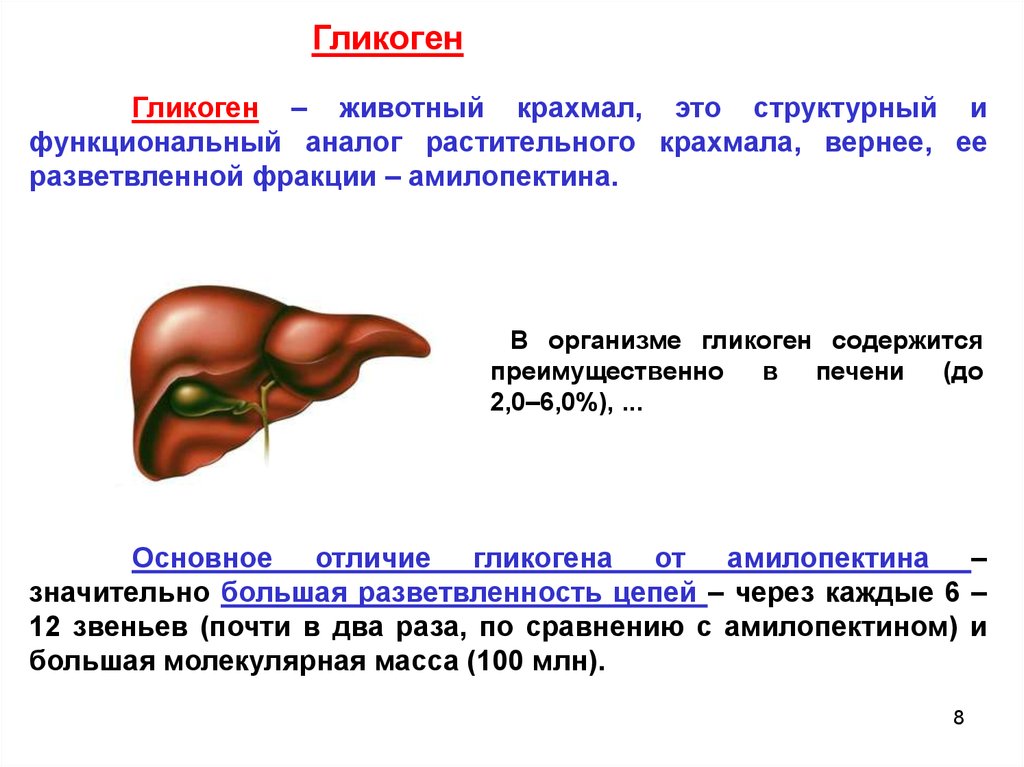
ГликогенГликоген – животный крахмал, это структурный и
функциональный аналог растительного крахмала, вернее, ее
разветвленной фракции – амилопектина.
В организме гликоген содержится
преимущественно в печени (до
2,0‒6,0%), ...
Основное отличие гликогена от амилопектина –
значительно большая разветвленность цепей – через каждые 6 –
12 звеньев (почти в два раза, по сравнению с амилопектином) и
большая молекулярная масса (100 млн).
8
9.
ГликогенСильное
разветвление
обеспечивает
гликогену
выполнение энергетической функции, позволяя в стрессовых
ситуациях быстро отщеплять нужное количество глюкозы по
многочисленным разветвлениям.
А глюкоза-основной источник энергии для организма
Большая молекулярная масса помогает выполнить
функцию резервного углевода. Он из-за больших размеров не
может проникать через клеточную мембрану и депонирован в
клетках, пока не возникает потребность в энергии.
!
9
10.
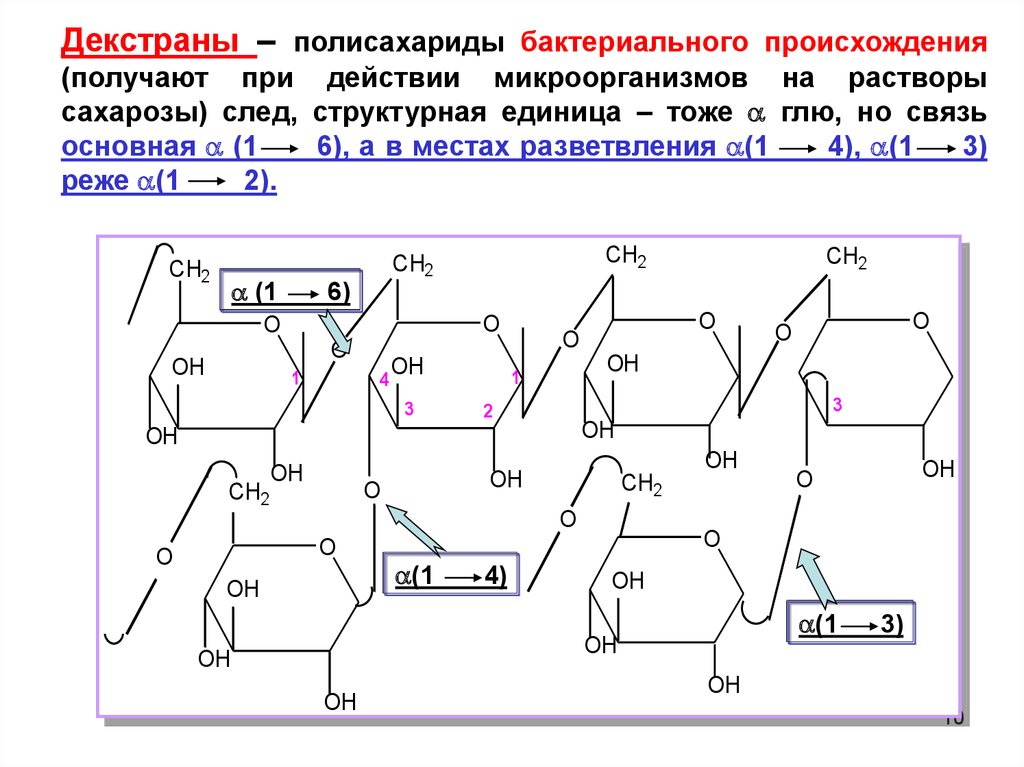
Декстраны – полисахариды бактериального происхождения(получают при действии микроорганизмов на растворы
сахарозы) след, структурная единица – тоже глю, но связь
основная (1
6), а в местах разветвления (1
4), (1
3)
реже (1
2).
CH2
(1
O
O
1
4
OH
3
O
1
OH
OH
CH2
O
OH
(1
4)
OH
OH
OH
O
O
OH
(1
OH
OH
O
O
OH
OH
O
O
O
O
3
2
OH
CH2
CH2
6)
O
OH
CH2
CH2
3)
OH
10
11.
Декстраны используются как заменители крови. Но так какбольшая Мм мешает их растворимости, с помощью кислотного
гидролиза или ультразвука ее понижают и получают препарат
полиглюкин. Декстраны обладают антигенными свойствами.
11
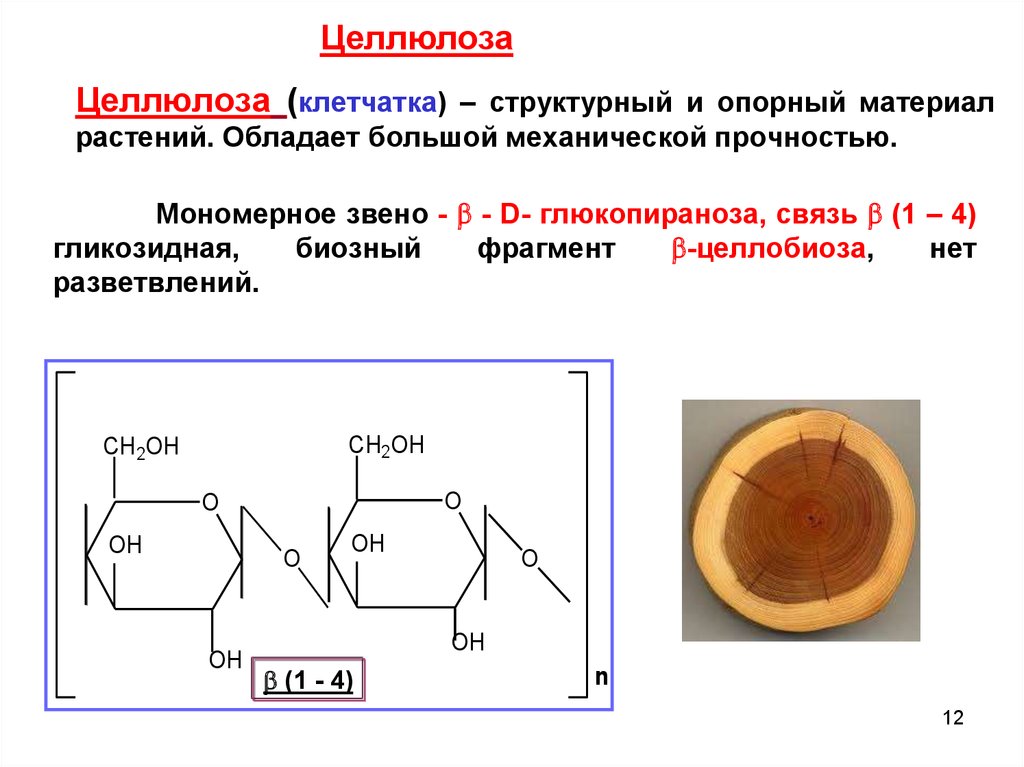
12. Мономерное звено - - D- глюкопираноза, связь (1 – 4) гликозидная, биозный фрагмент -целлобиоза, нет разветвлений.
ЦеллюлозаЦеллюлоза (клетчатка) – структурный и опорный материал
растений. Обладает большой механической прочностью.
Мономерное звено - - D- глюкопираноза, связь (1 – 4)
гликозидная,
биозный
фрагмент
-целлобиоза,
нет
разветвлений.
CH2OH
CH2OH
O
O
OH
O
OH
OH
O
OH
(1 - 4)
n
12
13.
ЦеллюлозаВ макромолекуле содержится (2500 – 12 тыс. )
глюкозных звеньев. Мм достигает 1 – 2 млн.
Линейное строение обусловлено конфигурацией ОН –
полуацетального. Кроме того, этому способствует образование
водородных связей внутри цепи и между цепями. Такая упаковка
цепей обеспечивает механическую прочность, волокнистость,
нерастворимость в воде, химическую инертность.
13
14.
ЦеллюлозаЦеллюлоза не расщепляется
ферментом, желудочнокишечного тракта (нет
глюкозидазы), но есть
необходимые вещества,
активизирующие
перистальтику желудка и
кишечника.
14
15.
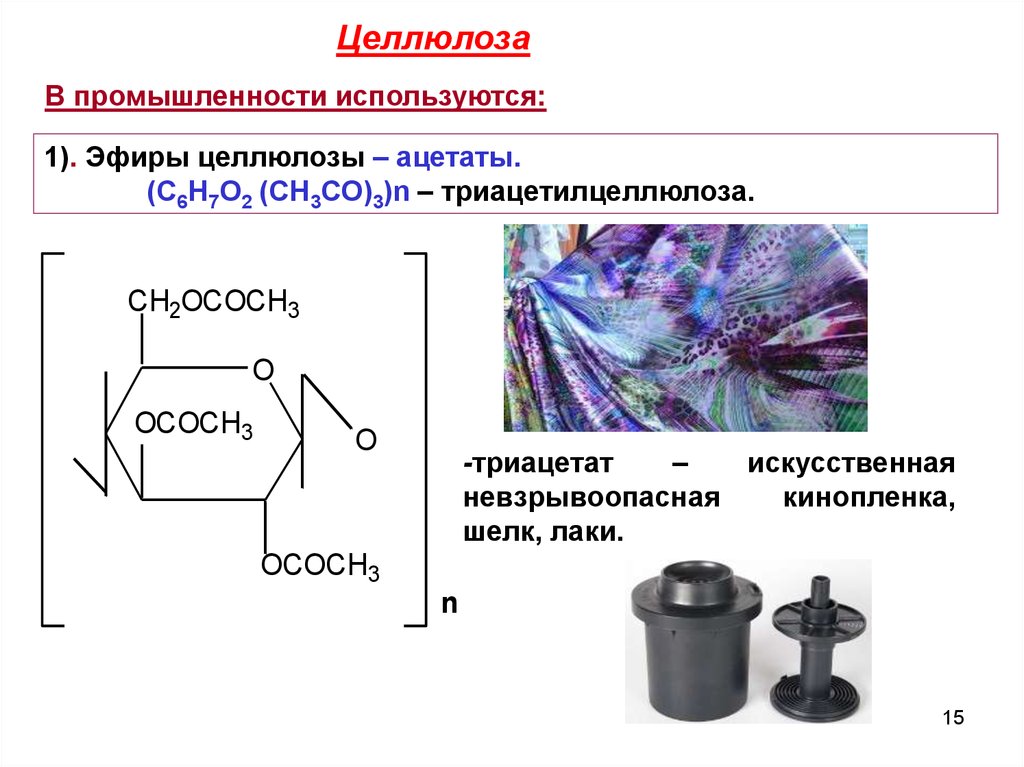
ЦеллюлозаВ промышленности используются:
1). Эфиры целлюлозы – ацетаты.
(С6Н7О2 (СН3СО)3)n – триацетилцеллюлоза.
CH2OCOCH3
O
OCOCH3
O
OCOCH3
-триацетат
–
искусственная
невзрывоопасная
кинопленка,
шелк, лаки.
n
15
16.
CH2OC 2H5O
2). Этиловый
эфир(С6Н7О2(ОС2Н5)3)n
OC 2H5
O
OC 2H5
CH2ONO 2
O
3). Нитрат целлюлозы (ди – и три -)
ONO 2
O
тринитрат –пироксилен, взрывчатое
вещество, бездымный порох
ONO 2
n
16
17.
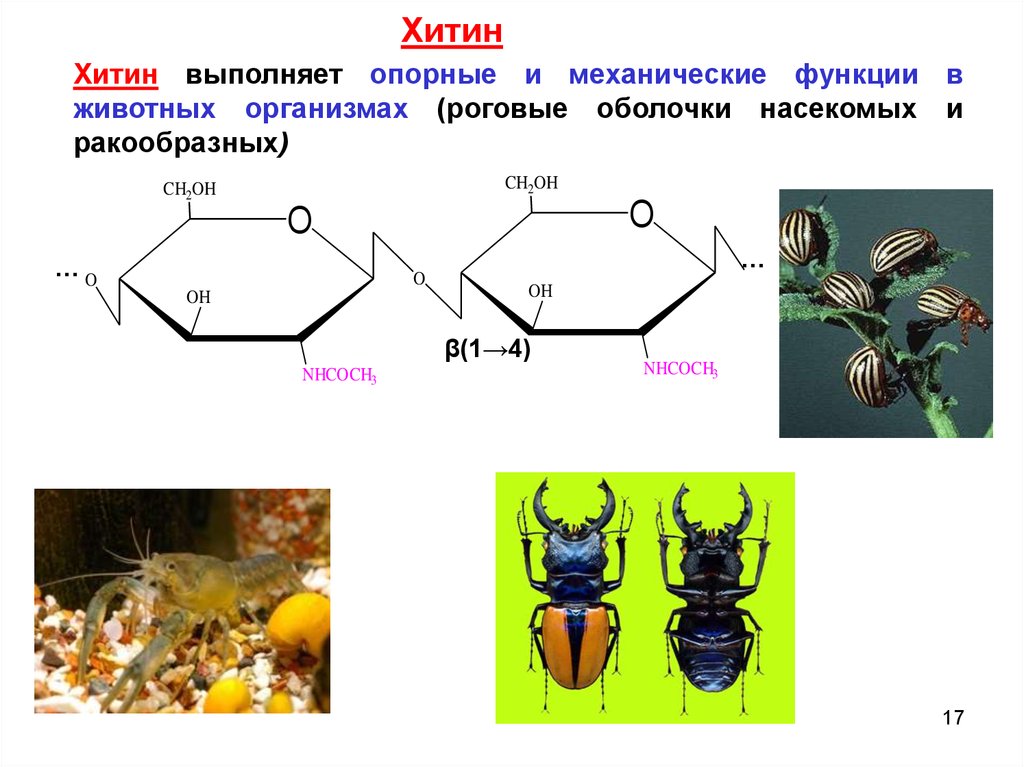
ХитинХитин выполняет опорные и механические функции в
животных организмах (роговые оболочки насекомых и
ракообразных)
CH2OH
CH2OH
O
O
…O
O
OH
…
OH
β(1→4)
NHCOCH3
NHCOCH3
17
18.
ГетерополисахаридыГетерополисахариды – состоят из остатков разных
моносахаридов. Изучены меньше, чем гомополисахариды. Очень
важны гетерополисахариды соединительной ткани, которая
распространена по всему организму: кожа, хрящи, сухожилия,
роговица, стенки крупных кровеносных сосудов, суставная
жидкость, кости.
рыхлая
плотная
соединительная ткань
хрящ,
кость,
Соединительная ткань обуславливает прочность и упругость
органов, эластичность, стойкость к проникновению молекул.
18
Гетерополисахариды связаны с белками.
19.
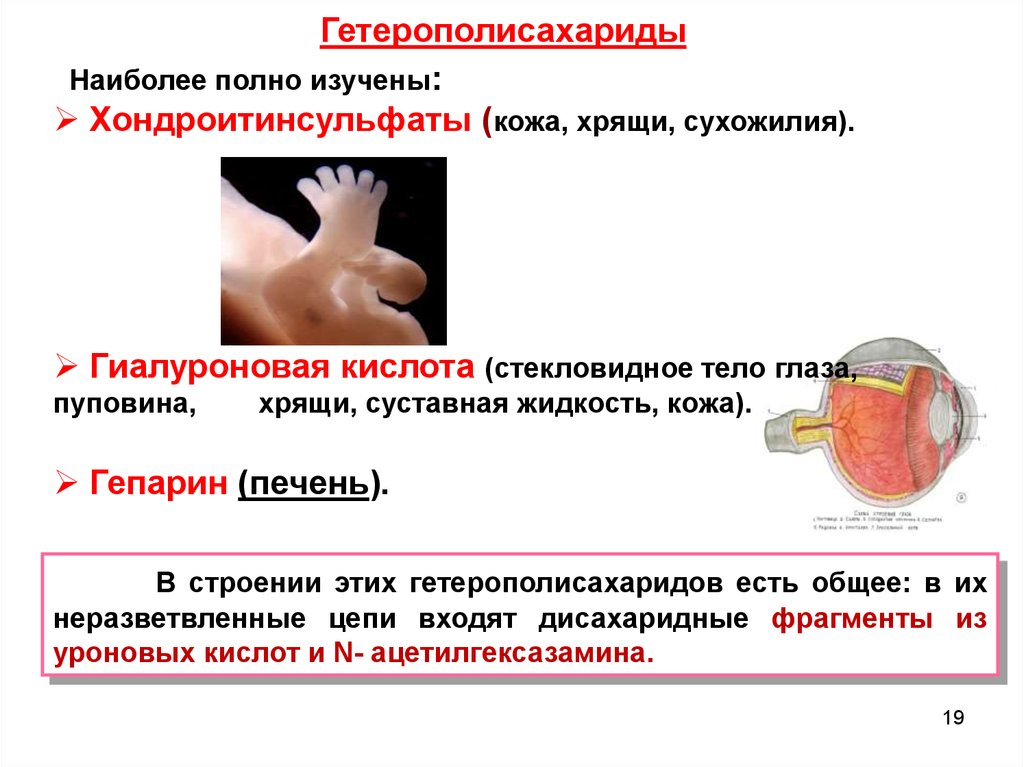
ГетерополисахаридыНаиболее полно изучены:
Хондроитинсульфаты (кожа, хрящи, сухожилия).
Гиалуроновая кислота (стекловидное тело глаза,
пуповина,
хрящи, суставная жидкость, кожа).
Гепарин (печень).
В строении этих гетерополисахаридов есть общее: в их
неразветвленные цепи входят дисахаридные фрагменты из
уроновых кислот и N- ацетилгексазамина.
19
20.
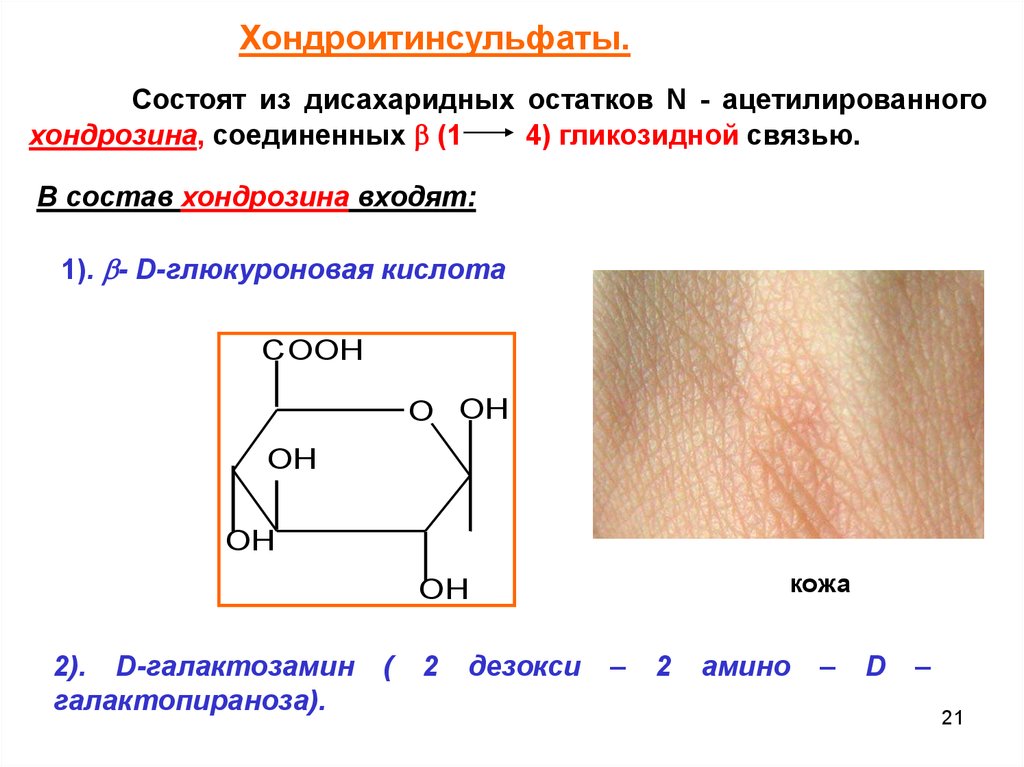
Хондроитинсульфаты.(кожа, хрящи, сухожилия).(Мм – 10 тыс. до 60 тыс.)
20
21.
Хондроитинсульфаты.Состоят из дисахаридных остатков N - ацетилированного
хондрозина, соединенных (1
4) гликозидной связью.
В состав хондрозина входят:
1). - D-глюкуроновая кислота
COOH
O OH
OH
OH
кожа
OH
2). D-галактозамин
галактопираноза).
(
2
дезокси
–
2
амино
–
D
–
21
22.
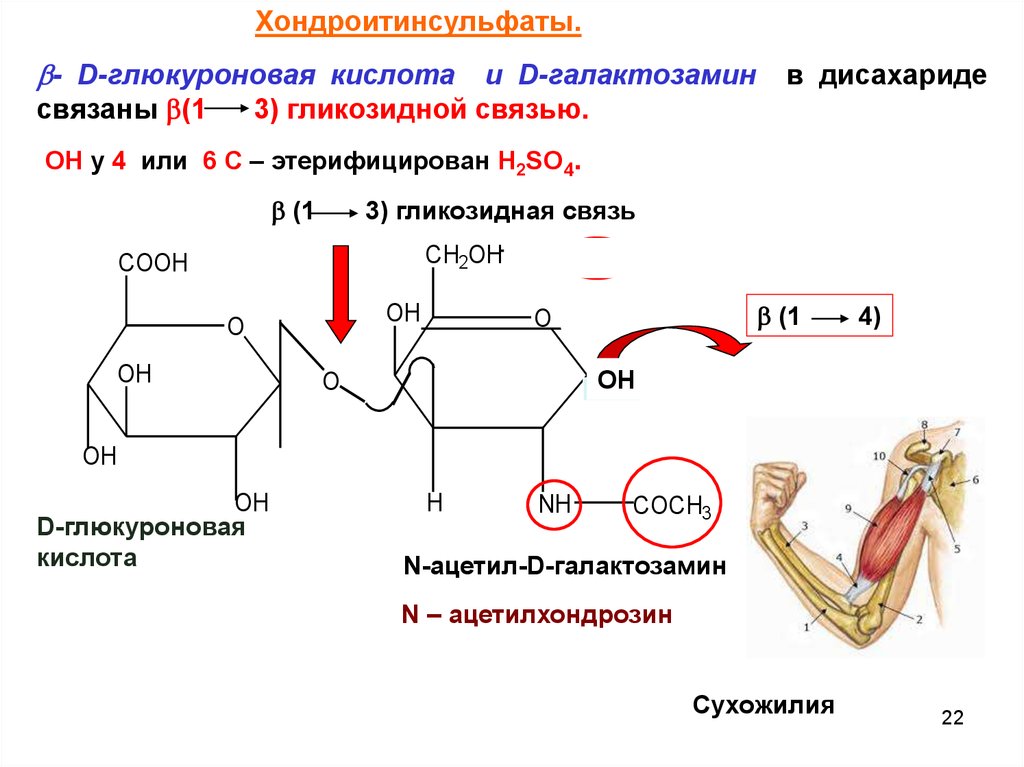
Хондроитинсульфаты.- D-глюкуроновая кислота
и D-галактозамин
3) гликозидной связью.
связаны (1
в дисахариде
ОН у 4 или 6 С – этерифицирован Н2SO4.
(1
3) гликозидная связь
CH2OH
COOH
OH
O
OH
CH2SO4
(1
O
4)
ОНOH
O
OH
OH
D-глюкуроновая
кислота
H
NH
COCH3
N-ацетил-D-галактозамин
N – ацетилхондрозин
Сухожилия
22
23.
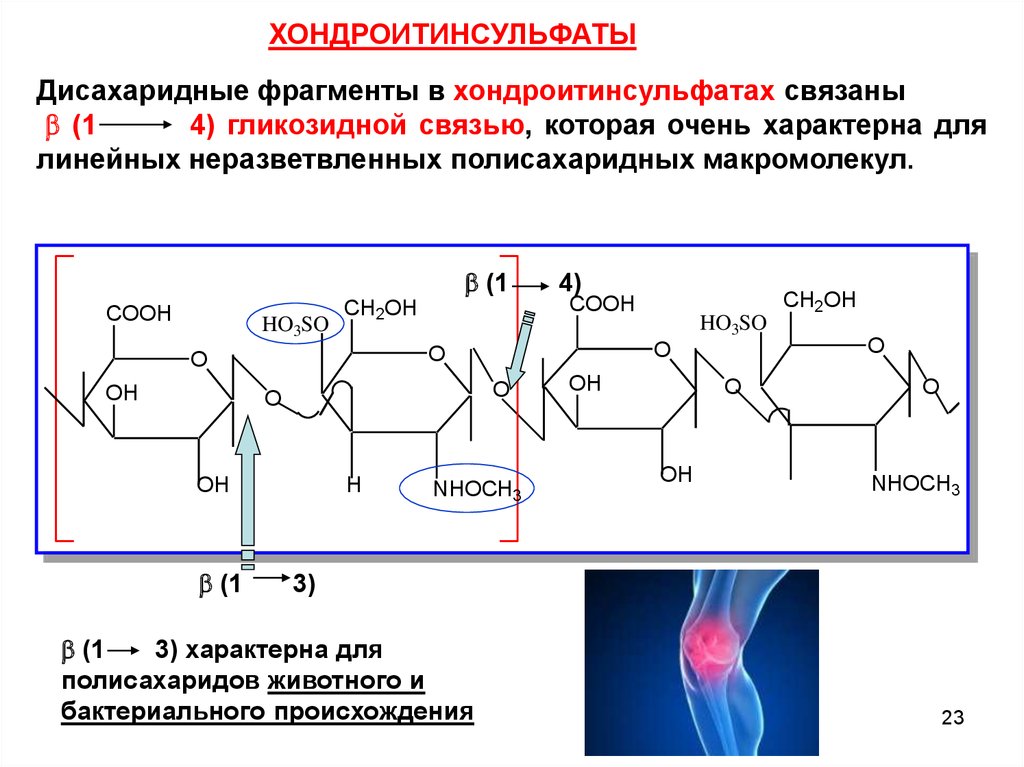
ХОНДРОИТИНСУЛЬФАТЫДисахаридные фрагменты в хондроитинсульфатах связаны
(1
4) гликозидной связью, которая очень характерна для
линейных неразветвленных полисахаридных макромолекул.
COOH
HO3SO
CH2OH
COOH
O
O
O
OH
(1
4)
O
O
OH
(1
H
NHOCH3
OH
HO3SO
O
OH
CH2OH
O
O
NHOCH3
3)
(1
3) характерна для
полисахаридов животного и
бактериального происхождения
23
24.
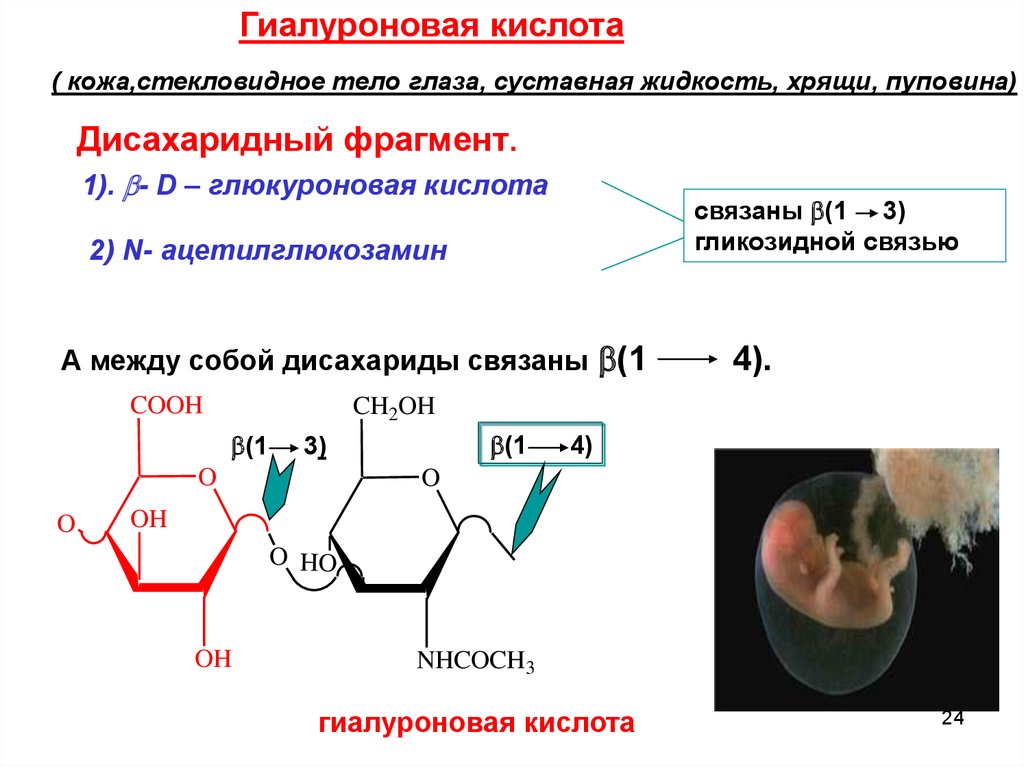
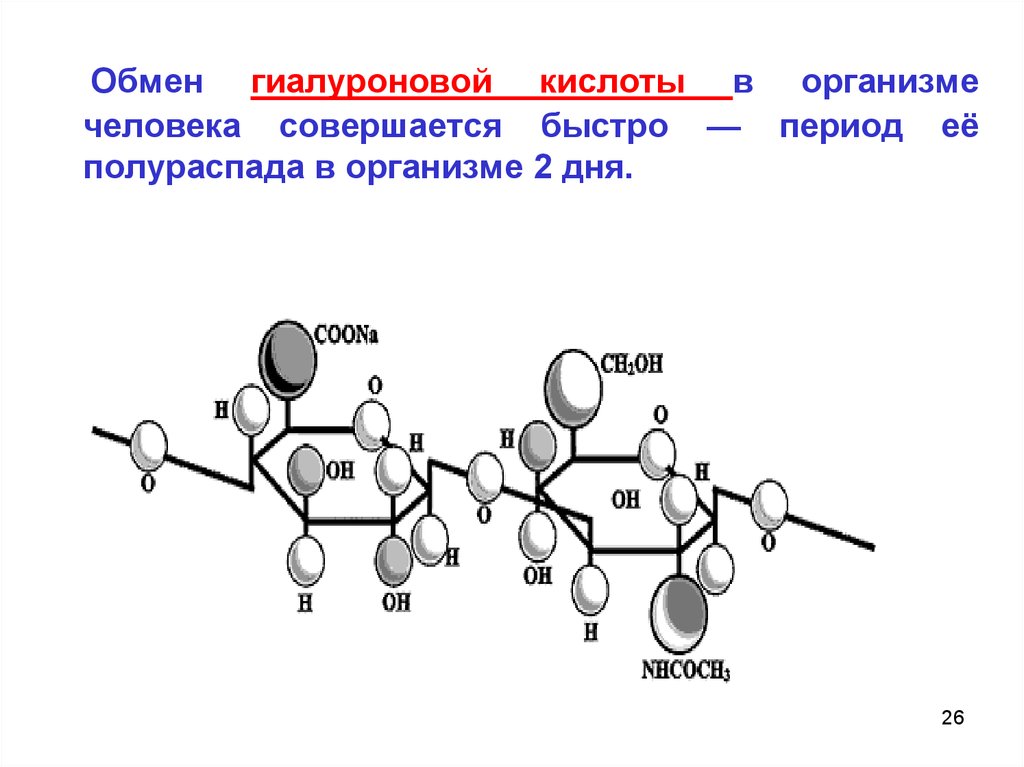
Гиалуроновая кислота( кожа,стекловидное тело глаза, суставная жидкость, хрящи, пуповина)
Дисахаридный фрагмент.
1). - D – глюкуроновая кислота
связаны (1 3)
гликозидной связью
2) N- ацетилглюкозамин
А между собой дисахариды связаны (1
COOH
CH2OH
(1
(1
3)
O
4)
O
OH
O
OH
OH
O
4).
NHCOCH3
гиалуроновая кислота
24
25.
Гиалуроновая кислотаОдним из основных факторов старения кожи является снижение
содержания гиалуроновой кислоты и тесно связанное с этим
уменьшение естественного запаса влаги в коже.
Широко используется косметологии для омоложения кожи
25
26.
Обмен гиалуроновой кислоты в организмечеловека совершается быстро — период её
полураспада в организме 2 дня.
26
27.
Гидролизгиалуроновой
кислоты
осуществляется
гиалуронидазой,
которая
присутствует
в
оболочках
болезнетворных бактерий, сперме, яде змей, пауков, пчёл,
слюнных выделениях пиявок, быстро растущих опухолях.
27
28.
Основу клеток и жидкостей животных организмов составляютсмешанные биополимеры
Смешанные биополимеры
С преобладанием
углеводной -пептидогликаны и
протеогликаны,
преобладанием
полипептидной части –
гликопротеины,
с преобладанием
липидной части
- гликолипиды.
- гликопротеин: короткие
- протеогликан: (регулярно
построенная неразветвленная п\с
цепь.
полисахаридные цепи
(олигосахариды) и почти всегда
разветвленные.
28
29.
Хондроитинсульфаты всвободном состоянии не
встречаются, они всегда
связаны с белками. На
конце цепи
хондроитинсульфата
имеется тетрасахаридный
фрагмент, посредством
которого осуществляется
связь с полипептидной
цепью
Тетрасахаридный мостик состоит
из D-глюкуроновой кислоты,
2х остатков D- галактопиранозы
и остатка D- ксилопиранозы.
29
30.
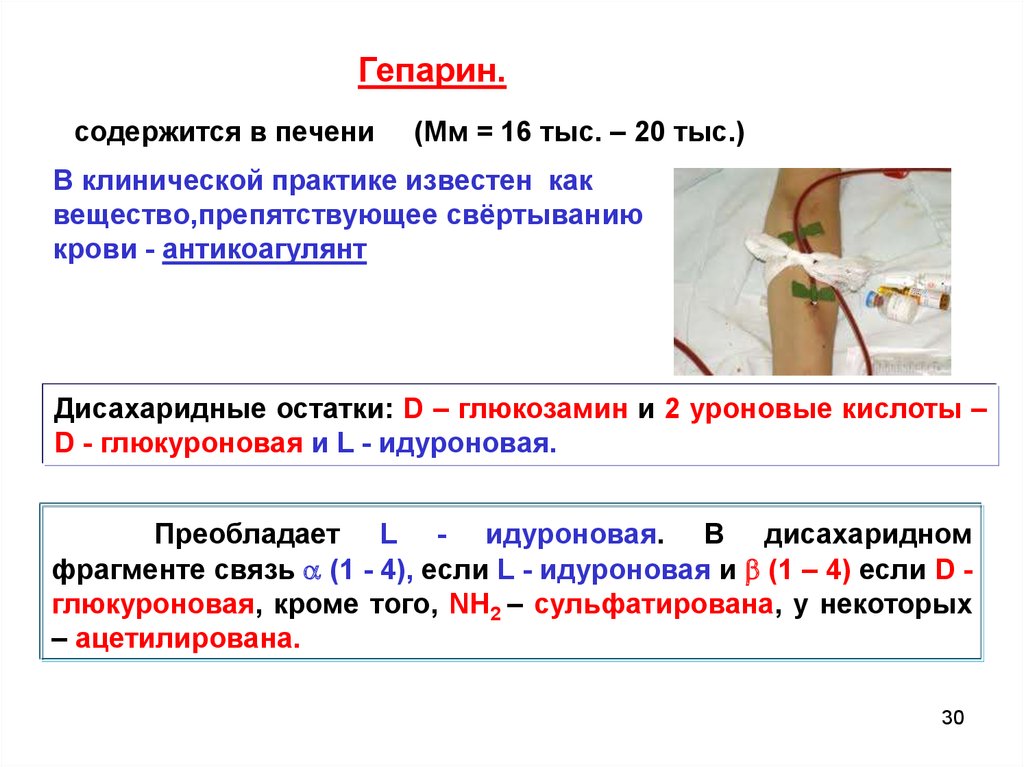
Гепарин.содержится в печени
(Мм = 16 тыс. – 20 тыс.)
В клинической практике известен как
вещество,препятствующее свёртыванию
крови - антикоагулянт
Дисахаридные остатки: D – глюкозамин и 2 уроновые кислоты –
D - глюкуроновая и L - идуроновая.
Преобладает L - идуроновая. В дисахаридном
фрагменте связь (1 - 4), если L - идуроновая и (1 – 4) если D глюкуроновая, кроме того, NH2 – сульфатирована, у некоторых
– ацетилирована.
30
31.
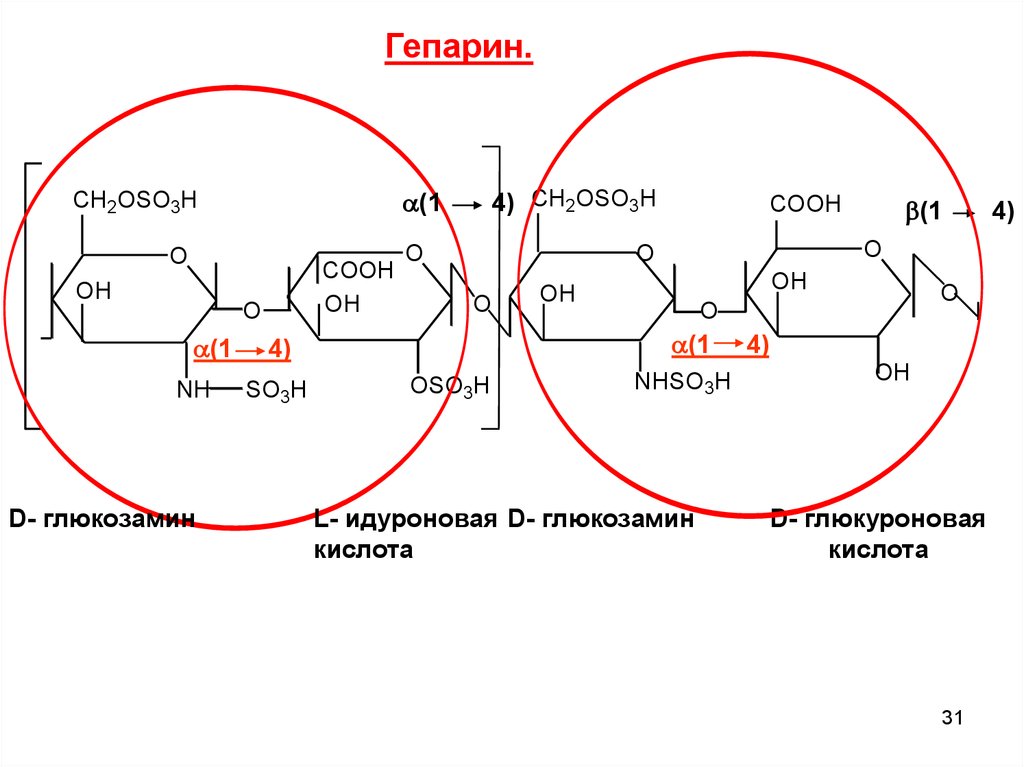
Гепарин.O
OH
COOH
OH
O
(1
NH
D- глюкозамин
4) CH2OSO3H
(1
CH2OSO3H
O
O
OH
OH
O
O
(1
OSO3H
(1
O
O
4)
SO3H
COOH
NHSO3H
L- идуроновая D- глюкозамин
кислота
4)
OH
D- глюкуроновая
кислота
31
4)
32. Биохимические свойства гепарина
Синтезируется в организме животных и человека.Антикоагулянтные свойства: препятствует свертываемости
крови.
Регулятор многих биохимических и физиологических
процессов, протекающих в животном организме.
Антилипемические свойства.
Антимитотическое влияния.
Является естественным противосвертывающим фактором.
32
33.
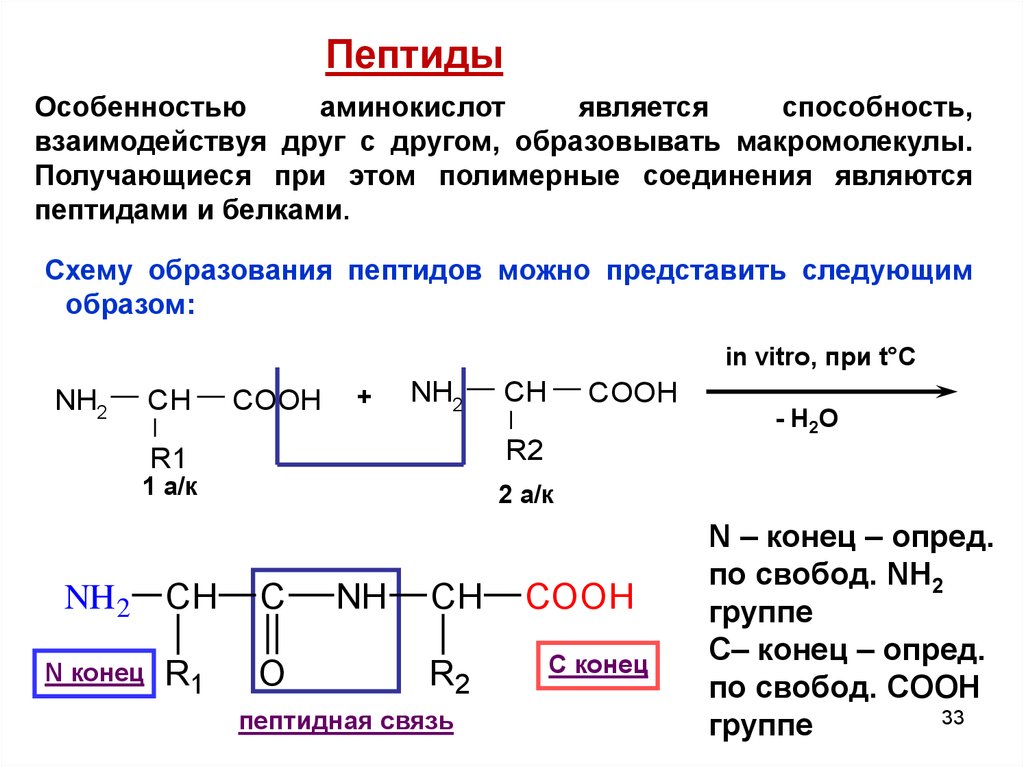
ПептидыОсобенностью
аминокислот
является
способность,
взаимодействуя друг с другом, образовывать макромолекулы.
Получающиеся при этом полимерные соединения являются
пептидами и белками.
Схему образования пептидов можно представить следующим
образом:
in vitro, при t°C
NH2
CH
COOH
+
NH2
1 а/к
N конец
R1
COOH
- H2O
R2
R1
NH 2 CH
CH
2 а/к
C
O
NH
CH
R2
пептидная связь
COOH
С конец
N – конец – опред.
по свобод. NH2
группе
С– конец – опред.
по свобод. COOH
33
группе
34.
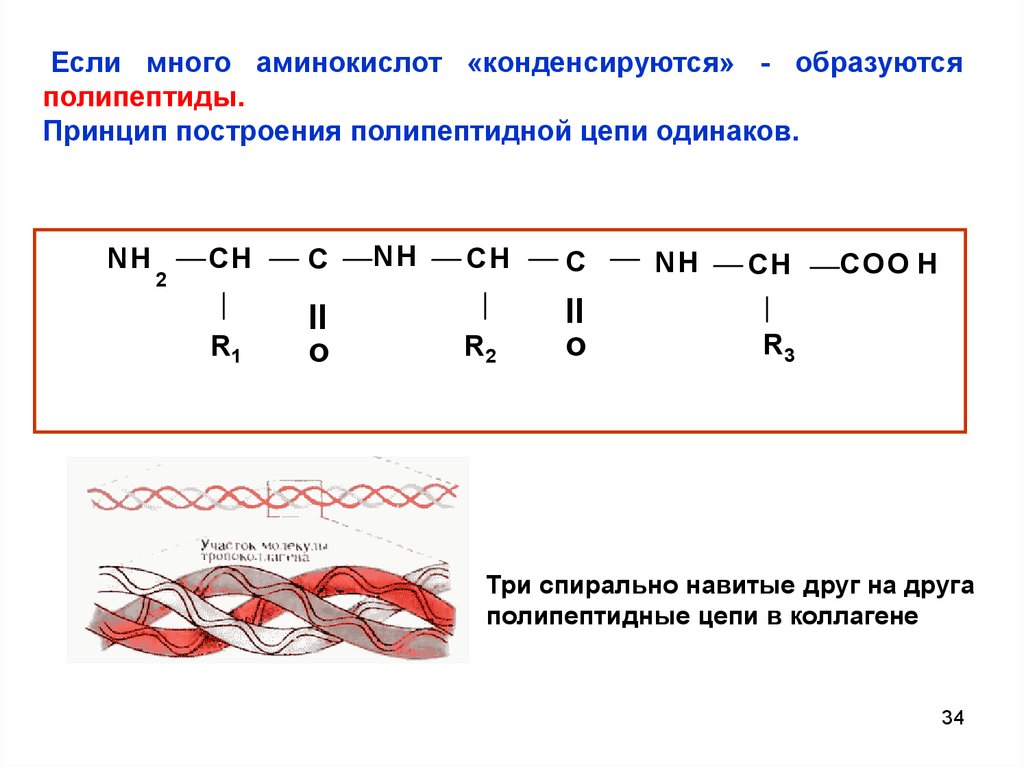
Если много аминокислот «конденсируются» - образуютсяполипептиды.
Принцип построения полипептидной цепи одинаков.
NH
2
CH
C
R1
II
o
NH
CH
C
R2
II
o
NH
CH
COO H
R3
Три спирально навитые друг на друга
полипептидные цепи в коллагене
34
35.
Каскадный синтез пептидов.(ала-гли)
Все
операции
проводятся
в
запрограммированной последовательности
1)
2)
3)
4)
5)
определённой
Защита NH2 группы I ак (ала)
Защита СООН-группы II ак
(гли)
Активация СООН-группы I ак
(ала)
Синтез (SN)
Снятие защиты
35
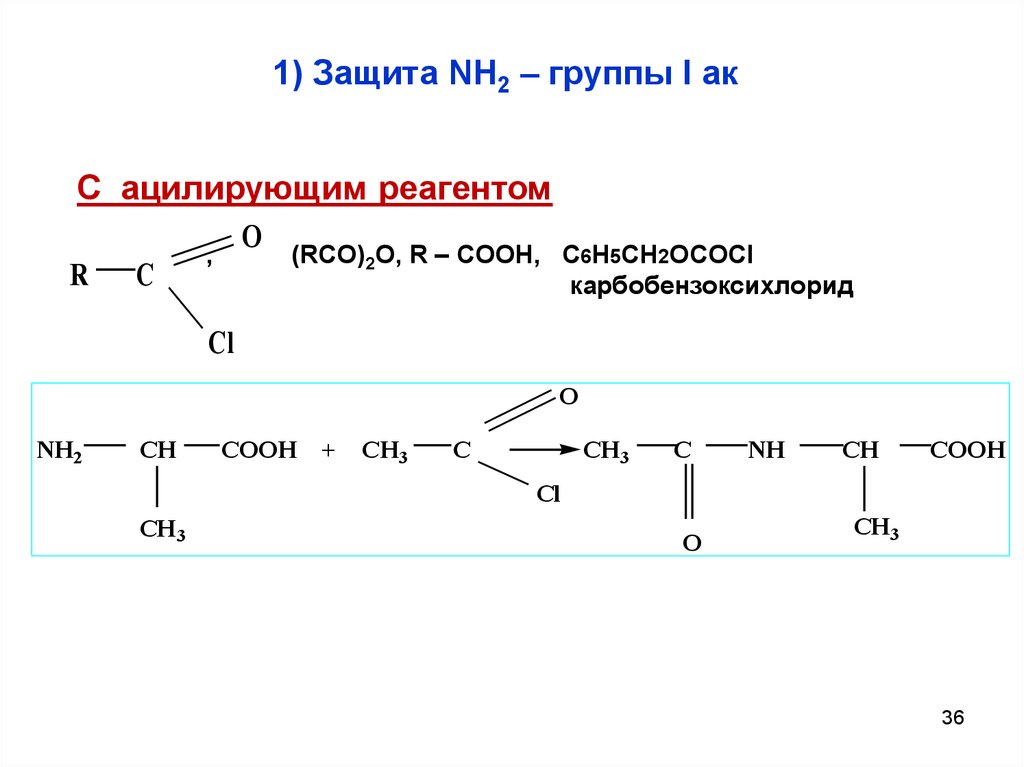
36. 1) Защита NH2 – группы I ак
С ацилирующим реагентомR
C
O
,
(RCO)2O, R – COOH, C6H5CH2OCOCl
карбобензоксихлорид
Cl
O
NH2
CH
COOH
+
CH3
C
CH3
C
NH
CH
COOH
Cl
CH 3
O
CH 3
36
37. 2) Защита СООН – группы II ак
Реакция этерификацииO
сухой
HCl
NH2
CH2
COOH
+
C2H5OH
- H2O
NH2
CH2
C
OC2H5
гли
37
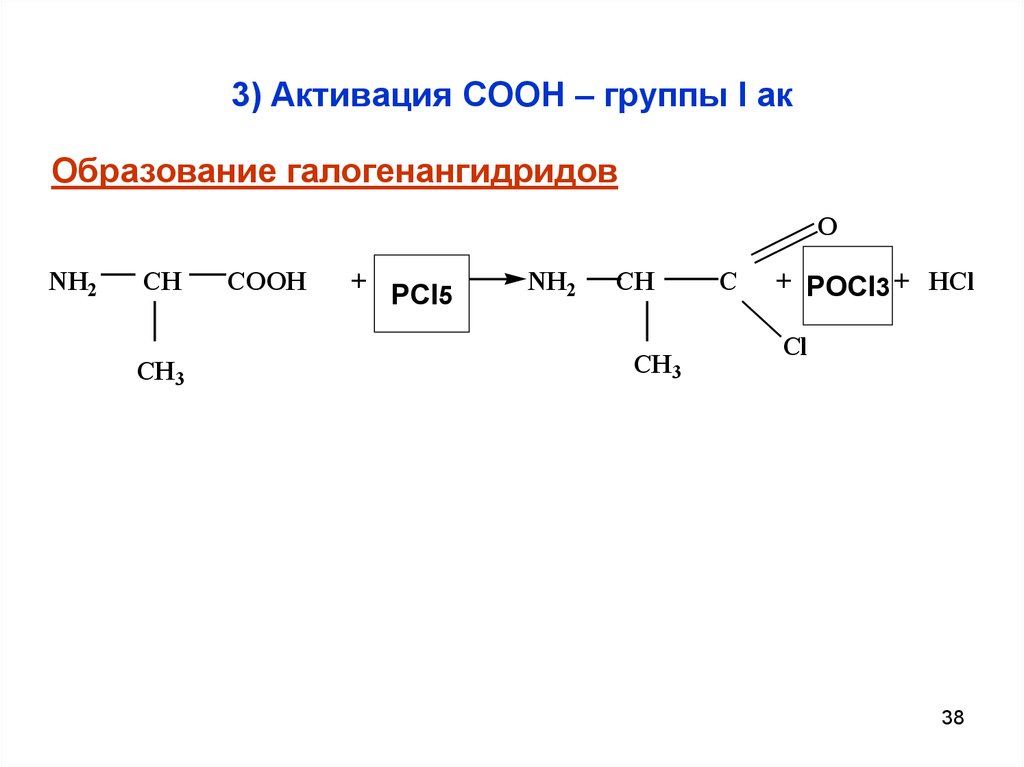
38. 3) Активация СООН – группы I ак
Образование галогенангидридовO
NH2
CH
CH 3
COOH
+ PCl3
PCl5
NH2
CH
CH 3
C
+ POCl
PCl3 3 + HCl
Cl
38
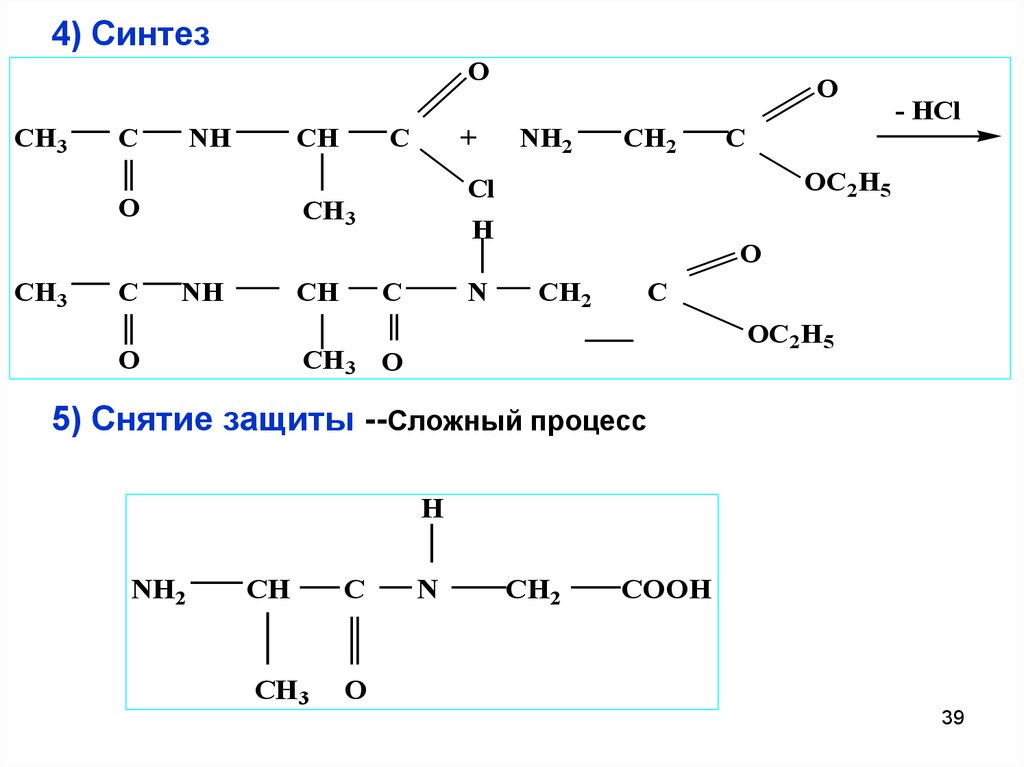
39. 4) Синтез
OCH3
C
NH
CH
O
CH3
C
C
+
CH
O
NH2
CH2
C
H
C
N
- HCl
OC2H5
Cl
CH 3
NH
O
O
CH2
C
OC2H5
CH 3 O
5) Снятие защиты --Сложный процесс
H
NH2
CH
C
CH 3
O
N
CH2
COOH
39
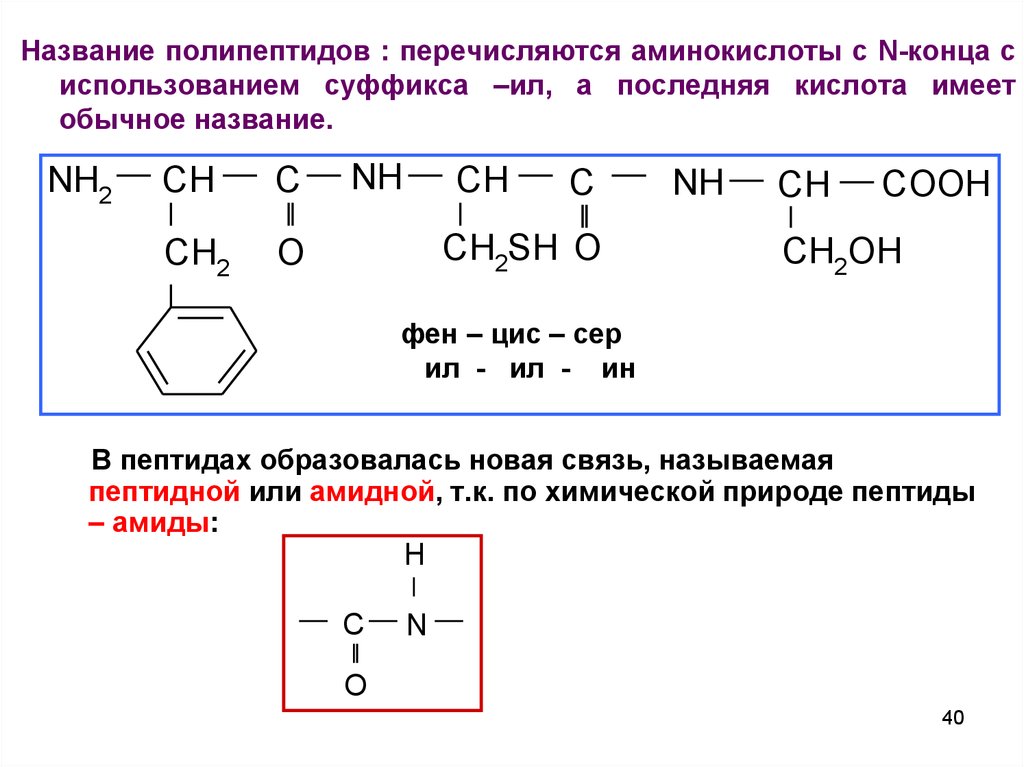
40.
Название полипептидов : перечисляются аминокислоты с N-конца сиспользованием суффикса –ил, а последняя кислота имеет
обычное название.
NH2
CH
C
CH2
O
NH
CH
C
CH2SH O
NH
CH
COOH
CH2OH
фен – цис – сер
ил - ил - ин
В пептидах образовалась новая связь, называемая
пептидной или амидной, т.к. по химической природе пептиды
– амиды:
H
C
N
O
40
41.
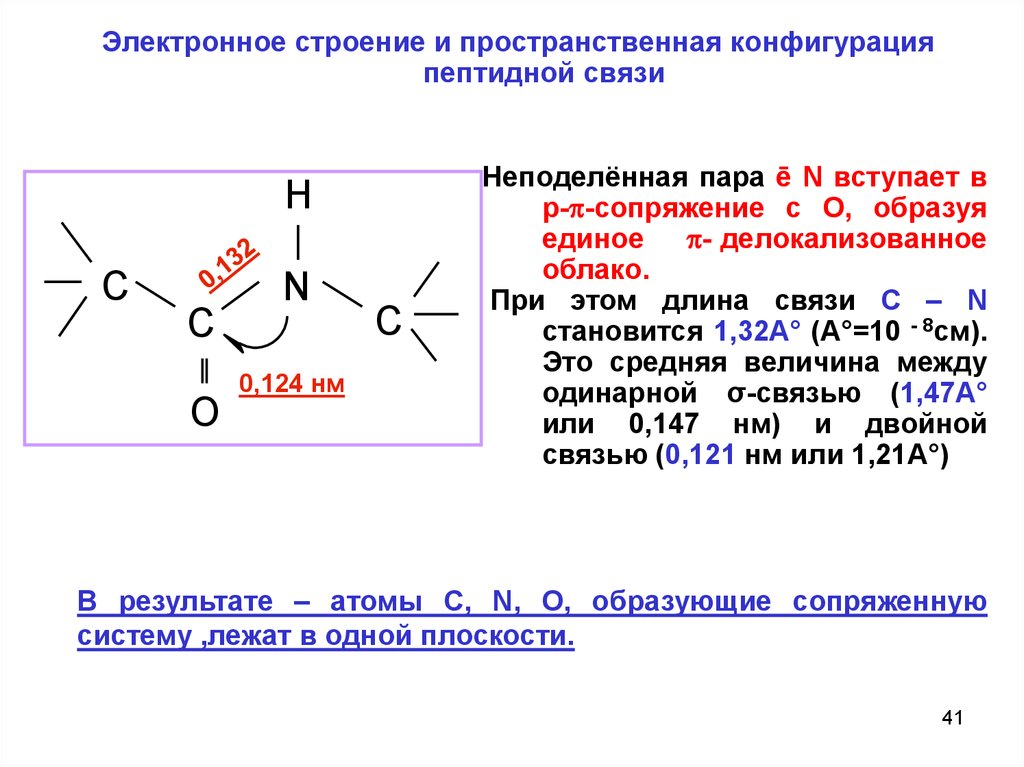
Электронное строение и пространственная конфигурацияпептидной связи
H
C
N
C
O
0,124 нм
C
Неподелённая пара ē N вступает в
р- -сопряжение с О, образуя
единое - делокализованное
облако.
При этом длина связи C – N
становится 1,32А° (А°=10 - 8см).
Это средняя величина между
одинарной σ-связью (1,47А°
или 0,147 нм) и двойной
связью (0,121 нм или 1,21А°)
В результате – атомы C, N, O, образующие сопряженную
систему ,лежат в одной плоскости.
41
42.
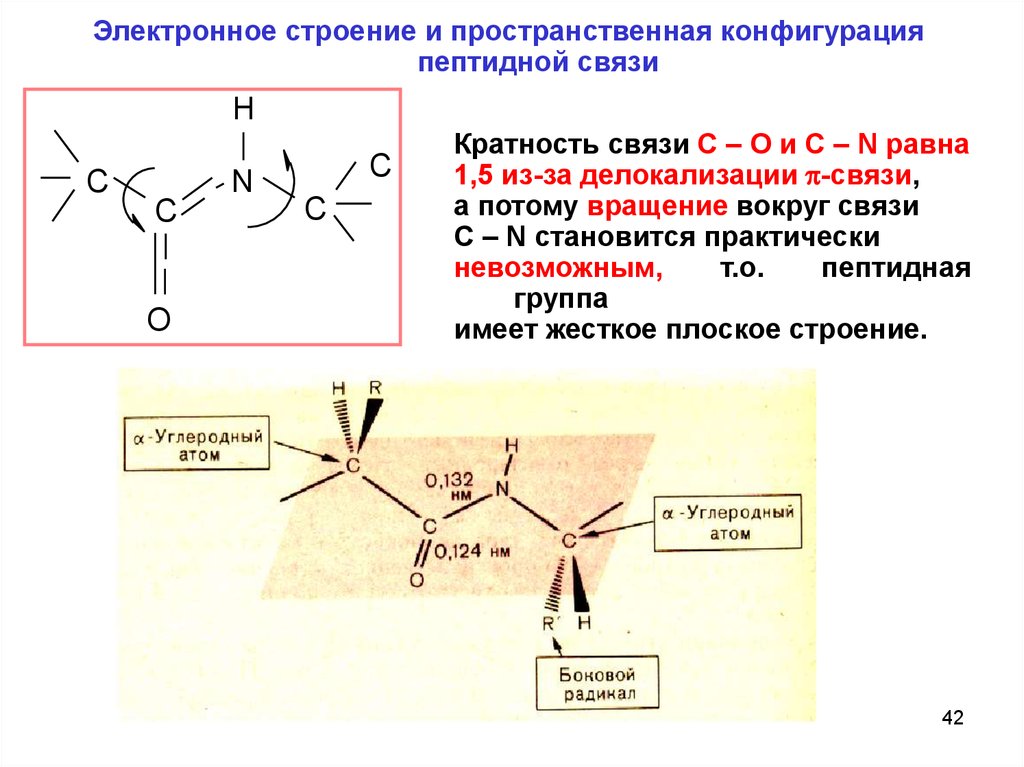
Электронное строение и пространственная конфигурацияпептидной связи
H
C
N
C
O
C
C
Кратность связи C – O и C – N равна
1,5 из-за делокализации -связи,
а потому вращение вокруг связи
C – N становится практически
невозможным,
т.о.
пептидная
группа
имеет жесткое плоское строение.
42
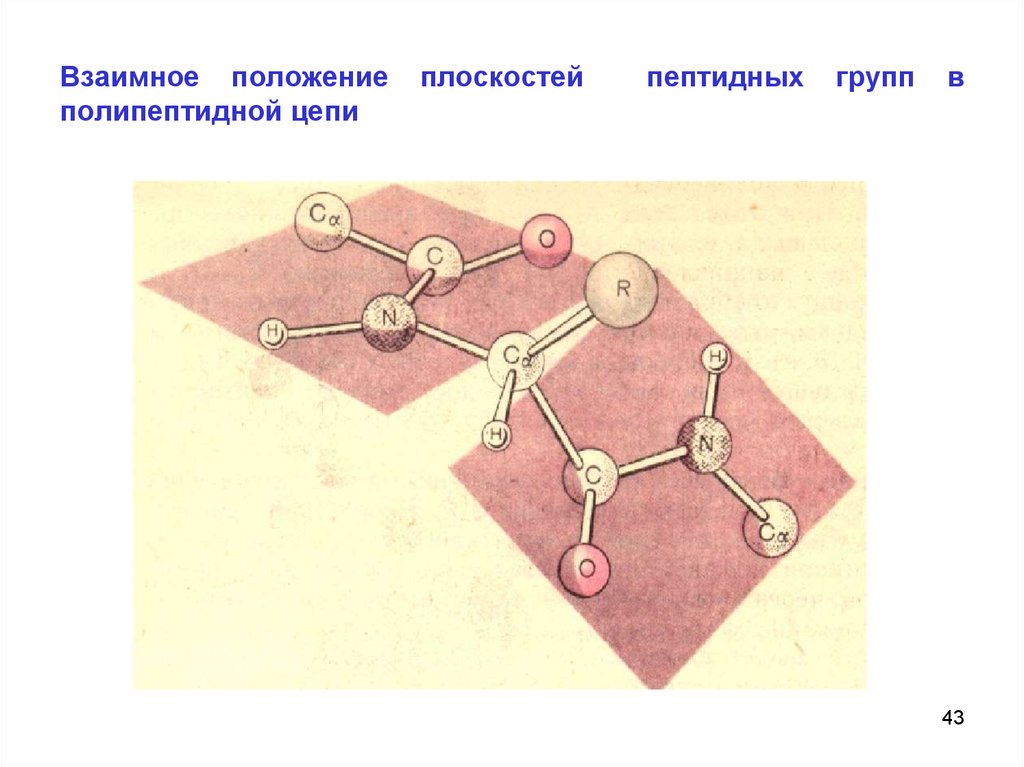
43. Взаимное положение плоскостей пептидных групп в полипептидной цепи
Взаимное положениеполипептидной цепи
плоскостей
пептидных
групп
в
43
44.
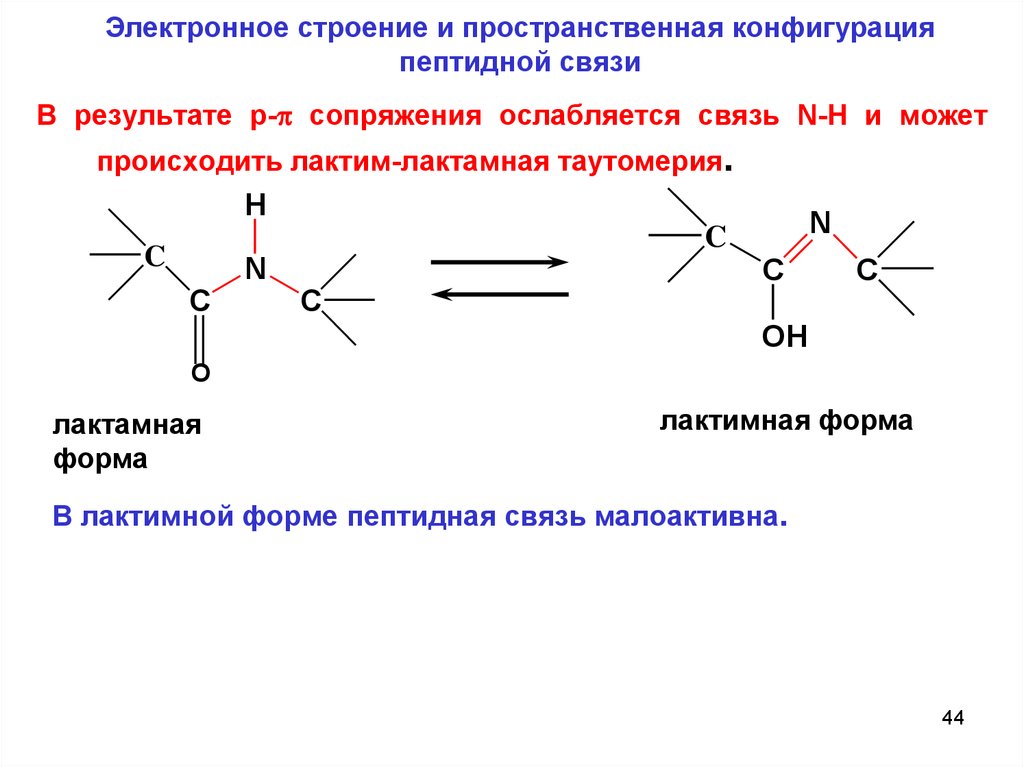
Электронное строение и пространственная конфигурацияпептидной связи
В результате p- сопряжения ослабляется связь N-H и может
происходить лактим-лактамная таутомерия.
H
N
C
C
N
C
C
C
C
OH
О
лактамная
форма
лактимная форма
В лактимной форме пептидная связь малоактивна.
44
45.
Наличие пептидной связи в белках и пептидах было предположеноА. Я. Данилевским и Э. Фишером и затем подтверждено
химическими и физическими данными
Данилевский Александр Яковлевич
[10(22).12.1838, Харьков, — 18.7.1923,
Петроград], русский биохимик, членкорреспондент Петербургской АН
(1898). Предложил теорию строения
белковой
молекулы,
«теорию
элементарных рядов».
Фишер (Fischer) Эмиль (9.10.1852– 15.7.1919),
немецкий
химик-органик
и
биохимик.
Иностранный
член-корреспондент
Петербургской АН (1899). Нобелевская премия
(1902).
45
46.
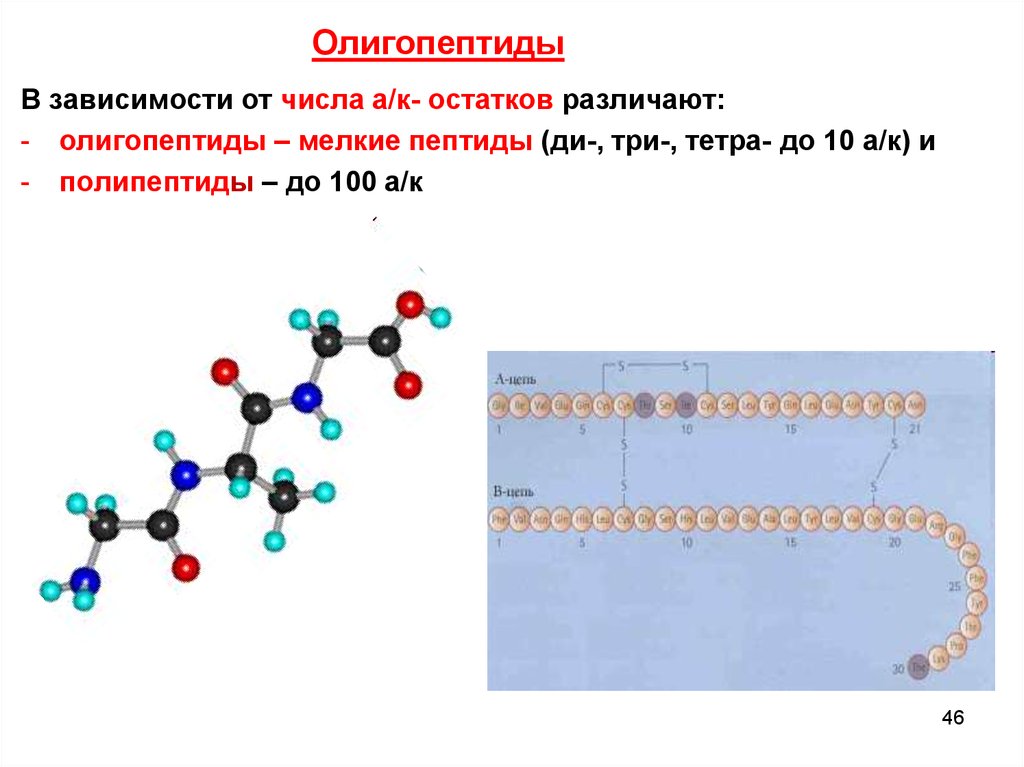
ОлигопептидыВ зависимости от числа а/к- остатков различают:
- олигопептиды – мелкие пептиды (ди-, три-, тетра- до 10 а/к) и
- полипептиды – до 100 а/к
46
47.
Классификация пептидов по функциям ворганизме
• Ферментативная функция
Пептиды - природные катализаторы
47
48.
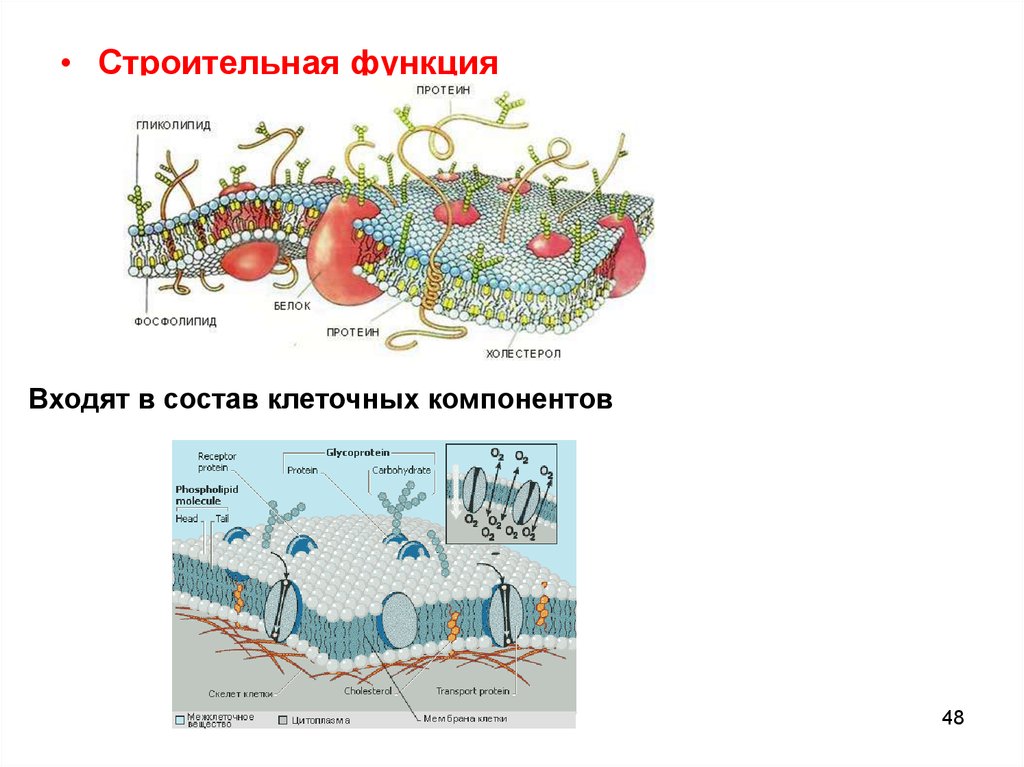
• Строительная функцияВходят в состав клеточных компонентов
48
49.
• Энергетическая функция1 грамм пептида = 17,6 кДж энергии
• Двигательная функция
3 белковые системы:
– Флагелин
– Актин - миозин
– Тубулин – динеин
49
50.
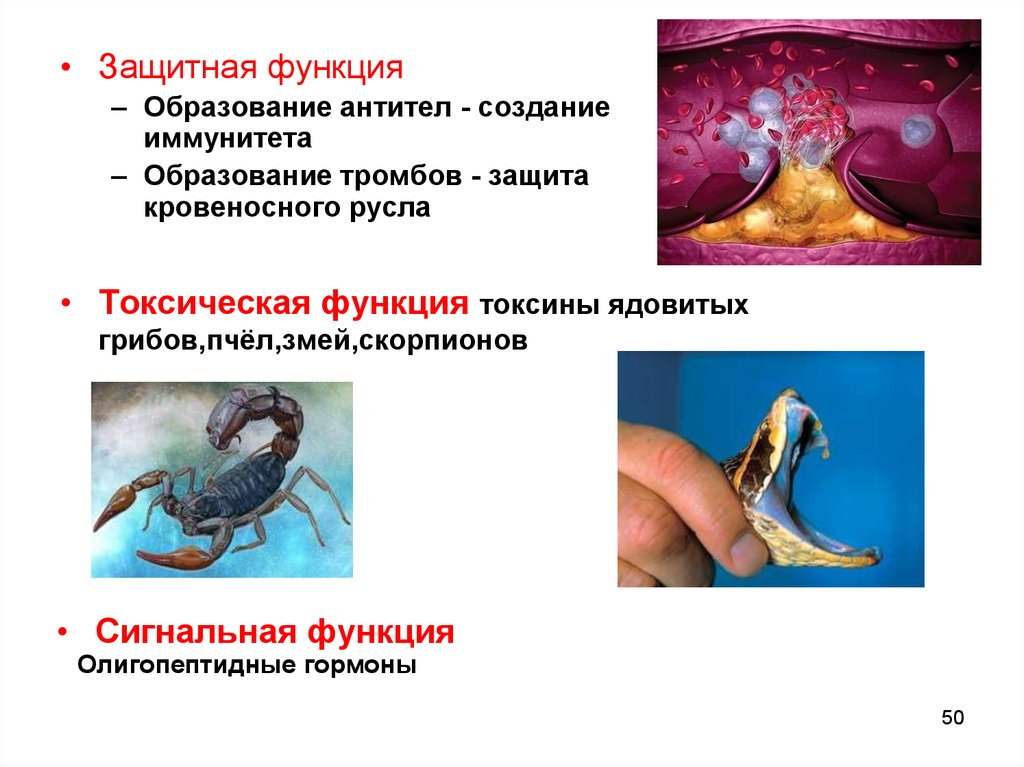
• Защитная функция– Образование антител - создание
иммунитета
– Образование тромбов - защита
кровеносного русла
• Токсическая функция токсины ядовитых
грибов,пчёл,змей,скорпионов
• Сигнальная функция
Олигопептидные гормоны
50
51.
• Транспортная функция• Антибиотическая функция
Олигопептидные антибиотики синтезируются бактериями и
низшими грибами
• Рецепторная фунция
Взаимодействие с окружающей средой
51
52.
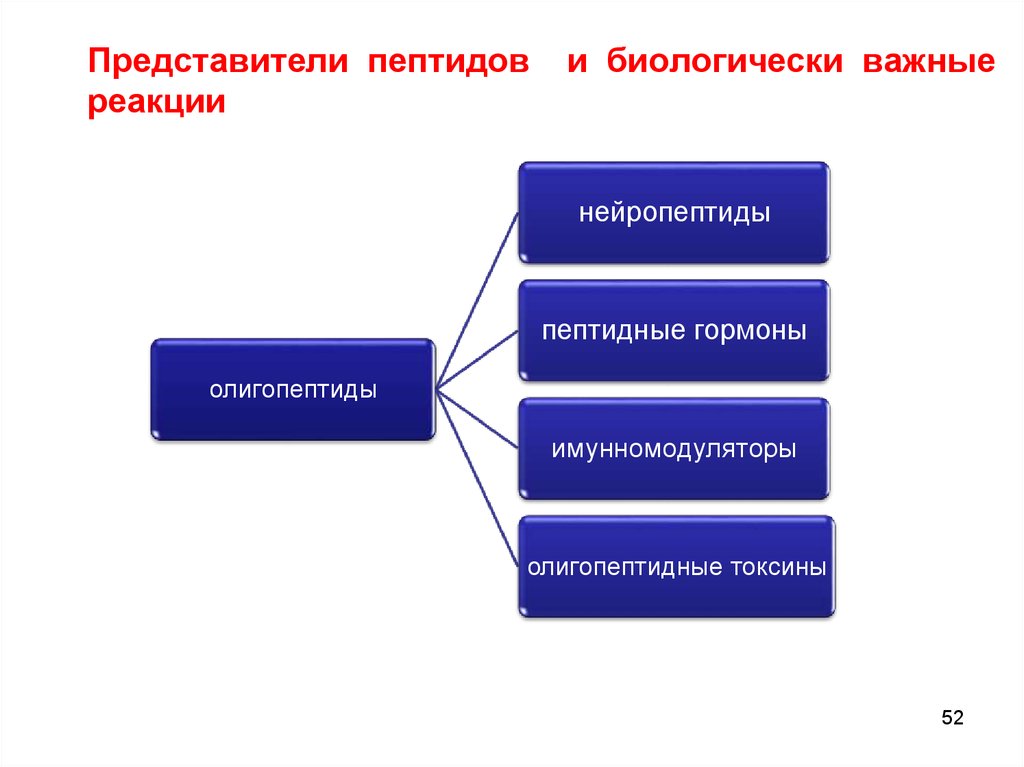
Представители пептидовреакции
и биологически важные
нейропептиды
пептидные гормоны
олигопептиды
имунномодуляторы
олигопептидные токсины
52
53.
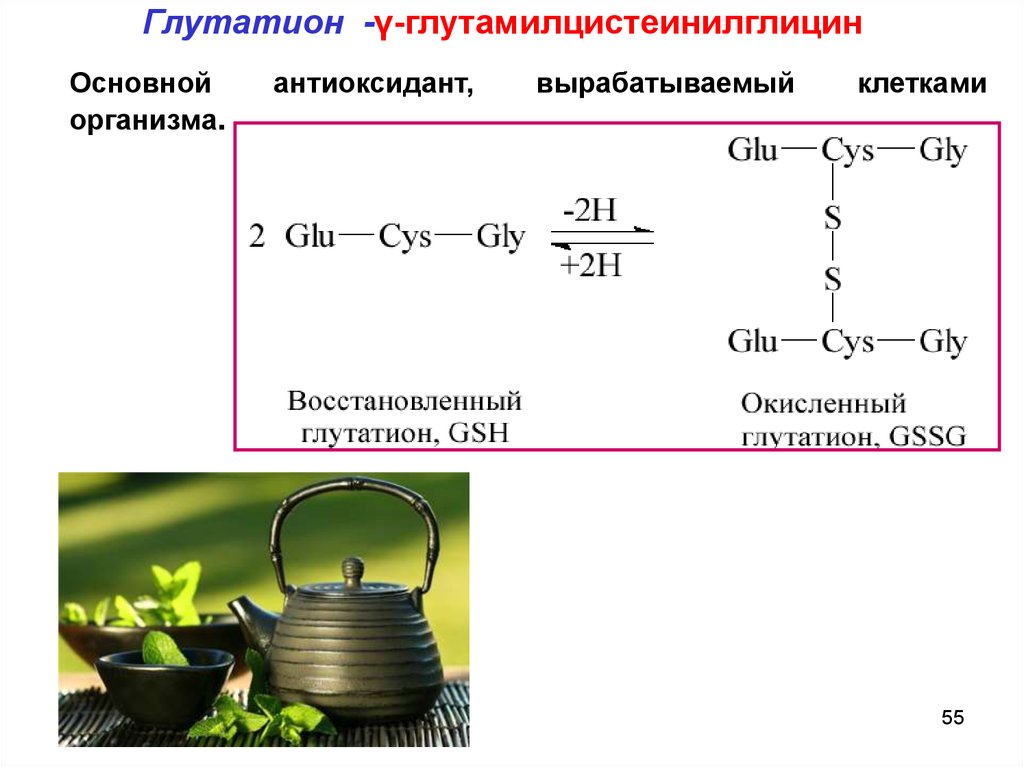
Глутатион -γ-глутамилцистеинилглицин(трипептид)
53
54.
Глутатион - γ-глутамилцистеинилглицинЗащищает гемоглобин и его белки, мембрану эритроцитов от
окислителей.
Эритроциты в норме
Клетки в отсутствии
глутатиона
54
55.
Глутатион -γ-глутамилцистеинилглицинОсновной
организма.
антиоксидант,
вырабатываемый
клетками
55
56.
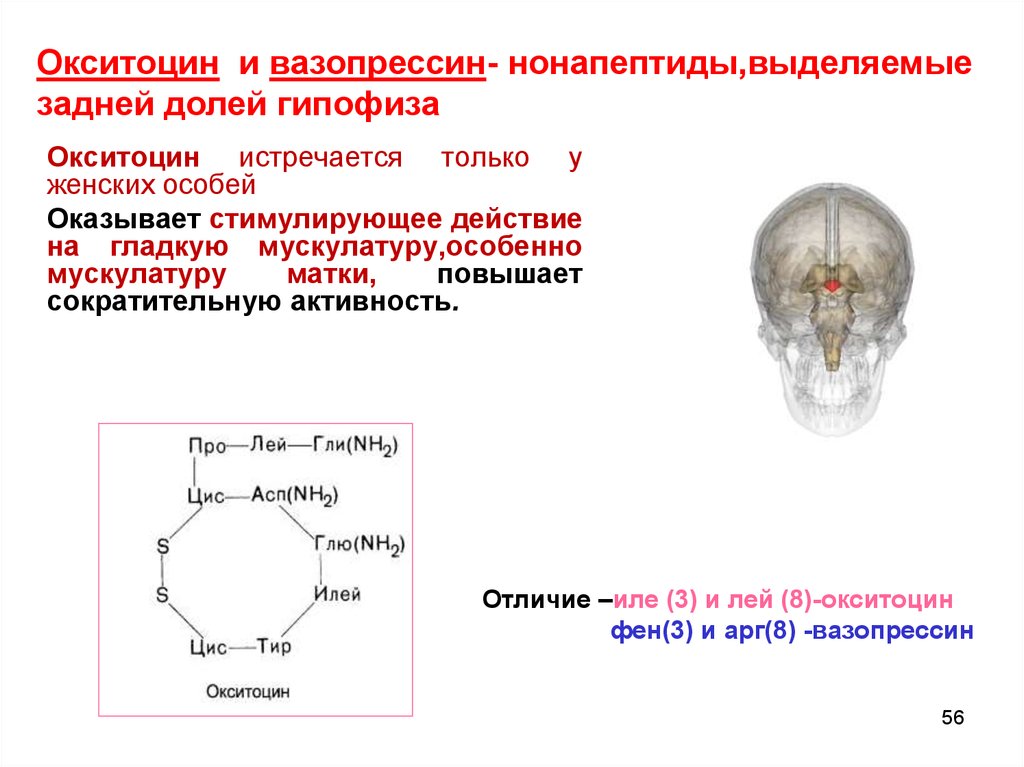
Окситоцин и вазопрессин- нонапептиды,выделяемыезадней долей гипофиза
Окситоцин истречается только у
женских особей
Оказывает стимулирующее действие
на гладкую мускулатуру,особенно
мускулатуру
матки,
повышает
сократительную активность.
Отличие –иле (3) и лей (8)-окситоцин
фен(3) и арг(8) -вазопрессин
56
57.
ОкситоцинГормон доверчивости. Участвует сразу же после родов
в формировании отношения мать-ребенок.
57
58.
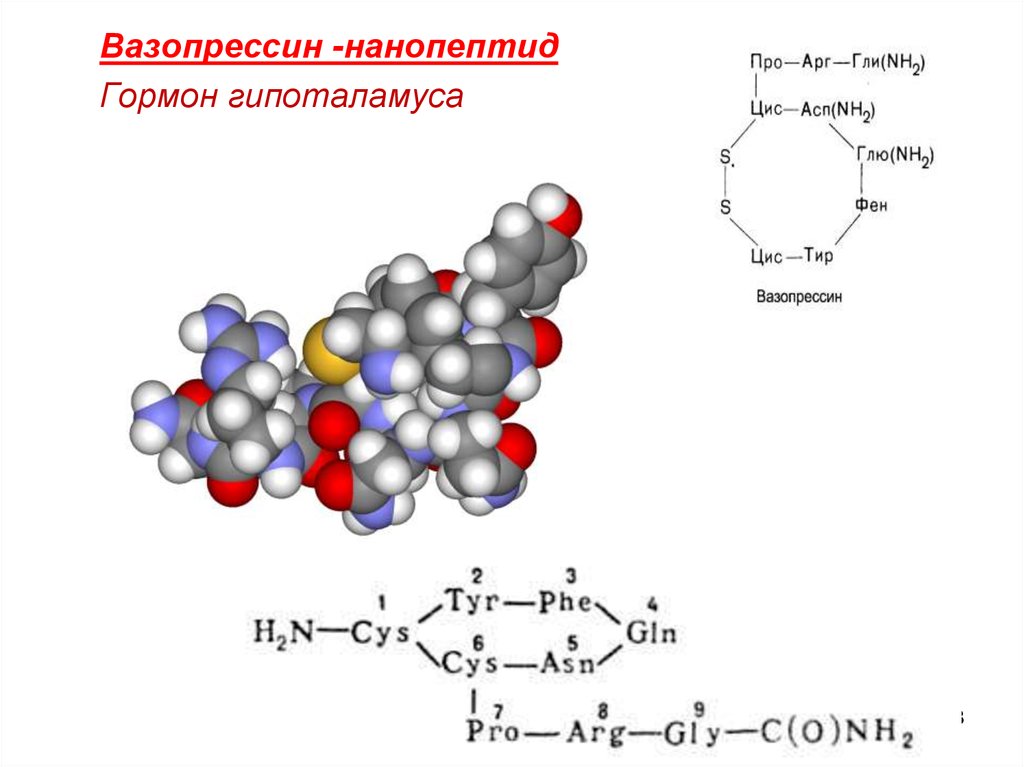
Вазопрессин -нанопептидГормон гипоталамуса
58
59.
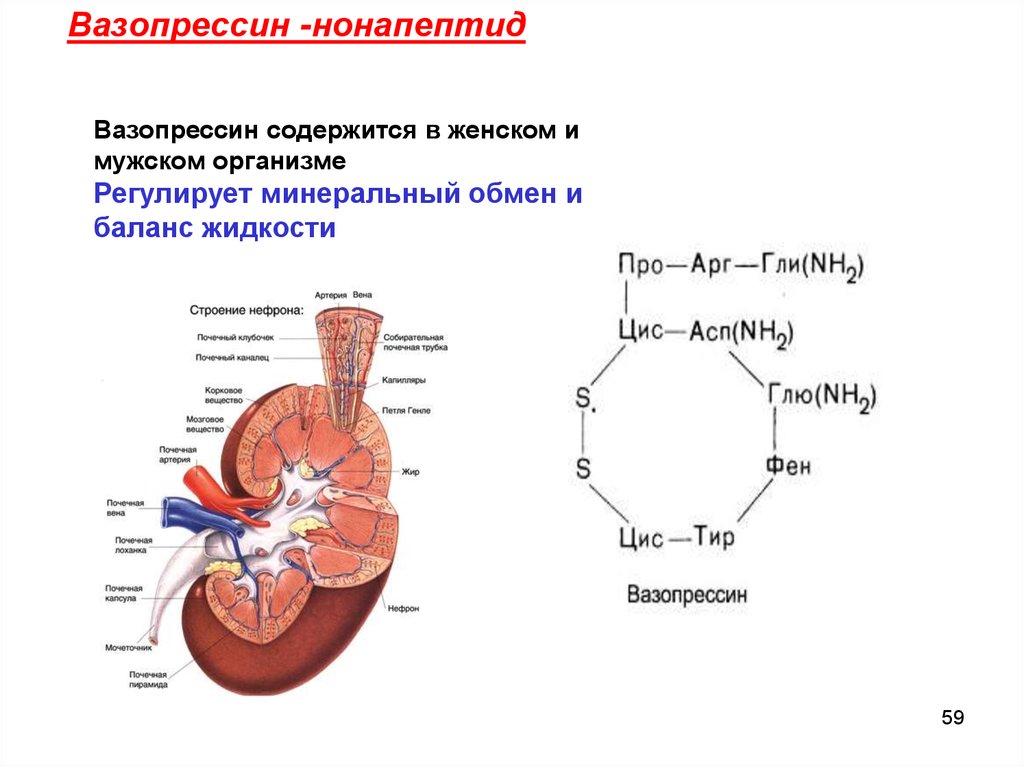
Вазопрессин -нонапептидВазопрессин содержится в женском и
мужском организме
Регулирует минеральный обмен и
баланс жидкости
59
60.
ВазопрессинТаблетки верности
Вазопрессин управляет родительским поведением, а
также
узнаванием
"своих"
и
формированием
привязанности, нежности и ласки.
Мощный стимулятор запоминания
60
61.
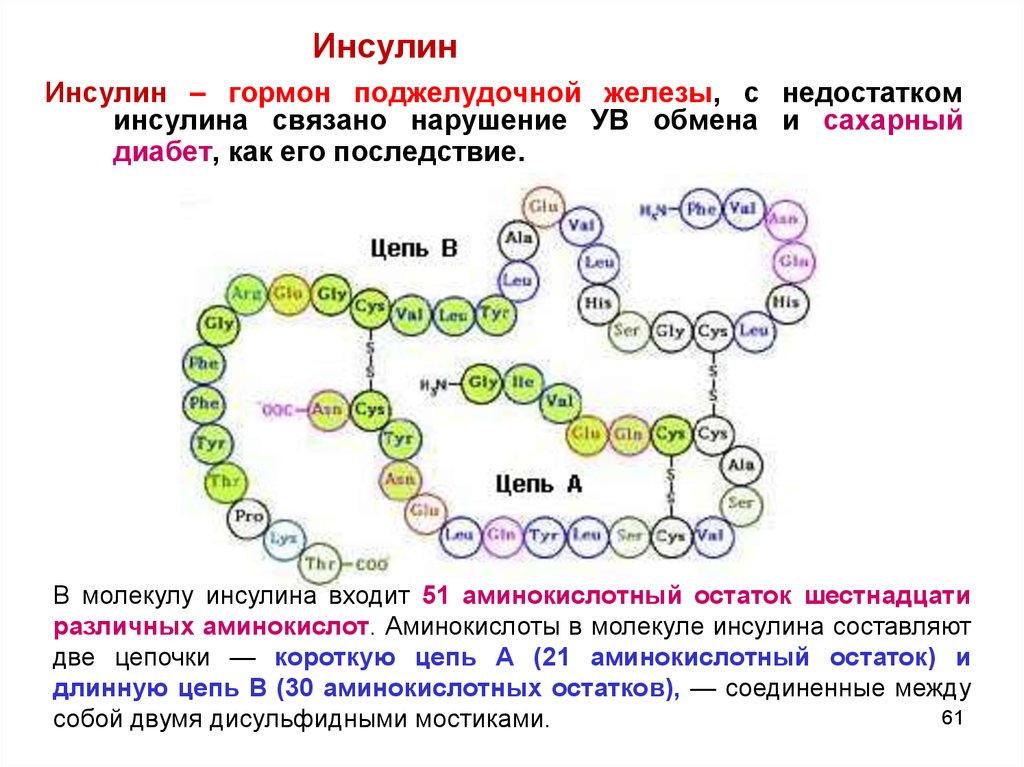
ИнсулинИнсулин – гормон поджелудочной железы, с недостатком
инсулина связано нарушение УВ обмена и сахарный
диабет, как его последствие.
В молекулу инсулина входит 51 аминокислотный остаток шестнадцати
различных аминокислот. Аминокислоты в молекуле инсулина составляют
две цепочки — короткую цепь А (21 аминокислотный остаток) и
длинную цепь В (30 аминокислотных остатков), — соединенные между
61
собой двумя дисульфидными мостиками.
62.
ИнсулинВпервые бычий инсулин
был
расшифрован
Фредериком С егером,
за что в 1958 году ему
была
вручена
Нобелевская премия
В
1980
году2-ая
Нобелевская премия за
разработку
методов
расшифровки
нуклеиновых кислот).
Расшифровка первичной структуры пептидов – мощный
стимул для развития работ по их синтезу.
С инсулина началась новая эпоха в биотехнологии
62
63.
НейропептидыНейропептиды
природные
олигопептиды,
образующиеся в центральной или периферической
нервной системе и регулирующие физиологические
функции организма человека и животных.
63
64.
Пептиды служат важным «средством общения» между собойнервных клеток наряду с давно известными медиаторами –
дофамином, норадреналином, ацетилхолином.
64
65.
Нейропептиды:•влияют на процессы обучения и
запоминания
•регулируют сон
•обладают обезболивающей
функцией
•ответственны за чувство голода,
страха и т.д.
65
66.
Многие пептиды работают в системе удовольствия,моделируя поведение нервных импульсов по тем
нервным путям, которые создают чувство радости,
веселья, обезболивания.
66
67.
Опиоидные пептидыК таким пептидам относятся опиоидные нейропептиды –
энкефалины и эндорфины.
Они образуются в мозге и оказывают на ЦНС действие,
сходное с дейстивием морфина.
Однако, к ним не возникает наркотического привыкания, о чем
свидетельствует их физиологически управляемый синтез.
67
68.
Опиоидные пептидыОпиоидные пептиды - группа природных и синтетических
пептидов, сходных с опиатами (морфин, кодеин и др.) по
способности связываться с опиатными рецепторами
организма.
Энкефалины:
лейцин-энкефалин
H 2 N Tyr Gly Gly Phe Leu COOH
Метионин-энкефалин
H 2 N Tyr Gly Gly Phe Met COOH
68
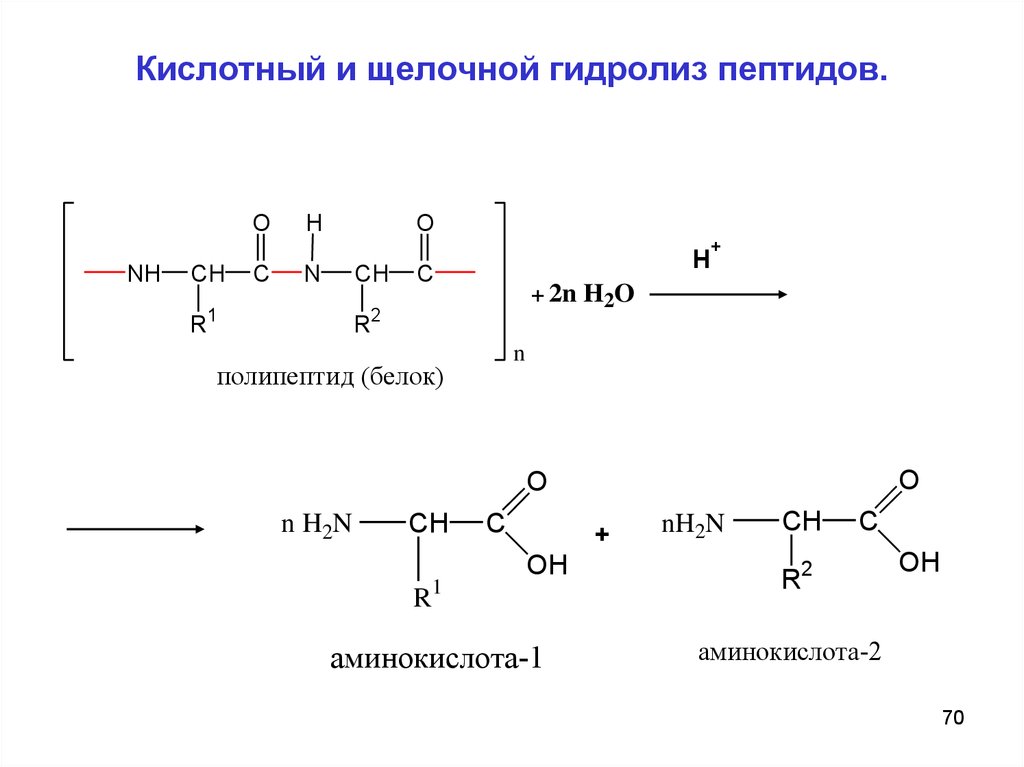
69. Кислотный и щелочной гидролиз пептидов.
Важное свойство пептидов - способность к гидролизу. Пригидролизе происходит полное или частичное расщепление
пептидной цепи и образуются более короткие пептиды с
меньшей
молекулярной
массой
или
α-аминокислоты,
составляющие цепь.
Гидролиз пептидов может происходить в кислой или щелочной
среде, а также под действием ферментов. В кислой и щелочной
средах образуются соли аминокислот. Ферментативный
гидролиз важен тем, что протекает селективно, т.е. позволяет
расщеплять строго определенные участки пептидной цепи.
69
70. Кислотный и щелочной гидролиз пептидов.
OH
O
+
NH
CH
R
C
N
CH
1
R
H
C
+ 2n H2O
2
n
полипептид (белок)
O
O
n H2N
CH
R1
C
+
OH
аминокислота-1
nH2N
CH
C
R2
OH
аминокислота-2
70
71. Структура белка
Белковые молекулы – полимерные, неразветвлённые цепи из аминокислот (> 100 аминокислот), структурные единицы –20 аминокислот.
Аминокислотный состав – это природа и количественное
соотношение входящих в белковую молекулу аминокислот.
71
72.
Первичная структура белкаПорядок расположения ковалентно связанных аминокислот в
полипептидной
цепи
называют
аминокислотной
последовательностью, или первичной структурой белков.
Первичная
структура
каждого
белка,
кодируемая
соответствующим геном, постоянна и несет в себе всю
информацию, необходимую для формирования структур
более высокого уровня.
72
73.
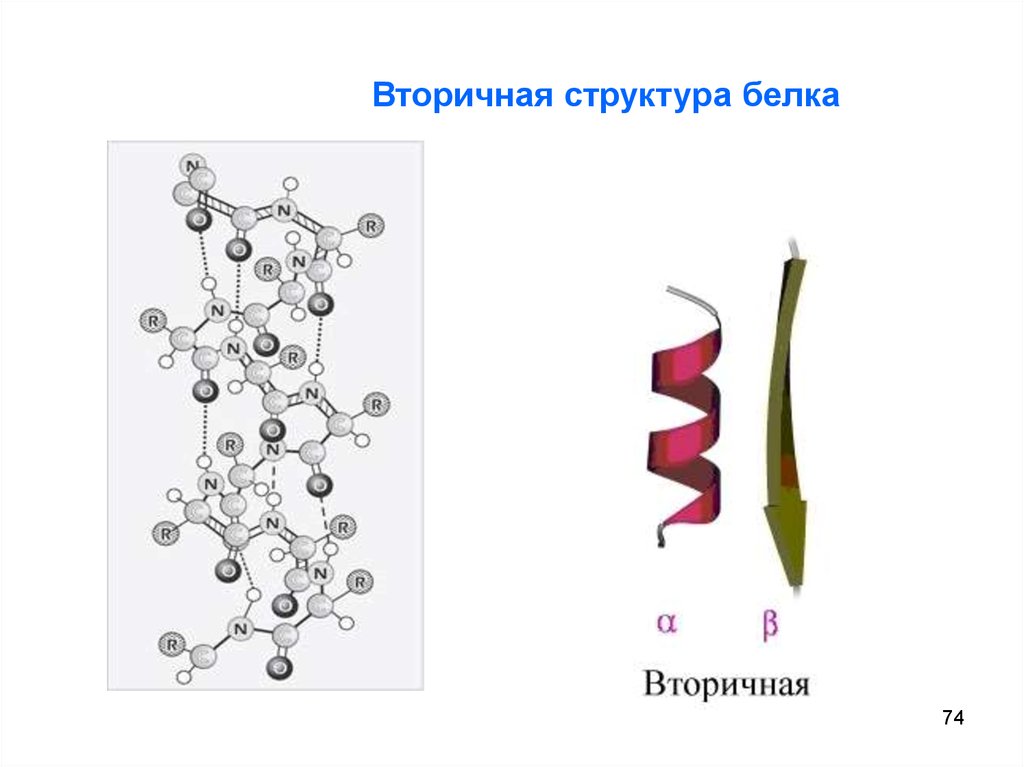
Вторичная структураII
Вторичная структура - укладка первичной структуры белка,
возможны два вида конформации:
Наиболее выгодная -спираль
(правозакрученная): цилиндр обвивает полипептидная цепь (степень
спирализации от 5 до 80 %).
Вторая структура – складчатый слой
( -структура):
полипептидные цепи лежат антипараллельно или параллельно друг
другу (водородные связи соединяют 2 различные цепи).
Вторичная структура фиксируется водородными связями между
пептидными группами.
73
74.
Вторичная структура белка74
75.
Третичная структура белкаТретичная структура – укладка вторичных структур одной
полипептидной цепи в глобулу. В формировании третичной
структуры, кроме водородных связей, большую роль играет
ионное и гидрофобное взаимодействие.
Основные виды взаимодействия:
-Взаимодействие боковых радикалов, которые при изгибе цепи
сближаются
-Водородные связи
-Дисульфидные ковалентные связи и другие
75
76.
Третичная структура белка76
77.
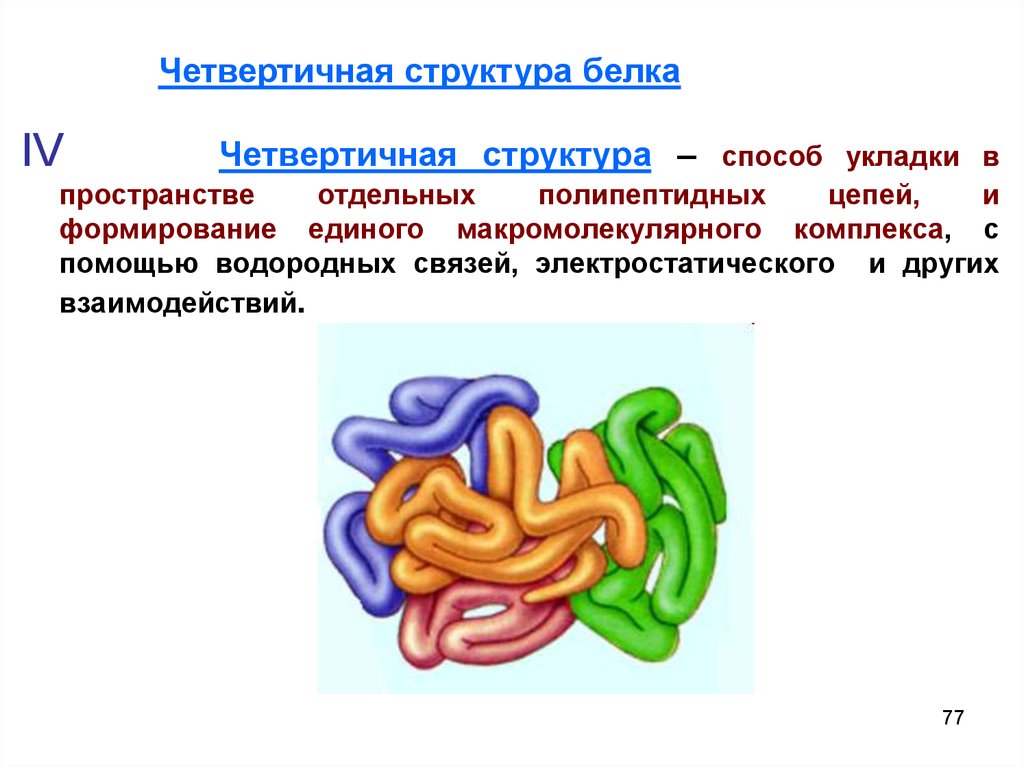
Четвертичная структура белкаIV
Четвертичная структура – способ укладки в
пространстве
отдельных
полипептидных
цепей,
и
формирование единого макромолекулярного комплекса, с
помощью водородных связей, электростатического и других
взаимодействий.
77
78.
Классификация сложных белков1.Гликопротеины.
2.Липопротеины.
3.Нуклеопротеины.
4. Фосфопротеины.
5. Металлопротеины.
78
79.
Спасибоза внимание!
79



































 chemistry
chemistry








