Similar presentations:
Основы химического равновесия
1. Лекция 6. Основы химического равновесия
Белорусский национальный технический университетКафедра ЮНЕСКО “Энергосбережение и
возобновляемые источники энергии”
Топливо и его
использование
Лекция 6. Основы химического равновесия
2.
ТопливоЛекция 6
Уравнение химической реакции
Процессы горения/газификации, так же как и
другие химические превращения, описываются
уравнениями химических реакций, имеющими вид
A B M N,
где A,B,M,N – химические символы реагирующих
веществ,
, , , - стехиометрические коэффициенты,
показывающие число молей вещества,
участвующих в реакции.
3.
Лекция 6Гомогенная реакция горения метана
Предполагая, что элементы, образующие молекулу
метана – С и Н, полностью окисляются кислородом и
образуют диоксид углерода и пары воды, можно записать
уравнение в общем виде
CH 4 O2 CO2 H 2O
и найти стехиометрические коэффициенты , , , из
уравнений баланса атомов С, Н и О с учётом того, что = 2
молей О2 достаточно для полного окисления α=1 молей
метана
баланс С : ;
баланс Н :
4 2 ;
баланс О :
2 2 ;
2
1CH 4 2O2 1CO2 2 H 2O
4.
Лекция 6Химические реакции горения и
газификации протекают с выделением или
поглощением тепла, которое называется
теплотой реакции.
Всякая химическая реакция сводится к
разрушению (разрыву) химических связей
между атомами в молекулах и образованию
новых связей. При этом изменяется
энтальпия (p=const) или внутренняя
энергия (v=const) реагирующих веществ.
5.
Лекция 6Если энергия, выделяющаяся при
образовании новых связей, больше энергии,
затрачиваемой на разрушение связей в
исходных молекулах, то реакция
сопровождается выделением теплоты
(экзотермический процесс).
Если энергия, выделившаяся при
образовании новых связей, меньше энергии
разрыва связей, то реакция связана с
поглощением теплоты из окружающей среды
(эндотермический процесс).
6.
Согласно 1-му началу термодинамики, изменениеЛекция 5
внутренней энергии dU или энтальпии dH = d(U+pV)
реагентов в процессе их химического превращения в
продукты реакции происходит за счёт поглощения (или
выделения) теплоты δQ и совершения работы δL
dU Q L.
U, H – функции состояния, и их изменение в результате
химической реакции не зависит от пути (механизма), по
которому развивается реакция, а определяется лишь
начальным и конечным состояниями системы (составами и
свойствами реагентов и продуктов).
Теплота реакции в общем случае зависит от пути
процесса, но в двух простейших случаях, когда процессы
совершаются при V,Т=const и p,Т=const, её значение также
определяется только начальным и конечным состояниями
системы.
7.
Если реакция протекает при постоянном объёме (V,Т = const, 6
Лекция
изохорно-изотермический процесс), и при этом работа не
совершается (L = 0), то теплота реакции равна разности
внутренней энергии системы после и до реакции
QV U 2 U1 rU
Если реакция протекает при постоянном давлении (p=const,
изобарный процесс) и совершается только работа объёмного
расширения (типичные условия в устройствах
сжигания/газификации), то теплота реакции равна разности
энтальпий системы после и до реакции
Q p U 2 U1 p V2 V1
U 2 pV2 U1 pV1 r H
При ΔН < 0 реакция экзотермическая, при ΔН > 0 –
эндотермическая (тепло поглощается из окружающей среды).
8.
Лекция 5Закон Гесса (следствие I начала т/д)
Теплота реакций при р,Т = const или при V,T = const не
зависит от пути их протекания (от промежуточных стадий), а
определяется только начальным и конечным состояниями
системы.
Следствия из закона Гесса
1) Теплота реакции равна разности между суммой теплот
образования (Uобр или Нобр ) конечных продуктов реакции и
суммой теплот образования исходных реагентов
Qp r Н Н обр
прод
Н обр
исх . реаг
2) Теплота реакции равна разности между суммами теплот
сгорания (Uсгор или Нсгор ) исходных реагентов и продуктов
реакции
Qp r Н
исх. реаг
Н сгор Н сгор
прод
9.
Лекция 5Теплота реакции образования метана
C 2 H 2 CH 4
Теплота реакции равна сумме теплот сгорания исходных
реагентов за вычетом суммы теплот сгорания продуктов
реакции (2-е следствие из з-на Гесса)
C O2 CO2 393777 кДж/кмоль
2 H 2 O2 2 H 2O 2 286000 кДж/кмоль
СH 4 2O2 CO2 2 H 2O 890999 кДж/кмоль
r Н 393777 2 286000 ( 890999) 74778
кДж/кмоль
10.
Лекция 5Гомогенное и гетерогенное горение
Компоненты горючей смеси могут находиться в
одном агрегатном состоянии, например,
– газообразном при сжигании газов в воздухе,
либо в различных состояниях:
– твердое топливо и газообразный окислитель;
– жидкое топливо и газообразный окислитель.
Система , в которой компоненты находятся в
одном агрегатном состоянии, называется
гомогенной, а в различных – гетерогенной.
От агрегатного состояния реагентов и
продуктов зависят их энтальпия образования и,
следовательно, – теплота реакции.
11.
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯЛекция 5
Энтальпия образования сложного вещества есть
энтальпия реакции его синтеза из простых в-в, взятых в
наиболее устойчивых физических состояниях при заданных
внешних р, Т.
Стандартные энтальпии образования веществ
приводятся в таблицах при одних и тех же ("стандартных")
условиях: р = 1 атм и определённой температуре, обычно
298.15 К = 25 оС.
Обозначение:
0
0
H обр , 298
или f H 298
Стандартные энтальпии образования простых
веществ:
− углерода С (графит);
− водорода Н2 (газ);
− кислорода О2 (газ);
− азота N2 (газ) и т.п.
приняты равными 0 (нулю).
12.
ЭНТАЛЬПИЯ СГОРАНИЯЛекция 5
Энтальпия сгорания простого и сложного вещества
есть энтальпия реакции его полного окисления кислородом до
образования высших оксидов, причём всегда указывается
каких именно оксидов и в каком фазовом состоянии.
Стандартные энтальпии сгорания веществ приводятся
в таблицах при одних и тех же ("стандартных") условиях: р =
1 атм и определённой температуре, обычно 298.15 К = 25 оС.
Обозначение:
H
0
сгор , 298
или с H
0
298
Теплота сгорания указывается в расчёте на 1 моль
окисляемого вещества (топлива), кДж/моль.
13.
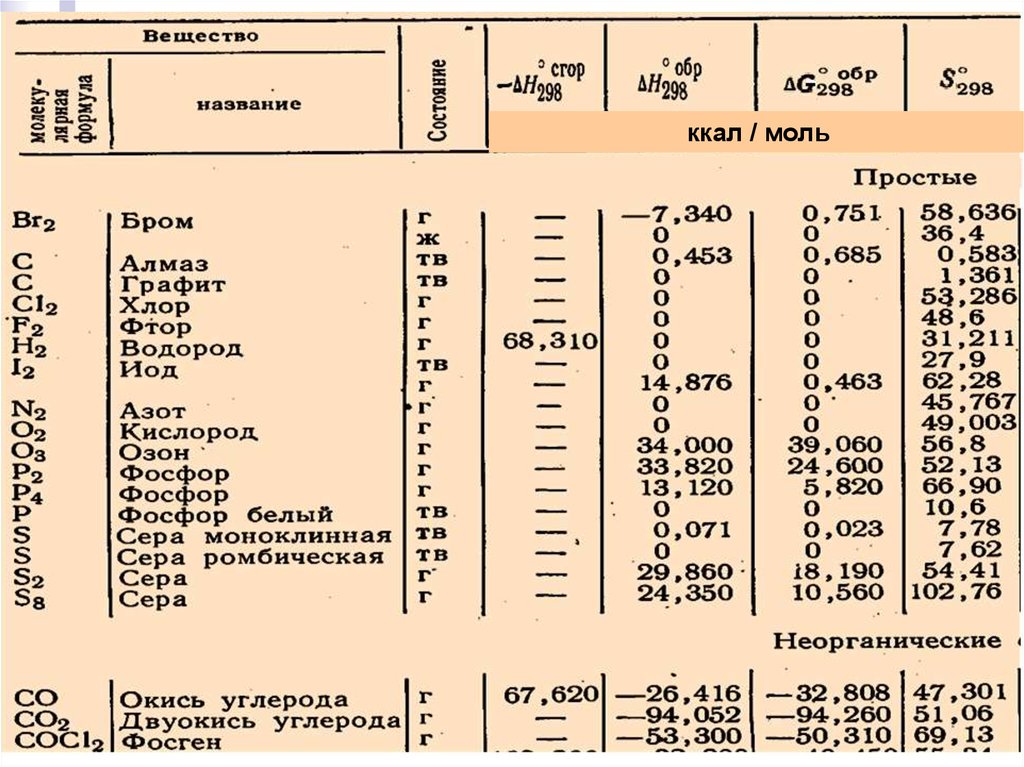
Лекция 6ккал / моль
14.
Лекция 515.
Лекция 616.
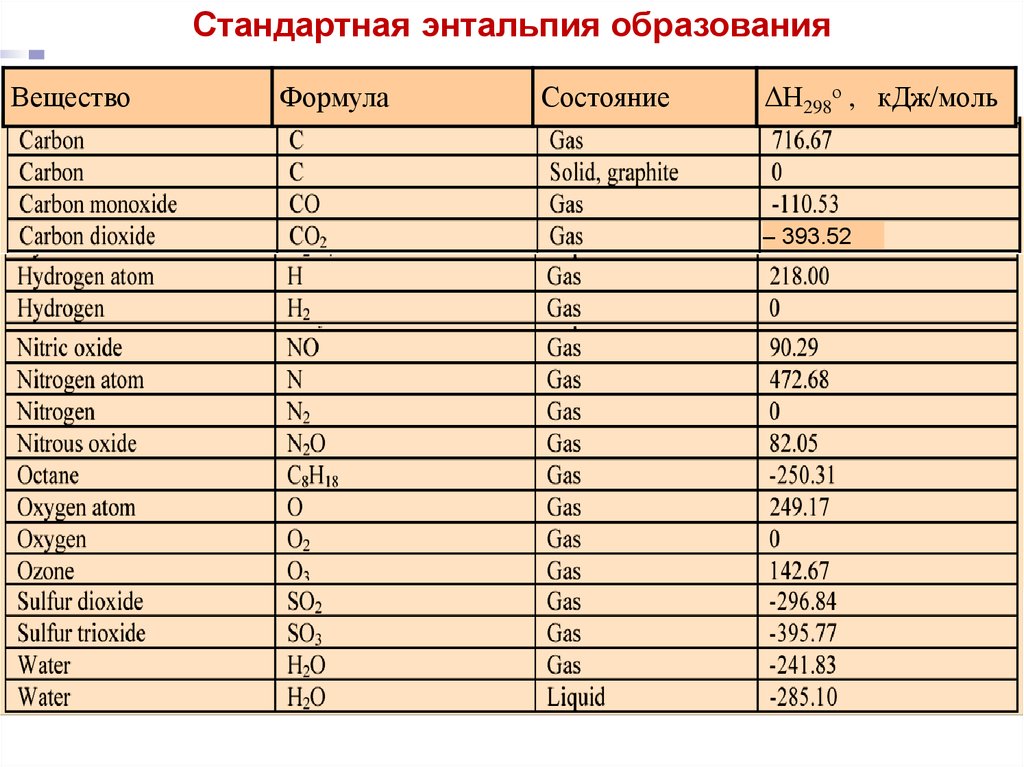
Стандартная энтальпия образованияВещество
Формула
Состояние
Лекция 5
ΔН298о , кДж/моль
– 393.52
17.
Лекция 5Теплота реакции горения этилена при C.У.
Предполгается, что смесь находится в стехиометрическом
соотношении при стандартных условиях (р = 1 кгс/см2, Т =
298.15 К), а вода образуется в жидком состоянии.
1C2 H 4 3O2 11.28 N 2 2CO2 2H 2O 11.28 N 2
(11.28 = 3 × (0.79/0.21).
0
H р ,298 2 H обр
,298
CO2
0
1 H обр
,298
0
2 H обр
,298
C2 H 4
H 2O , ж
0
11.28 H обр
,298
0
0
3 H обр
11.28
H
обр,298
,298
O2
N2
N2
2 393.52 2 285.10 11.28 0
1 52.38 3(0) 11.28 0 1409.62 кДж/моль.
18.
Лекция 6Влияние температуры на теплоту реакции
горения (экзотермической)
Суммарная
энтальпия
образования
реагентов
Суммарная
энтальпия
образования
продуктов
19.
Лекция 6Влияние Т на термодинамические свойства этилена
Термохимические данные для этилена C2H4
Идеальный газ, молярная масса 28.05 кг/кмоль
Tr = 298.15 K, Стандартное давление p = 0.1 MPa
20.
оС 5Лекция
Теплота реакции горения этилена при 500
Предполгается, что смесь находится в стехиометрическом
соотношении при р = 1 атм, Т = 500 К, а вода образуется в
газообразном состоянии.
Сначала пересчитывается предыдущий пример для
температуры 298 К, но для воды в состоянии газа.
0
H 298 2 H обр
,298
CO2
0
1 H обр
,298
0
2 H обр
,298
C2 H 4
H 2O , Г
0
11.28 H обр
,298
N2
0
0
3 H обр
11.28
H
,298
обр ,298
O2
N2
2 393.52 2 241.83 11.28 0
1 52.38 3(0) 11.28 0 1323.08 кДж/моль.
( 1409.62 кДж/моль).
Затем по таблицам определяются разности энтальпий
образования между 500 К и 298 К для всех продуктов (вводятся в
теплоту реакции со знаком +) и реагентов (вводятся со знаком –).
21.
Лекция 6Обратимость химических реакций
Экспериментально установлено, что
химические реакции не всегда протекают до полного
превращения исходных веществ.
Наряду с продуктами реакции в системе
присутствует некоторое количество исходных и
промежуточных соединений, что объяснятся
одновременным протеканием реакций в двух
противоположных направлениях.
Такой ход реакций называется химической
обратимостью и отражается в виде:
A B
M N
22.
Лекция 6Скорость химической реакции, как будет
показано далее, пропорциональна концентрациям
(количество вещества в единице объёма)
участвующих в ней веществ (реагентов).
По мере протекания реакции из-за уменьшения
количества исходных веществ скорость прямой
реакции уменьшается, а обратной увеличивается,
так как продукты прямой реакции все прибывают.
Когда скорости прямой и обратной реакций
уравновешиваются, то состав смеси в системе с
течением времени остается неизменным.
Наступает химическое равновесие.
23.
Лекция 6В зависимости от условий (Т, р) равновесие
может быть, например, сильно смещено в сторону
продуктов реакции.
Может казаться, что реакция протекает
только в одну сторону.
При других условиях равновесие, напротив,
может быть сильно сдвинуто в сторону исходных
веществ, реакция как будто бы вовсе не
протекает.
Могут быть и любые промежуточные
варианты.
24.
Лекция 6Скорость протекания химических реакций и
положение равновесия зависят от химической
природы реагирующих веществ, концентрации
реагирующих веществ, физических условий (Т,
р,V).
Наступление химического равновесия данной
реакции при постоянных температуре и
давлении зависит от концентраций реагирующих
веществ C (моль/м3).
Эта зависимость определяется законом
действующих масс.
25.
Закон действующих массЛекция 6
В однородной среде при постоянных T и p
скорость химической реакции пропорциональна
произведению концентраций реагирующих веществ
A B
M N
Скорость прямой реакции в любой
момент времени:
W1 k1 C A CB ,
а скорость обратной реакции
W2 k2 CM CN
1CH 4 2O2 1CO2 2 H 2O
26.
Лекция 6Здесь CA ,CB ,CM ,CN – текущие
концентрации реагирующих веществ,
моль/м3,
k1 и k2 – коэффициенты
пропорциональности, характерные для
природы реагирующих веществ и зависящие
от температуры, называемые
константами скорости прямой и
обратной реакции. При какой-то заданной
температуре k1 и k2 = const.
27.
Лекция 6Результирующая скорость реакции,
равная разности скоростей прямой и
обратной реакций, в ходе превращения
уменьшается и становится равной нулю при
равновесии, для которого можно записать
k1 C A CB k2 CM CN
28.
Лекция 6Отсюда следует выражение
для
концентраций реагирующих веществ и
констант скоростей в состоянии
равновесия, являющееся
математическим выражением закона
действующих масс
C A CB k 2
K
C
C M C N k1
КС – безразмерная величина, называемая
константой равновесия (по концентрациям).
29.
Лекция 6Так как k1 и k2 при данной температуре
являются постоянными, то и константа
равновесия КС является также постоянной
величиной, характерной для данной
реакции.
Зная значение константы равновесия КС,
можно определить состав равновесной смеси
при данной температуре.
Константы
равновесия
для
многих
реакций приводятся в термодинамических
справочниках.
30.
При Т = const парциальные давления газов в смесиЛекция 6
пропорциональны их концентрациям (МА – масса реагента А)
p AV M A RAT M A
R
A
T
MA
CA
AV
pA
CA
, R 8314 Дж / (кмоль К )
RT
поэтому константу равновесия Кp можно выразить через
парциальные давления газов в смеси. Для эквимолярной
реакции
p A pB
Kp
pM p N
В общем случае при изменении числа молей в реакции
K с K p RT , n ( )
n
31.
Лекция 6Если в газовой смеси может
происходить несколько различных реакций,
то закон действующих масс применяется к
каждой реакции в отдельности.
В условиях промышленного сжигания
топлив обычно состояние равновесия не
наступает, так как для этого необходим
промежуток времени, в 10-100 раз бóльший,
чем среднее время пребывания газов в
топочной камере.
32.
Лекция 6Скорости обратных реакций разложения
(диссоциации) продуктов сгорания при
топочных температурах (1600-18000С и ниже)
весьма малы (например, степень
диссоциации водяных паров в этих условиях
не более 1-3%).
Таким образом, в топках котельных
агрегатов реакции окисления горючих
веществ идут практически только в прямом
направлении.
33.
Лекция 6Строго говоря, область
применения закона действующих
масс ограничивается идеальными
газами, однако с достаточной для
практики точностью, можно
использовать и закон действующих
масс и все выводы из него и для
реальных газов.
34.
Лекция 6Для процессов горения важное значение
имеют гетерогенные реакции в системах, в
частности, состоящих из твердого топлива и
газа.
Однако химические реакции в гетерогенной
системе, состоящей из жидкого топлива и
газа, протекают в газовой фазе между
насыщенным паром топлива и газом.
В результате этого в системе наступает
равновесие в газовой фазе, для которого
справедливы все законы гомогенных газовых
реакций.
35. Принцип Ле Шателье – Брауна
Лекция 6Принцип Ле Шателье – Брауна
Если на систему в состоянии
равновесия воздействовать извне,
изменяя термодинамические параметры
состояния (р, V, Т), то равновесие
смещается в том направлении, которое
противодействует внешнему
воздействию (ослабляет его эффект).
Принцип Ле Шателье справедлив для
всех систем, в том числе и в химических
реакциях.
36.
Лекция 6Например, если прямая реакция экзотермична
(протекает с выделение теплоты), как в случае
реакций горения (следовательно, обратная реакция
эндотермична – идет с поглощением теплоты), то
при повышении температуры извне увеличивается
скорость обратной реакции, тепловыделение
уменьшается, и равновесие смещается в сторону
исходных веществ (реагентов).
При понижении температуры увеличивается
скорость прямой реакции, и равновесие в смещается
в сторону продуктов реакции.
При не слишком высоких температурах эти
смещения для реакций горения мало заметны.
37.
Лекция 6 тоЕсли из системы выводится какой-либо продукт,
равновесие сдвигается в сторону увеличения его
концентрации.
ПРИМЕР. Паровая газификация (конверсия, риформинг)
углерода с целью получения водорода
С Н 2О
СО Н 2
эндотермическая конверсия
экзотермическая "шифт-реакция" СО Н О
СО Н
2
2
2
Чтобы повысить выход Н2, нужно повышать температуру при
проведения 1-ой реакции и понижать – при 2-ой, осуществляя
их в отдельных реакторах.
Результирующая реакция
С 2 Н 2О
СО2 2 Н 2
Адсорбция углекислого газа и вывод его из системы в виде
твёрдого продукта сдвинет равновесие в сторону увеличения
концентрации водорода
С 2 Н 2О СаО СаСО3 2 Н 2
38.
Лекция 6Давление воздействует на положение
равновесия в том случае, если реакция
протекает с изменением объема газов и не
влияет на равновесие эквимолярных
реакций, не сопровождающихся изменением
объема.
Для реакций с увеличением объема при
повышении давления извне равновесие
смещается в сторону исходных реагентов,
т.е. уменьшения объема, а при понижении
давления – в сторону продуктов –
увеличения объема.
39.
Лекция 6Принцип Ле Шателье-Брауна указывает
только направление смещения
равновесия, но не дает возможности
провести количественные расчеты.
Соотношения, позволяющие проводить
расчеты, можно получить, используя
термодинамические методы
(равновесные расчеты с
использованием констант равновесия).
40.
Лекция 6При очень высоких температурах реакции
горения вообще не протекают.
Следовательно, за счет горения нельзя
достичь очень высоких температур (выше
4000-5000 К в зависимости от условий).
В камерах сгорания реактивных двигателей,
где температуры достигают 3000-3500 К,
даже при высоких давлениях существенна
роль обратных реакций.
41. Зависимость химического равновесия реакций горения от температуры
При внешнем изменении температуры равновесиесистемы смещается в ту или другую сторону в зависимости от
знака и величины теплового эффекта.
Чтобы определить состав равновесной смеси при
различных температурах, необходимо знать зависимость
константы равновесия от температуры. Эта зависимость при
V = const и p = const выражается уравнениями изохоры
реакции
d ln K C
Qv
2
dT
RT
и изобары реакции
d ln K p
dT
Qp
RT 2
42.
5 Qd ln Лекция
KC
v2
Знак "–" в правой части показывает, что:
dT
RT
если Q = ΔrH < 0 (экзотермическая реакция) ,
то с ростом температуры константы Kc и Kp
увеличиваются, и равновесие смещается в сторону
образования исходных веществ. Отсюда следует,
что для более полного протекания такой реакции
благоприятны невысокие температуры;
если Q = ΔrH > 0, то с возрастанием
температуры константа равновесия уменьшается,
равновесие сдвигается в сторону образования
конечных веществ. Поэтому в эндотермических
реакциях высокие температуры
благоприятствуют более полному их протеканию.
k2 C A CB
KC
k1 CM CN
k2 p A pB
Kp
k1 pM pN
43.
Лекция 5Константа равновесия и энергия Гиббса
(свободная энтальпия; изобарно-изотермический потенциал)
G H T S
0
0
0
G0, H0, S0– стандартные значения (р=1 атм, Т = 298 К)
энергии Гиббса, энтальпии и энтропии, все в
кДж/моль; Т – абсолютная температура, К.
Стандартное изменение энергии Гиббса для
реакции образования какого-либо вещества
G
0
обр
RT ln K p
44.
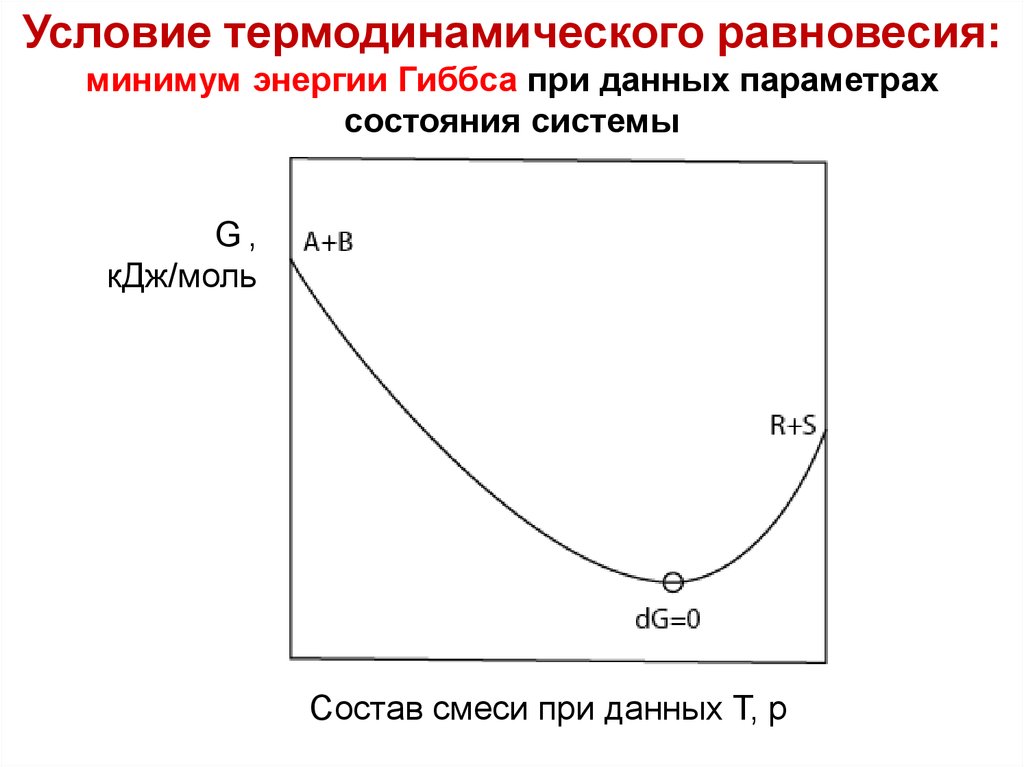
Лекция 6Условие термодинамического равновесия:
минимум энергии Гиббса при данных параметрах
состояния системы
G,
кДж/моль
A B
R S
Состав смеси при данных Т, р
45.
Изменение энергии Гиббса при образовании "термического"Лекция 5
моноксида азота
Сжигание топлива при высоких температурах (Т > 1300
К) сопровождается окислением азота воздуха с образованием
т.н. "термических" оксидов азота.
0.5N 2 0.5O2 NO
Оценим изменение энергии Гиббса для такой реакции,
протекающей при температуре Т = 2000 К
G H T S
0
0
0
ΔG0обр = Δ H0обр(NO) – 0.5 {Δ H0обр(N2) + Δ H0обр(O2)} –
–T {S0(NO) - 0.5 {S0(N2) + S0(O2)} =
(по таблицам)
что позволяет определить константу
равновесия
= 65.060 кДж/моль,
G 0обр RT ln K p
46.
Лекция 5Энергия Гиббса для смеси компонентов
K
G Gk N k
k 1
– энергия Гиббса k-го компонента, Nk – число молей k-го
компонента в системе, K – число химических компонентов в
системе.
Для смесей идеальных газов и идеальных растворов
функция Гиббса k-го компонента задается выражением
Gk Gk T , p RT ln X k
Gk T , p H TS
– энергия Гиббса "чистого" компонента,
R – универсальная газовая постоянная, Xk – мольная
(объёмная) доля k-го компонента.











































 chemistry
chemistry








