Similar presentations:
Свойства растворов электролитов
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 7
СВОЙСТВА РАСТВОРОВ
ЭЛЕКТРОЛИТОВ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Электролитическая диссоциация
Коллигативные свойства растворов электролитов
Сильные и слабые электролиты
Состояние сильных электролитов в растворе
Диссоциация слабых электролитов. Константа
диссоциации
Активность ионов
Теории кислот и оснований
Модуль 2. Лекция 7. Свойства растворов электролитов
3. Электролитическая диссоциация
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭлектролитическая диссоциация
Электролиты - вещества, растворы или
расплавы которых проводят электрический ток
Причиной электропроводности растворов
электролитов является наличие ионов,
образующихся в результате диссоциации
Электролитическая диссоциация – процесс
самопроизвольного распада растворенного
вещества на ионы (положительные – катионы
и отрицательные – анионы)
Модуль 2. Лекция 7. Свойства растворов электролитов
4. Степень диссоциации
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСтепень диссоциации
Степень диссоциации ( ) – отношение количества вещества,
распавшегося на ионы, к общему количеству растворенного
вещества
Степень диссоциации выражают в долях единицы или в процентах
Степень диссоциации зависит от природы растворенного вещества
и растворителя, от температуры и концентрации раствора
– наибольшей степенью диссоциации характеризуются вещества
с ионной связью
– степень диссоциации растворенного вещества тем выше, чем
больше полярность молекул растворителя
– степень диссоциации увеличивается при повышении
температуры, при понижении концентрации раствора
Модуль 2. Лекция 7. Свойства растворов электролитов
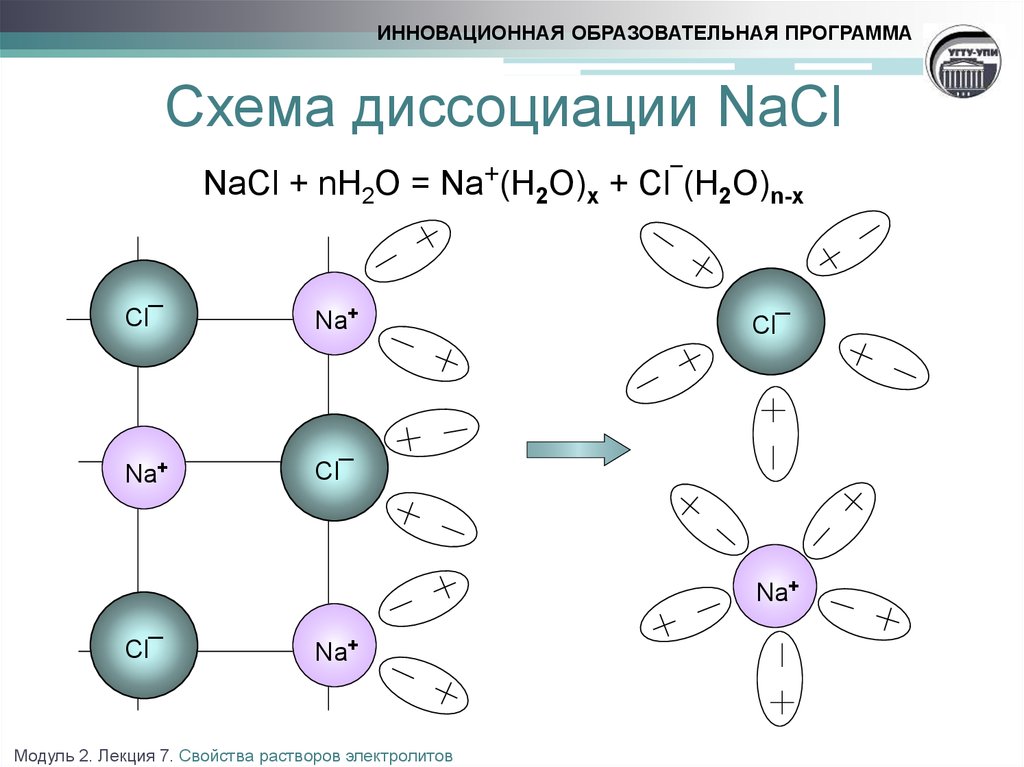
5. Схема диссоциации NaCl NaCl + nH2O = Na+(H2O)x + Cl¯(H2O)n-x
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСхема диссоциации NaCl
NaCl + nH2O = Na+(H2O)x + Cl¯(H2O)n-x
Cl¯
Na+
Na+
Cl¯
Cl¯
Na+
Cl¯
Na+
Модуль 2. Лекция 7. Свойства растворов электролитов
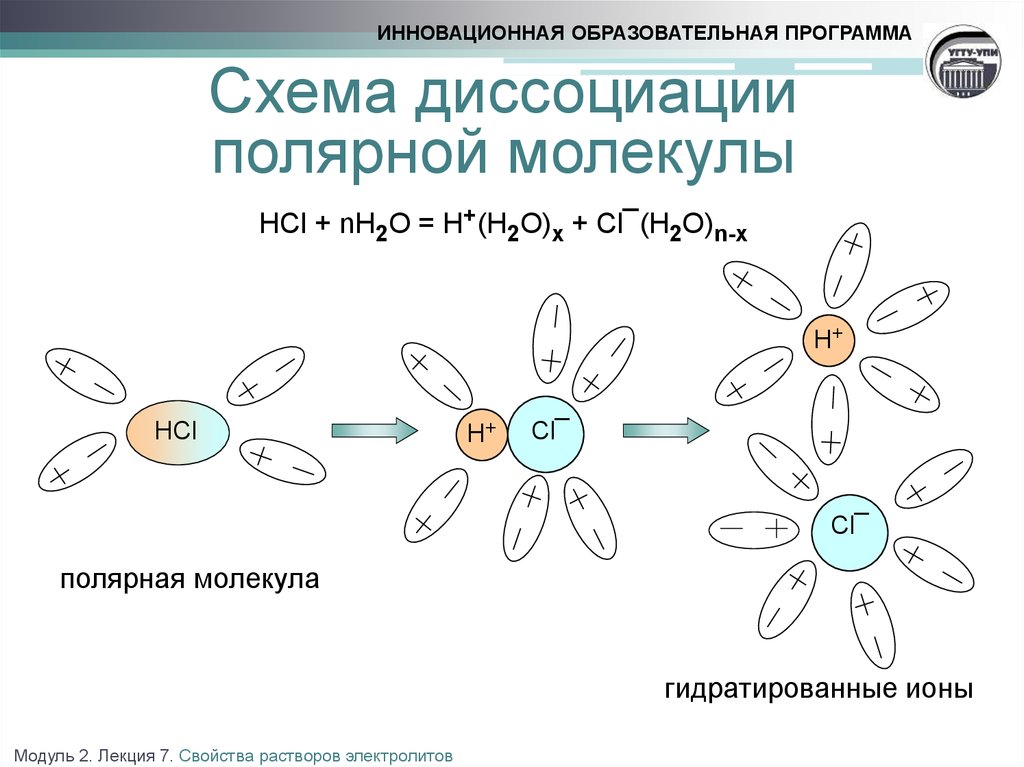
6. Схема диссоциации полярной молекулы HCl + nH2O = H+(H2O)x + Cl¯(H2O)n-x
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСхема диссоциации
полярной молекулы
HCl + nH2O = H+(H2O)x + Cl¯(H2O)n-x
H+
HCl
H+
Cl¯
Cl¯
полярная молекула
гидратированные ионы
Модуль 2. Лекция 7. Свойства растворов электролитов
7. Коллигативные свойства растворов электролитов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКоллигативные свойства
растворов электролитов
Относительное понижение давления насыщенного
пара растворителя над раствором
p0 p
i
p0
0
Понижение температуры кристаллизации раствора
Tкр iK к Cm
Повышение температуры кипения раствора
Tкип iK эCm
Осмотическое давление раствора
pосм iCRT
i - изотонический коэффициент
Модуль 2. Лекция 7. Свойства растворов электролитов
8. Изотонический коэффициент (i)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАИзотонический коэффициент (i)
равен отношению числа находящихся в растворе
частиц (недиссоциированных молекул и ионов) к
общему числу молекул растворенного вещества
Связь изотонического коэффициента со степенью диссоциации
Обозначим C – общее число растворенных молекул электролита
αC – число молекул, распавшихся на ионы
(C – αC) – число молекул, не распавшихся на ионы
n – число ионов, образующихся при диссоциации
nαC – число ионов в растворе
i
C αC nαC
1 α nα
C
Модуль 2. Лекция 7. Свойства растворов электролитов
i 1 α(n 1)
α
i 1
n 1
9. Сильные электролиты
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСильные электролиты
Условно – степень диссоциации которых
в 0,1М растворе > 30%
Большинство солей
Многие неорганические кислоты:
HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 и
другие
Основания – гидроксиды щелочных и
щелочноземельных металлов: LiOH, NaOH,
KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2
Модуль 2. Лекция 7. Свойства растворов электролитов
10. Слабые электролиты
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСлабые электролиты
Некоторые неорганические и большинство
органических кислот:
H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, H2S, HF, HCN,
CH3COOH и другие
Основания (кроме гидроксидов щелочных и
щелочноземельных металлов) и амфотерные
гидроксиды
Помимо перечисленных, свойства слабых
электролитов проявляют также некоторые соли,
например, HgCl2, Fe(NCS)3
Модуль 2. Лекция 7. Свойства растворов электролитов
11. Состояние сильных электролитов в водном растворе
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСостояние сильных
электролитов в водном растворе
Практически полностью диссоциированы на ионы
Al2(SO4)3 = 2Al3+ + 3SO42HNO3 = H+ + NO3-
Ca(OH)2 = Ca2+ + 2OH-
Взаимодействие ионов в растворе (образование так называемой
ионной атмосферы из ионов противоположного заряда, гидратной
оболочки из полярных молекул воды)
Изменение свойств раствора в том же направлении, как
при уменьшении степени диссоциации
Степень диссоциации можно назвать кажущейся,
значения α менее 100 %
Меньше концентрация
раствора
слабее взаимодействие ионов
Модуль 2. Лекция 7. Свойства растворов электролитов
α
100%
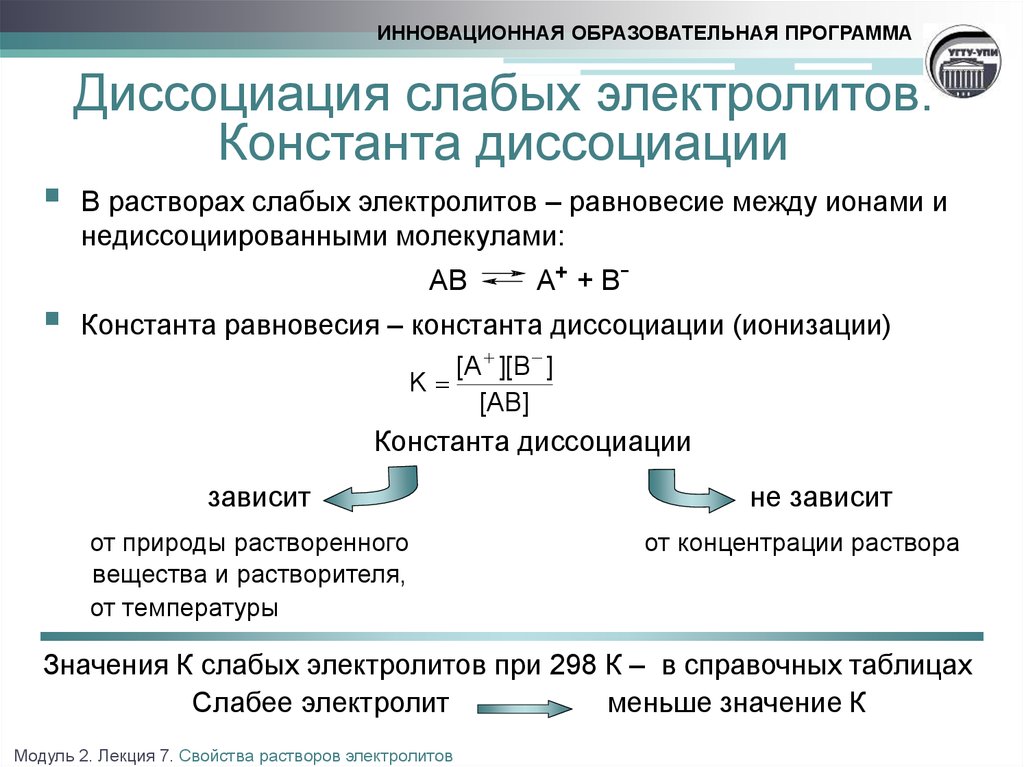
12. Диссоциация слабых электролитов. Константа диссоциации
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАДиссоциация слабых электролитов.
Константа диссоциации
В растворах слабых электролитов – равновесие между ионами и
недиссоциированными молекулами:
AB
A+ + B-
Константа равновесия – константа диссоциации (ионизации)
[A ][B ]
K
[AB]
Константа диссоциации
зависит
от природы растворенного
вещества и растворителя,
от температуры
не зависит
от концентрации раствора
Значения К слабых электролитов при 298 К – в справочных таблицах
Слабее электролит
меньше значение К
Модуль 2. Лекция 7. Свойства растворов электролитов
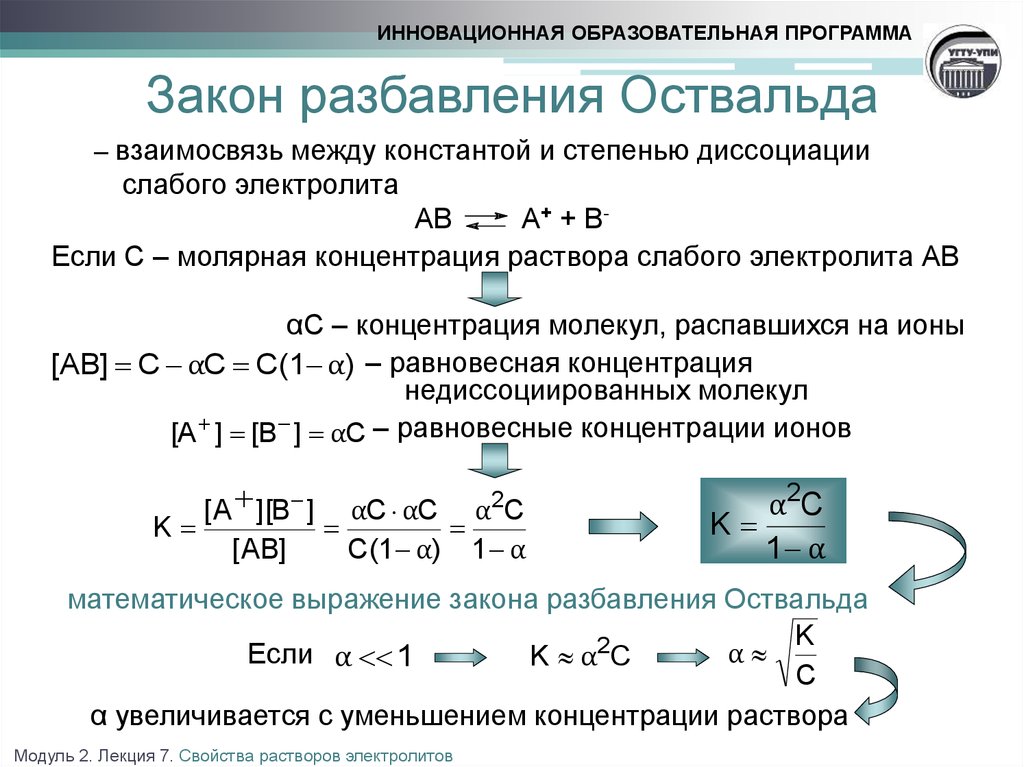
13. Закон разбавления Оствальда
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗакон разбавления Оствальда
– взаимосвязь между константой и степенью диссоциации
слабого электролита
AB
A+ + BЕсли С – молярная концентрация раствора слабого электролита АВ
αС – концентрация молекул, распавшихся на ионы
[AB] C αC C(1 α) – равновесная концентрация
недиссоциированных молекул
[A ] [B ] αC – равновесные концентрации ионов
[ A ][B ] αC αC α2C
K
[ AB]
C(1 α) 1 α
α2C
K
1 α
математическое выражение закона разбавления Оствальда
K
α
Если α 1
K α2C
C
α увеличивается с уменьшением концентрации раствора
Модуль 2. Лекция 7. Свойства растворов электролитов
14. Диссоциация слабых кислот
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАДиссоциация слабых кислот
Кислоты диссоциируют с образованием ионов водорода
CH3COOH
K
CH3COOH
H+ + CH3COO-
[H ][CH3COO ]
1,8 10 5
[CH3COOH]
Многоосновные кислоты диссоциируют ступенчато. Число
ступеней диссоциации равно основности кислоты
I ступень:
H2S
II ступень: HSS2HS-
H+ + HS-
K1H2S
H+ + S2-
2S
KH
2
[H ][HS ]
8,9 10 8
[H2S]
[H ][S 2 ]
[HS ]
средние соли: K2S; BaS
кислые соли: KHS; Ba(HS)2
Модуль 2. Лекция 7. Свойства растворов электролитов
1,3 10 13
15. Диссоциация слабых оснований
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАДиссоциация слабых оснований
Основания диссоциируют с образованием ионов ОHСлабые основания, содержащие несколько ионов ОH-,
диссоциируют по ступеням
I ступень:
Fe(OH)2
FeOH+ + OH-
K1
[FeOH ][OH ]
II ступень:
FeOH+
Fe2+
+ OH-
K2
[Fe(OH)2 ]
[Fe2 ][OH ]
[FeOH ]
6,2 10 5
2,8 10 6
Fe2+
средние соли:
FeOH+
основные соли: FeOHCl, (FeOH)2SO4
Модуль 2. Лекция 7. Свойства растворов электролитов
FeCl2, FeSO4
16. Активность ионов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММААктивность ионов
При описании свойств реальных растворов используют
закономерности, применимые к идеальным и бесконечно
разбавленным растворам, заменяя входящие в них
концентрации компонентов (С) активностями (а)
а = С
- коэффициент активности
Коэффициент активности формально учитывает все
виды взаимодействий частиц в данном растворе
Значение уменьшается с увеличением концентрации
Для предельно разбавленных растворов = 1, т. е. а = С
CH3COOH
H+
+ CH3COO-
Модуль 2. Лекция 7. Свойства растворов электролитов
K
aH aCH COO
3
aCH3COOH
17. Протонная теория кислот и оснований
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПротонная теория кислот и оснований
Предложена Д.Бренстедом
При взаимодействии кислота отдает протон, основание – принимает
Кислота – любая водородсодержащая частица (молекула или ион),
способная быть донором протонов, основание – любая частица,
способная быть акцептором протонов
основание + протон
сопряженные
Реакция нейтрализации
кислота1 + основание2
HF
+
NH3
кислота
кислота2 + основание1
NH4+
+ F-
кислота1 основание2 кислота2 основание1
HF и F- – сопряженные кислота и основание
NH3 и NH4+ –сопряженные основание и кислота
Модуль 2. Лекция 7. Свойства растворов электролитов
18. Протолиз и протолитические равновесия
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПротолиз и протолитические
равновесия
Протолиз – процесс передачи протона от кислоты к основанию
Протолиты – кислоты и основания, соответственно теряющие и
приобретающие протоны
Протонное сродство – энергия, которая выделяется при
присоединении протона к молекуле или иону. Характеризует
кислотно-основные свойства
Основание – частица с бóльшим значением протонного сродства,
кислота – частица с меньшим значением протонного сродства
Протолитическое или кислотно-основное равновесие – ионномолекулярное равновесие, устанавливающееся после передачи
протона
Модуль 2. Лекция 7. Свойства растворов электролитов
19. Кислотно-основные свойства воды
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКислотно-основные свойства воды
Свойства кислоты
H2O + NH3
NH4+ + OHкислота1 oснование2 кислота2 основание1
Свойства основания
HF + H2O
H3O+ + Fкислота1 снование2 кислота2 основание1
Основные свойства ослабевают (протонное
сродство уменьшается) в ряду NH3 – H2O – HF
Модуль 2. Лекция 7. Свойства растворов электролитов
20. Электронная теория кислот и оснований
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭлектронная теория кислот и
оснований
Кислота – акцептор, основание – донор электронов
Амфотерные соединения проявляют свойства как донора, так и
акцептора электронов
Взаимодействие кислоты и основания приводит к образованию
ковалентной связи по донорно-акцепторному механизму
Кислота может не содержать атома водорода, такие кислоты
называют апротонными
F
Н
F Н
FB+ N
FB N
F
кислота
Н
основание
Модуль 2. Лекция 7. Свойства растворов электролитов
F Н
21. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Электролиты (соли, кислоты и основания) при растворении
подвергаются полной или частичной диссоциации. В первом
случае их называют сильными электролитами, во втором –
слабыми
Количественные характеристики процесса диссоциации –
степень и константа диссоциации
Математические выражения коллигативных свойств растворов
включают поправочный множитель – изотонический
коэффициент
При описании свойств реальных растворов принято заменять
концентрации компонентов активностями
Кислотно-основные свойства веществ рассматривают с
различных позиций: теории электролитической диссоциации,
протонной и электронной теорий
Модуль 2. Лекция 7. Свойства растворов электролитов
22. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш.
шк., 1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Модуль 2. Лекция 7. Свойства растворов электролитов


















 chemistry
chemistry








