Similar presentations:
Электросинтез. (Тема 7)
1. Тема 7 «ЭЛЕКТРОСИНТЕЗ».
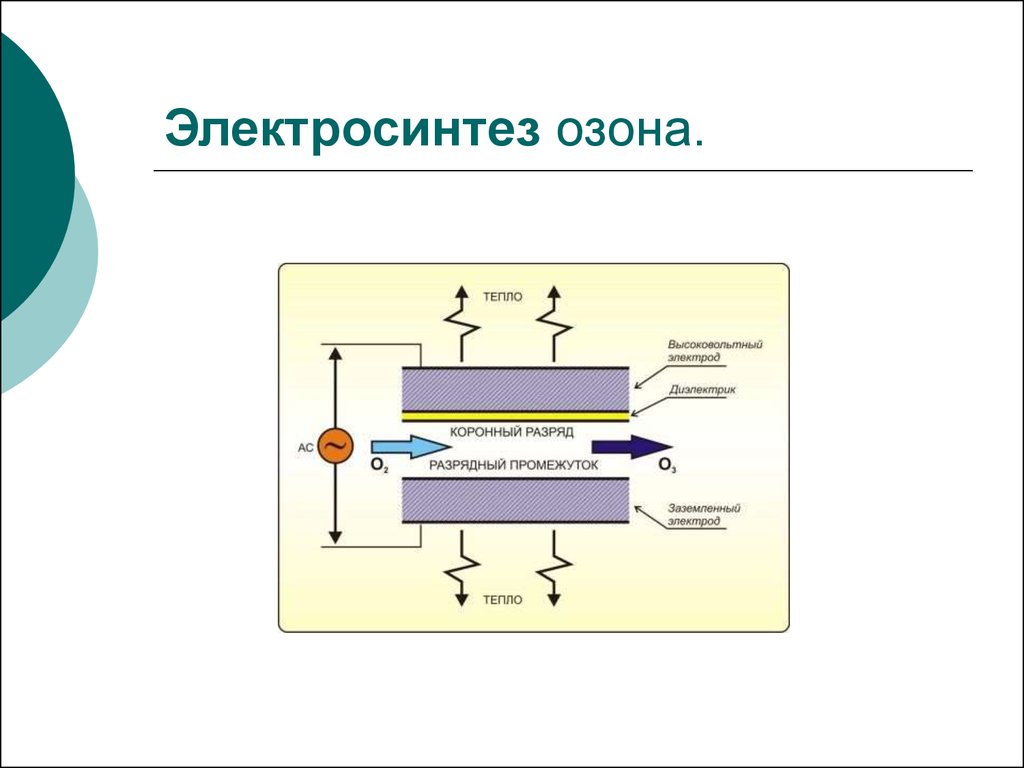
2. Электросинтез озона.
3. Электрохимическое окисление и восстановление
Под электрохимическим синтезом понимаютполучение неорганических и органических
веществ с помощью электролиза.
Особенностью электролиза является
пространственное разделение процессов
окисления и восстановления. На
поверхности положительного электрода
(анода) ионы отдают электроны, т. е.
протекает реакция электрохимического
окисления. На электроде, подключенном к
отрицательному полюсу источника тока
(катоде) происходят присоединение
электронов, т. е. реакция электрохимического восстановления. Процессы
электрохимического синтеза могут протекать
и в объеме электролита в условиях
взаимодействия электродных продуктов.
4. Сущность электросинтеза
Молекулы или ионы веществ, попавшие наповерхность электродов, подвергаются действию
электрических сил, способных производить
глубокие изменения в их структуре. Толщина
приэлектродного слоя, в котором происходит
электрохимическая реакция, составляет примерно
10−8 см.
При потенциале электрода, равном 1 В,
градиент потенциала выразится величиной
106 В/см. Электролиз является мощным средством
воздействия на вещество. Поэтому такие сильные
окислители (хлорная и пероксодисерная кислоты
и их соли – перхлораты, персульфаты) и
восстановители получают успешнее всего
электрохимическим способом.
5. Достоинства электрохимических способов получения веществ
в целом ряде случаев можно проводить процессы,неосуществимые чисто химическим путем, или же достигать
более высоких выходов продуктов, а также осуществлять
реакции в более простых и доступных условиях;
можно проводить реакции окисления и восстановления без
участия неорганических окислителей и восстановителей,
загрязняющих конечный продукт, а, следовательно, и
приводящих к его потере при очистке;
путем изменения условий электросинтеза можно управлять
скоростью и направлением процесса, получая из одного и
того же сырья ряд продуктов, соответствующих различной
степени окисления или восстановления;
применение электрохимических способов во многих случаях
упрощает технологическую схему производства благодаря тому,
что исчезает необходимость в ряде операций, проводимых в
химических синтезах, при этом сокращается количество основной и вспомогательной аппаратуры;
в отличие от ряда способов химического восстановления или
окисления процессы электросинтеза могут проводиться
непрерывно.
6. Недостатки электросинтеза
К числу основных недостатков электрохимическихсинтезов относится большой расход электроэнергии
на единицу выпускаемой продукции, особенно в
процессах получения сильных окислителей и сильных
восстановителей.
Вещество может подвергаться превращению под
действием электрического тока лишь в том случае,
если оно попадает на поверхность электрода, т. е.
электрохимическая реакция протекает не во всем
объеме раствора, а лишь в весьма ограниченном.
Поэтому для переработки одного и того же
количества вещества с помощью электрического тока
требуется большее время, чем при химическом
синтезе. Это является крупным недостатком всех
электрохимических синтезов.
7. Электролизеры.
Аппараты для проведения электросинтезаназываются электролизерами. Корпус лабораторных
электролизеров изготавливают из стекла, некоторых видов
пластических масс: органического стекла, полипропилена,
винипласта, тефлона.
Для поддержания оптимальных параметров
электрохимических реакций на протяжении всего времени их
проведения электролизер снабжают эффективной системой
теплообмена, перемешивания.
Конструкция электролизера должна обеспечивать отбор проб
раствора для анализа, отбор и отвод газообразных продуктов,
а также возможность проведения электрохимических реакций
в периодическом или непрерывном режимах.
8. Электролизеры периодического или непрерывного режимов
В первом случае постоянный ток пропускают черезэлектролит до тех пор, пока все исходное вещество
или определенная часть его не восстановится или не
окислится в целевой продукт. Затем электролит
сливают, заполняют свежей порцией электролита и
исходного вещества, и вновь проводят электролиз.
В непрерывном процессе католит и анолит
необходимого состава подают в ячейку с постоянной
скоростью, и равные количества непрерывно выводят
для поддержания постоянного состава раствора в
электролизере. Это обеспечивает лучший контроль
состава электролита, что улучшает в свою очередь
селективность процесса и обеспечивает более
высокие выходы потоку.
9. Электролизер СЭУ-40 в комплекте с основным оборудованием.
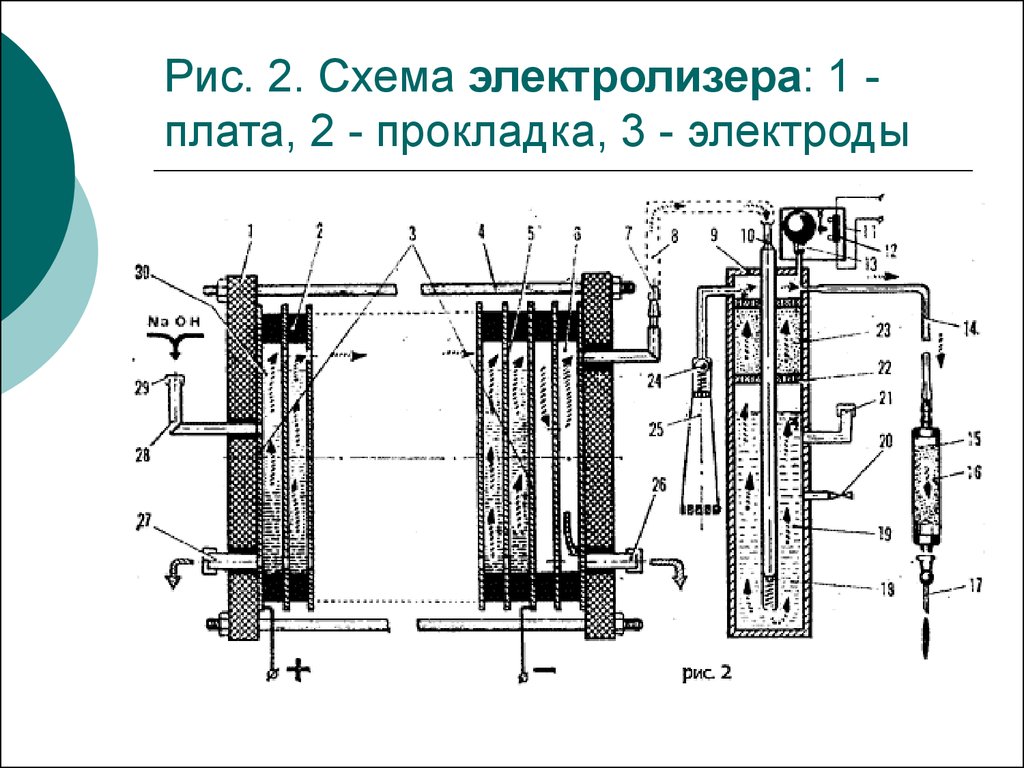
10. Рис. 2. Схема электролизера: 1 - плата, 2 - прокладка, 3 - электроды
Рис. 2. Схема электролизера: 1 плата, 2 - прокладка, 3 - электроды11. Бытовой электролизер активатор воды Ива
12. Производительность электролизера
характеризуется силой пропущенного черезсистему тока или плотностью тока. Чем выше сила
тока, пропускаемого через электролизер, тем
больше продукта можно получить в единицу
времени, т. е. тем выше производительность
электролизера.
Отношение силы проходящего электрического тока
через электролизер к величине поверхности
электрода называется плотностью тока.
Величина плотности тока характеризует
количество продукта, получаемого с единицы
поверхности электрода, т. е. в конечном счёте,
производительность электролизера. Поэтому, если
повышение плотности тока не влечет за собой
падения выхода продукта, электросинтез проводят
при максимально высокой плотности тока.
13. Селективность Электролизера
При электросинтезе на электроды накладываютсяопределенные потенциалы, которые стараются
сохранить постоянными в течение всего синтеза, т. к.
образование целевого продукта электрохимического
синтеза происходят в определенной, иногда очень узкой
области потенциалов электрода.
Изменение плотности тока для увеличения выхода
продукта возможно лишь в тех пределах, которые
соответствуют поляризации электродов до потенциалов,
лежащих в этой оптимальной области. При выходе за эти
пределы начинаются другие нежелательные реакции –
дальнейшее окисление и восстановление конечных
продуктов, разложение растворителя, депассивация и
растворение анода и т. д.
Естественно, что все это снижает селективность
электрохимической реакции и выход целевого продукта.
14.
При электролизе ток, пропускаемый черезэлектролизер, может расходоваться на
несколько параллельных электрохимических
реакций. Например, при электролизе водных
растворов основным реакциям сопутствует
реакция разложения воды на
кислород и водород.
Следовательно, пропускаемый через
электролит ток распределяется между
несколькими процессами, протекающими на
данном электроде одновременно:
I = i1 + i2 + i3 + … + in
где I – ток, проходящий через электролизер;
i1, i2,...in – ток, расходуемый в единицу
времени на параллельные реакции.
15. Выход по току
Чтобы учесть эффективность использования,пропущенного через электролизер количества
электричества на образование конечного продукта,
рассчитывают выход по току.
Выход по току – отношение количества электричества,
теоретически необходимого для получения продукта (по
закону Фарадея), к практически затраченному
количеству. Иногда выход по току рассчитывают по
отношению количества полученного в результате
реакции целевого продукта к тому количеству, которое
согласно теории, должно было образоваться при данной
загрузке исходного вещества. Последнюю величину
называют также выходом по веществу. Выход по
веществу характеризует селективность
электрохимической реакции.
16. Диафрагмы.
Часто, когда требуется исключить взаимодействиепродуктов электролиза, образующихся на аноде и катоде, а
также предотвратить участие исходных веществ в реакциях
на электроде противоположного знака, в электролизере
устанавливают пористую перегородку-диафрагму,
разделяющую его на два пространства – анодное и
катодное.
Раствор, заливаемый в анодное пространство, называют
анолитом, в катодное – католитом. Диафрагмы бывают
погруженными и фильтрующими.
Диафрагмы первого типа действуют без направленного
через них потока электролита и предназначены для
предотвращения переноса раствора из одного электродного
пространства в другое и смешения продуктов электролиза
и исходных веществ. Предотвратить изменение состава
раствора вследствие миграции ионов под влиянием
электрического поля с помощью таких диафрагм не
удается.
17. Примеры погруженных диафрагм
Для разделения водорода и кислородапри электролизе воды применяют
погруженные пористые диафрагмы в виде
ткани из устойчивого в щелочах
длинноволокнистого асбеста. При электролизе растворов хлороводородной
кислоты хлор и водород
разделяют с помощью диафрагмы из
поливинилхлоридной ткани.
18. Фильтрующие диафрагмы
Фильтрующие диафрагмы предназначены дляпредотвращения переноса ионов под действием
электрического тока. Это достигается созданием потока
электролита в направлении, противоположном миграции
иона. Фильтрующие диафрагмы относятся к
крупнопористым, т. к. через поры должны проходить не
только ионы, но я сам электролит. Наибольшее
распространение фильтрующие диафрагмы получили в
производстве хлора и гипохлорита электролизом
растворов хлора с твердым катодом.
Диафрагмы должны обладать хорошей химической
стойкостью и достаточной механической прочностью.
Материалами для их изготовления служат асбест,
керамика, пластмассы. В некоторых случаях
используются ионообменные диафрагмы или мембраны,
обладающие способностью селективно пропускать ионы
одного знака и препятствовать движению
противоположно заряженных ионов.
19. Электролиты.
Большое значение для осуществления электрохимическогопроцесса имеет правильный выбор электролита.
Электролит должен обладать более высокой удельной
электропроводностью, чтобы уменьшить потери
напряжения в электролизере на преодоление сопротивления
электролита.
Состав электролита должен обеспечивать при проведении
электролиза разряд на электродах определенных ионов с
получением требуемого продукта и предотвращать или
ограничивать возможность разряда других ионов, снижающих
коэффициент полезного использования тока в процессах
электросинтеза.
Электролит должен обладать минимальной агрессивностью по
отношению к материалам, из которых изготовлена
аппаратура, и сохранять стабильность своих характеристик на
протяжении длительного периода электролиза.
20. Выбор электролита
Выбор электролита в некоторых случаях решается легкои однозначно. В этих случаях электролит служит
одновременно исходным веществом для получения целевого
продукта. Так при получении хлора и щелочи в качестве
электролита применяют водные растворы хлорида натрия
или хлорида калия.
Основным требованием к электролиту в этом случае
является преимущественное по сравнению с растворителем
участие ионов в реакциях электрохимического окисления
или восстановления.
Выход по току в этом случае определяется долей тока,
расходуемой на превращение иона электролита в целевой
продукт. Эта доля тока определяется соотношением
потенциалов окисления или восстановления ионов
электролита и потенциалов, при которых происходит
разложение растворителя. В общем случае потенциал
окисления аниона должен быть более отрицателен, а
потенциал восстановления катиона – более положителен,
чем соответствующие потенциалы окисления и
восстановления растворителя.
21.
Вместе с тем известны примеры, когда окислениеили восстановление ионов электролита протекает
соответственно при более положительных или более
отрицательных значениях потенциалов, чем
значения, при которых происходит разложение
растворителя в отсутствие исходного вещества.
При электрохимическом восстановлении или
окисление одного иона электролита. Например, в
катодных реакциях выбор катиона имеет
первостепенное значение, а анион обычно
выбирают на основании растворимости соли и
способности аниона увеличивать растворимость
исследуемого электролита. Если для
электрохимического окисления не нужен
окисляющийся анион, то выбирают какой-либо
трудноокисляемый анион: перхлорат,
тетрафторборат, гексафторфосфат или нитрат.
22. Выбор концентрации электролита
Концентрацию исходного электролита выбирают,руководствуясь в основном двумя соображениями –
выходом продукта реакция и удельной
электропроводностью раствора.
Иногда электропроводность электролита возрастает с
увеличением его концентрации до определенного
значения, а затем падает с повышением концентрация.
Такая зависимость наблюдается при применении в
качестве электролита NaOH, КОН, H2SO4, HClO4 и других
веществ с высокой растворимостью в воде.
Для соединений с ограниченной растворимостью в воде
часто состояние насыщения раствора достигается
раньше, чем оптимальная проводимость (например, КСl,
NaCl). Для электролиза применяют растворы, имеющие
оптимальные и возможно более высокие концентрации.
23. Инертные добавки для увеличения электропроводности электролита
Иногда по условиям технологического процесса электролизудолжен подвергаться электролит с низкой концентрацией ионов,
разряжающихся на электродах и вступающих затем в реакции
анодного окисления или катодного восстановления. В этих
случаях в состав электролита вводят инертные добавки для
увеличения электропроводности электролита.
Например, при окислении хлората в перхлорат натрия в
присутствии добавок фторидов, которые влияют на электродный
потенциал и сдвигают его значение в область, оптимальную для
образования данного продукта.
Кроме того существуют добавки, придающие электродам
каталитические свойства, подавляющие побочные
электрохимические реакции выделения водорода на катоде и
кислорода на аноде, подавляющие другие нежелательные
реакции.
Все добавки, оказывающие влияние на параметры
электрохимической реакции, вводятся в малых количествах – от
долей грамма до нескольких граммов на литр
подвергаемого электролизу раствора.
24. Фоновый электролит
Если исходное вещество не является электролитом, то егоэлектрохимическое превращение возможно только в присутствии
электролита, называемого фоновым.
Концентрация фонового электролита и его природа
определяются электропроводностью раствора, влиянием
фонового электролита на растворимость исходного вещества,
устойчивостью промежуточных и конечных продуктов
электролиза. В отличие от электролитов, являющихся
одновременно исходными веществами, фоновые электролиты не
должны участвовать в реакциях окисления или восстановления,
протекающих на электродах.
Например, хлорная кислота может быть использована как
фоновый электролит при электрохимическом синтезе озона,
протекающем при высоких положительных потенциалах:
3H2O = O3 + 6H+ + 6ē. Глубокое окисление молекулярного хлора
0,5Cl2 + 4H2O = HClO4 + 7H+ +7ē и хлороводородной кислоты
HCl + 4H2O = HClO4 + 8H+ + 8ē
возможно только при поляризации анода до высокого
положительного потенциала, а это в свою очередь возможно на
фоне устойчивого и хорошо проводящего ток электролита.
Таким фоновым электролитом является хлорная кислота.
25. Растворители.
Существенная роль в создании электропроводящей системыдля электросинтеза принадлежит растворителю. Природа
растворителя оказывает влияние и на направление
электрохимических реакций. Выбор растворителя
определяется выполняемой им ролью в электрохимических
реакциях.
Если растворитель является одновременно компонентом
реакционной смеси, он должен окисляться или
восстанавливаться в области потенциалов,
соответствующих образованию целевых продуктов реакций.
Если же растворитель используется в целях создания среды
для проведения электрохимической реакции, то он должен
сохранять инертность и не участвовать в этих реакциях в
области потенциалов, при которых происходят окисление
или восстановление. Кроме того растворитель должен
хорошо растворять исходное вещество с образованием
достаточно концентрированных растворов, обеспечивать
легкое отделение полученных веществ по окончании
электролиза.
26. Характеристики растворителей
Одной из характеристик растворителя являетсядиэлектрическая проницаемость ε, она влияет на
электропроводимость среды.
Растворители можно грубо разделить на 3 группы:
растворители с высокой диэлектрической проницаемостью
(ε > 60; вода, формальдегид);
растворители со средним значением ε (20 < e < 50;
метанол, ацетонитрил (CH3CN), аммиак);
растворителя с низким значением ε (ε < 13; уксусная
кислота, метиламин).
Растворители с очень низким значением диэлектрической
проницаемости не могут использоваться в качестве среды
для проведения электрохимических реакций.
Лучшими являются растворители с высоким значением ε,
поскольку в них неорганические, вещества лучше
растворяются и лучше диссоциируют. Растворители с точки
зрения протон донорной активности можно
классифицировать на протонные и апротонные.
27. Протонные и апротонные
К первым относятся растворители, способные кобразованию водородных связей с анионами.
Протонные растворители могут классифицироваться и
по иному принципу, например, на гидроксидные (вода,
спирты), протогенные (кислоты, значительно более
сильные, чем вода), протофильные (основания,
значительно более сильные, чем вода).
Апротонные растворители имеют водород, но не
обладают достаточно ярко выраженными кислотными
или основными свойствами. Таким образом, при выборе
растворителя следует учитывать диэлектрическую
проницаемость растворителя и способность его
взаимодействовать с ионами электролита или
исходного вещества.
28. Неводные растворители
Обычно в качестве растворителя используют воду,в которой хорошо растворимы различные
электролиты, исходные вещества и продукты
реакции.
Круг неводных растворителей ограничен жидким
фтороводородом и аммиаком. Жидкий
фтороводород используется одновременно как
растворитель и как источник фтора в реакциях
электрохимического фторирования.
Сам по себе жидкий фтороводород имеет
незначительную электропроводность, поэтому в
систему вводят соединения, повышающие его
электропроводность, например, фториды
щелочных металлов. Жидкий фтороводород
применяют в процессах получения пентафторида
хлора, сульфурилфторида, фторида азота, а также
фтора.
29. Жидкий аммиак
Растворителем при электрохимическомполучении химических продуктов может
служить и жидкий аммиак. Однако
использование аммиака в качестве
растворителя затруднено из-за неудобной
для работы области температур, в которой
аммиак находится в жидком состоянии
(от –77,78 С до –33,4 С).
Жидкий аммиак в некоторых случаях
является одновременно и исходным
веществом, например при электрохимическом
получении гидразина. В жидком аммиаке
электролизу подвергаются растворы
галогенидов, например бромида калия,
хлорида натрия.
30. Расплавы
Часто расплавы используются при полученииметаллорганических соединений. Например,
расплав NaCl–СH3AlCl3, обладающий высокой
удельной электропроводностью, может быть
использован для получения органических
соединений олова, ртути, свинца.
Напряжение разложения для ионов СН3 в данном расплаве ниже, чем для ионов хлора,
что дает возможность при электролизе с
соответствующими анодами получать
металлорганические соединения с
удовлетворительными выходами.
Расплавы комплексов типа NaF∙Al(С2Н5)3,
KF∙2Al(C2H5)3, NaAl(C2Н5)4, KAl(C2H5)4
используются также в качестве систем для
получения металлорганических соединений.
31. Электроды
Материал и конструкция электродов определяютнаправление и селективность электрохимического
процесса, напряжение на электролизере и удельный
расход электроэнергии.
В каждом процессе предъявляются свои
специфические требования к электродам.
Однако все электроды должны удовлетворять ряду
общих требований:
материал для изготовления электродов должен
обладать хорошей электропроводностью,
высокой каталитической активностью и
селективностью по отношению к целевой
электрохимической реакции,
достаточной механической прочностью,
сохранять свои свойства при длительной
эксплуатации.
32. Электрохимический синтез на анодах
Многообразие анодных процессов принятоделить на две большие группы – процессы,
протекающие на растворимых и
нерастворимых анодах. Однако и в том, и в
другом случаях на анодах протекают реакции
электрохимического окисления, которые можно
разделить на несколько типов.
К первому типу можно отнести реакции, в
которых происходит лишь изменение
заряда иона:
[Fe(CN)6]4− = [Fe(CN)6]3−+ ē.
Электрохимические реакции второго типа
сопровождаются изменением состава ионов
или молекул:
Mn2+ + 4H2O = MnO4− + 8H+ + 5ē,
HCl + 4H2O = HClO4 + 8H+ + 8ē.
33. Нерастворимые аноды.
Использование нерастворимых анодов дляэлектрохимического синтеза неорганических
веществ является наиболее сложной проблемой.
Нерастворимый анод должен сохранять свои
свойства в исключительно жестких условиях
эксплуатации – агрессивные среды, повышенные
температуры, высокие положительные потенциалы.
За исключением щелочных, щелочноземельных и
некоторых активных металлов III группы
Периодической системы, все металлы являются
потенциальными материалами для анодов.
При поляризации в средах, содержащих
кислородные соединения, на аноде выделяется
кислород, в результате чего поверхность всех
металлов (исключение составляет золото)
покрывается оксидами. Оксидная пленка
предохраняет некоторые металлы от дальнейшего
окисления, и они сохраняют стабильность свойств
при электролизе. Это позволяет использовать их в
качестве анодных материалов.
34. Металлы и сплавы в качестве нерастворимых анодов
Таких металлов очень мало. Это металлыплатиновой группы, а в щелочных средах
еще никель и материалы на основе железа,
например, нержавеющая сталь.
Аноды на основе платины и ее сплавов
применяются для синтеза при низких и особенно
при достаточно высоких положительных
потенциалах.
Для ряда синтезов в качестве анода
применяют титан, покрытый оксидами
рутения.
В некоторых процессах могут применяться
аноды из индивидуальных оксидов марганца,
железа, кобальта, никеля.
К достаточно селективным анодам относятся
композиционные аноды, активный слой
которых состоит из оксидов двух или более
металлов.
35. Графитовые электроды
Одним из самых широко используемых в электролизеэлектродных материалов является графит. Он
удовлетворяет большинству требований: высокая
электропроводность, приближающаяся к
металлической, стойкость к химическим
воздействиям, стабильность характеристик при
анодной поляризации, невысокая стоимость.
Недостатки: износ в процессе электролиза, который
происходит из-за окисления углерода кислородом или
окислителями, образующимися в процессе электролиза
или присутствующими в электролите, например,
гипохлоритом, хлоратом, бихроматом.
На нерастворимых анодах из графита,
платинированного титана, магнетита, оксида свинца
(IV), оксида палладия (IV) могут быть получены при
электролизе соединения галогенов – гипохлориты, хлораты,
хлорная кислота, перхлораты, кислородные соединения
фтора, брома, иода, некоторые некислородные
соединения галогенов.
36. Электролиз водных растворов хлоридов
Так при электролизе чистых водных растворовхлоридов щелочных металлов на аноде происходит
разряд ионов хлора с образованием хлора
2Cl−= Cl2 + 2ē.
Одновременно на аноде протекает процесс разряда
молекул воды
H2O = 0,5O2 + 2H+ + 2ē.
Относительные скорости выделения на аноде хлора и
кислорода зависят от условий процесса электролиза
(материала анода, рН электролита, концентрации
хлорида металла, плотности тока, температуры
процесса).
Повышенное перенапряжение выделения кислорода
(по сравнению с перенапряжением для хлора)
практически на всех анодных материалах позволяет
получить хлор высокой концентрации.
37. Катодный процесс
На катоде протекает реакция2H2O + 2ē = H2 + 2OH−
Если обеспечить достаточно интенсивное
перемешивание слоев электролита,
прилегающих к аноду и катоду, то
возможно образование гипохлорита по
реакциям:
Cl2 + H2O = HClO + HCl,
HCl + HClO + 2OH− = 2H2O + Cl− + ClO−
Суммарно процесс может быть выражен
уравнением
Cl− + H2O = H2 + ClO−
38. Получение гипохлорита
Получение гипохлорита в этом случаепроисходит в результате химического
взаимодействия электродных продуктов.
Частично гипохлорит может быть получен и
вследствие одновременного разряда ионов Cl−
и ОН− (или воды) на аноде
Cl− + 2OH− = ClO− + H2O + 2ē.
На каждую молекулу Cl2 выделяется два иона
ОН−, то щелочь сдвинет равновесие реакции
гидролиза хлора вправо и хлор выделяться не
будет. Таким способом можно получить
разбавленные растворы гипохлорита натрия
и других металлов.
При увеличении концентрация ионы ClO−
начинают окисляться на аноде с
образованием хлорат-ионов
ClO− + 2H2O = ClO3 − + 4H+ + 4ē.
39.
Хлораты образуются также в результатепротекающей в объеме реакции дисмутации
ионов гипохлорита
3ClO− = ClO3 − + 2Cl−.
Доли соответственного электрохимического и
химического процессов окисления
гипохлорита в хлорат зависят от условий
проведения электролиза.
На катоде протекают процессы восстановления
гипохлорит и хлорат-иона:
ClO− + H2O + 2ē = Cl− + 2OH−,
ClO3− +3H2O + 6ē = Cl− + 6OH−.
Для снижения скорости этих реакций к раствору
добавляют соли, образующие на катоде
пористые пленки, затрудняющие подвод ионов
ClO− и ClO3− к поверхности катода.
В качестве таких добавок могут применяться
соли хрома, кальция, магния, ванадия.
40.
На платиновых, магнетитовых, оксидносвинцовых анодах в определенныхусловиях возможно дальнейшее окисление
полученного хлората до перхлората:
ClO3− + H2O = ClO4 − + 2H+ + 2ē.
На графитовых анодах не достигается
потенциала, необходимый для протекания
последней реакции, процесс окисления
хлората до перхлората практически не идет.
ВЫВОДЫ: меняя условия электросинтеза
(электроды, концентрацию электролита,
добавки к электролиту, плотность тока и
др.), можно из одних и тех же реагентов
получить различные продукты.
41. Получение пероксодисерной кислоты
Большое теоретическое и прикладное значениеимеет получение пероксодисерной кислоты, ее
солей и пероксида водорода.
На механизм образования пероксодисерной
кислоты и пероксодисульфата аммония
существует несколько точек зрения.
По одной из них на аноде происходит
разряд ионов SO42− или HSO4−:
2SO42– = 2SO4− + 2ē,
2SO4 − = S2O82−
или
2HSO4 − = 2HSO4 + 2ē,
2HSO4 = H2S2O8.
42. Факторы влияния
На процесс образования пероксодисернойкислоты влияют следующие факторы: состав
электролита, добавки и примеси в электролите,
плотность тока, температура электролита и
материал анода.
Анодные материалы должны обладать высокой
коррозионной стойкостью, высоким
перенапряжением выделения кислорода и
отличаться низкой прочностью связи
адсорбированных радикалов SO4 − или HSO4 с
поверхностью электрода. Только платина
отвечает этим требованиям. Выход по току
пероксодисерной кислоты на платине составляет
70–75 %.
Однако, одновременно с образованием H2S2O8
на аноде происходят выделение кислорода
H2O = 0,5O2 + 2H+ + 2ē,
а на катоде образование водорода
2H3O+ + 2ē = H2 + 2H2O.
43. Побочные реакции
Одновременно с образованием H2S2O8 на анодепроисходят выделение кислорода
H2O = 0,5O2 + 2H+ + 2ē,
а на катоде образование водорода
2H3O+ + 2ē = H2 + 2H2O.
Пероксодисерная кислота в присутствии воды и серной
кислоты подвергается гидролизу с образованием
монопероксодисерной кислоты H2SO5:
H2S2O8 + H2O = H2SO5 + H2SO4.
Последняя окисляется на аноде
H2SO5 + H2O = H2SO4 + O2 + 2H+ + 2ē
и подвергается гидролизу в растворе
H2SO5 + H2O = H2SO4 + H2O2.
Гидролиз кислоты H2SO5 начинается тогда, когда
полностью произойдет гидролиз H2S2O8. После накопления
80–90 % кислоты начинается образование пероксида
водорода.
44. Получение Н2O2, (NH4)2S2O8
Скорость образования H2O2 повышается сувеличением температуры, однако при этом
растет скорость разложения Н2O2, H2SO5 и H2S2O8.
Одной из причин является наличие в растворе
примесей катализаторов.
Электрохимически пероксид водорода получают
как вторичный продукт в результате
гидролиза не только пероксодисерной кислоты,
но и ее солей, в частности, пероксодисульфата
аммония.
При получении пероксодисульфата аммония
уменьшение содержания серной кислоты в
электролите увеличивает выход по току.
Образование пероксодисульфата происходит по
схеме:
2SO4 2− = S2O82− + 2ē,
S2O8 2− + 2NH4 + = (NH4)2S2O8.
45. Растворимые аноды
Растворимые аноды используются в реакциях,протекающих с образованием продуктов, в состав
которых входит материал анода. Электролиз с
растворимыми анодами применяется в
процессах электросинтеза для получения
неорганических окислителей и
металлорганических соединений.
Если нерастворимые аноды должны сохранять
пассивные свойства в областях
потенциалов, при которых протекает процесс
электрохимического окисления, то растворимые
аноды, наоборот, не должны пассивироваться.
Выбор условий электролиза производится с
учетом поддержания анода в активном
состоянии. Активное состояние анода
зависит от:
от состава подвергаемого электролизу
раствора,
анодной плотности тока и температуры.
46. Металл - растворимый анод
В качестве растворимого анода может бытьиспользован марганец и его сплавы,
например, в процессе электросинтеза
перманганата калия:
Mn + 8OH− = MnO4− + 4H2O + 7ē.
Растворение анода может прекращаться
вследствие пассивации за счет образования
на поверхности пленки оксида марганца
(IV). В качестве материала растворимого анода
используется не дефицитный металлический
марганец, а его сплавы.
Во избежание пассивации поддерживают
определенную плотность тока (1,5–4,5 кА/м2 )
и пониженную температуру (15–30 0С).
47. Получение оксидов с раст. анодом
Растворимый анод может бытьиспользован для получения оксидов
некоторых металлов. Так, оксид меди (I),
применяемый в качестве наполнителя
лаков и красок, может быть получен
электролизом концентрированных,
щелочных растворов хлорида натрия при
повышенной температуре (до 80 0С) с
медным анодом, на котором протекает
электрохимическая реакция:
2Cu + 2OH− = Cu2O + H2O + 2ē.
Исходный раствор должен содержать
до 800 г/л хлорида натрия.
48.
Оксид меди (I) может быть получен и приэлектролизе более разбавленных растворов
хлорида натрия (175 г/л) при рН = 10,
содержащих в качестве добавки 0,025 г/л
желатина. Если раствор не подщелачивать, то
при электролизе может образовываться оксид
меди (II) вместе с некоторым количеством
оксида меди (I).
Электрохимический синтез оксида ртути (II)
протекает при электролизе водных растворов
карбоната или гидроксида калия, гидроксида
натрия, а также смесей этих веществ с
хлоридом калия. Механизм реакции синтеза
оксида ртути (II):
Hg + 2OH− = HgO + H2O + 2ē.
49. Синтез металлборанов
Серебро, цинк, кадмий, медь могутбыть использованы в качестве
растворимых анодов при
электросинтезе металлборанов.
Процесс протекает при электролизе
неводных растворов, содержащих
бороводородные анионы, в
ацетонитриле(CH3CN ),
метилхлориде(хлорметан, фреон 40)
СН3Сl ) и этаноле в присутствии
трифенилфосфора(C18H15P):
Me + B3H8 = Me(B3H8).
50. Электрохимический синтез на катодах
Электрохимический синтез неорганическихсоединений на катоде получил значительно
меньшее применение, чем окисление на
аноде, т.к. в большинстве случаев
химические процессы восстановления
оказываются дешевле электрохимических.
В качестве катодов обычно используют
металлы и графит.
В подавляющем большинстве
электрохимических процессов в качестве
растворителя используется вода, и поэтому на
катоде идет разряд ионов водорода или молекул
воды с выделением газообразного водорода.
51.
Потенциал катода зависит отприроды металла, свойств
электролита, величины
перенапряжения выделения
водорода.
(Что это?)
52. Ответ: Поляризация и перенапряжение
При самопроизвольных процессах устанавливаетсяравновесный потенциал электродов. При прохождении
электрического тока потенциал электродов изменяется.
Изменение потенциала электрода при прохождении тока
называется поляризацией:
E = Ei – Ep,
где E – поляризация;
Ei – потенциал электрода при прохождении тока;
Ep – равновесный потенциал.
Термин «поляризация» употребляют как для обозначения
величины изменения потенциала, так и самого явления
изменения потенциала при прохождении тока.
Различают анодную ( Eа) и катодную поляризацию
( Eк). Если известны причины изменения потенциала,
например, катодное выделение водорода, то изменение
потенциала называют перенапряжением.
Для экспериментального определения поляризации строят
кривую зависимости потенциала электрода от
протекающего через электрод тока. Поскольку электроды
могут быть разной площади, то скорость процесса относят к
единице площади поверхности, которая называется
плотностью тока (i):
i = I/S [A/см2]
53.
Активность металлов в реакции выделенияводорода определяется энергией связи Me–Н.
Чем выше энергия связи Me–Н, тем больше
металл катализирует процесс выделения
водорода, тем меньше на нем
перенапряжение.
Перенапряжение водорода на электроде при
восстановлении в протонном растворителе
определяет, сколь отрицательным может
быть потенциал, пока не начнется
восстановление среды (воды),
конкурирующее с восстановлением вещества.
54.
Водородное перенапряжение вызвано замедленнымэлектрохимическим выделением водорода; реакция включает
следующие стадии:
H3O+ + ē = Hадс. + H2O; (I)
Hадс. + H3O+ + ē = + H2 адс + H2О; (II)
H2 адс. = H2. (III)
Cтадия (I) является медленной на металлах с высоким
водородным перенапряжением. Это означает, что на
поверхности этих металлов нет адсорбированных атомов
водорода в заметном количестве, и на таких катодах
восстановление происходит путем перехода электрона
непосредственно на восстанавливаемое вещество, минуя стадий
образования адсорбированных атомов водорода.
На электродах с низким водородным перенапряжением
медленной считается стадия (II). Следовательно, поверхность
катода сильнее покрыта адсорбированным атомарным водородом.
Восстановление на таких электродах протекает по
электрокаталитическому механизму.
Высоким перенапряжением отличаются ртуть, свинец,
кадмий, цинк, олово. Выделение водорода на этих металлах
идет при очень отрицательных потенциалах, что делает
возможным восстановление трудновосстанавливаемых
неорганических соединений.
Особое место занимает ртуть. Очень высокое перенапряжение
водорода и способность образовывать соединения с металлами
создают предпосылки для выделения при электролизе на ртути
в виде амальгам очень многих металлов.
55. Синтез на ртутных катодах
Ртутный катод используется в промышленных масштабахпри производстве гидроксида натрия. На катоде идут два
параллельных процесса: основной – выделение натрия с
образованием амальгамы и побочный – выделение
водорода.
Последний процесс идет с большим перенапряжением, в
то же время разряд ионов натрия – практически без
перенапряжения. Разложение образовавшейся
амальгамы натрия позволяет получать
концентрированные растворы NaOH высокой степени
чистоты.
На ртутном катоде в ванне с диафрагмой получают
электровосстановлением азотной кислоты в
сернокислотной или солянокислой средах
гидроксиламин:
2HNO3 + 2H2O + H2SO4 + 12ē = (NH2OH)2∙H2SO4 + 3O2
или
HNO3 + 7HCl + 6ē = NH2OH∙HCl + 3Cl2 + 2H2O.
56.
К металлам со средним перенапряжениемводорода относят железо, кобальт, никель,
серебро, титан, цирконий, ниобий, тантал.
Тантал и цирконий применяют в качестве
катодов при электролизе растворов, содержащих
окислители, восстановление которых
необходимо избежать.
Стальные катоды используются в
производстве неорганических прод. – водорода
и кислорода, хлора и щелочи, гипохлоритов,
хлоратов, хлорной кислоты, перборатов.
Нержавеющая сталь – в виде катода при
получении дитионата натрия. Na2S2O4 –
сильный восстановитель, применяемый при
крашении тканей, синтезе красителей, в
пищевой и фармацевтической промышленности.
57. Получение дитионата натрия
Электрохимически дитионат натрия получаютпутем катодного восстановления водного
раствора SO2 в электролизере с катионитовой
диафрагмой. При электролизе происходят
следующие реакции на катоде:
4SO2 + 4ē = 2S2O42−,
на аноде выделяется кислород:
4NaOH = 4Na+ + O2 + 2H2O + 4ē.
Ионы натрия проникают в катодное
пространство через катионитовую диафрагму и
образуют с анионами S2О42− дитионат натрия.
В тех случаях, когда целевой процесс идет
на аноде, а потенциал катода должен быть
минимальным, в качестве катодного
материала используют платину, имеющую
самое низкое перенапряжение водорода.
58. Неметаллические катоды
Для восстановления кислорода воздуха до H2O2 разработанактивный высокопористый катод, прессованием и
термической обработкой из равных количеств
активированного угля и частиц полиэтилена.
Используя такой катод, в электролизерах с диафрагмой при
циркуляции электролита из анодного в катодное получают
неконцентрированные, а разбавленные растворы, содержащие
около 5 г/л H2O2
Такие растворы используют для отбелки древесной
целлюлозы.
Пероксид водорода может быть получен как путем анодного
окисления серной кислоты или ее солей с последующим
гидролизом и дистилляцией образующегося H2O2 (рассмотрено
выше), так и путем восстановления кислорода на катоде:
O2 + 2H+ + 2ē = H2O2
E0 = 0,68 B.
Катодное восстановление кислорода имеет недостаток, так как
одновременно с целевым процессом протекают реакции
восстановления H2O2 и О2:
H2O2 + 2H+ + 2ē = 2H2O
E0 = 1,77 B,
O2 + 4H+ + 4ē = 2H2O
E0 = 1,23 B.
Восстановление кислорода до Н2О2 будет происходить только в
том случае, если перенапряжение последних реакций
будет велико.
59. Примеры электросинтезов на катодах
Среди реакций получения неорганическихсоединений на катоде значительное место
занимает электросинтез соединений металлов
низшей валентности. Например, различных
хромовых квасцов, гидроксида и сульфата
хрома реактивной квалификации
путем электровосстановления кислородных
соединений шестивалентного хрома. При
электролизе раствора, CrO3 (60 г/л), серная
кислота и сульфат аммония, на катоде образ.
квасцы по суммарной реакции:
H2Cr2O7+(NH4)2SO4+3H2SO4+20H2O=
2NH4Cr(SO4)2∙2H2O + 3/2O2
Выход по току близок к количественному в
широком интервале плотностей тока и температур
60.
Э. восстановлением получают гидроксида хрома (III):Na2CrO4 + 4H2O + 3ē = Cr(OH)3 + 2NaOH + 3OH−.
C высоким выходом по току синтезируют сульфат хрома
реактивной квалификации при электролизе раствора,
содержащего CrО3 и H2SO4 на свинцовом катоде.
Уран низшей валентности получают путем
электровосстановления его высших кислородных
соединений и некоторые другие процессы.
Возможен электрохимический синтез карбонилов
ванадия, хрома, марганца, железа, кобальта и
никеля. В основе получения карбонилов лежит электролиз
раствора комплексной соли металла в неводном
растворителе, насыщаемом под давлением оксидом
углерода. Реакции электросинтеза на катоде, н-р,
гексакарбонила хрома из раствора хлорида хрома (III) в
пиридине, содержащем в качестве электролита бромид
тетрабутиламмония:
СrCl3(C5H5N)3 + 2ē = CrCl2(C5H5N)2 + Cl− + C5H5N,
CrCl2(C5H5N)2 + 6CO + 2ē = Cr(CO)6 + 2Cl− + 2C5H5N.
На первой стадии трихлортрипиридинат хрома
превращается на катоде в дихлордипиридат, который
участвует в дальнейшей реакции на катоде совместно с
оксидом углерода. Выход по току достигает 85 %
61. Растворимые катоды.
Реакция электровосстановления на катодеможет идти с образованием продукта, в
состав которого входит материал катода. Н-р,
катодное получение металлорганических
соединений, которые образуются при
восстановлении карбонильных, ненасыщенных
и галогеносодержащих соединений. Наиболее
разработанным является процесс получения
металлалкилов из галогеналкилов RX:
nRX + Me + nē = Me(R)n + nX−.
В качестве растворимых катодов можно
использовать Hg, Pb, Sn, Zn, Sb, Bi.
Примером Me(R)n может служить
тетраэтилсвинец.
Другим процессом, протекающим при
электролизе на растворимом катоде, является
реакция образования гидридов. При
катодном восстановлении могут быть
получены гидриды олова, кремния.
62. Электрохимическое инициирование
Электрохимическое инициирование реакцийосновано на электролизе систем, в состав
которых входят исходные вещества, а также
образующиеся в результате электрохимического
акта активные частицы (свободные радикалы,
ионы), инициирующие процесс. Процесс
инициирования связан с протеканием
определенных электрохимических реакций,
которые могут иметь место как на катоде, так и
на аноде. В зависимости от условий проведения
электролиза (значения потенциала, природы
растворителя и т. д.) могут образовываться как
на аноде, так и на катоде свободные радикалы,
ион-радикалы, ионы, а также некоторые
продукты их взаимодействия с отдельными
компонентами системы.
63. Косвенное электрохимическое инициирование
Электрохимический процесс приводит как к непосредственномуобразованию активных центров (прямое электрохимическое
инициирование), так и к образованию активных центров за счет
вторичных реакций, протекающих между полученными на
электроде продуктами и соединениями, присутствующими в
системе (косвенное электрохимическое инициирование).
В случае косвенного электрохимического инициирования
кинетические параметры отличаются от параметров прямого
электрохим. иниц. процесса, так как, в общем, скорость всего
процесса определяется наиболее медленной стадией, которой
может являться именно промежуточная реакция.
В этом случае скорость инициирования
νин= k∙c∙ƒ,
где c – концентрация инициатора; ƒ – коэффициент
инициирования; k– константа скорости образования свободного
радикала из молекулы инициатора.
Последняя величина и определяется электрохимической
кинетикой процесса с участием в нем данного вещества, поэтому
для разных веществ константа скорости образования свободного
радикала из молекул инициатора будет различной.
64. Примеры электрохим. инициирования
В качестве источника активных центров используюткатодное восстановление либо самого вещества, либо
ионов водорода, персульфатов щелочных металлов,
солей аммония и фосфония, карбонильных соединений,
гидропероксидов и др.
В приэлектродном слое одновременно может протекать не
один единственный процесс, приводящий к получению
частиц какой-то одной определенной природы, а
несколько процессов, благодаря которым образуются
различные продукты. В зависимости от природы
растворителя, рН среды, материала электрода, его
потенциала преобладает та или иная реакция.
Инициирование может быть возможным за счет
электровосстановления кислорода до пероксида
водорода, на ртутном катоде в кислой среде по
реакциям:
.
O2 + H+ + ē = HO2,
.
HO2 + H+ + ē = H2O2.
65.
Пероксид водорода далее восстанавливается до воды:.
H2O2 + ē = OH + HO−,
HO− + H+ = H2O,
.
OH + H+ + ē = H2O.
.
Радикал ОН может выступать инициатором, например, реакции
полимеризации какого-либо мономера, для этих же целей может быть
использована реакция образования активных центров при
восстановлении на катоде персульфат-ионов:
.
S2O82− + ē = SO42− + SO4−.
Образование S2O82− возможно при окислении сульфат-ионов на электроде
первично образующимися активными кислородсодержащими соединениями,
например пероксидом водорода, выделяющимися при разряде ОН-ионов
с последующей рекомбинацией радикалов:
.
2OH− = 2OH + 2ē,
.
2OH = H2O2,
2SO4 2− + H2O2 = S2O82− + 2OH−.
.
На аноде в начале образуются радикалы ОН, которые затем окисляют ионы
SO42− в объеме раствора с переходом электронов без передачи кислорода.
.
2SO42− + 2OH = 2SO4− + 2OH−,
2SO4− = S2O82−.
66.
Известны способы электрохимического формированияокислительно-восстановительных инициирующих систем с
использованием растворимых анодов; при этом
пероксидные соединения предварительно вводятся в
реакционную смесь, а ионы металлов генерируются
электрохимически: Me = Men+ + nē.
При инициировании реакций анодным окислением
учитывается анодное поведение всей системы анионрастворитель, так как, во-первых, начало разложения фона
зависит от его общего состава (электролит + растворитель), а
во вторых, на характер отдельных стадий, в которых могут
участвовать и электролиты, и растворитель, накладываются
не только индивидуальные свойства последних, но и их
сочетание.
Например, при электролизе ацетонитрильного раствора,
содержащего анионы ClO4−, взаимодействуют перхлоратрадикалы с молекулами растворителя:
.
ClO4 − = ClO4 + ē,
.
ClO4 + CH3CN = [CH3CN]+ + ClO4−.
Катион-радикалы [CH3СN]+ могут выступать инициаторами
реакции полимеризации стирола (винилбензола)
67.
Однако, в присутствии даженебольших количеств воды может
протекать реакция:
.
.
ClO4 + H2O = HClO4 + OH.
Имеют место и другие особенности
системы растворитель - электролит,
которые учитываются при анодном
инициировании процессов.

































































 physics
physics chemistry
chemistry








