Similar presentations:
Фотосинтез. Хлорофилл
1. Фотосинтез: что делать, когда всё, что можно, уже окислилось?
а/ умереть от отсутствия энергииб/ найти способ «регенерации» восстановленных соединений:
СО2 + Н2О → (СН2О) + О2
Для этого необходимо:
1. Найти «псевдонеиссякаемый» источник энергии (вспоминая
первую лекцию – безотказного кредитора для безнадежной игры…)
2. Придумать систему трансформации этой энергии в энергию
восстановленных соединений.
Псевдонеиссякаемый источник энергии на Земле –
только энергия звезды по имени Солнце…
Таким образом, основные задачи:
• поймать энергию солнечных квантов
• преобразовать ее в энергию
восстановленных соединений.
2.
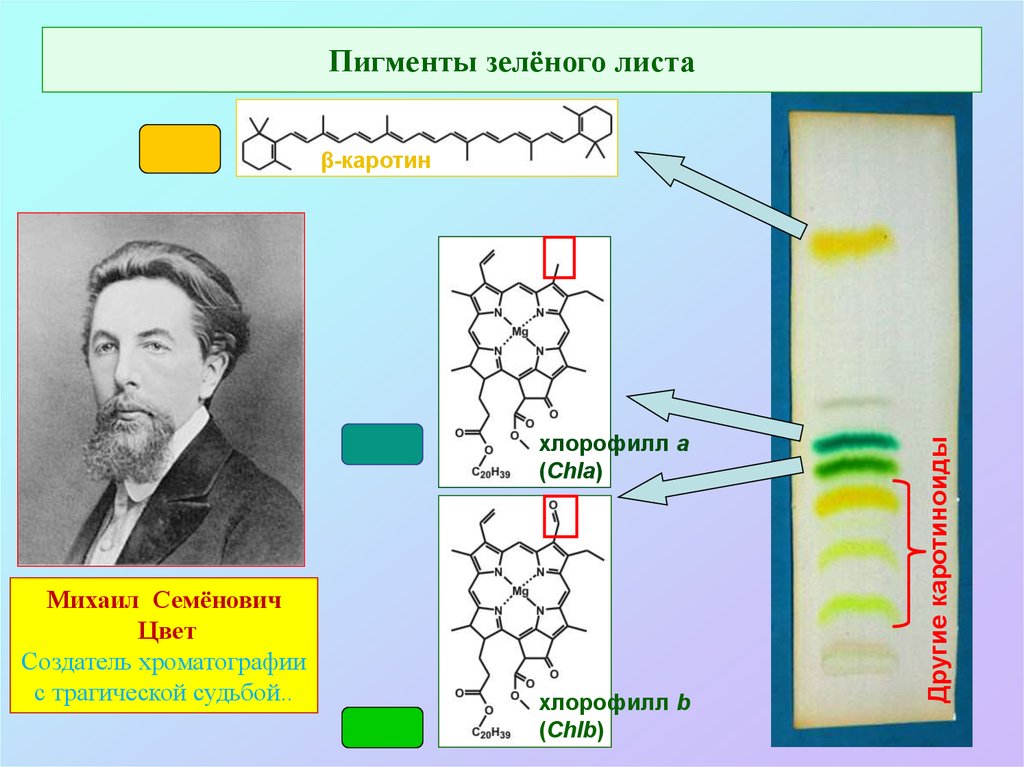
Пигменты зелёного листахлорофилл а
(Chla)
Михаил Семёнович
Цвет
Создатель хроматографии
с трагической судьбой..
хлорофилл b
(Chlb)
Другие каротиноиды
β-каротин
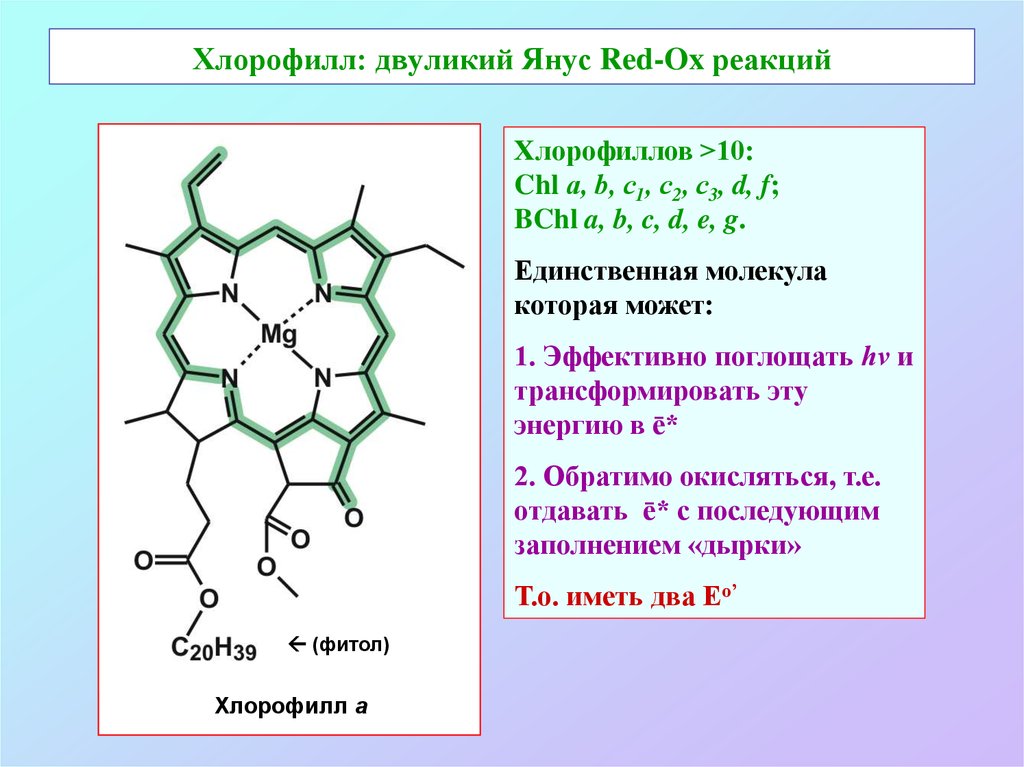
3. Хлорофилл: двуликий Янус Red-Ox реакций
Хлорофиллов >10:Chl а, b, c1, с2, с3, d, f;
BChl a, b, c, d, e, g.
Единственная молекула
которая может:
1. Эффективно поглощать hν и
трансформировать эту
энергию в ē*
2. Обратимо окисляться, т.е.
отдавать ē* с последующим
заполнением «дырки»
Т.о. иметь два Еo’
(фитол)
Хлорофилл a
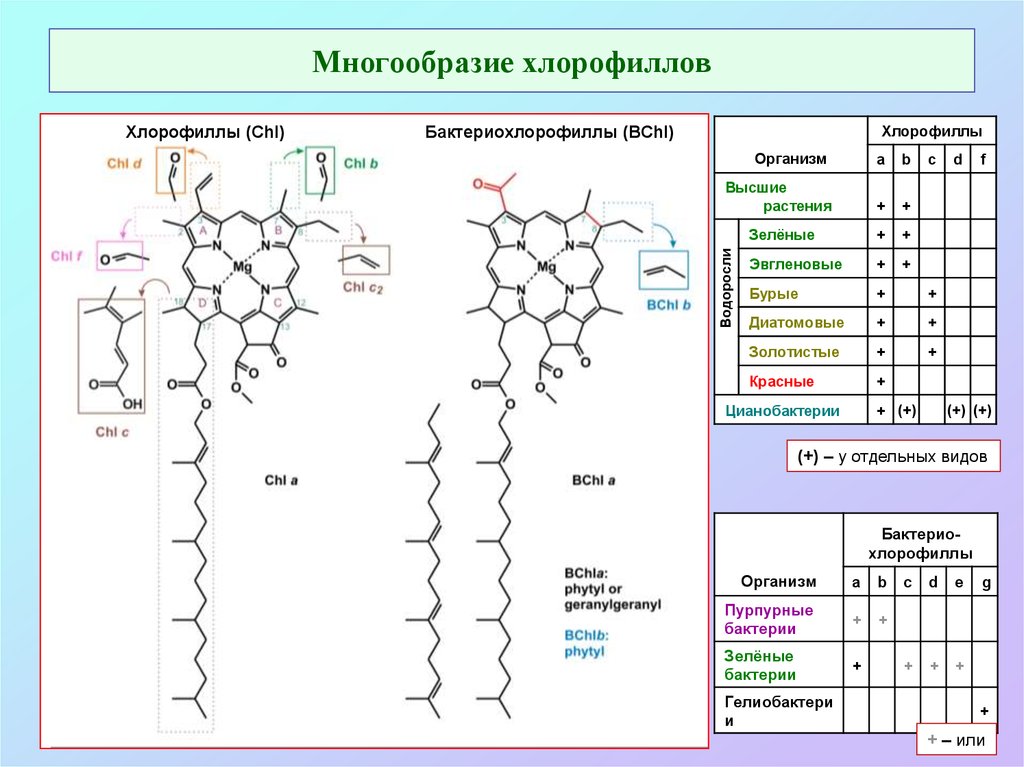
4. Многообразие хлорофиллов
ХлорофиллыБактериохлорофиллы (BChl)
Организм
a
b
Высшие
растения
+
+
Зелёные
+
+
Эвгленовые
+
+
Бурые
+
+
Диатомовые
+
+
Золотистые
+
+
Красные
+
Водоросли
Хлорофиллы (Chl)
c
+ (+)
Цианобактерии
d
f
(+) (+)
(+) – у отдельных видов
Бактериохлорофиллы
Организм
a
b
Пурпурные
бактерии
+
+
Зелёные
бактерии
+
Гелиобактери
и
c
d
e
+
+
+
g
+
+ – или
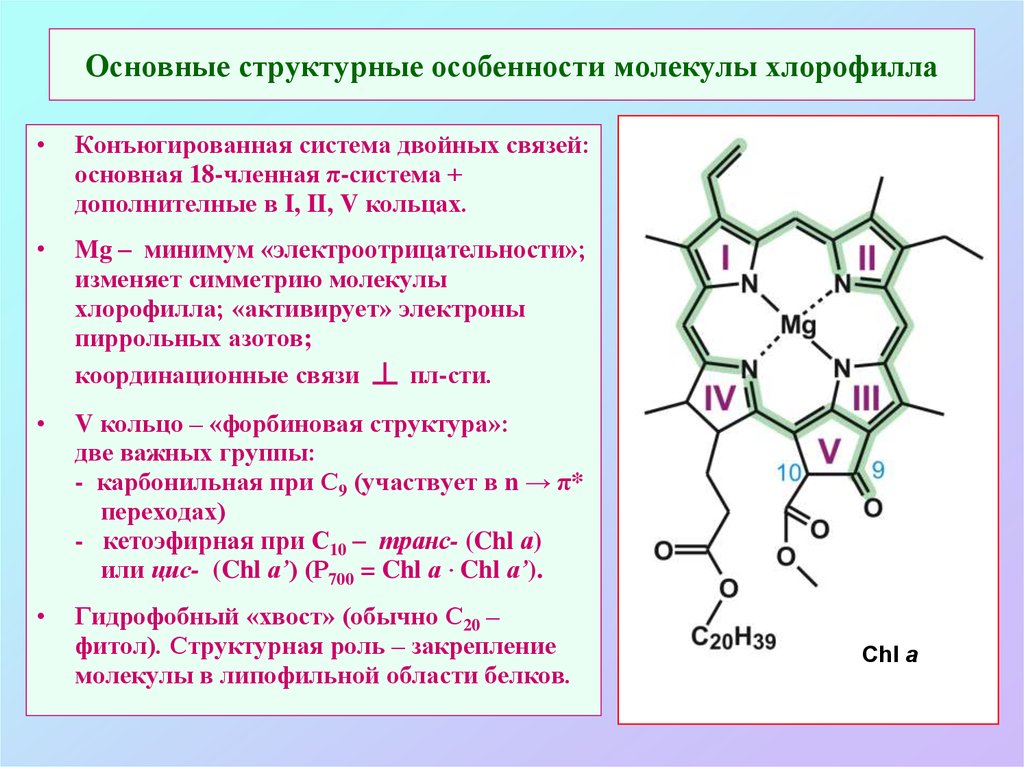
5. Основные структурные особенности молекулы хлорофилла
Конъюгированная система двойных связей:
основная 18-членная π-система +
дополнителные в I, II, V кольцах.
Mg – минимум «электроотрицательности»;
изменяет симметрию молекулы
хлорофилла; «активирует» электроны
пиррольных азотов;
координационные связи ┴ пл-сти.
V кольцо – «форбиновая структура»:
две важных группы:
- карбонильная при С9 (участвует в n → π*
переходах)
- кетоэфирная при С10 – транс- (Chl а)
или цис- (Chl а’) (Р700 = Chl а · Chl а’).
Гидрофобный «хвост» (обычно С20 –
фитол). Структурная роль – закрепление
молекулы в липофильной области белков.
Chl a
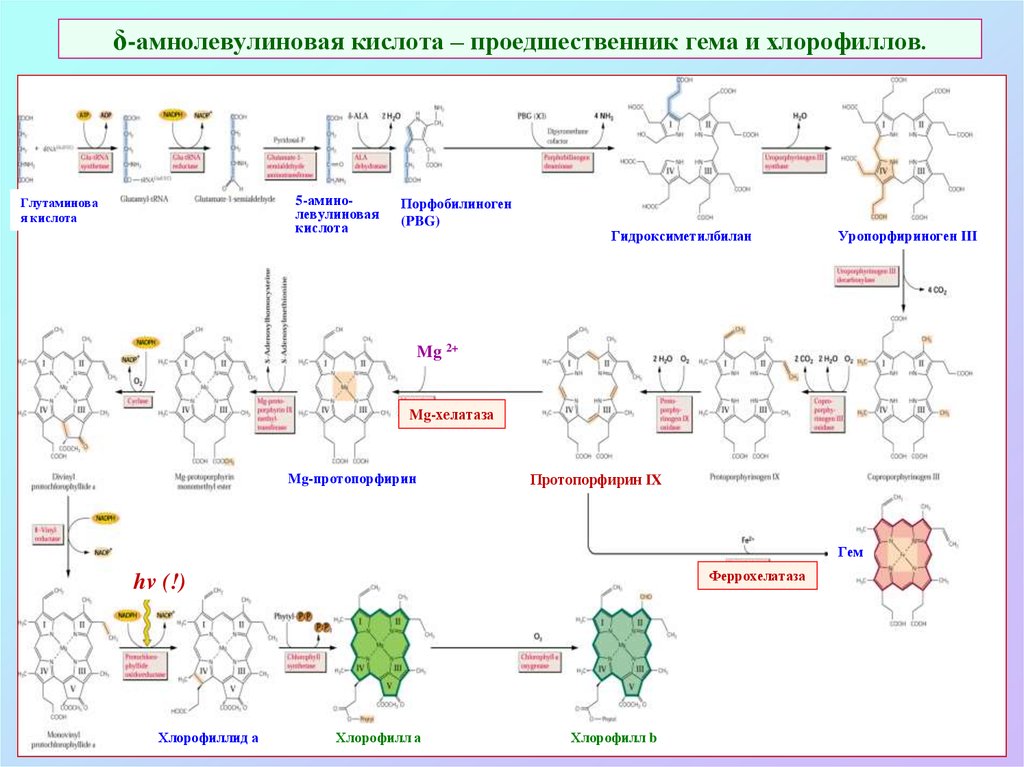
6. δ-амнолевулиновая кислота – проедшественник гема и хлорофиллов.
5-аминолевулиноваякислота
Глутаминова
я кислота
Порфобилиноген
(PBG)
Гидроксиметилбилан
Уропорфириноген III
Mg 2+
Mg-хелатаза
Mg-протопорфирин
Протопорфирин IX
Гем
Феррохелатаза
hv (!)
Хлорофиллид а
Хлорофилл а
Хлорофилл b
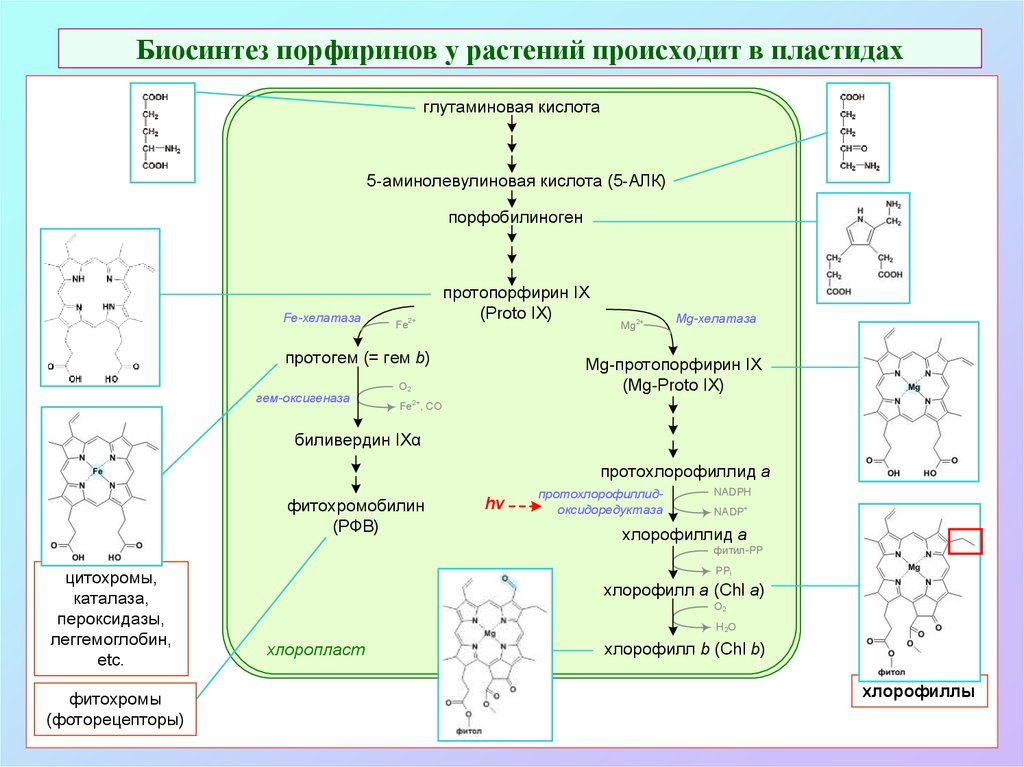
7. Биосинтез порфиринов у растений происходит в пластидах
глутаминовая кислота5-аминолевулиновая кислота (5-АЛК)
порфобилиноген
Fe-хелатаза
Fe2+
протопорфирин IX
(Proto IX)
протогем (= гем b)
гем-оксигеназа
Mg2+
Mg-хелатаза
Mg-протопорфирин IX
(Mg-Proto IX)
О2
Fe2+, СО
биливердин IXα
протохлорофиллид a
фитохромобилин
(РФВ)
hv
протохлорофиллидоксидоредуктаза
NADPH
NADP+
хлорофиллид a
фитил-PP
цитохромы,
каталаза,
пероксидазы,
леггемоглобин,
etc.
фитохромы
(фоторецепторы)
PPi
хлорофилл а (Chl a)
О2
H2O
хлоропласт
хлорофилл b (Chl b)
хлорофиллы
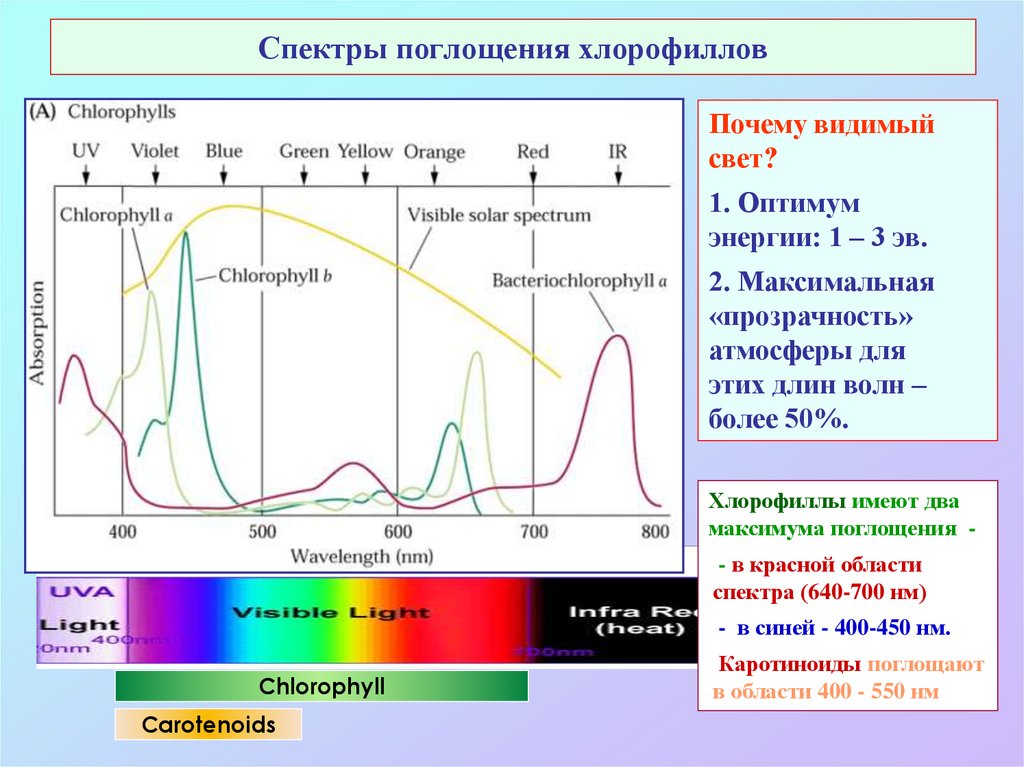
8. Спектры поглощения хлорофиллов
Почему видимыйсвет?
1. Оптимум
энергии: 1 – 3 эв.
2. Максимальная
«прозрачность»
атмосферы для
этих длин волн –
более 50%.
Хлорофиллы имеют два
максимума поглощения - в красной области
спектра (640-700 нм)
- в синей - 400-450 нм.
Chlorophyll
Carotenoids
Каротиноиды поглощают
в области 400 - 550 нм
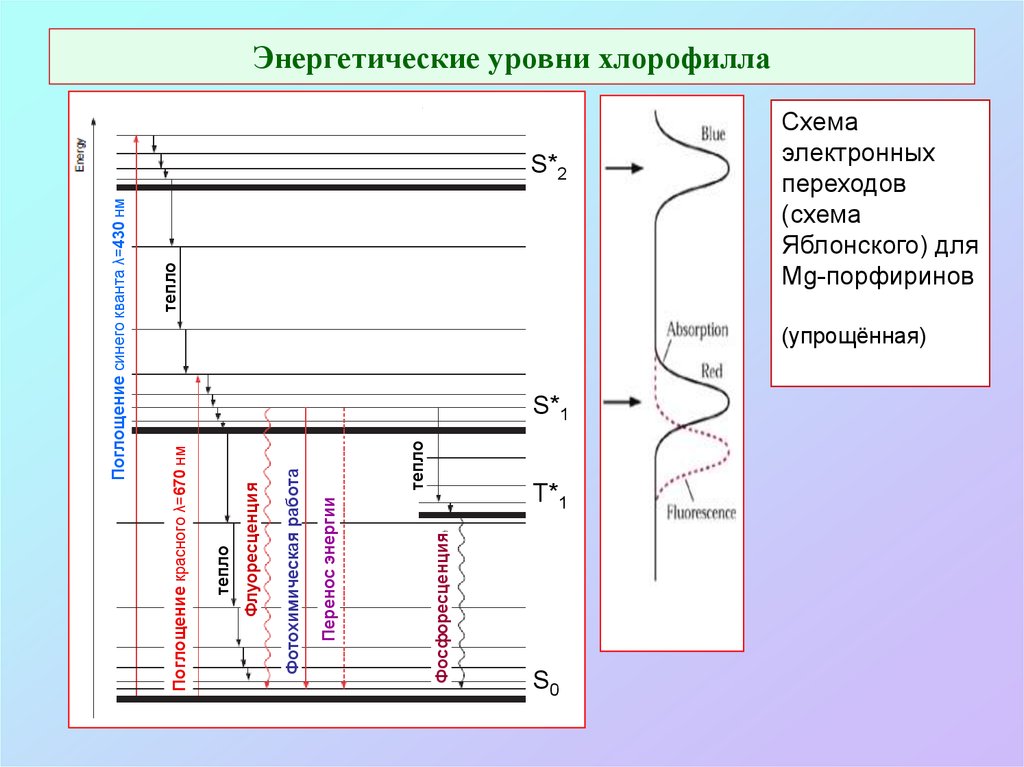
9. Энергетические уровни хлорофилла
ФосфоресценцияПеренос энергии
тепло
Фотохимическая работа
Флуоресценция
тепло
Поглощение красного λ=670 нм
тепло
Поглощение синего кванта λ=430 нм
Энергетические уровни хлорофилла
S*2
S*1
T*1
S0
Схема
электронных
переходов
(схема
Яблонского) для
Mg-порфиринов
(упрощённая)
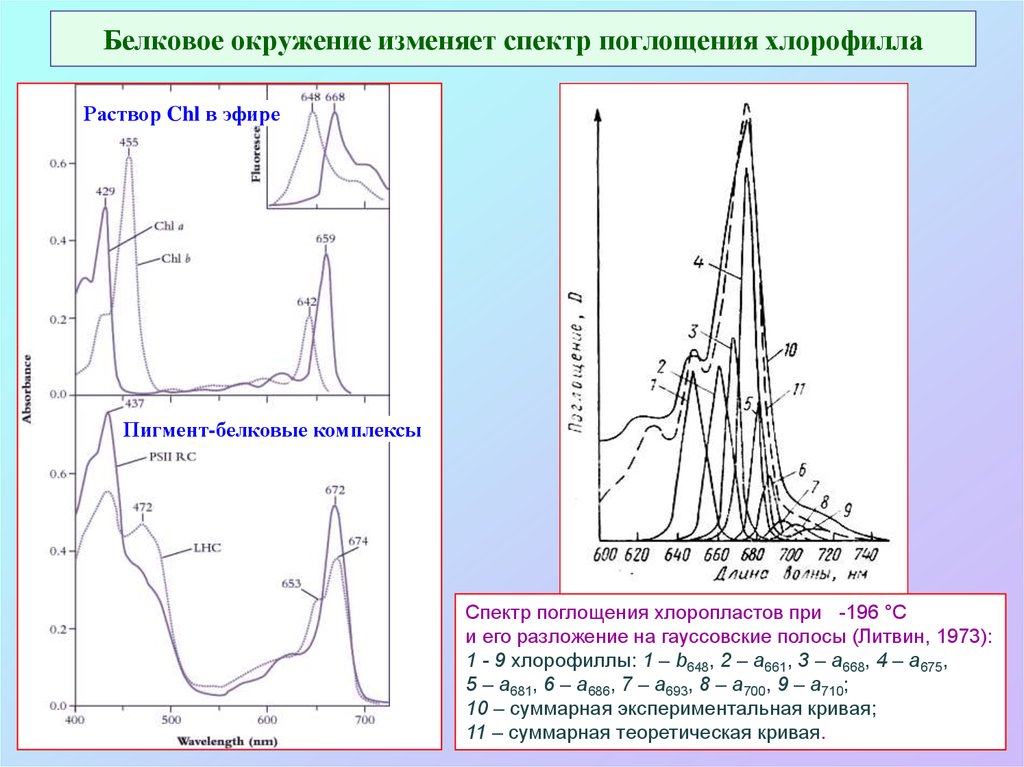
10. Белковое окружение изменяет спектр поглощения хлорофилла
Раствор Chl в эфиреПигмент-белковые комплексы
Спектр поглощения хлоропластов при -196 °С
и его разложение на гауссовские полосы (Литвин, 1973):
1 - 9 хлорофиллы: 1 – b648, 2 – a661, 3 – a668, 4 – a675,
5 – a681, 6 – a686, 7 – a693, 8 – a700, 9 – a710;
10 – суммарная экспериментальная кривая;
11 – суммарная теоретическая кривая.
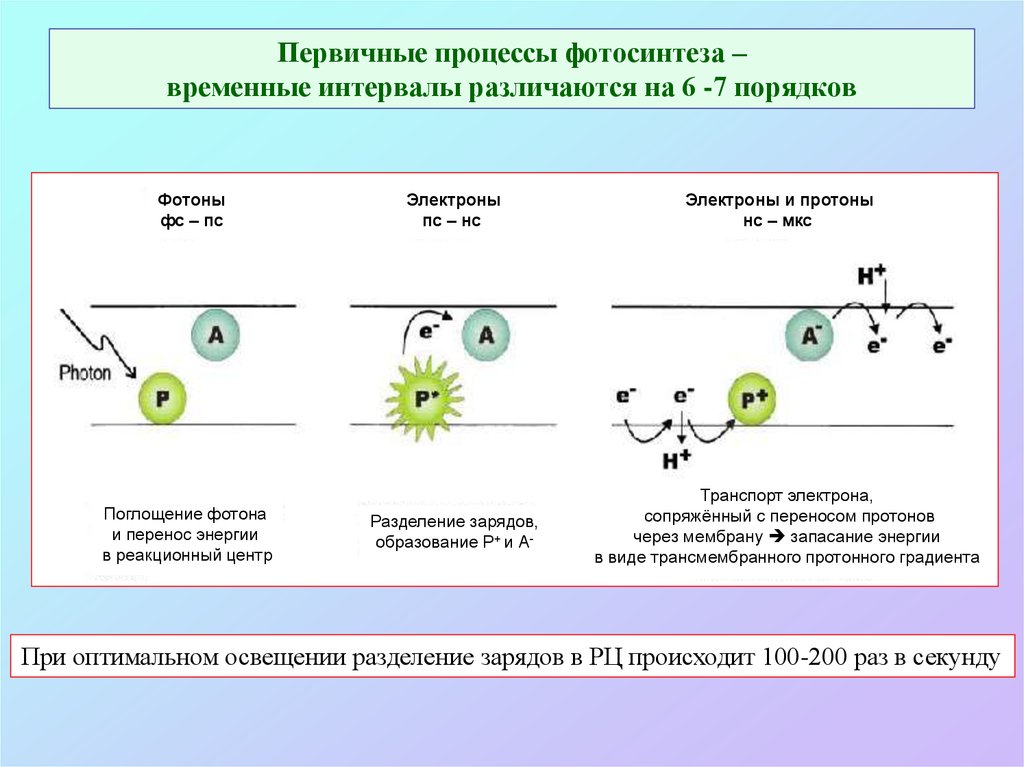
11. Первичные процессы фотосинтеза – временные интервалы различаются на 6 -7 порядков
Фотоныфс – пс
Поглощение фотона
и перенос энергии
в реакционный центр
Электроны
пс – нс
Разделение зарядов,
образование P+ и А-
Электроны и протоны
нс – мкс
Транспорт электрона,
сопряжённый с переносом протонов
через мембрану запасание энергии
в виде трансмембранного протонного градиента
При оптимальном освещении разделение зарядов в РЦ происходит 100-200 раз в секунду
12. Простейшая схема фотосинтеза - пурпурные бактерии (тип II РЦ).
За счет работы b6c1-комплексапротоны «перекачиваются»
через мембрану, и за счет
+
образующегося ΔµН
–
синтезируется АТФ.
Но главная задача не решена –
нет образования
восстановленных соединений.
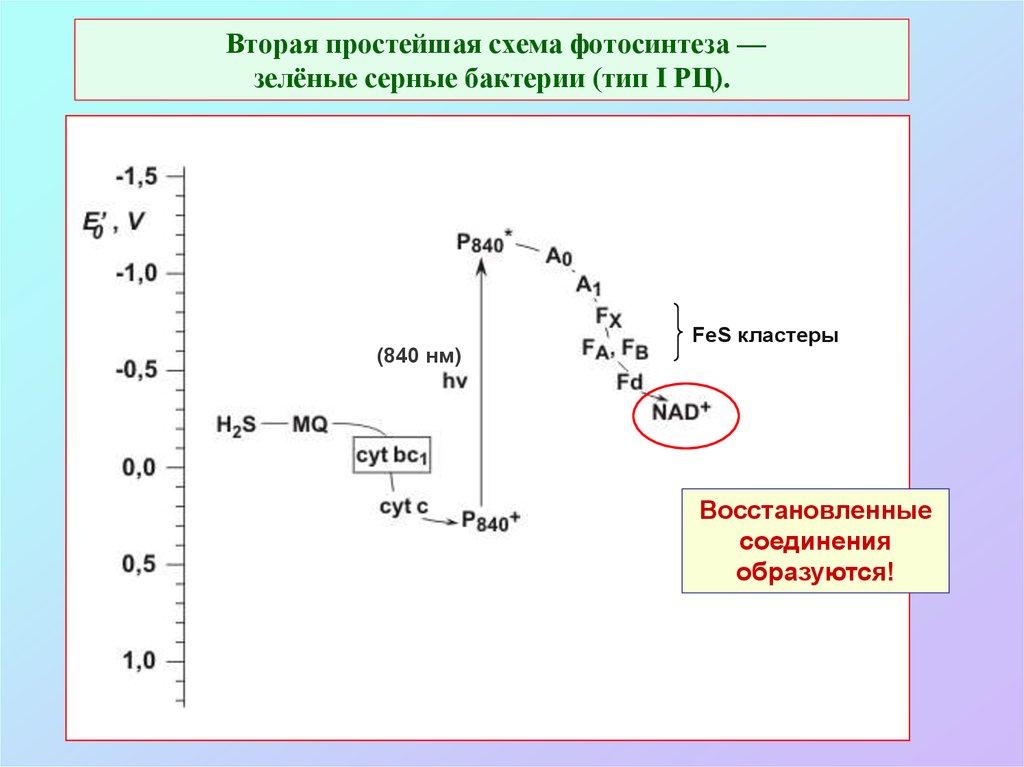
13. Вторая простейшая схема фотосинтеза — зелёные серные бактерии (тип I РЦ).
(840 нм)FeS кластеры
Восстановленные
соединения
образуются!
14. Очередная проблема: где взять источник (донор) электронов (окисляемое соединение)?
Основные требования к донору электронов:1. Ео’ меньше Ео’ хл+ (т.е. может отдавать е- на хл+)
2. Продукты окисления нетоксичны (желательно)
3. Его должно быть много
Н2S – хорош по всем параметрам, кроме последнего:
1. Ео’н2S = - 0,23 – электрон достаточно легко «забрать»
2. Продукт окисления (сера) - легко уводится из реакции
Н2О – отвратителен по всем параметрам, кроме
последнего:
1. Ео’н2о = +0,82 – очень много, электрон «оторвать» трудно
2. Продукт окисления (кислород) - очень токсичен.
Но последний фактор оказался решающим.
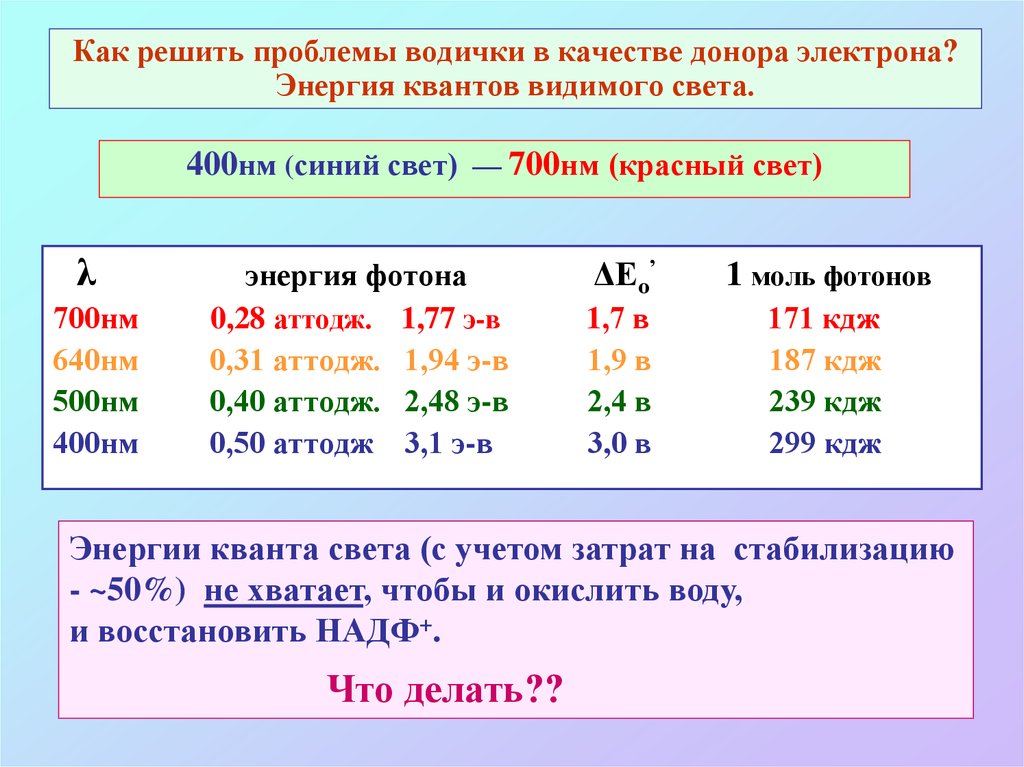
15. Как решить проблемы водички в качестве донора электрона? Энергия квантов видимого света.
400нм (синий свет) — 700нм (красный свет)λ
700нм
640нм
500нм
400нм
энергия фотона
0,28 аттодж. 1,77 э-в
0,31 аттодж. 1,94 э-в
0,40 аттодж. 2,48 э-в
0,50 аттодж 3,1 э-в
ΔЕо’
1 моль фотонов
1,7 в
1,9 в
2,4 в
3,0 в
171 кдж
187 кдж
239 кдж
299 кдж
Энергии кванта света (с учетом затрат на стабилизацию
- ~50%) не хватает, чтобы и окислить воду,
и восстановить НАДФ+.
Что делать??
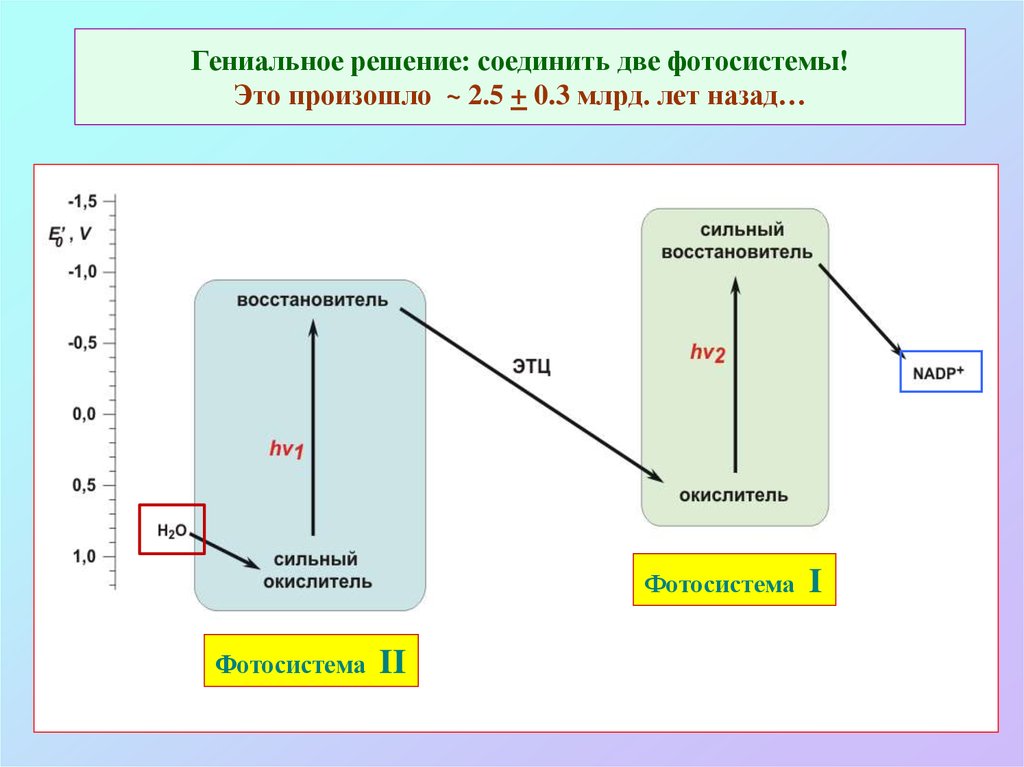
16. Гениальное решение: соединить две фотосистемы! Это произошло ~ 2.5 + 0.3 млрд. лет назад…
ФотосистемаФотосистема
II
I
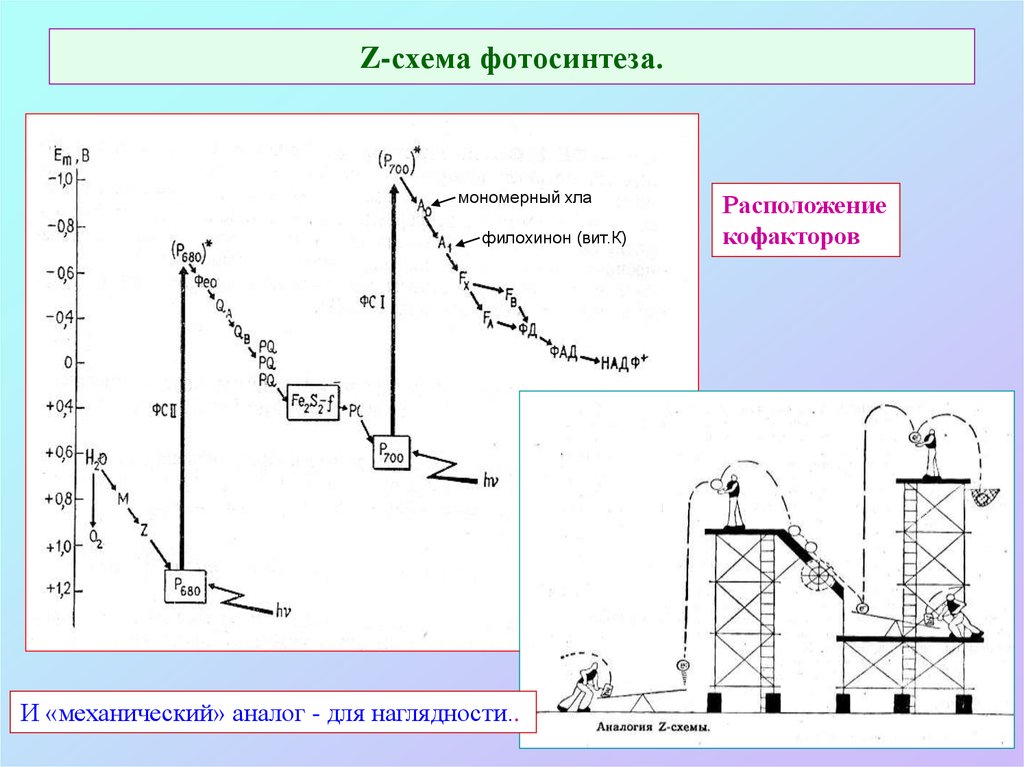
17. Z-схема фотосинтеза.
мономерный хлафилохинон (вит.К)
И «механический» аналог - для наглядности..
Расположение
кофакторов
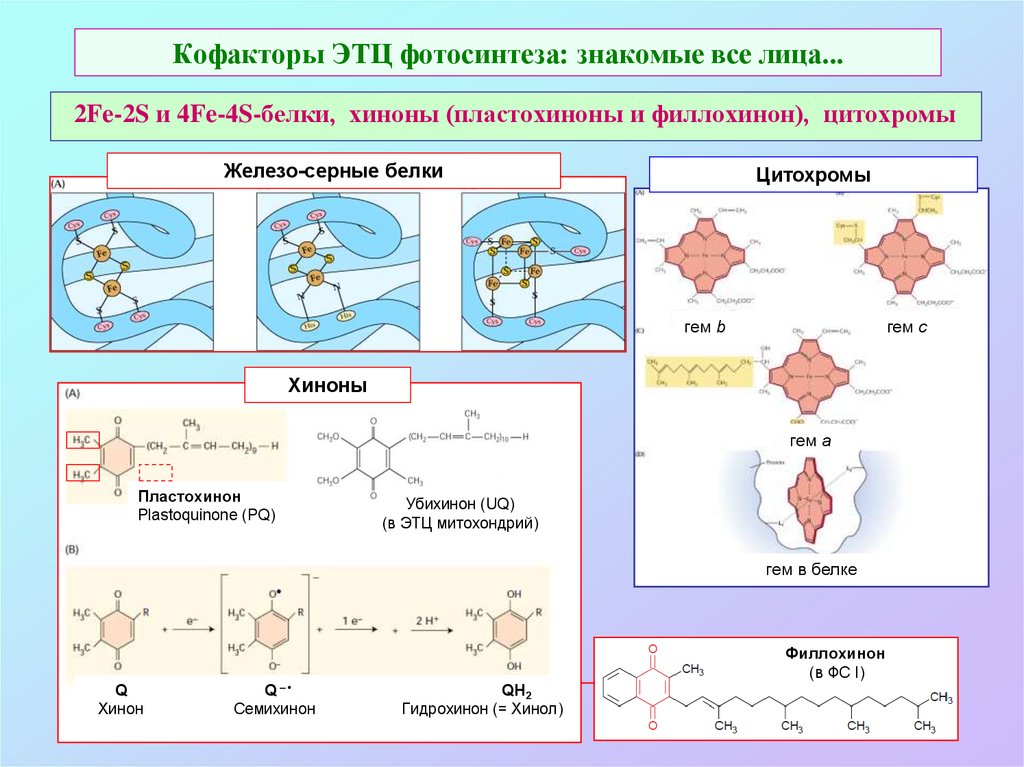
18. Кофакторы ЭТЦ фотосинтеза: знакомые все лица...
2Fe-2S и 4Fe-4S-белки, хиноны (пластохиноны и филлохинон), цитохромыЖелезо-серные белки
Цитохромы
гем b
гем c
Хиноны
гем a
Пластохинон
Plastoquinone (PQ)
Убихинон (UQ)
(в ЭТЦ митохондрий)
гем в белке
Филлохинон
(в ФС I)
Q
Хинон
Q–
Семихинон
QH2
Гидрохинон (= Хинол)
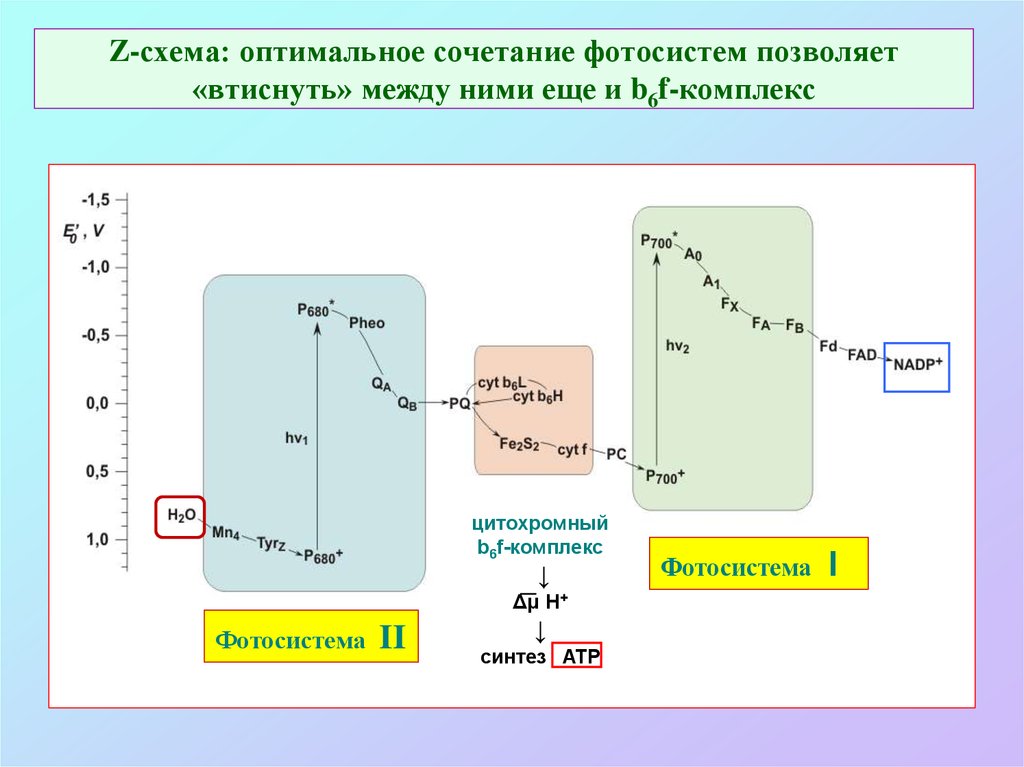
19. Z-схема: оптимальное сочетание фотосистем позволяет «втиснуть» между ними еще и b6f-комплекс
цитохромныйb6f-комплекс
↓
Δμ H+
Фотосистема
II
↓
синтез ATP
Фотосистема
I
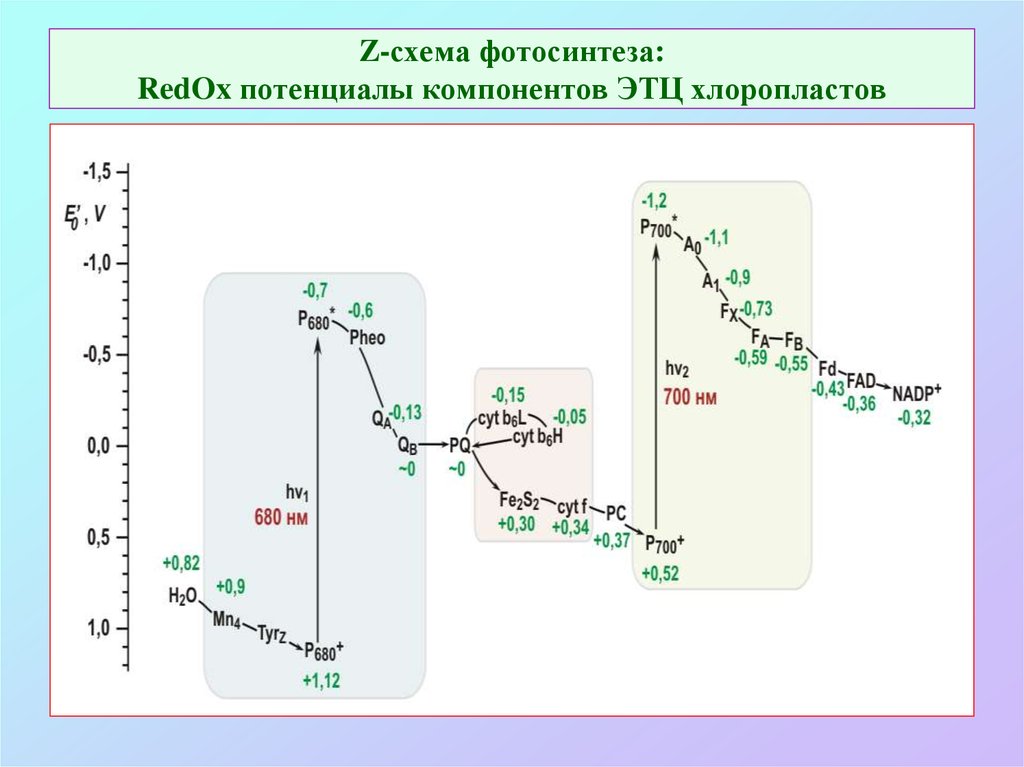
20. Z-схема фотосинтеза: RedOx потенциалы компонентов ЭТЦ хлоропластов
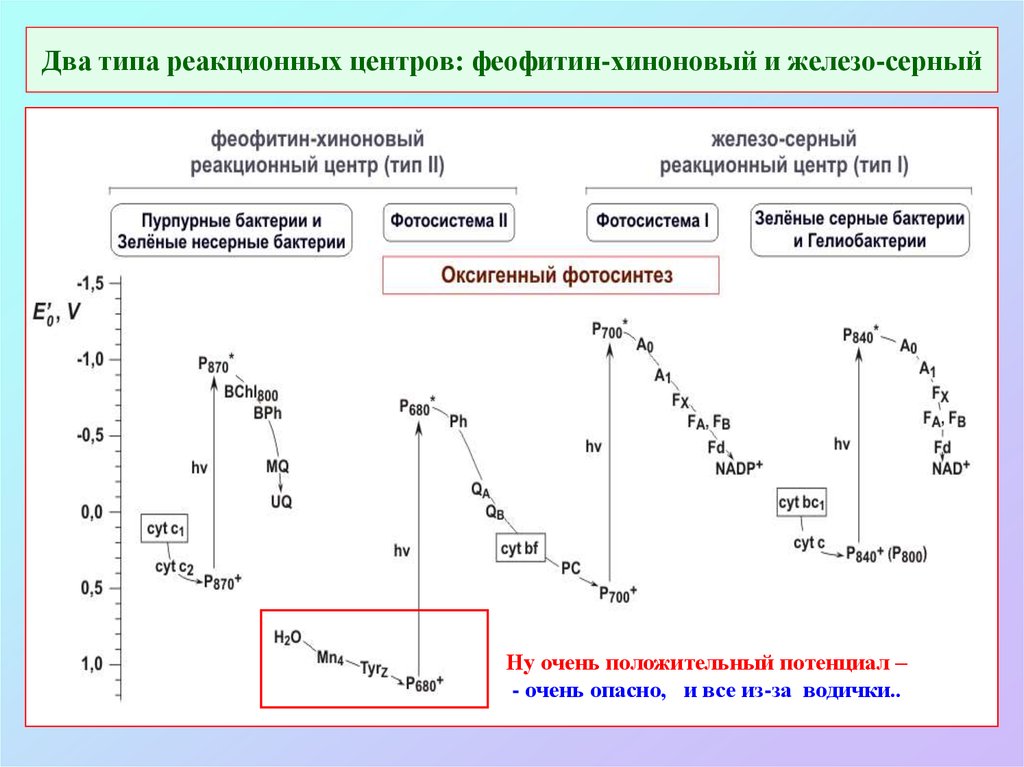
21. Два типа реакционных центров: феофитин-хиноновый и железо-серный
Ну очень положительный потенциал –- очень опасно, и все из-за водички..
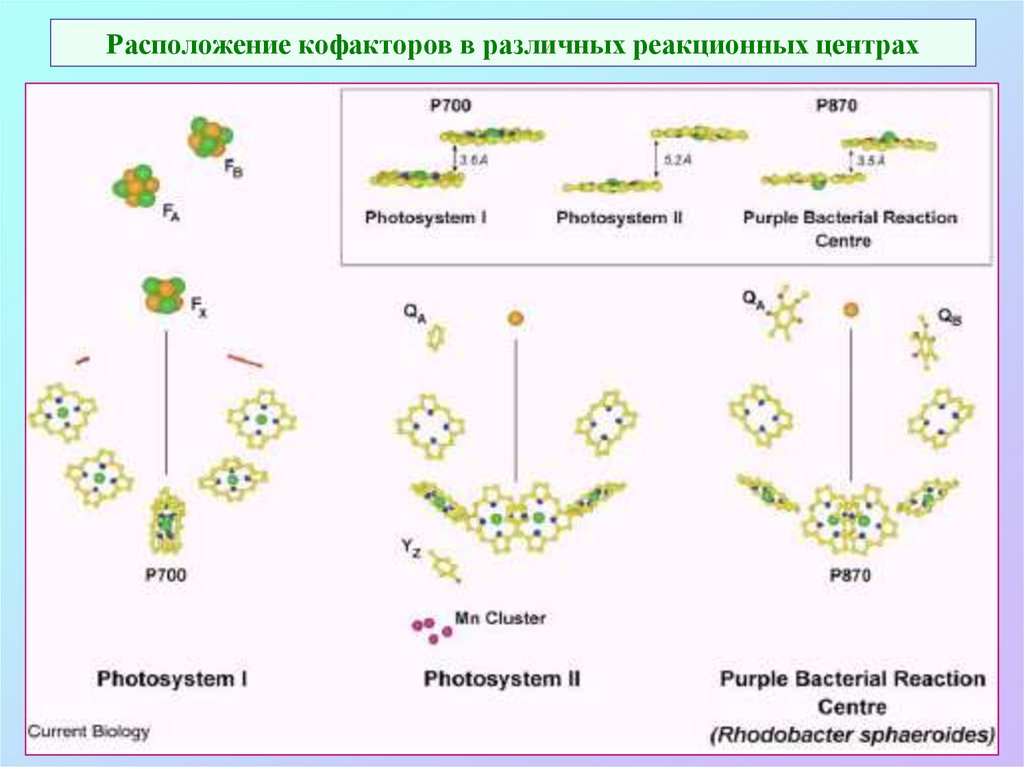
22. Расположение кофакторов в различных реакционных центрах
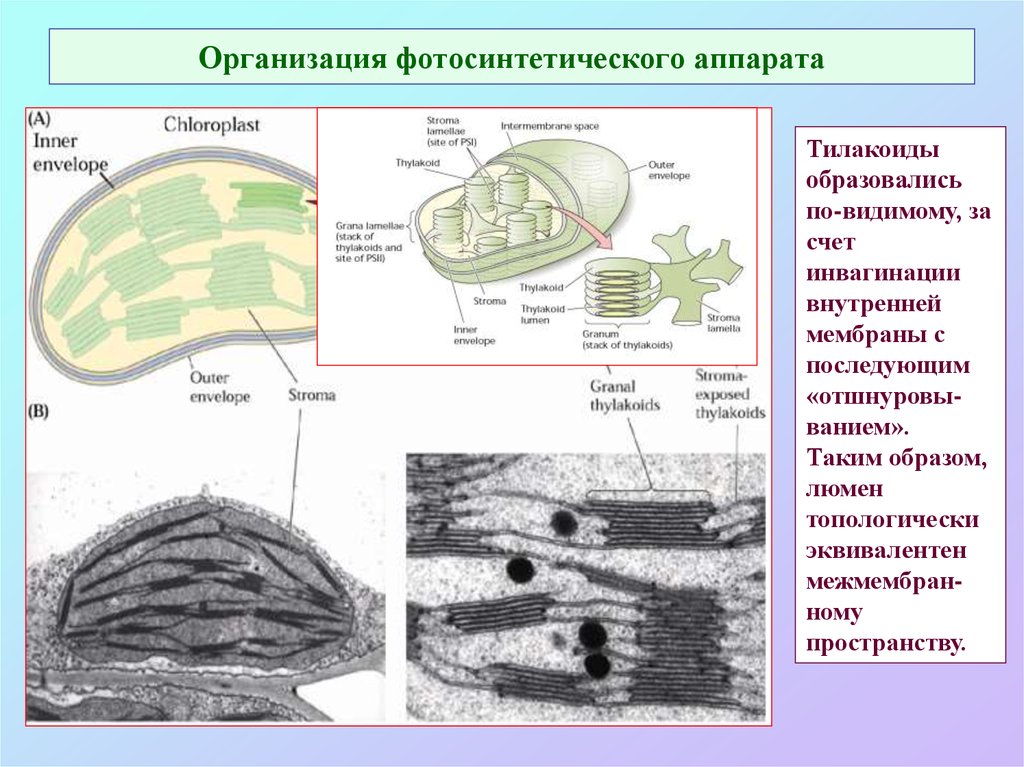
23. Организация фотосинтетического аппарата
Тилакоидыобразовались
по-видимому, за
счет
инвагинации
внутренней
мембраны с
последующим
«отшнуровыванием».
Таким образом,
люмен
топологически
эквивалентен
межмембранному
пространству.
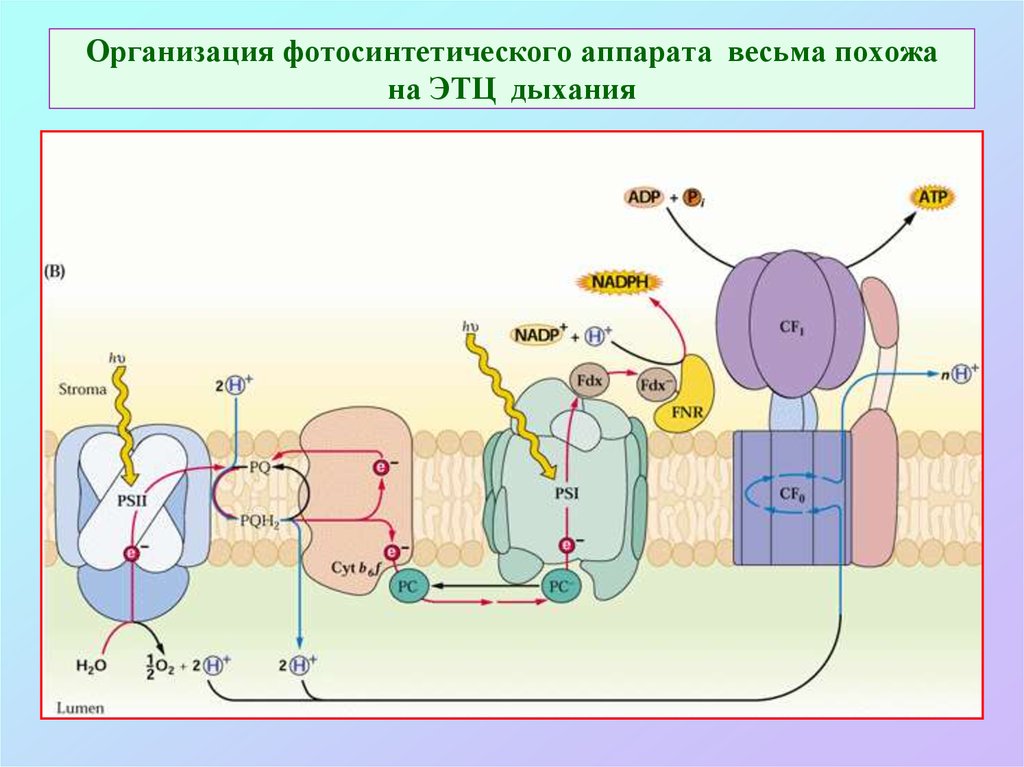
24. Организация фотосинтетического аппарата весьма похожа на ЭТЦ дыхания
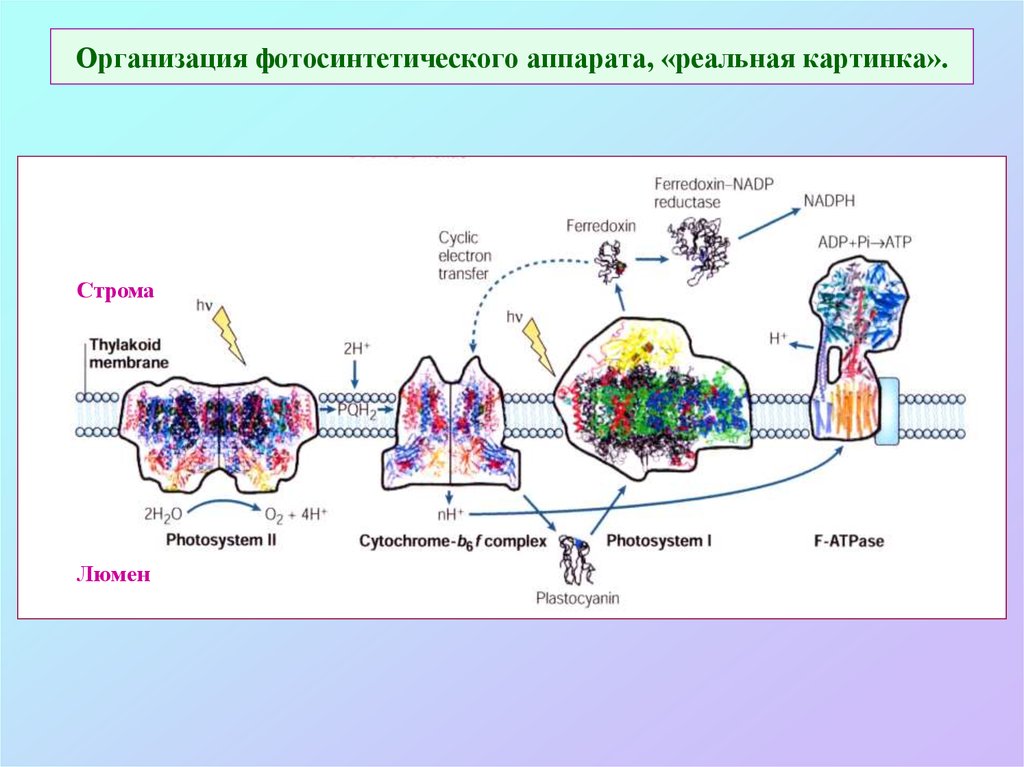
25. Организация фотосинтетического аппарата, «реальная картинка».
СтромаЛюмен
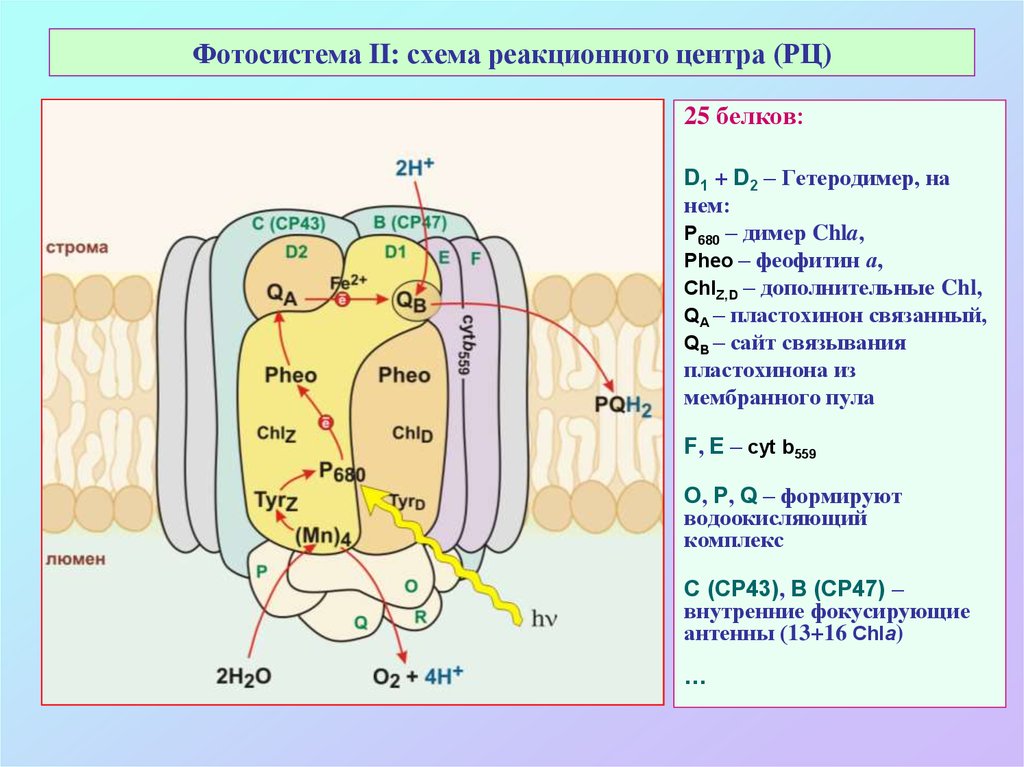
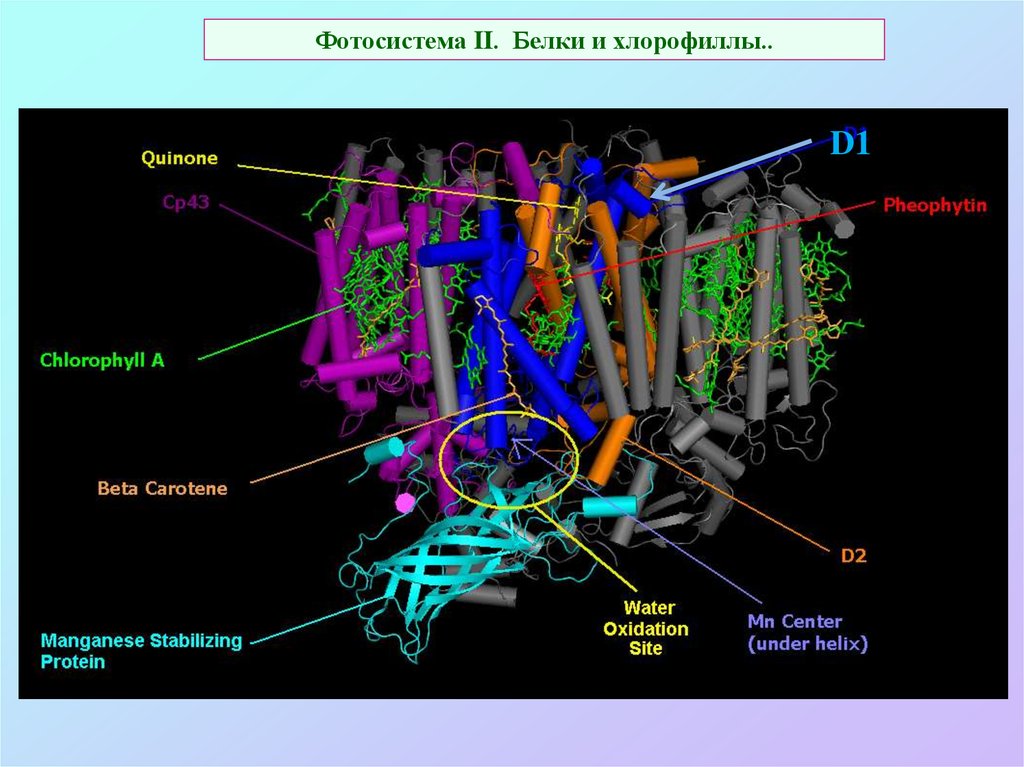
26. Фотосистема II: схема реакционного центра (РЦ)
25 белков:D1 + D2 – Гетеродимер, на
нем:
Р680 – димер Chla,
Pheo – феофитин а,
ChlZ,D – дополнительные Chl,
QA – пластохинон связанный,
QB – сайт связывания
пластохинона из
мембранного пула
F, E – cyt b559
O, P, Q – формируют
водоокисляющий
комплекс
C (CP43), B (CP47) –
внутренние фокусирующие
антенны (13+16 Chla)
…
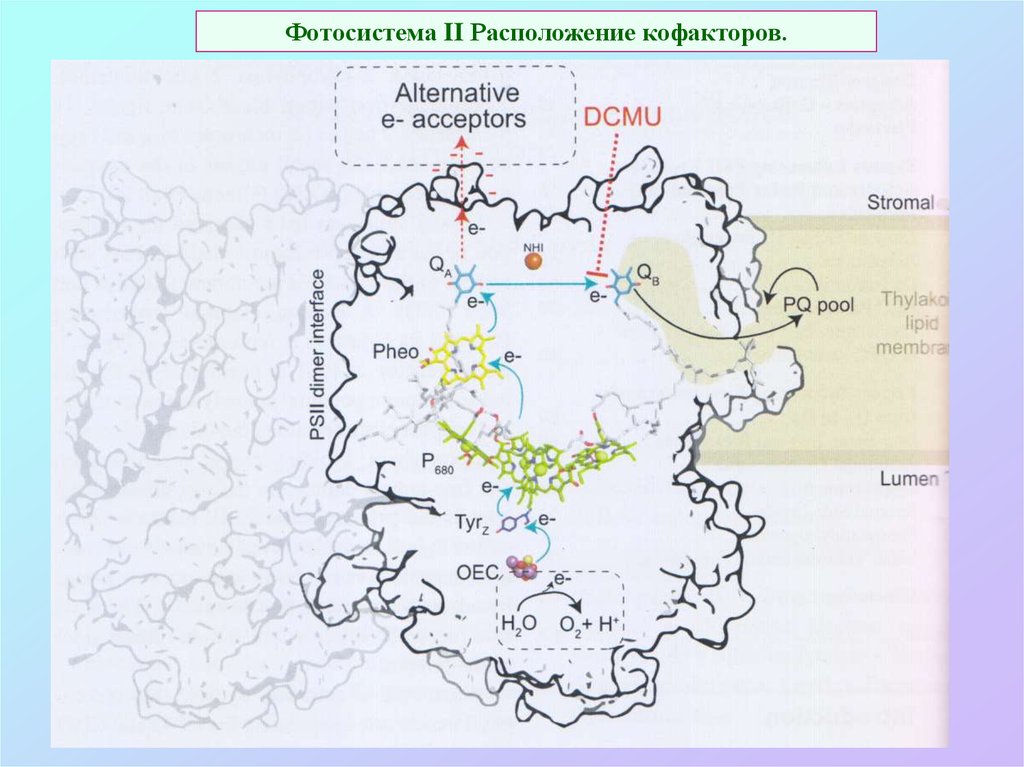
27. Фотосистема II Расположение кофакторов.
28. Фотосистема II. Белки и хлорофиллы..
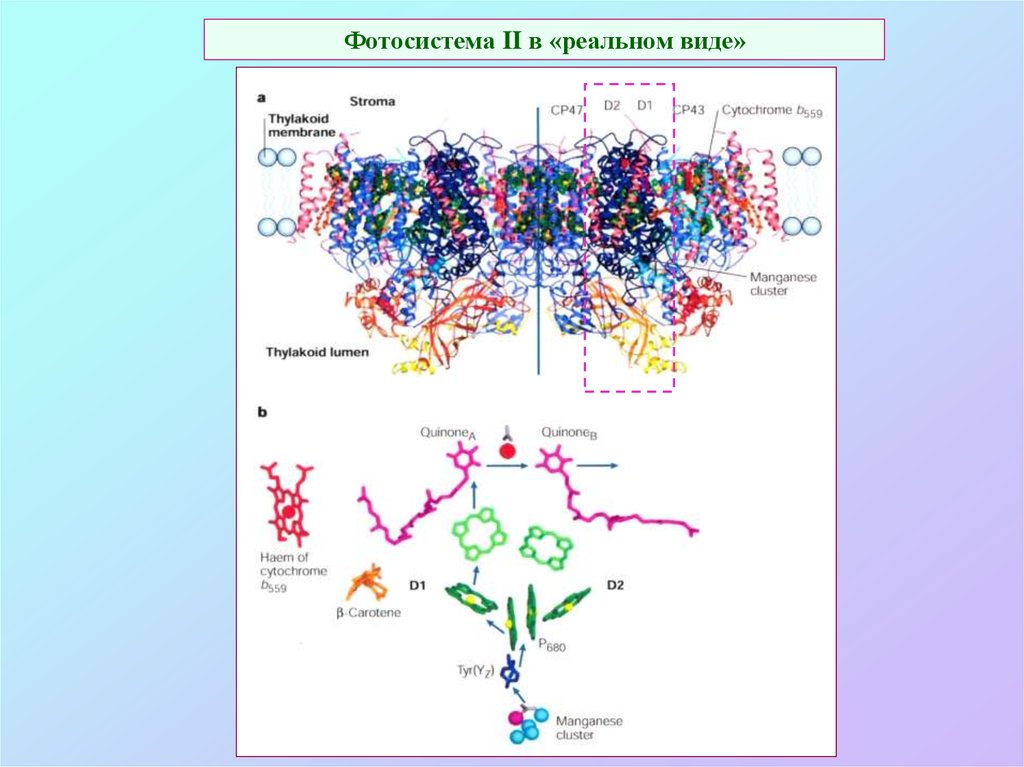
D129. Фотосистема II в «реальном виде»
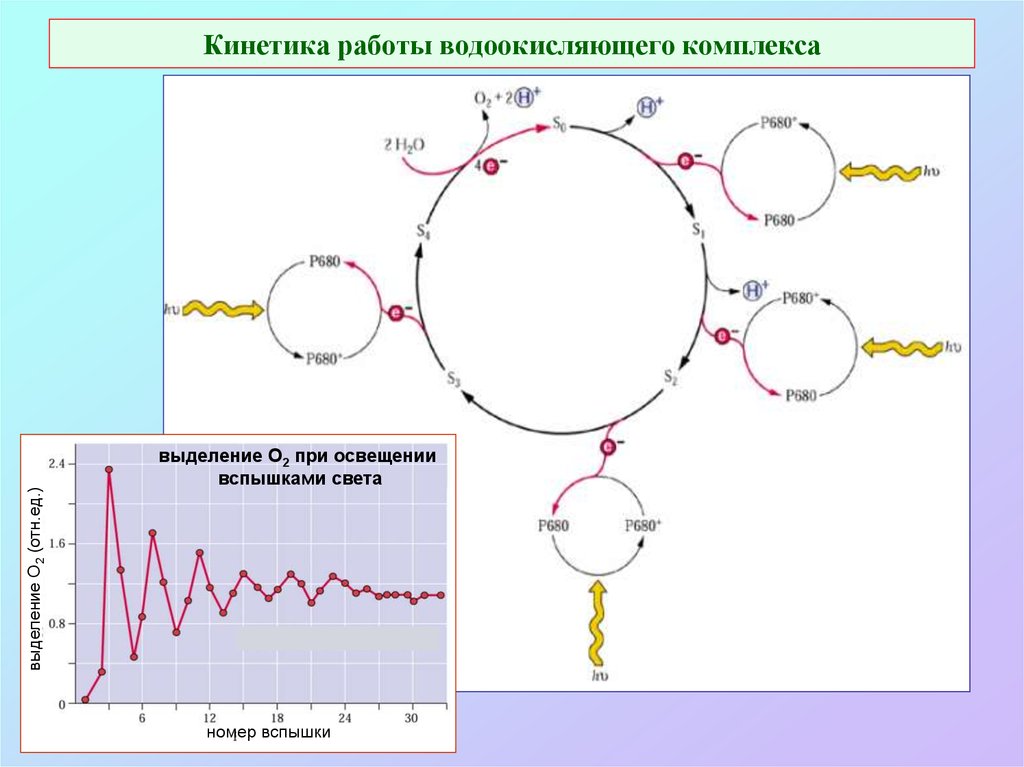
30. Кинетика работы водоокисляющего комплекса
выделение О2 (отн.ед.)Кинетика работы водоокисляющего комплекса
выделение O2 при освещении
вспышками света
номер вспышки
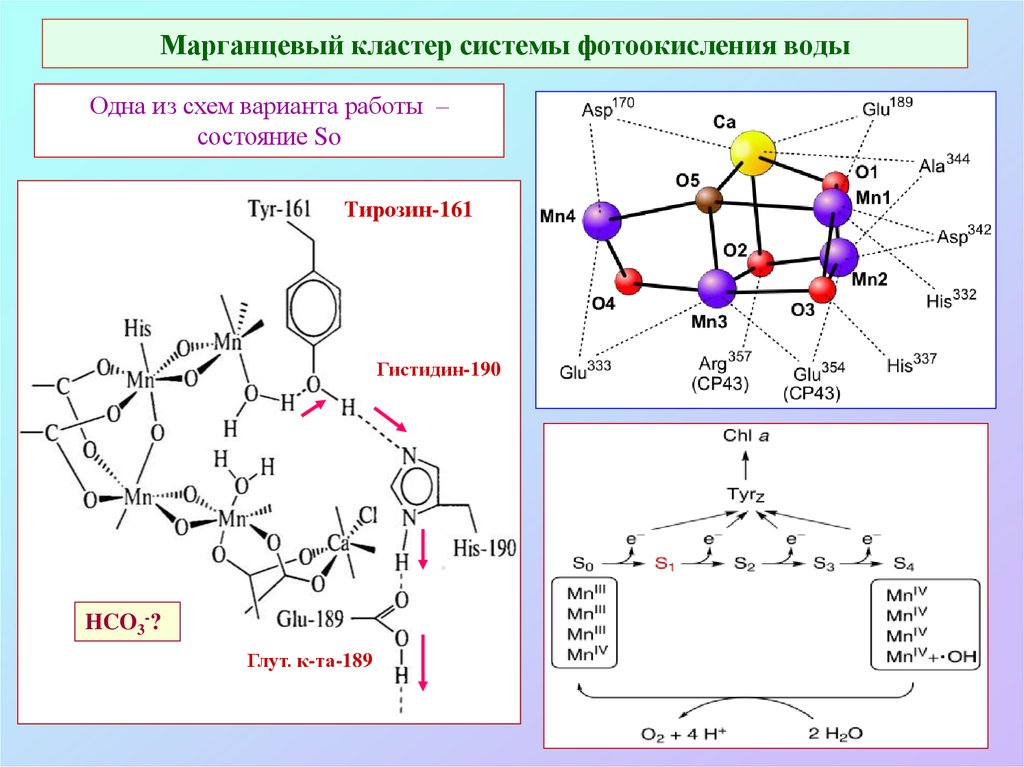
31. Марганцевый кластер системы фотоокисления воды
Одна из схем варианта работы –состояние So
Тирозин-161
Гистидин-190
HCO3-?
Глут. к-та-189
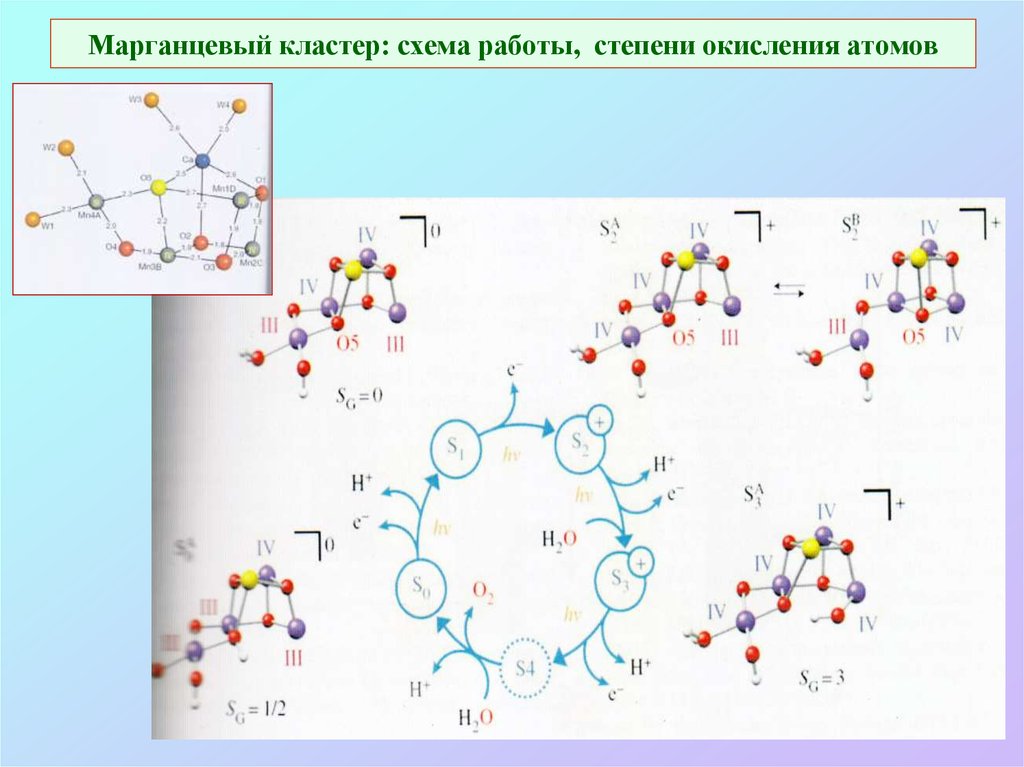
32. Марганцевый кластер: схема работы, степени окисления атомов
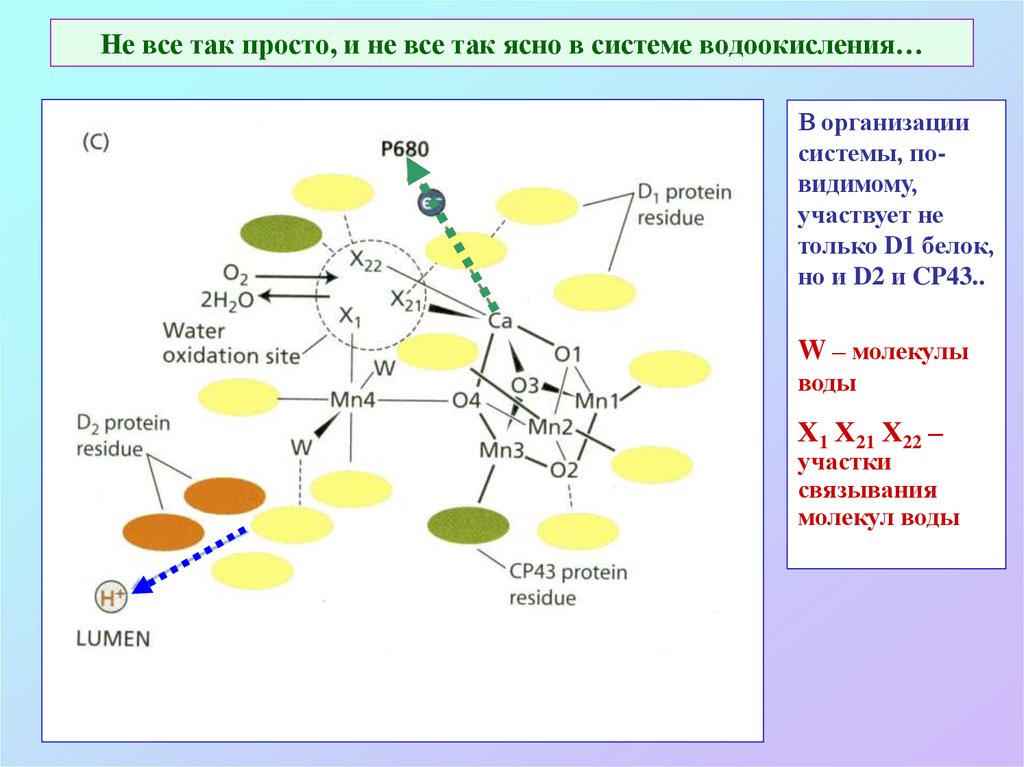
33. Не все так просто, и не все так ясно в системе водоокисления…
В организациисистемы, повидимому,
участвует не
только D1 белок,
но и D2 и CP43..
W – молекулы
воды
Х1 Х21 Х22 –
участки
связывания
молекул воды
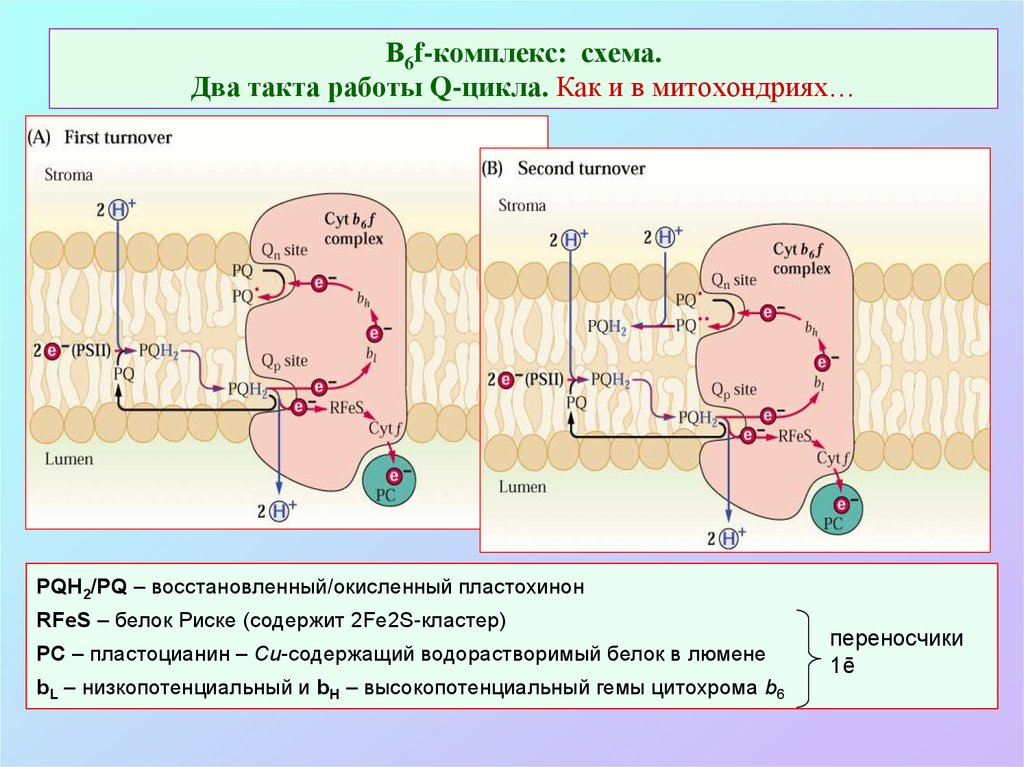
34. В6f-комплекс: схема. Два такта работы Q-цикла. Как и в митохондриях…
PQH2/PQ – восстановленный/окисленный пластохинонRFeS – белок Риске (содержит 2Fe2S-кластер)
PC – пластоцианин – Cu-содержащий водорастворимый белок в люмене
bL – низкопотенциальный и bH – высокопотенциальный гемы цитохрома b6
переносчики
1ē
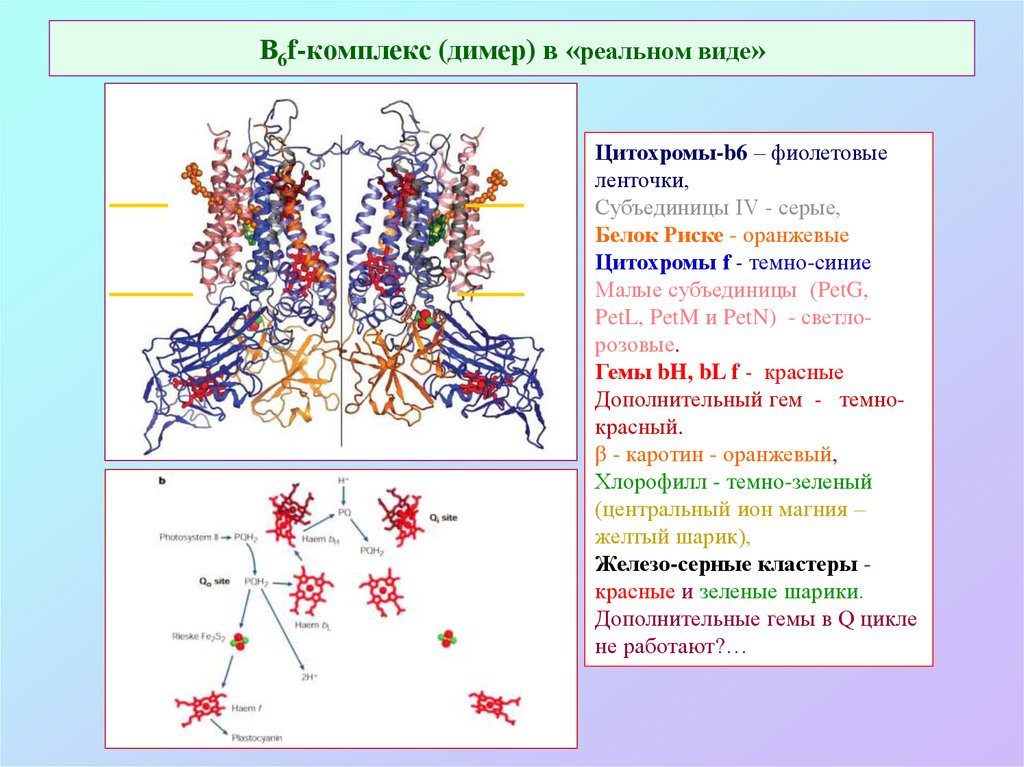
35. В6f-комплекс (димер) в «реальном виде»
Цитохромы-b6 – фиолетовыеленточки,
Субъединицы IV - серые,
Белок Риске - оранжевые
Цитохромы f - темно-синие
Малые субъединицы (PetG,
PetL, PetM и PetN) - светлорозовые.
Гемы bH, bL f - красные
Дополнительный гем - темнокрасный.
β - каротин - оранжевый,
Хлорофилл - темно-зеленый
(центральный ион магния –
желтый шарик),
Железо-серные кластеры красные и зеленые шарики.
Дополнительные гемы в Q цикле
не работают?…
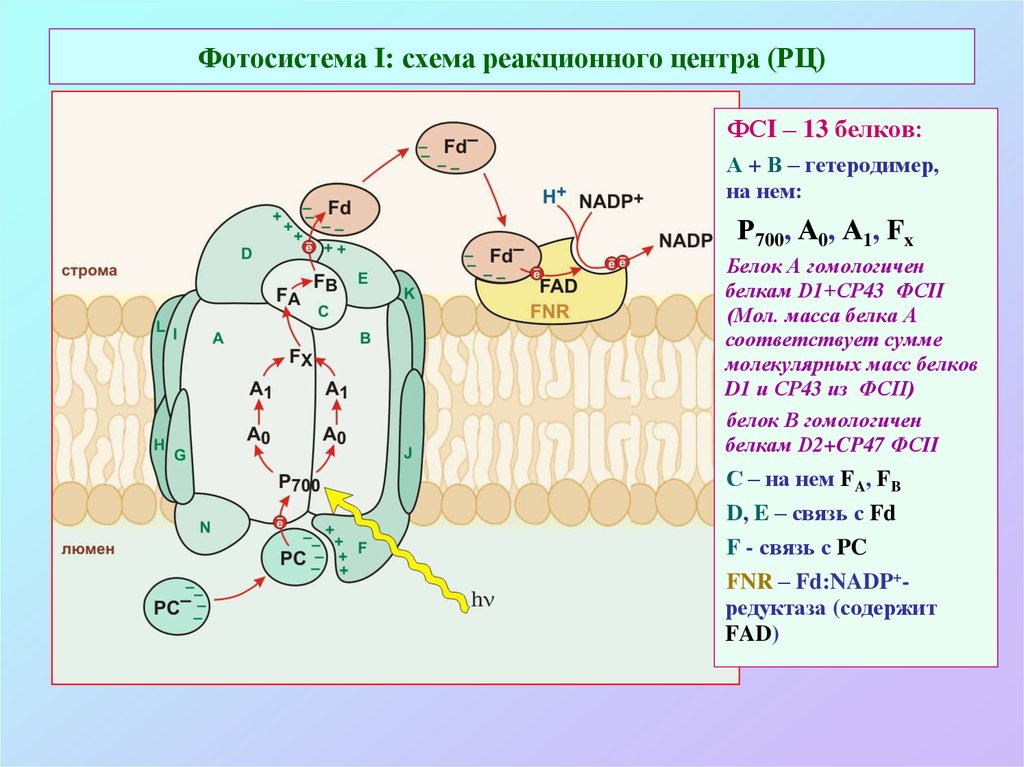
36. Фотосистема I: схема реакционного центра (РЦ)
ФСI – 13 белков:А + В – гетеродимер,
на нем:
Р700, А0, А1, Fx
Белок А гомологичен
белкам D1+СP43 ФСII
(Мол. масса белка А
соответствует сумме
молекулярных масс белков
D1 и СP43 из ФСII)
белок В гомологичен
белкам D2+CP47 ФСII
С – на нем FA, FB
D, E – связь с Fd
F - связь с PC
FNR – Fd:NADP+редуктаза (содержит
FAD)
37. Фотосистема I в «реальном виде»
В отличие от бактериального РЦ, в ФСI высших растений работаютобе ветви транспорта электронов (не симметрично)
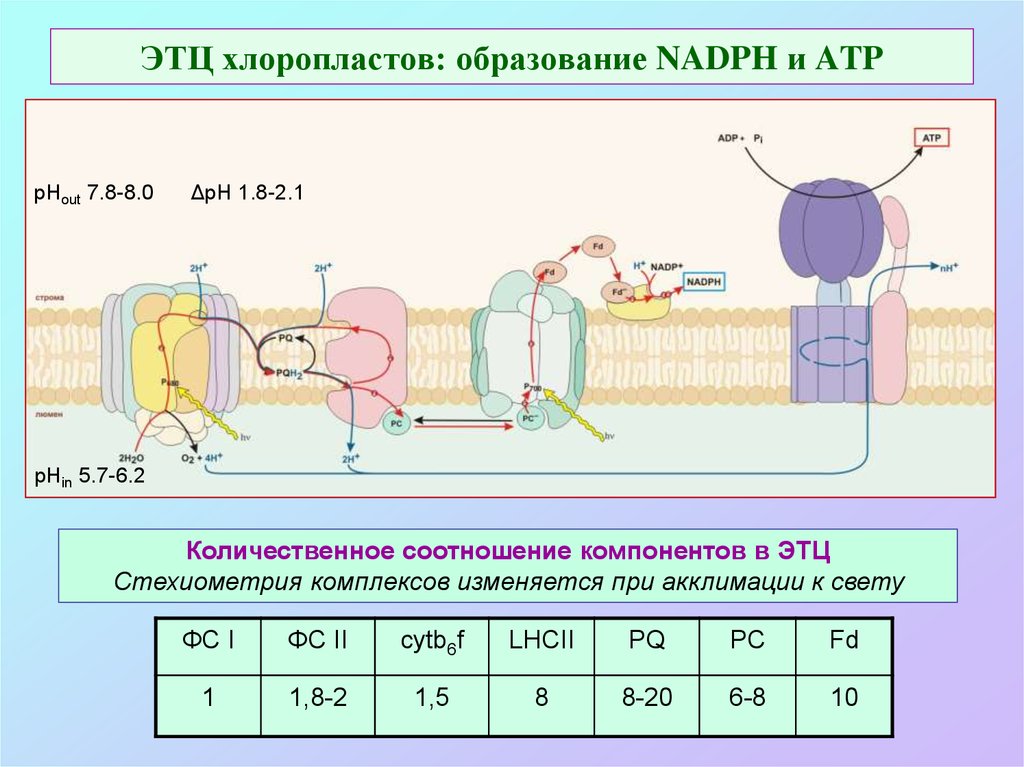
38. ЭТЦ хлоропластов: образование NADPH и ATP
рНout 7.8-8.0ΔpH 1.8-2.1
pHin 5.7-6.2
Количественное соотношение компонентов в ЭТЦ
Стехиометрия комплексов изменяется при акклимации к свету
ФС I
ФС II
cytb6f
LHCII
PQ
PC
Fd
1
1,8-2
1,5
8
8-20
6-8
10
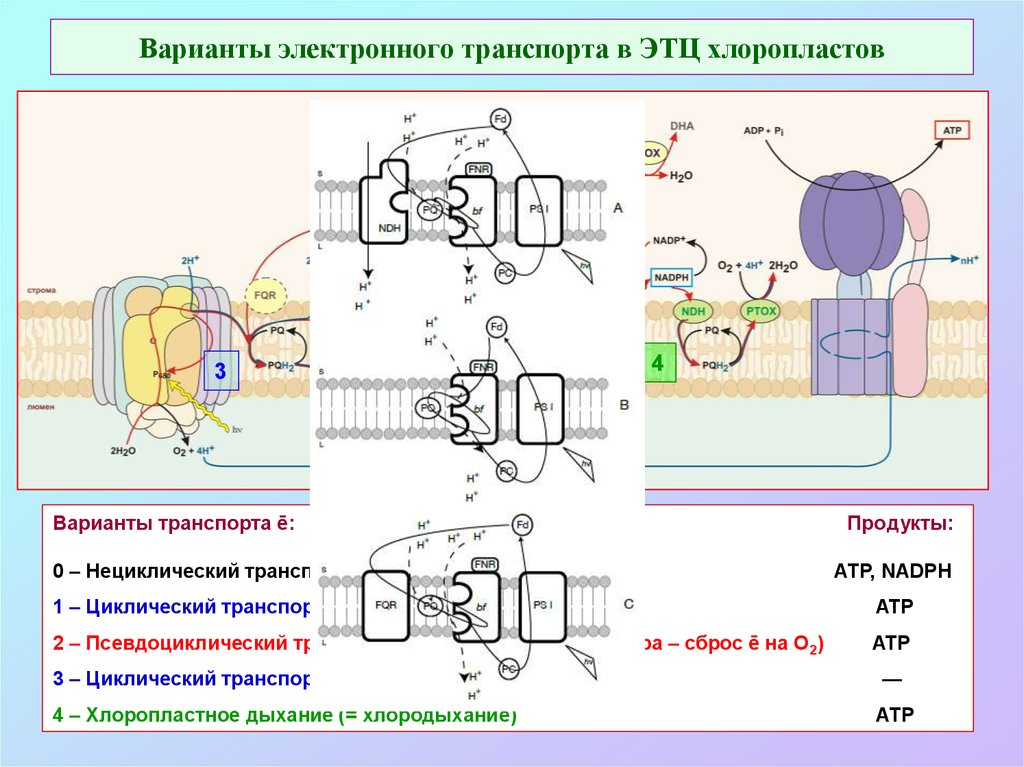
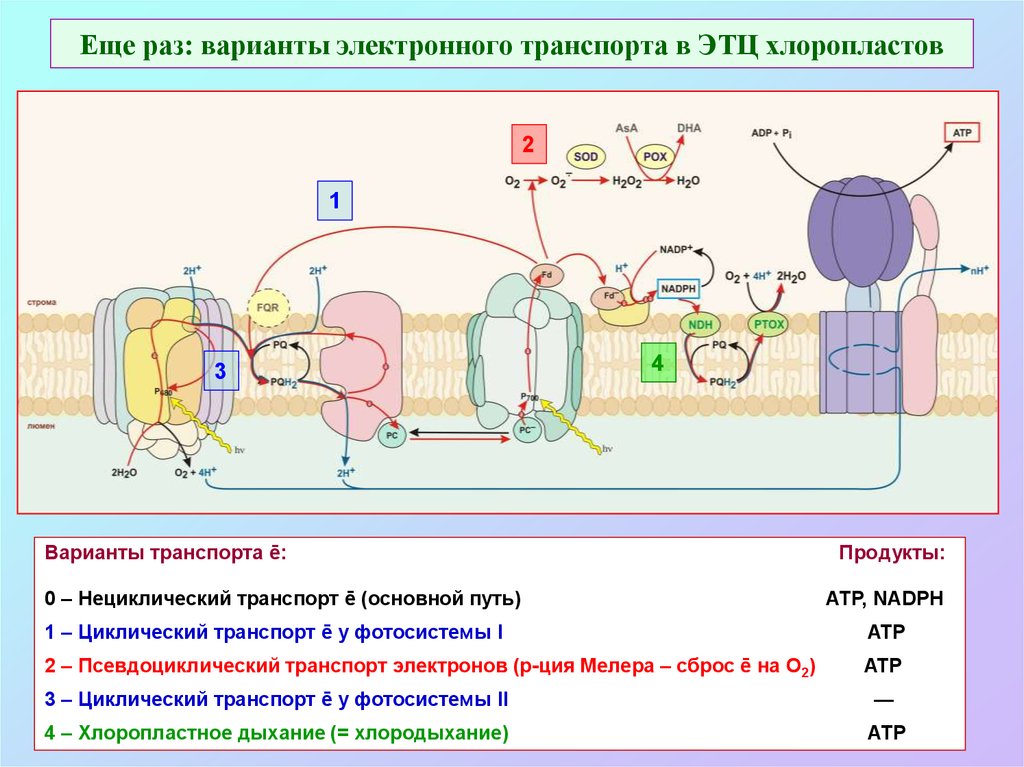
39. Варианты электронного транспорта в ЭТЦ хлоропластов
21
3
4
Варианты транспорта ē:
0 – Нециклический транспорт ē (основной путь)
Продукты:
АТР, NADPH
1 – Циклический транспорт ē у фотосистемы I
ATP
2 – Псевдоциклический транспорт электронов (р-ция Мелера – сброс ē на О2)
ATP
3 – Циклический транспорт ē у фотосистемы II
—
4 – Хлоропластное дыхание (= хлородыхание)
АТР
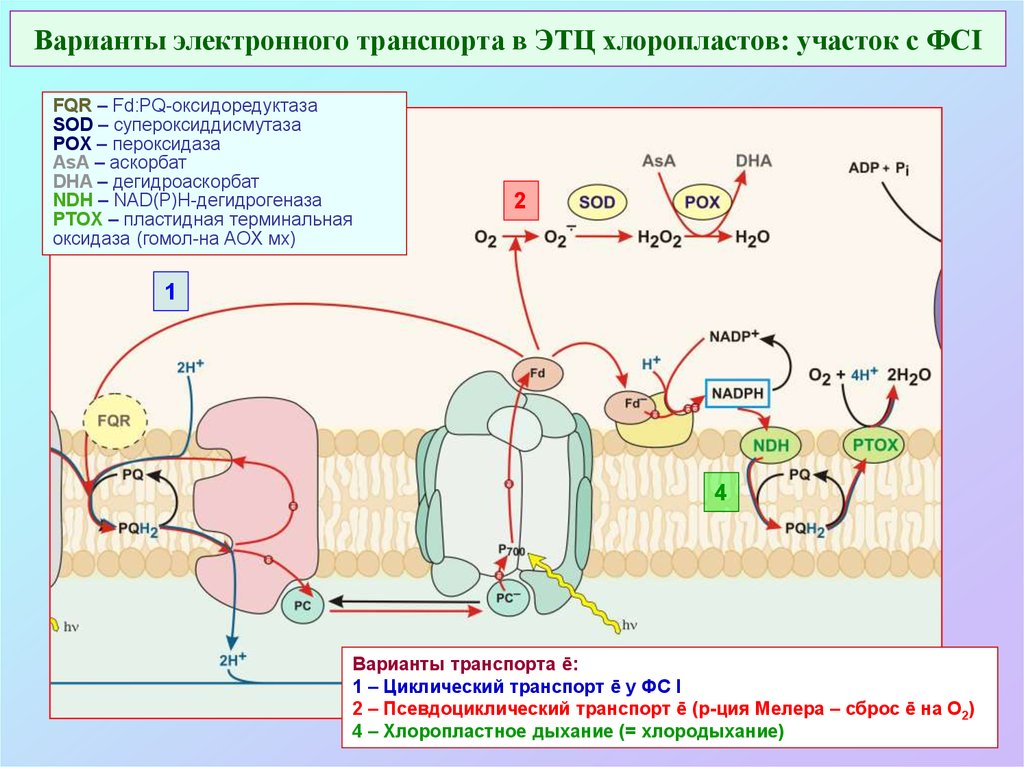
40. Варианты электронного транспорта в ЭТЦ хлоропластов: участок с ФСI
FQR – Fd:PQ-оксидоредуктазаSOD – супероксиддисмутаза
POX – пероксидаза
AsA – аскорбат
DHA – дегидроаскорбат
NDH – NAD(P)H-дегидрогеназа
PTOX – пластидная терминальная
оксидаза (гомол-на AOX мх)
2
1
4
Варианты транспорта ē:
1 – Циклический транспорт ē у ФС I
2 – Псевдоциклический транспорт ē (р-ция Мелера – сброс ē на О2)
4 – Хлоропластное дыхание (= хлородыхание)
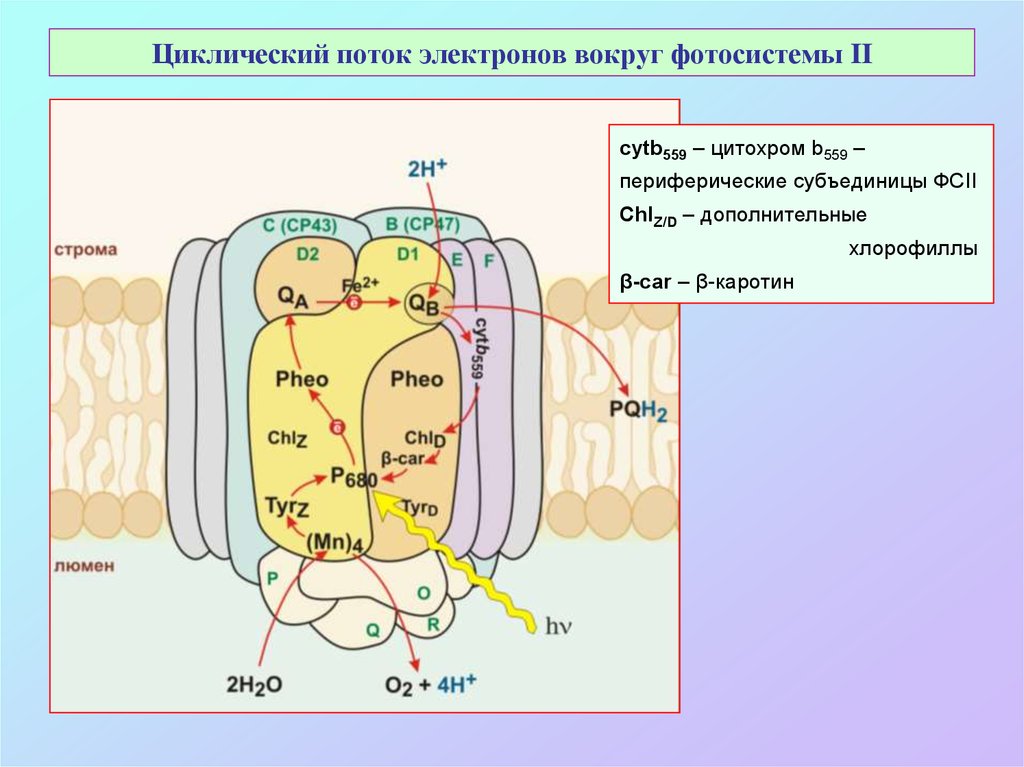
41. Циклический поток электронов вокруг фотосистемы II
cytb559 – цитохром b559 –периферические субъединицы ФСII
ChlZ/D – дополнительные
хлорофиллы
β-car – β-каротин
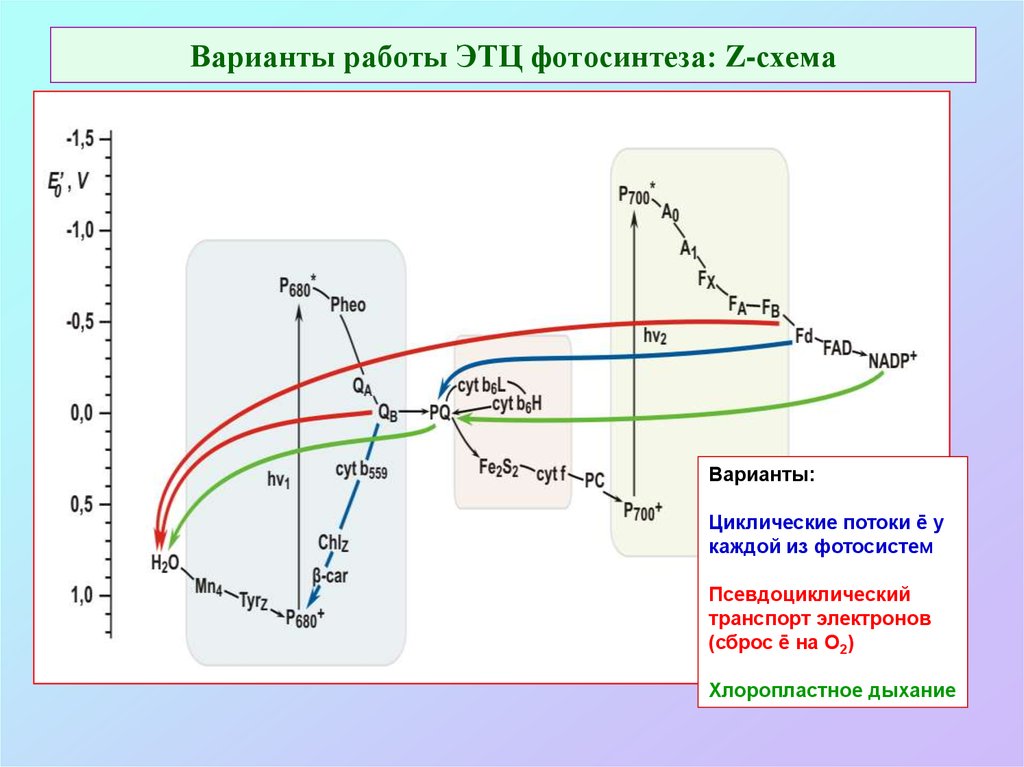
42. Варианты работы ЭТЦ фотосинтеза: Z-схема
Варианты:Циклические потоки ē у
каждой из фотосистем
Псевдоциклический
транспорт электронов
(сброс ē на О2)
Хлоропластное дыхание
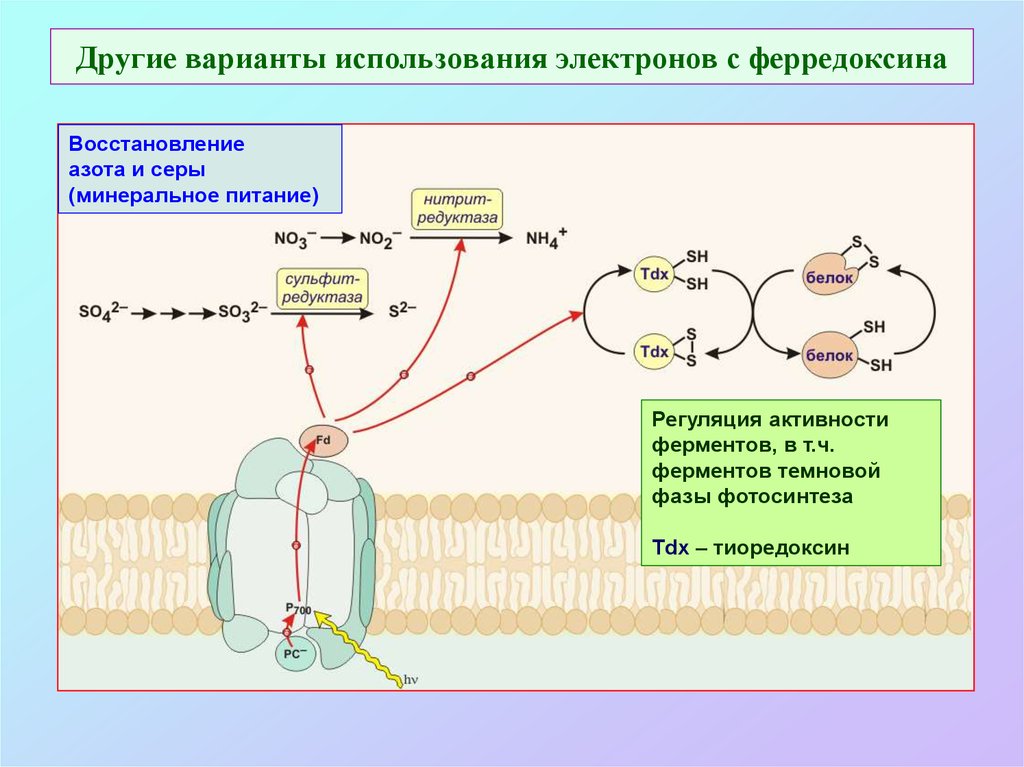
43. Другие варианты использования электронов с ферредоксина
Восстановлениеазота и серы
(минеральное питание)
Регуляция активности
ферментов, в т.ч.
ферментов темновой
фазы фотосинтеза
Tdx – тиоредоксин
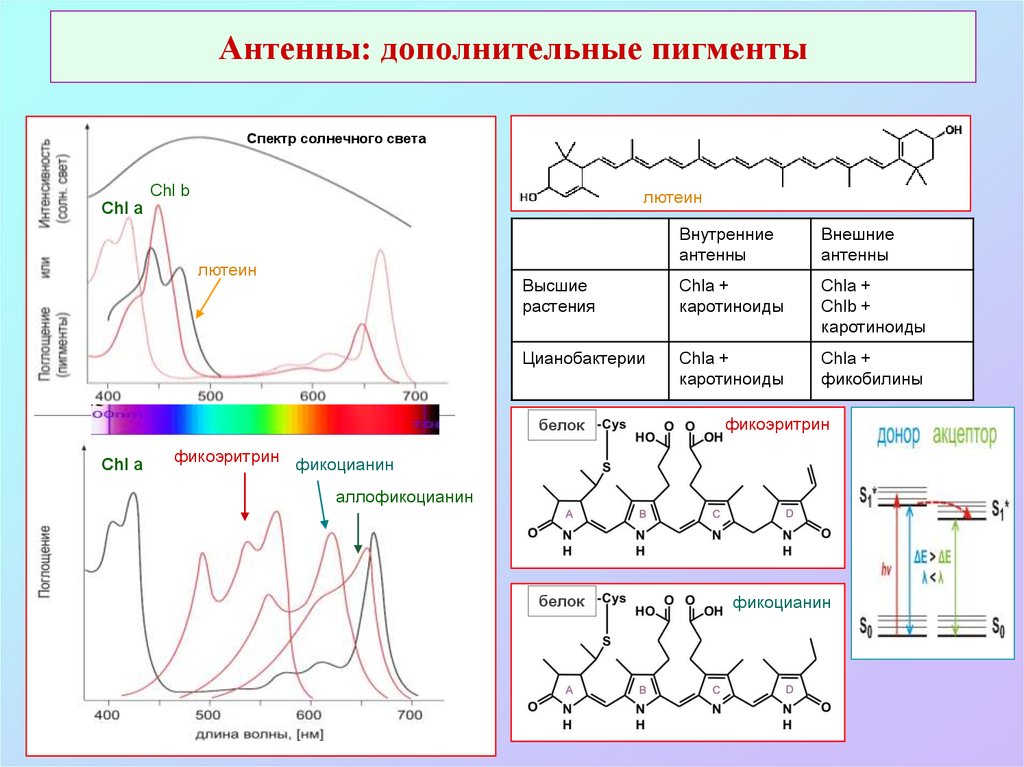
44. Антенны: дополнительные пигменты
Спектр солнечного светаChl b
лютеин
Chl a
лютеин
Chl a
Внутренние
антенны
Внешние
антенны
Высшие
растения
Chla +
каротиноиды
Chla +
Chlb +
каротиноиды
Цианобактерии
Chla +
каротиноиды
Chla +
фикобилины
белок
фикоэритрин
белок
фикоцианин
фикоэритрин фикоцианин
аллофикоцианин
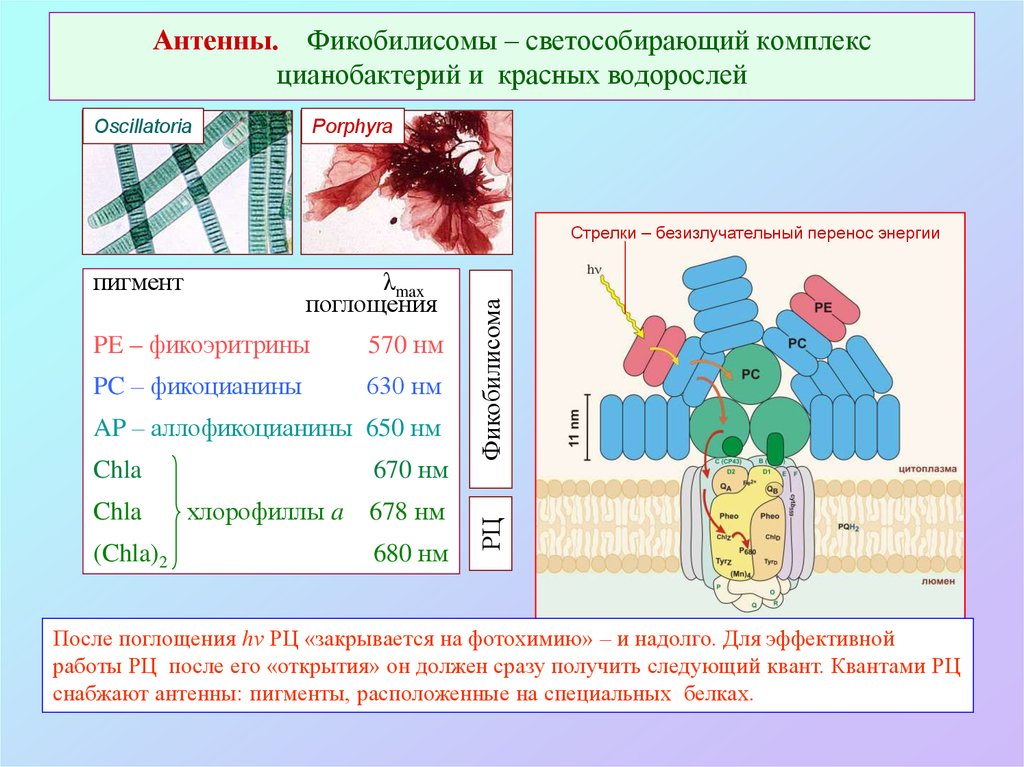
45. Антенны. Фикобилисомы – светособирающий комплекс цианобактерий и красных водорослей
OscillatoriaPorphyra
λmax
поглощения
PE – фикоэритрины
570 нм
PC – фикоцианины
630 нм
AP – аллофикоцианины 650 нм
670 нм
Chla
Chla
(Chla)2
хлорофиллы a
678 нм
680 нм
РЦ
пигмент
Фикобилисома
Стрелки – безизлучательный перенос энергии
После поглощения hν РЦ «закрывается на фотохимию» – и надолго. Для эффективной
работы РЦ после его «открытия» он должен сразу получить следующий квант. Квантами РЦ
снабжают антенны: пигменты, расположенные на специальных белках.
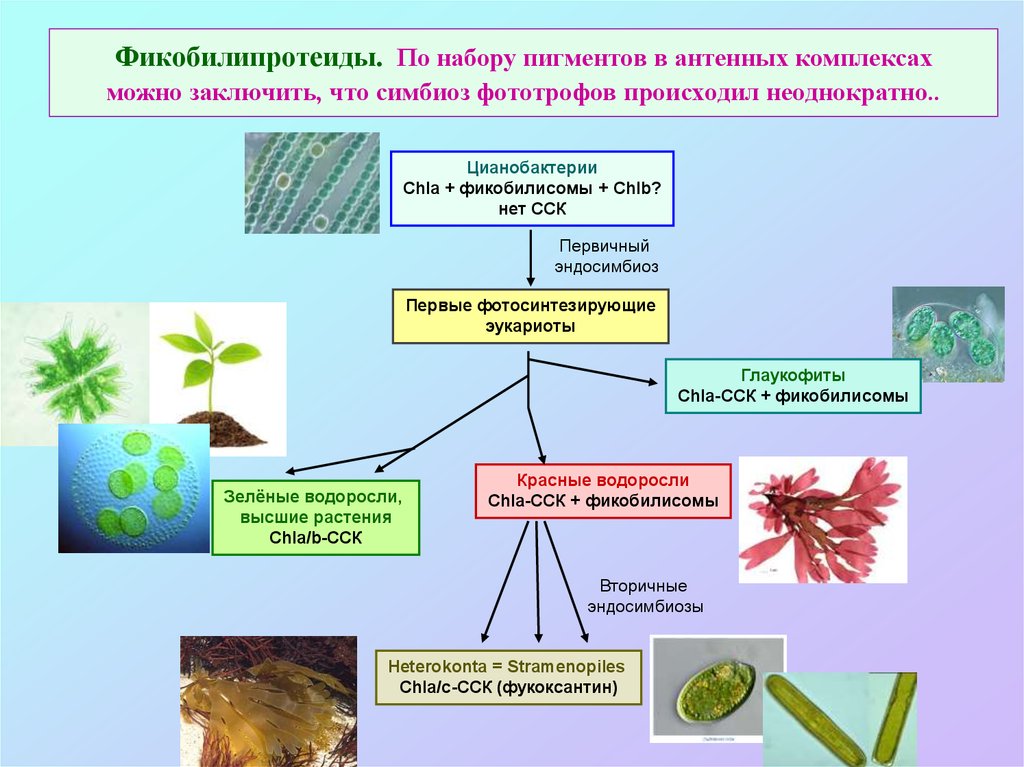
46. Фикобилипротеиды. По набору пигментов в антенных комплексах можно заключить, что симбиоз фототрофов происходил неоднократно..
ЦианобактерииChla + фикобилисомы + Chlb?
нет CСК
Первичный
эндосимбиоз
Первые фотосинтезирующие
эукариоты
Глаукофиты
Chla-CСК + фикобилисомы
Зелёные водоросли,
высшие растения
Chla/b-CСК
Красные водоросли
Chla-CСК + фикобилисомы
Вторичные
эндосимбиозы
Heterokonta = Stramenopiles
Chla/c-CСК (фукоксантин)
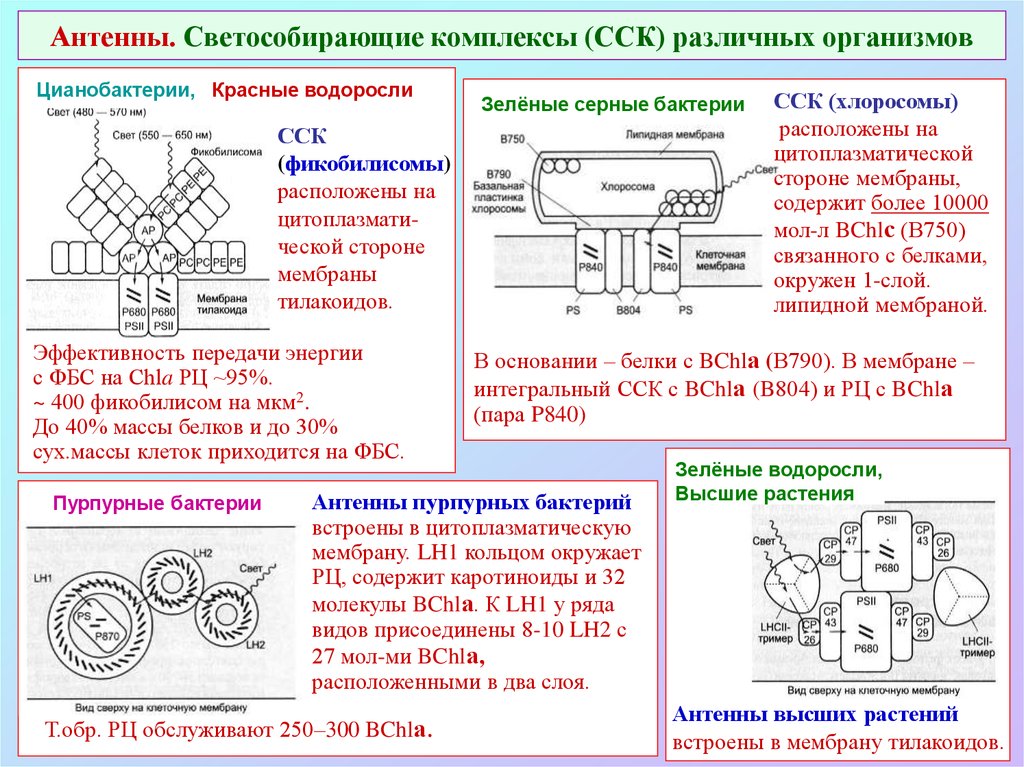
47. Антенны. Светособирающие комплексы (ССК) различных организмов
Цианобактерии, Красные водорослиЗелёные серные бактерии
ССК
(фикобилисомы)
расположены на
цитоплазматической стороне
мембраны
тилакоидов.
Эффективность передачи энергии
с ФБС на Chla РЦ ~95%.
~ 400 фикобилисом на мкм2.
До 40% массы белков и до 30%
сух.массы клеток приходится на ФБС.
Пурпурные бактерии
В основании – белки с BChlа (В790). В мембране –
интегральный ССК с BChlа (B804) и РЦ с BChlа
(пара P840)
Антенны пурпурных бактерий
встроены в цитоплазматическую
мембрану. LH1 кольцом окружает
РЦ, содержит каротиноиды и 32
молекулы BChlа. К LH1 у ряда
видов присоединены 8-10 LH2 с
27 мол-ми BChlа,
расположенными в два слоя.
Т.обр. РЦ обслуживают 250–300 BChlа.
ССК (хлоросомы)
расположены на
цитоплазматической
стороне мембраны,
содержит более 10000
мол-л BChlс (В750)
связанного с белками,
окружен 1-слой.
липидной мембраной.
Зелёные водоросли,
Высшие растения
Антенны высших растений
встроены в мембрану тилакоидов.
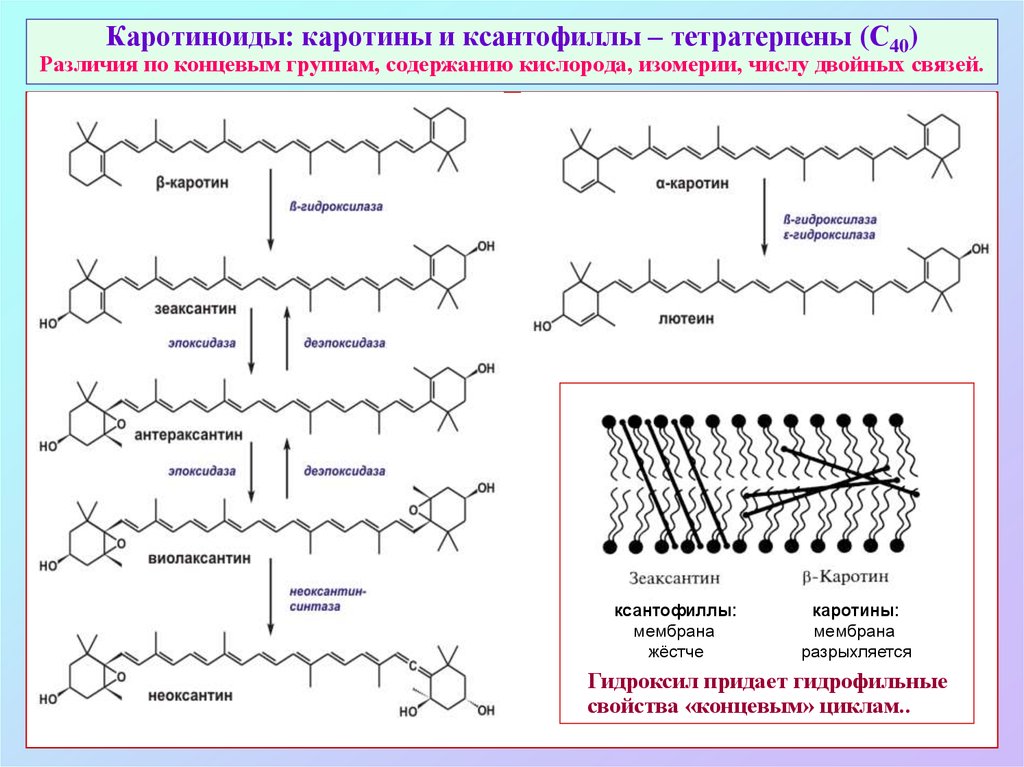
48. Каротиноиды: каротины и ксантофиллы – тетратерпены (С40) Различия по концевым группам, содержанию кислорода, изомерии, числу
двойных связей.ксантофиллы:
мембрана
жёстче
каротины:
мембрана
разрыхляется
Гидроксил придает гидрофильные
свойства «концевым» циклам..
49. Развлечения господ инженеров. Генных…
Колонии E.coli, экспрессирующие геныбиосинтеза соответствующих каротиноидов
λmax,
нм
3
286
5
347
7
400
9
439
11
472
11
11
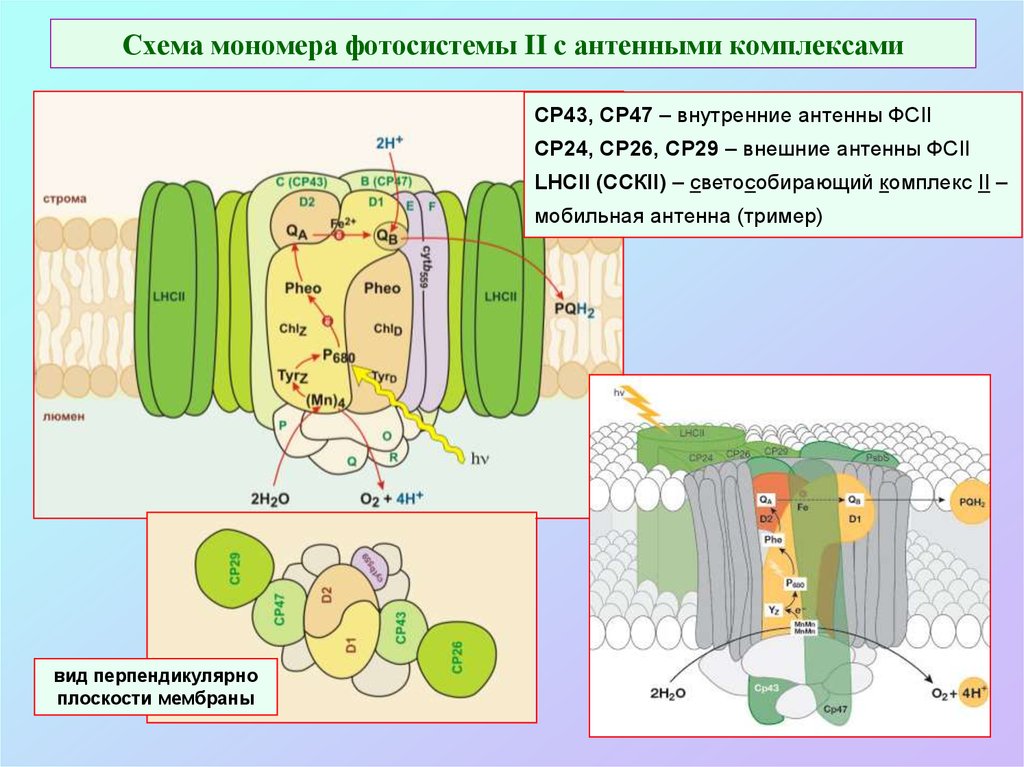
50. Схема мономера фотосистемы II с антенными комплексами
СР43, СР47 – внутренние антенны ФСIICP24, CP26, CP29 – внешние антенны ФСII
LHCII (ССКII) – светособирающий комплекс II –
мобильная антенна (тример)
вид перпендикулярно
плоскости мембраны
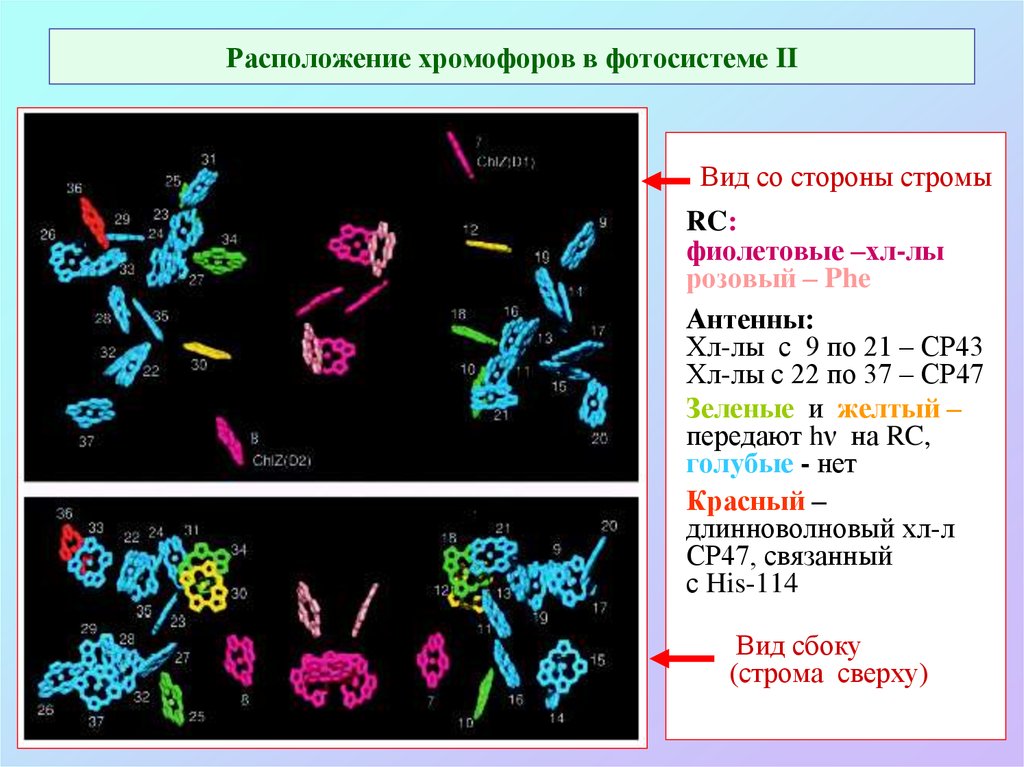
51. Расположение хромофоров в фотосистеме II
Вид со стороны стромыRC:
фиолетовые –хл-лы
розовый – Phe
Антенны:
Хл-лы с 9 по 21 – СР43
Хл-лы с 22 по 37 – СР47
Зеленые и желтый –
передают hν на RC,
голубые - нет
Красный –
длинноволновый хл-л
СР47, связанный
с His-114
Вид сбоку
(строма сверху)
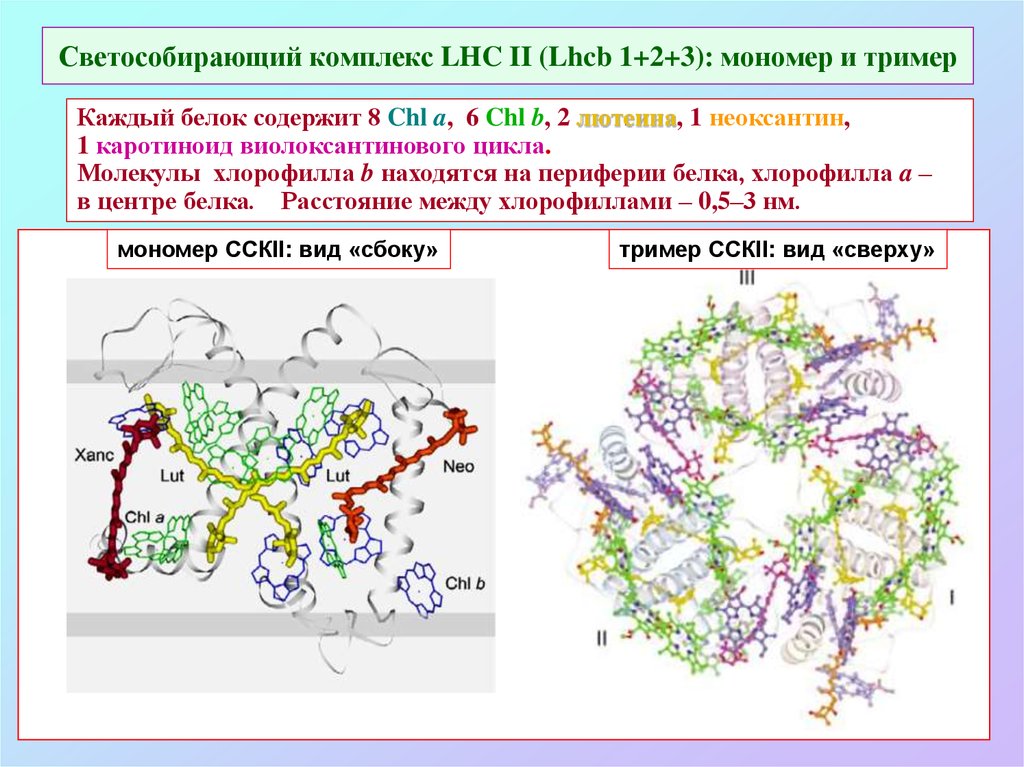
52. Светособирающий комплекс LHC II (Lhcb 1+2+3): мономер и тример
Каждый белок содержит 8 Chl a, 6 Chl b, 2 лютеина, 1 неоксантин,1 каротиноид виолоксантинового цикла.
Молекулы хлорофилла b находятся на периферии белка, хлорофилла a –
в центре белка. Расстояние между хлорофиллами – 0,5–3 нм.
мономер ССКII: вид «сбоку»
тример ССКII: вид «сверху»
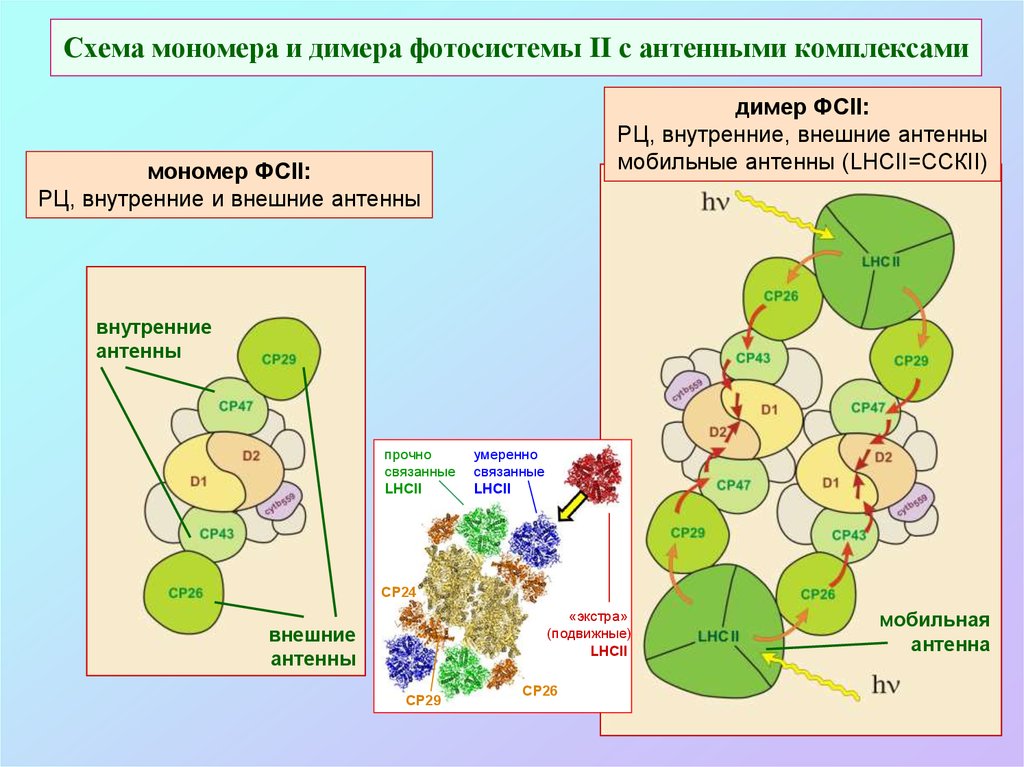
53. Схема мономера и димера фотосистемы II с антенными комплексами
димер ФСII:РЦ, внутренние, внешние антенны
мобильные антенны (LHCII=ССКII)
мономер ФСII:
РЦ, внутренние и внешние антенны
внутренние
антенны
прочно
связанные
LHCII
умеренно
связанные
LHCII
СР24
«экстра»
(подвижные)
LHCII
внешние
антенны
СР29
СР26
мобильная
антенна
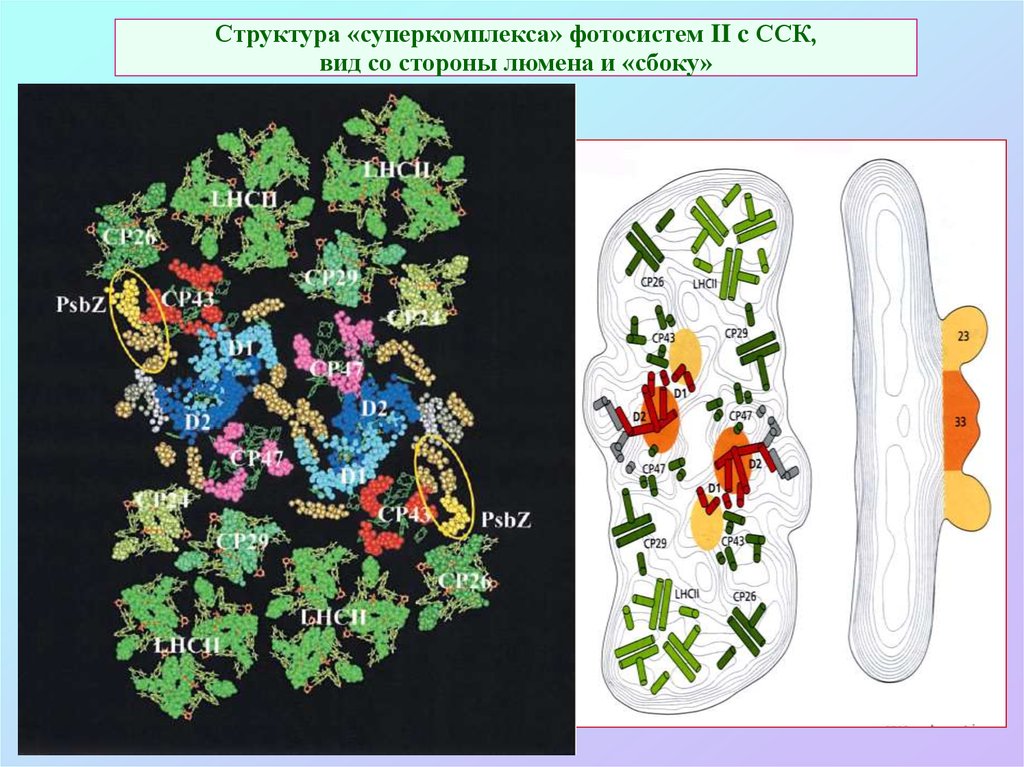
54. Структура «суперкомплекса» фотосистем II c ССК, вид со стороны люмена и «сбоку»
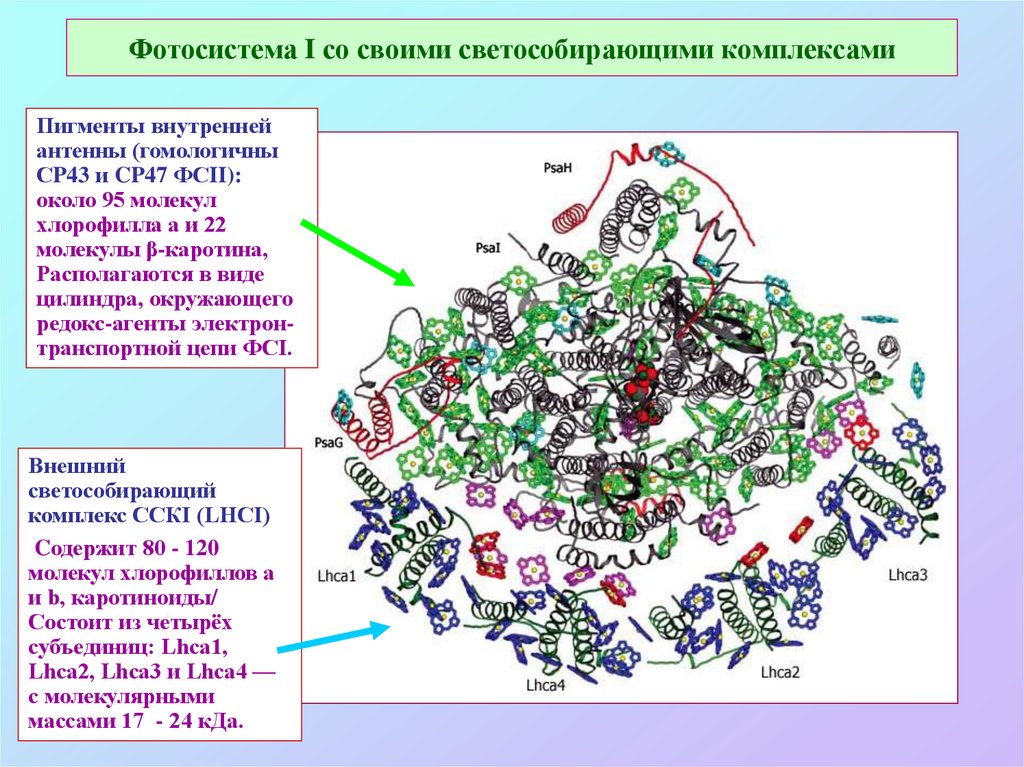
55. Фотосистема I со своими светособирающими комплексами
Пигменты внутреннейантенны (гомологичны
СP43 и CP47 ФСII):
около 95 молекул
хлорофилла а и 22
молекулы β-каротина,
Располагаются в виде
цилиндра, окружающего
редокс-агенты электронтранспортной цепи ФСI.
Внешний
светособирающий
комплекс ССКI (LHCI)
Cодержит 80 - 120
молекул хлорофиллов а
и b, каротиноиды/
Состоит из четырёх
субъединиц: Lhca1,
Lhca2, Lhca3 и Lhca4 —
с молекулярными
массами 17 - 24 кДа.
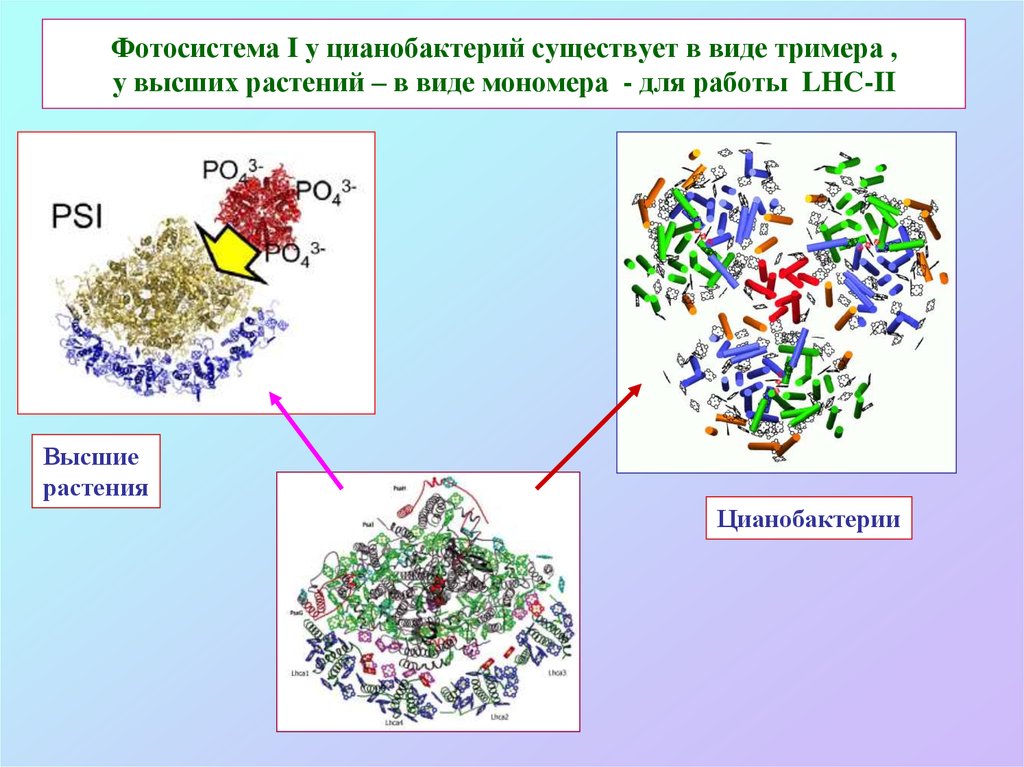
56. Фотосистема I у цианобактерий существует в виде тримера , у высших растений – в виде мономера - для работы LHC-II
Высшиерастения
Цианобактерии
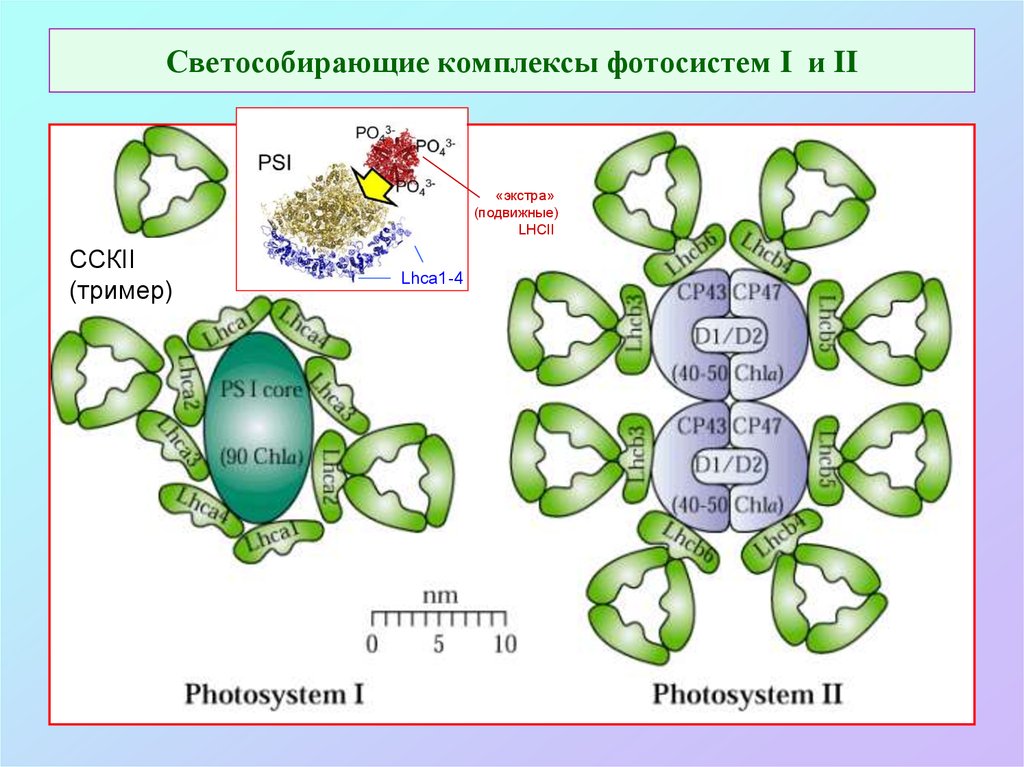
57. Светособирающие комплексы фотосистем I и II
«экстра»(подвижные)
LHCII
ССКII
(тример)
Lhca1-4
58. Состав хлорофилл-белковых комплексов ФСI и ФСII
Фотосисте
ма
Реакционный
центр
Внутренние антенны
(фокусирующие)
Внешние антенны
ФСII
D1, D2, cytb559
6 Chla, 2 β-car,
2 Pheo, …
CP43, CP47
13 и 16 Chla, 9 β-car
CP29, CР26, CP24 и др.
(=Lhcb4,5,6)
Chla+Chlb (a/b=1,5),
ксантофиллы
ФСI
А, В
6 Chla, 2 β-car,
…
те же А, В
79 Chla, 20 β-car
(+ 11 Chla на периф.б.)
Lhca1,2,3,4 (ССК I)
Chla+Chlb (a/b=3,5),
ксантофиллы
Мобильная
антенна
ССКII
Lhcb1,2,3
8 Chla +
6 Chlb +
2 Lut +
1 Neo +
1 Zea/Viol
на каждом
белке
(a/b=1,3)
Одна «фотосинтетическая единица» – т.е. одна ЭТЦ (от ФСII до ФСI) – обслуживается
примерно 500 молекулами пигментов: хлорофиллы a и b, каротиноиды.
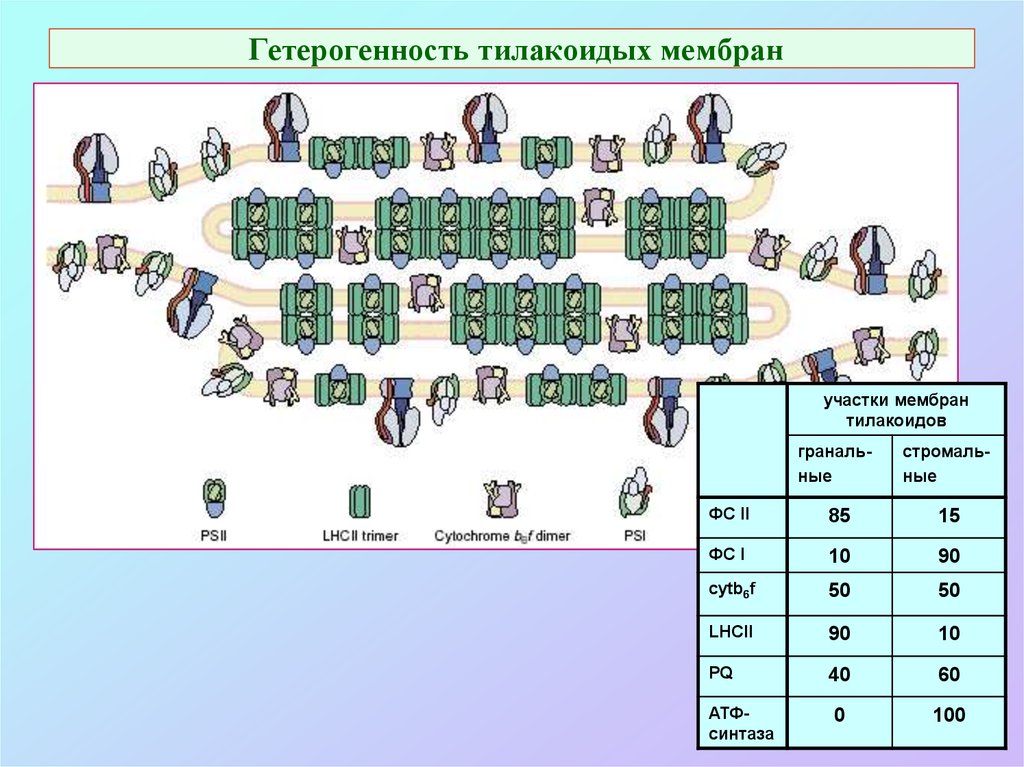
59. Гетерогенность тилакоидых мембран
участки мембрантилакоидов
гранальные
стромальные
ФС II
85
15
ФС I
10
90
cytb6f
50
50
LHCII
90
10
PQ
40
60
0
100
АТФсинтаза
60.
Hosta‘Piedmont Gold’
Hosta
‘Golden Haze’
Hosta sieboldiana
‘Elegans’
61. Механизмы регулирования и защиты ФСII от фотодеструкции
• нециклический поток, регулирование мобильнымиантеннами;
• циклические потоки вокруг каждой фотосистемы;
• псевдоциклический транспорт электронов
• Хлоропластное дыхание - ?
• виолоксантиновый цикл
• «тушение» триплетного состояния хлорофилла
каротиноидами
• «обезвреживание» активных форм кислорода
каротиноидами
• каротиноиды «на заклание»
• замена D1-белка
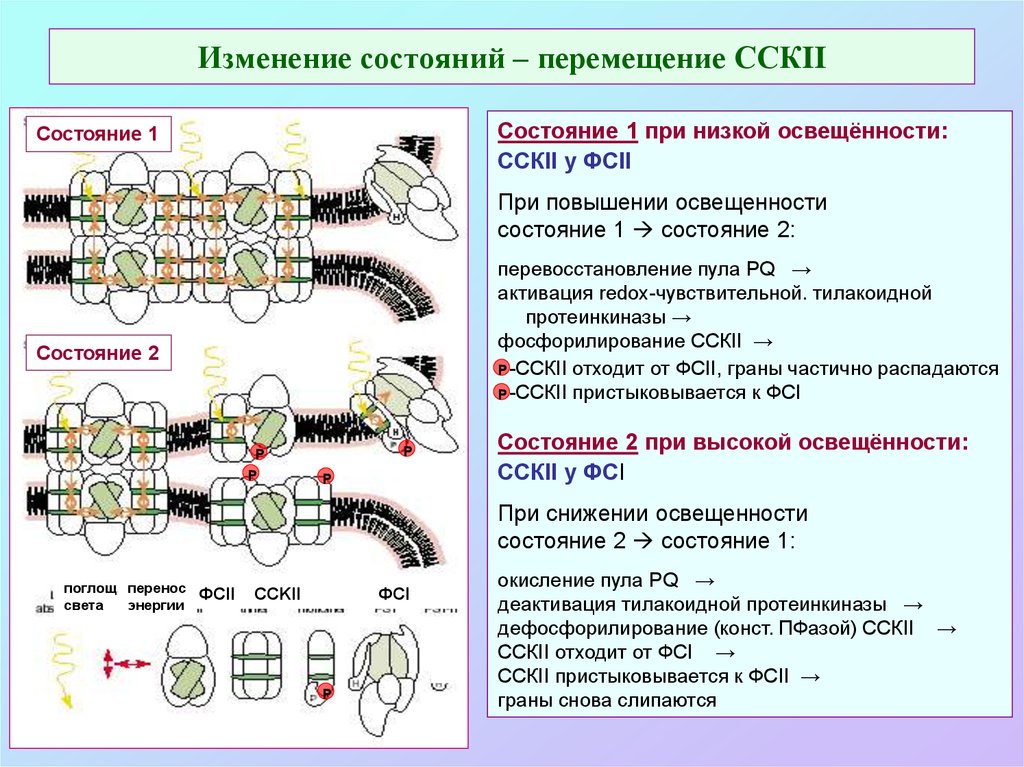
62. Изменение состояний – перемещение ССКII
Состояние 1 при низкой освещённости:ССКII у ФСII
Состояние 1
При повышении освещенности
состояние 1 состояние 2:
перевосстановление пула PQ →
активация redox-чувствительной. тилакоидной
протеинкиназы →
фосфорилирование ССКII →
Р -ССКII отходит от ФСII, граны частично распадаются
Р -ССКII пристыковывается к ФСI
Состояние 2
Р
Р
Р
Р
Состояние 2 при высокой освещённости:
ССКII у ФСI
При снижении освещенности
состояние 2 состояние 1:
поглощ. перенос
света
энергии
ФСII
ФСI
CCKII
Р
окисление пула PQ →
деактивация тилакоидной протеинкиназы →
дефосфорилирование (конст. ПФазой) ССКII →
ССКII отходит от ФСI →
ССКII пристыковывается к ФСII →
граны снова слипаются
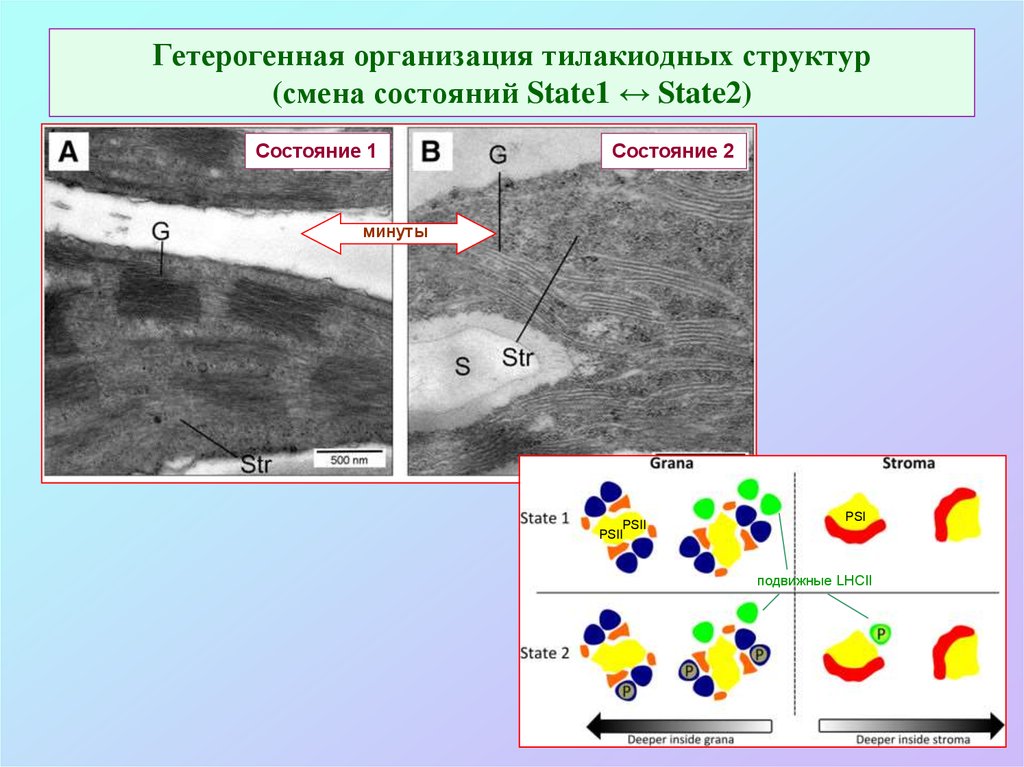
63. Гетерогенная организация тилакиодных структур (смена состояний State1 ↔ State2)
Состояние 1Состояние 2
минуты
PSII
PSII
PSI
подвижные LHCII
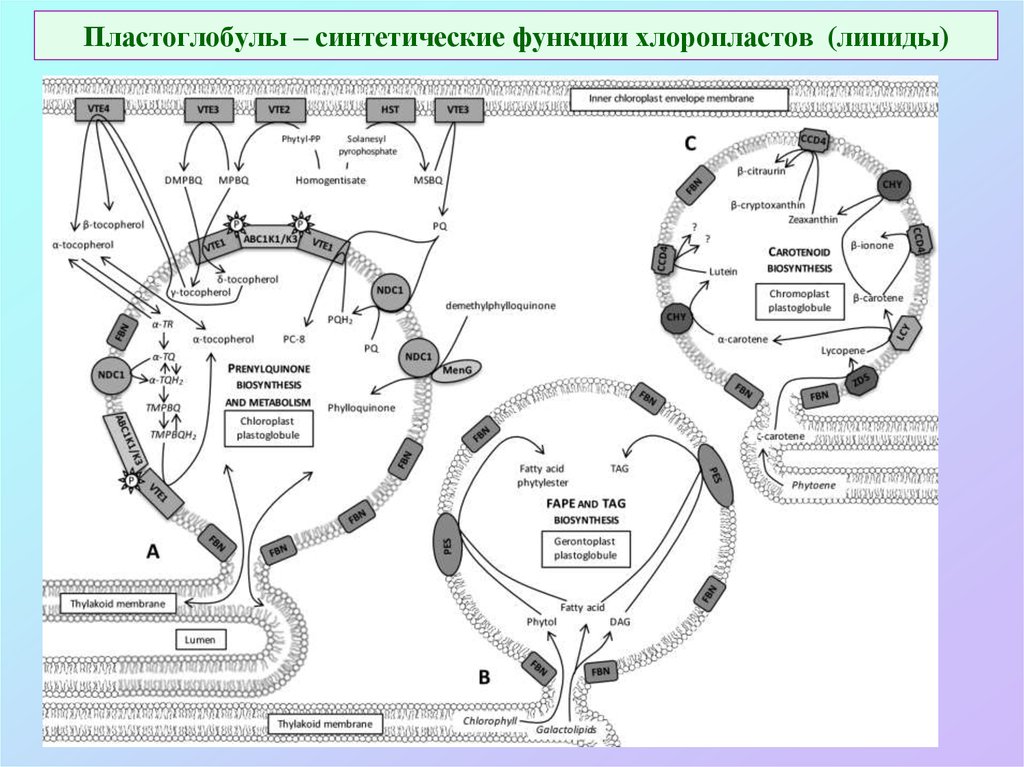
64. Пластоглобулы – синтетические функции хлоропластов (липиды)
65. Еще раз: варианты электронного транспорта в ЭТЦ хлоропластов
21
3
4
Варианты транспорта ē:
0 – Нециклический транспорт ē (основной путь)
Продукты:
АТР, NADPH
1 – Циклический транспорт ē у фотосистемы I
ATP
2 – Псевдоциклический транспорт электронов (р-ция Мелера – сброс ē на О2)
ATP
3 – Циклический транспорт ē у фотосистемы II
—
4 – Хлоропластное дыхание (= хлородыхание)
АТР
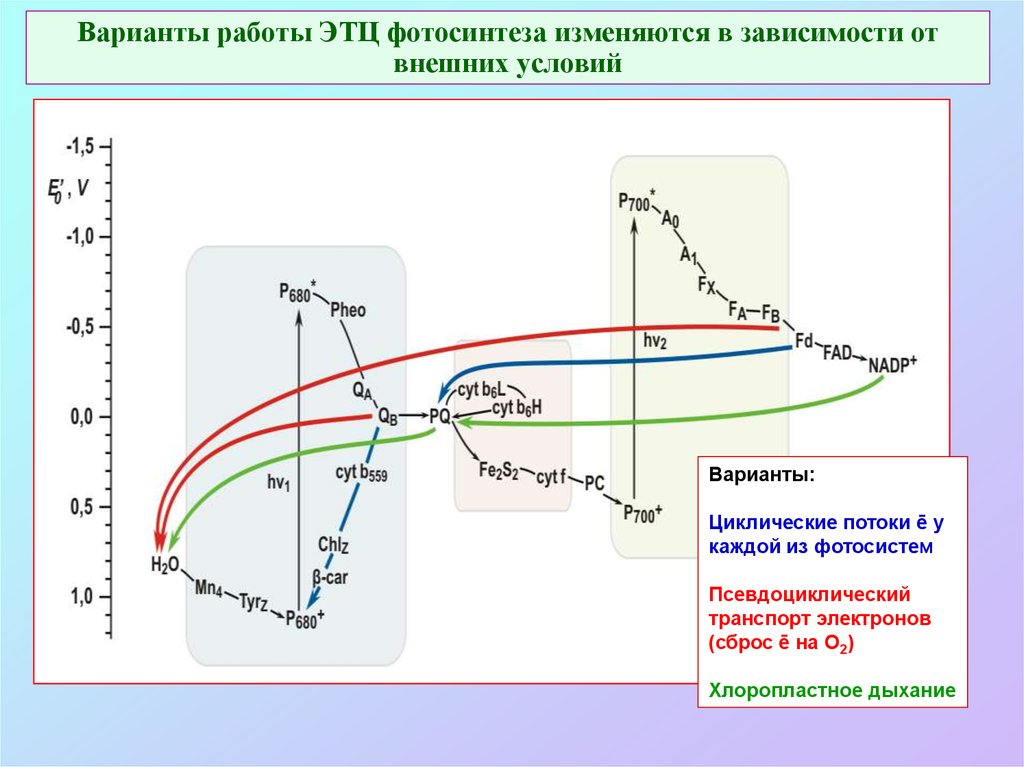
66. Варианты работы ЭТЦ фотосинтеза изменяются в зависимости от внешних условий
Варианты:Циклические потоки ē у
каждой из фотосистем
Псевдоциклический
транспорт электронов
(сброс ē на О2)
Хлоропластное дыхание
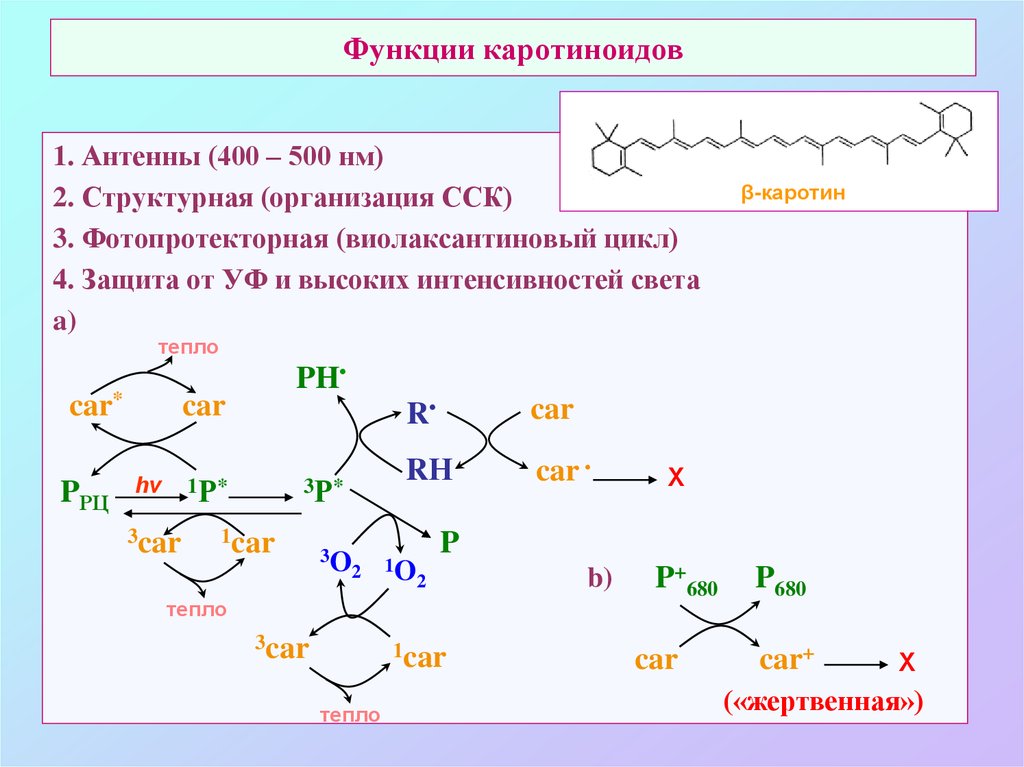
67. Функции каротиноидов
1. Антенны (400 – 500 нм)2. Структурная (организация ССК)
3. Фотопротекторная (виолаксантиновый цикл)
4. Защита от УФ и высоких интенсивностей света
a)
β-каротин
тепло
car*
PРЦ
PH
car
1Р*
hν
3car
3Р*
1car
3O
2
R
car
RН
car
1O
P
2
тепло
3car
1car
тепло
Х
b)
P+680
car
P680
car+
Х
(«жертвенная»)
68. Каротиноиды в хлоропластах
1. Разные состояния: мономерная или агрегированная форма, связь с белками.2. Изомеры: транс – в антеннах, цис – в РЦ. При этом в РЦ – β-каротины, в
ССК – ксантофиллы.
Ядро ФС I высших растений содержит 24 молекул β-каротина (2 в РЦ, 22 – во
внутренней антенне. из них 5 – в цис-конформации).
Ядро ФС II: на D1 и D2 белках расположены симметрично 2 молекулы
β-каротина. На D1 – все-транс форма, на D2 – 15-цис форма. Внутренняя
антенна (СР43 и СР47) – 2-3 молекулы β-каротина и несколько молекул
лютеина. ССК (СР24, СР26, СР29) – в каждом 1 -2 молекулы лютеина, а также
молекулы неоксантина, зеаксантина, антероксантина и виолоксантина.
Антенная функция – все-транс форма.
Защитные функции - все-транс форма β-каротина на D1 белке –
альтернативный донор е- для Р680 при низких tо и нарушении работы OEC.
15-цис форма на D2 – тушение триплета Р680 за счет изомеризации во всетранс-форму.
69. Виолоксантиновый цикл – основа «нефотохимического тушения»
люменмембрана тилакоида
строма
Энергия S1 ниже
S1 хлорофилла
S2*
виолаксантин
эпоксидаза
антераксантин
деэпоксидаза
эпоксидаза
S0
тепл
о
hv
деэпоксидаза
S1*
Viol Chl Zea
зеаксантин
pHopt 5,0
AscH– – аскорбат
DHA - дегидроаскорбат
pHopt 7,6
Энергия S1 выше
S1 хлорофилла
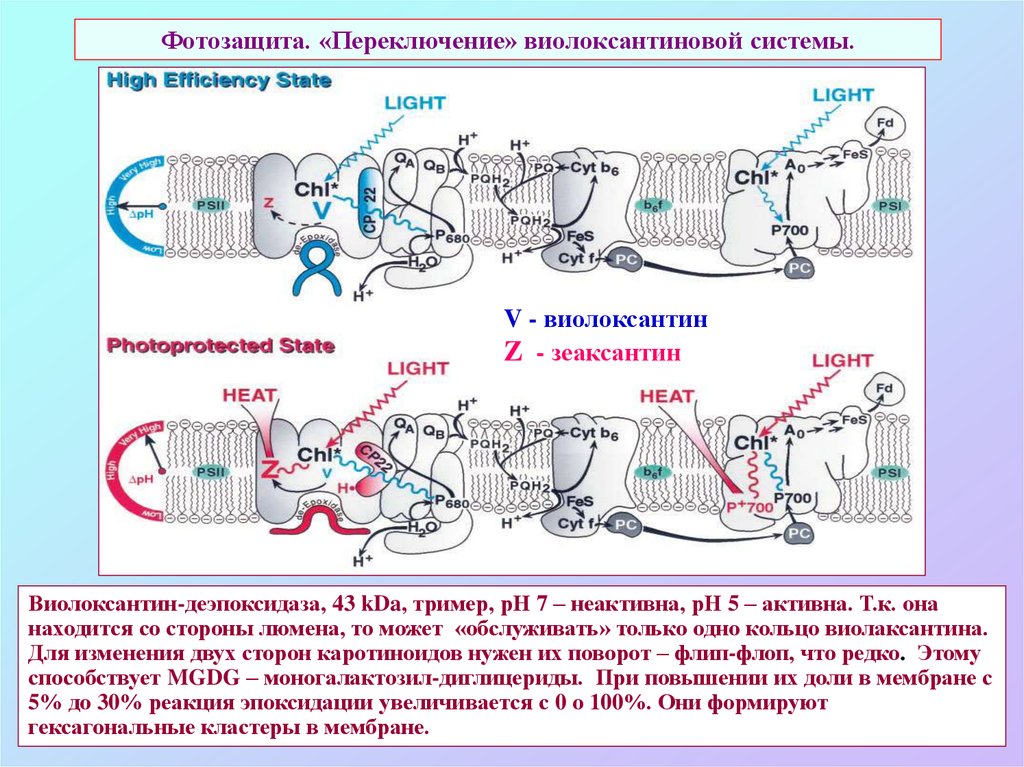
70. Фотозащита. «Переключение» виолоксантиновой системы.
V - виолоксантинZ - зеаксантин
Виолоксантин-деэпоксидаза, 43 kDa, тример, рН 7 – неактивна, рН 5 – активна. Т.к. она
находится со стороны люмена, то может «обслуживать» только одно кольцо виолаксантина.
Для изменения двух сторон каротиноидов нужен их поворот – флип-флоп, что редко. Этому
способствует MGDG – моногалактозил-диглицериды. При повышении их доли в мембране с
5% до 30% реакция эпоксидации увеличивается с 0 о 100%. Они формируют
гексагональные кластеры в мембране.
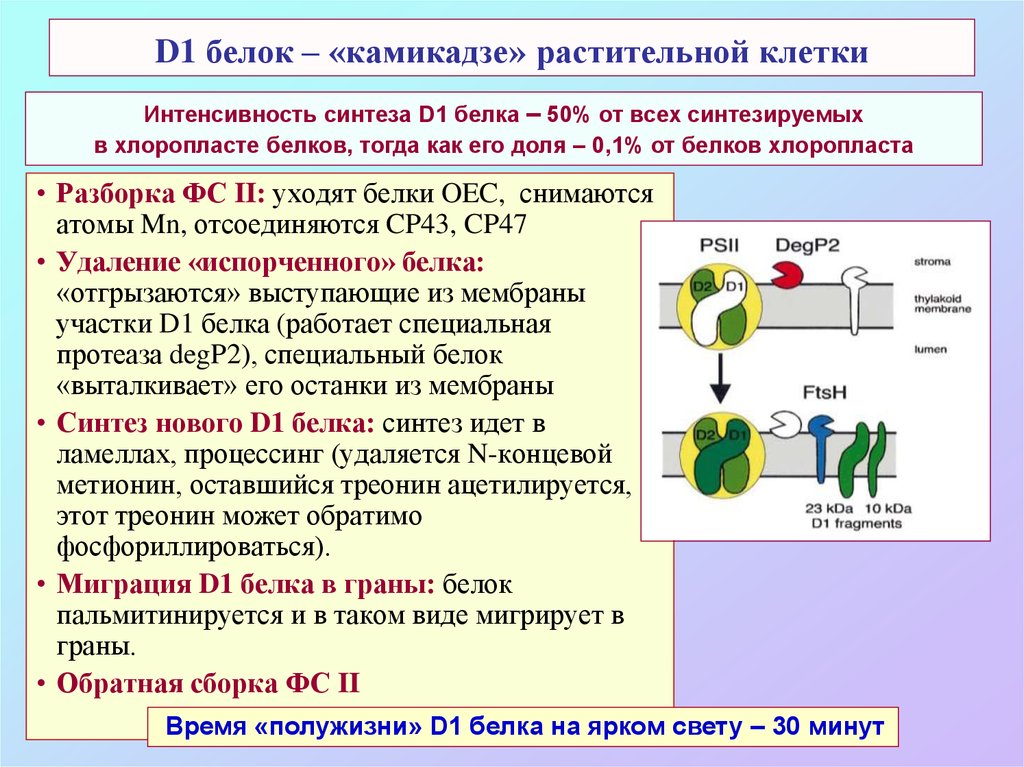
71. D1 белок – «камикадзе» растительной клетки
Интенсивность синтеза D1 белка – 50% от всех синтезируемыхв хлоропласте белков, тогда как его доля – 0,1% от белков хлоропласта
• Разборка ФС II: уходят белки OEC, снимаются
атомы Mn, отсоединяются CP43, CP47
• Удаление «испорченного» белка:
«отгрызаются» выступающие из мембраны
участки D1 белка (работает специальная
протеаза degP2), специальный белок
«выталкивает» его останки из мембраны
• Синтез нового D1 белка: синтез идет в
ламеллах, процессинг (удаляется N-концевой
метионин, оставшийся треонин ацетилируется,
этот треонин может обратимо
фосфориллироваться).
• Миграция D1 белка в граны: белок
пальмитинируется и в таком виде мигрирует в
граны.
• Обратная сборка ФС II
Время «полужизни» D1 белка на ярком свету – 30 минут










 biology
biology








