Similar presentations:
Основы молекулярной физики
1.
ЛЕКЦИЯ № 16 ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИМолекулярная физика (или точнее физика вещества) - раздел
физики, изучающий поведение макросистем, т.е. физических систем,
состоящих из очень большого числа частиц.
Пример: 1 г воды состоит из ~1022 молекул.
Методы изучения вещества (систем многих частиц)
Статистический метод – физическое описание макросистемы,
которое осуществляется на основе использования конкретных моделей
и рассмотрения вероятностных закономерностей коллективного
поведения частиц системы.
Пример
модели:
модель
газа:
система из невзаимодействующих между
собой материальных точек.
Микропараметры - это параметры,
характеризующие отдельную частицу.
Например, масса молекулы, ее скорость,
энергия, … .
Статистический метод оперирует, как
правило, с усредненными значениями
микропараметров.
2.
Термодинамический метод –метод изучения макросистем, прикотором не рассматривается их внутреннее строение, а поведение
систем описывается с помощью макропараметров (или параметров
состояния).
Макропараметры величины, доступные измерению и
характеризующие макросистему в целом.
Примеры:
- давление (измеряется манометром);
- энергия (измеряется калориметром) ;
- температура (измеряется термометром) …
3.
Простейшие характеристики макросистемКоличество вещества,
структурных
элементов,
[ ] = моль.
– величина, характеризующая число
составляющих
физическую
систему;
1 моль – это количество вещества в системе, в которой содержится
столько же структурных элементов, сколько содержится атомов в
изотопе углерода 12C массой 0,012 кг.
Число Авогадро – число структурных элементов, содержащихся в
одном моле вещества; NA=6,02 1023 моль–1.
Молярная масса – масса одного моля вещества; [ ] = кг моль.
Количество вещества:
N NA m ,
(16.1)
где N и m – число структурных элементов и масса вещества.
Масса одной частицы вещества (структурного элемента):
mm N A
.
(16.2)
4.
Равновесные состояния и процессыТермодинамическое равновесие – это такое состояние макросистемы,
при котором ее макропараметры остаются неизменными.
В неравновесной макросистеме действуют механизмы, стремящиеся
привести ее в равновесное состояние. Поэтому
макросистема,
находящаяся при неименных внешних условиях, приходит в равновесное
состояние.
Релаксация – процесс самопроизвольного перехода макросистемы из
неравновесного в равновесное состояние.
Равновесным называется процесс перехода макросистемы из одного
равновесного состояния в другое равновесное состояние.
Необходимое
условие
равновесного
процесса
–
его
«квазистатичность» (медленность), когда скорость изменения внешних
условий существенно меньше скорости протекания в системе
релаксационных процессов.
Обратимым называется такой термодинамический процесс, который
допускает возвращение макросистемы в первоначальное состояние без
каких-либо изменений в окружающей среде.
Равновесные процессы всегда обратимы.
Неравновесные процессы всегда необратимы.
5.
Температура и термодинамическое равновесиеТемпература – величина, определяющая степень нагретости тел.
Чувственная
оценка
температуры
сильно
зависит
от
теплопроводности контактируемых тел.
Пример: при оценке на ощупь металлические предметы в комнате
кажутся холоднее деревянных. Если же их нагреть до одной и той же
температуры, превышающей температуру руки, то соотношение будет
обратным.
Вывод: в основу количественного определения температуры и
построения точной температурной шкалы должны быть положены
объективные физические явления и факты, свободные от
субъективизма чувственных восприятий.
Это
можно
сделать,
если
воспользоваться
понятием
термодинамического равновесия.
6.
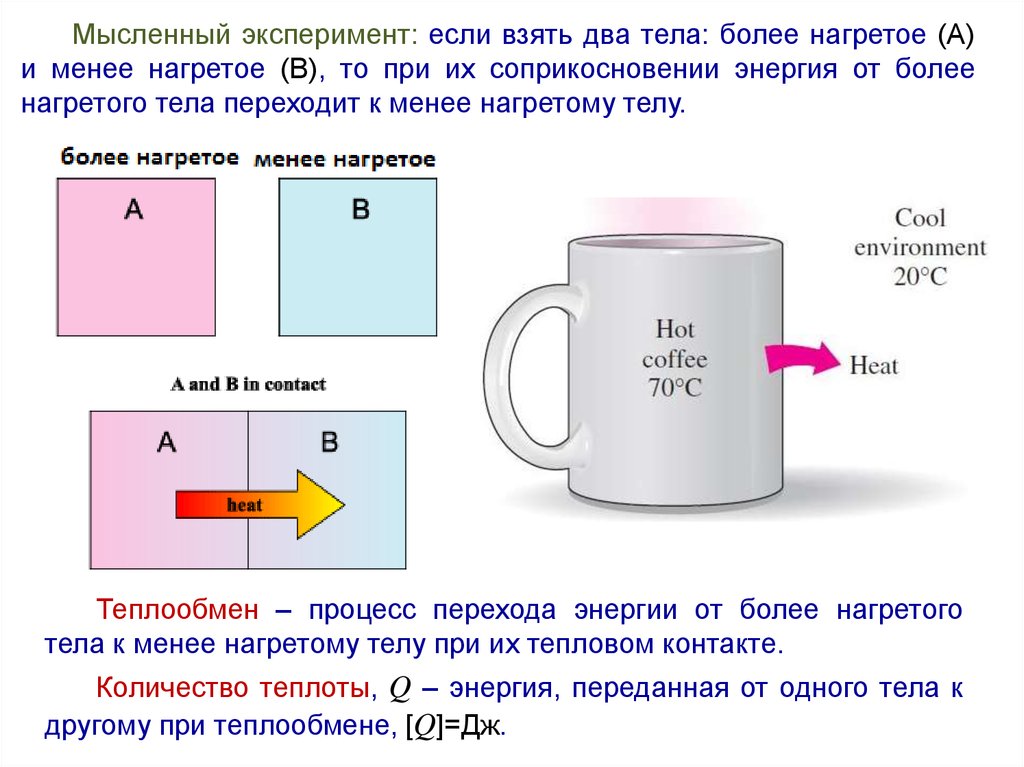
Мысленный эксперимент: если взять два тела: более нагретое (А)и менее нагретое (В), то при их соприкосновении энергия от более
нагретого тела переходит к менее нагретому телу.
Теплообмен – процесс перехода энергии от более нагретого
тела к менее нагретому телу при их тепловом контакте.
Количество теплоты, Q – энергия, переданная от одного тела к
другому при теплообмене, [Q]=Дж.
7.
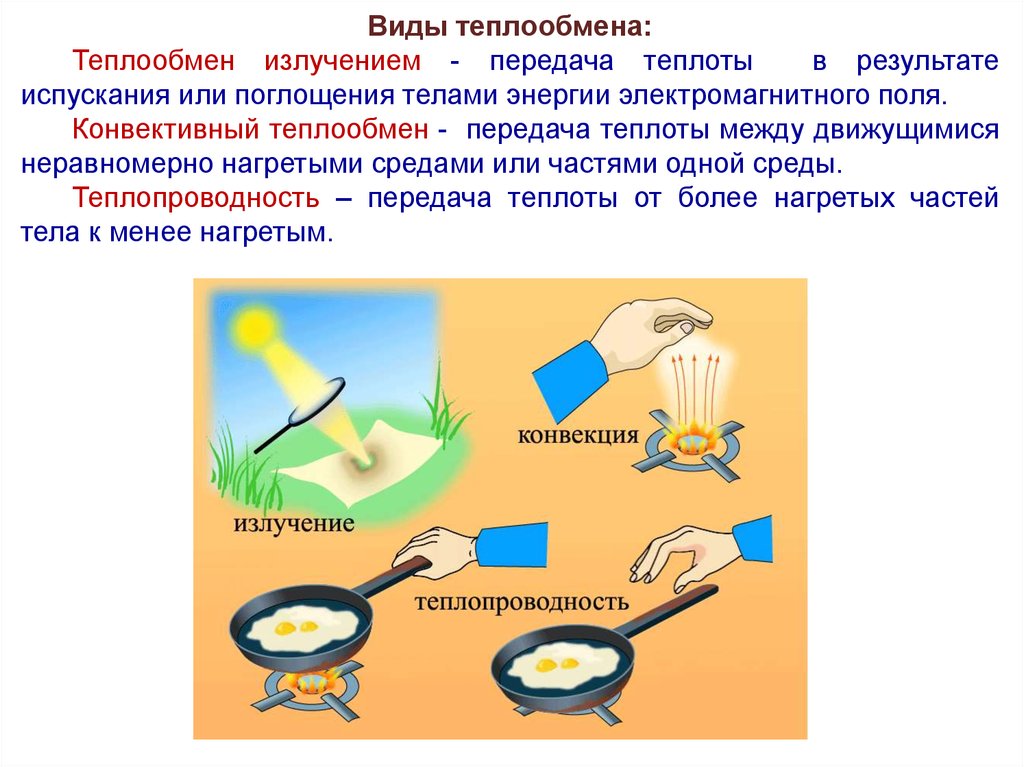
Виды теплообмена:Теплообмен излучением - передача теплоты
в результате
испускания или поглощения телами энергии электромагнитного поля.
Конвективный теплообмен - передача теплоты между движущимися
неравномерно нагретыми средами или частями одной среды.
Теплопроводность – передача теплоты от более нагретых частей
тела к менее нагретым.
8.
Переходэнергии
между
телами
продолжается до тех пор, пока не
установится состояние термодинамического
равновесия и температуры не выровняются.
Температура – скалярная величина, характеризующая состояние
термодинамического равновесия. То есть этот параметр таков, что
равновесные системы, между которыми осуществлен тепловой контакт,
останутся равновесными только при условии, что их температуры
одинаковы.
Под
температурой
понимается
физическая
величина,
определяющая:
- законы изменения состояния идеального газа;
- коэффициент полезного действия идеального термодинамического
цикла Карно;
- среднюю кинетическую энергию хаотического (теплового) движения
молекул;
- мощность излучения абсолютно черного тела;
- распределение атомов по уровням энергии.
9.
Определение температуры в кинетической теории газовВ кинетической теории газов доказывается, что если две подсистемы
(из одинаковых или разных молекул) могут обмениваться энергией, то
в состоянии равновесия оказываются равными средние кинетические
энергии.
С молекулярно-кинетической точки зрения температура – это
скалярная величина, являющаяся мерой средней кинетической
энергии поступательного движения молекулы:
T
где
2
пост
3k
,
1
пост mmv~ 2 ,
2
(16.3)
(16.4)
v 12 v 22 ... v N2 - средняя квадратичная скорость,
~
v
N
Дж/К – постоянная Больцмана – переводной
коэффициент, определяющий какая часть джоуля содержится в
одном кельвине.
k=1,38 10-23
10.
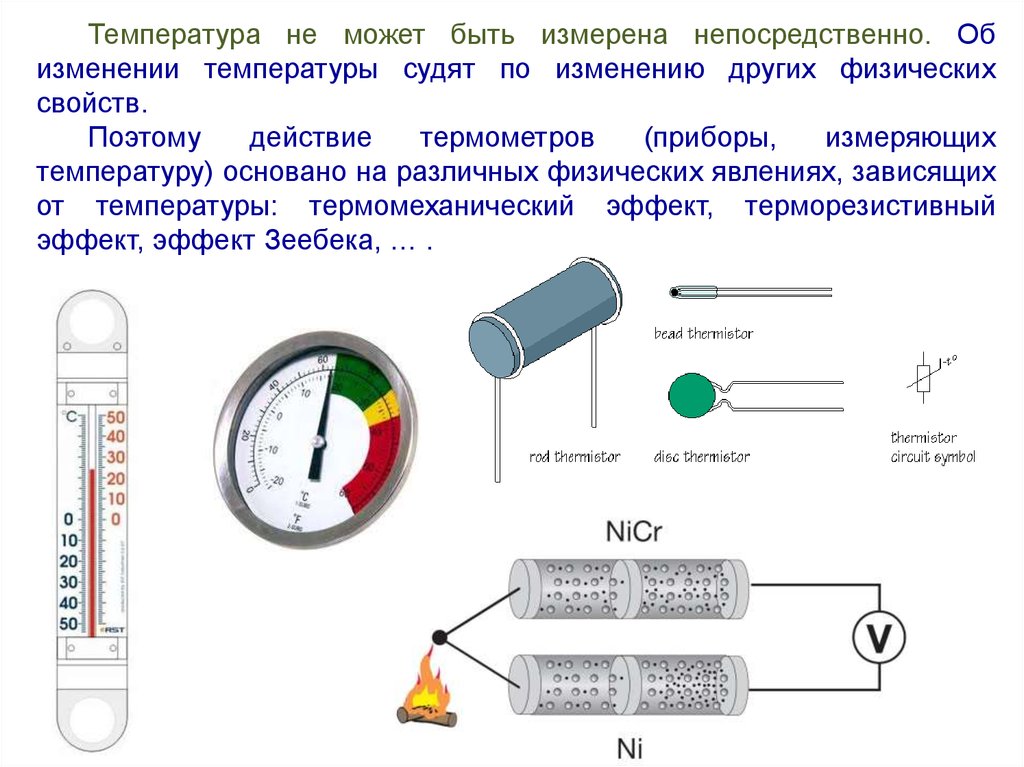
Температура не может быть измерена непосредственно. Обизменении температуры судят по изменению других физических
свойств.
Поэтому
действие
термометров
(приборы,
измеряющих
температуру) основано на различных физических явлениях, зависящих
от температуры: термомеханический эффект, терморезистивный
эффект, эффект Зеебека, … .
11.
Температурные шкалы:Шкала Кельвина:
T,K=t C+273,15
Шкала Фаренгейта:
t F=32 F+1,8t C
t C=5/9(t F-32 C)
12.
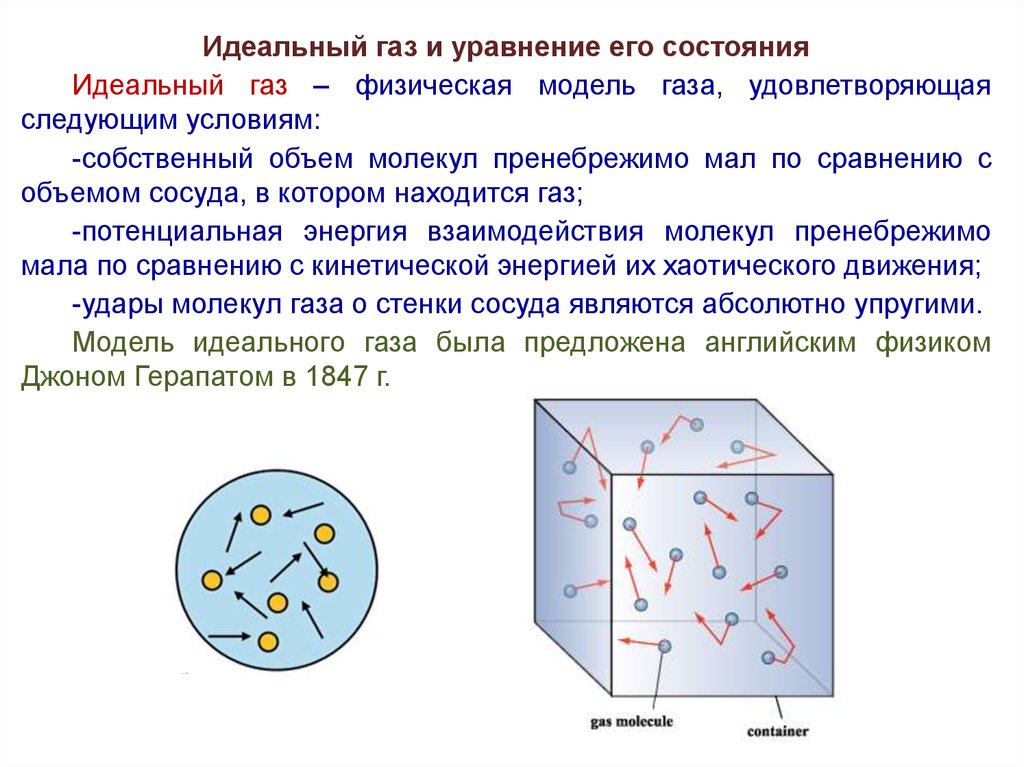
Идеальный газ и уравнение его состоянияИдеальный газ – физическая модель газа, удовлетворяющая
следующим условиям:
-собственный объем молекул пренебрежимо мал по сравнению с
объемом сосуда, в котором находится газ;
-потенциальная энергия взаимодействия молекул пренебрежимо
мала по сравнению с кинетической энергией их хаотического движения;
-удары молекул газа о стенки сосуда являются абсолютно упругими.
Модель идеального газа была предложена английским физиком
Джоном Герапатом в 1847 г.
13.
Уравнение состояния – уравнение, связывающее параметрысостояния макросистемы.
Состояние газа определяется рядом параметров, важнейшими из
которых являются температура и давление.
Давление, p – сила, действующая на единицу площади поверхности
в направлении нормали к этой поверхности, [p]=Па.
Статистический метод: давление определяется суммарным
импульсом, передаваемым молекулами в единицу времени единице
площади поверхности сосуда, в котором находится газ.
14.
Уравнение состояния идеального газа(Бенуа Клапейрон, 1834 г., Дмитрий Менделеев, 1874 г.)
m
N
pV RT RT
RT NkT
NA
p RT nkT
,
(16.5)
где R=8,31 Дж/(моль К) – универсальная газовая постоянная,
k=R/NA= 1,38 10-23 Дж/К – постоянная Больцмана,
=m/V – плотность газа,
n=N/V – концентрация молекул газа.
Основное уравнение МКТ идеального газа
(Рудольф Клаузиус, 1850 г.)
Подставляя (16.3) и (16.4) в (16.5), получим
2
1
pV N пост Nmmv~ 2
3
3
2
1
p n пост nmmv~ 2
3
3
.
(16.6)
15.
Изотермический процессИзотермическим называется процесс, происходящий при постоянной
температуре.
Закон Бойля-Мариотта (Роберт Бойль, 1661 г., Эдм Мариотт, 1676 г.):
при постоянной температуре давление данной массы идеального газа
обратно пропорционально его объему:
pV const .
(16.7)
16.
Изохорный процессИзохорным
объеме.
называется
процесс,
происходящий
при
постоянном
Закон Шарля (Жак Шарль, 1787 г.): при постоянном объеме давление
данной массы идеального газа пропорционален его температуре:
p T const .
(16.8)
17.
Изобарный процессИзобарным
давлении.
называется
процесс, происходящий
при постоянном
Закон Гей-Люссака (Жозеф Гей-Люссак, 1802 г.): при постоянном
давлении объем данной массы идеального газа пропорционален его
температуре:
V T const .
(16.9)
18.
Закон Авогадро (Амедео Авогадро, 1811 г.): в равных объемахразличных газов при одинаковых значениях температуры и давления
содержится одинаковое число молекул.
Закон Дальтона (Джон Дальтон, 1801 г.): давление смеси химически
невзаимодействующих идеальных газов равно сумме их парциальных
давлений:
p
J
pj
j 1
,
(16.10)
где pj – парциальное давление j-го компонента газовой смеси, т.е. то
давление, которое оказывает на стенки сосуда j-ый компонент в
отсутствие в сосуде других компонентов смеси.














 physics
physics








