Similar presentations:
Хирургические заболевания сердца
1.
12.
Госпитальная хирургияЛекция “ХИРУРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
СЕРДЦА”
Кафедра госпитальной хирургии
заведующий кафедрой
д.м.н. Алексей Иванович Фетюков
2
3.
План лекцииОСНОВНЫЕ ТЕМЫ:
1 – Анатомо-физиологические особенности сердца
2 – Основные задачи сердечно – сосудистой хирургии
3 – Врожденные пороки сердца (ВПС)
4 – Приобретенные пороки клапанов сердца (ППС)
5 – Оперативное лечение приобретенных клапанных пороков сердца
6 – Хирургия нарушений проводимости сердечной мышцы
7 – Окклюзионные поражения коронарных артерий
8 – Аневризма сердца (АС)
9 – Перикардиты
10 – Ранения сердца
РАЗДЕЛЫ:
• Актуальность
• Определение
• Классификация
• Клиника
• Диагностика
• Лечебная тактика
• Исходы
3
ЛИТЕРАТУРА
4.
Сердце вид спереди4
5.
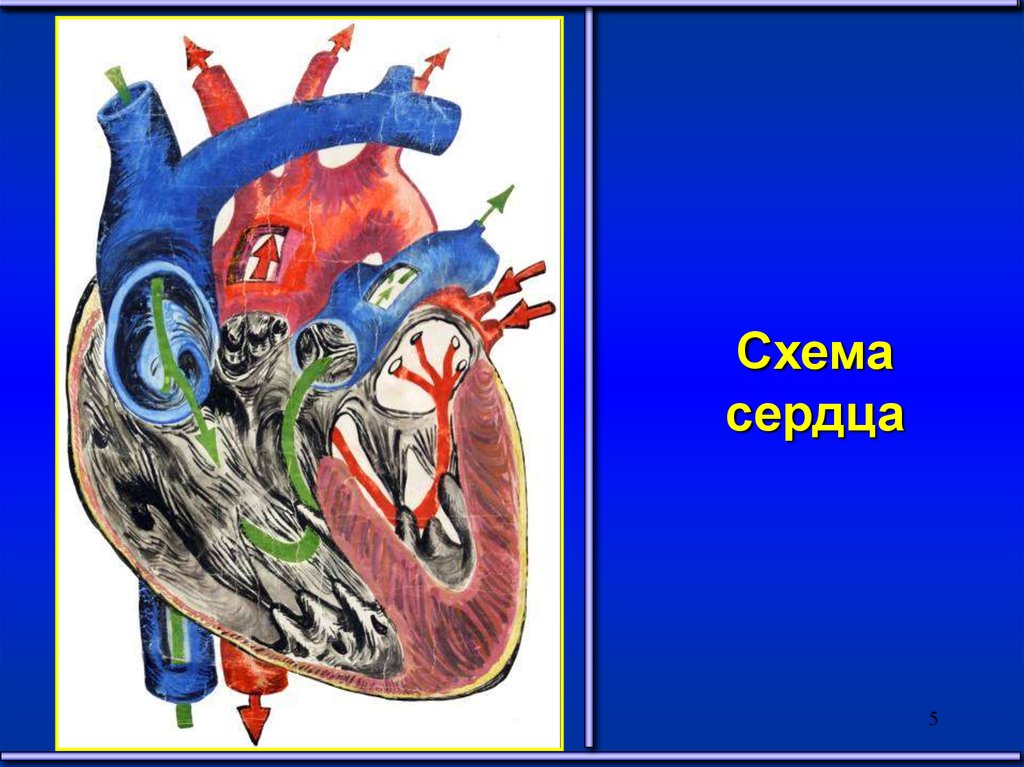
Схемасердца
5
6.
Основные задачисердечно – сосудистой хирургии
Исторически сердечно – сосудистая хирургия
последовательно решала следующие проблемы:
- общие вопросы;
- врожденные и приобретенные пороки сердца;
- ишемическая болезнь сердца;
- сосудистая патология;
- аритмия;
- терминальная сердечная недостаточность;
- сочетанные заболевания сердца и сосудов
6
7.
Классификация пороков сердцаI
Врожденные пороки
1
2
3
II
С увеличением легочного кровотока – "белые" пороки (открытый
артериальный проток, дефекты межпредсердной, межжелудочковой
перегородок:
а) изолированные, б) сочетанные (болезнь Эбштейна, синдром
Лютембаше, пороки Фалло)
С обеднением легочного кровотока – "синие" пороки (стеноз легочной
артерии)
а) изолированный, б) в сочетании с другими врожденными
пороками (триада, тетрада, пентада Фалло, синдром Лютембаше)
С неизменным легочным кровотоком (аномалии расположения
сердца и магистральных сосудов; транспозиция аорты и легочной
артерии)
Приобретенные пороки
1
2
3
Приобретенные пороки митрального клапана
(стеноз, недостаточность)
Приобретенные пороки аортального клапана
(стеноз, недостаточность)
Приобретенные пороки трехстворчатого клапана
(стеноз, недостаточность)
7
8.
Врожденные пороки сердцаВрожденные пороки сердца (ВПС) – это аномалии
положения или морфологической структуры сердца,
крупных сосудов, возникающих в результате нарушения
или незавершенности их формообразования в периоды
внутриутробного и (реже) постнатального раз-вития
организма.
Встречаются не более чем в 1% обследуемых
новорожденных. В России ежегодно среди новорожденных
ВПС встречается в 0,8 – 1% случаев.
Своевременно выполненная радикальная коррекция
ВПС, до развития морфологических изменений сердца и
легких, обеспечивает не только выздоровление детей, но и
дальнейшее полноценное трудоустройство.
8
9.
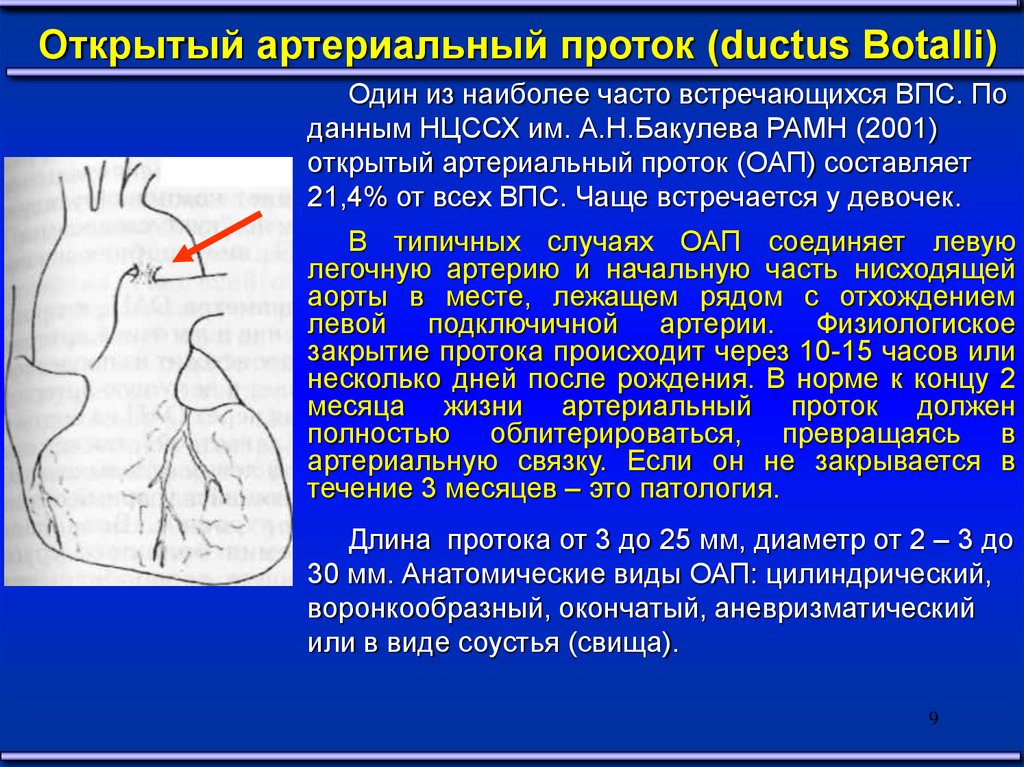
Открытый артериальный проток (ductus Botalli)Один из наиболее часто встречающихся ВПС. По
данным НЦССХ им. А.Н.Бакулева РАМН (2001)
открытый артериальный проток (ОАП) составляет
21,4% от всех ВПС. Чаще встречается у девочек.
В типичных случаях ОАП соединяет левую
легочную артерию и начальную часть нисходящей
аорты в месте, лежащем рядом с отхождением
левой подключичной артерии. Физиологиское
закрытие протока происходит через 10-15 часов или
несколько дней после рождения. В норме к концу 2
месяца жизни артериальный проток должен
полностью облитерироваться, превращаясь в
артериальную связку. Если он не закрывается в
течение 3 месяцев – это патология.
Длина протока от 3 до 25 мм, диаметр от 2 – 3 до
30 мм. Анатомические виды ОАП: цилиндрический,
воронкообразный, окончатый, аневризматический
или в виде соустья (свища).
9
10.
Нарушения гемодинамики – вначале, когда давление в легочной артериизначительно ниже, чем в аорте, сброс крови происходит слева направо«балластная кровь», которая вновь поступает в левые отделы сердца,
вызывая их объемную перегрузку. Наступает гипертрофия левого
желудочка. Возникает гиперволемия малого круга и гиповолемия
большого круга кровообращения. Гиперволемия малого круга приводит
вначале к функциональным, а затем – к органическим изменениям
сосудистого легочного русла. Развивается легочная гипертензия с
последующей гипертрофией правого желудочка. При резкой легочной
гипертензии давление в легочной артерии становится равным давлению
в аорте и начинается перекрестный сброс крови.
Стадии ОАП:
1 ст. – Систолическое давление в легочной артерии < 40%
артериального;
2 ст. – Умеренная гипертензия (систолическое давление в легочной
артерии 40 – 70% артериального);
3 ст. – Выраженная гипертензия (систолическое давление в легочной
артерии > 75% артериального);
4 ст. – Крайне тяжелая ( систолическое давление в легочной артерии
уравновешивается, прекращается сброс артериальной крови; кровь
10
сбрасывается из легочной артерии в аорту - с-м Эйзенменгера ).
11.
Диагностика ОАП1 - ЭКГ – отклонение вертикальной оси вправо;
2 – Фонокардиография – ромбовидной формы систолодиастолический
шум над легочной артерией;
3 – Рентгенологическое обследование – усиление легочного рисунка, в прямой
проекции выбухание второй дуги – легочной артерии по левому контуру сердца и
удлинение четвертой дуги – левого желудочка. Признаки увеличенного
кровенаполнения сосудов малого круга;
4 – Эхокардиоскопия – выявляет состояние правых и левых отделов сердца,
может зафиксировать сброс крови слева направо, дать ряд важных
гемодинамических параметров порока, возможна визуализация самого ОАП;
5 – Ангиокардиография;
6 – Аортография;
7 – Зондирование сердца – увеличение насыщения крови в легочной
артерии свыше 2 об.% - признак ОАП;
8 – Катетеризация полостей сердца – зонд проходит из легочной артерии
через ОАП в аорту.
11
12.
Лечение ОАПЛечение только оперативное.
Оптимальные сроки
операции 3 – 6 лет. Доступ заднебоковой в 3 межреберье
слева. Далее или перевязка, или прошивание, или
пересечение протока с ушиванием его концов, возможно с
помощью аппарата УАП – 20.
Первая успешная перевязка ОАП выполнена Робертом Гроссом в
1938 году, а в 1944 году он же впервые выполнил пересечение протока и
ушивание его концов. В России впервые произвел оперативное лечение
ОАП А.Н.Бакулев в 1948 году.
W.Portsman в 1967 году с помощью чрескожных эндоваскулярных
катетерных манипуляций впервые произвел обтурацию ОАП. В СССР
впервые аналогичное вмешательство выполнил Ю.С.Некласов в 1981
году.
В последние годы разработан и широко применяется
метод торакоскопического клиппирования ОАП под
12
контролем видеотехники.
13.
Дефект межпредсердной перегородки (ДМПП)В общей структуре ВПС ДМПП в среднем составляет 7%. Это самый
частый ВПС у детей старшего возраста и, особенно, у взрослых, так как
дети с более тяжелыми ВПС не доживают до взрослого возраста
В 1975 году К. Рокитанский детально описал патологоанатомическую
картину ДМПП. Впервые 2 сентября 1952 года Джон Льюис в клинике
Миннесотского университета произвел успешное ушивание ДМПП на
остановленном сердце в условиях умеренной гипотермии (28 гр.) пятилетней
девочке. В России первым успешно ушил ДМПП в условиях общей гипотермии
А.А.Вишневский.
Эмбриологически ДМПП разделяют на 3 группы:
1 – первичный: характеризуется большими размерами и чаще находится в нижней
части межпредсердной перегородки, встречается до 10% среди ДМПП;
2 – вторичный: локализация чаще в центре межпредсердной перегородки, всегда в
нижнем отделе дефекта имеется край межпредсердней перегородки, этот вид дефекта
наиболее частый - до 90%;
3 – единственное предсердие: редкий вид ВПС, при нем полностью отсутствует
межпредсердная перегородка, часто является составной частью различных пороков.
Нарушение гемодинамики – сброс артериальной крови из левого предсердия в
правое, возникает гиперволемия в правых отделах сердца и малого круга
кровообращения, что приводит к легочной гипертензии и гипертрофии правого 13
желудочка. С-м Эйзенменгера – сброс крови из правых отделов сердца в левые.
14.
Диагностика ДМПП1 - ЭКГ – гипертрофия правого желудочка и пр. предсердия;
2 – Фонокардиография – увеличенный и вначале расщепленный второй
тон;
3 – Рентгенологическое обследование – признаки повышенного
кровотока в легких, усиление легочного рисунка, расширение легочной
артерии и ее ветвей;
4 – Эхокардиоскопия – данные о размерах камер сердца, возможна
визуализация дефекта;
5 – Допплерография – турбулентный
межпредсердной перегородки;
поток
крови
на
уровне
6 – Цветное картирование – выявляет направление сброса крови через
дефект;
7 – Катетеризация полостей сердца и ангиокардиография – дают
наиболее точные сведения о размерах и локализации дефекта, объеме и
направлении сброса крови через дефект, уровне давления в полостях
сердца и легочной артерии, газовом составе крови.
14
15.
Лечение ДМПП5 степеней легочной гипертензии при ДМПП: 0 –общее
легочное сопротивление – норма – 200 дин/см с; I –
умеренная – 200 – 400 дин/см с; II –значительная – 400 –
600 дин/см с; III – тяжелая 600 – 800 дин/ см с; IV –
необратимая – более 800 дин/см с.
Единственным радикальным методом лечения ДМПП является
операция. Без операции средняя продолжительность жизни 40 лет.
Лучше оперировать в возрасте 5 – 8 лет (до 15 – 16 лет), когда нет
легочной гипертензии, нарушений ритма и дистрофических изменений
миокарда.
Операция заключается в ушивании дефекта или пластике его заплатой
из ауто – или ксеноперикарда, а также синтетического материала в
условиях искусственного кровообращения или в условиях «сухого
сердца» с применением общей гипотермической защиты.
Послеоперационная летальность 5 - 7%
15
16.
Дефект межжелудочковой перегородки (ДМЖП)При ДМЖП имеется сообщение между правым и левым желудочками
через дефект в межжелудочковой перегородке. Впервые дефект описали
П.Ф.Толочинов в 1874 году и француз H.L.Roger в 1879 году (болезнь
Толочинова – Роже).
Это самый частый ВПС. В общей структуре ВПС составляет 19 – 25%.
Дефекты могут быть в мембранозной и мышечной частях
межжелудочковой перегородки, но чаще (90%) - в мембранозной части.
Первую успешную операцию по коррекции ДМЖП у 4-х летней
девочки в условиях перекрестного кровообращения выполнил Уолтон
Лилехай в 1954 году – штат Миннесота. В Росси успешную операцию
выполнил А.А.Вишневский в 1957 году в условиях искусственного
кровообращения.
Нарушение гемодинамики – сброс крови через дефект из левого в
правый желудочек и малый круг кровообращения. Формируется легочная
гипертензия, в конечном итоге появляется синдром Эйзенменгера,
характеризующийся цианозом, выраженной гипертрофией правого
16
желудочка и снижением перегрузок левых отделов сердца.
17.
Диагностика ДМЖП1 - ЭКГ – гипертрофия правого желудочка и правого
предсердия;
2 – Фонокардиография –интенсивный высокочастотный
систолический шум, фиксируется высокий раздвоенный
(расщепленный) второй тон;
3 – Рентгенологическое обследование –
усиление
легочного рисунка, легочный застой, отмечается выбухание
второй дуги (легочной артерии) по левому контуру сердца и
усиленная пульсация корней легких;
4 – Эхокардиоскопия – состояние и функцию миокарда,
визуализировать ДМЖП и направление сброса крови;
5 – Катетеризация полостей сердца и ангиокардиография –
выполняется только в сложных диагностических случаях.
17
18.
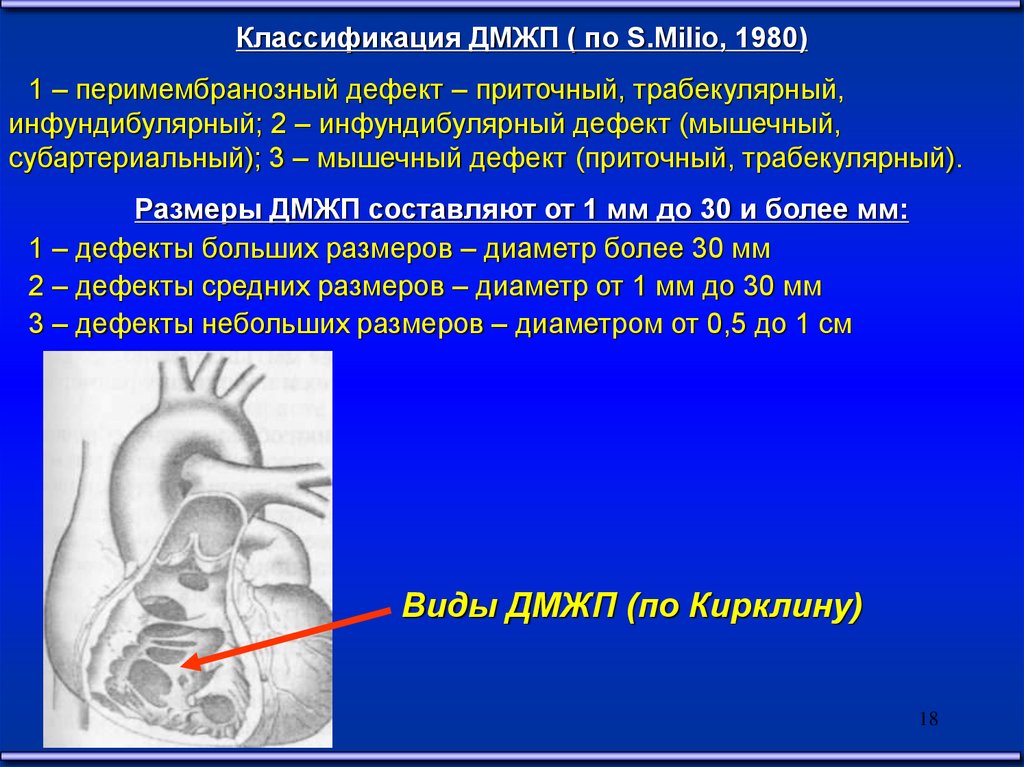
Классификация ДМЖП ( по S.Milio, 1980)1 – перимембранозный дефект – приточный, трабекулярный,
инфундибулярный; 2 – инфундибулярный дефект (мышечный,
субартериальный); 3 – мышечный дефект (приточный, трабекулярный).
Размеры ДМЖП составляют от 1 мм до 30 и более мм:
1 – дефекты больших размеров – диаметр более 30 мм
2 – дефекты средних размеров – диаметр от 1 мм до 30 мм
3 – дефекты небольших размеров – диаметром от 0,5 до 1 см
Виды ДМЖП (по Кирклину)
18
19.
Лечение ДМЖПБез операции средняя продолжительность жизни не более 30 лет.
Дефекты мышечной части перегородки и небольшие мембранозные
дефекты могут закрываться самостоятельно. При сохраняющихся ДМЖП
показано оперативное лечение.
Операция заключается в ушивании дефекта или пластике его заплатой
из ауто – или ксеноперикарда, а также синтетического материала в
условиях искусственного кровообращения на «сухом сердце».
Послеоперационная летальность минимальная.
В настоящее время в клиническую практику внедрены новые рентгеноэндоваскулярные методы лечения, которые позволяют за-крыть ДМПП и
ДМЖП без выполнения традиционных операций.
Различные типы зонтиков, применяющиеся для закрытия ДМПП и ДМЖП
19
20.
Болезнь ЭбштейнаБолезнь (аномалия) Эбштейна – характеризуется дисплазией и
смещением створок трикуспидального клапана в полость правого
желудочка, характеризуется уменьшением размеров правого желудочка с
увеличением правого предсердия, что приводит к трикуспидальной
недостаточности. Описана патанатомом Эбштейном в 1866 году.
Составляет в общей структуре ВПС 0,5 – 1%. Порок часто сочетается
(85%) с ДМПП, что обусловливает сброс крови в левое предсердие с
развитием выраженного цианоза.
Классификация по степени смещения створок:
1 степень – смещение от фиброзного кольца до верхушки правого желудочка на ¼;
2 степень – смещение до ½
3 степень – ниже середины.
Средняя продолжительность жизни таких больных 20 лет. 30 – 40% боль-ных
погибает до 10 лет, 50% - до 20 лет, 80% - до 30 лет.
Лечение – протезирование 3-х створчатого клапана с одновременным
закрытием дефекта перегородки; пластические операции с перемещением
эктопированных створок.
При невозможности
протезирования
клапана
выполняются паллиативные операции: аортолегочный анастомоз, полное
или
20
частичное закрытие ДМПП, кавапульмональный анастомоз.
21.
Синдром ЛютембашеСиндром Лютембаше – сочетание ДМЖП с
митральным стенозом. Встречается от 4 до 6%
всех ВПС.
Нарушение кровообращения по типу ДМЖП,
усиленного
стенозом
митрального
клапана.
Протекает с клиникой белого порока.
Лечение – ушивание ДМЖП и ликвидация стеноза
митрального клапана. Отдаленные результаты
удовлетворительные.
21
22.
Изолированный стеноз легочной артерииИзолированный стеноз легочной артерии (ИСЛА) – распространен-ный
порок, составляющий до 9% всех ВПС.
Классификация ИСЛА по анатомическим вариантам (по H. Bankl,1980)
1 вариант – отсутствует разделение клапана на створки с центральным или
эксцентрическим отверстием от 1 до 10 мм;
2
вариант
инфундибулярный
(подклапанный)
стеноз
за
счет
гипертрофированных мышц наджелудочкового гребня или выводного тракта
правого желудочка;
3 вариант - суправальвулярный (надклапанный) – стеноз легочной артерии и ее
ветвей;
4 вариант – имеет место разделение правого желудочка на проксимальную
камеру с высоким давлением и дистальную – с низким давлением. Может
обозначаться как 2-х камерный правый желудочек, двойной правый желудочек,
3-х камерное сердце. Как правило сочетается с ДМЖП.
5 вариант –
перегородкой;
атрезия
легочной
артерии
с
интактной
межжелудочковой
6 вариант – отсутствует ствол и ветви легочной артерии, а также артериальный
проток. При этом всегда присутствует ДМЖП.
22
23.
Нарушение гемодинамики – в результате препятствия на пути тока крови изправого желудочка, систолическое давление в нем значительно повышается (до
200 мм рт. ст.). Образовавшийся систолический градиент давления между
правым желудочком и легочной артерией обеспечивает достаточный сердечный
выброс. Возрастающая нагрузка на правый желудочек приводит к его
гипертрофии, а в дальнейшем к тоногенной и миогенной дилатации. Постепенно
возникающая
недостаточность
правых
отделов
сердца
приводит
к
декомпенсации по большому кругу кровообращения.
Степени тяжести стеноза:
I. – умеренный стеноз (систолическое давление в пр. желудочке 60 мм рт.ст.)
II. – выраженные стеноз (систолическое давление 60 – 100 мм рт.ст.)
III. – резкий стеноз ( систолическое давление более 100 мм рт. ст.)
Диагностика – ЭКГ (правограмма и признаки гипертрофии правого предсердия и
пр. желудочка); ФКГ (ромбовидный систолический шум, занимающий всю
систолу); рентгенологически (обеднение легочного рисунка, увеличение сердца
за счет правого желудочка); эхокардиоскопия подтверждает диагноз;
катетеризация сердца и измерение давления в правом желудочке.
23
24.
ЛечениеИСЛА
хирургическое,
так
как
средняя
продолжительность жизни больных без операции 25 лет.
Виды хирургических вмешательств:
- закрытая чрезжелудочковая вальвулотомия;
- открытая вальвулотомия (под
восстановлением функции клапана);
контролем
глаза
с
- интравазальная дилатация (баллонная вальвулопластика
через легочную артерию);
- инфундибулэктомия (протезирование);
- имплантация стентов.
Операции выполняются в условиях умеренной гипотермии
или с использованием АИК.
24
25.
Пороки ФаллоТРИАДА ФАЛЛО – встречается у новорожденных
в 2 - 5% случаев.
Включает в себя:
1 – стеноз легочной артерии;
2 – дефект межпредсердной перегородки;
3 – гипертрофию миокарда правого желудочка.
Диагностика: эхокардиоскопия,
отделов сердца.
зондирование
правых
Лечение – хирургическое: ликвидация стеноза легочной
артерии + устранение ДМПП.
Оптимальный возраст для хирургического лечения –
7 – 10 лет. Летальность 20 – 25%.
25
26.
ТЕТРАДА ФАЛЛО – один из самых распространенных цианотическихпороков сердца. Встречается у новорожденных в 8% случаев, у детей
старшего возраста – 12 – 14%. Впервые порок описал французский врач
Этьен-Луи Атур Фалло в 1888 году.
Включает в себя 4 компонента:
1 – стеноз легочной артерии;
2 – дефект межжелудочковой перегородки;
3 – смещение устья аорты в правую сторону (декстрапозиция
аорты);
4 – гипертрофия правого желудочка.
Выделяют 3 клинико – анатомические варианты порока:
1 – тетрада Фалло с атрезией устья легочной артерии;
2 – классическая форма с различной степенью стеноза;
3 – бледная форма тетрады Фалло.
26
27.
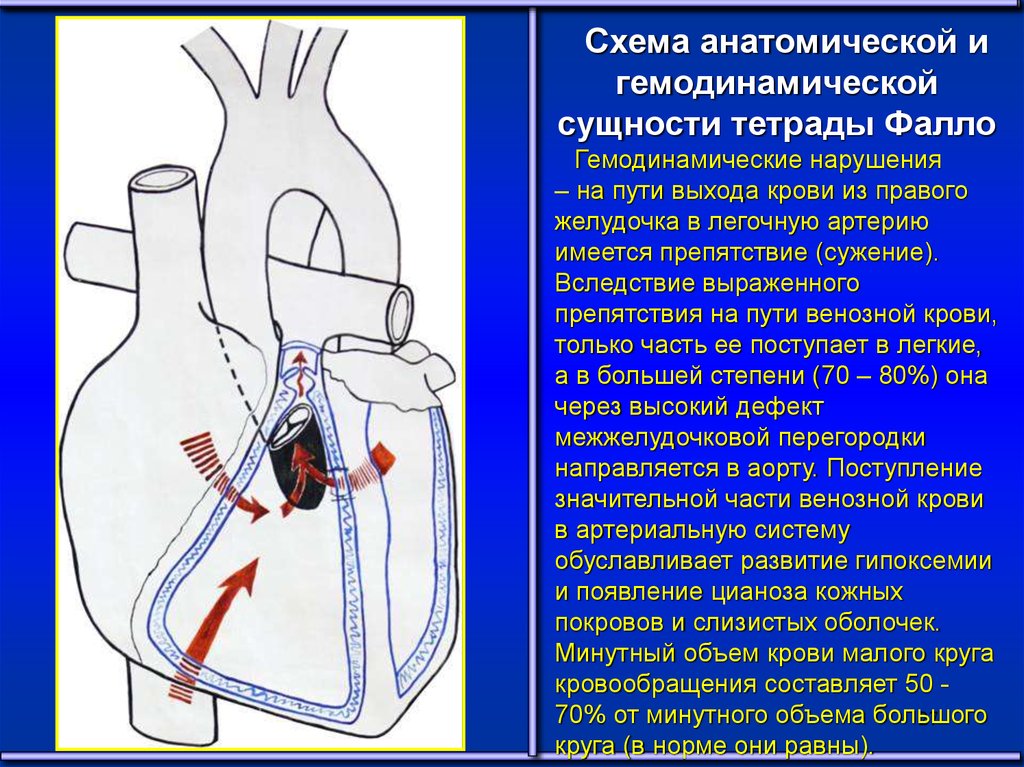
Схема анатомической игемодинамической
сущности тетрады Фалло
Гемодинамические нарушения
– на пути выхода крови из правого
желудочка в легочную артерию
имеется препятствие (сужение).
Вследствие выраженного
препятствия на пути венозной крови,
только часть ее поступает в легкие,
а в большей степени (70 – 80%) она
через высокий дефект
межжелудочковой перегородки
направляется в аорту. Поступление
значительной части венозной крови
в артериальную систему
обуславливает развитие гипоксемии
и появление цианоза кожных
покровов и слизистых оболочек.
Минутный объем крови малого круга
кровообращения составляет 50 70% от минутного объема большого
27
круга (в норме они равны).
28.
Диагностика тетрады ФаллоПри ТЕТРАДЕ ФАЛЛО – имеются изменения
(полицитемия) в клиническом анализе крови: число Эр
повышается до 6 – 7 т/л, Нв -160 – 200 г/л и более,
гематокрит повышается до 65 %.
ЭКГ – отклонение электрической
гипертрофия правого желудочка;
оси
вправо
и
ФКГ – грубый ромбовидной формы систолический шум;
Рентгеноскопия – повышенная прозрачность легочных
полей, сердце в прямой проекции в виде голландской
туфельки («деревянный башмачок»);
Эхокардиоскопия – позволяет установить гипертрофию
правого желудочка и степень стеноза выводного отдела,
смещение аорты, визуализировать межжелудочковый
дефект со сбросом крови справа налево;
Катетеризация полостей сердца и ангиокардиография
устанавливают окончательный диагноз.
28
29.
Лечение тетрады ФаллоБольшинство не оперированных детей при этом пороке умирает до
совершеннолетия. Средняя продолжительность жизни 12 лет. Всем
больным с тетрадой Фалло показано оперативное лечение.
2 вида операций: радикальные и паллиативные операции
Радикальные операции устраняют стеноз легочной артерии и ДМЖП.
Паллиативные операции создают сообщение между аортой и
легочной артерий, стабилизируют больного и в дальнейшем позволяют
выполнить радикальную операцию. Применяются: подключичнолегочный анастомоз («классический анастомоз») по Блелоку – Тауссиг;
анастомоз между подключичной и легочной артерией с помощью
трансплантата
по
Вишневскому
–
Долецкому;
создание
кавапульмонального анастомоза по Галанкину – Дарбиняну – Мешалкину
и др. Отдаленные результаты радикальных операций благоприятные.
ПЕНТАДА ФАЛЛО – все то же, что и при тетраде Фалло + ДМПП.
Принципы диагностики и хирургического лечения такие же, что и при
тетраде Фалло.
Летальность 25 – 30%
29
30.
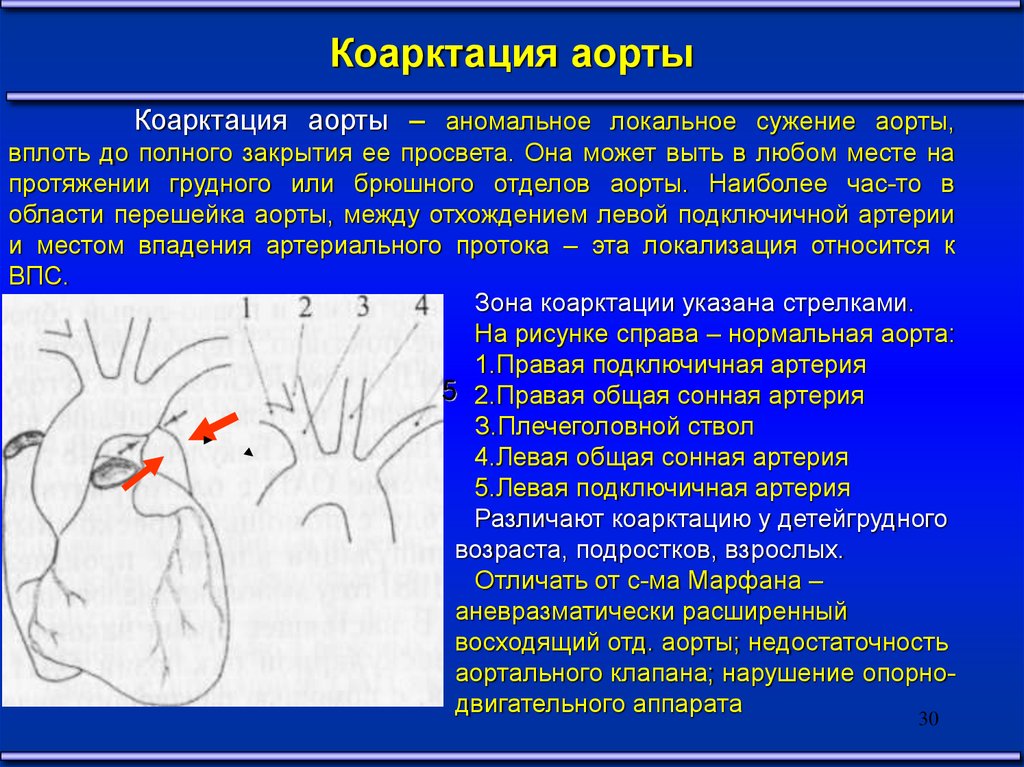
Коарктация аортыКоарктация аорты – аномальное локальное сужение аорты,
вплоть до полного закрытия ее просвета. Она может выть в любом месте на
протяжении грудного или брюшного отделов аорты. Наиболее час-то в
области перешейка аорты, между отхождением левой подключичной артерии
и местом впадения артериального протока – эта локализация относится к
ВПС.
Зона коарктации указана стрелками.
На рисунке справа – нормальная аорта:
1.Правая подключичная артерия
5 2.Правая общая сонная артерия
З.Плечеголовной ствол
4.Левая общая сонная артерия
5.Левая подключичная артерия
Различают коарктацию у детейгрудного
возраста, подростков, взрослых.
Отличать от с-ма Марфана –
аневразматически расширенный
восходящий отд. аорты; недостаточность
аортального клапана; нарушение опорнодвигательного аппарата
30
31.
Нарушение гемодинамики – проявляется артериальной гипертензией вверхней половине тела и понижением давления в нижних отделах. Имеются два
режима кровообращения – выше и ниже места сужения аорты. Две версии
патогенеза артериальной гипертензии: механическое препятствие кровотоку на
уровне коарктации и ишемия почек вследствие сниженного кровотока с
включением системы ренин – ангиотензин – альдостерон. Повышенная нагрузка
на левый желудочек приводит к его гипертрофии.
Три степени сужения: 1ст.-умеренная (АД-150 мм рт.ст.); 2 ст.-средней тяжести
(АД -150-200); 3 ст. – тяжелая (АД более 250)
Диагностика
ЭКГ - гипертрофия левого желудочка;
ФКГ – среднеамплитудный систолический шум ромбовидной формы;
Рентген – может визуализироваться расширение восходящей аорты,
увеличенный левый желудочек. У взрослых отмечается узурация нижних краев
ребер вследствие сдавления резко расширенными межреберными артериями;
УЗИ – гипертрофия левого желудочка, расширение восходящей аорты, можно
выявить и саму коарктацию;
МРТ – локализует место коарктации и состояние дуги аорты;
Аортография –диагноз подтверждается окончательно.
31
Лечение коарктации –без операции большинство умирает, не достигнув
40-летнегот возраста
32.
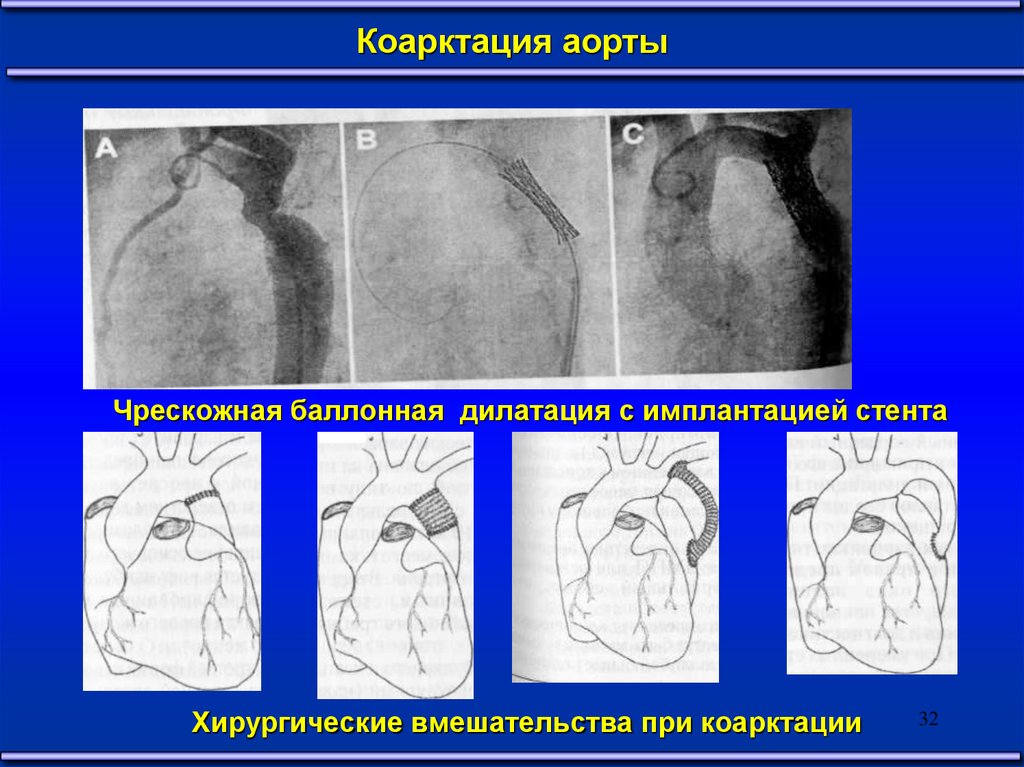
Коарктация аортыЧрескожная баллонная дилатация с имплантацией стента
Хирургические вмешательства при коарктации
32
33.
Приобретенные пороки клапанов сердца (ППС)ППС – это приобретенные различные
патологоанатомические нарушения клапанного аппарата
сердца, приводящие к расстройству функции сердца и всей
системы кровообращения.
По данным Е.Н.Мешалкина (1989) в СССР ежегодно от
ППС умирало 25 000 человек.
Этиология – ревматизм является одной из основных причин
возникновения ППС. Страдает как правило митральный клапан. В то же
время продолжается тенденция к увеличению роли инфекционного
септического эндокардита – в основном касается аортального клапана у
наркоманов. Миксоматозная трансформация створок и хорд
митрального клапана может стать причиной синдрома пролапса
митрального клапана и вызвать митральную недостаточность. ИБС,
закрытая травма груди, проникающие ранения сердца, сифилис,
системная красная волчанка могут привести к формированию ППС.
33
34.
МИТРАЛЬНЫЙ СТЕНОЗ (МС)МС – сужение левого атриовентрикулярного отверстия
встречается у 50 - 80 больных на 100 000 населения. Вначале
появляются признаки митральной недостаточности, а затем
стенозирования. В среднем порок развивается через 5 – 15 лет от
начала ревматизма и чаще наблюдается в относительно молодом
возрасте. У женщин чаще в 4 раза.
В норме площадь клапана колеблется от 4 до 6 кв. см. Длина окружности
составляет от 9 до 11 см.
ПАТОГЕНЕЗ – различают два типа формирования стеноза:
1 – сужение за счет сращения соприкасающихся между собой
краев створок клапана вблизи фиброзного кольца. Образующиеся
по полюсам клапана в области комиссур сращения, постепенно
распространяются к середине митрального отверстия, которое
постепенно суживается в виде «пуговичной или пиджачной петли»;
2 – кроме сращения створок, отмечается вовлечение
подклапанных структур (сухожильные нити, сосочковые мышцы).
Они склерозируются, укорачиваются и срастаются между собой,
34
створки втягиваются в форме «рыбьего рта».
35.
Нарушения гемодинамики – МС создает препятствие дляизгнания крови из левого предсердия (ЛП) в левый желудочек
(ЛЖ). В ЛП давление повышается до 20 – 25 мм рт. ст. (норма – 5 –
9 мм рт. ст.). Увеличивается разница давления ЛП – ЛЖ и
удлиняется систола ЛП. Эти два фактора являются первоначально
компенсаторными. Дальнейшее повышения давления в ЛП
приводит к повышению давления в легочных венах. Рефлекторно
повышается давление в легочных артериолах (рефлекс Китаева).
Это защитный сосудосуживающий рефлекс. Однако длительный
спазм легочных артериол вызывает пролиферацию их гладкой
мускулатуры, что приводит к диффузным склеротическим
изменениям.
Возникает «бурая индурация легких» (Рудольф
Вирхов, в конце XIX века). Все это приводит к выраженной
легочной гипертензии и формированию второго барьера току
крови, что резко увеличивает нагрузку на правый желудочек (ПЖ).
В
итоге
наступает
декомпенсация
в
большом
круге
кровообращения. Развиваются различной степени выраженности
дистрофические изменения в миокарде, сопровождающиеся
мерцательной аритмией и формированием тромбов в левом ушке
и полости ЛП. Помимо этого отмечается увеличение печени,
35
появляются отеки ног, асцит.
36.
Классификация митрального стенозаВ зависимости от диаметра митрального отверстия
(В.И.Бураковский, 1989) :
1 – резкий стеноз – до 0,5 кв. см
2 – значительный стеноз – 0,5 – 1,0 кв. см
3 – умеренный стеноз – свыше 1,0 кв. см
По клиническому течению (А.Н.Бакулев, Е.А.Дамир)
I ст. – полная компенсация – бессимптомная
II ст. – недостаточность кровообращения по малому кругу
кровообращения
III ст. – недостаточность кровообращения по большому кругу
кровообращения
IV ст. – резко выраженная недостаточность кровообращения
по большому кругу (мерцательная аритмия)
V ст. – терминальная дистрофия (периферические 36отеки,
постоянная одышка, анасарка, кахексия)
37.
В зависимости от выраженности хронической сердечнойнедостаточности (функциональные классы):
Класс I – Обычная физическая активность не вызывает
заметной усталости.
Класс II – Незначительное ограничение физической
активности
Класс III – Заметное ограничение физической
активности
Класс IV – Недостаточность кровообращения в покое
37
38.
КлассификацияНью-йоркской ассоциации кардиологов
I ст. – бессимптомная (площадь клапана 2 – 2,5 кв. см)
II ст. – статическая несостоятельность (1,5 – 2,0 кв. см) – нарушения при
повышенной физической нагрузке
III ст. – прогрессирующая недостаточность ( 1,0 – 1,5 кв. см) – нарушения в покое,
при обычной активности (мерцательная аритмия, образование
тромбов в предсердии, артериальные эмболии, фиброз легкого)
IV ст. – терминальная несостоятельность (менее 1,0 кв.см) – нарушения при
малейшей активности и в покое
V ст. – необратимая – тяжелые дегенеративные изменения паренхимы
органов и сердца
Классификация в зависимости от данных эхокардиографии
(по Г.М.Соловьеву)
I степень – критический стеноз (1,0 – 1,6 кв. см)
II ст. – выраженный стеноз (1,7 – 2,2 кв. см)
III ст. – умеренный стеноз ( 2,3 – 2,9 кв. см)
IV ст. – незначительный стеноз (более 3,0 кв.см)
38
39.
Хирургическое лечение МСПервая закрытая митральная комиссуротомия путем расширения
стенозированного митрального отверстия пальцем, введенным через ушко ЛП,
произвел английский хирург Суттар (H.Soutar) в 1925 году. Ч. Бейли (США) в
1948 году с помощью комиссуротома
успешно осуществил закрытую
митральную комиссуротомию. В России А.Н.Бакулев в 1952 году первым
произвел закрытую митральную комиссуротомию. Коррекция митрального
клапана с использованием АИК выполнена У. Лиллехаем в 1957 году.
Первая успешная имплантация створчатого протеза в митральную позицию
произведена N.Braunwald в 1961 году. В России в 1963 году Г.М.Соловьев
впервые протезировал митральный клапан с помощью шарового протеза.
Баллонная дилатация стеноза.
ПОКАЗАНИЯ – по Бакулеву и Ньюорской ассоциации абсолютные показания к
оперативному лечению II - III – IV стадии, по Г.М.Соловьеву – I – II ст.
Показания к хирургическому лечению в зависимости от функционального
класса
Относительные – II функциональный класс
Абсолютные III – IV функциональные классы
Противопоказания: терминальная и дистрофическая стадии болезни
39
40.
Оперативное лечение приобретенныхклапанных пороков сердца
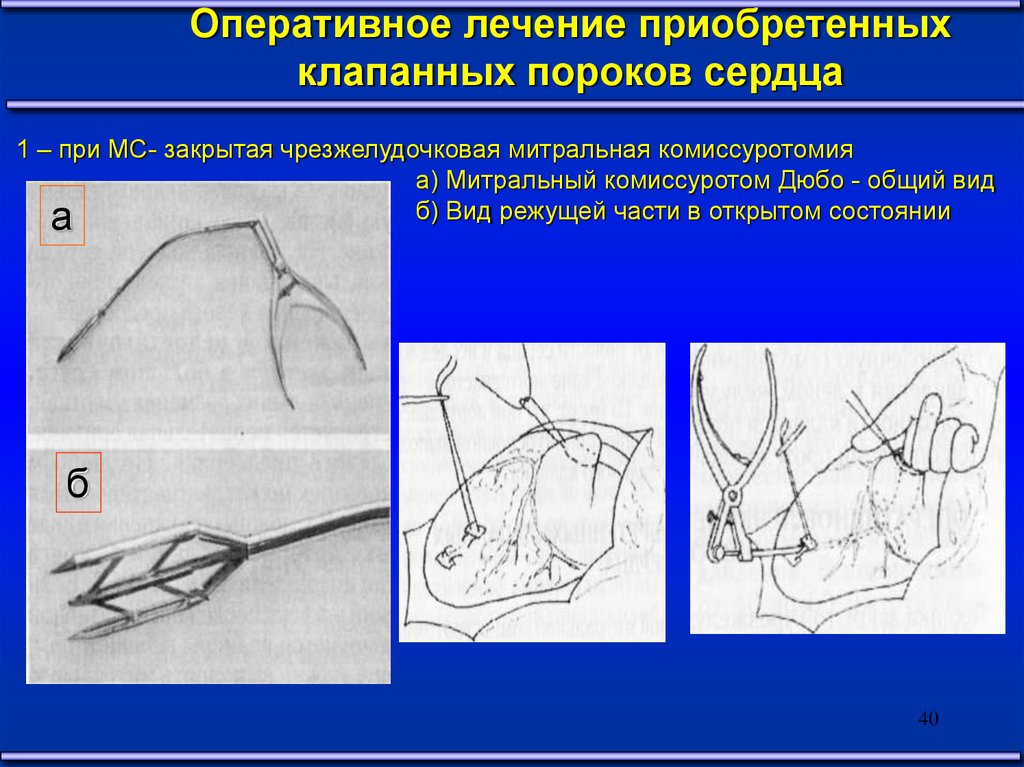
1 – при МС- закрытая чрезжелудочковая митральная комиссуротомия
а) Митральный комиссуротом Дюбо - общий вид
б) Вид режущей части в открытом состоянии
а
б
40
41.
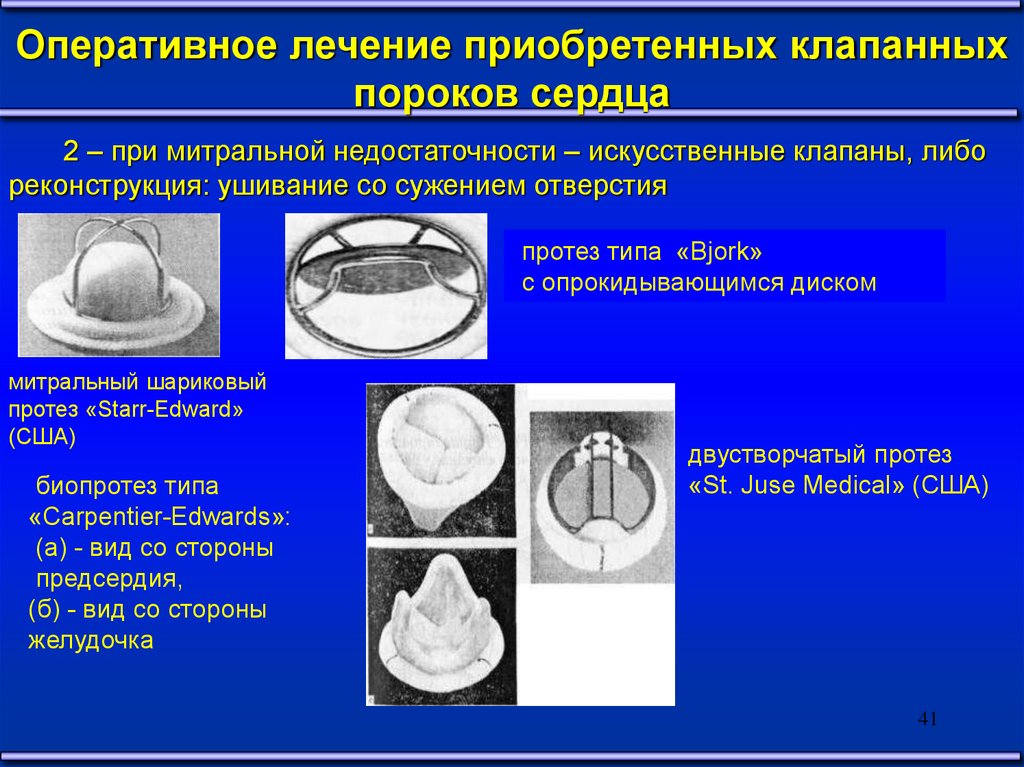
Оперативное лечение приобретенных клапанныхпороков сердца
2 – при митральной недостаточности – искусственные клапаны, либо
реконструкция: ушивание со сужением отверстия
протез типа «Bjork»
с опрокидывающимся диском
митральный шариковый
протез «Starr-Edward»
(США)
биопротез типа
«Carpentier-Edwards»:
(a) - вид со стороны
предсердия,
(б) - вид со стороны
желудочка
двустворчатый протез
«St. Juse Medical» (США)
41
42.
Оперативное лечение приобретенных клапанныхпороков сердца
3 – недостаточность аортального клапана –
протезирование
аортального
клапана
либо
реконструкция
4 – недостаточность 3-х створчатого клапана –
аннулопластика, реконструкция, протезирование
5 – стеноз правого атриовентрикулярного отверстия
– комиссуротомия, баллонная дилатация
6 – аортальный стеноз – чрезжелудочковая
комиссуротомия,
чрезаортальная
комиссуротомия,
баллонная дилатация, аортовальвулопластика
7 – аортальная недостаточность – исскуственный
клапан, эндоваскулярная коррекция
42
43.
Хирургия нарушений проводимостисердечной мышцы
Прошло более 45 лет, когда в 1958 году была
произведена
первая
успешная
электрокардиостимуляция в клинике. В мире
ежегодно имплантируется более 300 000
различных систем для проведения постоянной
стимуляции сердца (Бокерия Л.А., 1990).
Разработаны
и
применяются
новые,
современные типы электрокардиостимуляторов
(ЭКС).
Имплантация ЭКС производится 300500 больным на один миллион населения.
43
44.
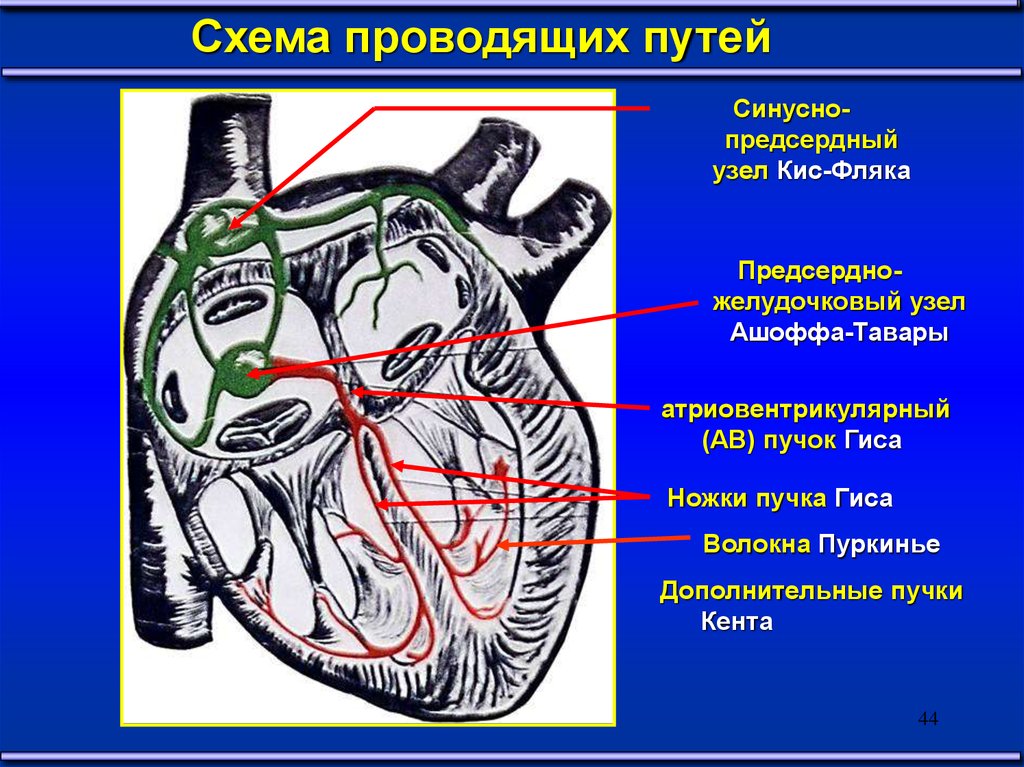
Схема проводящих путейСинуснопредсердный
узел Кис-Фляка
Предсердножелудочковый узел
Ашоффа-Тавары
атриовентрикулярный
(АВ) пучок Гиса
Ножки пучка Гиса
Волокна Пуркинье
Дополнительные пучки
Кента
44
45.
СИНДРОМ СЛАБОСТИ СИНУСОВОГО УЗЛА ( СССУ )Патология ритма сердца
возникает в результате нарушения
формирования импульса или нарушения проведения его.
Брадикардия - частота сокращения предсердий или желудочков
менее 60 ударов в одну минуту. Блокада – замедление или прерывание
проведения импульса через тот или иной участок сердца. Эти
проявления являются основой клинической картины синдрома слабости
синусового узла. Термин был предложен в нашей стране А.Л. Сыркиным
в 1970 году. СССУ подразумевает дисфункцию синусового узла из-за
дегенеративных изменений в узле, в проводящей системе сердца и
предсердии.
СССУ может быть вследствие ишемии или воспалительного
процесса. Поэтому раньше считалось, что главная причина СССУ-ИБС. К
другим причинам относятся: миокардит, перикардит, кардиопатия,
амилоидоз, ревматизм, сифилис, гипертоническая болезнь и др. Однако
в последние годы доказано, что в основе СССУ часто лежат генетически
обусловленные склерогенеративные изменения в синусно-предсердном
узле, в проводящей системе сердца, которые клинически проявляются на
6 - 7 декаде жизни.
45
46.
При СССУ встречается 5 видов аритмий1 – синусовая брадикардия
2 – синоатриальная блокада
3 – отказ синусно-предсерного узла («синус-арест»)
4 – синдром брадитахиаритмии
5 – постоянное мерцание или трепетание предсердий
Хроническая гипоксия, перегрузка миокарда приводят к истощению
желудочкового автоматизма, что проявляется в виде синдрома Морганьи-ЭдамсаСтокса.
ЛЕЧЕНИЕ – консервативная терапия при СССУ малоэффективна.
Кардиостимуляция (КС):
I. От способа контакта концевой части электрода с сердцем различают:
1 – эндокардиальную; 2 - миокардиальную стимуляцию: а- учащающая;
б - урезающая; в – разновидность –пищеводная
II. По времени использования: 1 – временная; 2 – постоянная
Временная (наружная, непрямая) КС показана при частых приступах синдрома
Морганьи-Эдамса-Стокса.
Постоянная миокардиальная в настоящее время выполняется через пункцию
плечеголовной вены или подключичной вены.
46
47.
Коррекция аритмий (тахикардия, тахиаритмия)При
не
эффективности
консервативной
терапии
применяется
хирургическое вмешательство – создание искусственной полной АВ
блокады с развитием желудочковой брадикардии с последующей
имплантацией ЭКС с водителем ритма 70 уд. в 1 минуту.
Операции на открытом сердце – инцизия узла, прошивание лигатурой,
электрокоагуляция в проекции п. Гиса, криодеструкция, резекция
синусового узла, радиочастотная деструкция, лазерное воздействие,
ультразвуковым скальпелем.
В
настоящее
время
предложена
чрезвенная
катетерная
электродеструкция п. Гиса. Через правую бедренную вену, в правое
предсердие вводятся электроды в проекции п. Гиса и наносится
высокоамплитудный импульс от стандартного дефибрилатора в 200 400 джоулей.
При синдроме Вольфа-Паркинсона-Уайта ( врожденная особенность
проводящей системы с наличием дополнительных проводящих путейпучки Кента, разновидность наджелудочковой тахикардии) –
производится ликвидация пучков Кента с применением криогена,
ультразвука, электро – и лазерной техники.
47
48.
Узловая тахикардия из серии наджелудочковых тахикардий –анатомическим субстратом являются два пути проведения в самом
атриовентрикулярном соединении. Разрушение одного из путей или
паранодально проходящих дополнительных связей устраняет аритмию с
сохранением синусового ритма. Это достигается паранодальной
криодеструкцией, паранодальной электрокоагуляцией, инцизией. В ряде
случаев возникает поперечная блокада сердца, что требует
имплантации ЭКС.
Желудочковая тахикардия – у больных с аневризмой левого
желудочка после аневризмэктомии в условиях АИК ликвидируется или
изолируется аритмогенная зона путем эндокардиальной резекции в
сочетании с криодеструкцией.
Желудочковая аритмия – при неэффективности консервативной
терапии прибегают к имплантации антитахикардического стимулятора
или кардиодефибрилятора.
Предсердная тахикардия – методы лечения те же.
Пароксизмальная тахикардия – патогенез объясняется наличием
двух путей проведения в атриовентрикулярном узле (a-b). Ликвидация
этой связи устраняет тахикардию при полном сохранении функции узла.
48
49.
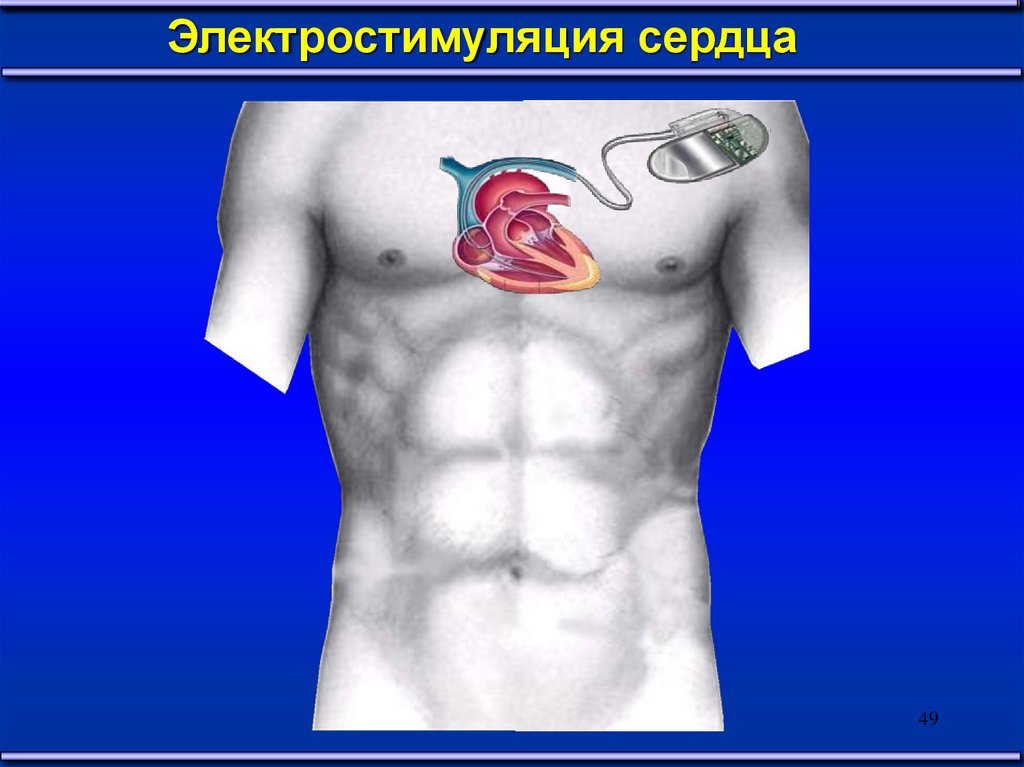
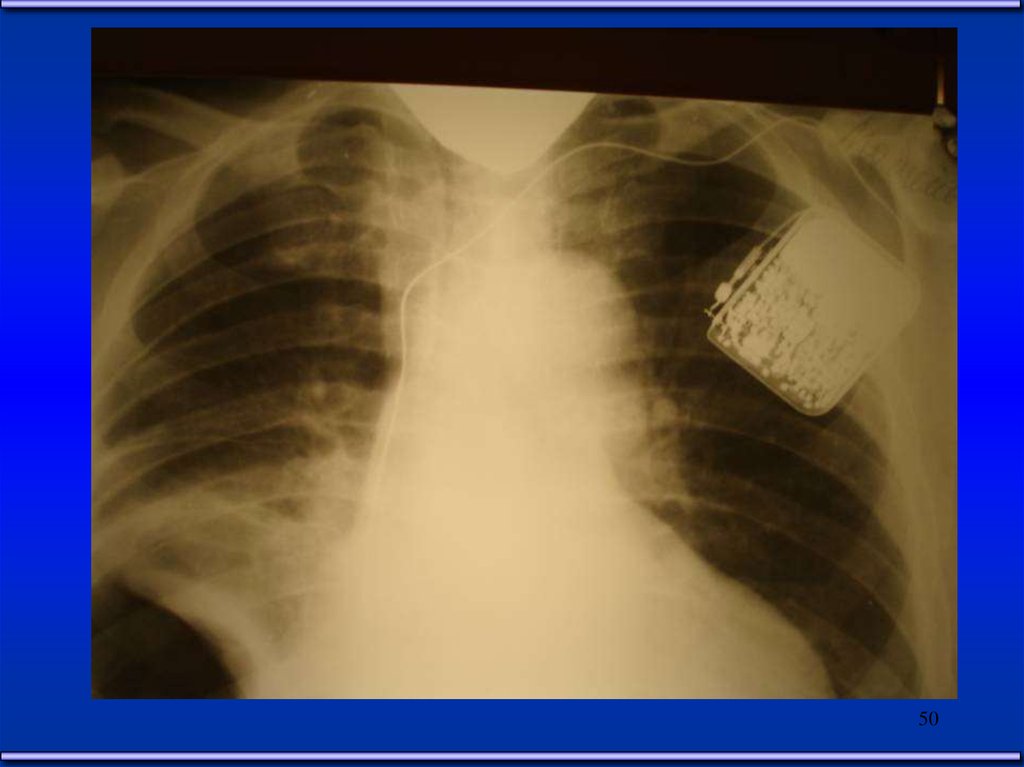
Электростимуляция сердца49
50.
5051.
Окклюзионные поражения коронарных артерийНесмотря на определенные успехи в профилактике и лечении ИБС,
она по-прежнему занимает ведущие позиции в структуре заболеваемости
и смертности населения индустриально развитых стран. На ИБС
приходится одна треть всех смертей в цивилизованных странах мира
(Бокерия Л.А.и соавт., 2000). По данным Госкомстата России,
опубликованным в 2000 году, болезни сердца и сосудов остаются главной
причиной смертности.
Группа экспертов ВОЗ в 1971 году дала этой патологии следующее
определение: "Ишемическая болезнь сердца представляет собой острую
или хроническую дисфункцию сердца, возникшую вследствие
относительного или абсолютного уменьшения снабжения миокарда
артериальной кровью".
Е. Braunwald предложил определение ишемии миокарда, которое в
настоящее время считается классическим: "Ишемия миокарда —
состояние, при котором имеется недостаток кислорода, сочетающийся с
неадекватным вымыванием метаболитов в результате снижения
перфузии миокарда".
51
52.
Фракция выброса левого желудочка - основной критерий для отборабольных на реваскуляризацию миокарда.
Основные сложности при определении показаний к оперативному
лечению ИБС возникают в связи с кардиомиопатией, аневризмой левого
желудочка, а также постинфарктными желудочковыми аритмиями.
Выбор метода реваскуляризации миокарда определяется данными
селективной коронарографии и вентрикулографии.
При определении показаний к хирургической реваскуляризации
миокарда выделяют 3 группы больных: 1 – пациенты, которым абсолютно
показано хирургическое лечение, результаты которого не вызывают
сомнения; 2 – пациенты, у которых преимущества хирургии пред
консервативной терапией до конца не выяснены; 3 – пациенты, у которых
преимуществ перед консервативной терапией нет.
Идеальным для хирургического лечения ИБС является: клиническая
картина выраженной стенокардии; сегментарное стенозирование
магистральных коронарных артерий или их крупных ветвей; хорошая
проходимость
дистального
коронарного
русла;
сохраненный
жизнеспособный миокард.
52
53.
Методы хирургического лечения ИБСДве группы методов хирургического лечения ИБС:
1 – непрямая реваскуляризация: новокаиновые блокады; создание
сосудистых анастомозов сердца с окружающими тканями – большой
сальник, прямые мышцы живота, петли тонкой кишки, желудок, лоскут
диафрагмы, большая грудная мышца; облучение лазерным лучом
ишемизированных участков миокарда через полости предсердий или
желудочков; двухсторонняя перевязка внутренней грудной артерии –
операция Фиески; имплантация внутренней грудной артерии в миокард
– о. Уинберг.
2
–
прямая
реваскуляризация
миокарда.
Развитию
прямых
реваскуляризирующих
операций
способствовало
внедрение
коронарографии, который впервые был применен в Кливлендской
клинике (США) кардиологом Ф. Соунес в 1959 году. В основном сейчас
для выполнения коронарографии используется доступ через
бедренную артерию по Сельдингеру.
53
54.
- эндартерэктомия из пораженного сегмента (о. Бейли);- аортокоронарное шунтирование (АКШ).
Впервые об успешной операции АКШ сообщил Рене Фавалоро в
1967 году (г. Кливленд, США). В 1964 году H.Garret, M.De Bakey
выполнили аортокоронарный шунт с использованием большой
подкожной вены. В настоящее время эта операция нашла самое
широкое применение.
- множественное шунтирование с включением в кровоток нескольких
коронарных артерий. Недостатками аутовенозных шунтов является их
постепенное закрытие. В среднем сроки функционирования
аутовенозных шунтов составляют от 7 до 10 лет. К 10 годам
функционирует менее 50% шунтов;
- маммарно-коронарный анастомоз. В 1964 году в Ленинграде
русский хирург Василий Иванович Колесов впервые в мире успешно
осуществил прямую реваскуляризацию миокарда с помощью внутренней
грудной (маммарной) артерии. Внутренняя грудная артерия более чем в
90% случаев не облитерируется в течение 15 лет. Поэтому в настоящее
время в основном для восстановления кровотока в передней
межжелудочковой артерии используется внутренняя грудная артерия;
54
55.
- использование для АКШ биотрансплантатов (Zurbrugg H.R, 1998);- анастомоз с правой желудочно-сальниковой артерией;
- эндоваскулярное расширение стеноза с имплантацией стента;
- ангиопластика с помощью эксимерного лазера;
- трансмиокардиальная лазерная реваскуляризация миокарда –
формируются каналы с помощью лазера в миокарде левого желудочка
таким образом, что соединяются миокард и его афферентные сосуды,
при этом кровь напрямую поступает в миокард из полости левого
желудочка (Махмуд Мирхосейни,1983; Ю.Ю.Бредикис, 1984);
- лечебный ангиогенез – применение факторов роста коллатерального
кровообращения;
- эпидуральная высокочастотная электрическая стимуляция спинного
мозга;
- пересадка эмбриональных кардиоцитов;
- пересадка сердца.
55
56.
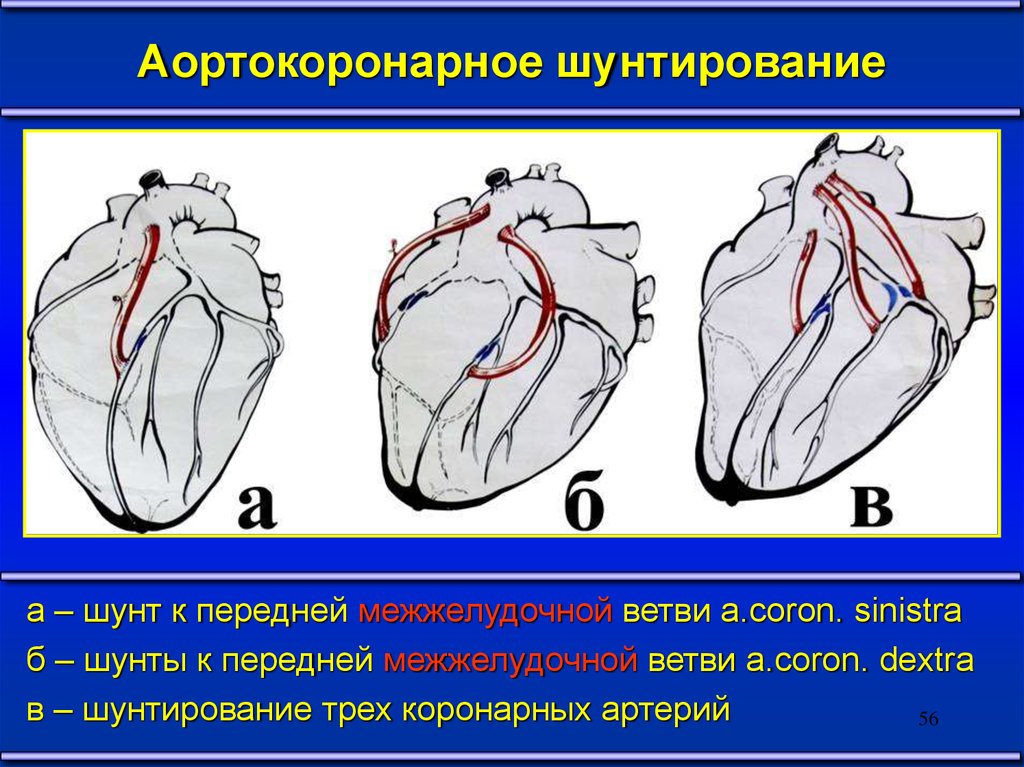
Аортокоронарное шунтированиеа – шунт к передней межжелудочной ветви a.coron. sinistra
б – шунты к передней межжелудочной ветви a.coron. dextra
в – шунтирование трех коронарных артерий
56
57.
АНЕВРИЗМА СЕРДЦА (АС)Аневризма сердца – патологическое выпячивание
истонченного и
несокращающегося участка стенки желудочка сердца. Впервые об АС сообщил
Гунтер в 1757 году. Наиболее частая причина АС (около 95%) - инфаркт миокарда.
Другие причины: врожденные случаи, инфекционные заболевания (сепсис,
сифилис) и травматические повреждения сердца.
Классификация. АС разделяются на острые, подострые и хронические. По
форме аневризмы могут быть плоскими (диффузные), мешковидными,
грибовидными.
Лечение - единственно радикальным методом лечения АС является операция.
Виды операций:
- укрепление истонченной стенки аутотрансплантатами (сальником, кожным
лоскутом, лоскутом из диафрагмы);
- погружение АС швами – применяется при небольших мешотчатых АС;
- резекция аневризмы закрытым способом с помощью пережатия мешка
специальными клеммами;
- резекция АС открытым способом в условиях АИК с полным удалением
аритмогенных зон;
- кардиомиопластика или кардиовентрикулопластика – использование скелетной
мышцы для поддержания работы сердечной мышцы при декомпенсации.
57
58.
ПерикардитыКлассификация
1
2
По этиологии:
- инфекционный (специф. и неспециф)
- неинфекционный (асептический)
- от простейших
- паразитарные
По клиническому течению:
- фибринозный (сухой) экссудативный (серозн. сер-фибр. гемор.)
- гнойный
- гангренозный
- гнилостный
- адгезивный (слипчивый)
- фиброзный (конструктивный или "сдавливающий)
Лечение
1
2
Консервативное:
- этиотропное
- патогенетическое
- симптоматическое
Хирургическое:
- пункция перикарда
- перикардиотомия
- при сдавливающем перикардите – кордиолиз
- предсердный тораколиз
- перикардэктомия
58
59.
Существует более 10 способов пункции перикарда. Наиболее частоэто осуществляется по методу Ларрея с помощью специальных игл или
тонкого троакара. Пункционная игла вводится в левом углу между
основанием мечевидного отростка и местом при-крепления седьмого
рёберного
хряща.
Безопасность
пункции
полости
перикарда
обеспечивается проведением её под УЗИ или КТ. Во время пункции
эвакуируется содержимое и с помощью антисептических средств
санируется полость перикарда.
При
гнойных
перикардитах
осуществляется
чрескожное
дренирование полости перикарда с целью промывания и введения
лекарственных препаратов сроком до 3 суток.
При
хроническом
констриктивном
перикардите
показано
оперативное лечение. Существует трансстернальный доступ с полным
продольным пересечением грудины и чрездвухплевральный в четвертом
или пятом межреберьях - с поперечным пересечением грудины.
Производится
субтотальная
перикардэктомия.
Обязательно
освобождаются от рубцовых сдавлений устья полых вен.
Критерием достаточного освобождения сердца от сдавливающих
рубцовых тканей является нормализация ЦВД к окончанию операции.
59
60.
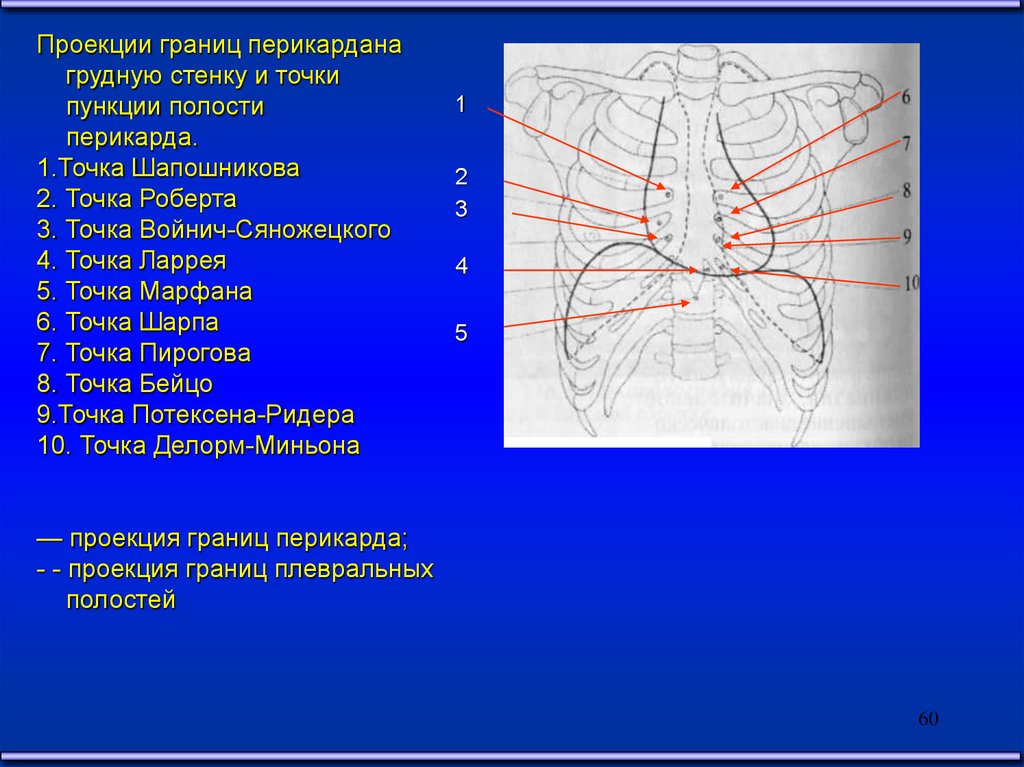
Проекции границ перикарданагрудную стенку и точки
пункции полости
перикарда.
1.Точка Шапошникова
2. Точка Роберта
3. Точка Войнич-Сяножецкого
4. Точка Ларрея
5. Точка Марфана
6. Точка Шарпа
7. Точка Пирогова
8. Точка Бейцо
9.Точка Потексена-Ридера
10. Точка Делорм-Миньона
1
2
3
4
5
— проекция границ перикарда;
- - проекция границ плевральных
полостей
60
61.
РАНЕНИЯ СЕРДЦАВ структуре проникающих ранений груди повреждения сердца и
перикарда составляют около 15%. Своевременно и качественно
выполненное оперативное вмешательство дает пострадавшему шанс для
жизни.
Выделяют: 1 - колото-резаные; 2 – огнестрельные ранения сердца.
Размеры ранения от точечных до 2-3 и более см. При ножевых - чаще
повреждаются правые отделы сердца, а если сзади, то - левое
предсердие.
«Проекция сердца», при ранениях которой возможно повреждение
сердца, описал И.И. Греков: вверху - второе ребро, слева — средняя
подмышечная линия, справа - окологрудинная линия, снизу — левое
подреберье.
Тяжесть состояния пострадавшего объясняется: травматическим шоком,
поступлением крови в полость перикарда и тампонадой сердца. Быстрое
скопление 200 мл крови может вызвать проявления тампонады сердца.
Кроме того, кровь и воздух могут скапливаться в плевральных полостях.
61
62.
Возможноповреждение
внутрисердечных
структур:
межжелудочковой или межпредсердной перегородок, створок клапанов
или подклапанных структур. Хирург, ушив наружную рану сердца,
спасает только жизнь больного. В дальнейшем пациент переводится в
кардиохирургический центр, где выполняются соответствующие
корригирующие оперативные вмешательства.
При
сохранении сознания, то жалобы на слабость,
головокружение, кашель, одышку. При нарастании тампонады сердца и
продолжающемся кровотечении они быстро теряют силы, впадают в
обморочное состояние или сопор. Отмечается бледность кожных
покровов,
акроцианоз,
холодный
пот.
Одышка
усиливается,
артериальное давление падает, пульс становится нитевидным. В редких
случаях в течение относительно длительного времени пациенты с
ранением сердца могут чувствовать себя вполне удовлетворительно.
Диагностика основывается на расположении раны в «Проекции
сердца». Если позволяет состояние больного, то ему выполняют
рентгеновское обследование. При этом выявляется увеличение тени
сердца со сглаженной талией. Отмечается ослабленная пульсация
сердца. Нередко определяется гемопневмоторакс. Информативнее
всего ЭКС.
62
63.
При крайне тяжелом состоянии больного сразу жетранспортируют в операционную, где на фоне реанимационных
мероприятий, как правило, выполняется передняя торакотомия в 4-м или
5-м межреберьях. Затем производится продольная перикардиотомия
впереди от диафрагмального нерва. Рана сердца с пульсирующей струей
крови прикрывается пальцем и затем на нее накладываются швы.
Ушивают рану атравматической иглой, производя вкол и выкол на
расстоянии чуть менее 1 см (0,7-0,8 см) от краев раны. Для избежания
прорезывания раны при завязывании швов можно использовать
специальные прокладки или отсеченные участки перикарда. Для
избежания перевязки коронарных артерий, находящихся рядом с раной,
накладываются П-образные (матрацные) швы под артерией. Ушивание
перикарда производится с помощью редких швов и оставлением «окна» в
нижнем отделе. Это является важным этапом операции и предотвращает
возможное скопление жидкости или крови в полости перикарда. В
необходимых случаях производится реинфузия крови. Затем плевральная
полость дренируется двумя дренажами и ушивается наглухо. В
послеоперационном периоде проводится комплексная интенсивная
терапия.
63
64. ЛИТЕРАТУРА
•Амосов Н. М., Зиньковский М. Ф. Хирургическое лечение тетрады Фалло. Киев, 1982.•Амосов Н. М., БендетЯ. А. Терапевтические аспекты кардиохирургии. Киев, 1990.
•Бакулев А. А., Мешалкин Е. П. Врожденные пороки сердца. М., 1955.
•Бакулев А. Н. (ред.). Хирургическое лечение митральных стенозов. М, 1958.
•Бредикис Ю. Ю. Электрическая стимуляция сердца при тахикардиях и тахиаритмиях. М.,
1976.
•Бредикис Ю. Ю. Хирургическое лечение наджелудочковой тахикардии. Вильнюс, 1985.
•Бураковский В. И., Бокерия Л. А. (ред.). Сердечно-сосудистая хирургия. М., 1989.
•Василенко В. X. Приобретенные пороки сердца. М., 1972.
•Вишневский А. А. и др. Тетрада Фалло. М., 1969.
•Вишневский А. А., Галанкин И. К. Врожденные пороки сердца и крупных сосудов. М., 1962.
•Волколаков Я. В., Лацис А. Р. Хирургическое лечение дефекта межжелудочковой
перегородки. Рига, 1978.
•Галанкин Н. К. и др. Транспозиция магистральных сосудов и камер сердца. М., 1970.
•Гулямов Д. С. Дефект межжелудочковой перегородки. Ташкент, 1984.
•Зубарев Р. П. Аномалия Эбштейна. М., 1975.
•Костюченок Б. М. Пороки трикуспидального клапана. М., 1977.
•Лорие К. Врожденные пороки сердца. М., 1966.
•Маколкин В. И. Приобретенные пороки сердца. М., 1986.
•Муравьев М. В. Открытый артериальный проток. М., 1966.
•Петровский Б. В., Кешишева А. А. Хирургическое лечение открытого протока. М., 1963.
•Ромашов Ф. Н. Диагностика и хирургическое лечение врожденных пороков сердца и
сосудов. М., 1975.
•Соловьев Г. М. и др. Пороки трикуспидального клапана и пластические операции на нем. М.,
1988.
64
•Сумароков А. В., Моисеев В. С. Клиническая кардиология. М., 1986.
65. ЛИТЕРАТУРА
• Гогин Е. Е. Болезни перикарда. М., 1979.• Князев М. Д., Стегайло Р. А. Реконструктивная хирургия
прединфарктной стенокардии и острого инфаркта миокарда. - М.,
1978.
• Колесников И. С., Путов Н. В., Гребенникова А. Т. Хронические
перикардиты и их хирургическое лечение. - М., 1964.
• Колесов В. И. Хирургия венечных артерий сердца. - Л., 1977.
• Мягков И. И. и др. Постинфарктные аневризмы сердца. - Киев, 1987.
• Петровский Б. В., Князев М. Д., Шабалкин Б. В. Хирургия
хронической ишемической болезни сердца. - М., 1978.
• Петровский Б. В., Козлов И. 3. Аневризмы сердца. - М., 1965.
• Петровский Б. В. (ред.). Экстренная хирургия сердца и
сосудов.• М., 1980.
• Сумароков А. В., Моисеев В. С. Клиническая кардиология. - М., 1986.
• Углов Ф. Г., Самойлова М. А. Диагностика и лечение слипчивого
перикардита. - Л., 1962.
65




















































 medicine
medicine