Similar presentations:
Оксиды углероды
1.
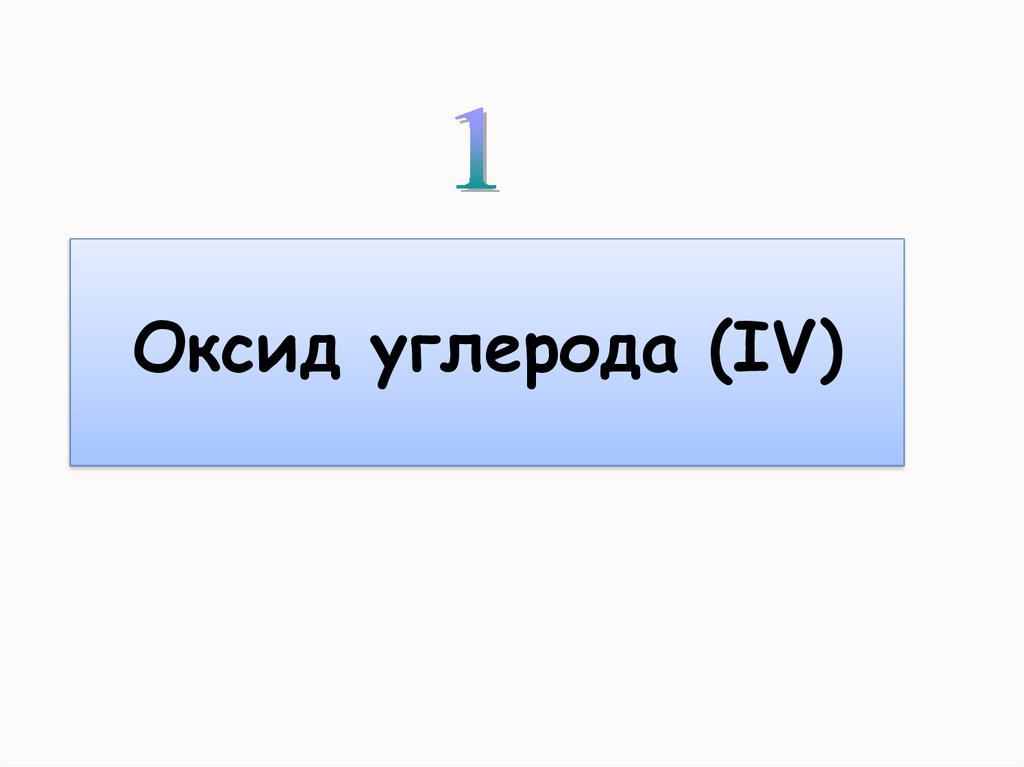
Оксидыуглерода
2.
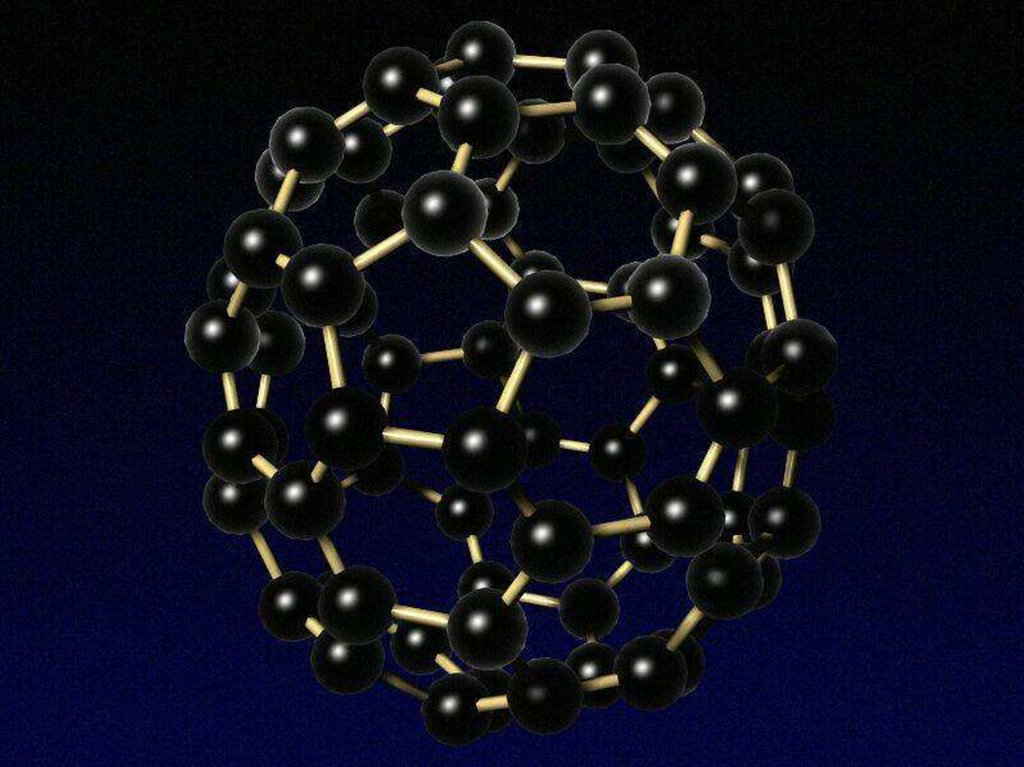
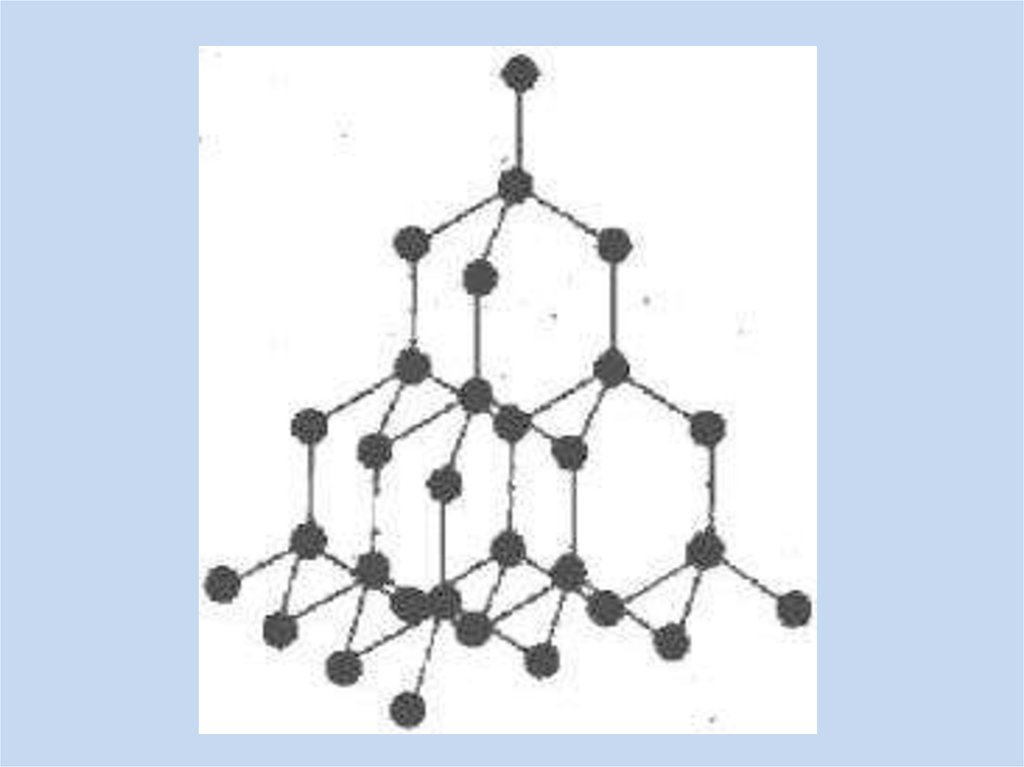
Вспомним изученное –Подберите
названия к
иллюстрациям
3.
34.
45.
56.
7.
78.
89.
910.
11. Задачи урока:
•Рассмотреть строение,получение, химические
свойства и применение
оксидов углерода;
•Выявить биологическое
действие изучаемых
веществ на живые
организмы.
12.
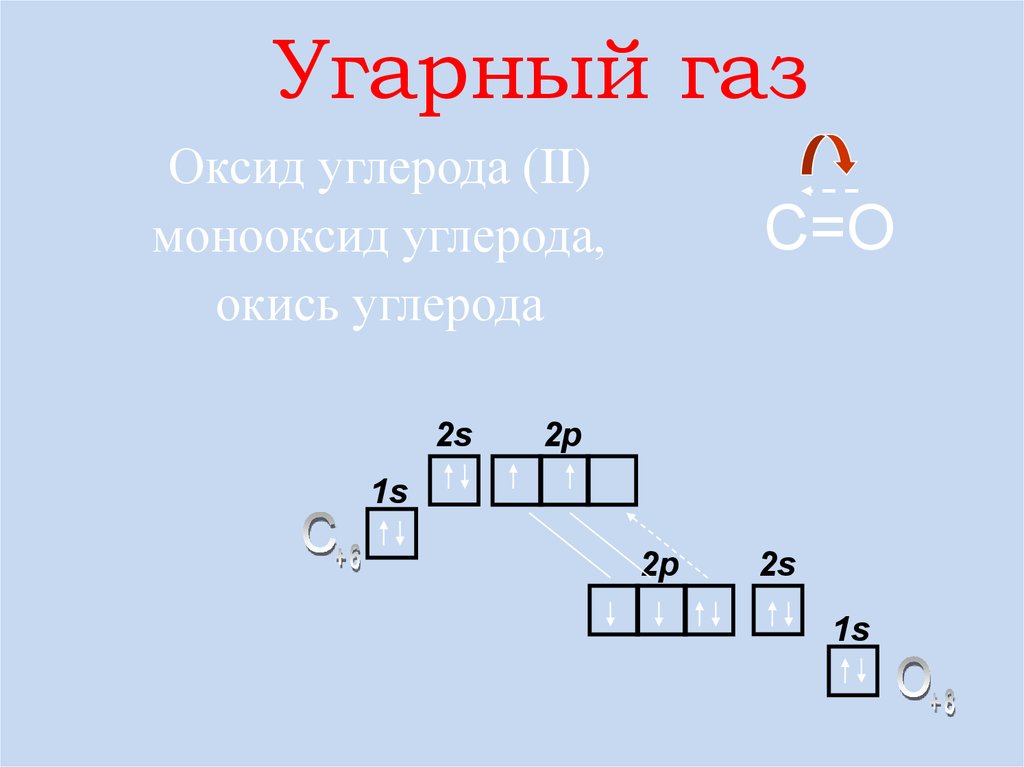
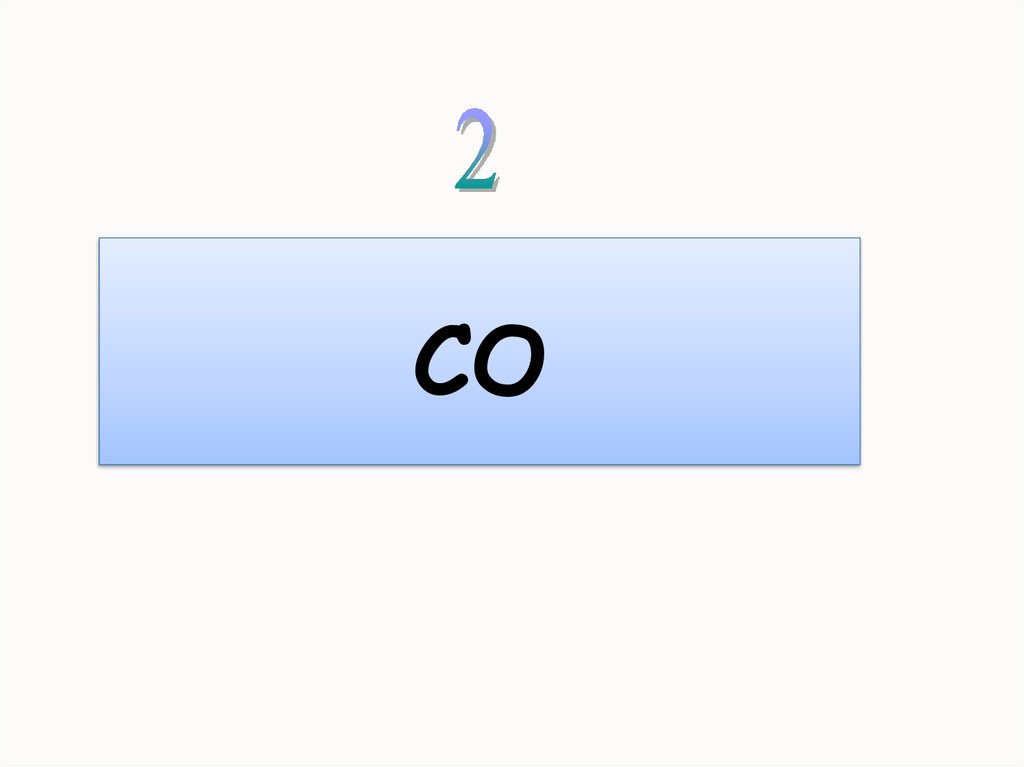
Угарный газОксид углерода (II)
монооксид углерода,
окись углерода
2s
С=О
2p
1s
2p
2s
1s
13. Способы получения:
–ядовитое вещество!
Угарный газ
ПДК (СО) = 20 мг/м3
Способы получения:
2С + О2 = 2СО
СО2 + С = 2СО
14. Физические свойства:
Мr(СО) = 28 Цвета, запаха не имеет.В воде нерастворим.
Мr(возд.) = 29
Химические свойства:
2СО + О2 = 2СО2
СО – сильный
восстановитель!
15.
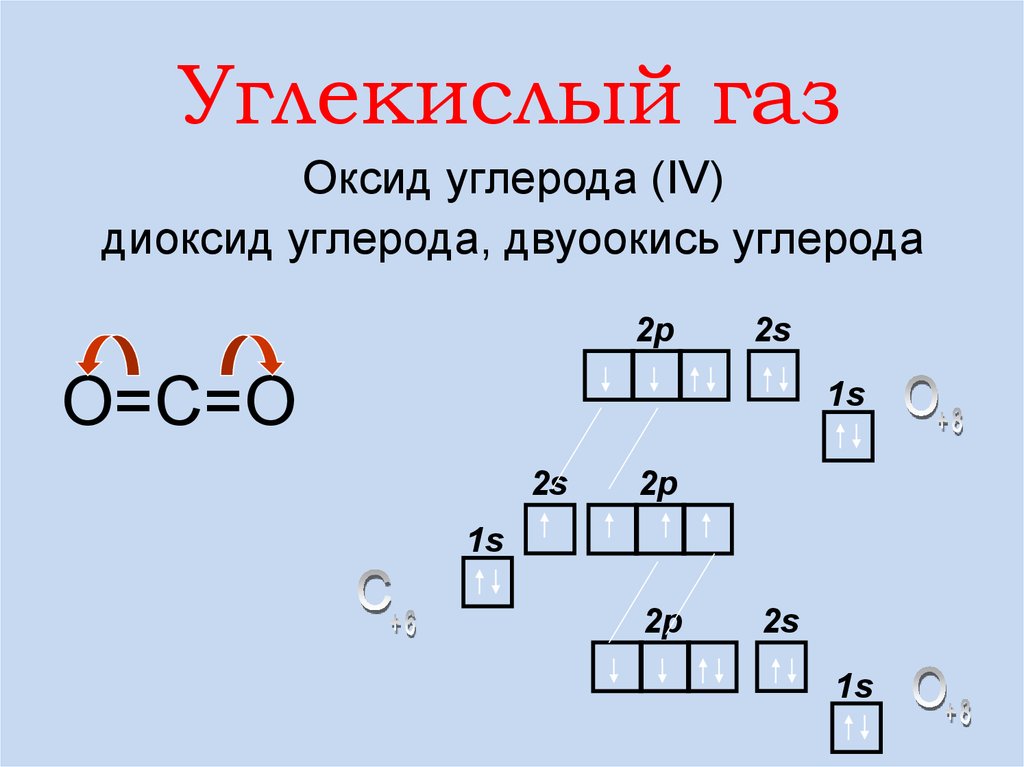
Углекислый газОксид углерода (IV)
диоксид углерода, двуоокись углерода
2p
2s
О=С=О
1s
2s
2p
1s
2p
2s
1s
16.
Углекислый газ—
условно ядовитое вещество
ПДК (СО2) = 30 мг/м3
Способы получения:
С + О2 = СО2
2СО + О2 = 2СО2
СаСО3 = СО2 + СаО
СаСО3 + 2HCl = H2О + СО2 + СаCl2
17. Физические свойства:
Мr(СО2) = 44Мr(возд.) = 29
Цвета, запаха не имеет.
Хорошо растворяется в воде.
Способы распознавания:
Не поддерживает горение
Вызывает помутнение известковой
воды
18.
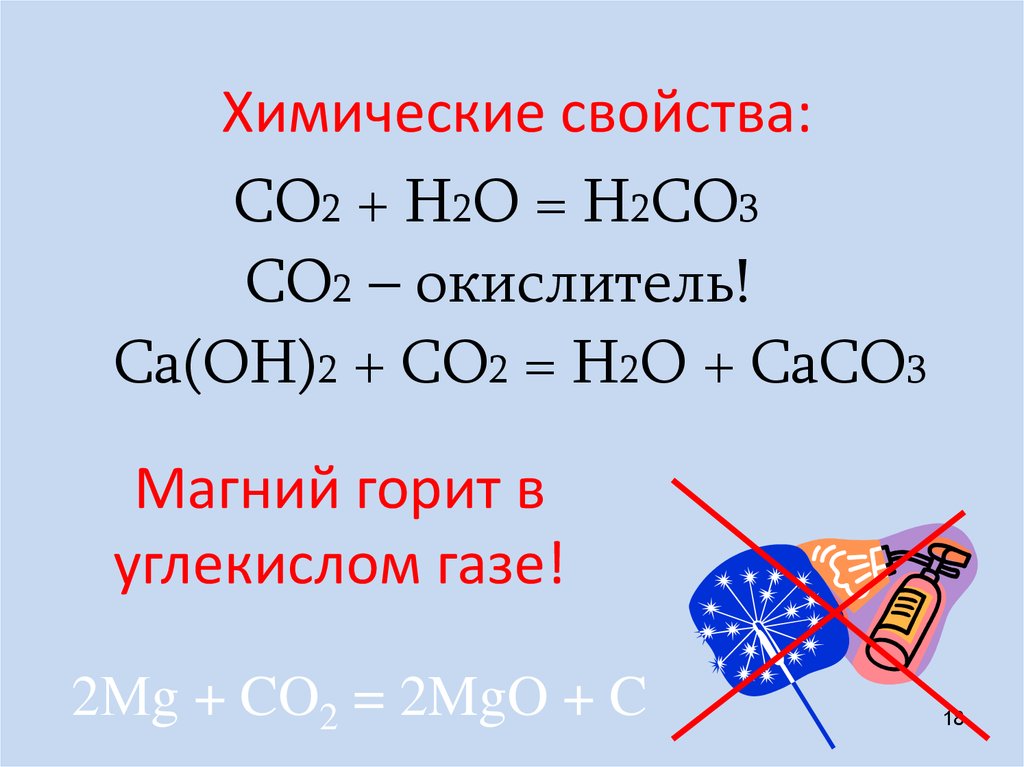
Химические свойства:СО2 + H2О = H2СО3
СО2 – окислитель!
Са(ОН)2 + СО2 = H2О + СаСО3
Магний горит в
углекислом газе!
2Мg + CO2 = 2MgO + C
18
19.
Химический диктант1 вариант
Фамилия:_______
2 вариант
Фамилия:_______
Углекислый газ
. . . . . . .
1 2 3 4 5 6 7
Угарный газ
. . . . . . .
1 2 3 4 5 6 7
20.
Оксид углерода (IV)21.
СO22.
Окислитель23.
Не имеет запаха24.
Растворим в воде25.
СO226.
Восстановитель27.
Домашнее задание§29 ,упр. 1 -4




















 chemistry
chemistry








