Similar presentations:
Оксид углерода
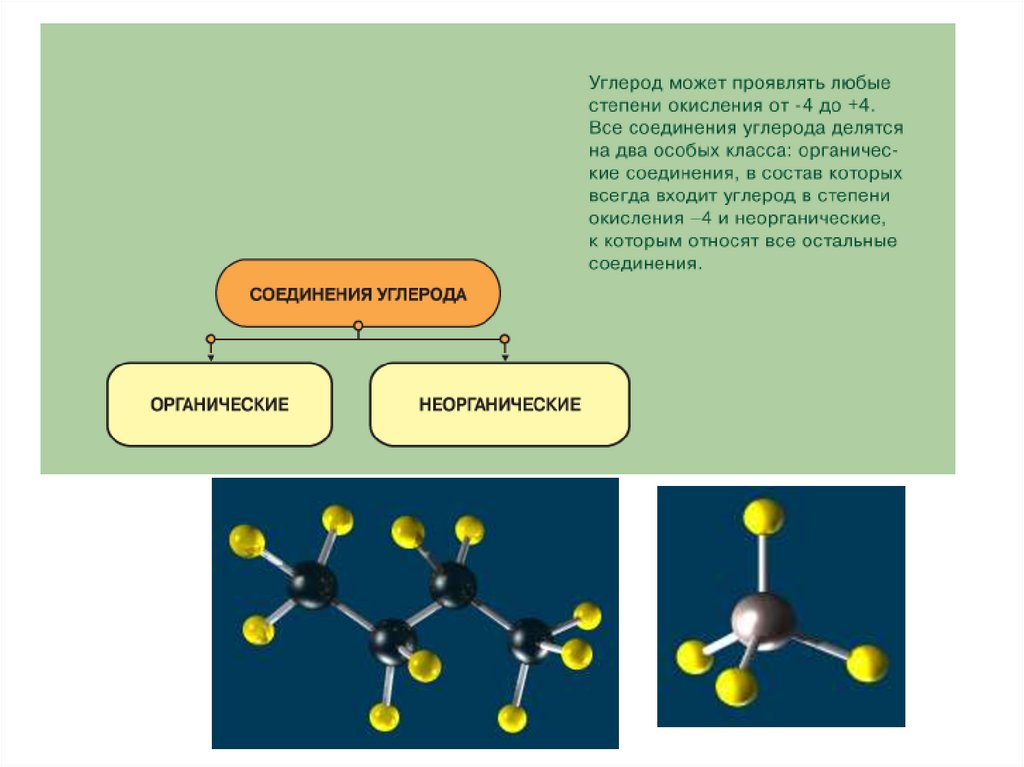
1. Оксиды углерода
2.
3.
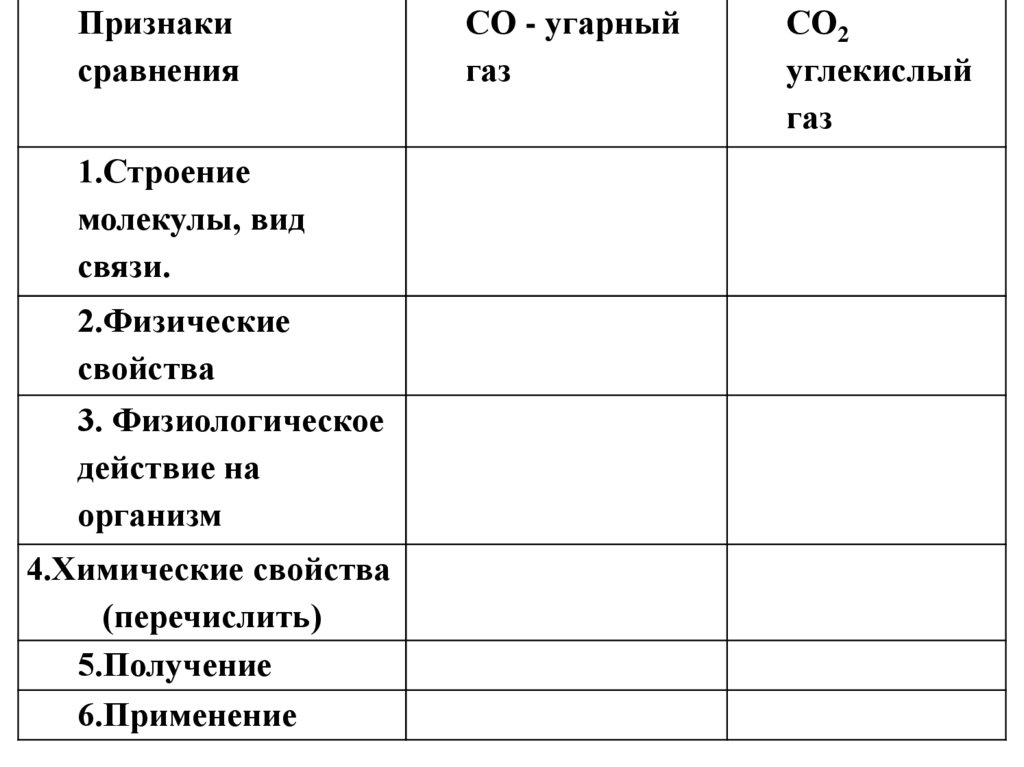
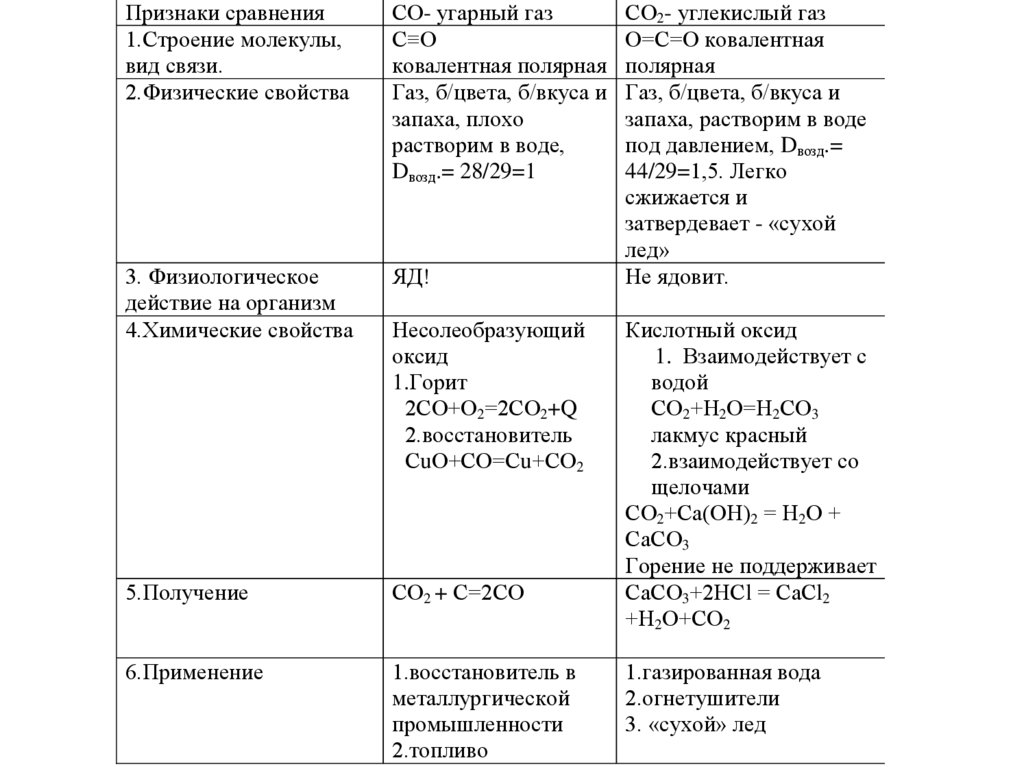
Признакисравнения
1.Строение
молекулы, вид
связи.
2.Физические
свойства
3. Физиологическое
действие на
организм
4.Химические свойства
(перечислить)
5.Получение
6.Применение
СО - угарный
газ
СО2
углекислый
газ
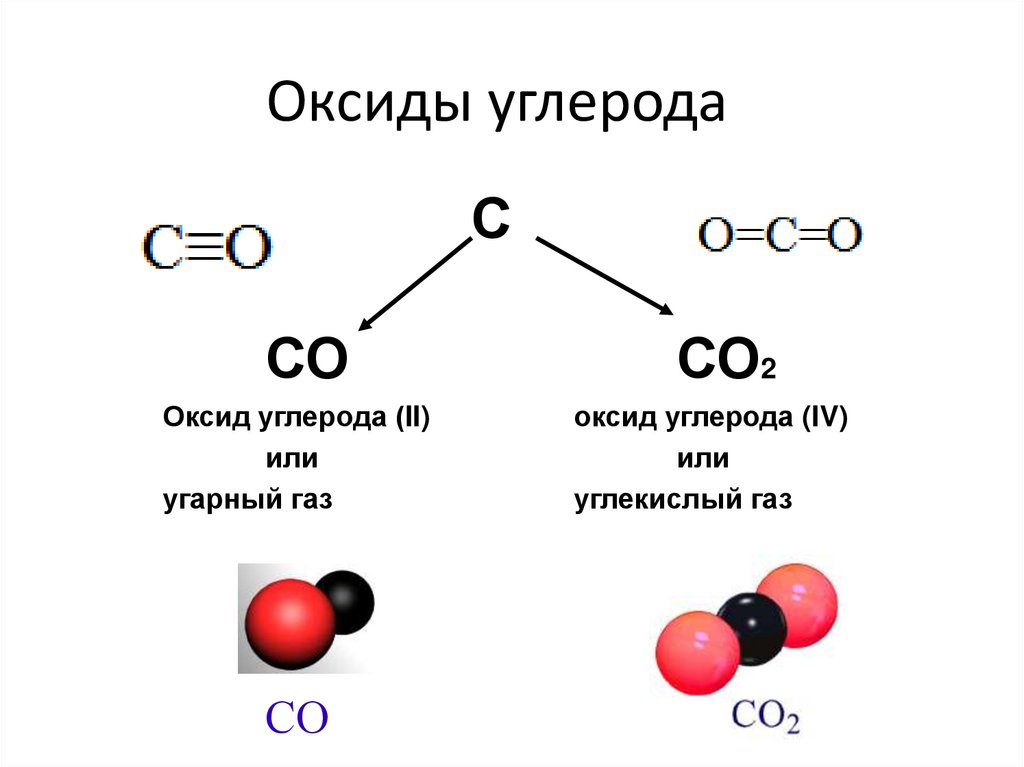
4. Оксиды углерода
ССО
Оксид углерода (II)
или
угарный газ
СО
СО2
оксид углерода (IV)
или
углекислый газ
5. Оксид углерода (II)
Угарный газ — бесцветный, не имеющий запаха,плохо растворимый в воде ядовитый газ,
относится к несолеобразующим оксидам.
Молекулы СО очень прочны, поскольку связь
между атомами углерода и кислорода в них
тройная.
Для оксида углерода (II) характерны
восстановительные свойства. Например, он
восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
6.
7.
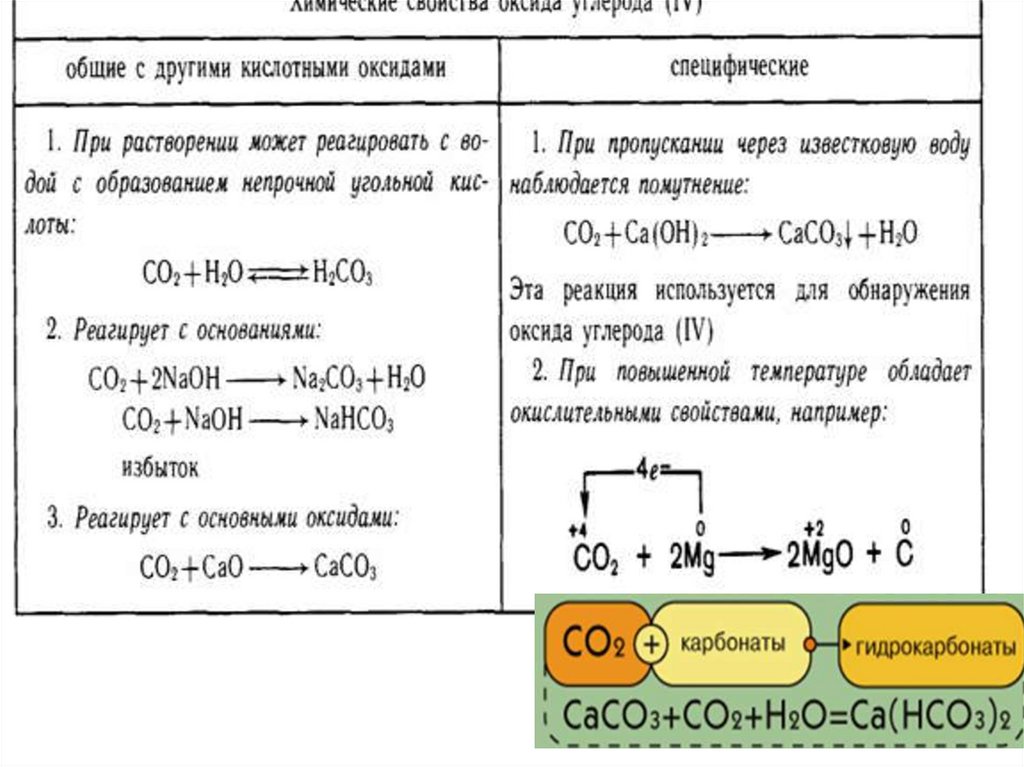
8. Оксид углерода (IV)
Углекислый газ– газ без цвета и запаха. Это кислотный оксид, ему
соответствует двухосновная угольная кислота.
Растворение оксида углерода (IV) — обратимый
процесс:
H2O + CO2 H2CO3
Для углекислого газа не характерны ни
окислительные, ни восстановительные свойства,
хотя некоторые наиболее активные металлы горят в
оксиде:
CO2 + 2Mg = 2MgO + С
9.
10.
11.
12. Получение оксида углерода (IV)
• В лаборатории оксид углерода (IV) получаютвзаимодействием карбоната кальция (мел,
мрамор) с соляной кислотой в аппаратах
Киппа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
• В промышленности этот оксид получают
сжиганием угля и при обжиге известняка:
C + O2 = CO2
CaCO3 = CaO + CO2
13.
Признаки сравнения1.Строение молекулы,
вид связи.
2.Физические свойства
СО- угарный газ
С≡О
ковалентная полярная
Газ, б/цвета, б/вкуса и
запаха, плохо
растворим в воде,
Dвозд.= 28/29=1
3. Физиологическое
действие на организм
4.Химические свойства
ЯД!
5.Получение
СО2 + С=2СО
6.Применение
1.восстановитель в
металлургической
промышленности
2.топливо
Несолеобразующий
оксид
1.Горит
2СО+О2=2СО2+Q
2.восстановитель
СuО+СО=Сu+СО2
СО2- углекислый газ
О=С=О ковалентная
полярная
Газ, б/цвета, б/вкуса и
запаха, растворим в воде
под давлением, Dвозд.=
44/29=1,5. Легко
сжижается и
затвердевает - «сухой
лед»
Не ядовит.
Кислотный оксид
1. Взаимодействует с
водой
СО2+Н2О=Н2СО3
лакмус красный
2.взаимодействует со
щелочами
СО2+Са(ОН)2 = Н2О +
СаСО3
Горение не поддерживает
СаСО3+2НСl = СаСl2
+Н2О+СО2
1.газированная вода
2.огнетушители
3. «сухой» лед








 chemistry
chemistry








