Similar presentations:
Неорганическая химия (все для повторения)
1.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮФедеральное государственное образовательное учреждение
высшего профессионального образования
Сибирский федеральный университет
Кафедра химии
Красноярск, 2008
900igr.net
2.
Неорганическая химия3.
УДКББК
540
24.1
Н52
Авторы:
С. Д. Кирик, Г. А. Королева, Н. М. Вострикова, Н. Н. Головнев, С. В. Сайкова
Электронный учебно-методический комплекс по дисциплине «Неорганическая химия» подготовлен в рамках реализации в 2007 г.
программы развития ФГОУ ВПО «Сибирский федеральный университет» на 2007–2010 гг. по разделу «Модернизация образовательного
процесса».
Рецензенты:
Красноярский краевой фонд науки;
Экспертная комиссия СФУ по подготовке учебно-методических комплексов дисциплин
Н52
Неорганическая химия. Презентационные материалы. Версия 1.0 [Электронный ресурс] : наглядное пособие /
С. Д. Кирик, Г. А. Королева, Н. М. Вострикова и др. – Электрон. дан. (6 Мб). – Красноярск : ИПК СФУ, 2008. –
(Неорганическая химия : УМКД № 265-2007 / рук. творч. коллектива С. Д. Кирик). – 1 электрон. опт. диск (DVD). –
Систем. требования : Intel Pentium (или аналогичный процессор других производителей) 1 ГГц ; 512 Мб оперативной
памяти ; 6 Мб свободного дискового пространства ; привод DVD ; операционная система Microsoft Windows 2000 SP 4 /
XP SP 2 / Vista (32 бит) ; Microsoft PowerPoint 2003 или выше.
ISBN 978-5-7638-1497-2 (комплекса)
ISBN 978-5-7638-1498-9 (пособия)
Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320802707 от 22.12.2008 г. (комплекса)
Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320802736 от 20.12.2008 г. (пособия)
Настоящее издание является частью электронного учебно-методического комплекса по дисциплине «Неорганическая химия»,
включающего учебную программу, курс лекций, лабораторный практикум, методические указания по самостоятельной работе, контрольноизмерительные материалы «Неорганическая химия. Банк тестовых заданий».
Представлена презентация (в виде слайдов) теоретического курса «Неорганическая химия».
Предназначено для студентов направлений подготовки бакалавров 150100.62 «Металлургия», 280200.62 «Защита окружающей
среды» укрупненных групп 150000 «Металлургия, машиностроение, металлообработка», 280000 «Безопасность жизнедеятельности,
природообустройство и защита окружающей среды».
© Сибирский федеральный университет, 2008
Рекомендовано к изданию Инновационно-методическим управлением СФУ
Разработка и оформление электронного образовательного ресурса: Центр технологий электронного обучения информационно-аналитического
департамента СФУ; лаборатория по разработке мультимедийных электронных образовательных ресурсов при КрЦНИТ
Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта запрещается. Встречающиеся
названия программного обеспечения, изделий, устройств или систем могут являться зарегистрированными товарными знаками тех или иных фирм.
Подп. к использованию 01.09.2008
Объем 6 Мб
Красноярск: СФУ, 660041, Красноярск, пр. Свободный, 79
4.
ОглавлениеОбщие сведения
Модуль 1. Общетеоретические основы неорганической химии
• Раздел 1. Общие закономерности химических процессов
• Раздел 2. Строение атома и периодическая система
• Раздел 3. Химическая связь
• Раздел 4. Растворы и дисперсные системы
Модуль 2. Химия элементов и их соединений
• Раздел 6. Общая характеристика химических элементов
Модуль 3. Химическая идентификация и анализ вещества
4
5.
Общие сведения6. Цели курса
• Развитие компетенций, способствующих формированиювыпускника нового поколения.
• Формирование у студентов химического мышления путем
освоения основных закономерностей и общих методов химии как
науки для решения различных химических проблем.
• Формирование творческих способностей будущих специалистовбакалавров с помощью предметного содержания обучения и
соответствующей организацией познавательной деятельности
по его усвоению (лабораторный практикум, решение задач, как
лабораторно-практического, так и теоретического направления).
• Овладение студентами теоретических основ и навыков
современных химических и физико-химических методов,
применяемых в аналитических лабораториях предприятий и
научно-исследовательских институтах цветной металлургии.
Введение
6
7.
Задачи курса• Научить понимать природу химических реакций,
используемых в металлургии цветных, редких
и благородных металлов.
• Использовать общие закономерности протекания
химических реакций, современное представление
о строении атома, положения элементов в периодической
системе и теорию химической связи.
• Научить прогнозировать и определять свойства
соединений и направление химической реакции.
• Осуществлять анализ свойств неорганических веществ,
исходя из строения атома элемента и положения его
в периодической системе Д. И. Менделеева.
Введение
7
8.
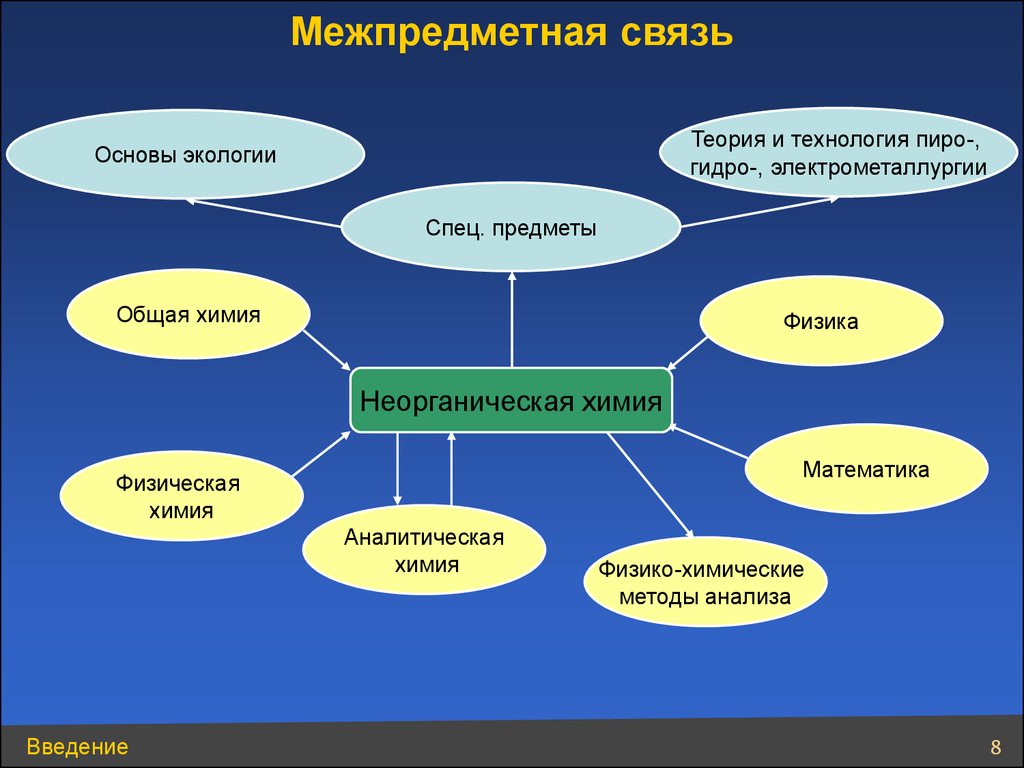
Межпредметная связьТеория и технология пиро-,
гидро-, электрометаллургии
Основы экологии
Спец. предметы
Общая химия
Физика
Неорганическая химия
Математика
Физическая
химия
Аналитическая
химия
Введение
Физико-химические
методы анализа
8
9.
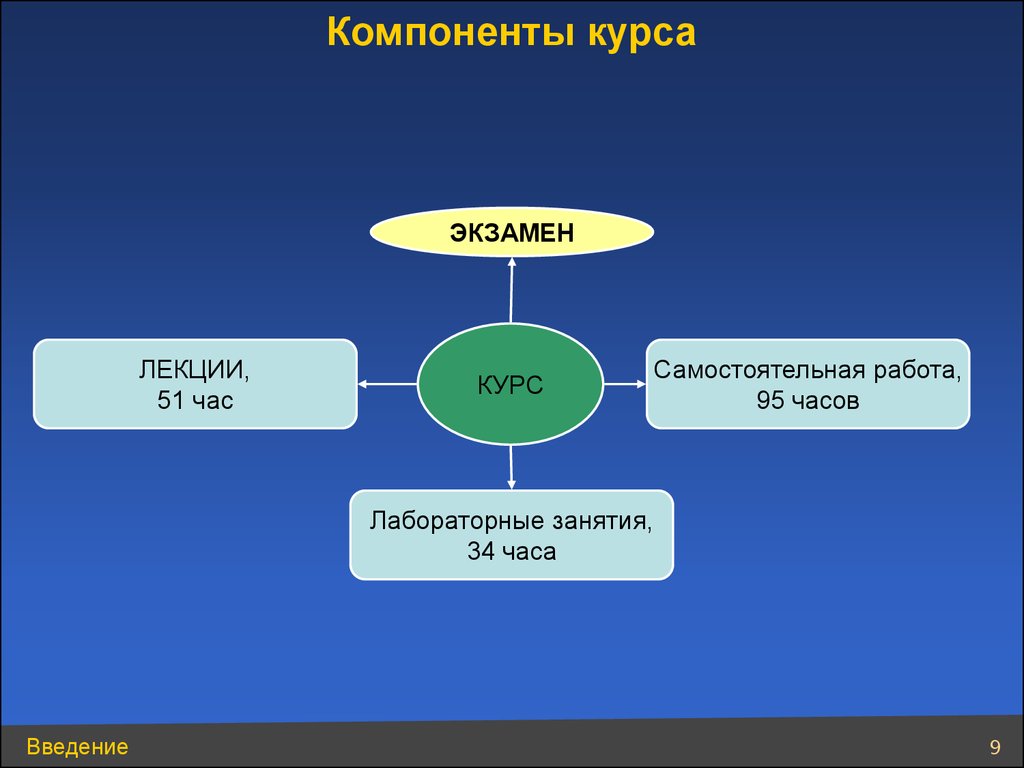
Компоненты курсаЭКЗАМЕН
ЛЕКЦИИ,
51 час
КУРС
Самостоятельная работа,
95 часов
Лабораторные занятия,
34 часа
Введение
9
10.
Содержание курсаНеорганическая химия
Модуль 1
Модуль 2
Модуль 3
Введение
10
11.
Библиографический список1. Коржуков, Н. Г. Неорганическая химия: учеб. пособие для вузов / Под науч.
ред. Г. М. Курдюмова – М. : МИСИС, 2004. – 512с.
2. Ахметов, Н. С. Общая и неорганическая химия / Н. С. Ахметов. – М. : Высш.
шк., 2001. – 743с.
3. Глинка, Н. Л. Общая химия / Н. Л. Глинка. – М. : Интеграл-Пресс, 2002. –
780с.
4. Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. школа, 2002. –
558с.
5. Понамарев, В. Д. Аналитическая химия (в двух частях). Ч. 1. Теоретические
основы. Качественный анализ – М. : Высш. шк., 1982 – 288с.
6. Основы аналитической химии в 2-х кн., Книга 2. Методы химического
анализа: учеб. для вузов под ред. А. Ю. Золотова. 2-е изд., перераб.
и доп. – М. : Высш. шк., 1999 – 494с.
Введение
11
12. Модуль 1 Общетеоретические основы неорганической химии
13. Раздел 1 Общие закономерности химических процессов
Общетеоретические основы неорганической химии13
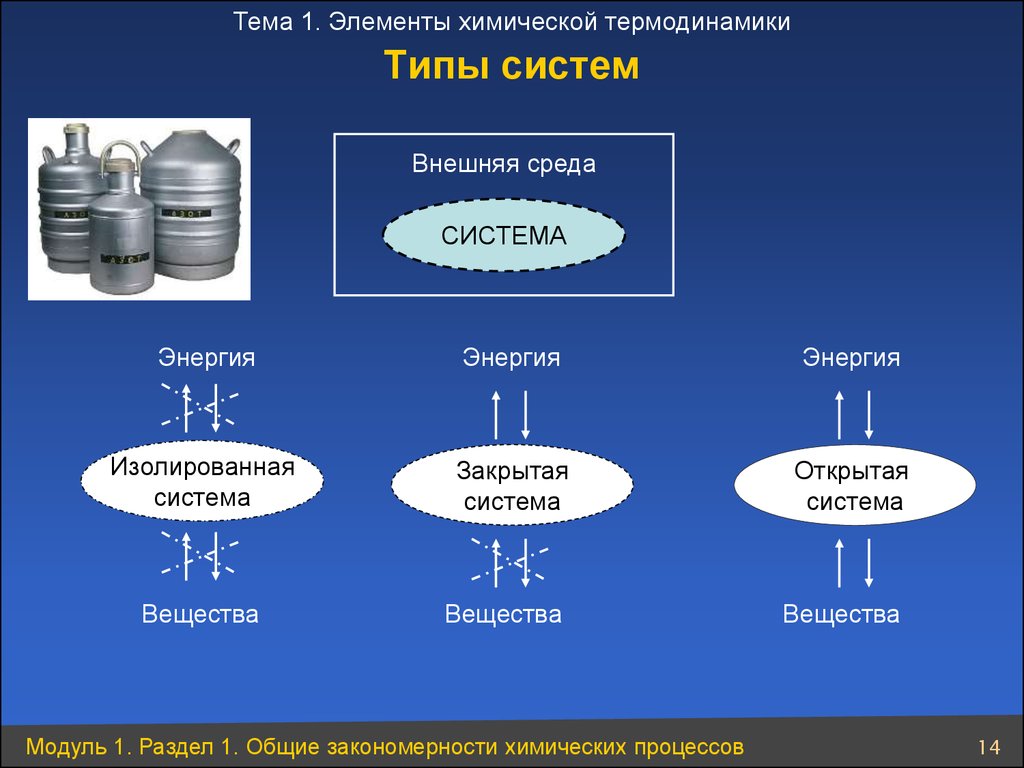
14. Типы систем
Тема 1. Элементы химической термодинамикиТипы систем
Внешняя среда
СИСТЕМА
Энергия
Энергия
Энергия
Изолированная
система
Закрытая
система
Открытая
система
Вещества
Вещества
Модуль 1. Раздел 1. Общие закономерности химических процессов
Вещества
14
15.
Тема 1. Элементы химической термодинамикиПервый закон термодинамики
Энергия изолированной системы постоянна.
Окружающие тела
dU = Q – A
U
СИСТЕМА
Q 0
A 0
Изменение внутренней энергии системы (dU) равно количеству
теплоты ( Q), перешедшей от системы к внешней среде (или
наоборот), за вычетом всех видов работ ( А), совершенных
системой над внешней средой (или наоборот).
Модуль 1. Раздел 1. Общие закономерности химических процессов
15
16.
Тема 1. Элементы химической термодинамикиЗакон Гесса
Тепловой эффект химических реакций зависит только от вида и состояния
исходного вещества и конечных продуктов, но не зависит от пути перехода.
Г. И. Гесс (1836 г.) –
проф. Горного Института
(Петербург)
Следствие: тепловой эффект реакции равен разности между теплотами
образования всех веществ, указанных в правой части уравнения
(продуктами), и теплотами образования всех веществ в левой части
(реагентами), взятых со стехиометрическими коэффициентами
(для теплоты сгорания – наоборот!).
Модуль 1. Раздел 1. Общие закономерности химических процессов
16
17.
Тема 1. Элементы химической термодинамикиЭнтальпийная диаграмма окисления графита
0
0
0
Н1 = Н2 + Н3
Модуль 1. Раздел 1. Общие закономерности химических процессов
17
18.
Тема 1. Элементы химической термодинамикиСамопроизвольные процессы
p1>p2
или T1>T2
p2
T2
Перемешивание газов
Модуль 1. Раздел 1. Общие закономерности химических процессов
18
19.
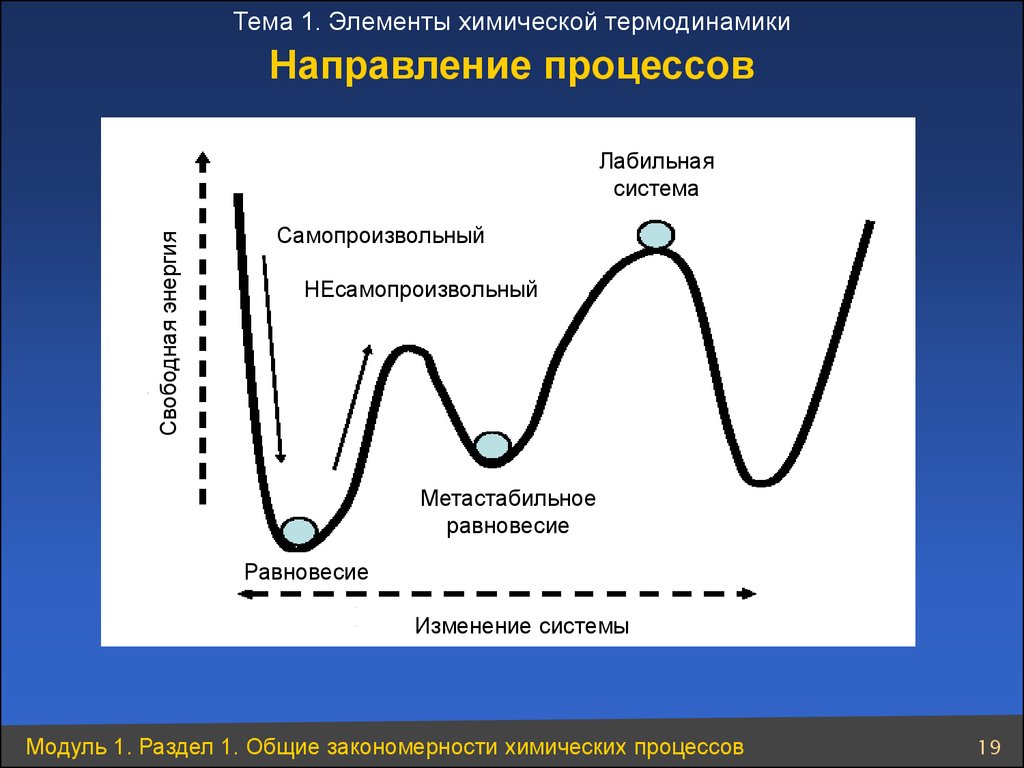
Тема 1. Элементы химической термодинамикиНаправление процессов
Свободная энергия
Лабильная
система
Самопроизвольный
НЕсамопроизвольный
Метастабильное
равновесие
Равновесие
Изменение системы
Модуль 1. Раздел 1. Общие закономерности химических процессов
19
20.
Тема 1. Элементы химической термодинамикиТретий закон термодинамики
Энтропия идеального кристалла чистого вещества
при абсолютном нуле равна нулю.
Планк (1911 г.)
Модуль 1. Раздел 1. Общие закономерности химических процессов
20
21.
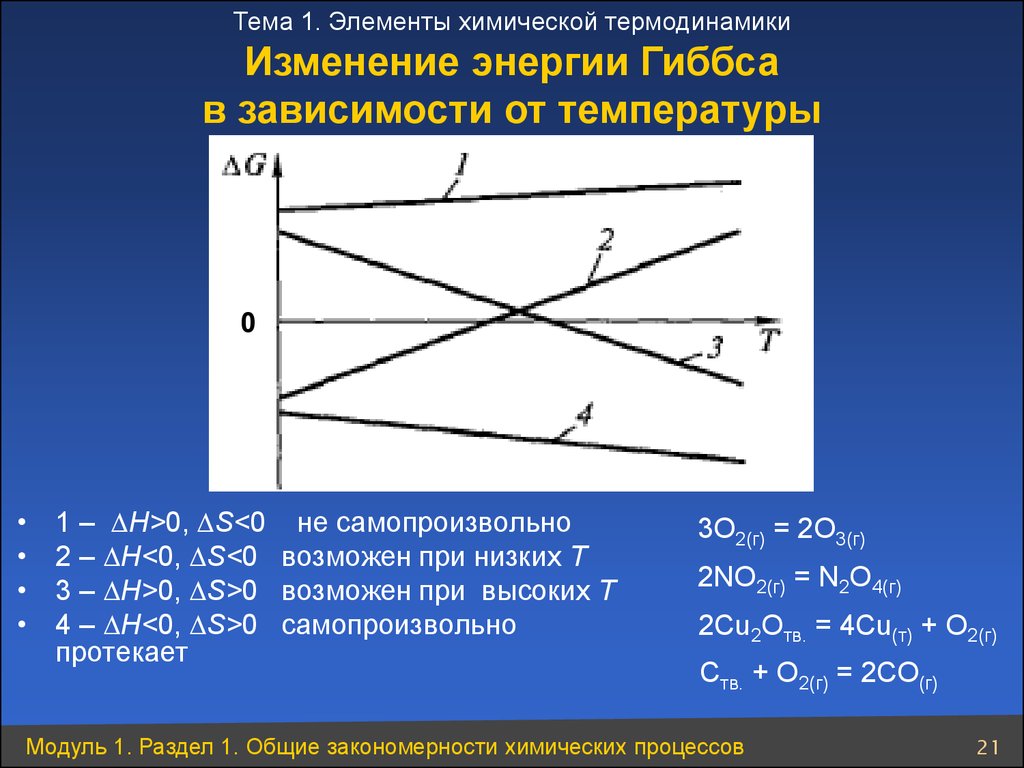
Тема 1. Элементы химической термодинамикиИзменение энергии Гиббса
в зависимости от температуры
0
1 – H>0, S<0 не самопроизвольно
2 – H<0, S<0 возможен при низких Т
3 – H>0, S>0 возможен при высоких Т
4 – H<0, S>0 самопроизвольно
протекает
3О2(г) = 2О3(г)
2NO2(г) = N2О4(г)
2Сu2Oтв. = 4Сu(т) + О2(г)
Ств. + О2(г) = 2СО(г)
Модуль 1. Раздел 1. Общие закономерности химических процессов
21
22.
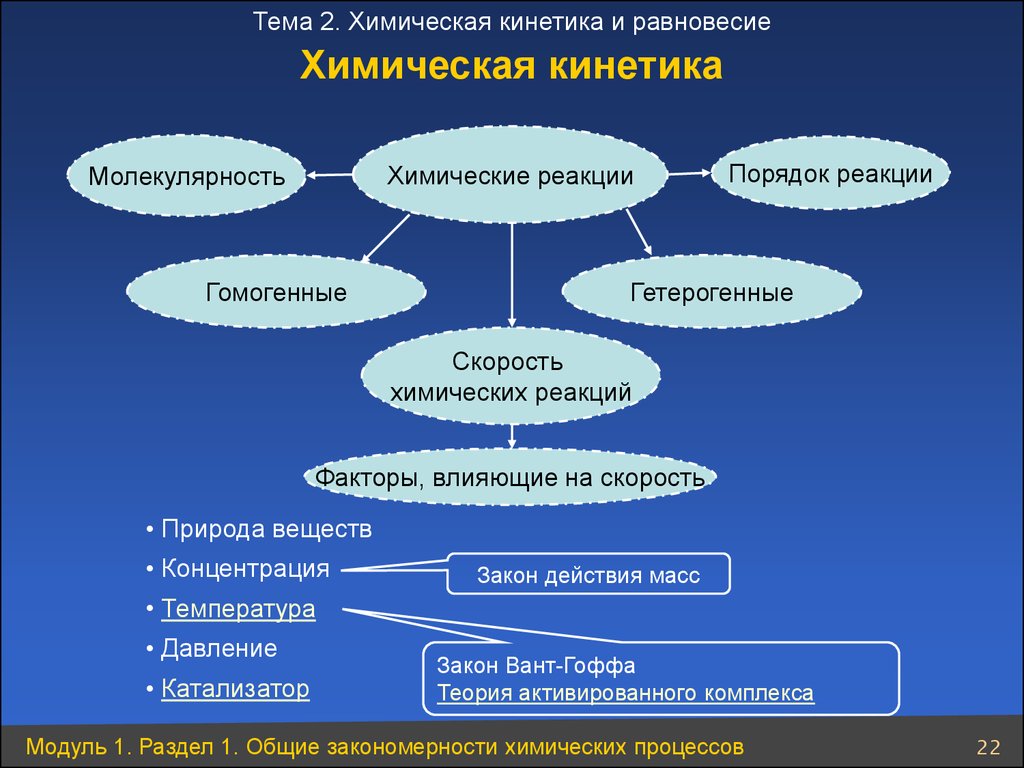
Тема 2. Химическая кинетика и равновесиеХимическая кинетика
Химические реакции
Молекулярность
Гомогенные
Порядок реакции
Гетерогенные
Скорость
химических реакций
Факторы, влияющие на скорость
• Природа веществ
• Концентрация
Закон действия масс
• Температура
• Давление
• Катализатор
Закон Вант-Гоффа
Теория активированного комплекса
Модуль 1. Раздел 1. Общие закономерности химических процессов
22
23.
Тема 2. Химическая кинетика и равновесиеЗакон действующих масс
аА + bВ + …… = сС + dD +….
k C A CB
nA
2CO(г)+О2(г)= О2(г)
Vгом k C CO2
2
CO
nB
С(к) +О 2(г) =СО 2(г)
Vгет k PO2
Модуль 1. Раздел 1. Общие закономерности химических процессов
23
24.
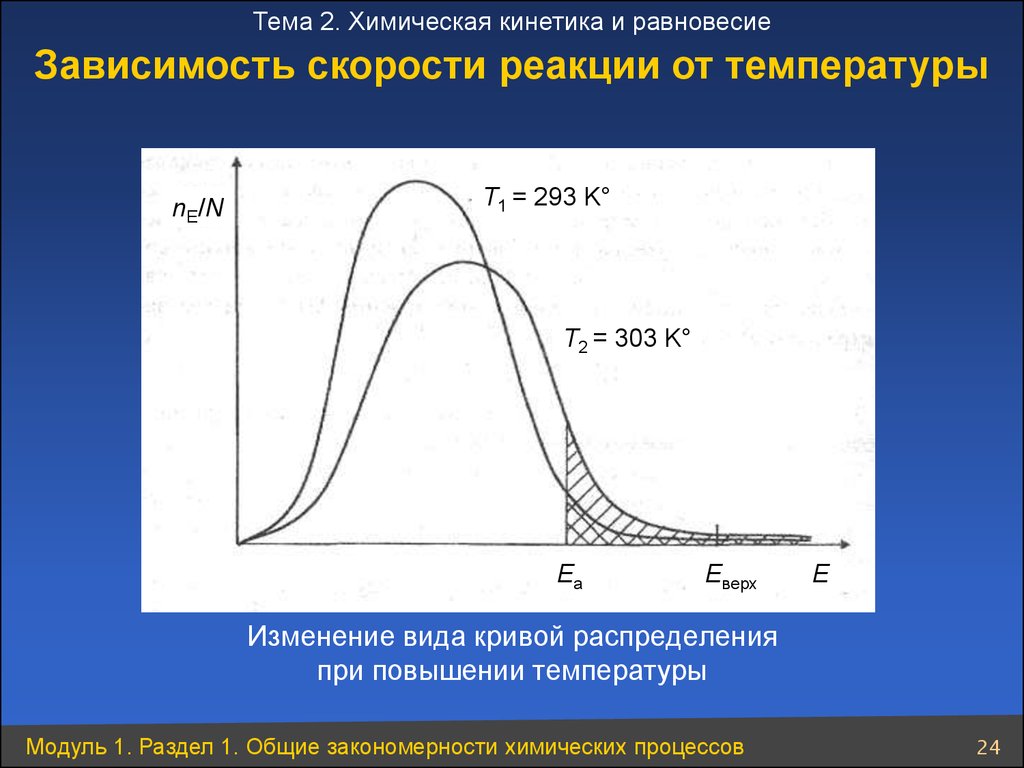
Тема 2. Химическая кинетика и равновесиеЗависимость скорости реакции от температуры
nE/N
T1 = 293 K°
T2 = 303 K°
Ea
Eверх
E
Изменение вида кривой распределения
при повышении температуры
Модуль 1. Раздел 1. Общие закономерности химических процессов
24
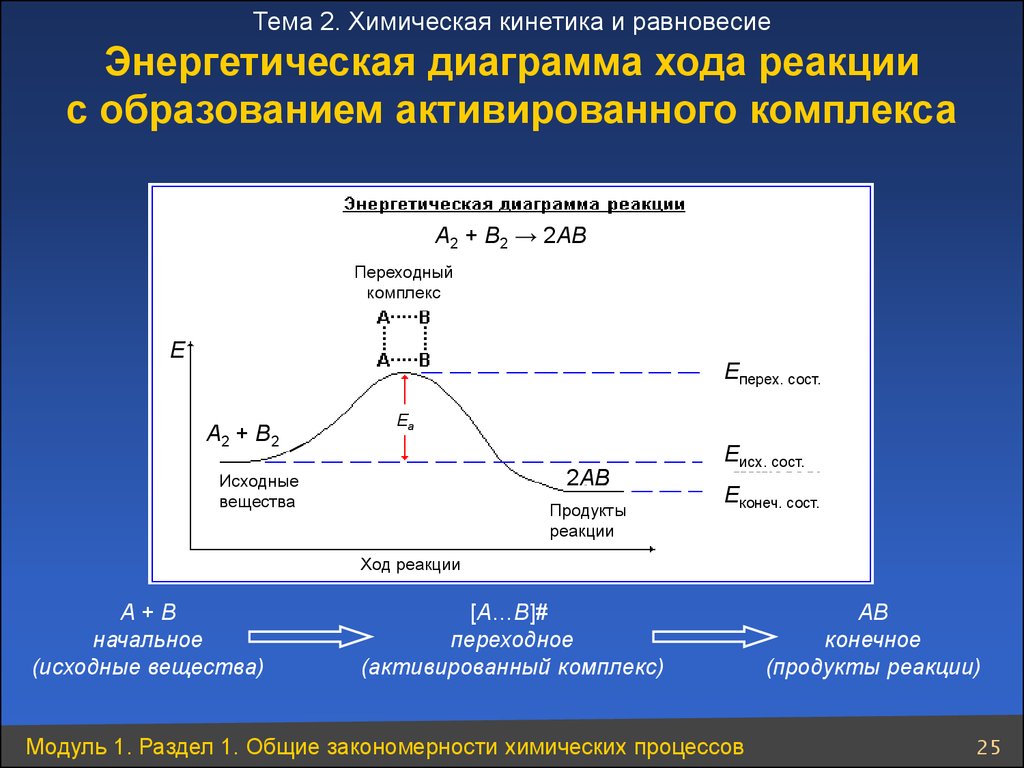
25.
Тема 2. Химическая кинетика и равновесиеЭнергетическая диаграмма хода реакции
с образованием активированного комплекса
A2 + B2 → 2AB
Переходный
комплекс
E
Еперех. сост.
A2 + B2
Ea
2AB
Исходные
вещества
Продукты
реакции
Еисх. сост.
Еконеч. сост.
Ход реакции
А+В
начальное
(исходные вещества)
[А…В]#
переходное
(активированный комплекс)
Модуль 1. Раздел 1. Общие закономерности химических процессов
АВ
конечное
(продукты реакции)
25
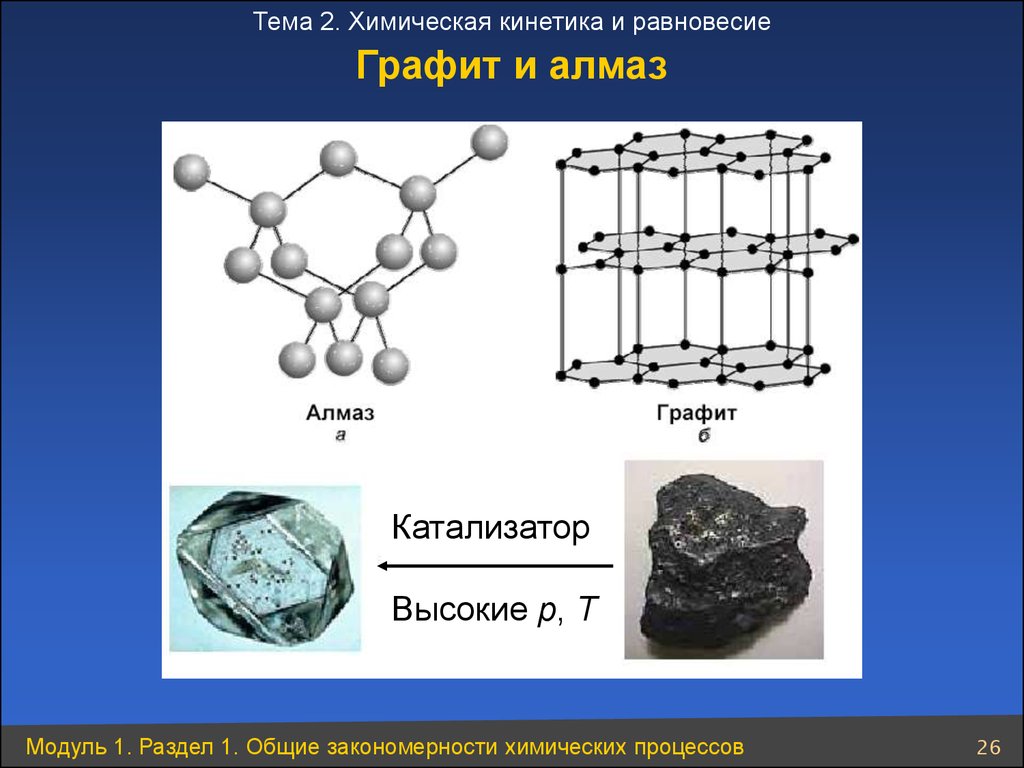
26.
Тема 2. Химическая кинетика и равновесиеГрафит и алмаз
Катализатор
Высокие p, T
Модуль 1. Раздел 1. Общие закономерности химических процессов
26
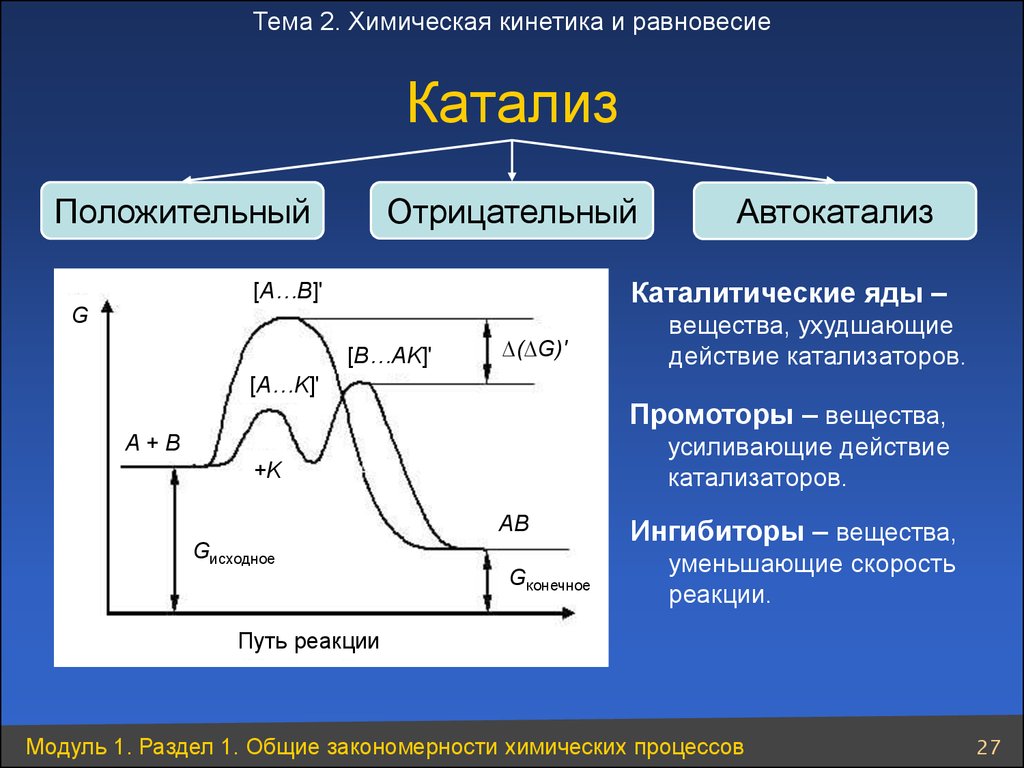
27. Катализ
Тема 2. Химическая кинетика и равновесиеКатализ
Отрицательный
Положительный
Автокатализ
Каталитические яды –
[A…B]'
G
[B…AK]'
∆(∆G)'
вещества, ухудшающие
действие катализаторов.
[A…K]'
Промоторы – вещества,
усиливающие действие
катализаторов.
A+B
+K
AB
Gисходное
Gконечное
Ингибиторы – вещества,
уменьшающие скорость
реакции.
Путь реакции
Модуль 1. Раздел 1. Общие закономерности химических процессов
27
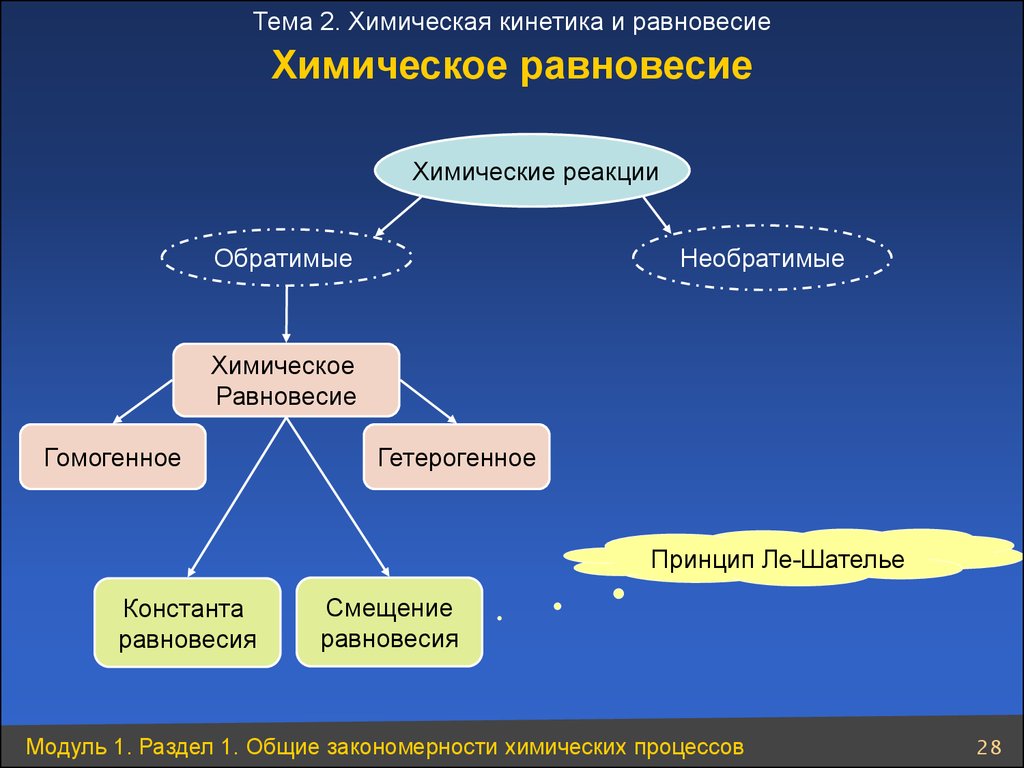
28.
Тема 2. Химическая кинетика и равновесиеХимическое равновесие
Химические реакции
Обратимые
Необратимые
Химическое
Равновесие
Гомогенное
Гетерогенное
Принцип Ле-Шателье
Константа
равновесия
Смещение
равновесия
Модуль 1. Раздел 1. Общие закономерности химических процессов
28
29.
Тема 2. Химическая кинетика и равновесиеХимическое равновесие в гомогенных системах
2NO2 N2O4
V1 V2
k СNO2 k N2O4
2
Кр
∆G0 = RT lnKp
KP
Модуль 1. Раздел 1. Общие закономерности химических процессов
k
k
N 2O 4
NO2 2
29
30.
Тема 2. Химическая кинетика и равновесиеСмещение химического равновесия
Принцип Ле-Шателье:
если находящаяся
в химическом равновесии
система подвергается
внешнему воздействию,
то в ней возникают процессы,
стремящиеся ослабить это
воздействие.
Анри-Луи Ле-Шателье
(1850–1936 )
Модуль 1. Раздел 1. Общие закономерности химических процессов
30
31.
Тема 2. Химическая кинетика и равновесиеФазовая диаграмма воды
Модуль 1. Раздел 1. Общие закономерности химических процессов
31
32. Раздел 2 Строение атома и периодическая система
Общетеоретические основы неорганической химии32
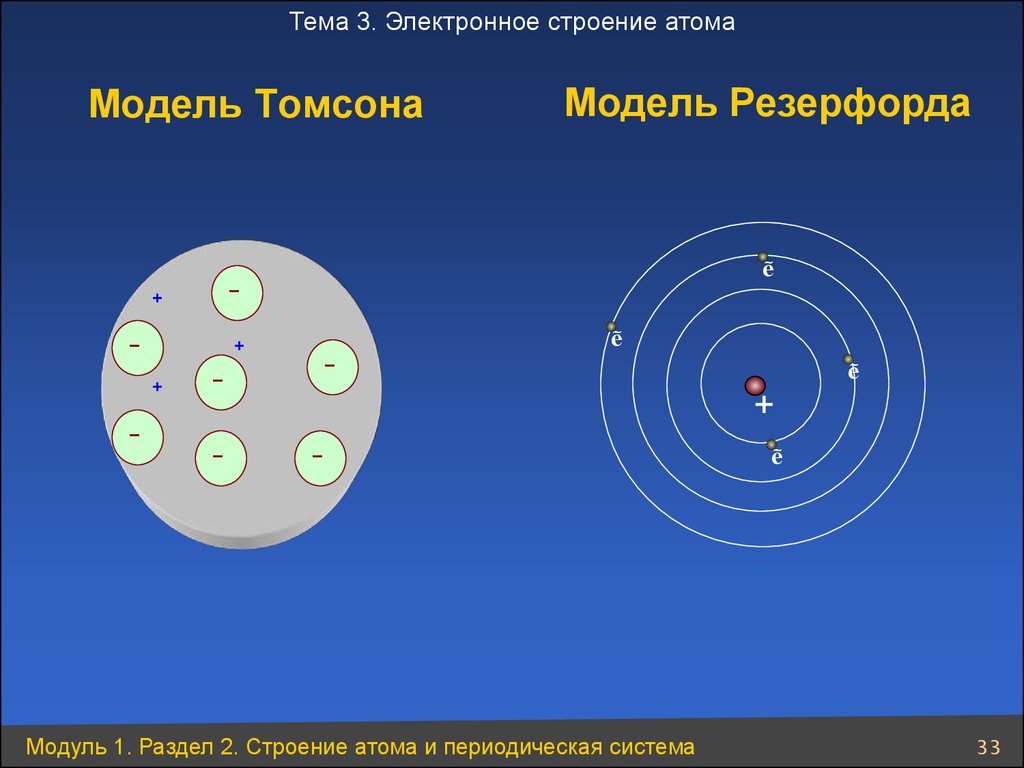
33. Модель Томсона
Тема 3. Электронное строение атомаМодель Томсона
+
–
+
– +
+
+
Модель Резерфорда
ẽ
ẽ
–
–+
+
–
–
ẽ
–
Модуль 1. Раздел 2. Строение атома и периодическая система
ẽ
33
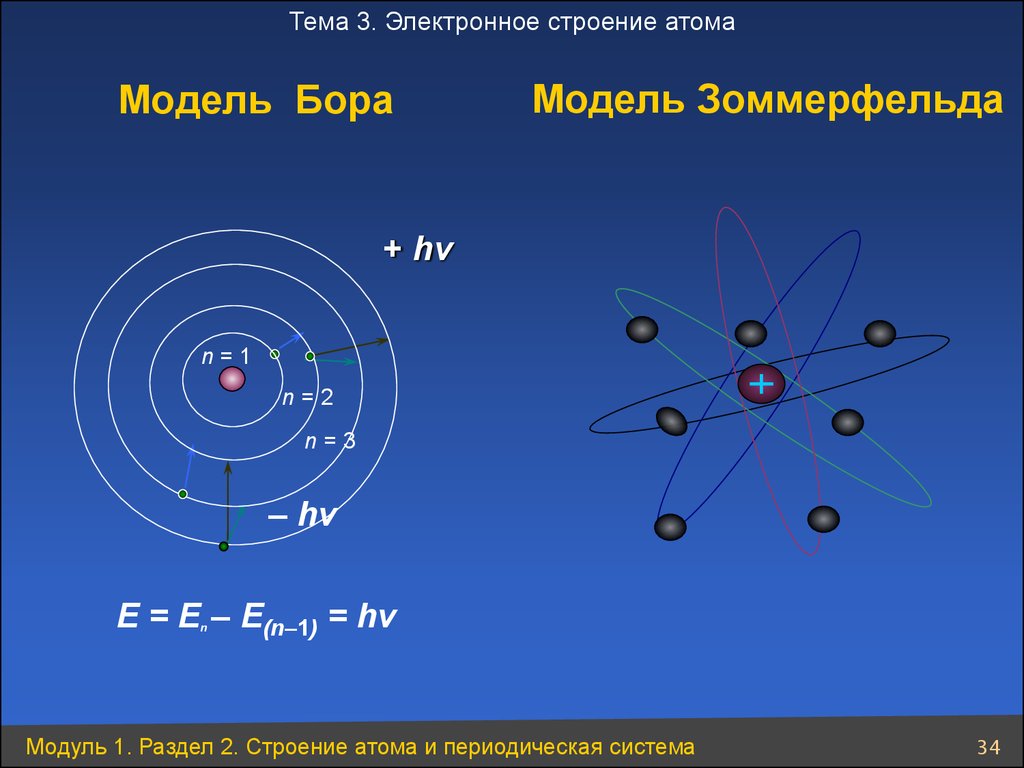
34. Модель Бора
Тема 3. Электронное строение атомаМодель Бора
Модель Зоммерфельда
+ hv
n=1
n=2
n=3
– hv
E = E – E(n–1) = hv
n
Модуль 1. Раздел 2. Строение атома и периодическая система
34
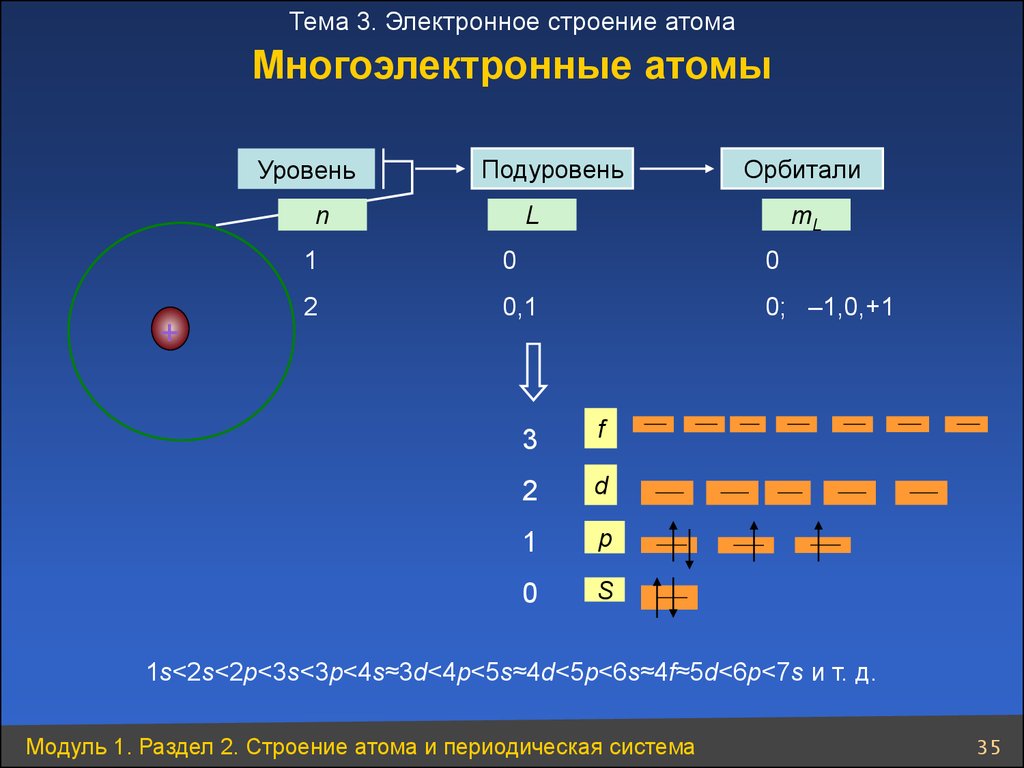
35.
Тема 3. Электронное строение атомаМногоэлектронные атомы
Уровень
Подуровень
n
+
Орбитали
L
mL
1
0
0
2
0,1
0; –1,0,+1
3
f
2
d
1
p
0
S
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s и т. д.
Модуль 1. Раздел 2. Строение атома и периодическая система
35
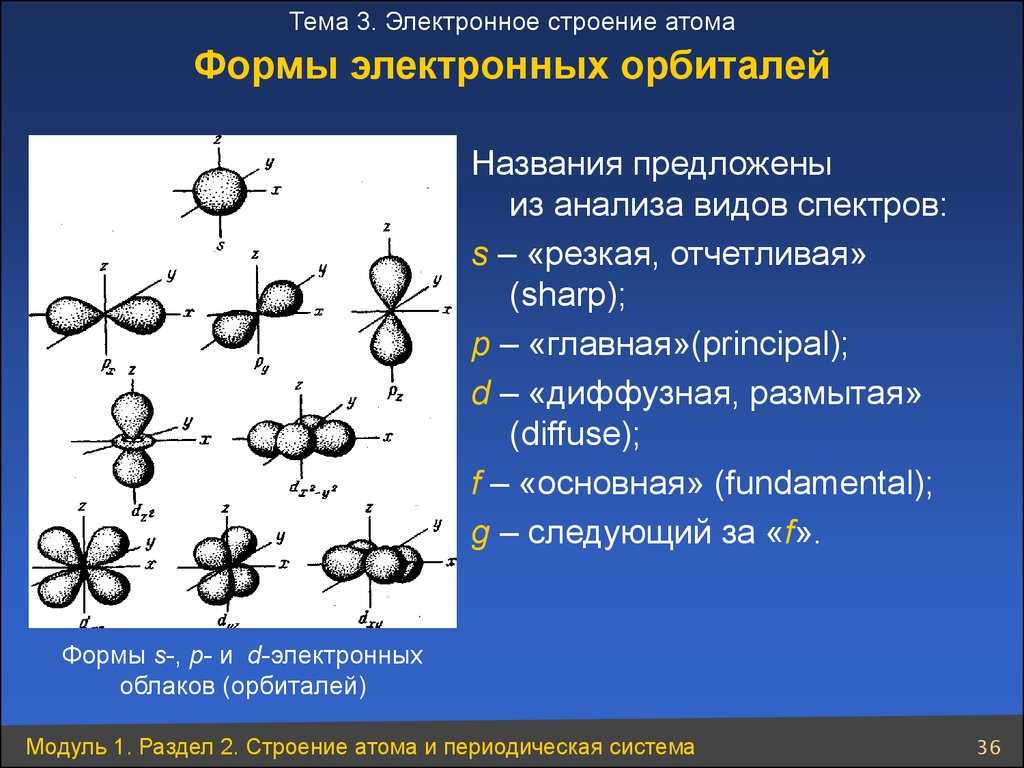
36.
Тема 3. Электронное строение атомаФормы электронных орбиталей
Названия предложены
из анализа видов спектров:
s – «резкая, отчетливая»
(sharp);
p – «главная»(principal);
d – «диффузная, размытая»
(diffuse);
f – «основная» (fundamental);
g – следующий за «f».
Формы s-, р- и d-электронных
облаков (орбиталей)
Модуль 1. Раздел 2. Строение атома и периодическая система
36
37.
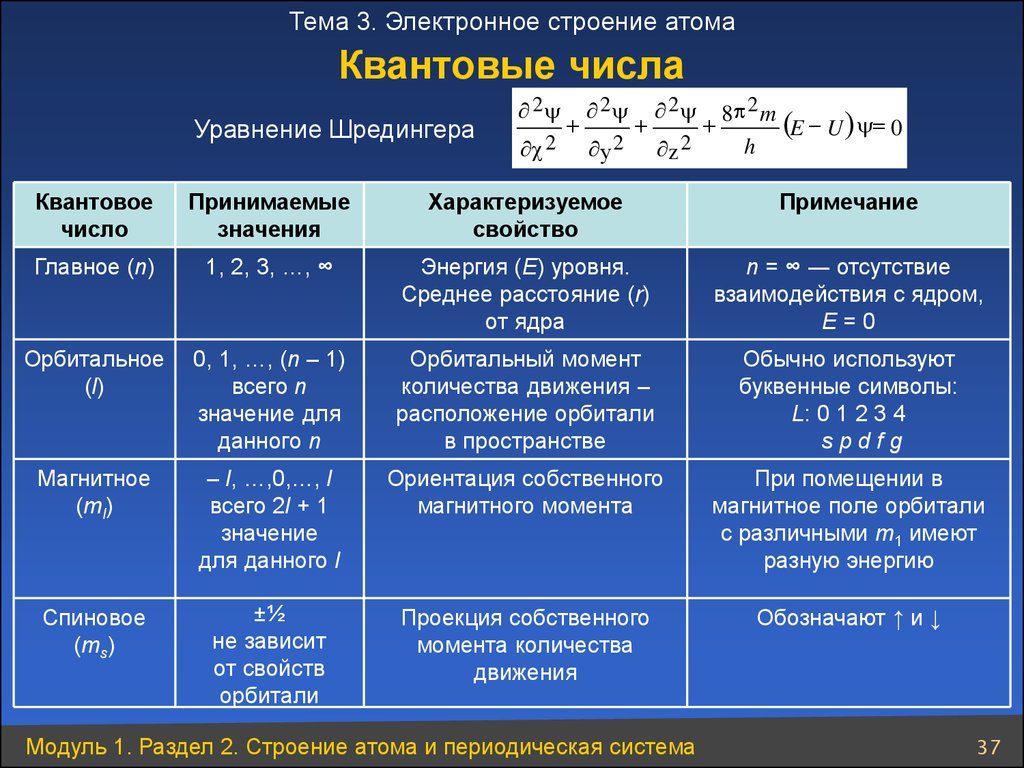
Тема 3. Электронное строение атомаКвантовые числа
Уравнение Шредингера
2y
2y
2y
8p 2 m
+
+
+
(E U ) y 0
2
2
2
h
c
у
z
Квантовое
число
Принимаемые
значения
Характеризуемое
свойство
Примечание
Главное (n)
1, 2, 3, …, ∞
Энергия (Е) уровня.
Среднее расстояние (r)
от ядра
n = ∞ ― отсутствие
взаимодействия с ядром,
Е=0
Орбитальное
(l)
0, 1, …, (n – 1)
всего n
значение для
данного n
Орбитальный момент
количества движения –
расположение орбитали
в пространстве
Обычно используют
буквенные символы:
L: 0 1 2 3 4
spdfg
Магнитное
(ml)
– l, …,0,…, l
всего 2l + 1
значение
для данного l
Ориентация собственного
магнитного момента
При помещении в
магнитное поле орбитали
с различными m1 имеют
разную энергию
Спиновое
(ms)
±½
не зависит
от свойств
орбитали
Проекция собственного
момента количества
движения
Обозначают ↑ и ↓
Модуль 1. Раздел 2. Строение атома и периодическая система
37
38.
Тема 3. Электронное строение атомаЭнергетические уровни
водородоподобного атома
Модуль 1. Раздел 2. Строение атома и периодическая система
38
39.
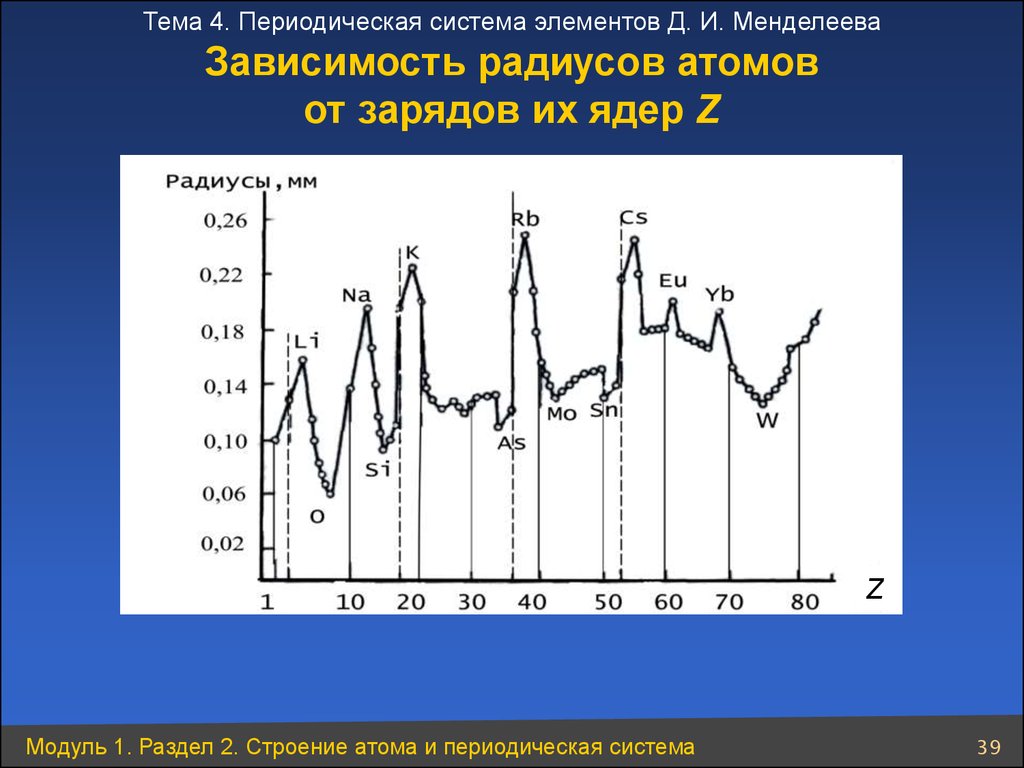
Тема 4. Периодическая система элементов Д. И. МенделееваЗависимость радиусов атомов
от зарядов их ядер Z
Z
Модуль 1. Раздел 2. Строение атома и периодическая система
39
40.
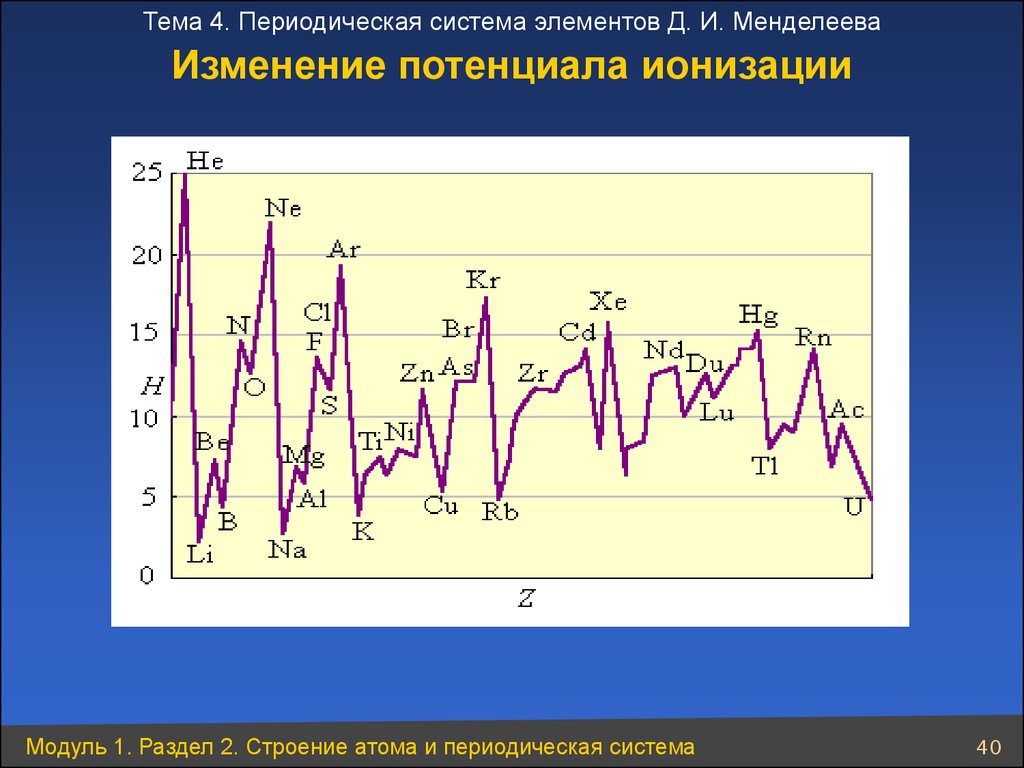
Тема 4. Периодическая система элементов Д. И. МенделееваИзменение потенциала ионизации
Модуль 1. Раздел 2. Строение атома и периодическая система
40
41.
Тема 4. Периодическая система элементов Д. И. МенделееваЭлектроотрицательность элементов
Модуль 1. Раздел 2. Строение атома и периодическая система
41
42.
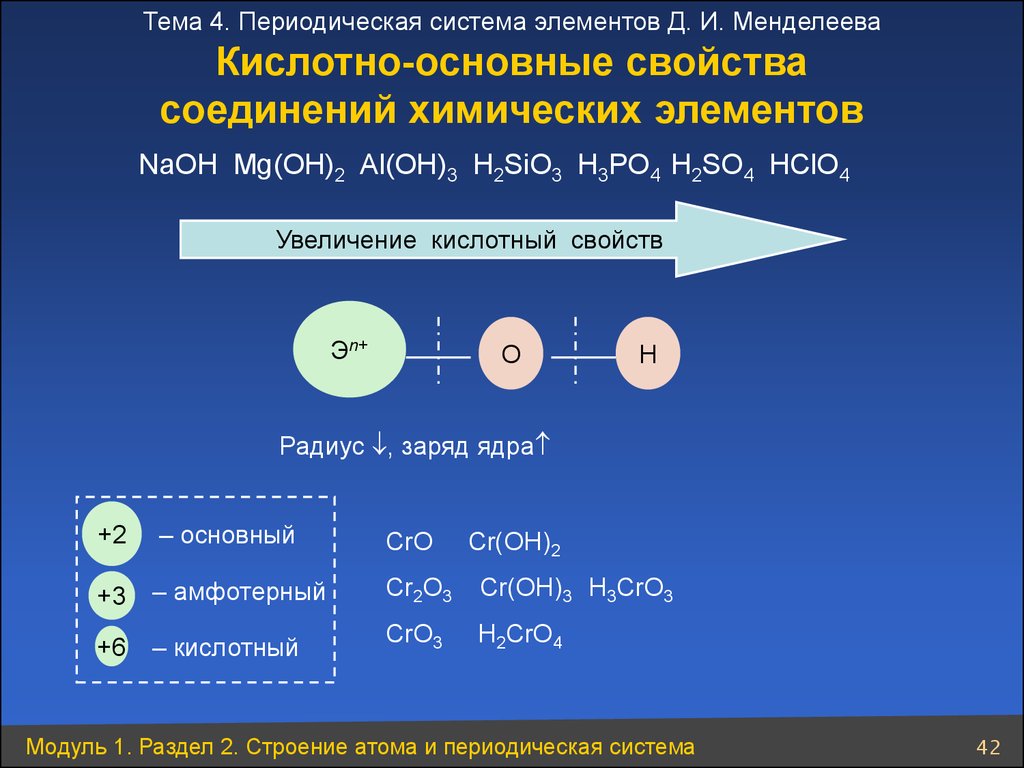
Тема 4. Периодическая система элементов Д. И. МенделееваКислотно-основные свойства
соединений химических элементов
NaOН Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HСlO4
Увеличение кислотный свойств
Эn+
О
Н
Радиус , заряд ядра
+2
– основный
CrO
Cr(OH)2
+3 – амфотерный
Cr2O3
Cr(OH)3 H3CrO3
+6 – кислотный
CrO3
H2CrO4
Модуль 1. Раздел 2. Строение атома и периодическая система
42
43.
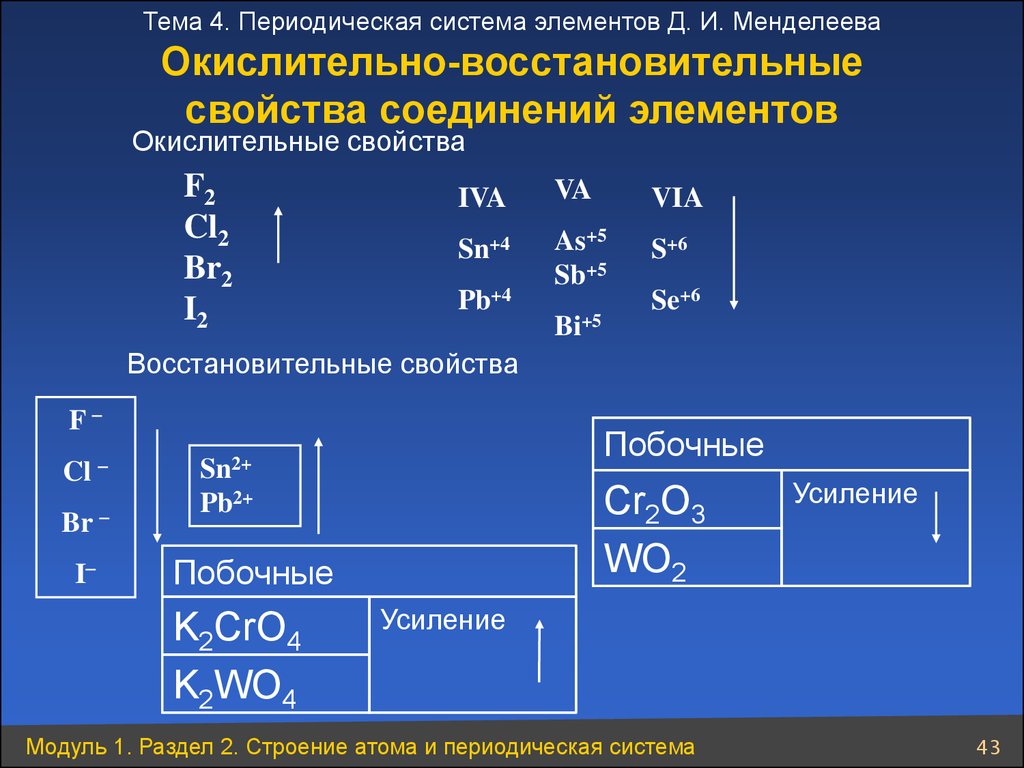
Тема 4. Периодическая система элементов Д. И. МенделееваОкислительно-восстановительные
свойства соединений элементов
Окислительные свойства
F2
Cl2
Br2
I2
IVA
VA
VIA
Sn+4
As+5
Sb+5
S+6
Pb+4
Bi+5
Se+6
Восстановительные свойства
F
Cl
Br
I
Побочные
Sn2+
Cr2O3
WO2
Pb2+
Побочные
K2CrO4
K2WO4
Усиление
Усиление
Модуль 1. Раздел 2. Строение атома и периодическая система
43
44. Раздел 3 Химическая связь
Общетеоретические основы неорганической химии44
45.
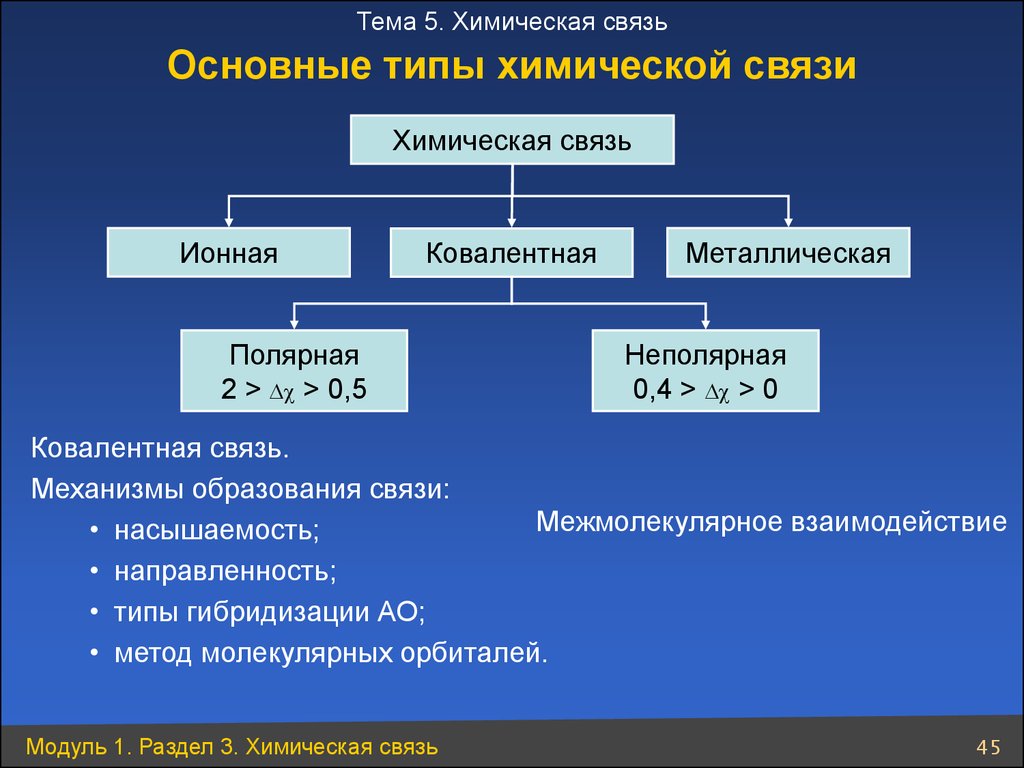
Тема 5. Химическая связьОсновные типы химической связи
Химическая связь
Ионная
Ковалентная
Полярная
2 > c > 0,5
Металлическая
Неполярная
0,4 > c > 0
Ковалентная связь.
Механизмы образования связи:
Межмолекулярное взаимодействие
• насышаемость;
• направленность;
• типы гибридизации АО;
• метод молекулярных орбиталей.
Модуль 1. Раздел 3. Химическая связь
45
46.
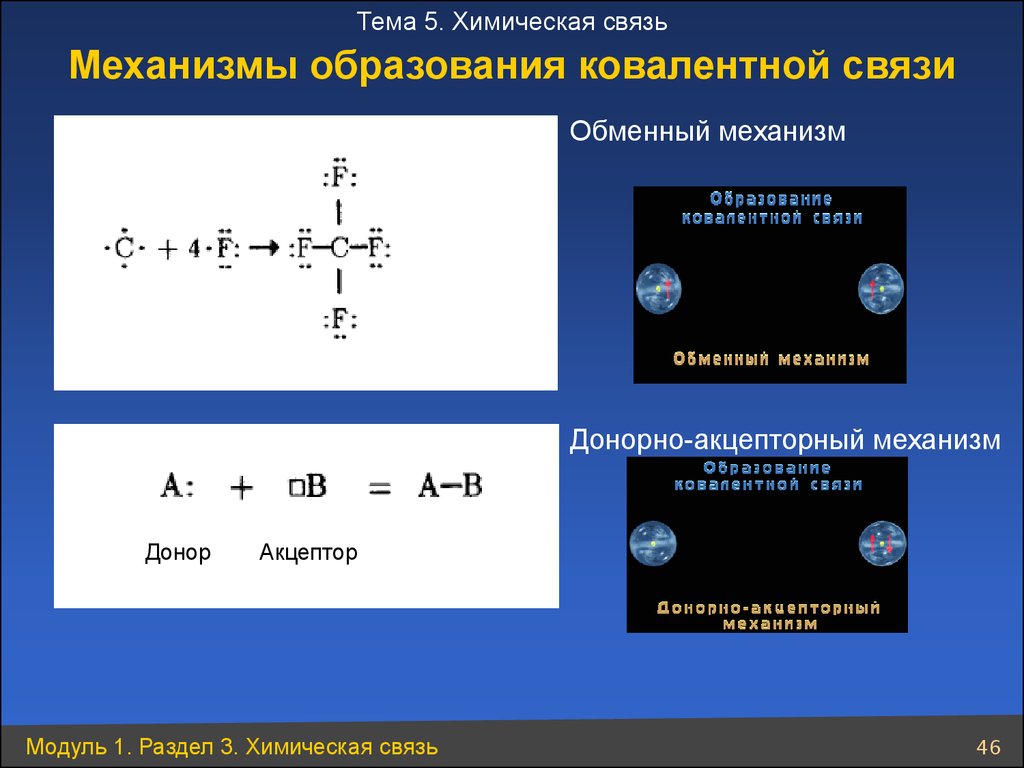
Тема 5. Химическая связьМеханизмы образования ковалентной связи
Обменный механизм
Донорно-акцепторный механизм
Донор
Акцептор
Модуль 1. Раздел 3. Химическая связь
46
47.
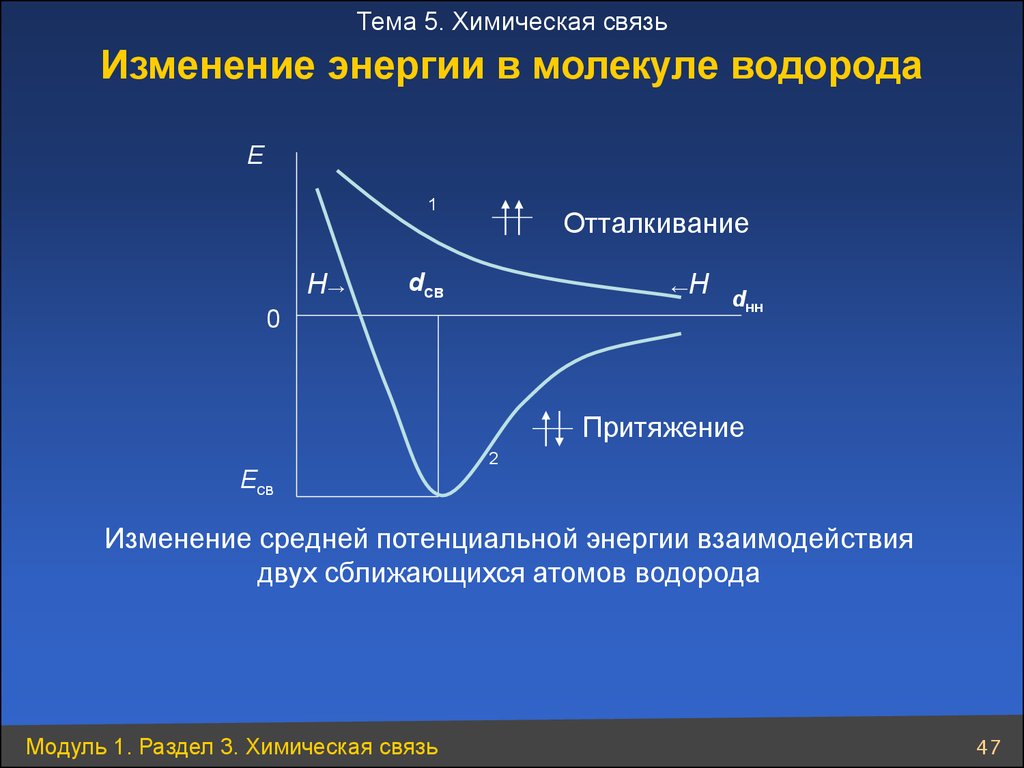
Тема 5. Химическая связьИзменение энергии в молекуле водорода
Е
1
Н→
Отталкивание
Н
dсв
←
0
dнн
Притяжение
Есв
2
Изменение средней потенциальной энергии взаимодействия
двух сближающихся атомов водорода
Модуль 1. Раздел 3. Химическая связь
47
48.
Тема 5. Химическая связьНасыщаемость ковалентной связи
О
F
N
2p
2p3
2s
2s2
В
В
2s
2p
2p
2р4
2s
2s2
: О : +2 H H O H
H
: N +3H H :N H
Модуль 1. Раздел 3. Химическая связь
48
49.
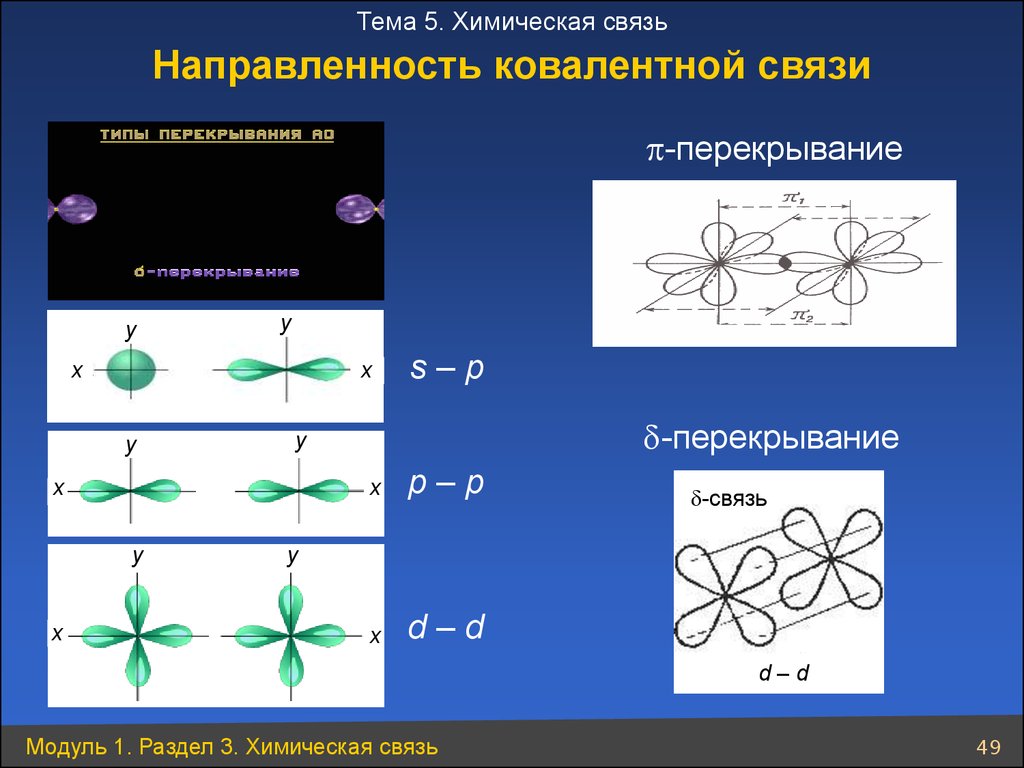
Тема 5. Химическая связьНаправленность ковалентной связи
p-перекрывание
y
y
x
x
y
x
-перекрывание
y
x
y
s–p
x
p–p
x
d–d
-связь
y
d–d
Модуль 1. Раздел 3. Химическая связь
49
50.
Тема 5. Химическая связьТипы гибридизаций АО
SP
Хлорид бериллия
S
P
180º
sp2
120º
Хлорид бора
Модуль 1. Раздел 3. Химическая связь
50
51.
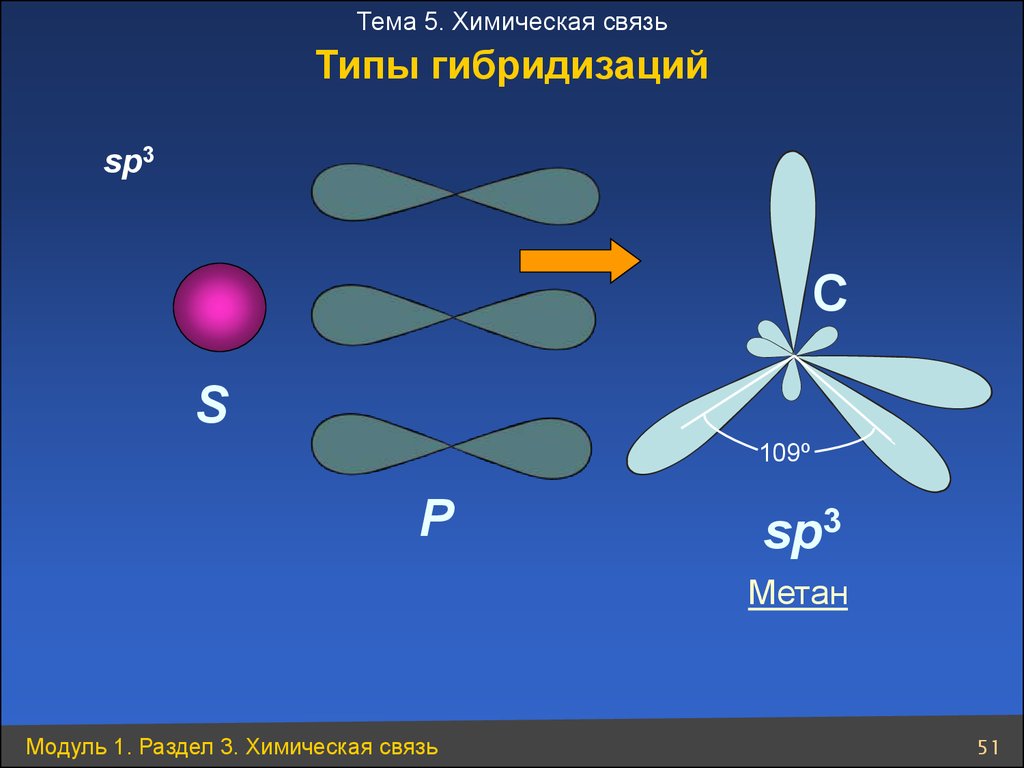
Тема 5. Химическая связьТипы гибридизаций
sp3
C
S
109º
P
sp3
Метан
Модуль 1. Раздел 3. Химическая связь
51
52.
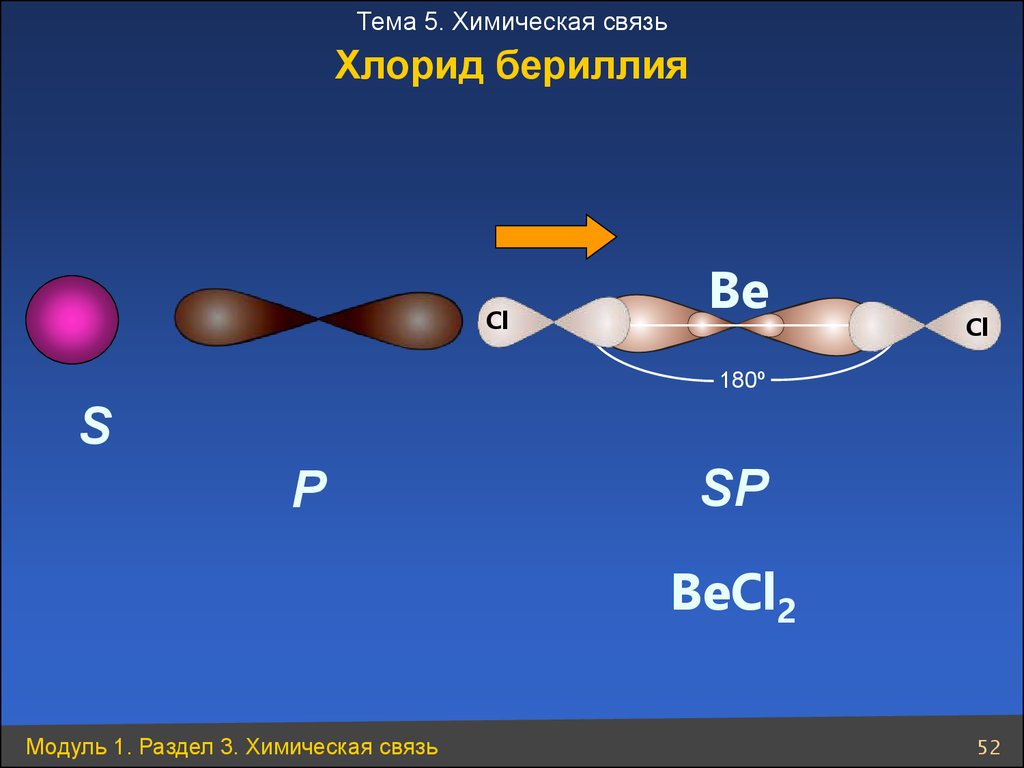
Тема 5. Химическая связьХлорид бериллия
Cl
Be
Cl
180º
S
P
SP
BeCl2
Модуль 1. Раздел 3. Химическая связь
52
53.
Тема 5. Химическая связьХлорид бора
Cl
В
S
120º
Cl
Cl
P
Модуль 1. Раздел 3. Химическая связь
ВCl3
53
54.
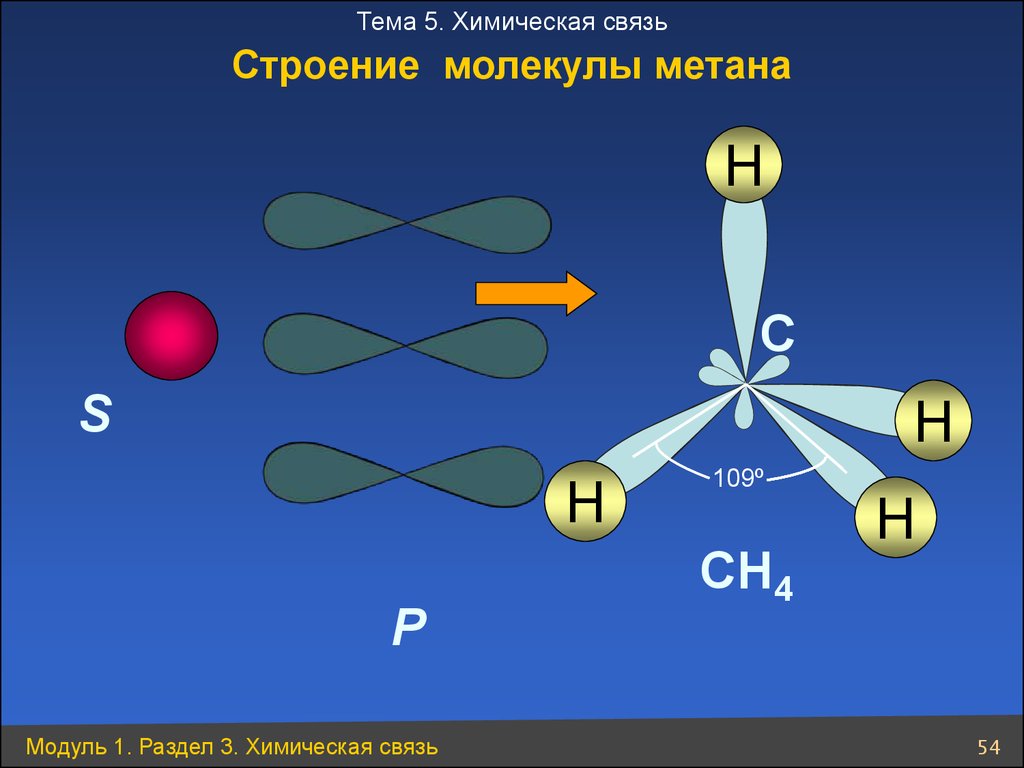
Тема 5. Химическая связьСтроение молекулы метана
H
C
S
H
H
P
Модуль 1. Раздел 3. Химическая связь
109º
H
CH4
54
55.
Тема 5. Химическая связьПримеры молекул
y
y
x
x
НСl
СН4
Модуль 1. Раздел 3. Химическая связь
NН3
Н2О
55
56.
Тема 5. Химическая связьМетод молекулярных орбиталей
Модуль 1. Раздел 3. Химическая связь
56
57.
Тема 5. Химическая связьДвухатомные гомоядерные молекулы
1-го периода
Е
МО
σ (1s1–1s2)
1s1
1s2
σcв (1s1+1s2)
Не2
n=0
Модуль 1. Раздел 3. Химическая связь
Е
МО
σ (1s1–1s2)
1s1
1s2
σcв (1s1+1s2)
Не2+
2 1
n
0.5
2
57
58.
Тема 5. Химическая связьМолекула кислорода ММО
Модуль 1. Раздел 3. Химическая связь
58
59.
Тема 5. Химическая связьИонная связь
Модуль 1. Раздел 3. Химическая связь
59
60.
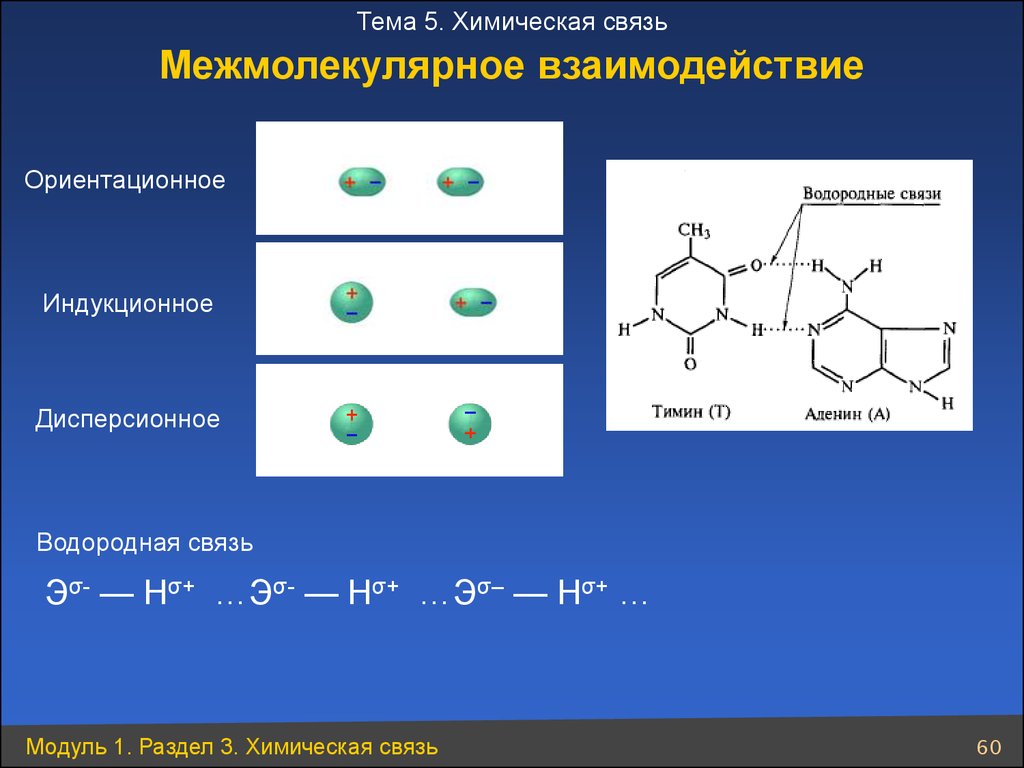
Тема 5. Химическая связьМежмолекулярное взаимодействие
Ориентационное
Индукционное
Дисперсионное
Водородная связь
Эσ- — Нσ+ …Эσ- — Нσ+ …Эσ– — Нσ+ …
Модуль 1. Раздел 3. Химическая связь
60
61. Раздел 4 Растворы и дисперсные системы
Общетеоретические основы неорганической химии61
62.
Тема 6. Общие свойства растворовДисперсные системы
Дисперсные системы
Грубодисперсные
d>10–3 см
Высокодисперсные
10–7<d<10–8 см
Коллоидные
10–7<d<10–8 см
Модуль 1. Раздел 4. Растворы и дисперсные системы
Истинные
d<10–8 см
62
63.
Тема 6. Общие свойства растворовКривые растворимости
г вещества/100 г Н
2О
120
NH4HCO3
NaNO3
100
80
KNO3
NH4Cl
60
NaCI
40
NaHCO3
20
0
0
20
40
60
80
100
t, °C
Модуль 1. Раздел 4. Растворы и дисперсные системы
63
64.
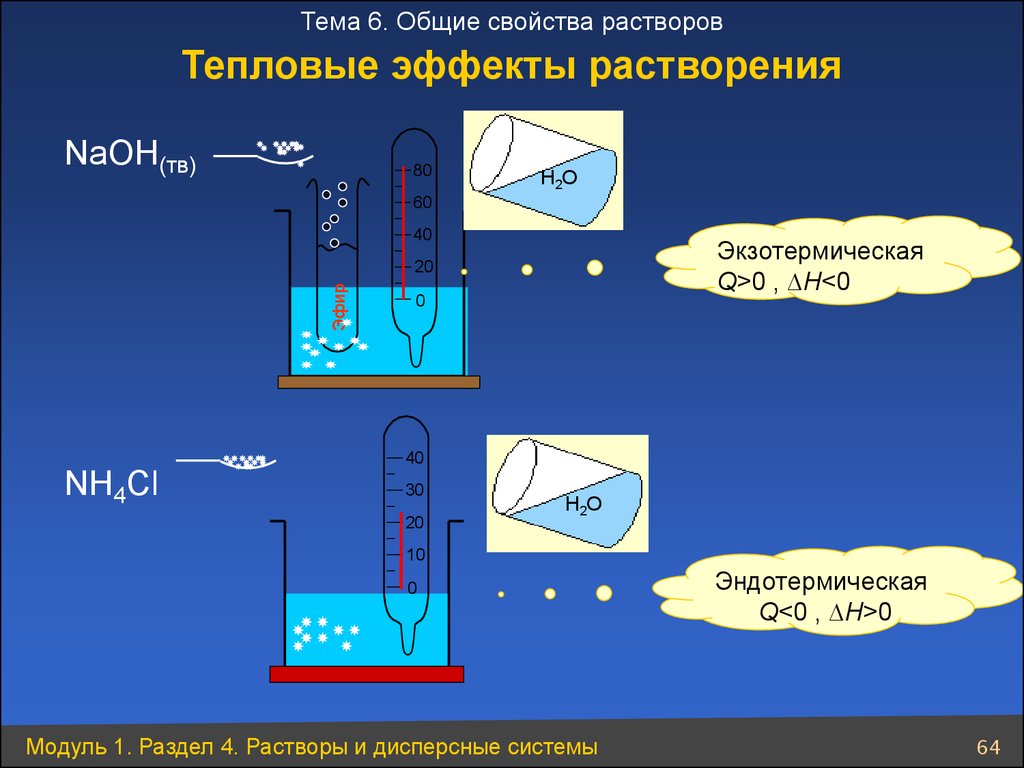
Тема 6. Общие свойства растворовТепловые эффекты растворения
NaOH(тв)
80
Н2О
60
40
Экзотермическая
Q>0 , ∆H<0
Эфир
20
0
40
NH4Cl
30
20
Н2О
10
0
Модуль 1. Раздел 4. Растворы и дисперсные системы
Эндотермическая
Q<0 , ∆H>0
64
65.
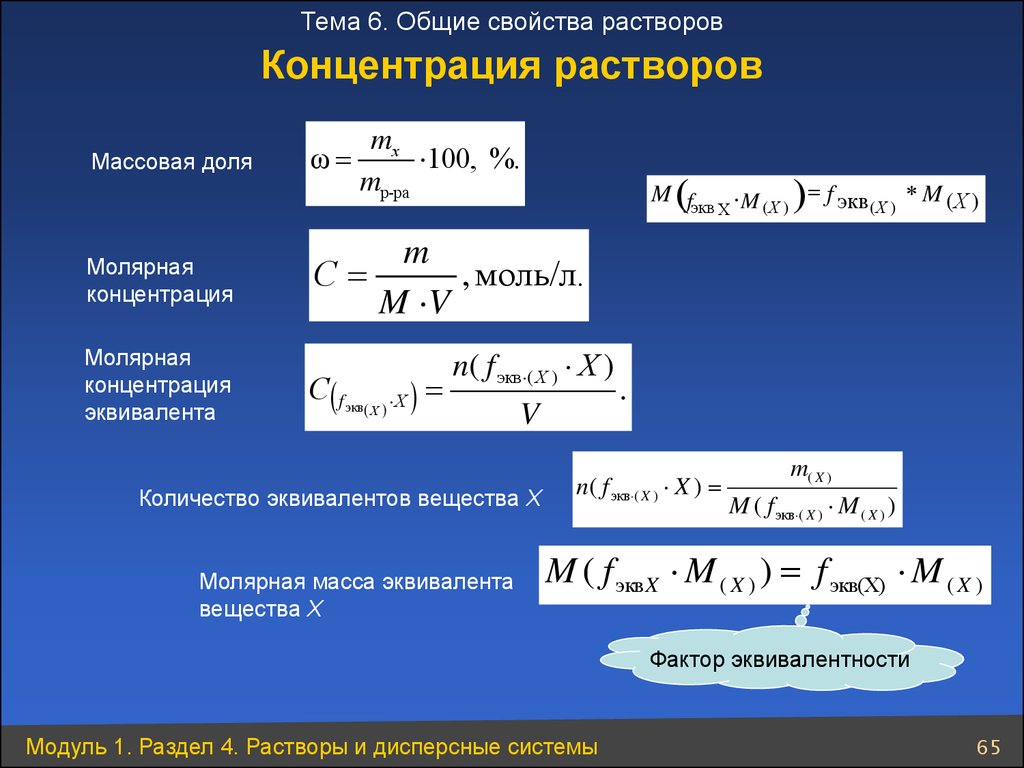
Тема 6. Общие свойства растворовКонцентрация растворов
mх
100, %.
mр-ра
Массовая доля
ω
Молярная
концентрация
m
С
, моль/л.
M V
Молярная
концентрация
эквивалента
С( f экв( Х ) Х )
M (fэкв M ( Х ) ) f экв ( Х ) M ( Х )
Х
n( f экв ( Х ) Х )
V
Количество эквивалентов вещества Х
Молярная масса эквивалента
вещества Х
.
n( f экв ( X ) X )
m( X )
M ( f экв ( X ) M ( X ) )
M ( f эквX M ( X ) ) f экв(X) M ( X )
Фактор эквивалентности
Модуль 1. Раздел 4. Растворы и дисперсные системы
65
66.
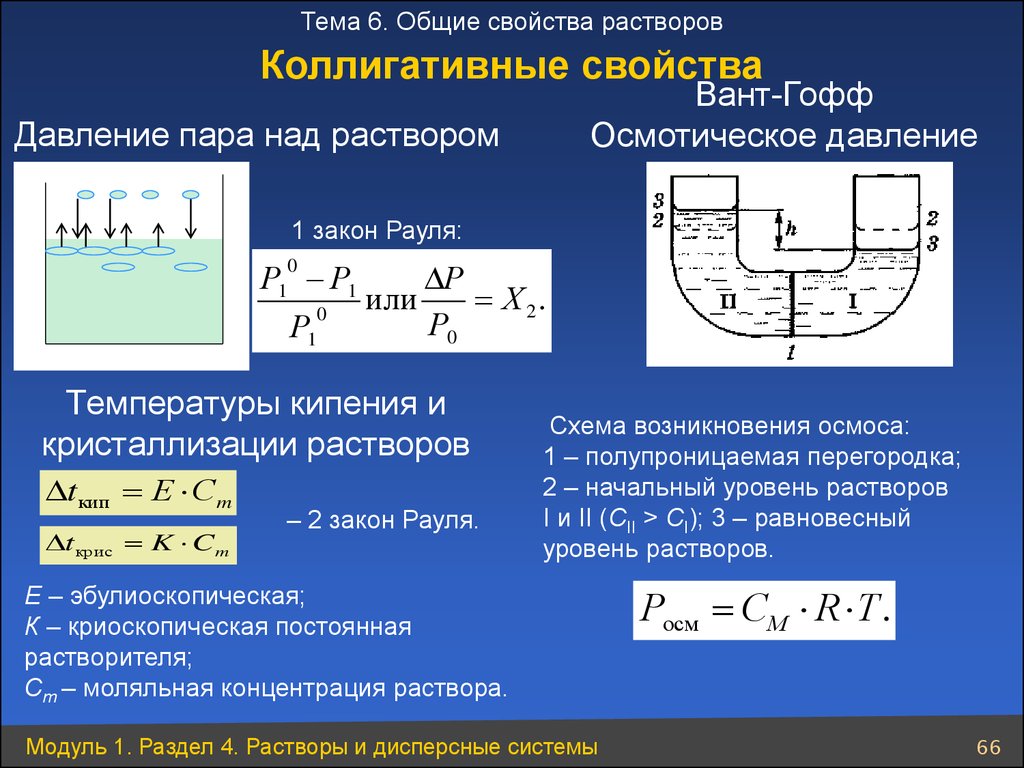
Тема 6. Общие свойства растворовКоллигативные свойства
Вант-Гофф
Осмотическое давление
Давление пара над раствором
1 закон Рауля:
Р1 Р1
Р
или
Х 2.
0
Р0
Р1
0
Температуры кипения и
кристаллизации растворов
tкип Е Сm
tкрис K Cm
– 2 закон Рауля.
Схема возникновения осмоса:
1 – полупроницаемая перегородка;
2 – начальный уровень растворов
I и II (СII > CI); 3 – равновесный
уровень растворов.
Е – эбулиоскопическая;
К – криоскопическая постоянная
растворителя;
Cm – моляльная концентрация раствора.
Модуль 1. Раздел 4. Растворы и дисперсные системы
Росм СМ R T .
66
67.
Тема 7. Ионные равновесия в растворах электролитовЭлектролиты
А
+
+
+
+
Катион
Анион
-
+
-
+
-
+
_
_
_
_
К
Это растворы:
• щелочей;
• солей;
• неорганических кислот
в воде;
• растворы ряда солей
в органических
растворителях.
Модуль 1. Раздел 4. Растворы и дисперсные системы
67
68.
Тема 7. Ионные равновесия в растворах электролитовТеория электролитической диссоциации
Диссоциация солей с ионной связью:
средней KCl K+ + Cl ;
кислой
KHSO3 K+ + HSO3 ;
основной CuOHNO3 CuOH+ + NO3 .
Диссоциация полярных молекул:
HCl H+ + Cl .
Слабый электролит:
Этапы электролитической диссоциации
полярных молекул (а)
и ионных кристаллов (б):
I – сольватация; II – ионизация;
III – диссоциация.
СH3CОOН H+ + СH3CОО .
Модуль 1. Раздел 4. Растворы и дисперсные системы
68
69.
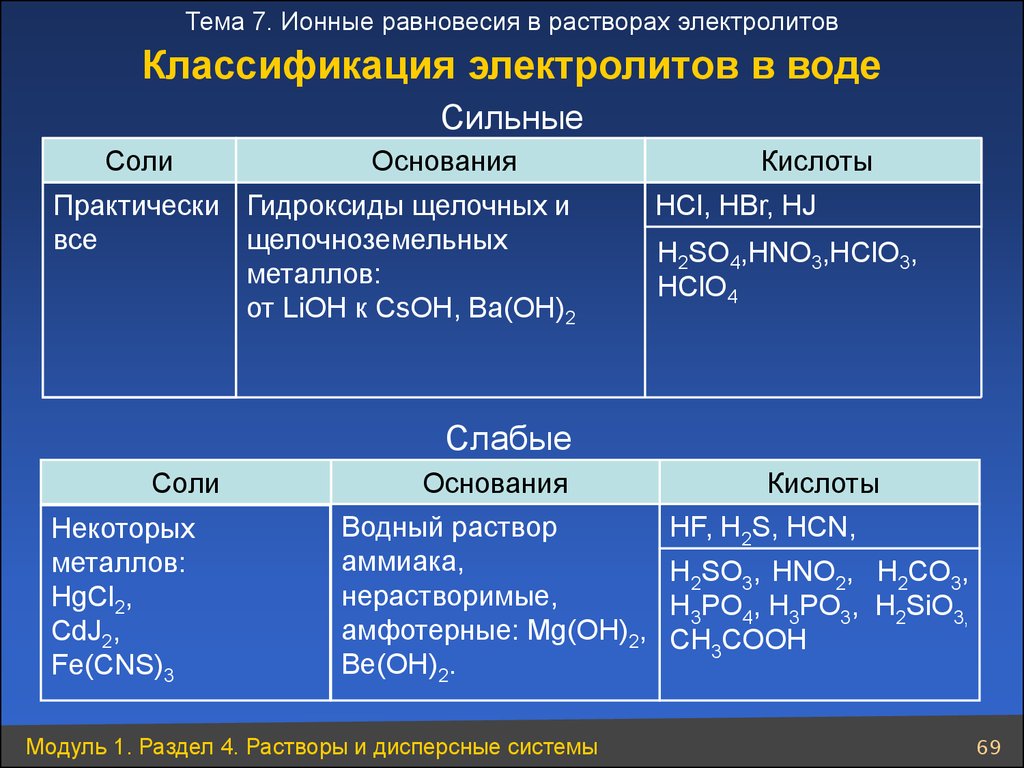
Тема 7. Ионные равновесия в растворах электролитовКлассификация электролитов в воде
Cильные
Соли
Основания
Практически Гидроксиды щелочных и
щелочноземельных
все
металлов:
от LiОН к CsОН, Ba(ОН)2
Кислоты
HCl, HBr, HJ
H2SO4,HNO3,HClО3,
НClO4
Слабые
Соли
Некоторых
металлов:
HgCl2,
CdJ2,
Fe(CNS)3
Основания
Водный раствор
аммиака,
нерастворимые,
амфотерные: Mg(OH)2,
Be(OH)2.
Модуль 1. Раздел 4. Растворы и дисперсные системы
Кислоты
HF, H2S, HCN,
H2SO3, HNO2, H2CO3,
H3PO4, H3PO3, H2SiO3,
CH3COOH
69
70.
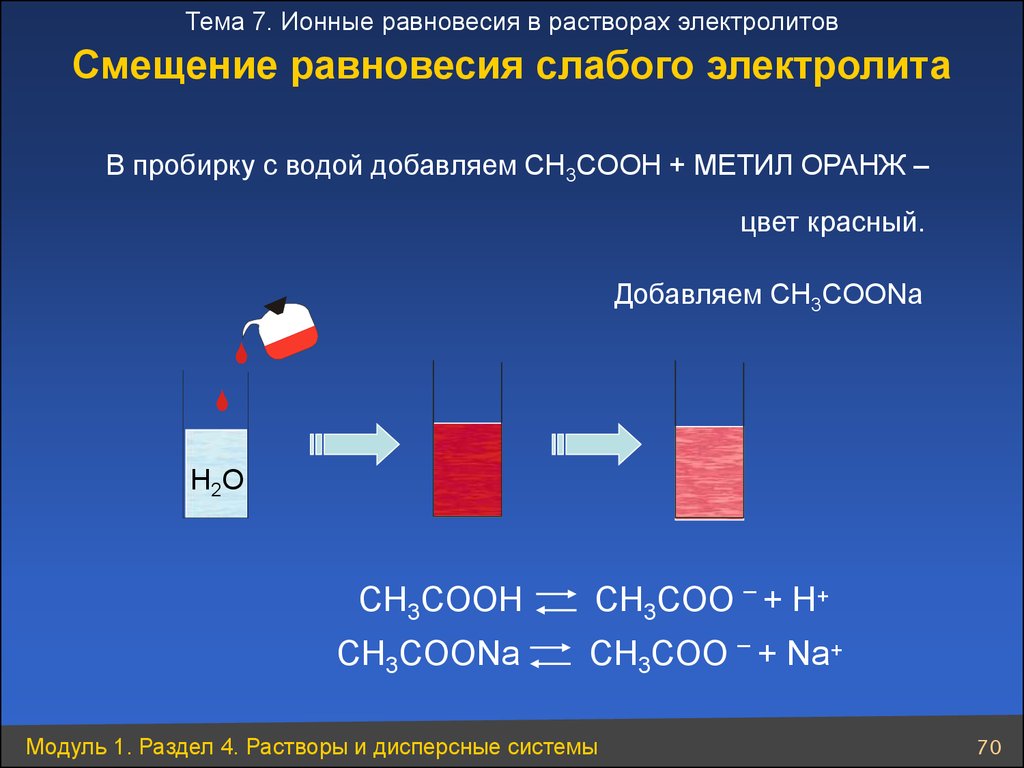
Тема 7. Ионные равновесия в растворах электролитовСмещение равновесия слабого электролита
В пробирку с водой добавляем CH3COOH + МЕТИЛ ОРАНЖ –
цвет красный.
Добавляем CH3COONa
H 2O
CH3COOH
CH3COONa
_
CH3COO + H+
_
CH3COO + Na+
Модуль 1. Раздел 4. Растворы и дисперсные системы
70
71.
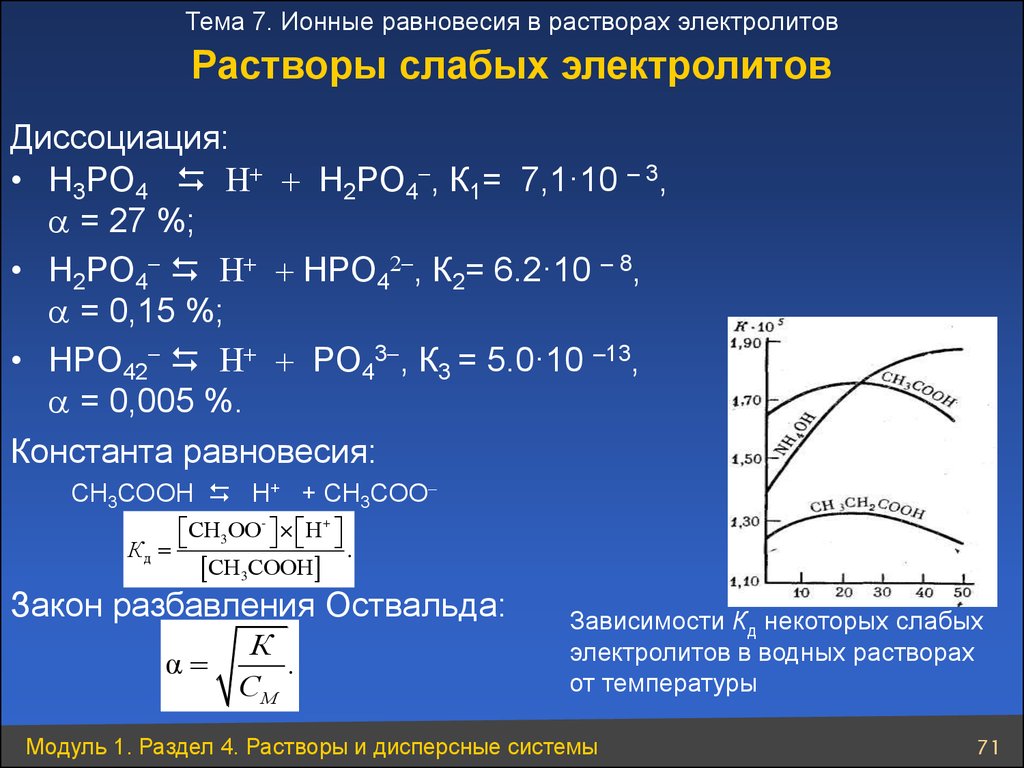
Тема 7. Ионные равновесия в растворах электролитовРастворы слабых электролитов
Диссоциация:
• H3PO4 + + H2PO4 , К1= 7,1·10 – 3,
= 27 %;
• H2PO4 + + HPO4 , К2= 6.2·10 – 8,
= 0,15 %;
• HPO42 + + PO43 , К3 = 5.0·10 –13,
= 0,005 %.
Константа равновесия:
СН3СООН Н+ + СН3СОО
СН 3ОО- × Н +
Кд
.
СН
СООН
3
Закон разбавления Оствальда:
α
К
.
СМ
Зависимости Кд некоторых слабых
электролитов в водных растворах
от температуры
Модуль 1. Раздел 4. Растворы и дисперсные системы
71
72.
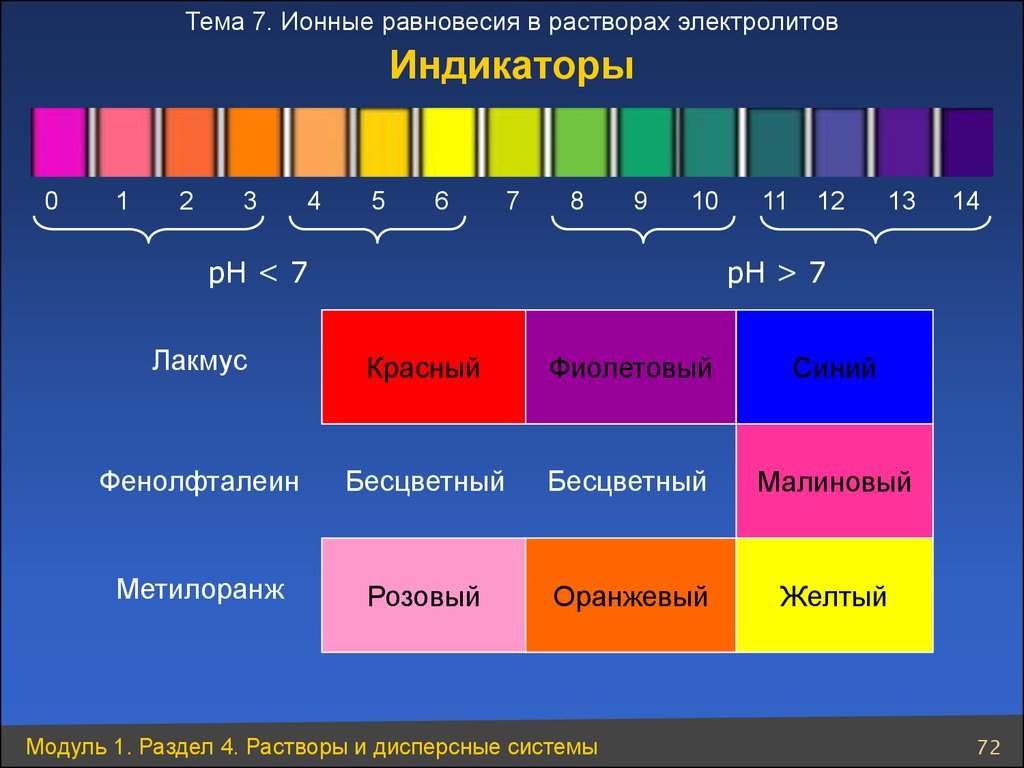
Тема 7. Ионные равновесия в растворах электролитовИндикаторы
0
1
2
3
4
5
6
7
8
9
10
рН < 7
11
12
13
14
рН > 7
Лакмус
Красный
Фиолетовый
Синий
Фенолфталеин
Бесцветный
Бесцветный
Малиновый
Метилоранж
Розовый
Оранжевый
Желтый
Модуль 1. Раздел 4. Растворы и дисперсные системы
72
73.
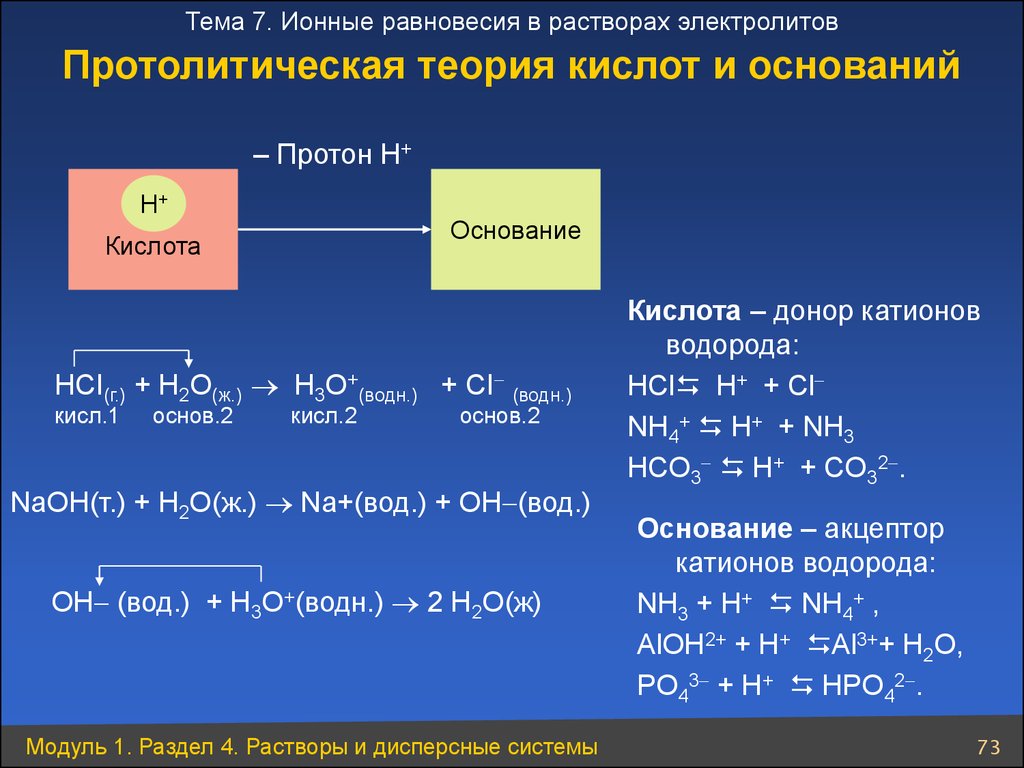
Тема 7. Ионные равновесия в растворах электролитовПротолитическая теория кислот и оснований
– Протон Н+
Н+
Основание
Кислота
НСI(г.) + H2О(ж.) H3О+(водн.) + СI (водн.)
кисл.1
основ.2
кисл.2
основ.2
NaOH(т.) + H2O(ж.) Na+(вод.) + OH (вод.)
OH (вод.) + H3O+(водн.) 2 H2O(ж)
Модуль 1. Раздел 4. Растворы и дисперсные системы
Кислота – донор катионов
водорода:
НСl H+ + Сl
NH4+ H+ + NH3
НCO3 H+ + CO32 .
Основание – акцептор
катионов водорода:
NH3 + H+ NH4+ ,
АlОН2+ + H+ Аl3++ H2О,
PO43 + H+ НPO42 .
73
74.
Тема 7. Ионные равновесия в растворах электролитовИоннообменные реакции
Необратимые реакции
Образуется осадок (↓)
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
Выделяются
газообразные вещества
Na2S+ 2HCl = H2S↑ + 2NaCl
Образуется
слабый электролит
2CH3COOK + H2SO4 = 2CH3COOH + K2SO4
Образуются
комплексные соединения
Hg(NO3)2 + 4KJ = K2[HgJ4] +2KNO3
Модуль 1. Раздел 4. Растворы и дисперсные системы
74
75.
Тема 7. Ионные равновесия в растворах электролитовГидролиз солей
Гидролиз солей
По катиону
По аниону
По катиону
и аниону
Модуль 1. Раздел 4. Растворы и дисперсные системы
Совместный
75
76.
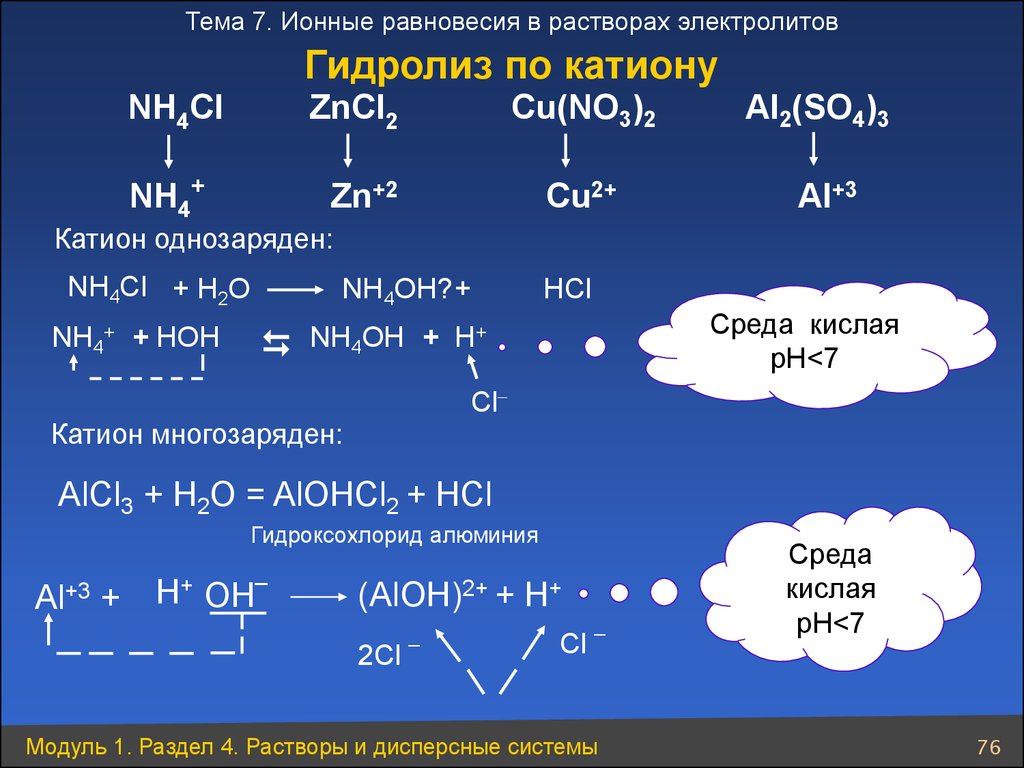
Тема 7. Ионные равновесия в растворах электролитовГидролиз по катиону
NH4Cl
ZnCl2
NH4+
Cu(NO3)2
Zn+2
Cu2+
Al2(SO4)3
Al+3
Катион однозаряден:
NН4Cl + Н2O
NH4OH? +
HCl
Среда кислая
pH<7
+
NH4OH + H
NH4+ + HOH
Cl
Катион многозаряден:
AlCl3 + H2O = AlOHCl2 + HCl
Гидроксохлорид алюминия
Al+3 +
_
H+ OH
(AlOH)2+ + H+
2Cl
_
Cl
_
Модуль 1. Раздел 4. Растворы и дисперсные системы
Среда
кислая
pH<7
76
77.
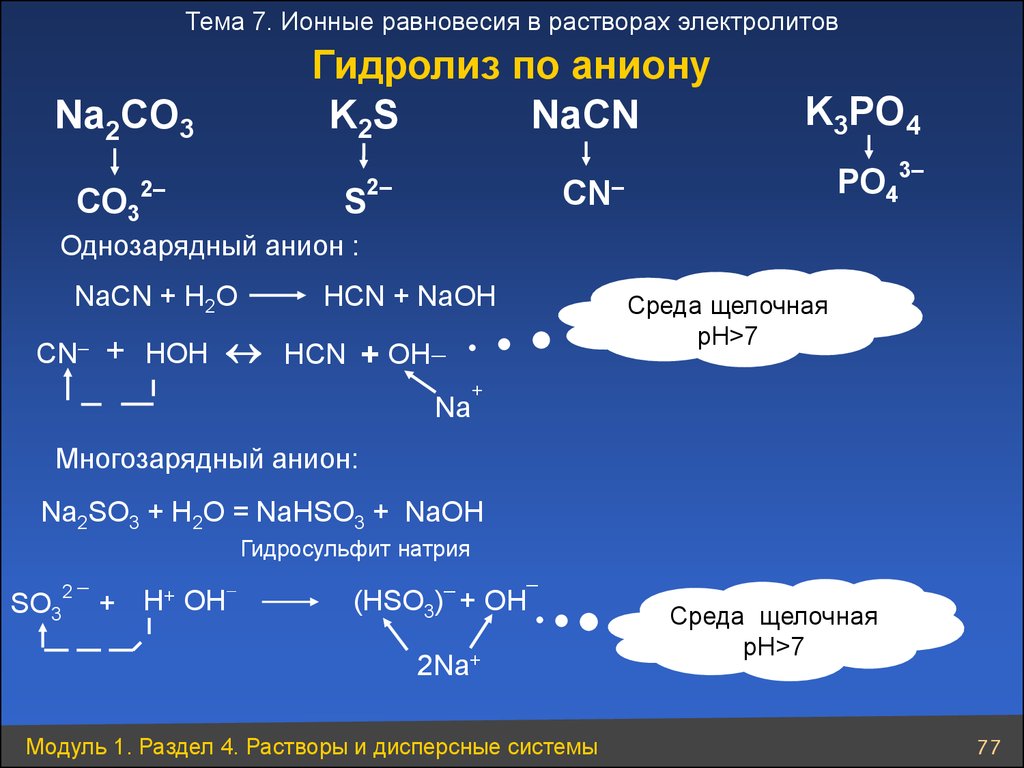
Тема 7. Ионные равновесия в растворах электролитовГидролиз по аниону
K2S
NaСN
Na2CO3
CO3
PO43–
CN–
2–
2–
K3PO4
S
Однозарядный анион :
NaСN + Н2O
НСN + NaOH
Среда щелочная
pH>7
CN– + НOН НСN + OН
Na
+
Многозарядный анион:
Na2SO3 + H2O = NaHSO3 + NaOH
Гидросульфит натрия
SO3
2
_
+
H+
OH
_
_
(HSO3) + OH
2Na+
Модуль 1. Раздел 4. Растворы и дисперсные системы
Среда щелочная
pH>7
77
78.
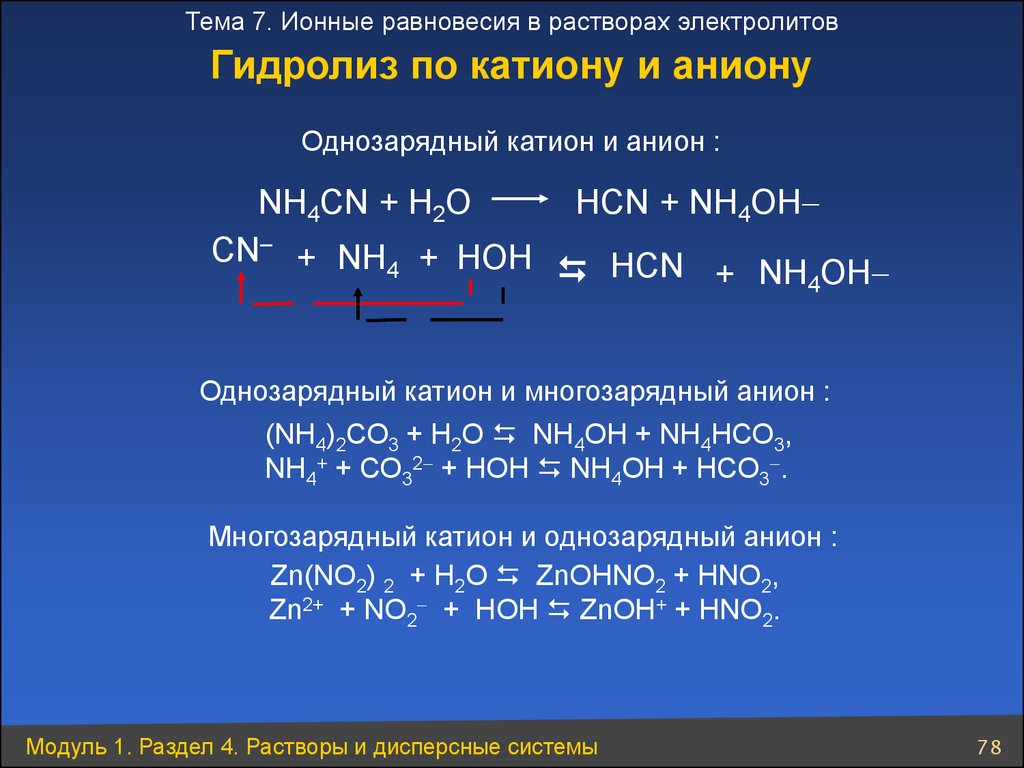
Тема 7. Ионные равновесия в растворах электролитовГидролиз по катиону и аниону
Однозарядный катион и анион :
NН4СN + Н2O
CN– + NН4 + НOН
НСN + NН4OН
НСN + NН4OН
Однозарядный катион и многозарядный анион :
(NН4)2СО3 + Н2О NH4ОН + NH4НСО3,
NH4+ + СО32 + HОН NH4OH + НСО3 .
Многозарядный катион и однозарядный анион :
Zn(NO2) 2 + Н2О ZnОНNO2 + НNO2,
Zn2+ + NO2 + HОН ZnОН+ + HNО2.
Модуль 1. Раздел 4. Растворы и дисперсные системы
78
79.
Тема 7. Ионные равновесия в растворах электролитовРеакции обмена, сопровождающиеся гидролизом
2AlCl3 + 3Na2CO3+ 3H2O 2Al(OH)3↓ + 3CO2 + 6NaCl
Cr2(SO4)3 + 3Na2S + 6H2O 2Cr(OH)3↓ + 3H2S + Na2SO4
2Cu(NO3)2 + 2Na2CO3 + H2O Cu2(OH)2CO3↓ + 4NaNO3 + CO2
Модуль 1. Раздел 4. Растворы и дисперсные системы
79
80.
Тема 8. Окислительно-восстановительные реакцииОкислительно-восстановительные реакции
В любой окислительно-восстановительной реакции
принимают участие две сопряженные пары
«окислитель-восстановитель» – O1, В1 и O2, В2 .
Хотя окисление без восстановления невозможно,
сами процессы можно записать раздельно.
Модуль 1. Раздел 4. Растворы и дисперсные системы
80
81.
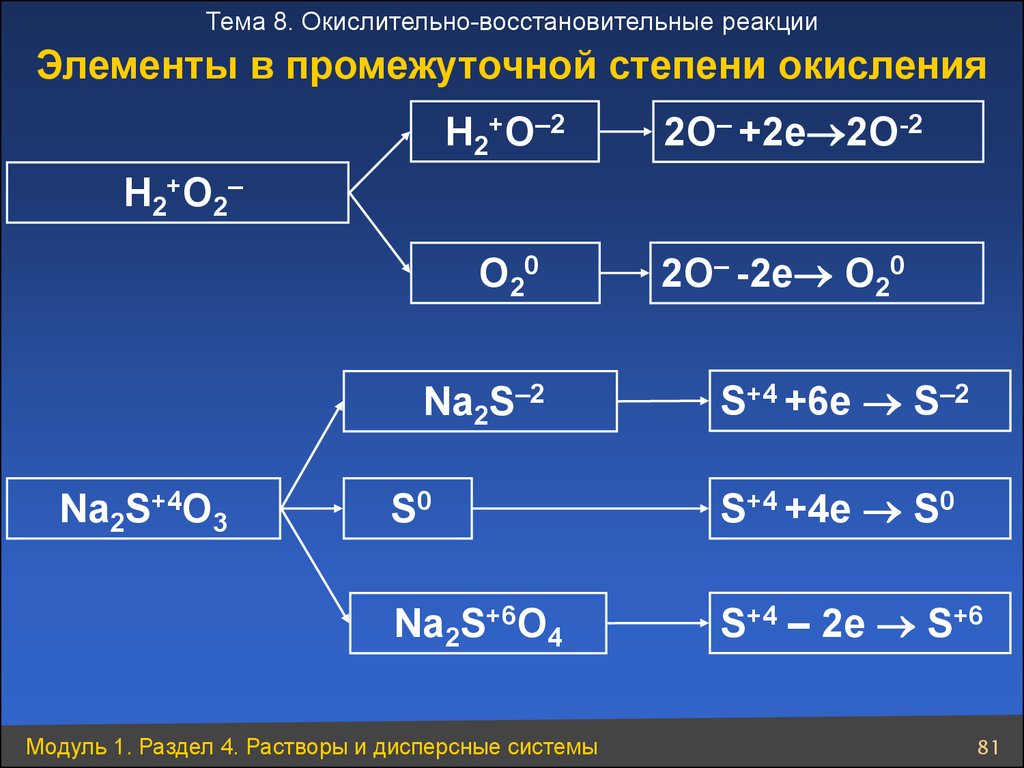
Тема 8. Окислительно-восстановительные реакцииЭлементы в промежуточной степени окисления
H2+O–2
2О– +2е 2О-2
О20
2О– -2е О20
H2+O2–
Na2S–2
Na2S+4O3
S+4 +6e S–2
S0
S+4 +4e S0
Na2S+6O4
S+4 – 2e S+6
Модуль 1. Раздел 4. Растворы и дисперсные системы
81
82.
Тема 8. Окислительно-восстановительные реакцииТипы ОВР
Межмолекулярные
2Сu0 +O20 2Cu2+O2–
3H2S 2 +H2S+6O4 4S0 + 4H2O
6KI + 4H2S+6O4 3I20+S0 +3K2SO4+4H2O
Внутримолекулярные
(N–3H4)2Cr2+6O7 (t0) N20 + Cr2+3O3 + 4H2O
2NaN+5O3–2 2NaN+3O2 + O20
Диспропорционирование
KCl+5O3–2 2KCl– + 3O20
4KCl+5O3 KCl +3KCl+7O4
Cl20 + 2KOH KCl +KCl+1O +H2O
4Na2S+4O3 Na2S 2 + 3Na2S+6O4
Модуль 1. Раздел 4. Растворы и дисперсные системы
82
83.
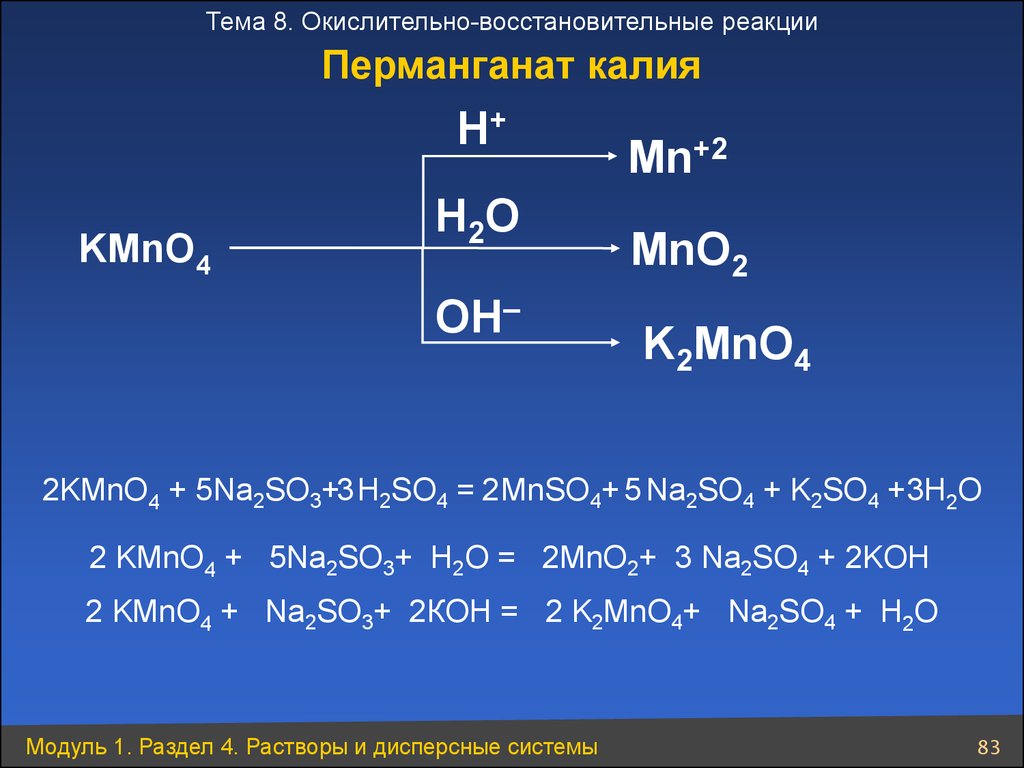
Тема 8. Окислительно-восстановительные реакцииПерманганат калия
H+
KMnO4
H 2O
OH–
Mn+2
MnO2
K2MnO4
2KMnO4 + 5Na2SO3+3 H2SO4 = 2 MnSO4+ 5 Na2SO4 + K2SO4 +3H2O
2 KMnO4 + 5Na2SO3+ H2O = 2MnO2+ 3 Na2SO4 + 2KOH
2 KMnO4 + Na2SO3+ 2КOH = 2 K2MnO4+ Na2SO4 + H2O
Модуль 1. Раздел 4. Растворы и дисперсные системы
83
84.
Тема 8. Окислительно-восстановительные реакцииИонно-электронный метод
[O2–]исх.в-в [O2–]кон.в-в
а) кислая среда
б) щелочная и нейтральная среды
[O2–]исх.в-в [O2–]кон.в-в
а) кислая и нейтральная среды
б) щелочная среда
Модуль 1. Раздел 4. Растворы и дисперсные системы
[O2–] + 2H+ = H2O;
[O2–] + H2O = 2OH–.
Н2О = [О2–] + 2Н+;
2ОН– = [О2-] + Н2О.
84
85.
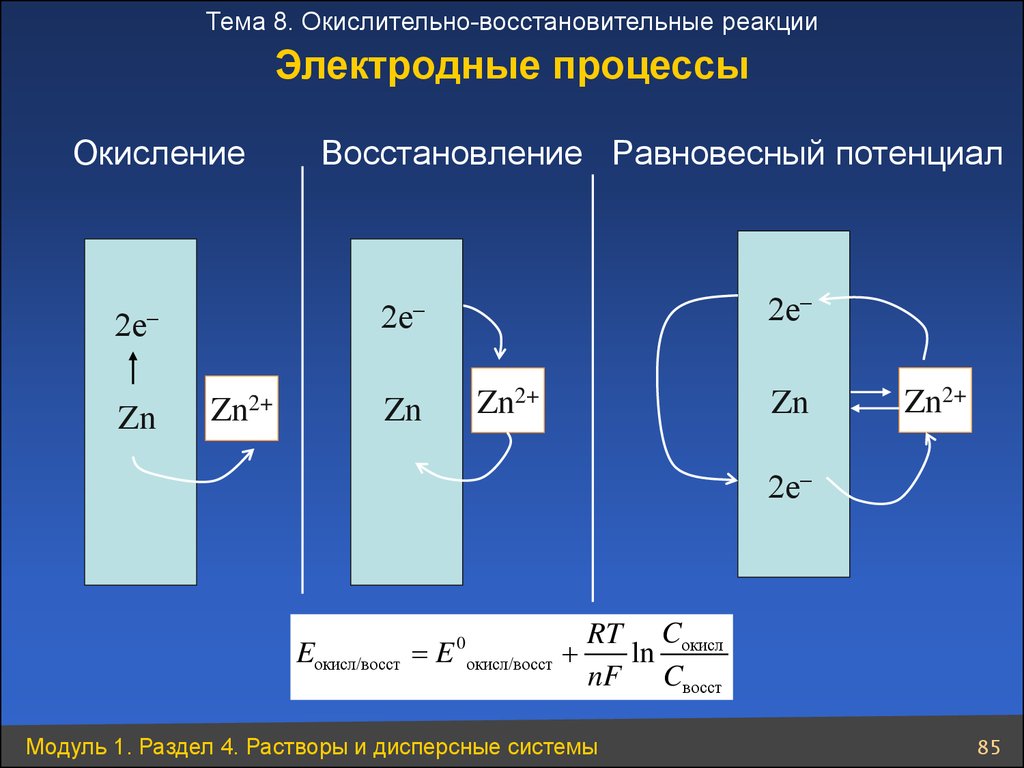
Тема 8. Окислительно-восстановительные реакцииЭлектродные процессы
Окисление
2е
2е
2е
Zn
Восстановление Равновесный потенциал
Zn2+
Zn2+
Zn
Zn
Zn2+
2е
Eокисл/восст
RT Cокисл
E окисл/восст +
ln
nF Cвосст
0
Модуль 1. Раздел 4. Растворы и дисперсные системы
85
86.
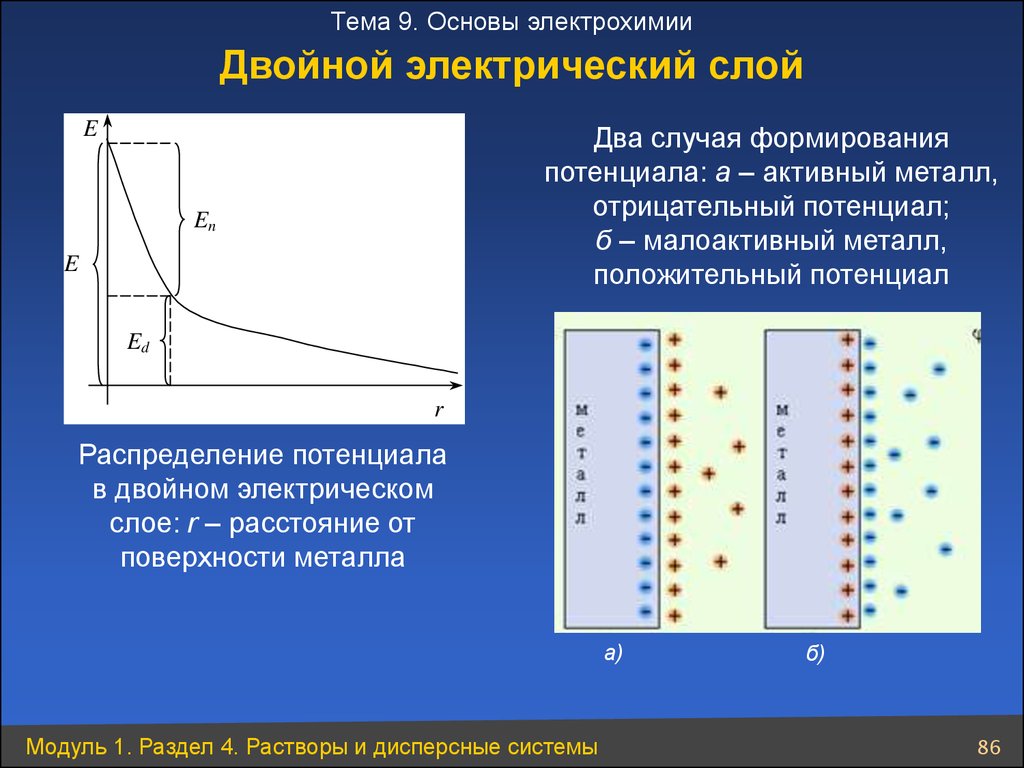
Тема 9. Основы электрохимииДвойной электрический слой
E
Два случая формирования
потенциала: а – активный металл,
отрицательный потенциал;
б – малоактивный металл,
положительный потенциал
En
E
Ed
r
Распределение потенциала
в двойном электрическом
слое: r – расстояние от
поверхности металла
а)
Модуль 1. Раздел 4. Растворы и дисперсные системы
б)
86
87.
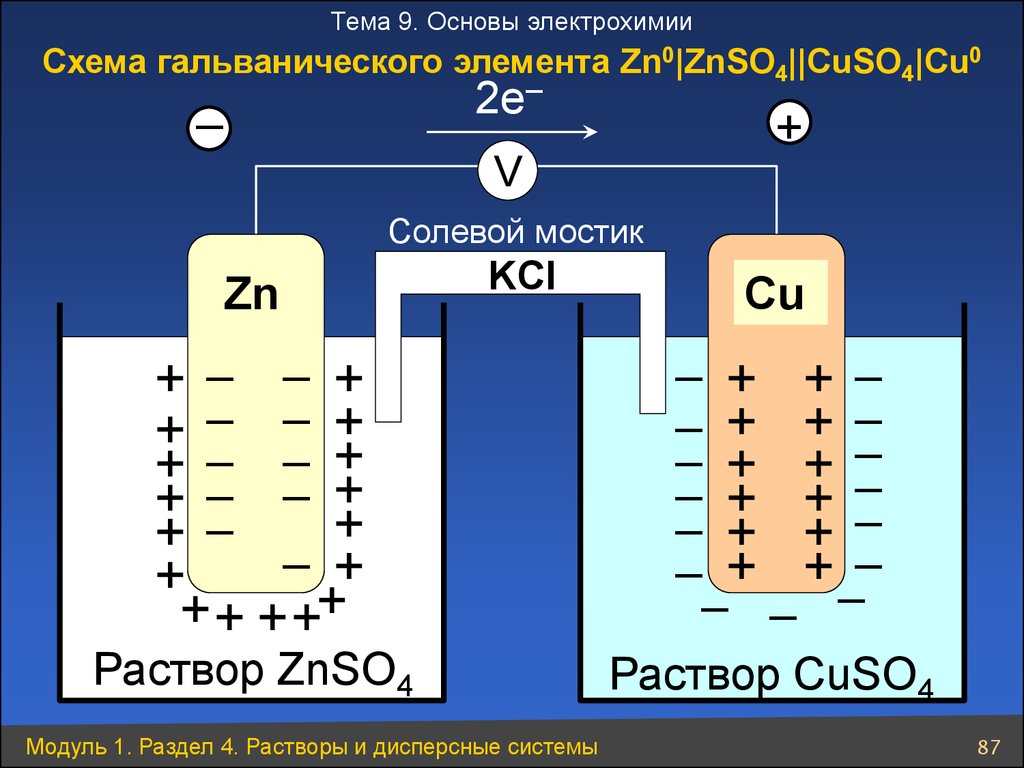
Тема 9. Основы электрохимииСхема гальванического элемента Zn0|ZnSO4||CuSO4|Cu0
2e–
–
+
V
Солевой мостик
Zn
KCl
Cu
+ – – +
+ – – +
+ – – +
+ – – +
+ – – +
+ – – ++
+ + ++
– + + –
– + + –
– + + ––
– + + –
– + +
– + + ––
– –
Раствор ZnSO4
Раствор CuSO4
Модуль 1. Раздел 4. Растворы и дисперсные системы
87
88.
Тема 9. Основы электрохимииПроцессы на аноде и катоде
Анод
–
Катод
+
Zn0|ZnSO4||CuSO4|Cu0
А: Zn0 – 2e Zn2+ 0= 0,76 окисление
K: Cu2+ + 2e Cu0 0 = +0,34 восстановZn0 + Cu2+ Zn2+ + Cu0
Е0= 0К – 0А
ление
Е0Cu-Zn= 0,34 – (–0,76)=1,1В.
Модуль 1. Раздел 4. Растворы и дисперсные системы
88
89.
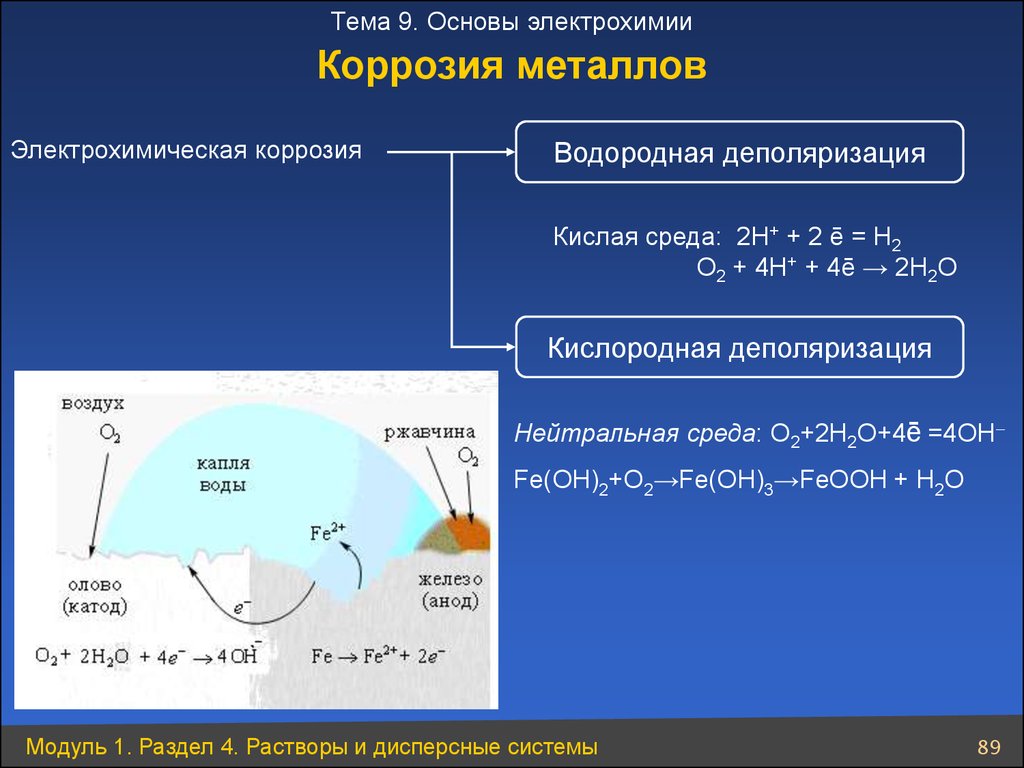
Тема 9. Основы электрохимииКоррозия металлов
Электрохимическая коррозия
Водородная деполяризация
Кислая среда: 2Н+ + 2 ē = Н2
О2 + 4Н+ + 4ē → 2Н2О
Кислородная деполяризация
Нейтральная среда: O2+2H2O+4ē =4OH
Fe(OH)2+O2→Fe(OH)3→FeOOH + H2O
Модуль 1. Раздел 4. Растворы и дисперсные системы
89
90.
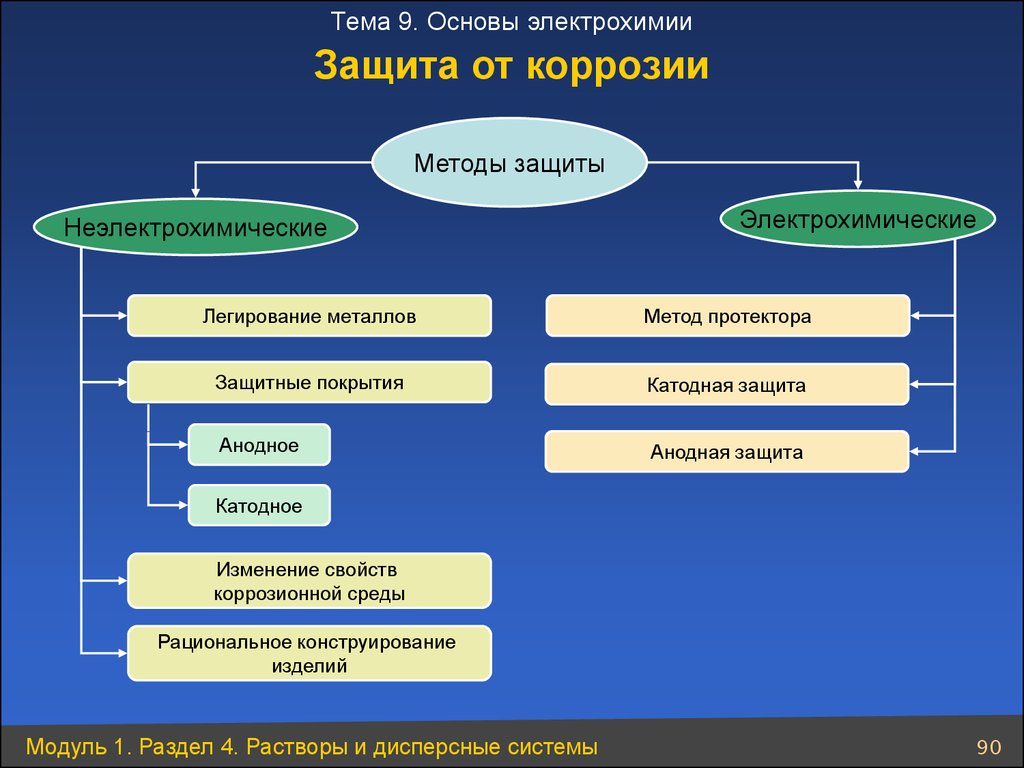
Тема 9. Основы электрохимииЗащита от коррозии
Методы защиты
Неэлектрохимические
Электрохимические
Легирование металлов
Метод протектора
Защитные покрытия
Катодная защита
Анодное
Анодная защита
Катодное
Изменение свойств
коррозионной среды
Рациональное конструирование
изделий
Модуль 1. Раздел 4. Растворы и дисперсные системы
90
91.
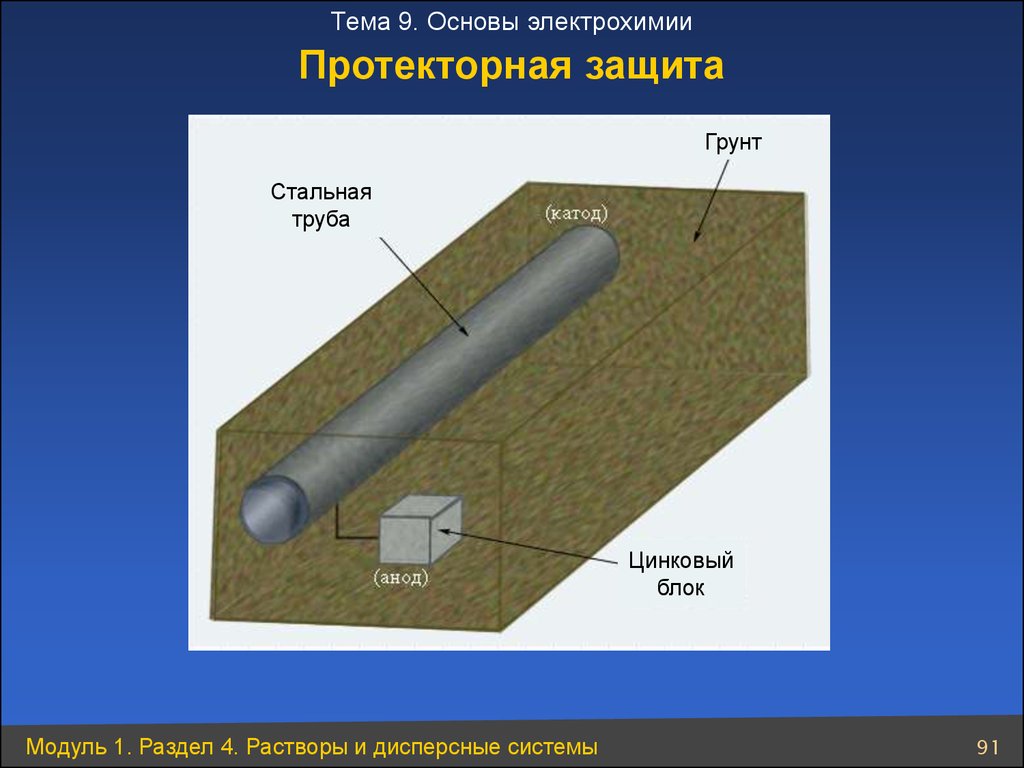
Тема 9. Основы электрохимииПротекторная защита
Грунт
Стальная
труба
Цинковый
блок
Модуль 1. Раздел 4. Растворы и дисперсные системы
91
92.
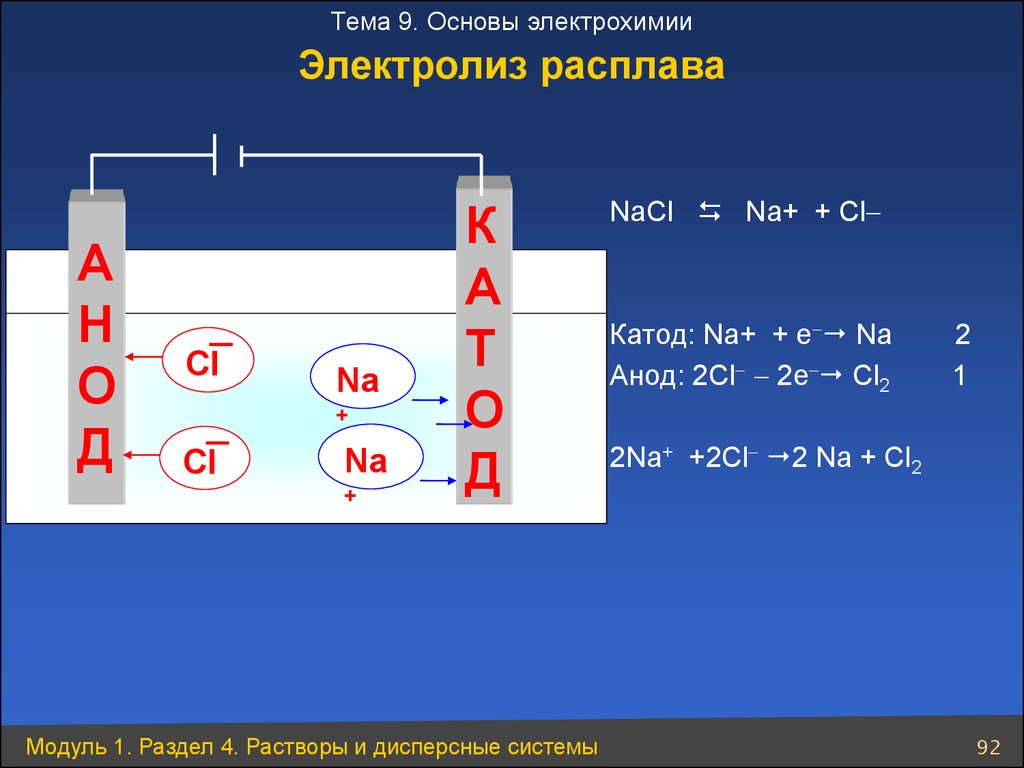
Тема 9. Основы электрохимииЭлектролиз расплава
А
Н
О
Д
CI
Na
+
CI
Na
+
К
А
Т
О
Д
Модуль 1. Раздел 4. Растворы и дисперсные системы
NaCl Na+ + Cl
Катод: Na+ + е Na
Анод: 2Cl 2е Cl2
2
1
2Na+ +2Cl 2 Na + Cl2
92
93.
Тема 9. Основы электрохимииЭлектролиз водных растворов
Катодные процессы
Li Rb K Ba Ca Na Mg
Восстанавливается:
2H2O + 2e =H2 + 2OH
или
2H++ 2e = H2
AI Mn Zn Cr Fe Co
Совместное
восстанавление:
Men++ ze = Me0
2H2O+2e =H2+2OH
Sn Pb H Cu Hg Ag Pt Au
Восстанавливается:
металл
Men+ + ne = Me0
Анодные процессы
Водные растворы
Окисляются анионы:
Не окисляются анионы:
R–COO CI Br I S2 F SO42 NO3 CO32
PO43 ,
2CI – 2e = CI2
2R–COO – 2e = 2CO2 + R– а окисляются молекулы
воды: 2H2O – 4e = O2 +
R
4H+
Модуль 1. Раздел 4. Растворы и дисперсные системы
Щелочные растворы
Окисляются: 4OH –
4e = O2 + 2H2О
93
94.
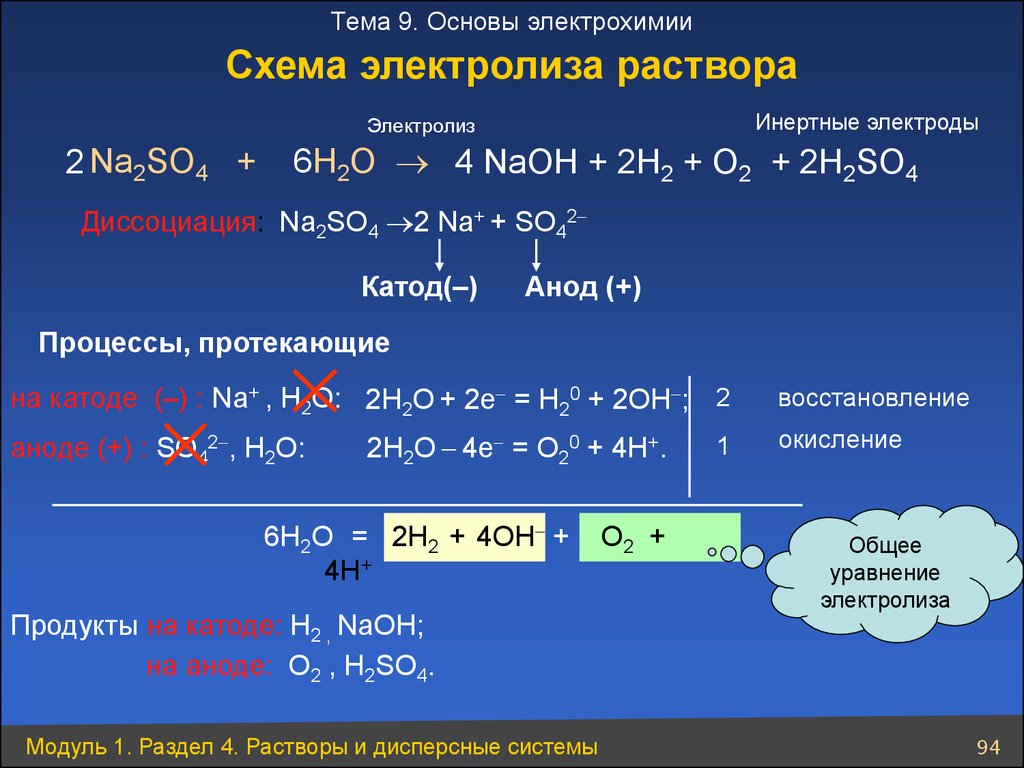
Тема 9. Основы электрохимииСхема электролиза раствора
Инертные электроды
Электролиз
2 Na2SO4 +
6H2O 4 NaОН + 2Н2 + O2 + 2Н2SO4
Диссоциация: Na2SO4 2 Na+ + SO42
Катод(–)
Анод (+)
Процессы, протекающие
на катоде (–) : Na+ , Н2О: 2Н2О + 2e = Н20 + 2ОН ; 2
аноде (+) : SO42 , Н2О:
2Н2О 4e = О20 + 4Н+.
6Н2О = 2Н2 + 4ОН +
4Н+
Продукты на катоде: Н2 , NaОН;
на аноде: O2 , Н2SO4.
Модуль 1. Раздел 4. Растворы и дисперсные системы
O2 +
1
восстановление
окисление
Общее
уравнение
электролиза
94
95.
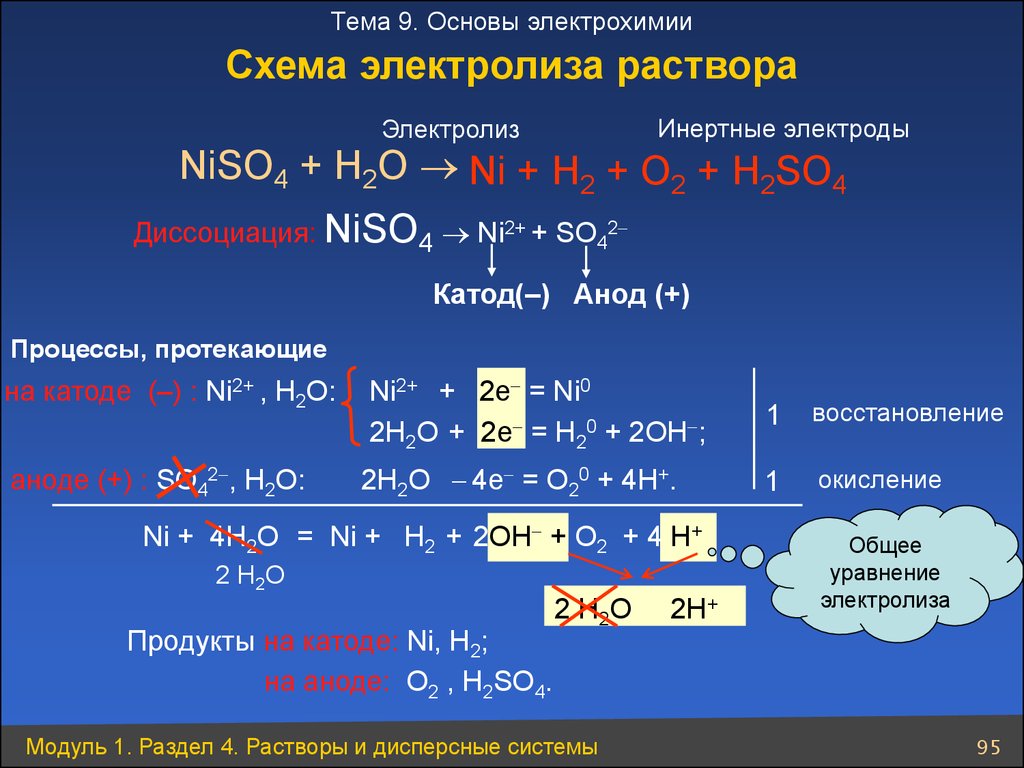
Тема 9. Основы электрохимииСхема электролиза раствора
Инертные электроды
Электролиз
NiSO4 + H2O Ni + Н2 + O2 + Н2SO4
Диссоциация: NiSO4 Ni2+ + SO42
Катод(–) Анод (+)
Процессы, протекающие
на катоде (–) : Ni2+ , Н2О:
Ni2+ + 2e = Ni0
2Н2О + 2e = Н20 + 2ОН ;
1
восстановление
аноде (+) : SO42 , Н2О:
2Н2О 4e = О20 + 4Н+.
1
окисление
Ni + 4Н2О = Ni + Н2 + 2ОН + O2 + 4 Н+
2 H2O
Продукты на катоде: Ni, Н2;
на аноде: O2 , H2SO4.
2 Н 2O
Модуль 1. Раздел 4. Растворы и дисперсные системы
2H+
Общее
уравнение
электролиза
95
96.
Тема 9. Основы электрохимииЗаконы Фарадея
I·t·Э
m=
F
где m – масса образовавшегося или подвергшегося превращению
вещества;
Э – эквивалентная масса вещества;
I – сила тока, А;
t – время, с;
F – постоянная Фарадея: 96500 Кл/моль.
При превращении одного моля эквивалентов вещества на электроде
через него проходит 96500 Кл (А·с).
Модуль 1. Раздел 4. Растворы и дисперсные системы
96
97. Модуль 2 Химия элементов и их соединений
98. Раздел 6 Общая характеристика химических элементов
Химия элементов и их соединений98
99.
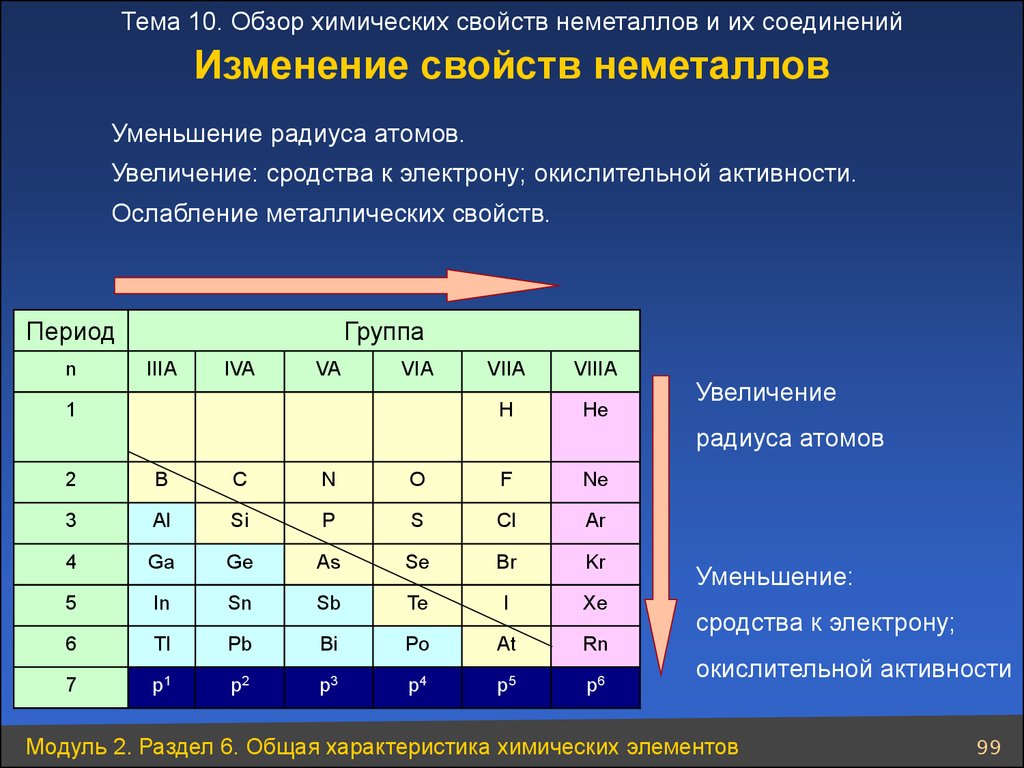
Тема 10. Обзор химических свойств неметаллов и их соединенийИзменение свойств неметаллов
Уменьшение радиуса атомов.
Увеличение: сродства к электрону; окислительной активности.
Ослабление металлических свойств.
Период
n
Группа
IIIA
IVA
VA
VIA
1
VIIA
VIIIA
H
He
Увеличение
радиуса атомов
2
B
C
N
O
F
Ne
3
Al
Si
P
S
Cl
Ar
4
Ga
Ge
As
Se
Br
Kr
5
In
Sn
Sb
Te
I
Xe
6
Tl
Pb
Bi
Po
At
Rn
7
p1
p2
p3
p4
p5
p6
Уменьшение:
сродства к электрону;
окислительной активности
Модуль 2. Раздел 6. Общая характеристика химических элементов
99
100.
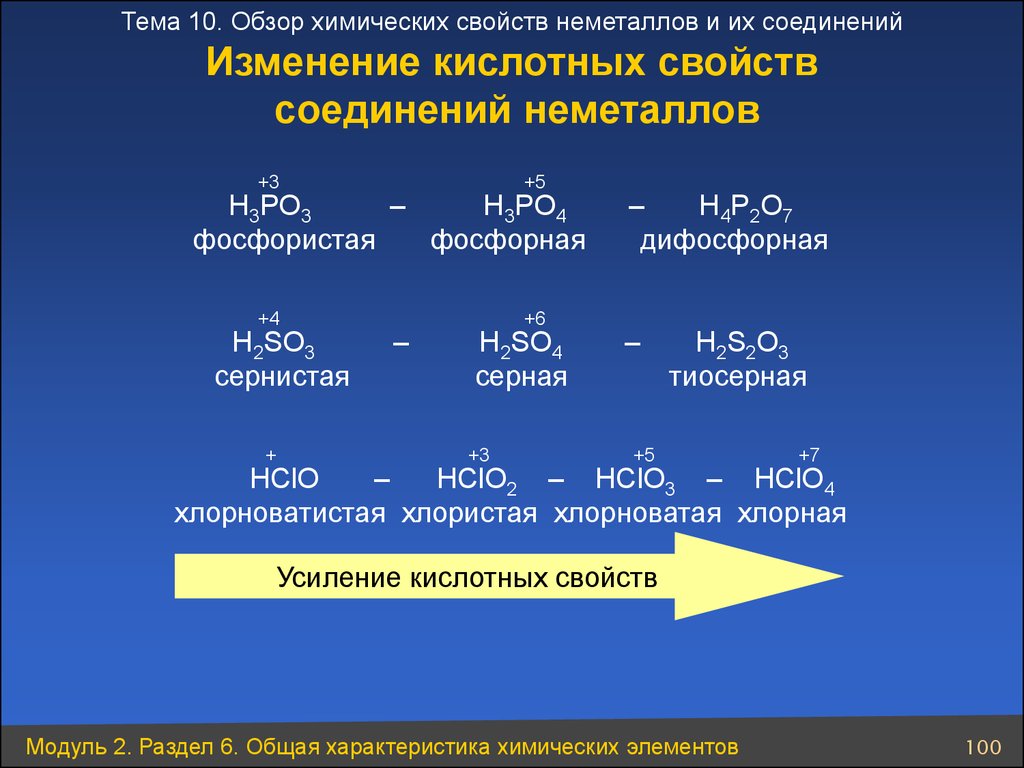
Тема 10. Обзор химических свойств неметаллов и их соединенийИзменение кислотных свойств
соединений неметаллов
+3
+5
+4
+6
H3PO3
–
H3PO4
фосфористая
фосфорная
H2SO3
сернистая
+
–
H2SO4
серная
+3
–
H4P2O7
дифосфорная
–
H2S2O3
тиосерная
+5
+7
HClO
–
HClO2 – HClO3 – HClO4
хлорноватистая хлористая хлорноватая хлорная
Усиление кислотных свойств
Модуль 2. Раздел 6. Общая характеристика химических элементов
100
101.
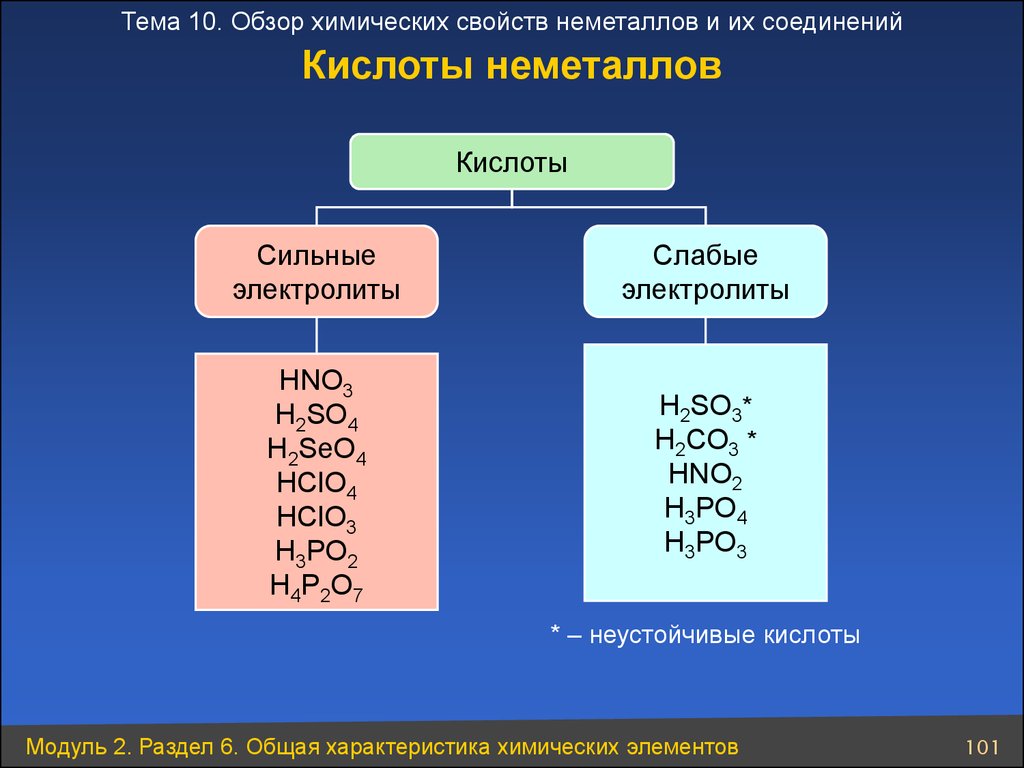
Тема 10. Обзор химических свойств неметаллов и их соединенийКислоты неметаллов
Кислоты
Сильные
электролиты
Слабые
электролиты
HNO3
H2SO4
H2SeO4
HClO4
HClO3
H3PO2
H4P2O7
H2SO3*
H2CO3 *
HNO2
H3PO4
H3PO3
* – неустойчивые кислоты
Модуль 2. Раздел 6. Общая характеристика химических элементов
101
102.
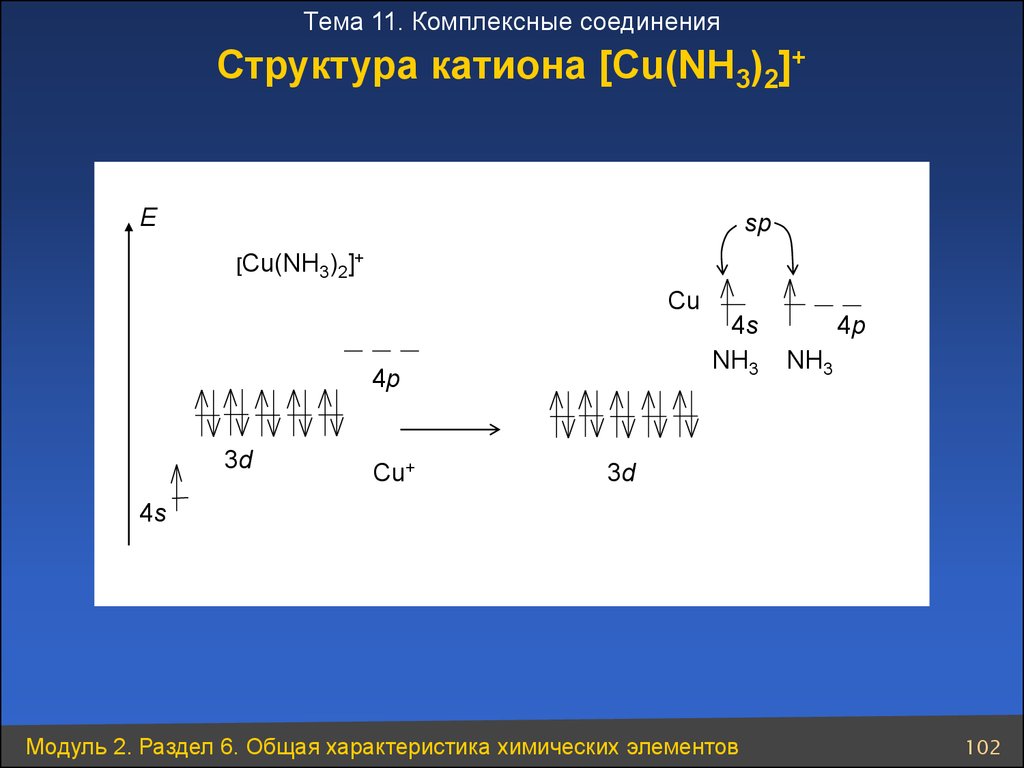
Тема 11. Комплексные соединенияСтруктура катиона [Cu(NH3)2]+
Е
sp
[Cu(NH3)2]+
Cu
4s
NH3
4p
3d
Cu+
4p
NH3
3d
4s
Модуль 2. Раздел 6. Общая характеристика химических элементов
102
103.
Тема 11. Комплексные соединенияКомплексные соединения Ni+2
Гибридизация атомных орбиталей при образовании параи диамагнитных комплексных ионов Ni+2
[Ni(NH3)4]2+
Е
Ni0
Ni2+
sp3
4s
4p
NH3 NH3 NH3 NH3
sp2 d
4p
[Ni(CN)4]23d
4s
3d
CN-
Ni2+
4s 4p
CN- CN- CN-
3d
Модуль 2. Раздел 6. Общая характеристика химических элементов
103
104.
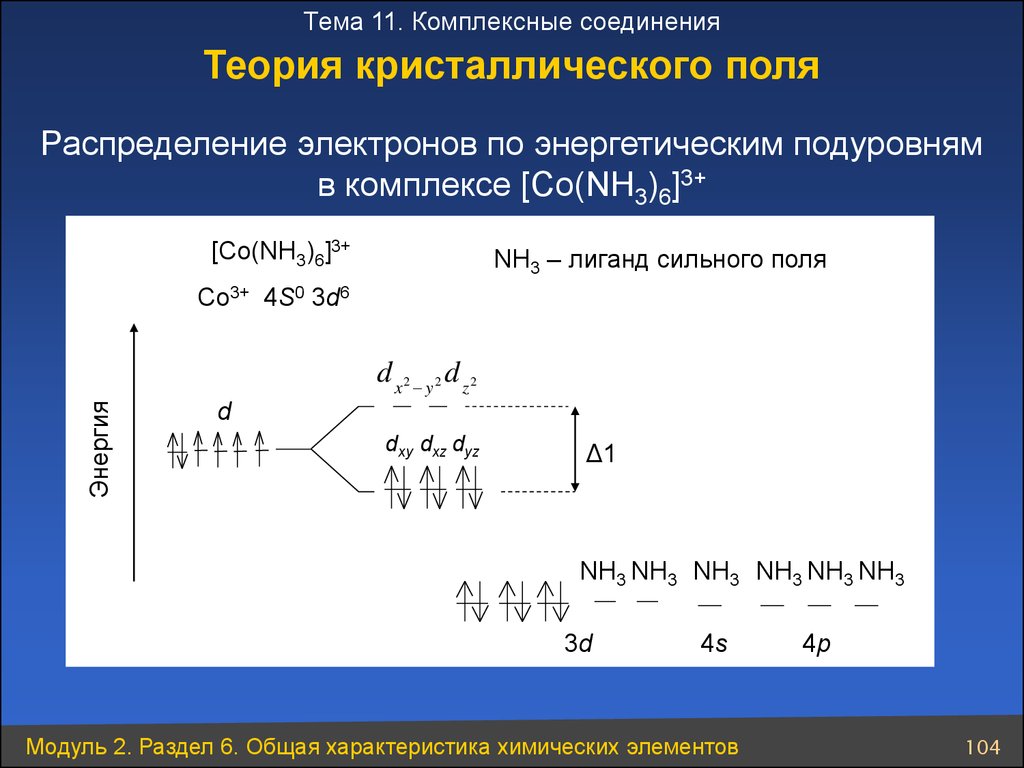
Тема 11. Комплексные соединенияТеория кристаллического поля
Распределение электронов по энергетическим подуровням
в комплексе [Co(NH3)6]3+
[Co(NH3)6]3+
NH3 – лиганд сильного поля
Co3+ 4S0 3d6
Энергия
d x2 y 2 d z 2
d
dxy dxz dyz
Δ1
NH3 NH3 NH3 NH3 NH3 NH3
3d
4s
Модуль 2. Раздел 6. Общая характеристика химических элементов
4p
104
105.
Тема 11. Комплексные соединенияТеория кристаллического поля
[CoF6]3–
: :
Co3+ 4S0 3d6
F– – лиганд слабого поля, имеющий
неподеленные пары электронов
:F:
Энергия
d x2 y2 d z
2
F-
d
dxy dxz dyz
F- F- F- F- F-
Δ1
4s
4p
Модуль 2. Раздел 6. Общая характеристика химических элементов
4d
105
106. Кристаллические решетки металлов
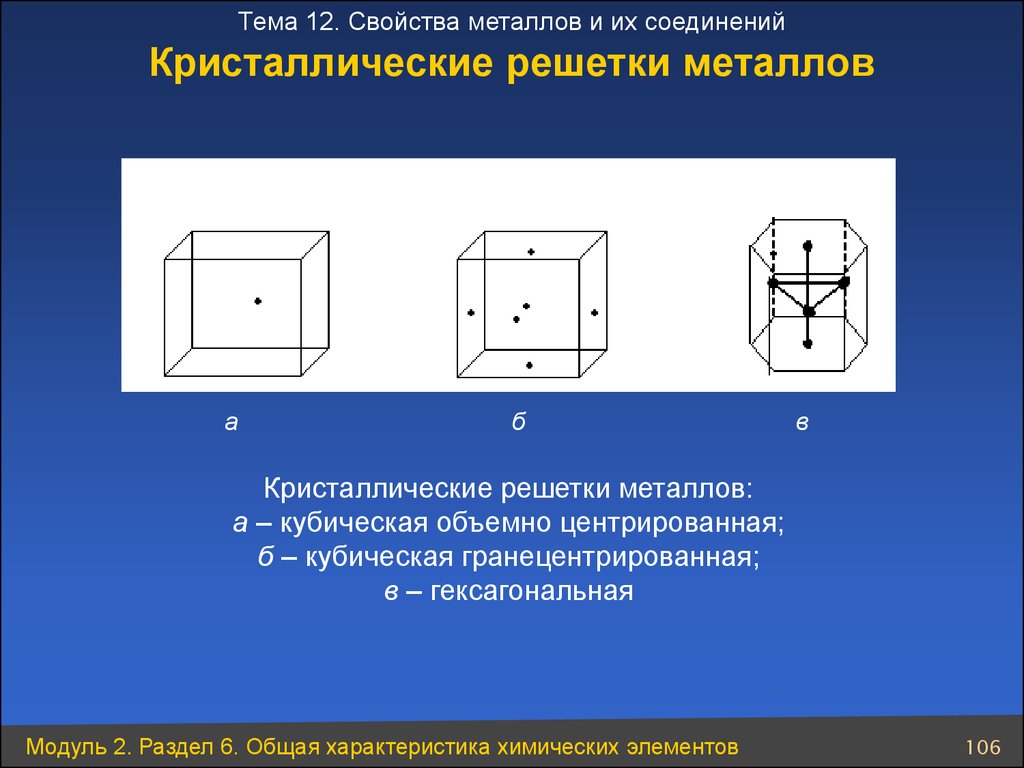
Тема 12. Свойства металлов и их соединенийКристаллические решетки металлов
а
б
в
Кристаллические решетки металлов:
а – кубическая объемно центрированная;
б – кубическая гранецентрированная;
в – гексагональная
Модуль 2. Раздел 6. Общая характеристика химических элементов
106
107.
Тема 12. Свойства металлов и их соединенийОбразование энергетических зон
в одновалентном металле
Разрыхляющие орбитали
Связывающие
орбитали
Валентные электроны
в свободном атоме
Зона проводимости
Валентная зона
Заполненные орбитали
Свободная зона
Внутренние электроны
Образование энергетических зон
в одновалентном металле
Модуль 2. Раздел 6. Общая характеристика химических элементов
107
108.
Тема 12. Свойства металлов и их соединенийОбразование энергетических зон
в кристалле диэлектрика
на примере алмаза
E
2p
2s
r0
r
1 – валентная зона;
2 – запрещенная зона;
3 – зона проводимости
Модуль 2. Раздел 6. Общая характеристика химических элементов
108
109.
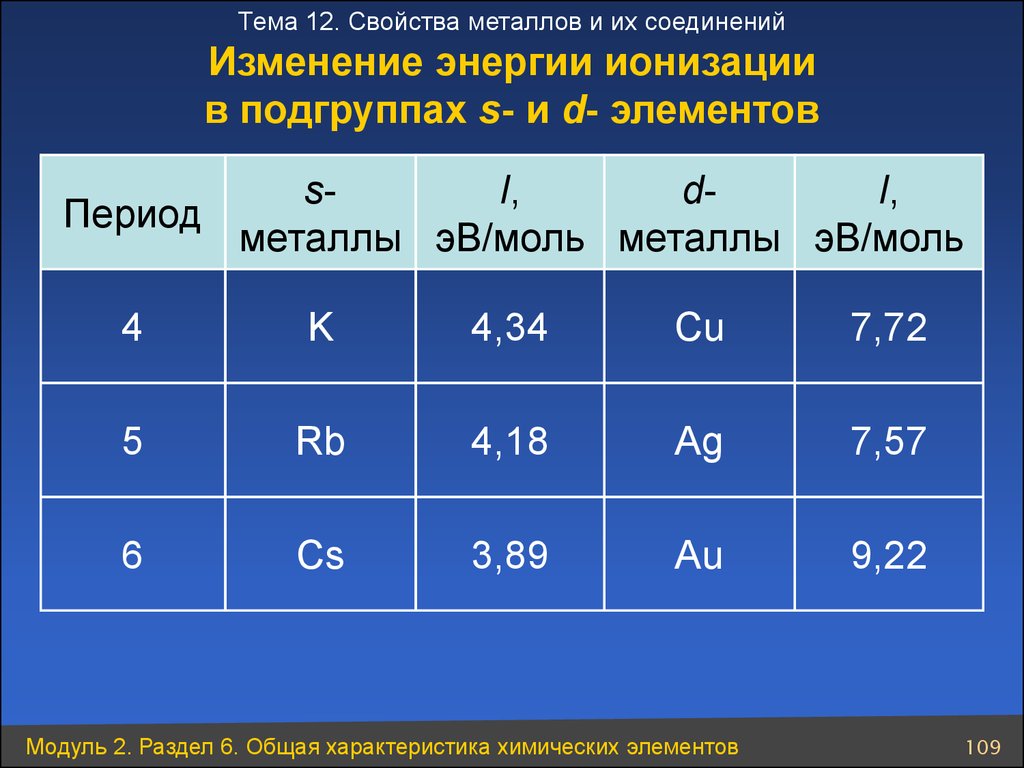
Тема 12. Свойства металлов и их соединенийИзменение энергии ионизации
в подгруппах s- и d- элементов
sI,
dI,
Период
металлы эВ/моль металлы эВ/моль
4
K
4,34
Cu
7,72
5
Rb
4,18
Ag
7,57
6
Cs
3,89
Au
9,22
Модуль 2. Раздел 6. Общая характеристика химических элементов
109
110.
Тема 12. Свойства металлов и их соединенийБинарные соединения
Оксиды – Na2O, BaO.
Пероксиды – Na2O2, BaO2.
Галиды – KCl, CaF2.
Сульфиды – MnS, Al2S3.
Гидриды – LiH, CaH2.
Нитриды – Na3N, AlN.
Карбиды – Be2C, CaC2.
Фосфиды – Ca3P2, Na3P.
Бориды – AlB, Mg3B2.
Силициды – Mg2Si, Al4Si3.
Модуль 2. Раздел 6. Общая характеристика химических элементов
110
111.
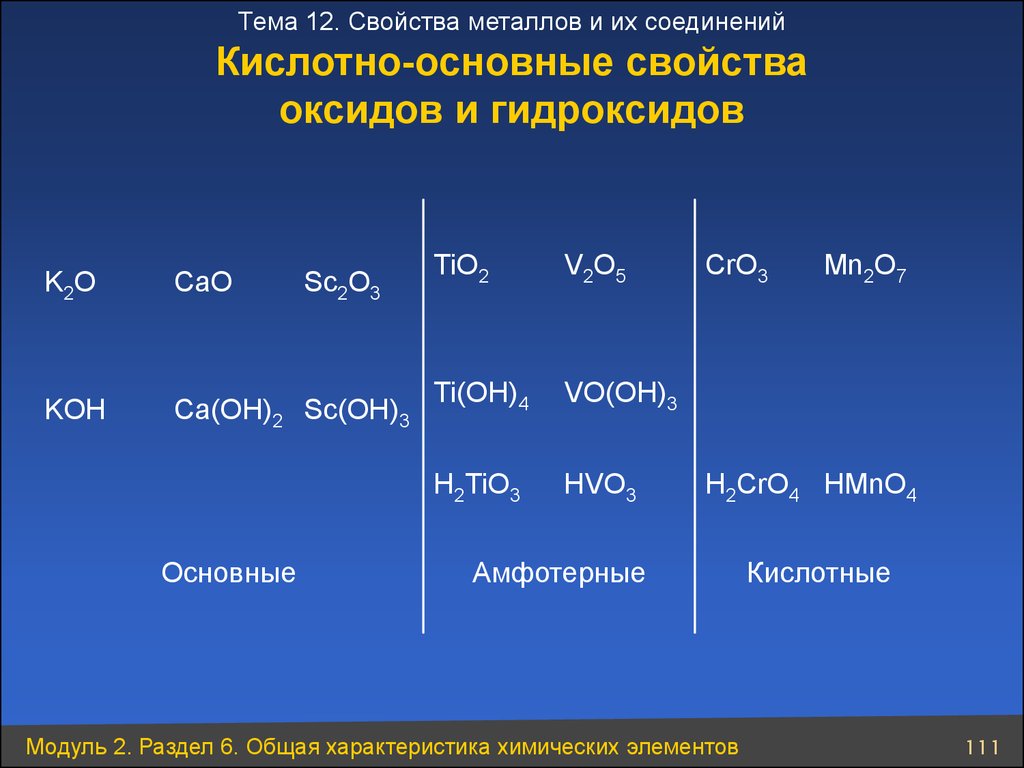
Тема 12. Свойства металлов и их соединенийКислотно-основные свойства
оксидов и гидроксидов
K2O
CaO
KOH
Ca(OH)2 Sc(OH)3
Основные
Sc2O3
TiO2
V2O5
Ti(OH)4
VO(ОH)3
H2TiO3
HVO3
CrO3
Mn2O7
H2CrO4 HMnO4
Амфотерные
Модуль 2. Раздел 6. Общая характеристика химических элементов
Кислотные
111
112. Концентрированная азотная кислота
Тема 12. Свойства металлов и их соединенийКонцентрированная азотная кислота
Активные Ме = нитрат + NH3 (NH4NO3) + H2O
HNO3( разб.) + ср.акт. Ме = нитрат + N2 (N2O, N2O3, HNO2) + H2O
Малоакт. Ме = нитрат + NO + H2O
NO3– +10 H+ + 8ē = NH4+ + 3H2O
E° = 0,87 В;
NO3– +4 H+ + 3ē = NO + 2H2O
E° = 0,96 В;
2NO3– +10 H+ + 8ē = N2O + 5 H2O
E° = 1,12 В;
2NO3– +12 H+ + 10ē = N2 + 6 H2O
E° = 1,25 В;
Модуль 2. Раздел 6. Общая характеристика химических элементов
112
113.
Тема 12. Свойства металлов и их соединенийКонцентрированная серная кислота
Актив. Ме = сульфат + H2S + H2O
H2SO4(k) +
Ср.акт. Ме = сульфат + S + H2O
Мал.акт. Ме = сульфат + SO2 + H2O
SO42– + 10H+ +8ē = H2S + 4 H2O
SO42– + 4H+ +2ē = SO2 + 2 H2O
SO42– + 8H+ +6ē = S + 4 H2O
E° = 0,31 B;
E° = 0,31 B;
E° = 0,15 B.
Модуль 2. Раздел 6. Общая характеристика химических элементов
113
114. Руды металлов
Тема 12. Свойства металлов и их соединенийРуды металлов
Оксидные
Fe2O3 – гематит
Al2O3 · nH2O – боксит
Cu2O – куприт
SnO2 – касситерит
MnO2 – пиролюзит
Сульфидные
PbS – гaленит
FeAsS – арсенопирит
FeS2 – пирит
MoS2 – молибденит
СuFeS2 – халькопирит
Модуль 2. Раздел 6. Общая характеристика химических элементов
114
115. Гидрометаллургический метод получения золота
Тема 12. Свойства металлов и их соединенийГидрометаллургический метод получения золота
4Au + O2 + 8NaCN + 2H2O = 4Na[Au(CN)2] + 4NaOH;
Au + 2CN– - 1 ē = [Au(CN)2]– 4
O2 + 2H2O + 4ē = 4OH;
1
4Au + O2 + 8CN– + 2H2O = 4 [Au(CN)2]– + 4OH–
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Модуль 2. Раздел 6. Общая характеристика химических элементов
115
116.
Тема 12. Свойства металлов и их соединенийФизико-химические характеристики S-металлов
Уменьшение энергии ионизации, Еион
Увеличение восстановительной активности
Еион
520
496
419
403
375
384
кДж/моль
Э Э+
Rа, нм
Еион
Li
0,155
899
Na
0,189
738
K
0,236
590
Rb
0,248
549
Cs
0,268
503
Fr
0,280
509
кДж/моль
Э+ Э2 + Be
Rа, нм
0,133
Mg
0,160
Ca
0,197
Sr
0,215
Ba
0,221
Ra
0,235
Увеличение радиуса атомов
нм – нанометр (1 нм = 10–9 м)
Модуль 2. Раздел 6. Общая характеристика химических элементов
116
117. Минералы S-металлов
Тема 12. Свойства металлов и их соединенийМинералы S-металлов
I А подгруппа
KCl·NaCl – сильвинит
KCl – сильвин
KCl·MgCl2·6H2O – карналлит
NaCl – галит
Na2SO4·10H2O – мирабилит
II А подгруппа
CaF2 – флюорит
CaCO3 – кальцит
MgCO3 – магнезит
MgCO3·CaCO3 – доломит
CaSO4·2H2O – гипс
BaSO4 – барит
SrSO4 – целестин
Модуль 2. Раздел 6. Общая характеристика химических элементов
117
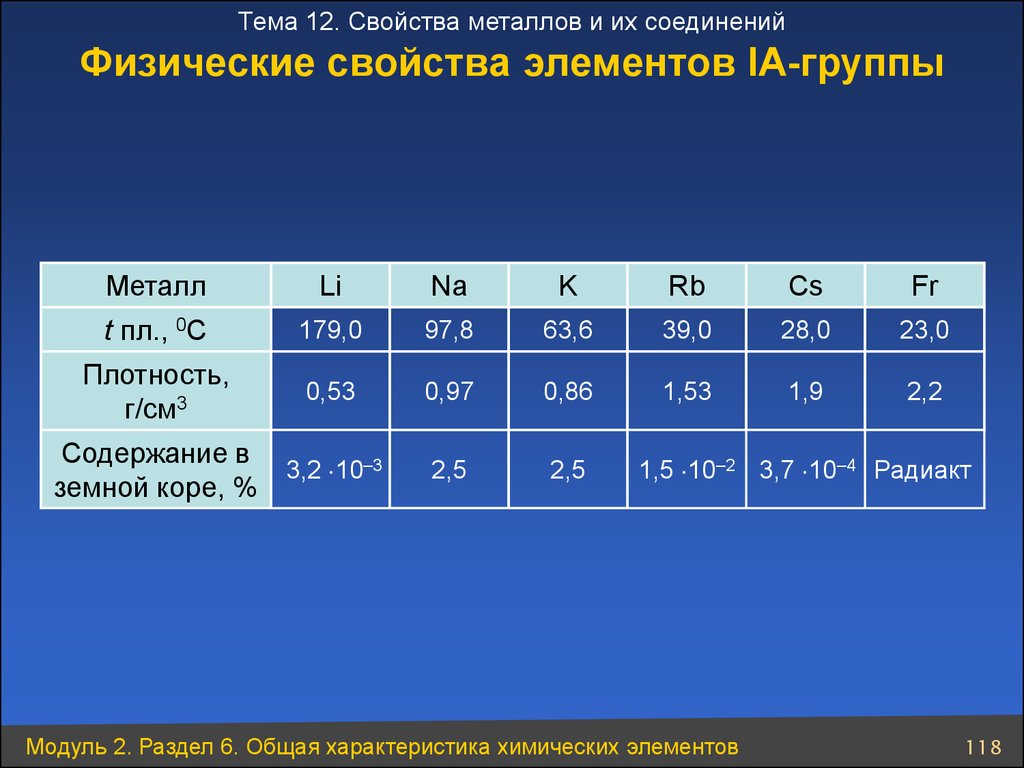
118. Физические свойства элементов ІА-группы
Тема 12. Свойства металлов и их соединенийФизические свойства элементов ІА-группы
Металл
Li
Na
K
Rb
Cs
Fr
t пл., 0C
179,0
97,8
63,6
39,0
28,0
23,0
Плотность,
г/см3
0,53
0,97
0,86
1,53
1,9
2,2
2,5
2,5
Содержание в
3,2 10–3
земной коре, %
1,5 10–2 3,7 10–4 Радиакт
Модуль 2. Раздел 6. Общая характеристика химических элементов
118
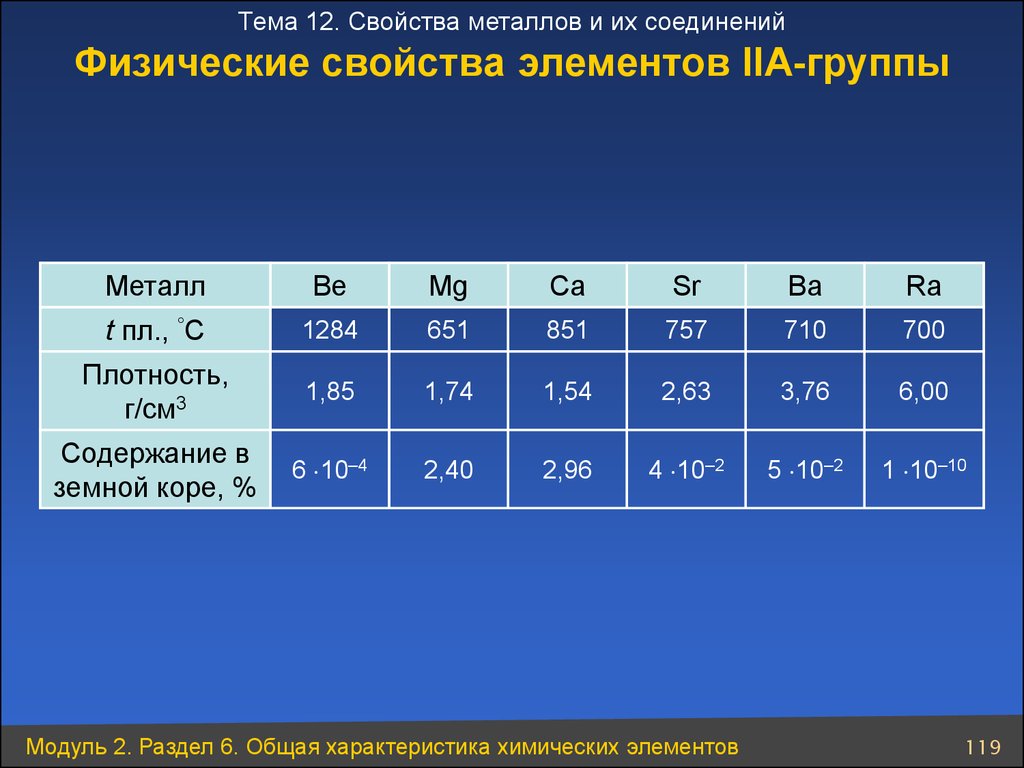
119. Физические свойства элементов ІІА-группы
Тема 12. Свойства металлов и их соединенийФизические свойства элементов ІІА-группы
Металл
Be
Mg
Ca
Sr
Ba
Ra
t пл., °C
1284
651
851
757
710
700
Плотность,
г/см3
1,85
1,74
1,54
2,63
3,76
6,00
Содержание в
земной коре, %
6 10–4
2,40
2,96
4 10–2
5 10–2
1 10–10
Модуль 2. Раздел 6. Общая характеристика химических элементов
119
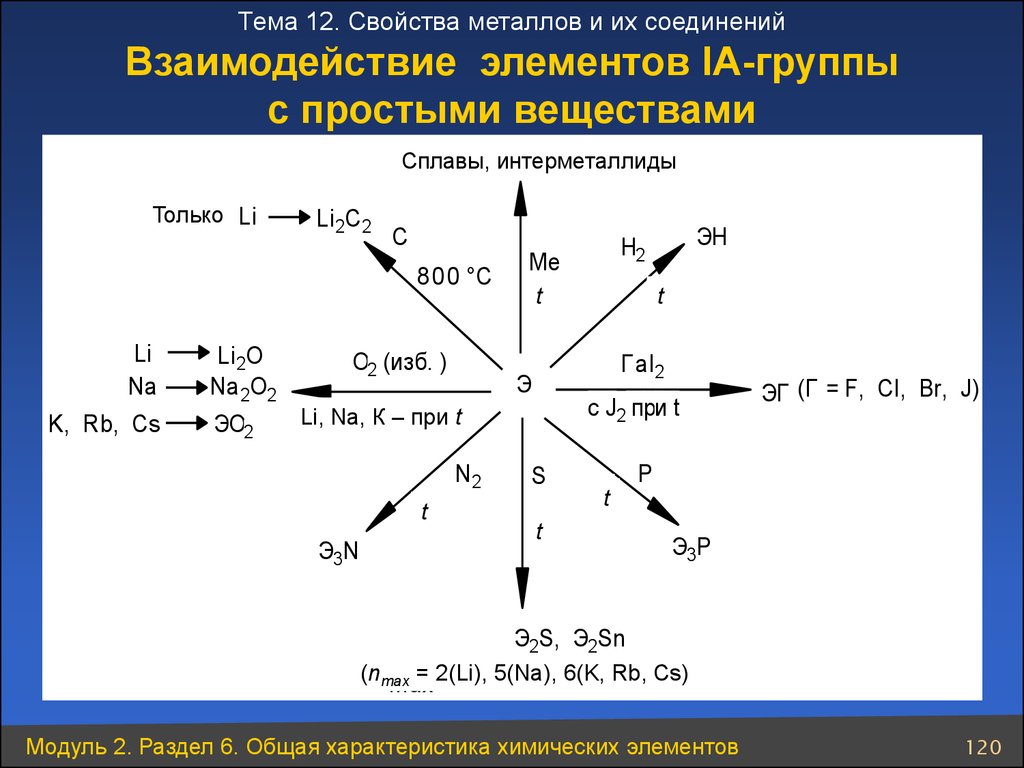
120.
Тема 12. Свойства металлов и их соединенийВзаимодействие элементов ІА-группы
с простыми веществами
сплавы,
Сплавы, интерметаллиды
интерметаллиды
Только
только Li
Li2C2
C
8 0 0 °C
Li
Na
K, Rb, Cs
Li2O
Na2O2
ЭО2
О2 (изб. )
Ме
tt
с J2 при t
Li, Na,
Li,
Na,КK– -при
приtt
t
Э3N
tt
Г аl2
Э
N2
ЭН
Н2
S
tt
tt
ЭГ (Г = F, Cl, Br, J)
P
Э3Р
Э2S, Э2Sn
(nmax
= 2(Li),
5(Na),
6(K, 6
Rb,
= 2 (Li),
5(Na),
(K,Cs)
Rb, Cs)
max
Модуль 2. Раздел 6. Общая характеристика химических элементов
120
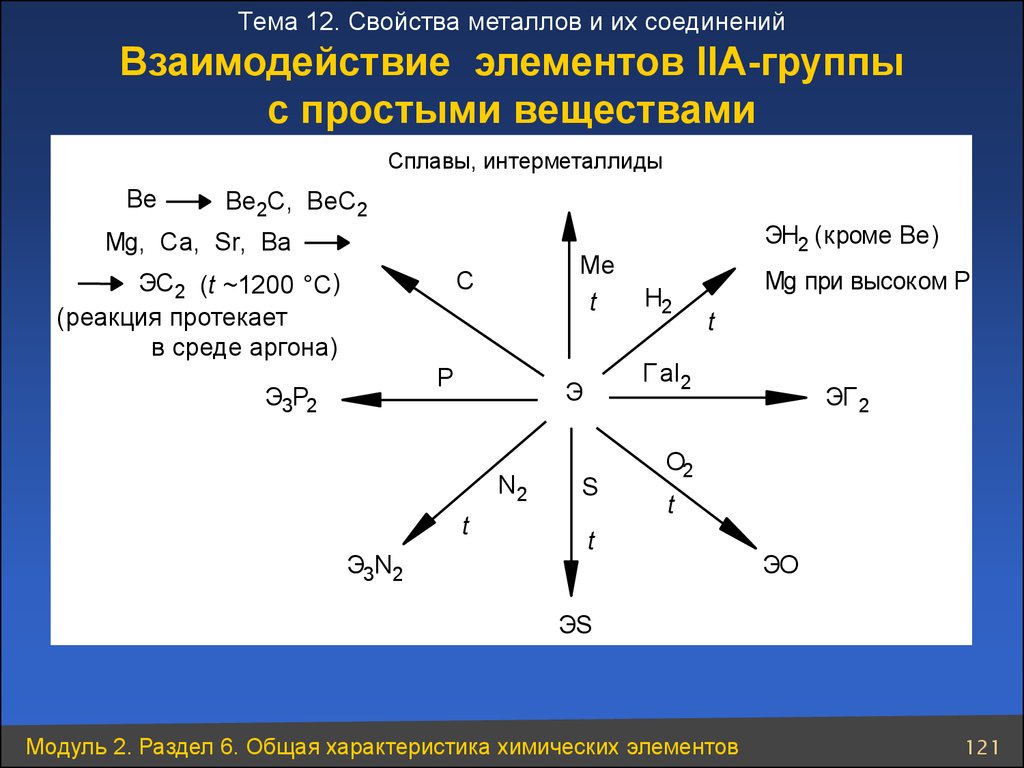
121.
Тема 12. Свойства металлов и их соединенийВзаимодействие элементов ІІА-группы
с простыми веществами
сплавы,
интерметаллиды
Сплавы,
интерметаллиды
Be
Be2C, BeC2
Mg, Ca, Sr, Ba
ЭС2 (t ~1200 °C)
(реакция протекает
в среде аргона)
C
t
P
Э3Р2
t
Н2
Mg при высоком Р
t
Г аl2
Э
N2
Э3N2
Ме
t
ЭН2 (кроме Be)
S
ЭГ 2
О2
t
t
ЭО
ЭS
Модуль 2. Раздел 6. Общая характеристика химических элементов
121
122. Руды металлов
Тема 12. Свойства металлов и их соединенийРуды металлов
Карбонаты: CaCO3 – кальцит (мел, мрамор, известняк);
SrCO3 – стронцианит; CaCO3 · MgCO3- доломит.
Сульфаты: BaSO4 – барит
CaSO4 · 2H2O – гипс; Na2SO4· 10H2O – мирабилит.
Галиды: KCl – сильвин; NaCl · KCl – сильвинит;
KCl · MgCl2 · H2O – карналлит;
3NaF· AlF3 – криолит.
Силикаты и алюмосиликаты:
ZrSiO4 – циркон; 3BeO· Al2O3· 6SiO2 – берилл;
Na2O (K2O) · Al2O3 · 2SiO2 – нефелин.
Полиметаллическиее руды:
FeTiO3 – ильменит (титанат);
CaWO4 – шеелит (вольфрамат); PbCrO4 – кроксит (хромат) и др.
Модуль 2. Раздел 6. Общая характеристика химических элементов
122
123.
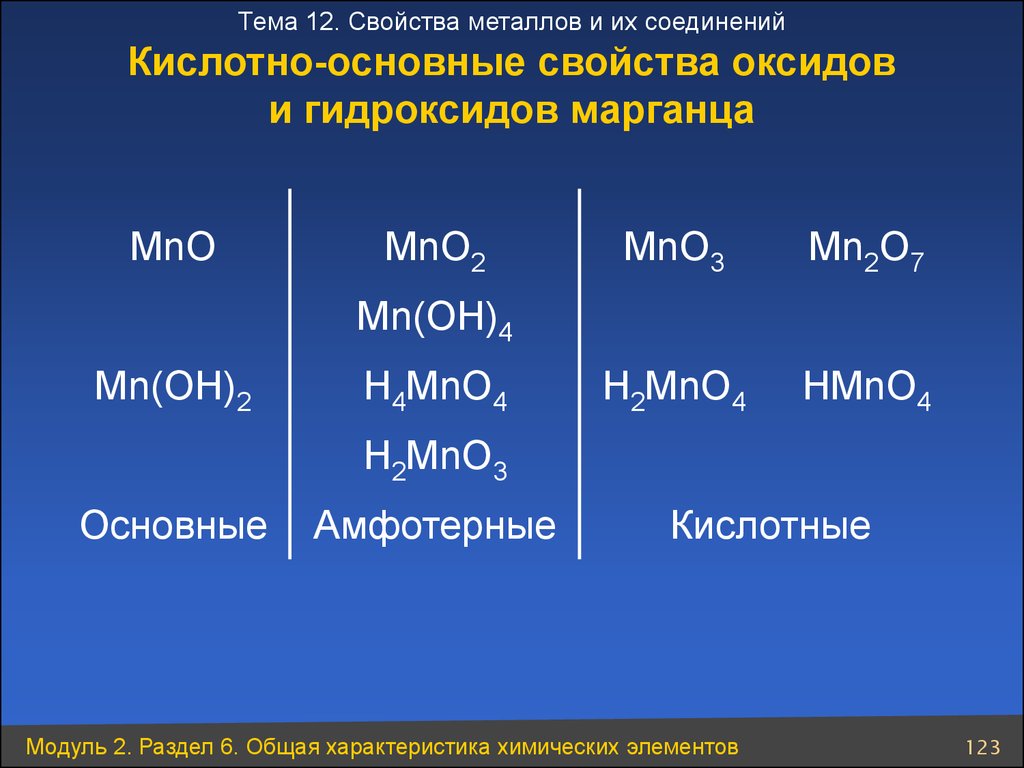
Тема 12. Свойства металлов и их соединенийКислотно-основные свойства оксидов
и гидроксидов марганца
MnO
MnO2
MnO3
Mn2O7
H2MnO4
HMnO4
Mn(OH)4
Mn(OH)2
H4MnO4
H2MnO3
Основные
Амфотерные
Кислотные
Модуль 2. Раздел 6. Общая характеристика химических элементов
123
124. Модуль 3 Химическая идентификация и анализ вещества
125.
Раздел 7.Химические и физико-химические
методы анализа
Основные принципы
качественного анализа
Титриметрический анализ
Общая характеристика физико-химических методов
анализа. Электрохимические методы:
потенциометрия, вольтамперометрия, кондуктометрия
Химическая идентификация и анализ вещества
125
126.
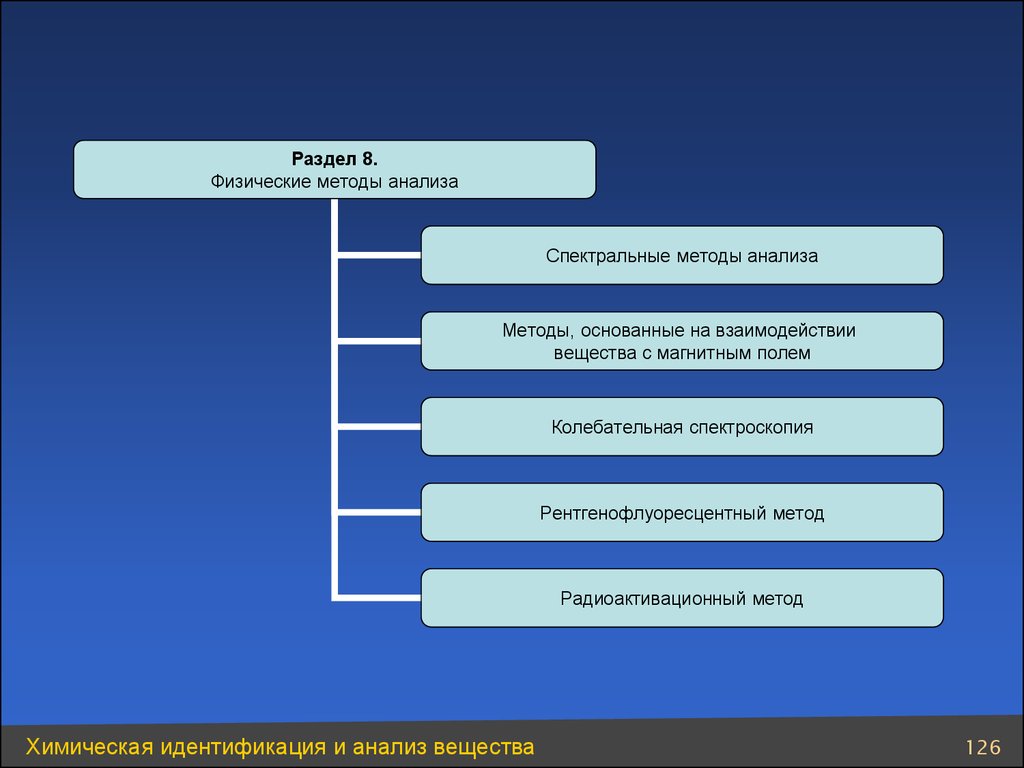
Раздел 8.Физические методы анализа
Спектральные методы анализа
Методы, основанные на взаимодействии
вещества с магнитным полем
Колебательная спектроскопия
Рентгенофлуоресцентный метод
Радиоактивационный метод
Химическая идентификация и анализ вещества
126
127.
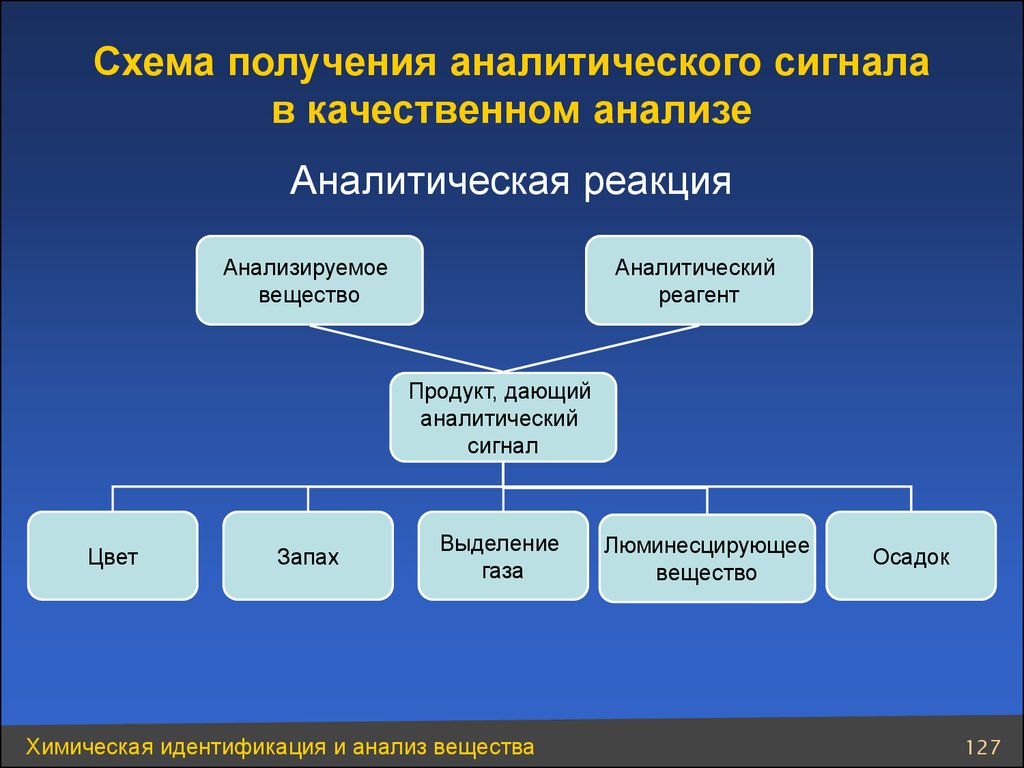
Схема получения аналитического сигналав качественном анализе
Аналитическая реакция
Анализируемое
вещество
Аналитический
реагент
Продукт, дающий
аналитический
сигнал
Цвет
Запах
Выделение
газа
Химическая идентификация и анализ вещества
Люминесцирующее
вещество
Осадок
127
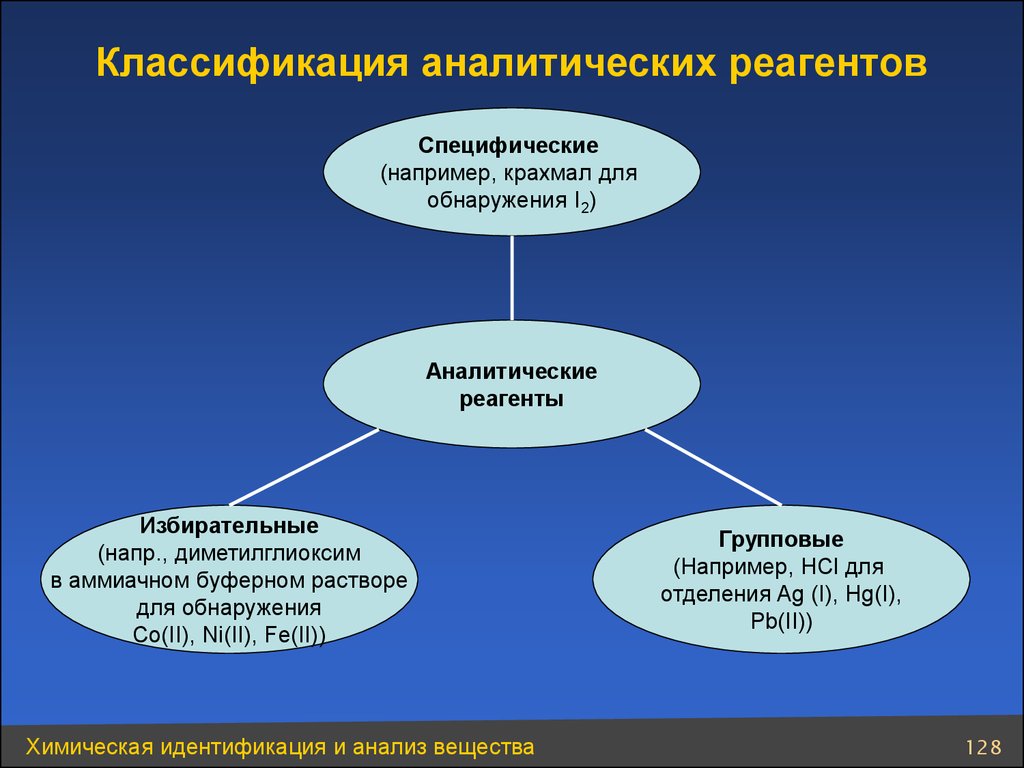
128. Классификация аналитических реагентов
Специфические(например, крахмал для
обнаружения I2)
Аналитические
реагенты
Избирательные
(напр., диметилглиоксим
в аммиачном буферном растворе
для обнаружения
Co(II), Ni(II), Fe(II))
Химическая идентификация и анализ вещества
Групповые
(Например, HCl для
отделения Ag (I), Hg(I),
Pb(II))
128
129.
Выбор способа титрованияУсловия определения
Способ титрования
1. Реакция титранта с определяемым
веществом: стехиометрична,
протекает быстро, количественно.
2. Имеется индикатор.
Прямое титрование:
анализируемый раствор +
титрант до КТТ
1. Реакция титрования протекает
медленно.
2. Определяемое вещество летучее.
3. Нет индикатора.
Обратное титрование:
анализируемый раствор +
определяемый объем стандартного
раствора; избыток стандартного
раствора + титрант до КТТ
1. Реакция титрования
нестехиометрична.
2. Определяемое вещество
неустойчиво.
3. Нет индикатора.
Титрование заместителя:
анализируемый раствор + избыток
вспомогательного раствора →
заместитель + титрант до КТТ
Химическая идентификация и анализ вещества
129





























































 chemistry
chemistry








