Similar presentations:
Обмен белков
1. ОБМЕН БЕЛКОВ
Д.б.н., профессорТамбовцева Р.В.
РГУФКСМиТ
Москва
2. ОБМЕН БЕЛКОВ В ОРГАНИЗМЕ
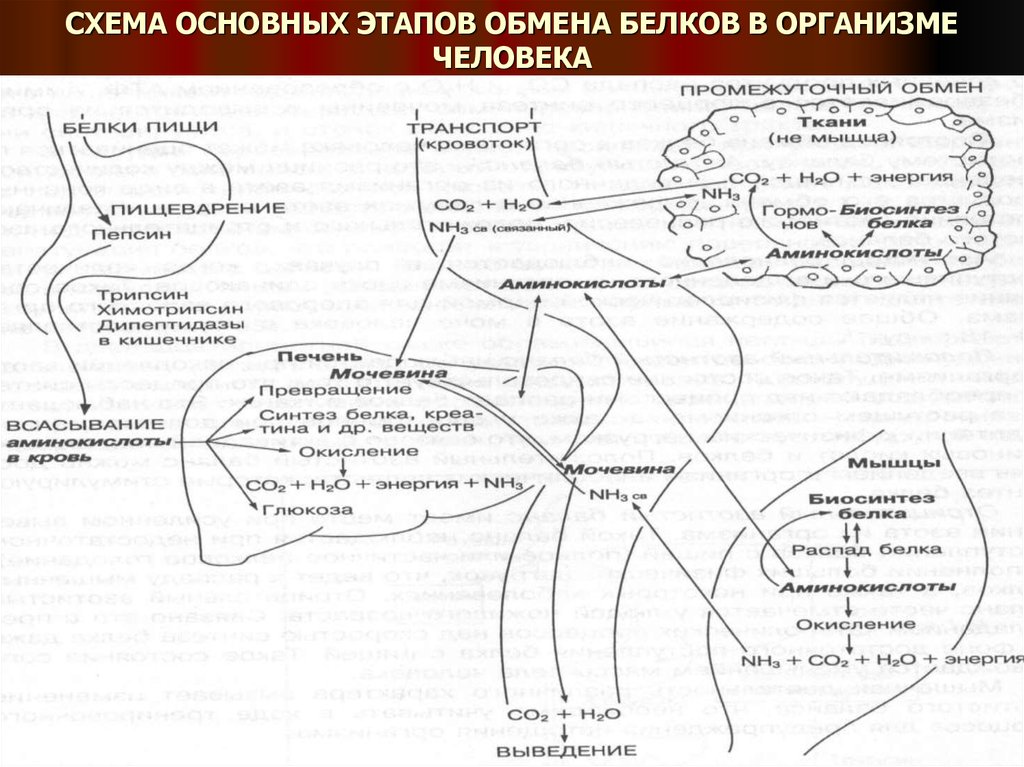
Обязательным условием жизнедеятельности организма являетсяпостоянный биосинтез белка.
Для обеспечения этого процесса необходимо поступление в организм
белков с пищей.
В ЖКТ белки пищи подвергаются ферментативному расщеплению
(гидролизу) до структурных мономеров – аминокислот, способных
проникать через стенку кишечника и всасываться в кровь.
Кровью они доставляются в ткани, где используются в основном в
биосинтезе индивидуальных белков организма и ряда других веществ или
подвергаются различным внутритканевым превращениям
(переаминированию, дезаминированию, декарбоксилированию), в
результате чего образуются органические кислоты, ацетил-КоА, амины,
свободный аммиак (NH3), обладающим токсичным действием.
Ацетил-КоА далее может окисляться в цикле трикарбоновых кислот до
конечных продуктов распада СО2 и Н2О с образованием АТФ. Аммиак
обезвреживается в процессе синтеза мочевины и выводится из организма.
Состояние обмена белков в организме человека может оцениваться по
азотистому балансу.
АЗОТИСТЫЙ БАЛАНС – это разница между количеством введенного с
пищей и выведенного из организма азота в виде конечных продуктов его
обмена, выраженная в граммах азота в сутки.
3. ОБМЕН БЕЛКОВ
Различают:1. Состояние азотистого равновесия
2. Положительного азотистого баланса
3. Отрицательного азотистого баланса
АЗОТИСТОЕ РАВНОВЕСИЕ наблюдается в случаях, когда количество поступившего и
выделенного из организма азота одинаковое. Такое состояние является
физиологической нормой для здорового взрослого организма.
Общее содержание азота в моче человека в норме составляет 10-18 г.сут.-1.
ПОЛОЖИТЕЛЬНЫЙ АЗОТИСТЫЙ БАЛАНС – наблюдается при накоплении азота в
организме. Такое состояние свидетельствует о том, что процессы синтеза
преобладают над процессами распада белков в тканях. Это наблюдается в растущем
организме, а также у спортсменов при долговременной адаптации к физическим
нагрузкам, что связано с синтезом нуклеиновых кислот и белков. Положительный
азотистый баланс можно достичь введением в организм анаболических веществ,
которые стимулируют синтез белка.
ОТРИЦАТЕЛЬНЫЙ АЗОТИСТЫЙ БАЛАНС имеет место при усиленном выведении азота
из организма. Такой баланс наблюдается при недостаточном поступлении белков с
пищей (полное или частичное белковое голодание), выполнение больших
физических нагрузок, что ведет к распаду мышечных белков, а также при некоторых
заболеваниях. Отрицательный азотистый баланс часто отмечается у людей пожилого
возраста. Связано это с преобладанием катаболических процессов над скоростью
синтеза белка даже на фоне достаточного поступления белка с пищей. Такое
состояние сопровождается уменьшением массы тела.
Мышечная деятельность вызывает изменение азотистого баланса, что необходимо
учитывать в ходе тренировочного процесса для предупреждения истощения
организма.
4. СХЕМА ОСНОВНЫХ ЭТАПОВ ОБМЕНА БЕЛКОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА
5. РАСЩЕПЛЕНИЕ БЕЛКОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ
Белки пищи в ротовой полости не расщепляются, так как слюна не содержитгидролитических ферментов
Химическое расщепление белков начинается в желудке под воздействием
протеолитических ферментов (пептидгидролаз), которые расщепляют пептидные
связи между аминокислотами:
Н
|
R1 – C – N – R2 + H2O R1 – C – OH + R2 – NH2
||
||
O
O
Ферменты (пептидогидролазы) образуются клетками слизистой оболочки желудка,
тонкого кишечника и поджелудочной железы в неактивной форме. Такая форма
ферментов предотвращает самопереваривание белков в клетках, где они
синтезируются, и стенок желудочно-кишечного тракта.
В желудке переваривание белков происходит при участии фермента желудочного
сока пепсина, который образуется из неактивного пепсиногена под воздействием
соляной кислоты.
Пепсин проявляет максимальную ферментативную активность в сильно кислой среде
при рН 1-2.
Под воздействием соляной кислоты происходит набухание и частичная денатурация
белков, что приводит к увеличению поверхности соприкосновения белков в желудке.
Пепсин расщепляет пептидные связи белковых молекул, в результате чего
образуются высокомолекулярные пептиды и простетические группы.
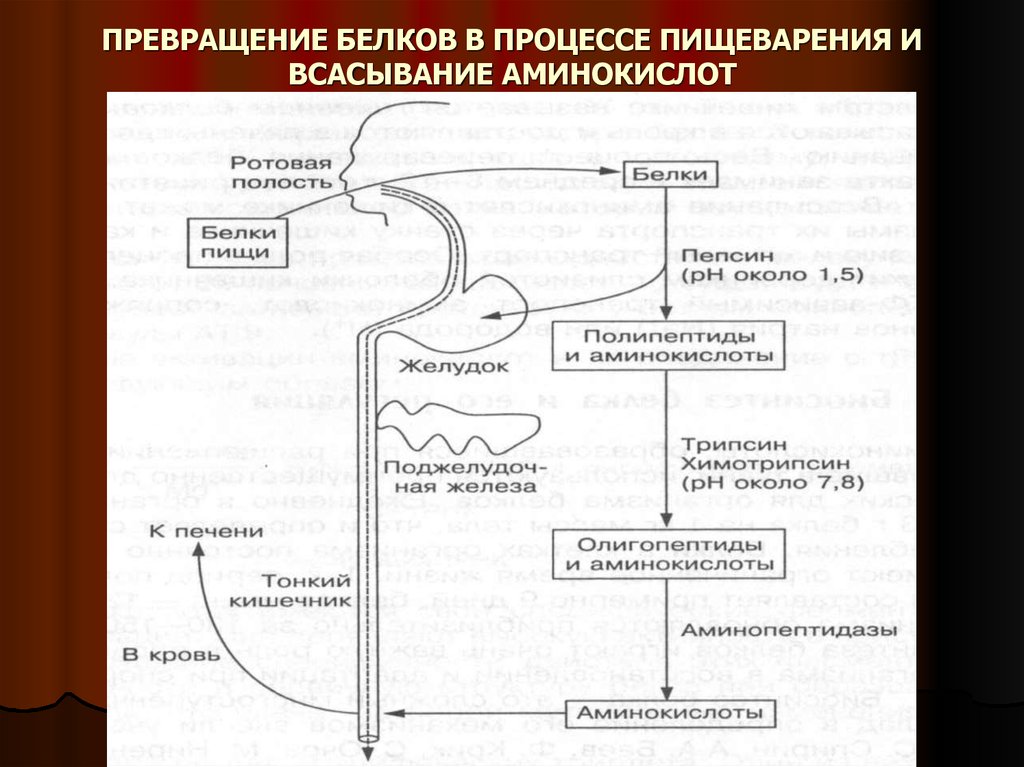
6. РАСЩЕПЛЕНИЕ БЕЛКОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ
В двенадцатиперстной кишке образовавшиеся пептиды подвергаются дальнейшемурасщеплению при участии ферментов поджелудочной железы и кишечного сока
трипсина и химотрипсина.
Поджелудочная железа вырабатывает неактивный фермент трипсиноген, который
под действием фермента слизистой оболочки тонкого кишечника – энтерокиназы
превращается в активный трипсин.
Трипсин воздействует на другой неактивный фермент химотрипсиноген, превращая
его в активный химотрипсин.
Трипсин и химотрипсин проявляют максимальную активность в слабощелочной среде
при рН=7,8. Они расщепляют белки (пептиды и полипептиды) на более простые
соединения – низкомолекулярные пептиды (олигопептиды) и некоторое количество
свободных аминокислот.
Окончательное расщепление низкомолекулярных пептидов до аминокислот
происходит в тонком кишечнике под действием высокоспецифических ферментов
аминопептидаз, карбоксипептидаз и дипептидаз.
Превращение белков, как и углеводов, происходит не только в полости кишечника, но
и на поверхности клеток слизистой оболочки (контактное или пристеночное
пищеварение).
В полости кишки расщепляются преимущественно белковые молекулы, а на
поверхности клеток (между микроворсинками) – относительно небольшие пептиды.
Образовавшиеся свободные аминокислоты и некоторые простые пептиды при
помощи сложных биохимических процессов всасываются в кровь и доставляются в
печень и другие ткани.
7. ПРЕВРАЩЕНИЕ БЕЛКОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ И ВСАСЫВАНИЕ АМИНОКИСЛОТ
8. РАСЩЕПЛЕНИЕ БЕЛКОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ
Белки, не расщепившиеся в тонком отделе кишечника, подвергаютсярасщеплению в толстом кишечнике под воздействием пептидаз, которые
синтезируются микрофлорой кишечника.
Ферменты микрофлоры толстого кишечника способны расщеплять многие
аминокислоты пищи с образованием различных токсичных веществ:
индол, фитол, скатол, крезол, сероводород, меркаптаны и др.
Такое превращение аминокислот в толстом кишечнике называют
гниением белков.
Токсические вещества всасываются в кровь и доставляются в печень, где
обезвреживаются.
Весь процесс переваривания белков в ЖКТ продолжается 8-12 часов
после принятия пищи.
Всасывание аминокислот в кишечнике может включать разные
механизмы их транспорта через стенку кишечника и капилляров: осмос,
диффузию и активный транспорт.
Особая роль в процессе всасывания принадлежит ворсинкам слизистой
оболочки кишечника, в которых происходит АТФ-зависимый транспорт
аминокислот, сопряженный с транспортом ионов натрия (N+) или
водорода (Н+).
9. БИОСИНТЕЗ БЕЛКА И ЕГО РЕГУЛЯЦИЯ
Аминокислоты, образовавшиеся при расщеплении белков пищи и поступившие вткани, используются преимущественно для биосинтеза специфических для организма
белков.
Ежедневно в организме образуется около 1,3 г белка на 1 кг массы тела, что и
определяет суточную норму его потребления.
Белки в клетках организма постоянно синтезируются, так как имеют ограниченное
время жизни. Период полураспада белков печени составляет 9 дней, белков мышц –
120 дней. Все белки организма обновляются за 130-150 суток.
Процессы биосинтеза белков играют важную роль в процессах роста и развития
организма в восстановлении и адаптации при спортивной деятельности.
Биосинтез белка – это сложный многоступенчатый процесс. Большой вклад в
определение его механизмов внесли ученые А.М.Белозерский, А.С.Спирин, А.А.Баев,
Ф.Крик, С.ОЧОА, М.Ниренберг и др.
Основная роль в определении структуры синтезируемых белков принадлежит ДНК.
Последовательность и набор аминокислот в белковой молекуле определяются
последовательностью нуклеотидов в молекуле ДНК.
Каждая аминокислота кодируется тремя расположенными рядом нуклеотидами
(триплетами) – кодонами. Четыре нуклеотида (А, Г, Т, Ц), входящие в состав ДНК,
могут образовывать 64 разных триплета, которые способны кодировать все 20
основных аминокислот.
Сами ДНК непосредственного участия в синтезе белка не принимают. Они находятся в
ядре клетки и содержат генетическую информацию о структуре белка. Синтез белка
происходит в рибосомах – клеточных структурах, находящихся в цитоплазме.
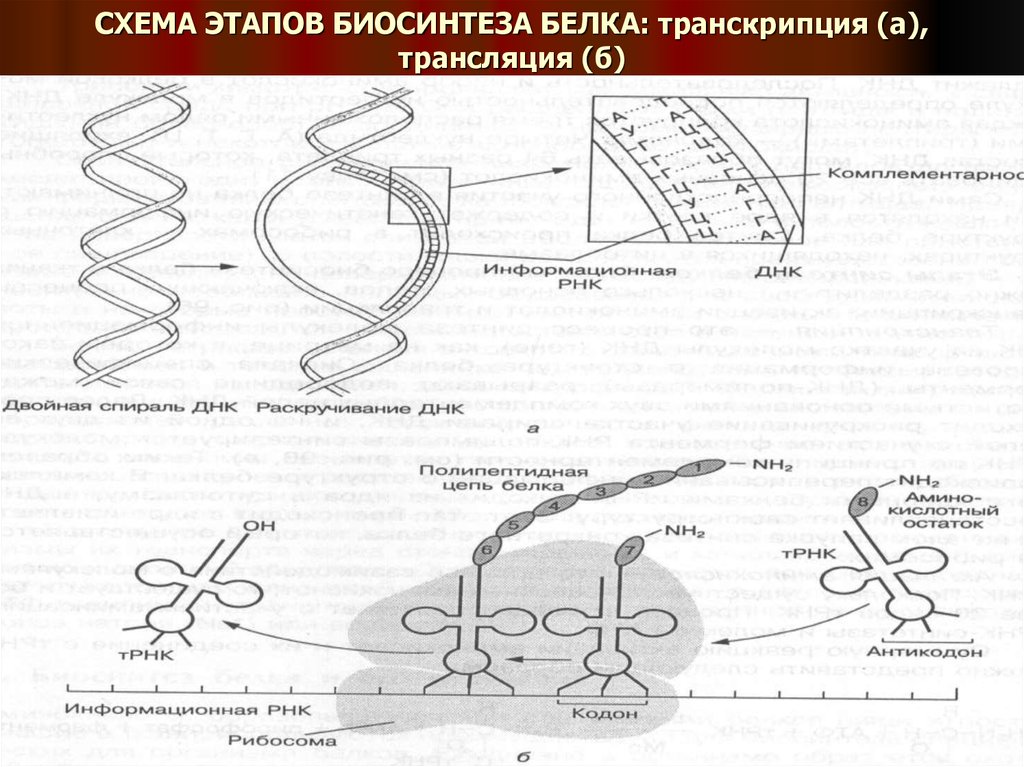
10. ЭТАПЫ СИНТЕЗА БЕЛКА
ТРАНСКРИПЦИЯ – это процесс синтеза молекулы информационной РНК на участкемолекулы ДНК (гене), как на матрице, в котором закодирована информация о
структуре белка.
Сначала специфические ферменты (ДНК-полимеразы) разрывают водородные связи
между азотистыми основаниями двух комплементарных цепей ДНК. Далее
происходит раскручивание участка спирали ДНК, и на одной из двух ее цепей с
участием фермента РНК-полимеразы синтезируется молекула иРНК по принципу
комплементарности. Таким образом происходит переписывание информации о
структуре белка.
В комплексе с ядерными белками иРНК выходит из ядра в цитоплазму, а ДНК
восстанавливает свою структуру.
Этот этап происходит в ядре и является началом запуска синтеза конкретного белка,
который осуществляется на рибосомах.
Активация аминокислот – это процесс взаимодействия с молекулами тРНК.
Поскольку существует 20 основных аминокислот, то существует и более 20 видов
тРНК. Процесс активации протекает с участием аминоацил-тРНК-синтетазы и
молекулы АТФ.
Суммарная реакция активации аминокислот и их соединение с тРНК:
11. БИОСИНТЕЗ БЕЛКА И ЕГО РЕГУЛЯЦИЯ
Молекулы тРНК имеют по два специфических триплета. Один из них – кодон, скоторым связывается аминокислота, другой – антикодон, который соответствует
кодону данной аминокислоты в иРНК.
Благодаря этому аминокислоты при синтезе белка располагаются в
последовательности, диктуемой последовательностью кодонов в иРНК.
Активированные аминокислоты доставляются к рибосомам.
ТРАНСЛЯЦИЯ – это процесс синтеза полипептидной цепи белка на рибосомах, в ходе
которого происходит передача информации из молекулы иРНК в определенную
последовательность аминокислот синтезирующегося белка.
Молекула иРНК передвигается между двумя субъединицами рибосомы – малой (30 S)
и большой (50 S). К малой субъединице присоединяется иРНК, а к большой – фермент,
синтезирующий белок (пептидил-трансфераза).
При передвижении иРНК между двумя субъединицами рибосом кодоны иРНК
взаимодействуют с интикодонами тРНК по принципу комплементарности. При этом
специальные ферменты катализируют присоединение аминокислотного остатка к
нарастающей полипептидной цепи. Этот процесс активирует рРНК.
Завершение биосинтеза белка обеспечивается кодонами терминации (стоп-сигналом)
в иРНК – УАА, УАГ и УГА, с которой не может связаться ни одна тРНК.
Поэтому процесс завершения биосинтеза белка называется терминацией.
Затем включается фактор освобождения и полипептидная цепь белка отделяется от
рибосом.
Сложная третичная структура молекулы белка формируется самопроизвольно в
цитоплазме и определяется характером первичной структуры белка, а также
условиями его окружения.
12. СХЕМА ЭТАПОВ БИОСИНТЕЗА БЕЛКА: транскрипция (а), трансляция (б)
13. РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКА
Синтез белка требует огромного количества АТФ.Процесс синтеза белка зависит от скорости восстановления уровня АТФ в клетках.
Механизмы регуляции белкового синтеза играют существенную роль в процессах
адаптации организма к мышечной деятельности, так как обеспечивают увеличение
или появление новых адаптивных белков в мышцах и других тканях.
Регуляция белкового синтеза возможна на всех его этапах:
1. На уровне транскрипции данного гена
2. Отбора и транспорта иРНК из ядра в цитоплазму
3. Включения иРНК в процесс трансляции на рибосомах.
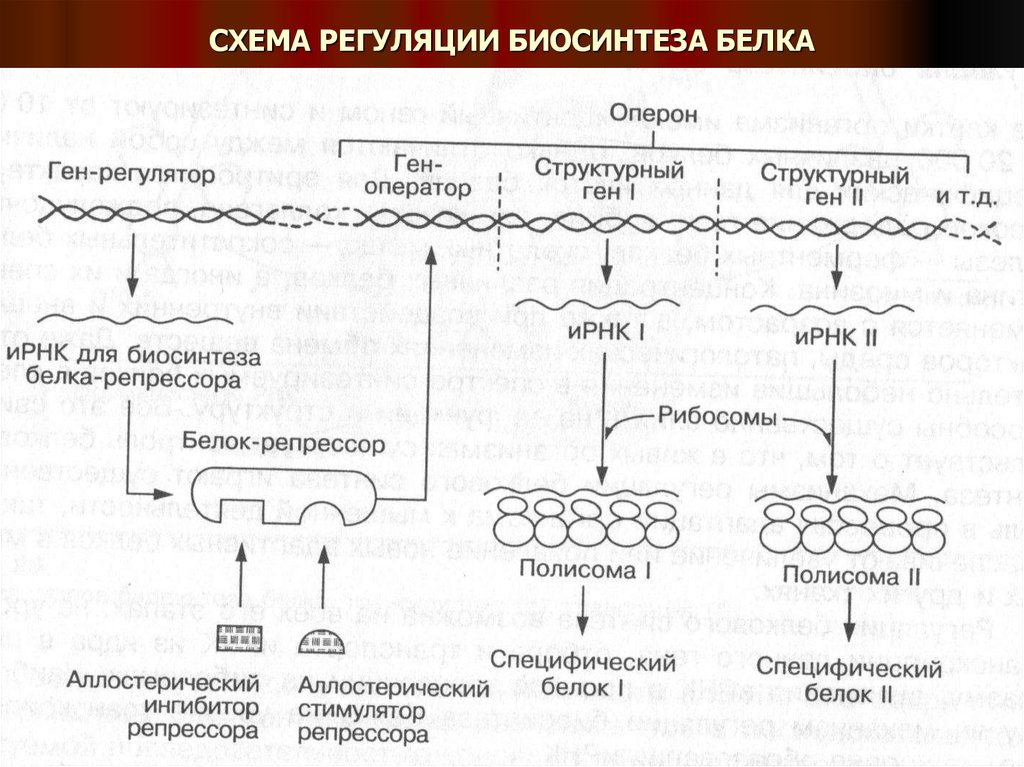
В молекуле ДНК имеются различные типы генов:
1. Система нескольких структурных генов, несущих генетическую информацию о
структуре кодирующих белков.
2. Гены-операторы
3. Гены-промоторы, составляющие оперон
4. Регуляторные гены.
Регуляция генетического аппарата осуществляется с участием специфических
веществ – индукторов и репрессоров.
Деятельность оперона в качестве поставщика иРНК контролируется геномоператором, функция которого контролируется пространственно изолированным от
него геном-регулятором, обеспечивающим синтез белка-репрессора.
Именно свободный белок-репрессор связывается с геном-оператором и блокирует
функцию оперона либо переводит его в неактивное (репрессорное) состояние.
14. РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКА
Белок-репрессор подвержен воздействию аллостерических индукторов,которые соединяются с ним и изменяют его структуру, что стимулирует
или ингибирует возникновение репрессора с геном-оператором
Механизм индукции синтеза белка: молекулы индуктора связываются с
белком-репрессором, что способствует освобождению гена-оператора и
запуску синтеза определенной иРНК (транскрипции). Важную роль в
регуляции активности ферментов РНК-синтетаз играют циклический АМФ,
уровень которого изменяется под действием гормонов, а также отдельных
гормонов (стероиды) и некоторых метаболитов.
В медицинской и спортивной практике широко используются
фармакологические препараты, являющиеся индукторами синтеза белка
– анаболики
АНАБОЛИКИ – эндогенные (внутриклеточные) и экзогенные
(внеклеточные).
Экзогенные гормональные анаболические стероиды стимулируют синтез
белка на уровне процесса транскрипции.
Эндогенные анаболики являются продуктами метаболизма либо
структурным материалом для синтеза нуклеотидов и нуклеиновых кислот,
т.е. они оказывают анаболическое действие на уровне синтеза
нуклеиновых кислот.
В качестве таких индукторов синтеза белка используют ОРОТАТ КАЛИЯ,
ИНОЗИН, АДЕНИЛОВАЯ КИСЛОТА.
15. СХЕМА РЕГУЛЯЦИИ БИОСИНТЕЗА БЕЛКА
16. ВНУТРИТКАНЕВЫЙ РАСПАД БЕЛКОВ
Наряду с процессами биосинтеза белка в клетках постоянно протекают процессы ихраспада (протеолиз) с участием протеолитических ферментов.
Все белки клетки имеют определенное время жизни – от нескольких минут до
нескольких недель и более.
В процессе распада белка образуются либо аминокислоты, либо низкомолекулярные
пептиды.
Внутриклеточный протеолиз протекает в лизосомах, которые содержат большой
набор гидролитических ферментов: около 50, включающие различные протеиназы –
катепсины.
Многие из этих ферментов проявляют высокую активность в кислой среде (рН= 5,0).
В скелетных мышцах, мозге, эритроцитах и других тканях обнаружены нейтральные и
щелочные протеиназы.
Усиление лизосомального распада белков наблюдается при многих функциональных
и патологических изменениях обмена веществ.
При физических нагрузках активируется лизосомальный протеолиз белков в
скелетных мышцах, печени и других тканях, особенно в нетренированном организме,
что связано с адаптивной перестройкой метаболизма в этих тканях.
В тренированном организме физические нагрузки вызывают значительные
разрушения внутриклеточных белков.
Распад белков в лизосомах активируется при голодании, а также при заболевании
диабетом, ревматоидным артритом, что приводит к дистрофичному состоянию.
Кроме лизосомного в клетках происходит АТФ-зависимый распад чужеродных и
собственных белков с участием специфических белков.
17. ВНУТРИКЛЕТОЧНОЕ ПРЕВРАЩЕНИЕ АМИНОКИСЛОТ
Имеется несколько типов реакций превращения аминокислот, характерныхдля внутриклеточного обмена:
ДЕЗАМИНИРОВАНИЕ
ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ)
ДЕКАРБОКСИЛИРОВАНИЕ
ДЕЗАМИНИРОВАНИЕ
дезаминирование аминокислот связано с потерей NH2- группы и
образованием свободного аммиака и кетокислот.
Реакции дезаминирования протекают при участии ферментов дезаминаз
или оксидаз.
Различают несколько видов процесса дезаминирования:
- восстановительное
- внутримолекулярное
- гидролитическое
- окислительное
У животных и человека преобладают внутримолекулярное и
окислительное дезаминирование
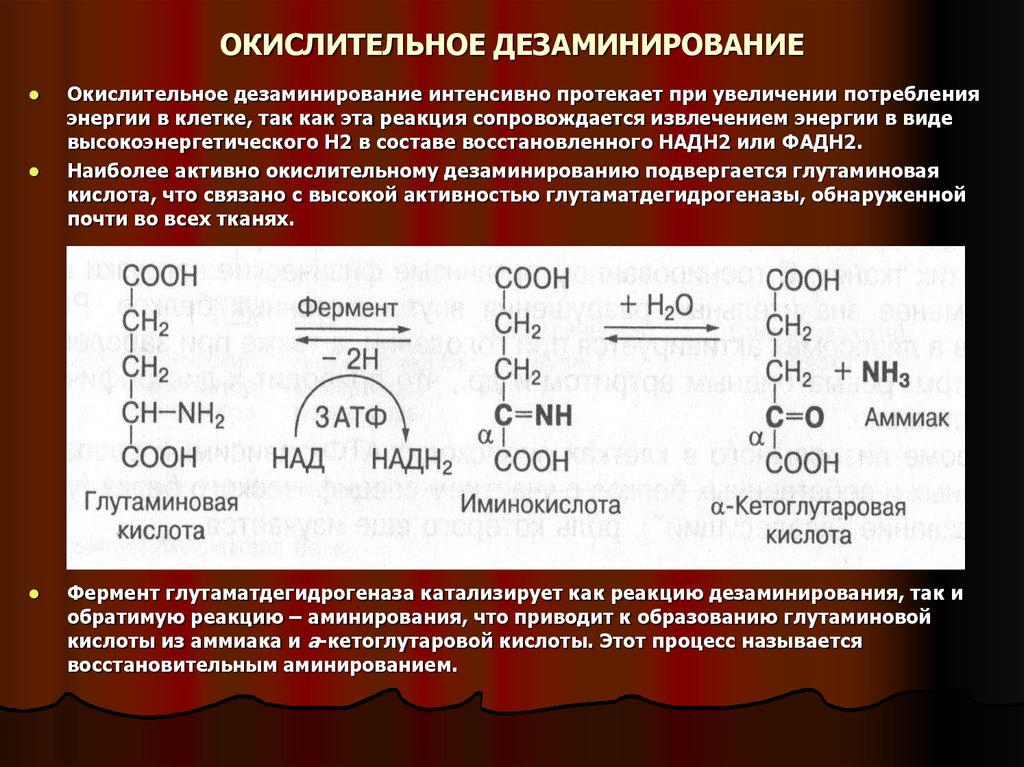
18. ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
Окислительное дезаминирование интенсивно протекает при увеличении потребленияэнергии в клетке, так как эта реакция сопровождается извлечением энергии в виде
высокоэнергетического Н2 в составе восстановленного НАДН2 или ФАДН2.
Наиболее активно окислительному дезаминированию подвергается глутаминовая
кислота, что связано с высокой активностью глутаматдегидрогеназы, обнаруженной
почти во всех тканях.
Фермент глутаматдегидрогеназа катализирует как реакцию дезаминирования, так и
обратимую реакцию – аминирования, что приводит к образованию глутаминовой
кислоты из аммиака и а-кетоглутаровой кислоты. Этот процесс называется
восстановительным аминированием.
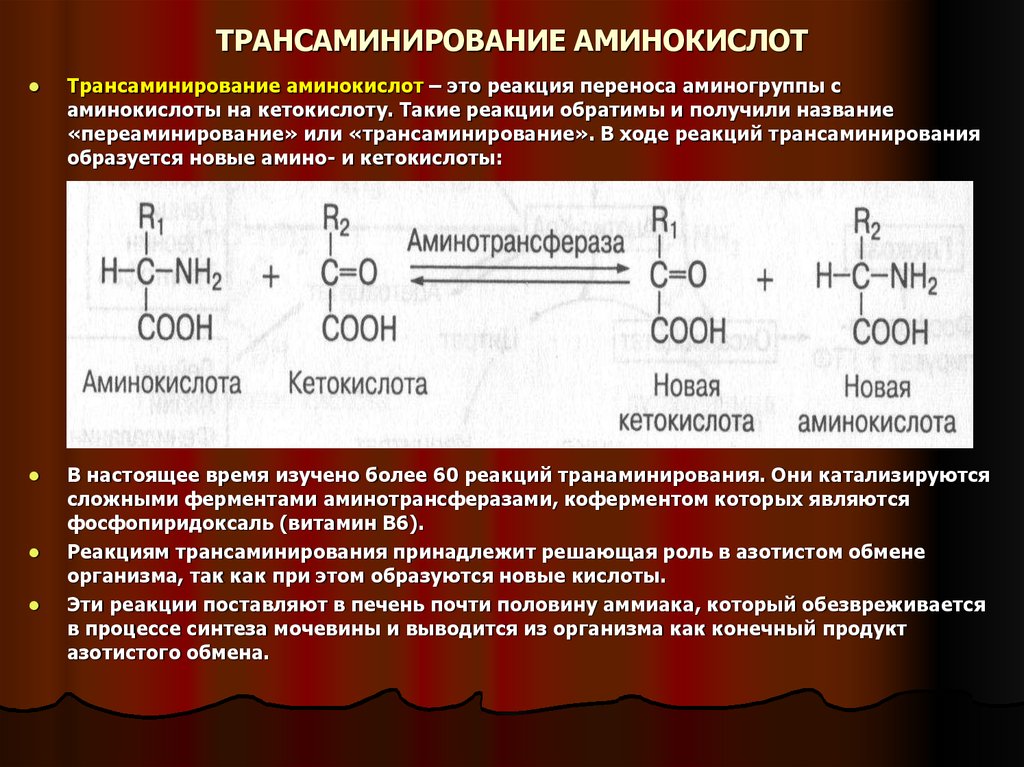
19. ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ
Трансаминирование аминокислот – это реакция переноса аминогруппы саминокислоты на кетокислоту. Такие реакции обратимы и получили название
«переаминирование» или «трансаминирование». В ходе реакций трансаминирования
образуется новые амино- и кетокислоты:
В настоящее время изучено более 60 реакций транаминирования. Они катализируются
сложными ферментами аминотрансферазами, коферментом которых являются
фосфопиридоксаль (витамин В6).
Реакциям трансаминирования принадлежит решающая роль в азотистом обмене
организма, так как при этом образуются новые кислоты.
Эти реакции поставляют в печень почти половину аммиака, который обезвреживается
в процессе синтеза мочевины и выводится из организма как конечный продукт
азотистого обмена.
20. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ
Декарбоксилирование аминокислот – это также один из путей превращенияаминокислот в тканях, связанный с отщеплением карбоксильной группы и
выделением углекислого газа (СО2).
При декарбоксилировании монокарбоновых аминокислот образуются амины и СО2.
Функционально важной реакцией, ведущее к образованию тканевого гормона
гистидина:
Реакции декарбоксилирования катализируются ферментами – декарбоксилазами
аминокислот, коферментом которых является также фосфопиридоксаль (витамин В6).
Декарбоксилирование аминокислот – необратимый процесс превращения
аминокислот, который приводит к образованию биогенных аминов, отличающихся
высокой биологической активностью.
21. ПРЕВРАЩЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ В УГЛЕВОДЫ И ЖИРЫ
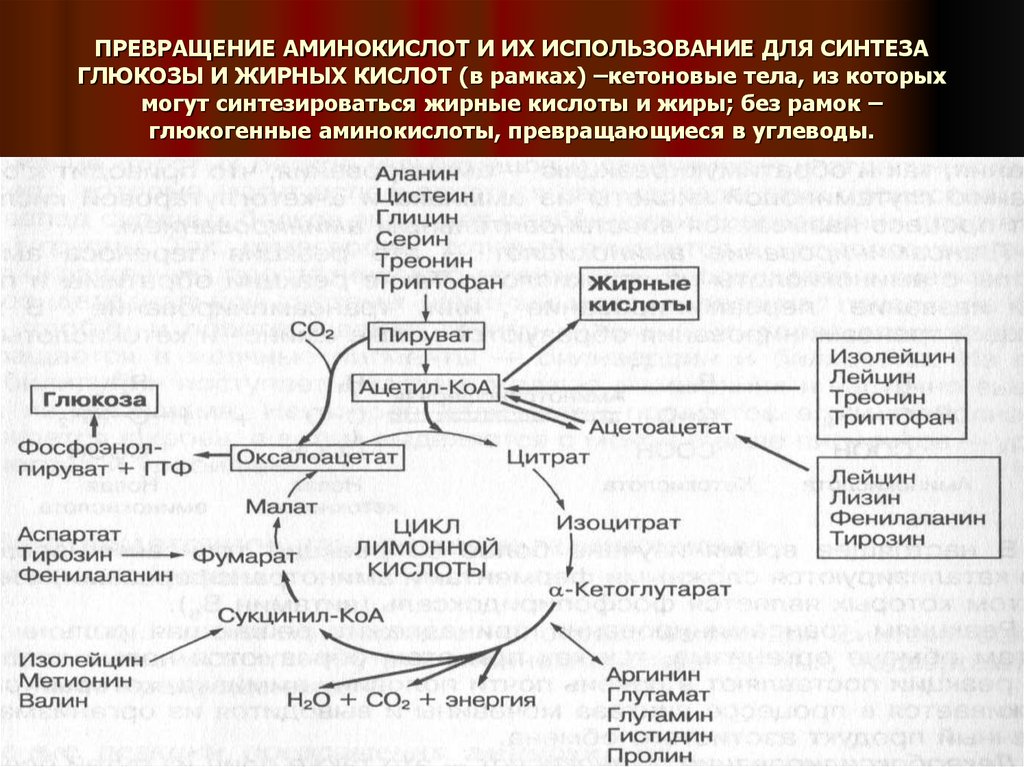
Аминокислоты имеют разные углеродные скелеты и своиметаболические пути превращения.
В процессе катаболизма они могут превращаться в
отдельные метаболиты цикла лимонной кислоты, в
пировиноградную кислоту либо в ацетил-КоА.
В дальнейшем эти метаболиты могут превращаться в
глюкозу либо в жирные кислоты и кетоновые тела.
Аминокислоты, из которых в процессе глюконеогенеза
образуется глюкоза, называются глюкогенными, а из них
образуются жирные кислоты и кетоновые тела –
кетогенными.
Часть аминокислот окисляется до конечных продуктов
обмена СО2 и Н20 с накоплением энергии.
Однако аминокислоты обеспечивают только 10-15%
энергопотребления организма.
22. ПРЕВРАЩЕНИЕ АМИНОКИСЛОТ И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ СИНТЕЗА ГЛЮКОЗЫ И ЖИРНЫХ КИСЛОТ (в рамках) –кетоновые тела, из которых могут
синтезироваться жирные кислоты и жиры; без рамок –глюкогенные аминокислоты, превращающиеся в углеводы.
23. МОЧЕВИНА - ОСНОВНОЙ КОНЕЧНЫЙ ПРОДУКТ РАСПАДА БЕЛКОВ И НУКЛЕИНОВЫХ КИСЛОТ
В процессе катаболизма белков и нуклеиновых кислот в тканях организма образуютсясвободный аммиак (NH3), а также кетокислоты и другие вещества.
Свободный аммиак – токсичное для организма вещество, особенно для мозга.
Токсичность аммиака связана с возможным локальных изменением рН в отдельных
частях клетки или заряда на клеточной мембране. Поэтому в организме существует
несколько механизмов связывания и обезвреживания свободного аммиака.
Непосредственное связывание аммиака в тканях, где он образуется, осуществляется с
участием глутаминовой и аспаргиновой аминокислот, которые превращаются в амиды
– глутамин и аспаргин.
Реакция связывания требует энергии АТЬФ и катализируется глутамин- или
аспаргинсинтетазами:
24. Мочевина – основной конечный продукт распада белков и нуклеиновых кислот
Амиды являются временной формой обезвреживания аммиака.Они легко проникают через клеточные мембраны и доставляют аммиак в печень.
В печени глутамин легко превращается в глутаминовую кислоту и свободный аммиак:
глутаминаза
Глутамин + Н20 -------- Глутамат + NH3
Доставленный в печень аммиак обезвреживается в процессе синтеза мочевины.
Часть свободного аммиака в клетках связывается в процессе образования новых
аминокислот.
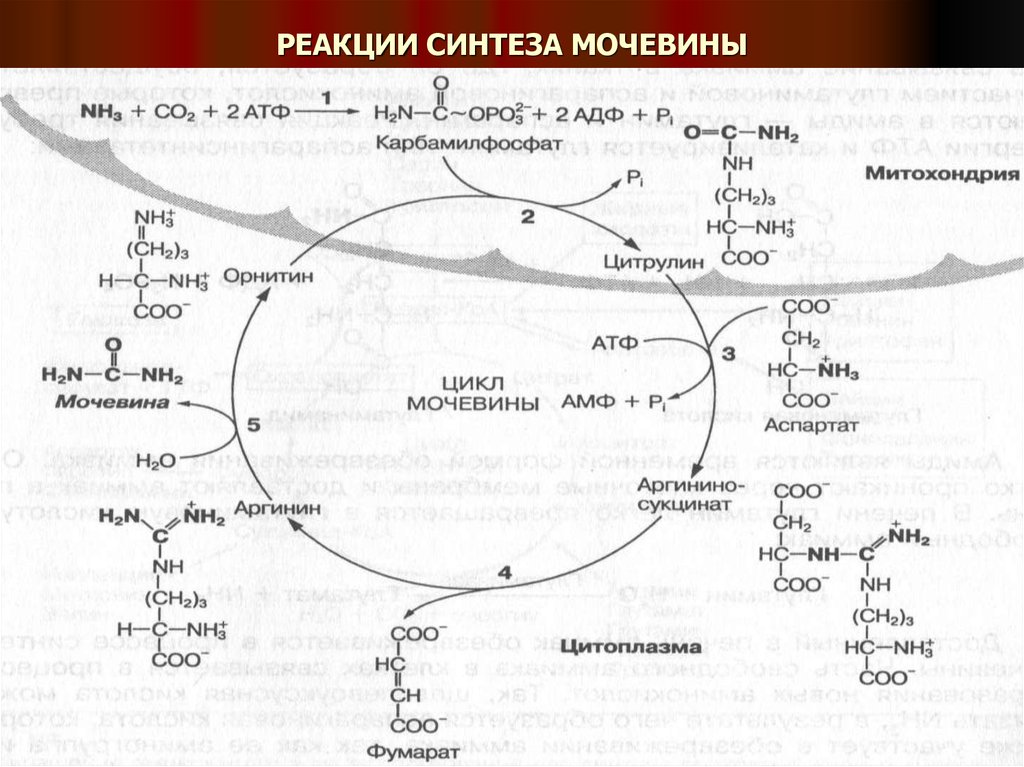
Процесс синтеза мочевины – сложный ферментативный цикл, начинающийся с
реакции, в которой участвует аминокислота орнитин, поэтому он называется
орнитиновым циклом.
Цикл включает 5 основных реакций:
1.Реакция: это взаимодействие аммиака (NH3) и углекислого газа (СО2) с участием
АТФ. В ходе этой реакции образуется высокоэнергетический карбамилфосфат (1),
который далее вступает во взаимодействие с аминокислотой орнитин с образованием
цитрулина и фосфорной кислоты (2). Эти реакции протекают в митохондриях.
Образовавшийся цитрулин из митохондрий поступает в цитоплазму, где
взаимодействует с молекулой аспаргиновой кислоты (аспартат), которая поставляет
вторую аминогруппу для синтеза мочевины (3). В этой реакции используется энергия
молекулы АТФ и образуется сложное вещество – аргининоянтарная кислота
(аргининсукцинат).
Аргининоянтарная кислота ферментативно расщепляется на фумаровую кислоту
(фумарат) и аргинин (4).
25. Мочевина – основной конечный продукт распада белков и нуклеиновых кислот
Аргинин под действием высокоспецифического фермента аргиназырасщепляется на мочевину и орнитин (5).
Образовавшийся орнитин может вступать во взаимодействие с новой
молекулой карбамилфосфата, а мочевина выводится из организма.
Суммарное уравнение синтеза мочевины:
2NH3+ СО2 +3АТФ = 3Н2О Н2N-СО-NН2 + 2АДФ + 2Н3РО4 + АМФ + Н4Р2О7
Мочевина является основным конечным продуктом обмена белков и
других азотосодержащих веществ.
С мочевиной выводится около 10-18 г общего азота организма человека,
тогда как с аминокислотами – до 1,15 г, аммонийными солями – до 1 г,
креатином – до 0,8 г, мочевой кислотой – до 0,2 г.
Мочевина из печени поступает в кровь, затем в почки и выводится с
мочой.
Содержание мочевины в крови в норме у взрослых людей – 3,3-6,5
ммоль.л-1 (20-30 мг%).
По изменению ее содержания в крови диагностируют скорость процесса
распада тканевых белков.
В практике спорта мочевина широко используется как биохимический
показатель процессов восстановления в организме после физических
нагрузок.
26. РЕАКЦИИ СИНТЕЗА МОЧЕВИНЫ
27. ОБМЕН БЕЛКОВ ПРИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Белки внося незначительный вклад в энергетику мышечной деятельности,поскольку обеспечивают только 10-15% общего энергопотребления
организма.
Тем не менее белки играют важную роль в обеспечении сократительной
функции скелетных мышц и сердца, в формировании долговременной
адаптации к физическим нагрузкам, создании определенного
композиционного состава мышц.
Физические нагрузки вызывают изменения в процессах синтеза и распада
белков в тканях, особенно в скелетных мышцах и печени, степень
выраженности которых зависит от интенсивности и длительности
физических нагрузок, а также от тренированности организма.
Изменение внутритканевого обмена белков определяет обычно по
концентрации в крови отдельных незаменимых аминокислот, которые в
организме не синтезируются и образуются при распаде тканевых белков.
В качестве специфического показателя распада сократительных белков
актина и миозина используется 3-метилгистидин.
Однократные физические нагрузки вызывают угнетение синтеза белка и
усиление их катаболизма. Например, при беге на тредмиле в течение часа
скорость синтеза белка в печени снижалась на 20 %, а при предельной
работе – на 65 %. Такая закономерность наблюдается при и в скелетных
мышцах.
Под воздействием физических нагрузок усиливается распад мышечных
белков (преимущественно структурных), хотя отдельные виды нагрузок
усиливают распад и сократительных белков.
28. ОБМЕН БЕЛКОВ ПРИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
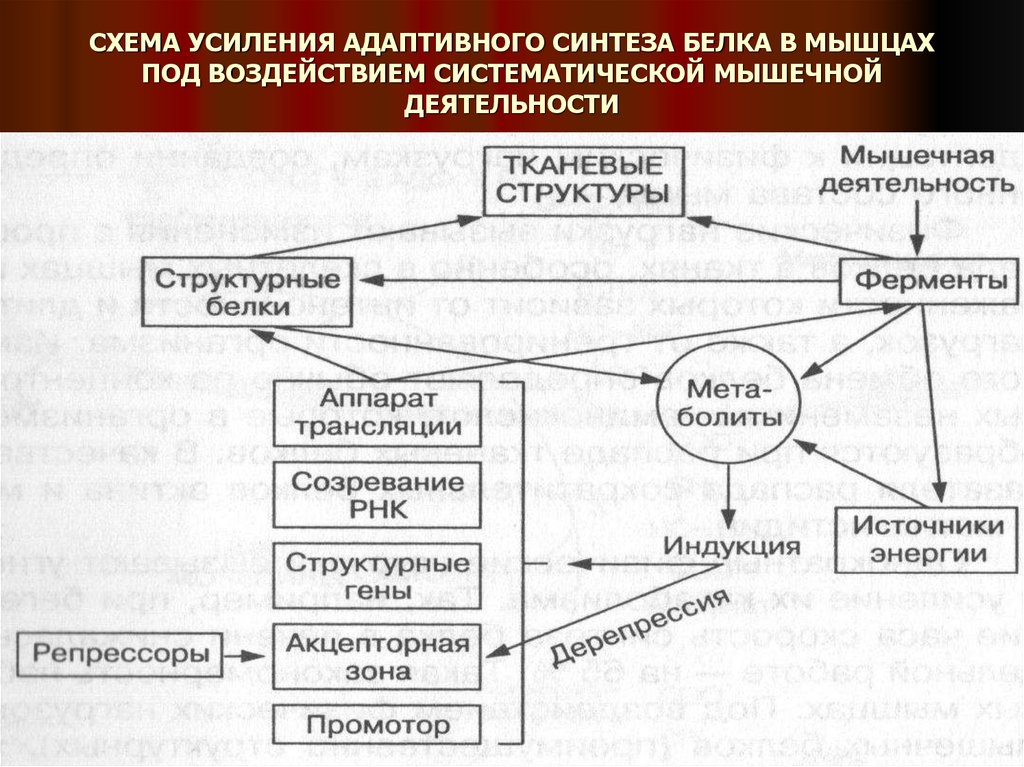
При систематических физических нагрузках в мышцах и других тканях активируетсяадаптивный синтез белков, а также миоглобина и многих ферментов.
Это приводит к увеличению мышечной массы, поперечного сечения мышечных
волокон, что рассматривается как гипертрофия мышц.
Увеличение количества ферментов создает благоприятные условия для расширения
энергетического потенциала в работающих мышцах, что усиливает биосинтез
мышечных белков после физических нагрузок и улучшает двигательные способности
человека.
Нагрузки скоростного и силового характера усиливают в большей степени синтез
миофибриллярных белков в мышцах, а нагрузки на выносливость –
митохондриальных ферментов, обеспечивающих процессы аэробного синтеза АТФ.
ПОД ВЛИЯНИЕМ ТРЕНИРОВКИ В СКЕЛЕТНЫХ МЫШЦАХ ПРОИСХОДИТ АДАПТИВНАЯ
АКТИВАЦИЯ ВСЕХ ОСНОВНЫХ ЗВЕНЬЕВ СИНТЕЗА БЕЛКА, ПРИВОДЯЩАЯ К ОБЩЕМУ
УВЕЛИЧЕНИЮ КЛЕТОЧНОГО БЕЛОКСИНТЕЗИРУЮЩЕГО ПОТЕНЦИАЛА.
В индукции адаптивного синтеза белка при тренировке важная роль принадлежит
гормонам: глюкокортикоидам, адреналину, соматотропину, тироксину, инсулину. Они
участвуют в обеспечении перехода срочных адаптивных реакций в долговременную
адаптацию.
Начало биохимической адаптации связано с повышением активности ряда ферментов
и увеличением количества энергетических субстратов.
Усиление энергетического обмена ведет к образованию метаболитов – индукторов
белкового синтеза на генетическом уровне.
Индукторами могут служить АДФ, АМФ, креатин, некоторые аминокислоты,
циклический АМФ и др.
29. ОБМЕН БЕЛКОВ ПРИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Повышение активности генома вызывает усиление процессов трансляциилибо синтеза структурных сократительных или ферментативных белков,
что обеспечивает высокую функциональную активность мышц
тренированного организма при выполнении мышечной работы.
Существенный вклад в энергетику мышечной деятельности, особенно
длительной, вносят аминокислоты – продукты распада эндогенных белков.
Количество аминокислот в тканях во время выполнения длительной
физической работы может увеличиваться в 20-25 раз.
Эти аминокислоты окисляются и восполняют АТФ либо вовлекаются в
процесс новообразования глюкозы и способствуют поддержанию ее уровня
в крови, а также уровня гликогена в печени и скелетных мышцах.
Процессы распада белков и окисления аминокислот сопровождаются
усиленным образованием аммиака (NН3) при мышечной деятельности,
который связывается в печени в цикле синтеза мочевины и выводится из
организма.
Поэтому физические нагрузки вызывают увеличение содержания мочевины
в крови, а нормализация ее уровня в период отдыха свидетельствует о
восстановлении процессов распада и синтеза белков в тканях.
30. СХЕМА УСИЛЕНИЯ АДАПТИВНОГО СИНТЕЗА БЕЛКА В МЫШЦАХ ПОД ВОЗДЕЙСТВИЕМ СИСТЕМАТИЧЕСКОЙ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
31.
БЛАГОДАРЮЗа
ВНИМАНИЕ






















 biology
biology








