Similar presentations:
Обмен белков и аминокислот
1. ЛЕКЦИЯ 3
ОБМЕН БЕЛКОВИ
АМИНОКИСЛОТ
2. ОСНОВНЫЕ ФУНКЦИИ БЕЛКОВ
структурная (эластин, коллаген);сократительная (актин, миозин);
транспортная (гемоглобин,
альбумин);
гормональная (гормоны передней
доли гипофиза, инсулин);
каталитическая (ферменты
гликолиза и др.);
иммунная (иммуноглобулины и
др.);
гемостатическая (белки
свертывания крови и др.);
рецепторная (рецепторы мембран
и др.);
энергетическая (источники АТФ и
др.);
электроосмотическая
(потенциалы возбуждения)
3.
НЕКОТОРЫЕ ОСОБЕННОСТИ ОБМЕНАБЕЛКОВ
ежедневно в организме взрослого человека
распадаются до аминокислот 200–400 г
белков;
период полураспада белков длится: одних несколько секунд и минут, других - часы, дни,
недели или даже месяцы;
в организме человека не могут
синтезироваться 8 (фен, мет, тре, три, вал,
лиз, лей, иле) из 20 протеиногенных
аминокислот. Они незаменимые;
единственным источником 8 незаменимых
аминокислот и азота являются белки пищи
4.
в организме животных нет депо аминокислот ибелков, они могут лишь перераспределяться
между отдельными тканями;
физиологический минимум белков в пище 30–
40 г/сут.;
норма белка в питании взрослого человека ≈
0,75 г/кг массы тела (50–80–100 г/сут);
белки обладают выраженной видовой и даже
индивидуальной специфичностью;
конечными продуктами распада белков в
организме животных являются высокотоксичные
аммиак (0,03 – 0,06 мМ/л),
мочевина (2,5 – 8,3 мМ/л);
для сохранения в организме азотистого баланса
белки в составе пищи должны поступать
регулярно
5. Переваривание белков в желудочно–кишечном тракте
Переваривание белков в желудочно–кишечном тракте
биологический смысл переваривания
белков - потеря видовой специфичности;
механизм переваривания - гидролиз белков;
класс ферментов – гидролазы, подкласс –
пептидазы;
типы разрушаемых связей – внутренние
(эндопептидазы), отщепление концевых
аминокислот (экзопептидазы);
все протеолитические ферменты
вырабатываются в неактивном виде
(проферменты)
6.
РОЛЬ HClактивация пепсиногена;
денатурация белков пищи;
бактерицидное действие НСl;
всасывание железа
7.
Гормоны,вырабаты
ваемые
слизистой
ЖКТ
Место
синтеза
протеолитичес
ких
ферментов
Место
действия
ферментов
рН
Пища →
гастрин,
гистамин
слизистая
желудка
полость
желудка
1,5–
2,0
Активация протеиназ
пепсиноген
трипсиноген
НCl и
химус →
секретин и
холецистокинин
поджелу–
дочная
железа
полость
тонкого
кишечника
серотонин
тонкий
кишечни
к
HCl
(медленно)
пепсин
(быстро)
энтерокиназ
а
кишечника,
трипсин
пепсин
гастрин
ренин
трипсин
трипсин
химотри
псин
проэластаза
трипсин
эластаза
↓
—ГЛИ—АЛА—
проколлагеназа
трипсин
коллаге
наза
коллаген
трипсин
карбоксипептидаза
7,0–
8,0
7,0–
8,0
↓
— Х— ТИР—
↓
— Х —ФЕН—
↓
—АРГ—Х—
↓
—ЛИЗ—Х—
↓
—ТРИ—Х—
↓
—ФЕН—Х—
↓
—ТИР—Х—
химотрипсино
ген
прокарбоксипептидаза
пристеночный
слой и
клетки
кишечного
эпителия
активатор
Специфичность
действия
эндопептидазы
профермент
активн
ый
ферме
нт
аминопептидаза
ди– и три – пептидазы
СВОБОДНЫЕ АМИНОКИСЛОТЫ
–CO–NH–CH–COOH
|
R
NH2–CH–CO–NH–CH–CO–
|
|
R
R
э
к
з
о
п
е
п
т
и
д
а
з
ы
8.
ВИДЫ КИСЛОТНОСТИ ЖЕЛУДОЧНОГОСОКА
гиперхлоргидрия – увеличение содержания свободной соляной
кислоты и общей кислотности. Она чаще всего наблюдается при
язвенной болезни желудка, двенадцатиперстной кишки, гастрите;
гипохлоргидрия – уменьшение количества свободной соляной
кислоты и общей кислотности. Наблюдается при гастрите, раке
желудка, злокачественном малокровии;
ахлоргидрия – полное отсутствие соляной кислоты; общая
кислотность значительно снижена, при этом в желудке появляются
продукты брожения: молочная, уксусная, масляная кислоты.
Наблюдается при хроническом гастрите, раке желудка,
злокачественном малокровии;
ахилия – отсутствие секреции желудочного сока, отмечается при
злокачественных образованиях желудка
9.
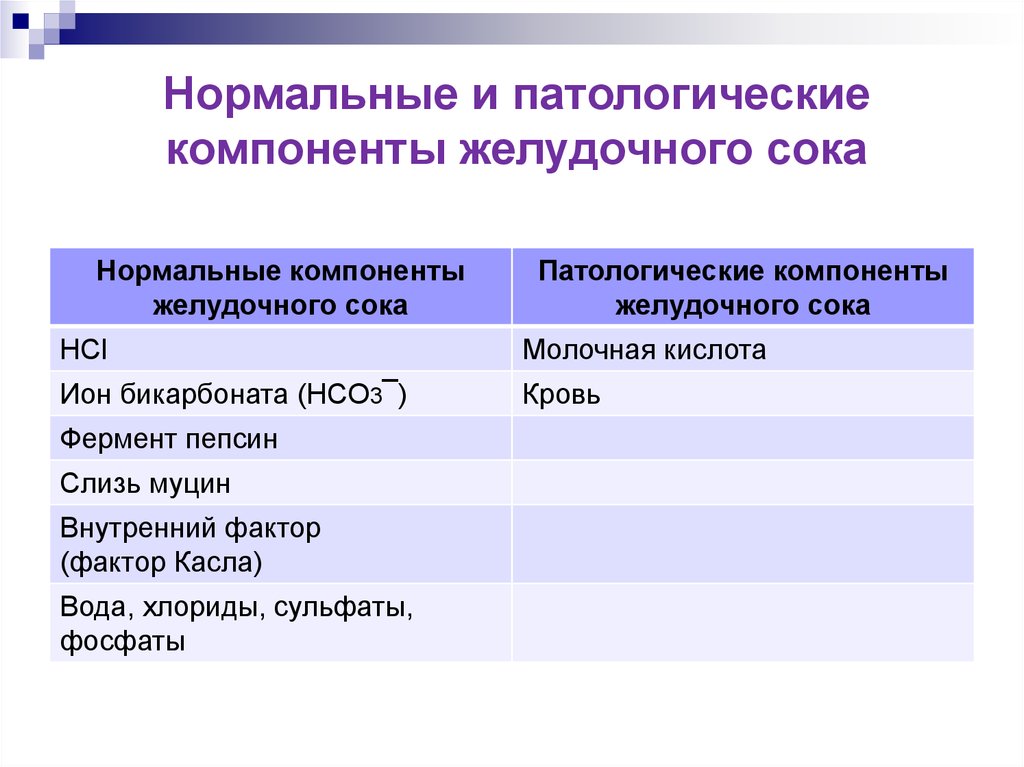
Нормальные и патологическиекомпоненты желудочного сока
Нормальные компоненты
желудочного сока
Патологические компоненты
желудочного сока
HCl
Молочная кислота
Ион бикарбоната (HCO3¯)
Кровь
Фермент пепсин
Слизь муцин
Внутренний фактор
(фактор Касла)
Вода, хлориды, сульфаты,
фосфаты
10.
ПРЕВРАЩЕНИЯ НЕГИДРОЛИЗОВАННЫХОЛИГОПЕПТИДОВ И НЕВСОСАВШИХСЯ
АМК В КИШЕЧНИКЕ (ГНИЕНИЕ)
11.
— механизмы обезвреживания (дезинтоксикации) ядовитых продуктов «гниения» белкови аминокислот в печени:
окисление продуктов гниения (гидроксилирование): скатол — скатоксил, индол —
индоксил;
присоединение серной кислоты (сульфирование)
фосфоаденозинфосфосульфат
ФАФС – арилсульфотрансфераза;
фоми
индоксилсерная кислота (животный индикан и диагностическое значение
определения его в моче);
Р
присоединение
глюкуроновой
кислоты
(глюкуронирование:
глюкоуронилтрансфераза, скатоксилглюкуроновая кислота);
УДФ
–
12.
Общие пути катаболизма аминокислот в тканях:I. путь декарбоксилирования (–СО2) и образования БАА (биологически активных аминов).
II. пути дезаминирования (–NH2) и трансаминирования
III. окисление углеводородного скелета до СО2 и Н2О и другие превращения
I. Декарбоксилирование аминокислот:
энзимы и коферменты (декарбоксилазы, В6 - пиридоксальфосфат) и схема реакции:
R
|
H2N – CH – COOH
E
R – CH2 – NH2
– CO2
— продукты декарбоксилирования, биологически-активные амины (БАА) и их
биологическая роль:
13.
Трансаминирование – переносаминогруппы (– NH2) с аминокислоты
на кетокислоту с образованием
новой кетокислоты и новой
аминокислоты (без выделения NH3)
трансаминазы
14.
Дезаминирование аминокислот– это отщепление аминогруппы
(-NH2 ) от аминокислоты в виде
аммиака (NH3) с образованием
кетокислоты
15.
Схема непрямого дезаминирования аминокислот: (трансдезаминирования)прямое окислительное
(1)
(2)
аминотрансфераза
НАД –глутаматдегидрогеназа
ллин
NH3
16.
Органоспецифические (печень, миокард) аминотрансферазы (печень – АЛТ=GPT; миокард АСТ-GOT).Аланин + α кетоглутарат
-
Аспартат + α кетоглутарат
АЛТ
п
и
р
у
в
а
т
+
г
л
у
т
а
м
а
т
GPT АСТ
оксалоацетат + глута
-
GОT
м
а
т
— В миокарде АСТ > АЛТ
— В печени АЛТ > АСТ
— Коэффициент де Ритса у здоровых лиц АСТ/АЛТ в плазме крови = 1,33 ± 0,42; при
инфаркте резко возрастает, при гепатитах понижается до 0,6;
17.
БИОСИНТЕЗ МОЧЕВИНЫВСЕ АМИНОКИСЛОТЫ
трансаминирование
УДАЛЕНИЕ ЧЕРЕЗ
ПОЧКИ
α–КЕТОГЛУТАРОВАЯ
ГЛУТАМАТ
МОЧЕВИНА
ГЛУТАМАТ
АРГИНИН
NH4+
+СО2+2АТФ
ФУМАРАТ
КАРБАМОИЛ–Р
ЦИТОПЛАЗМА
АРГИНИНОСУКЦИНАТ
АСПАРТАТ
АТФ
ГЛУТАМАТ
α–КЕТОГЛУТАРОВАЯ КИСЛОТА
трансаминирование
ВСЕ АМИНОКИСЛОТЫ
МИТОХОНДРИЯ
Затраты
энергии –
3 АТФ
18.
ОСОБЕННОСТИ ОБМЕНАСЕРУСОДЕРЖАЩИХ АМИНОКИСЛОТ
S-аденозилметионин
адреналин
тимин
Серин
Этаноламин
холин
НО-СН2-СН2-N
(СН3)3
СН
СООН
карнитин
катехоламинов;
креатина;
карнитина:
тимина;
холина.
лецитина
инактивация
метаболитов и
ксенобиотиков
СН3 -С-О-СН2-СН2-N (СН3)3
О
ацетилхолин
19.
СИНТЕЗ КРЕАТИНА И КРЕАТИНФОСФАТАМышцы, мозг
20.
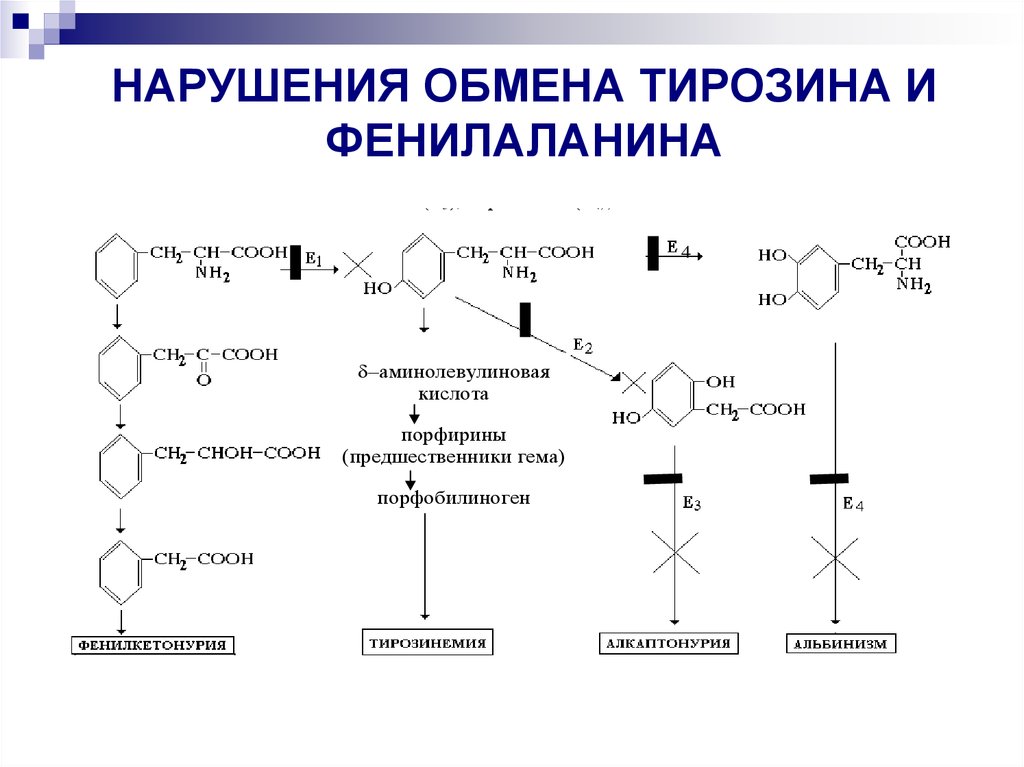
Наследственные нарушения обмена отдельных аминокислот и заболевания,которые возникают вследствие этого
НАРУШЕНИЯ
ОБМЕНА
ТИРОЗИНА
И
— причины нарушения обмена аминокислот (мутация генов, кодирующих синтез
энзимов обмена отдельных аминокислот);
ФЕНИЛАЛАНИНА
энзимы:
(дефектные
тирозина
и
фенилаланина
обмена
— нарушения
фенилаланингидроксилаза (Е1), тирозинаминотрансфераза (Е2), диоксигеназа
гомогентизиновой кислоты (Е3), тирозиназа (Е4)).
4
–аминолевулиновая
кислота
порфирины
(предшественники гема)
порфобилиноген
(300-600 мг/л)
в норме - нет
- фенилаланин, фенилпировиноградная, фенилмолочная, фенилуксусная кислоты,
тирозин, ДОФА, –аминолевулиновая кислота, порфирины, гомогентизиновая
кислота,
21.
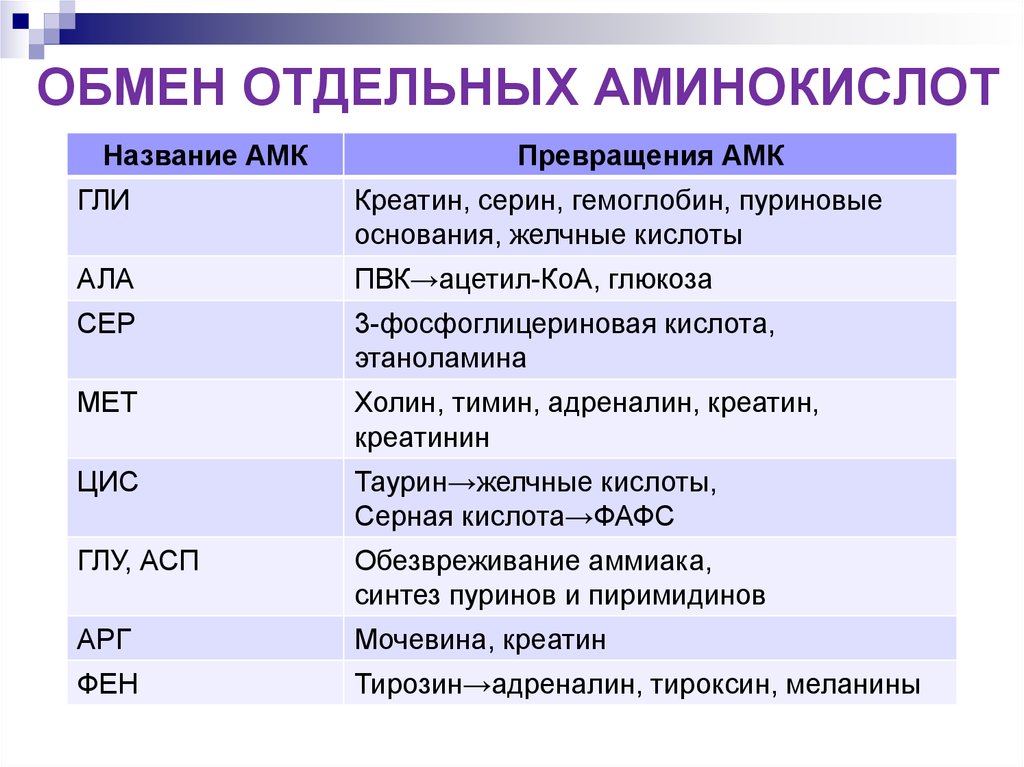
ОБМЕН ОТДЕЛЬНЫХ АМИНОКИСЛОТНазвание АМК
Превращения АМК
ГЛИ
Креатин, серин, гемоглобин, пуриновые
основания, желчные кислоты
АЛА
ПВК→ацетил-КоА, глюкоза
СЕР
3-фосфоглицериновая кислота,
этаноламина
МЕТ
Холин, тимин, адреналин, креатин,
креатинин
ЦИС
Таурин→желчные кислоты,
Серная кислота→ФАФС
ГЛУ, АСП
Обезвреживание аммиака,
синтез пуринов и пиримидинов
АРГ
Мочевина, креатин
ФЕН
Тирозин→адреналин, тироксин, меланины
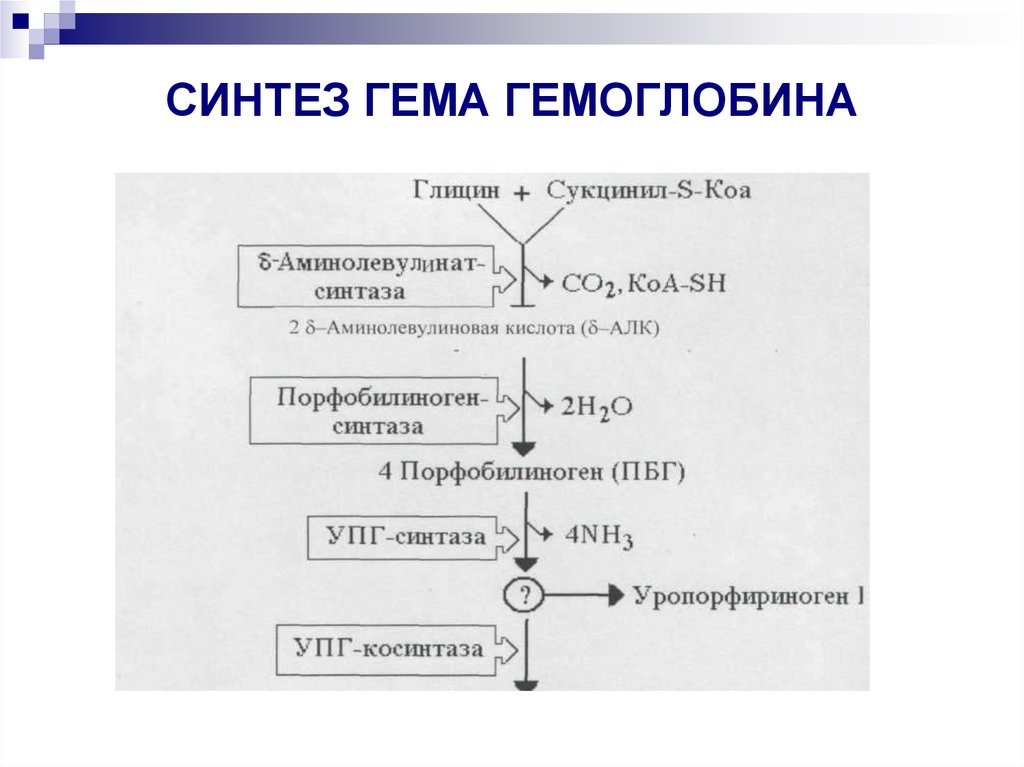
22. СИНТЕЗ ГЕМА ГЕМОГЛОБИНА
23.
24.
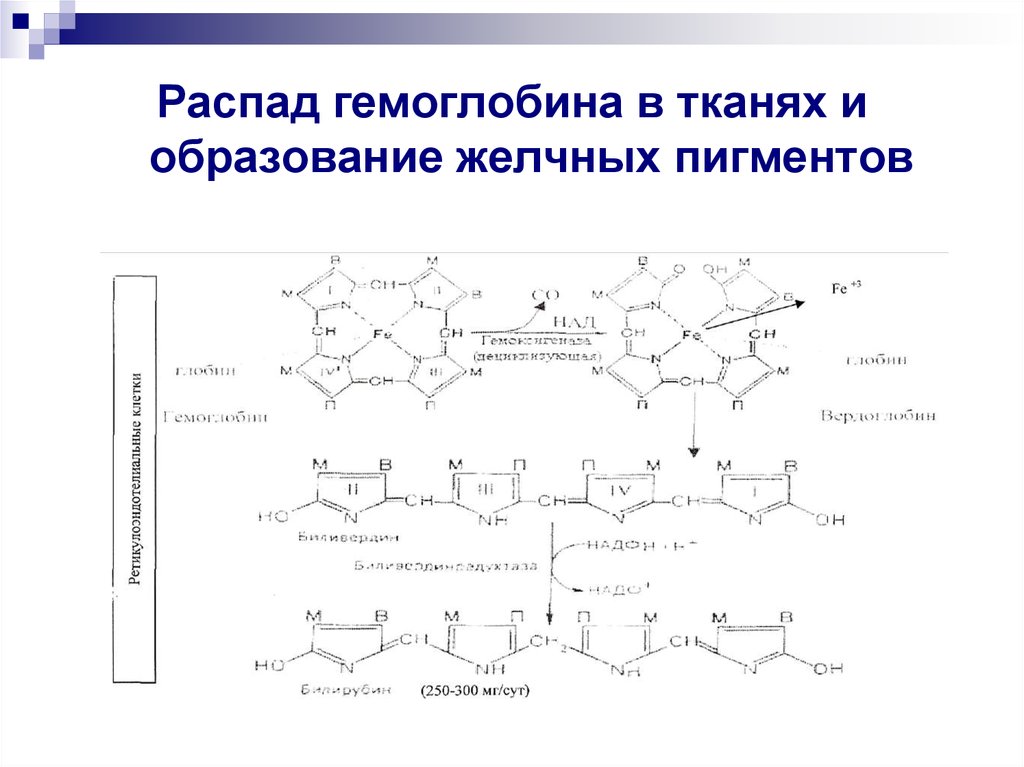
Распад гемоглобина в тканях иобразование желчных пигментов
25.
Комплекс альбумин - билирубин доставляется с токомкрови в печень
Механизм обезвреживания билирубина образование коньюгированного с глюкуроновой
кислотой нетоксичного диглюкуронида билирубина в
печени
26.
Непрямой билирубин(неконьюгированный, свободный)
Прямой билирубин
(коньюгированный, связанный)
27.
ПРЕОБРАЗОВАНИЕ БИЛИРУБИНА ВКИШЕЧНИКЕ
Схема нормального обмена уробилиногеновых тел
моно- , ди- и трипирролы
ПОЧКИ
ПЕЧЕНЬ
билирубин
мезобилирубин
мезобилиноген
(уробилиноген)
стеркобилиноген
стеркобилин
28.
1. Желтухи: (гипербилирубинемия > 50 мкмоль/л)отложение билирубина в тканях, в том числе слизистых, и окрашивание их в желтый цвет.
Дифференциальная диагностика различных типов желтух
29.
ПаренхиматознаяМеханическое нарушение
оттока желчи в
двенадцатиперстную кишку:
1. Желчный камень.
2. Опухоль
+++
(103-171 мкмоль/л)
+
+
+
N
++
+
+++
+++
+++
++
—
N или (+)
N
N или (–)
+++
–––
+→+++
N
+++
+→+++
усиленное разрушение
эритроцитов (токсикозы,
ожоги, переливание
несовместимой крови)
Непрямой
билирубин
Прямой билирубин
конъюгированный
Билирубин мочи
Уробилиноген мочи
(стеркобилиноген и
мезобилиноген)
Стеркобилин кала
Ферменты
ГПТ
ГОТ
Обтурационная
1. Нарушение проницаемости
гепатоцитов, т.е. захват билирубина
и выделения его с желчью.
2. Нарушение коньюгирования
билирубина.
3. Нарушение распада
мезобилиногена до ди- и трипиролов
Гемолитическая
30. ОБМЕН НУКЛЕОПРОТЕИНОВ
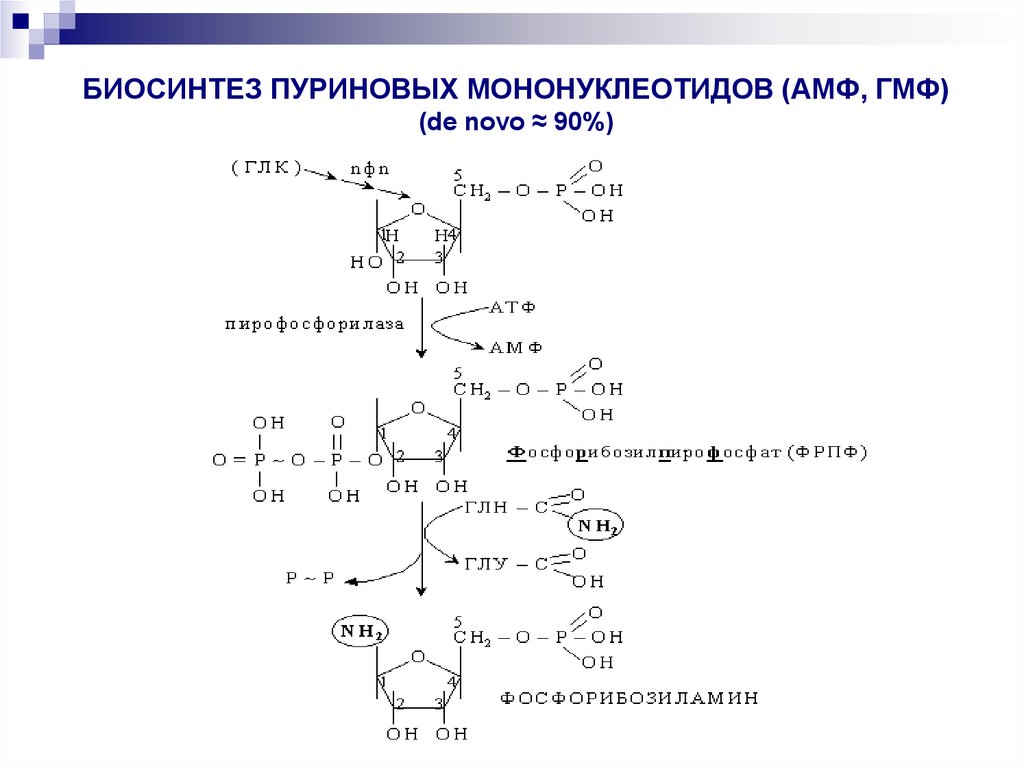
31. БИОСИНТЕЗ ПУРИНОВЫХ МОНОНУКЛЕОТИДОВ (АМФ, ГМФ) (de novo ≈ 90%)
32.
— последовательность химических реакций биосинтеза АМФ и ГМФ, а затемАДФ и АТФ, а также ГДФ и ГТФ:
(+)НАД, глутамин
ГМФ
—
(+)Аспартат
АМФ
глюкоза–рибозо–5–фосфат, 5–фосфорибозилпирофосфат, 5–фосфорибозиламин,
- инозиновая кислота, АМФ и ГМФ
?
?
АМФ
АДФ
АТФ
?
?
ГМФ
ГДФ
ГТФ
(макроэрги, окислительное или субстратное фосфорилирование)
33.
— Экстренный вариант (запасной путь) биосинтеза пуриновых мононуклеотидовАМФ и ГМФ (путь реутилизации промежуточных продуктов распада
мононуклеотидов)
(АМФ – ГМФ)
ГМФ
ФРПФ
Гуанин
Е1
ИМФ
АМФ
Гипоксантин
ФРПФ
Е2
ФРПФ
Аденин
Е1: Гуанин – Гипоксантин фосфорибозилтрансфераза
Е2: Аденин фосфорибозилтрансфераза
ФРПФ: фосфорибозилпирофосфат
Мочевая
кислота
34.
КОНЕЧНЫЙ ПРОДУКТ РАСПАДА ПУРИНОВЫХНУКЛЕОТИДОВ – МОЧЕВАЯ КИСЛОТА
NH 2
OH
N
H
N
- NH3
H
Аденозин
Гуанозин
N
ксантиноксидаза
N
2
HO
OH
N
N фад фадН
N
2
N
ксантин
оксидаза H–O
N
H
H
Гипоксантин
Аденин
NH3
N фад фадН
N
N
N
OH
N
N
N
H
мочевая кислота
Ксантин
O–H
H
OH
O
инозин
рибоза
N
рибоза
H2N
NH
N
N
N
3
H–N
N–H
H 2O
O
N
N
H
H
H
Гуанин
O
35.
НАРУШЕНИЯ СИНТЕЗА И РАСПАДА МОНОНУКЛЕОТИДОВ ПУРИНОВОГО ИПИРИМИДИНОВОГО РЯДА
1. Гиперурикемия и подагра:
в крови здорового человека 0,15 – 0,47 мМ/л мочевой кислоты (МК). В моче
присутствуют соли мочевой кислоты (ураты).
накопление МК в сыворотке крови и тканях (гиперурикемия, подагра).
Причины:
генетически детерминированное нарушение активности энзимов «запасного
пути» реутилизации пуриновых оснований.
употребление большого количества пищи, богатой нуклеопротеидами,
слабый кровоток (малоподвижный образ жизни, сердечно-сосудистые
заболевания)
при некоторых заболеваниях крови, почек, отравлении свинцом, некоторыми
лекарственными препаратами
Последствия - (из-за плохой растворимости мочевой кислоты в воде):
обильное отложение кристаллов мочекислого натрия (уратов натрия) в области
суставов
подагрические узлы – тофусы – (местное отложение и накопление уратов в мелких
суставах, сухожилиях, хрящах, коже):
лейкоциты фагоцитируют кристаллы уратов в них, разрушаются мембраны
лизосом, освободившиеся ферменты лизосом разрушают клетки, продукты
распада клетки вызывают воспаление
деформация суставов и нарушение их функции
Осложнения подагры:
отложение уратов в ткани почек (почечная недостаточность)
отложение уратов в почечных лоханках с образованием почечных камней
(мочекаменная болезнь)
у мужчин – заболевание в 20 раз чаще, чем у женщин
36.
1. Синдром Леша – Нихана:(тяжелая форма гиперурикемии):проявляется только у мальчиков)
Причина: наследственный дефект фермента «запасного пути» синтеза пуриновых
мононуклеотидов - гуанин-гипоксантин-фосфорибозилтрансферазы
Последствия:
гуанин (и гипоксантин) не используются повторно для синтеза нуклеотидов («путь
спасения»), а целиком превращаются в МК
компенсаторно усиливается образование пуриновых (и пиримидиновых)
нуклеотидов de novo.
нарушается регуляция их обмена
перепроизводство нуклеотидов и повышение в крови МК (гиперурикемия) и
фосфорибозилпирофосфата
Клинические проявления:
У детей к 2 годам развивается умственная отсталость
чрезвычайная агрессивность: дети получают удовольствие, нанося себе увечья
смерть в раннем возрасте из-за нарушения функции почек.
Лечение и предупреждение гиперурикемии и подагры :
исключение из диеты продуктов, богатых нуклеатидами (печени, икры, кофе, чая,
мяса)
применение фармакологического препарата – аллопуринола, структурного
аналога гипоксантина
аллопуринол – конкурентный ингибитор ксантиноксидазы
37.
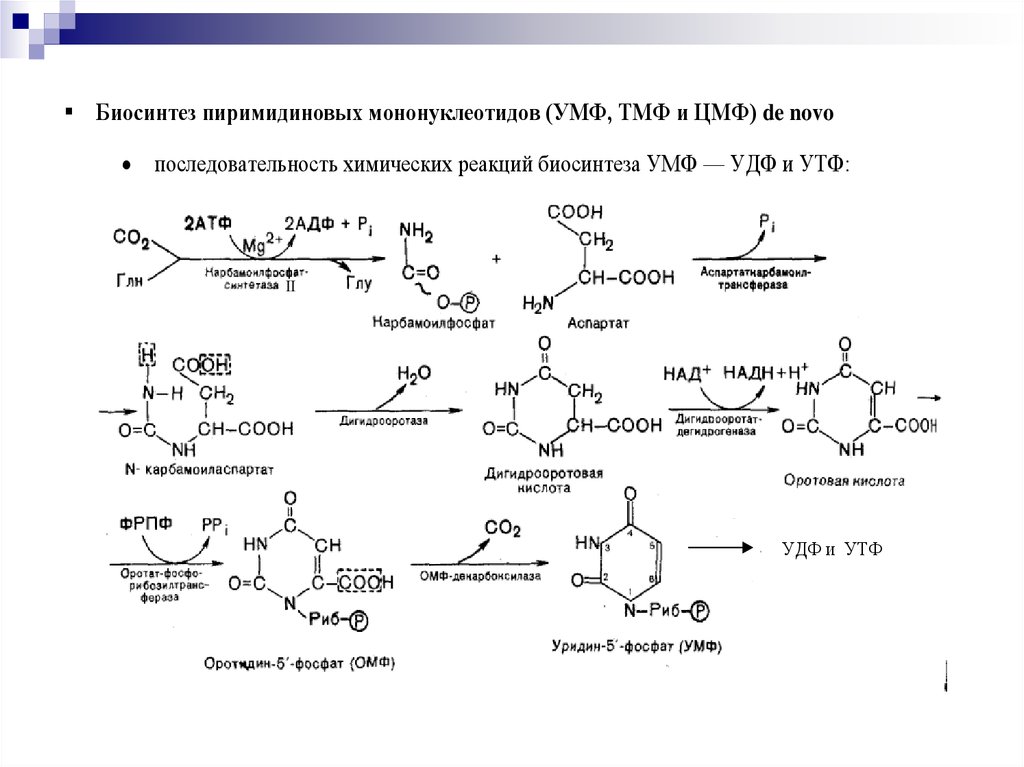
Биосинтез пиримидиновых мононуклеотидов (УМФ, ТМФ и ЦМФ) de novoпоследовательность химических реакций биосинтеза УМФ — УДФ и УТФ:
II
УДФ и УТФ
— синтез карбамоилфосфата и оротовой кислоты в цитозоле клеток (глутамин,
биотин, АТФ, карбамоилфосфатсинтетаза – II); мультиэнзимный комплекс
38.
— распад мононуклеотидов пиримидинового ряда (УМФ, ЦМФ и ТМФ) до конечныхпродуктов: мочевины, -аланина и CO2;
ЦМФ→
УМФ→
Урацил→
Дигидроурацил
1.
2. Карнозин
(анзерин)
Карнозин (+ СН3 - анзерин): дипептиды из гистидина и -аланина.
39.
1. Оротацидурия:наследственный дефект фермента (УТФ-синтетазы), катализирующего две
последние реакции синтеза УМФ (образование и декарбоксилирование
оротидиловой кислоты).
возникает недостаточность пиримидиновых нуклеотидов, необходимых для
синтеза ДНК и РНК
накопление оротовой кислоты в крови и высокая ее экскреция с мочой.
при отсутствии лечения – необратимое резкое отставание умственного и
физического развития. Больные погибают в первые годы жизни
оротовая кислота нетоксична, нарушение развития – следствие
«пиримидинового голода».
Лечение: применение уридина (без перерывов, на протяжение всей жизни)
для образования УМФ и других пиримидиновых нуклеотидов в обход
нарушенных реакций: (Уридин + АТФ
УМФ + АДФ)
Использование аналогов пурина и пиримидина как ингибиторов синтеза
нуклеотидов в химиотерапии рака
































 chemistry
chemistry








