Similar presentations:
Ионообменная хроматография
1. Ионообменная хроматография
2.
• Является частным вариантом ионнойхроматографии.
• Позволяет разделять ионы и полярные
молекулы, на основании зарядов
разделяемых молекул.
• Позволяет разделить практически
любые заряженные молекулы, в том
числе: крупные — белки, малые—
молекулы нуклеотидов и
аминокислот.
• Часто используют как первый этап
очистки белков.
3.
• Основана на обратимом обменесодержащихся в растворе ионов
электролита на подвижные ионы,
входящие в состав ионообменного
вещества (ионита).
• При этом происходит образование
хроматограмм вследствие различной
способности к обмену ионов
хроматографируемого раствора.
4.
• При фронтальном анализе исследуемый растворсмеси веществ непрерывно подают в верхнюю
часть колонки и собирают отдельные фракции
фильтрата.
• При анализе системы, содержащей компоненты
А и В, первым из колонки вытекает чистый
растворитель, затем, после насыщения
сорбента менее сорбирующимся веществом,
например В, из колонки вытекает раствор,
содержащий компонент В, а когда сорбент
насыщается компонентом А, в приемник
поступают одновременно два компонента А и
В.
• Указанным способом можно получить в чистом
виде только наименее сорбируемое вещество.
5.
• При вытеснительном анализе в колонку вводятпорцию раствора смеси, содержащей
компоненты А и В, и с помощью более
сорбирующегося вещества Д вытесняют ранее
сорбированные компоненты А и В.
• Введенное вещество Д вытесняет компонент А,
который вытесняет менее сорбируемый
компонент В.
• Происходит перемещение веществ А и В вдоль
слоя сорбента со скоростью, равной скорости
движения вытеснителя Д.
• Из колонки последовательно выходят
компоненты В и А в соответствии с их
избирательной сорбируемостью на сорбенте.
• Полнота разделения веществ зависит от
условий проведения анализа.
6.
• При элюентном анализе в колонку вводятисследуемую смесь компонентов, например, А,
В, С.
• Компоненты смеси располагают вдоль колонки
сверху вниз в перекрывающихся зонах в
соответствии с их сорбируемостью, например
А>В>С.
• Нижняя зона хроматограммы в колонке
содержит чистое вещество С.
• При элюировании (промывании) сорбента
элюентом (растворителем) вдоль колонки
происходит передвижение компонентов смеси
вследствие взаимного вытекания в
соответствии с их сорбируемостью.
• В фильтрате собирают компоненты в порядке
повышения их сорбируемости, вначале
компонент С, затем В и А.
7.
• Приблизительную закономерностьсорбируемости ионов с одинаковой
степенью окисления можно представить
в виде сорбционных рядов:
• Cs+ > Rb + >NH4+ > Na+
• Вa2+ > Sr2+ > Ca2+ > Mg2+
• Zn2+ > Сu2+ > Ni2+ > Co2+
• и т.д. - эти ряды изменяются в
зависимости от природы ионита,
хроматографируемых веществ,
внешних условий и т. д.
8. Иониты
• Ионитами называют твердыеорганические или неорганические
вещества практически нерастворимые в
воде и органических растворителях,
содержащие активные (ионогенные)
группы с подвижными ионами,
способными обмениваться на ионы
электролитов при контакте с их
растворами.
9.
• Неорганическими ионитами являютсяоксид алюминия «для хроматографии»,
пермутит и др.
• В качестве органических ионитов
применяют целлюлозу, сульфоуголь,
синтетические ионообменные полимеры
(смолы).
• Иониты особая группа полиэлектролитов,
один из ионов которых вследствие
большой ионной (молекулярной) массы
обладает малой подвижностью в отличие
от остальных подвижных ионов,
способных обмениваться на другие
ионы.
10.
• Иониты делят на три группы: катиониты,аниониты, амфолиты (амфотерные иониты).
• Катиониты - полимеры, способные обменивать
свои подвижные положительно заряженные
ионы на катионы электролитов в растворе.
• У катионитов активными группами являются
кислотные группы: -SO3H; -РО3Н2; -СООН,
которые структурно связаны с
пространственной молекулярной сеткой
ионита. Подвижными остаются только ионы
водорода этих групп или замещающие их
катионы.
11.
• Аниониты - полимеры, которыеобменивают свои подвижные,
отрицательно заряженные ионы, на
анионы электролитов в растворе.
• У анионитов активными группами
являются основные группы:-NH2;
=NH;=N- и др.
12.
• Амфотерные иониты проявляют себя каккатиониты или как аниониты в зависимости от
условий их применения.
• Важнейшей характеристикой ионитов является их
обменная емкость, которую выражают в
миллимолях поглощенных ионов на 1 г сухого
ионита или на 1 мл набухшего ионита (ммоль/г
или ммоль/мл).
• Для определения обменной емкости ионитов
существует два основных метода статический и
динамический.
• Статическим методом определяют полную
обменную емкость, т.е. обменную емкость по
отдельным активным группам ионита (СОЕ).
• В этом случае ионит непосредственно
помещают в исследуемый раствор на 24 часа и
между содержанием определяемых ионов в
растворе и ионитом возникает равновесие.
13.
• Динамическим методом определяютдинамическую обменную емкость ионита или
обменную емкость ионита до проскока
поглощающего иона (ДОЕ).
• В этом случае исследуемый раствор
пропускают через слой ионита высотой 20 см,
при скорости пропускания 0,5 л/ч и поперечном
сечении колонки 1 см-;
• при этом равновесия не наступает т.к. по мере
продвижения вниз раствор проходит сквозь
свежие порции ионита.
• В большинстве случаев СОЕ составляет около 58 ммоль/л или 5-8 мл 1 М раствора на 1 г
ионита.
• ДОЕ обычно в 3 раза меньше, чем СОЕ.
14.
Классификация ионитов
От степени диссоциации активных групп
зависит, насколько сильно выражены
основные или кислотные свойства
ионита.
В зависимости от этого различают четыре
группы ионитов.
1. Сильнокислотные катиониты,
содержащие сильно диссоциирующие
кислотные группы, например: -SO3H.
Эти катиониты способны к обмену ионов в
кислой, нейтральной и щелочной средах
(КУ-1, КУ-2, СДВ и др).
15.
• Слабокислотные катиониты, содержащиеслабо диссоциирующие кислотные
группы -СООН, -ОН и др., способны
обменивать ионы при рН>7(КБ-2, КБ-4 и
др.).
• Сильно основные аниониты, содержащие
четвертичные аммонийные группировки
– NR+. Эти аниониты способны к обмену
ионов в кислой, щелочной, нейтральной
средах (АВ-17, AB-I8 и др.).
• Слабоосновные аниониты, содержащие
основные группы -NH2; =NH;=N-. Обмен
ионов на таких анионитах происходит при
рН<7 (АН-23,АН-2Ф и др.).
16.
• Иониты, содержащие только одинаковыеионогенные группы, называются
монофункциональными, а имеющих несколько
подвижных групп называются
полифункциональными.
• Катиониты, у которых все подвижные ионы
представляют собой ионы водорода, обозначают
как Н - катиониты или Н-форма катионита.
• Если же ионы водорода замешены катионами
(Na+, Са2+ и т.д.), то применяют соответственно
обозначения Na-форма катионита.
• Аналогичны обозначения для анионитов.
• Свойства некоторых ионитов приведены в таблице.
Обменная емкость определена для катионитов
по 0,1 н NaOH, для анионитов - по 0,1 н НС1.
17.
МаркаИоногeн- Сдельный объем
ные группы
набухшего
ионита 8 мл/г
Катиониты
КУ-1
-SО3Н, - OH
КУ-2
-SО3Н
СДВ
-SО3Н
СБС
-SО3Н
КБ-4
-СООН
Аниониты
АВ-17
-N+(CH3)3
ЭДЭ-10П
=NH; =N- , N+(CH3)3
АН-2Ф
=NH; =NН-О
=NH; =NАН-1
-NH2; =NH
Обменная
емкость
ммоль/л
3
2.5
3.2
2.5
-
4.5-5.1
4.9-5.1
4.2
3.0
10.0
-, 3,4
4.3
8.5-9.0
2.5-2.8
2.2-2.5
10,6
4.1
4.0
18.
Ионообменные процессы• Реакции на ионитах протекают согласно
следующим уравнениям:
• катионный обмен R- H+ Na+ R-Na+H+
R- Na + К+ R-K + Na +
• анионный обмен R- ОН + Сl- R-Cl +OHR - Cl + NO3- R – NO3 + Сl-
19.
Поглощение ионов сорбентом зависит
от природы и структуры ионита,
от природы хроматографируемых веществ,
от условий проведения эксперимента.
Весьма важной величиной,
характеризующей процесс ионного обмена,
является коэффициент распределения Кр,
определяют и используют для нахождения
оптимальных условий
хроматографического разделения ионов.
20.
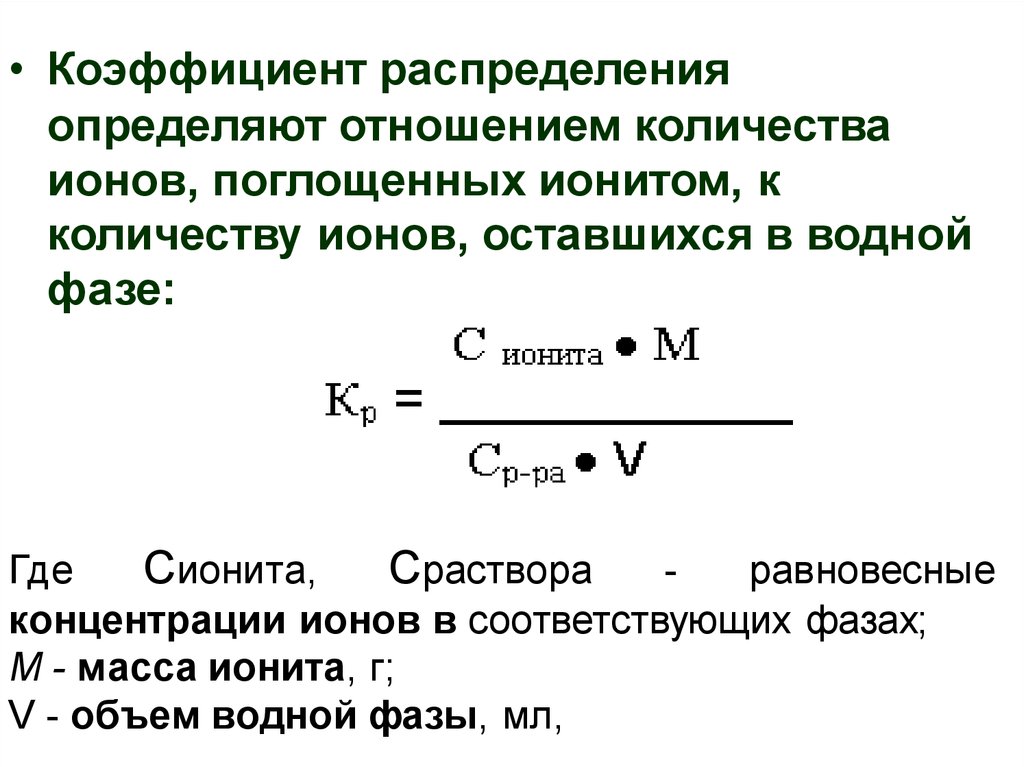
• Коэффициент распределенияопределяют отношением количества
ионов, поглощенных ионитом, к
количеству ионов, оставшихся в водной
фазе:
Где
Сионита,
Сраствора
равновесные
концентрации ионов в соответствующих фазах;
М - масса ионита, г;
V - объем водной фазы, мл,
21.
• Количество ионов определяют произведениемконцентрации его в той или другой фазе на количество
этой фазы.
• Чем больше концентрация ионов в фазе ионита и
чем больше масса ионита, тем более полным
является извлечение.
• О возможности разделения ионов судят по
отношению коэффициентов распределения этих
ионов, определенных в одинаковых условиях.
• Отношение коэффициентов распределения двух
ионов, найденных в одинаковых условиях, называют
коэффициентом разделения, характеризующим
способность этих ионов к разделению.
• Если коэффициенты распределения одинаковы, то
разделение ионов невозможно. Поэтому для
разделения выбирают такие условия, при которых
коэффициент разделения достаточно высок.
22. Адсорбционная хроматография
• основана на различной адсорбциивеществ поверхностью адсорбента.
• Силы взаимодействия, обусловливающие
адсорбцию, зависят от структуры молекул
и имеют различную природу.
• Общая энергия взаимодействия молекул
состоит из энергии дисперсионных,
индукционных и ориентационных сил.
23.
• На поверхности твердого тела имеютсяучастки, которые способны притягивать
молекулы посторонних веществ.
• Максимальное количество
адсорбированных примесей соответствует
покрытию поверхности адсорбента
мономолекулярным слоем.
• Между поверхностью адсорбента и
средой устанавливается подвижное
равновесие, определяемое равенством
скоростей адсорбции и десорбции
молекул.
24.
• Каждой концентрации адсорбируемоговещества отвечает определенное
равновесное количество его на адсорбенте.
• Разделение веществ в адсорбционной
хроматографии определяют
многократным повторением
элементарных актов сорбции и
десорбции и различием сорбируемости
анализируемых веществ.
• Зависимость количества адсорбированного
вещества от его концентрации в растворе
при постоянной температуре выражают
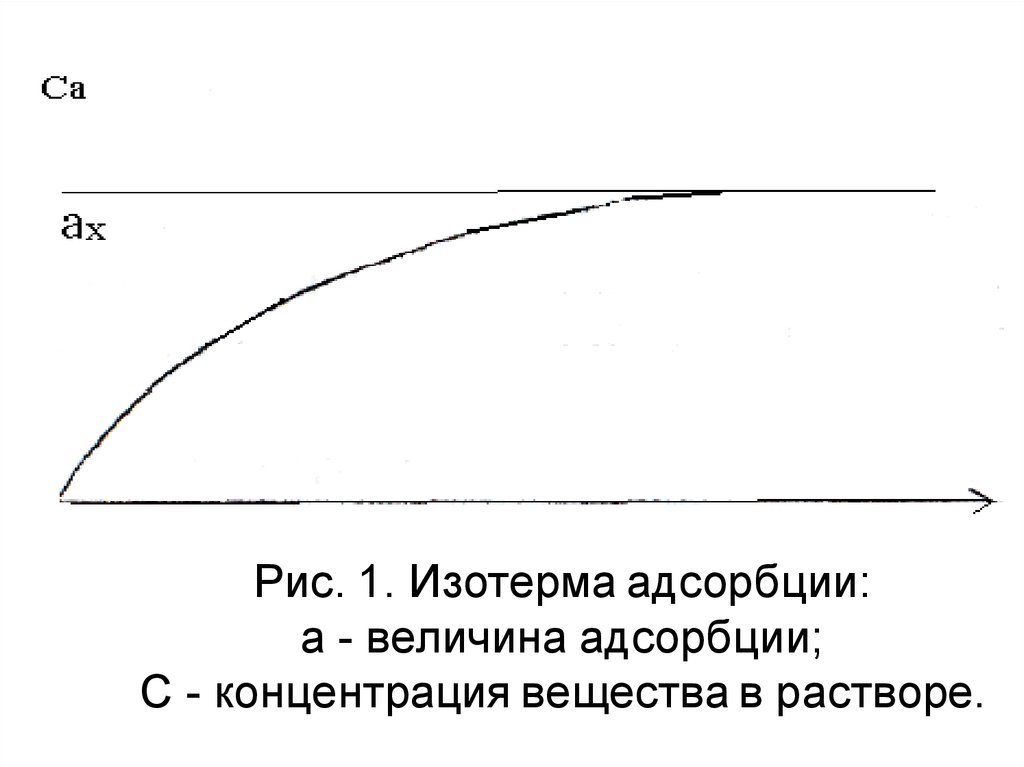
изотермой адсорбции (рис.1.).
25.
Рис. 1. Изотерма адсорбции:а - величина адсорбции;
С - концентрация вещества в растворе.
26.
• Из графика изотермы адсорбции следует, что сростом концентрации адсорбция возрастает
лишь до некоторого предела.
• Предельная адсорбция наступает тогда, когда
на поверхности адсорбента образуется
насыщенный мономолекулярный слой.
• Если обозначить через "а" количество
адсорбированного вещества, соответствующее
равновесному состоянию при заданной
концентрации, а - максимальное число мест на
адсорбенте, которое может быть занято
молекулами адсорбированного вещества, то
изотерма адсорбции Ленгмюра для одного
компонента будет иметь вид:
27.
а = а (В С)/(1+ В С)
где В - константа, характеризующая
поверхностную активность вещества;
С - равновесная концентрация.
Если С< 1, то а = а ,
В С = Кс или а = Кс,
т.е. получаем уравнение прямой, выходящей
из начала координат.
Если С 1,то :
а = а (В С)/(В С) или а = а
В этом случае получаем уравнение прямой,
параллельной оси абсцисс.
28.
• Анализ уравнения Ленгмюра показал, что прималых значениях "С" величина адсорбции "а"
прямо пропорциональна концентрации, а при
очень больших - является постоянной
величиной, соответствующей состоянию
насыщения поверхности адсорбента.
• Уравнение Ленгмюра описывает зависимость
величины адсорбции от концентрации.
• Из уравнения следует, что существует предел
адсорбции, т.е. увеличение концентрации
раствора выше определенного значения не
приводит к дальнейшему увеличению
количества адсорбированного вещества.
29.
На процесс адсорбции молекул из раствороввлияет присутствие растворителя, молекулы
которого, адсорбируясь на поверхности
сорбента, уменьшают адсорбируемость
растворенного вещества.
Поэтому следует подбирать растворитель с
наименьшей сорбционной способностью
по отношению к применяемому адсорбенту.
На величину адсорбции влияет и ряд других
факторов, к числу которых относят структуру
адсорбента, температуру и др.
30. Распределительная хроматография
• основана на распределении вещества между двумя несмачивающимися жидкостями: принято определять
отношение количества вещества в неподвижном
растворителе к количеству вещества в подвижном
растворителе.
• Подобное распределение концентрации называется
коэффициентом распределения данного вещества, т.е.:
• К = Снеподвиж./Сподвиж, где К - коэффициент
распределения;
• Снеподвиж - концентрация, определяемого компонента в
неподвижной фазе, моль/л;
• Сподвиж - концентрация того же вещества в подвижной
фазе, моль/л.
• Коэффициент распределения зависит от различных
факторов: природы вещества, природы растворителя,
температуры и техники проведения эксперимента.
31. Осадочная хроматография
• Метод основан на различной растворимоститрудно растворимых осадков, которые образуются
в результате реакции между
хроматографируемыми ионами и осадителем,
находящимся в колонке на твердом носителе.
• Основной особенностью является многократное
повторение процесса образования и
растворения осадка, происходящее на
поверхности носителя вдоль всей колонки.
• Различие в растворимости образующихся осадков
и возможность закрепления их на носителе
создают условия разделения смеси
неорганических ионов.
• В основе образования осадочной хроматограммы
лежат два процесса: процесс образования
осадка и процесс закрепления его на носителе.
32.
• Если пропустить через колонку с носителем иосадителем смесь двух катионов А и В, которые
реагируют с ионом осадителя Z, находящимся на
носителе в колонке, то процесс образования
осадочной хроматограммы может быть выражен
уравнениями:
RAn+ + nZr- = ArZn
RBm+ + nZr- = BrZm
• Соль, которая менее растворима, будет
выпадать в осадок на колонке до тех пор, пока
отношение концентрации катионов в растворе
не станет равным отношению произведений
растворимости обеих солей.






























 chemistry
chemistry








