Similar presentations:
Элементы группы галогенов
1. гАЛОГЕНЫ
Элементы фтор F, хлор С1, бром Вг, иод I, астатAt, входящие в VIIA-группу, называются
галогенами (общее обозначение Г). В переводе
с греч. галогены означают «солепорождающие»
2.
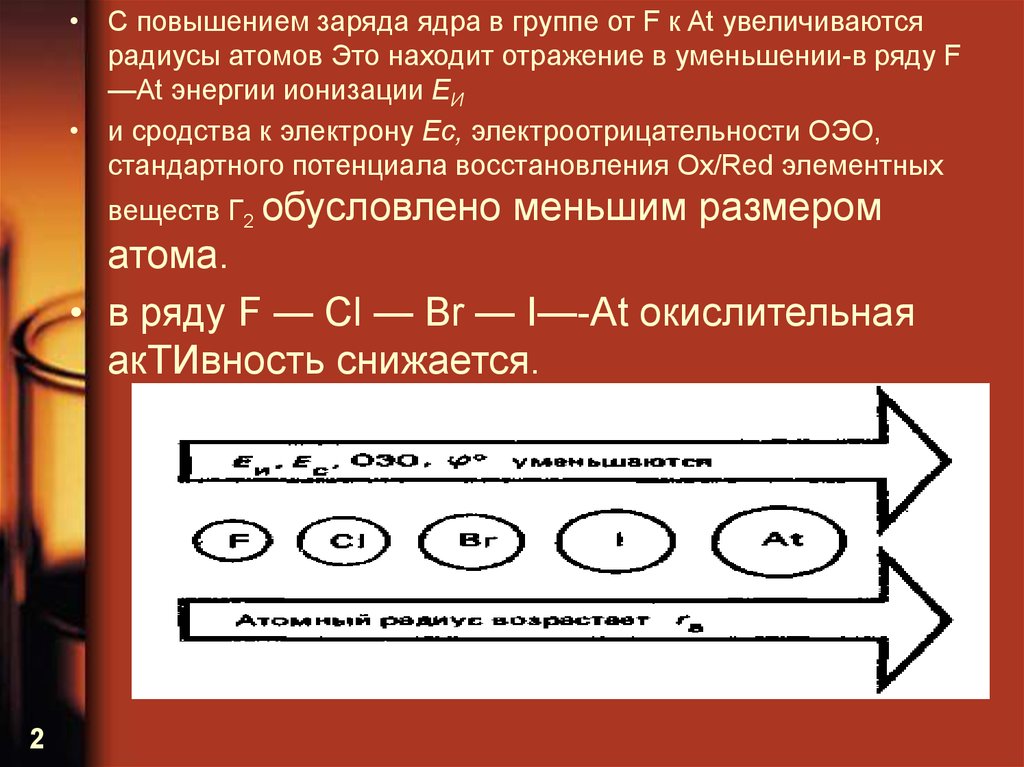
• С повышением заряда ядра в группе от F к At увеличиваютсярадиусы атомов Это находит отражение в уменьшении-в ряду F
—At энергии ионизации ЕИ
• и сродства к электрону Ес, электроотрицательности ОЭО,
стандартного потенциала восстановления Ох/Red элементных
веществ Г2 обусловлено
меньшим размером
атома.
• в ряду F — Cl — Br — I—-At окислительная
акТИвность снижается.
2
3.
• Элементные галогены (нулевая степеньокисления) представляют собой
двухатомные неполярные молекулы Г2.
Появление нечетных положительных
степеней окисления +1, +3, +5, + 7 атомов
Cl, Br, I, At связано с переходом
электронов на d-орбитали.
• Исключение составляет фтор. Отсутствие
низколежащих d-подуровней у его атома
приводит к тому, что процесс возбуждения
оказывается невыгодным.
3
4.
• Все галогены проявляют степеньокисления — 1 в водород-галогенидах НГ
(например, HF, HC1) и в солях-галогенидах
ЭГ (NaF, NaCl и др.).
• Водородгалогениды (НГ) — газы, хорошо
растворимые в воде. Водные растворы НГ
ведут себя как кислоты. Сила кислот НГ
растет с уменьшением
электроотрицательности галогенов сверху
вниз по группе. Такой характер изменения
силы кислот НГ объясняется уменьшением
прочности связи Н—Г в ряду HF — НС1 —
HBr —HI и уменьшением энергии
гидратации ионов Г4
5.
• Молекулы галогенов двухатомные: F2, Cl2, Br2, J2.• Фтор и хлор – газы, бром – летучая жидкость, иод –
твердый, но он легко возгоняется.
• Галогены являются сильными окислителями:
• 2Na+Cl2→2NaCl
• 2Р+5Cl2→2РCl5
• S+Cl2→SCl2
• 2FeCl2+Cl2→2FeCl3
• Na2SO3+Br2+H2O→Na2SO4+2HBr
• H2S+J2→S↓+2HJ.
• В ряду F-Cl-Br-J, по мере увеличения радиуса
атомов, окислительная активность нейтральных
атомов ослабевает.
• Особенно выраженную химическую активность
проявляет фтор, который при нагревании реагирует
даже с некоторыми благородными газами:
Хе+2F2→ХеF4.
• .
5
6.
Химическая активность галогенов (и окислительнаяспособность) уменьшается от фтора к иоду, т.к. с
увеличением радиуса атома способность галогенов
присоединять электроны уменьшается: F2>Cl2>Br2>J2.
Фтор реагирует с водородом со взрывом даже в
темноте.
Хлор без освещения не реагирует с водородом, но при
нагревании или при ярком свете реакция протекает по
цепному механизму. Бром с водородом взаимодействует
только при нагревании, а йод – только при сильном
нагревании, да и то не полностью, т.к. начинает идти
обратная реакция разложения йодоводорода.
Более активный галоген всегда вытесняет менее
активный из его соединений с металлами:
Cl2+2KBr→Br2+2KCl,
Br2+2KJ→J2+2KBr
6
7.
• галогеноводороды.• ==Летучие водородные соединения галогенов хорошо
растворимы в воде, вследствие полярности их молекул.
• ==В водных растворах они ведут себя как кислоты. Сила
кислот уменьшается от HJ к HF, т.к. прочность химической
связи в молекулах галогеноводородов падает в ряду
• HF-HCl-HBr-HJ,
• вследствие увеличения радиуса и поляризуемости анионов
от F- до J-.
• Анионы галогенов (кроме фтора) способны отдавать
электроны, поэтому они являются восстановителями.
Восстановительная способность галогенид – анионов по
мере возрастания их радиуса увеличивается: Cl-<Br-<J-.
• Характерная особенность фтороводородной кислоты – ее
способность взаимодействовать с диоксидом кремния:
SiO2+4HF→SiF4↑+2H2O.
7
8.
• Анионы галогенов склонны к комплексообразованию вкачестве лигандов.
• Устойчивость галогенидных комплексов обычно
уменьшается в ряду F->Cl->Br-->J-. Именно процессом
комплексообразования объясняется токсическое действие
фторид-ионов, которые, образуя фторидные комплексы с
катионами металлов, входящих в активные центры
ферментов, подавляют их активность.
• Известны комплексы, где комплексообразователем
является галогенид-ион, а лигандами – молекулы галогенов.
Так, растворимость молекулярного иода в воде резко
возрастает в присутствии иодида калия, что связано с
образованием комплексного аниона:
• J-+J2↔[J(J2)]-.
• Диссоциация комплекса обеспечивает присутствие в
растворе молекулярного иода, обладающего
бактерицидными свойствами. Поэтому в медицинской
практике используют раствор иода с добавлением KJ.
8
9.
• Из кислородсодержащих соединений наиболееустойчивы соли кислородных кислот, наименее –
оксиды и кислоты.
• Во всех кислородсодержащих соединениях
галогены, кроме фтора, проявляют
положительную степень окисления от +1 до +7.
• Фторид кислорода получают пропусканием
фтора через 2% раствор NaOH:
• 2F2+2NaOH→2NaF+H2O+OF2.
• Фтор окисляет воду:
• 2F2+H2O(ж)→OF2+2HF
• 2F2+2H2O(пар)→4HF+O2.
• Кислородсодержащих кислот фтор не образует
9
10.
• Наиболее многочисленны кислородные соединения хлора.При реакции хлора с водой образуется хлорная вода,
содержащая хлористый водород (соляную кислоту) и
гипохлористую (хлорноватистую) кислоту:
• Cl2+H2O↔HCl+HClO.
• Реакция является обратимой, а ее равновесие сильно
смещено влево. Гипохлористая кислота неустойчива и
легко распадается, особенно на свету:
• HClO↔HCl+O.
• В результате хлорная вода содержит три окислителя:
молекулярный хлор, гипохлористую кислоту и атомарный
кислород.
• Образующийся атомарный кислород обесцвечивает
красители и убивает микробы, что объясняет
отбеливающее и бактерицидное действие хлорной воды.
• Кислота HСlO настолько слабая, что даже угольной
кислотой вытесняется из растворов гипохлоритов:
• NaClO+H2O+CO2→NaHCO3+HClO.
10
11.
• HClO более сильный окислитель, чемгазообразный хлор. Она реагирует с
органическими соединениями RH:
• 2RH+2HClO→ROH+RCl+HCl+H2O.
• Гипохлористая кислота денатурирует белки, из
которых состоят микроорганизмы:
• R-CO-NH-R1+HClO→R-CO-NCl-R1+H2O.
• .
• При добавлении к хлорной воде щелочи
равновесие смещается вправо:
• Cl2+2KOH→KCl+KClO+H2O.
• Полученный раствор смеси солей, называемый
жавелевой водой, используется как
отбеливающее и дезинфицирующее средство:
KClO+CO2+H2O→KHCO3+HClO.
11
12.
• Хлорную известь рассматривают как смешанную сольсоляной и гипохлористой кислоты CaOCl2, которой отвечает
структурная формула:
Cl
• Ca
Ca(OH)2+Cl2→CaOCl2+H2O.
O-Cl
• Во влажном воздухе хлорная известь постепенно выделяет
гипохлористую кислоту, которая обеспечивает ее
отбеливающее, дезинфицирующее и дегазирующие
свойства:
• 2CaОCl2+2CO2+2H2O→CaCl2+Ca(HCO3)2+2HClO.
• При действии на хлорную известь соляной кислоты
происходит выделение свободного хлора:
CaOCl2+2HCl→CaCl2+H2O.
• Кислота HClO2 называется хлористой, а ее соли –
хлориты. Получают ее действием серной кислоты на
хлорит бария:
• Ba(ClO2)2+H2SO4→2HClO2+BaSO4↓.
12
13.
• При нагревании гипохлористая кислотаразлагается с образованием соляной и
хлорноватой кислот:
3HClO→2HCl+HClO3.
• При пропускании хлора через горячий
раствор щелочи образуются хлорид калия
и хлорат калия KClO3 (бертолетова соль):
• 6KOH+3Cl2→5KCl+KClO3+3H2O.
• Хлорную кислоту получают действием
H2SO4(конц.) на перхлорат калия:
• KClO4+H2SO4→HClO4+KHSO4.
13
14.
• По мере увеличения степени окисленияхлора в ряду HClO-HClO2-HClO3-HClO4,
сила кислот увеличивается.
• Сравнение окислительных свойств
кислородных кислот хлора показывает, что
в ряду анионов ClO- -ClO2- -ClO3- -ClO4уменьшается окислительная способность
14
15.
Хлор, фтор, бром, йодCl — макроэлемент [0,15%], остальные — микроэлементы [10–
5%]. Фтор
В организме фтора 7 мг. Больше всего фтора в эмали — около
0,01% [труднорастворимый фторапатит Са5[РО4]3F]:
Са5[РО4]3ОН + F– Са5[РО4]3F + OH–
ускоряя процесс реминерализации [образования кристаллов]:
10Са 2+ + 6РО4 3– + 2F– = 3Са3[РО4]2 СаF2
Для питьевой воды добавляют NaF до нормы [1 мг/л]. Недостаток
F приводит к кариесу.
Если содержание F будет выше 1,2 мг/л,, кости деформируются
[развивается флюороз].
Механизм токсического действия фтора — образование
комплексных соединений с кальцием, магнием и другими
элементами — активаторами ферментов, вследствие чего фтор
угнетает активность ряда ферментов.
Избыток фтора угнетает функцию щитовидной железы, т.к. фтор
— конкурент йода в синтезе гормонов щитовидной железы.
16.
• Хлор• В организме человека 100 г хлора.
• Хлорид-ионы активируют ферменты [амилаза
слюны], создают благоприятную среду
для действия протеолитических ферментов
желудочного сока, обеспечивают ионные потоки
через клеточные мембраны, участвуют в
поддержании осмотического равновесия.
Суточная потребность в NaCl составляет 5–10 г.
• NaCl необходим для выработки НСl в желудке.
НСl, помимо участия в пищеварении, уничтожает
бактерии холеры, брюшного тифа.
• Элементарный хлор — высокотоксичный газ.
16
17.
• Бром• В организме всего 7 мг [10–5%].
Локализуется в железах внутренней
секреции [в гипофизе]. Роль Br не ясна.
Наиболее чувствительна к Br ЦНС.
Бромид-ионы накапливаются в отделах
мозга и действуют успокаивающе при
повышенной возбудимости.
Восстанавливается равновесие между
процессами возбуждения и торможения.
• Br– может замещать Cl– и I–, он
выводится очень медленно. И хотя
токсичность его невелика, но накопление
может вызвать отравление — «бромизм».
17
18.
• Бром• В организме всего 7 мг [10–5%].
Локализуется в железах внутренней
секреции [в гипофизе]. Роль Br не ясна.
Наиболее чувствительна к Br ЦНС.
Бромид-ионы накапливаются в отделах
мозга и действуют успокаивающе при
повышенной возбудимости.
Восстанавливается равновесие между
процессами возбуждения и торможения.
• Br– может замещать Cl– и I–, он
выводится очень медленно. И хотя
токсичность его невелика, но накопление
может вызвать отравление — «бромизм».
18
19.
19• Йод
• Незаменимый биогенный элемент. В организме 25 мг I В
основном он связан в виде гормонов и только 1% — в виде
йодид-иона.
• Щитовидная железа секретирует гормоны тироксин и
трийодтиронин, которые влияют на обмен веществ,
теплообразование, поглощение кислорода.
• Гипотиреоз может быть связан: а/ с уменьшением
способности связывать и накапливать йодид-ионы; б/ с
недостатком в пище йода [эндемический зоб].
• KI применяют и при гипо-, и при гипертиреозе. При
эндемическом зобе йодид-ионы используются для синтеза
гормонов, при гипертиреозе йодид-ионы тормозят
йодирование тирозина йодом.
• 5% спиртовой раствор I2 — антисептическое средство.
• Раствор йода в йодистом калии [раствор Люголя]
применяется для смазывания слизистой оболочки гортани.
• Радиоактивный изотоп йода 131I применяется для
диагностических целей при нарушениях работы
щитовидной железы, для диагностики опухолей мозга.
• Йодиды окисляются кислородом при обычном освещении:
• h
• 2KI + 1/2O2 + H2O I2 + 2KOH
20.
CH4 + H2O →NH3 + H2O NH4+ + OH– (раствор – основание)
20
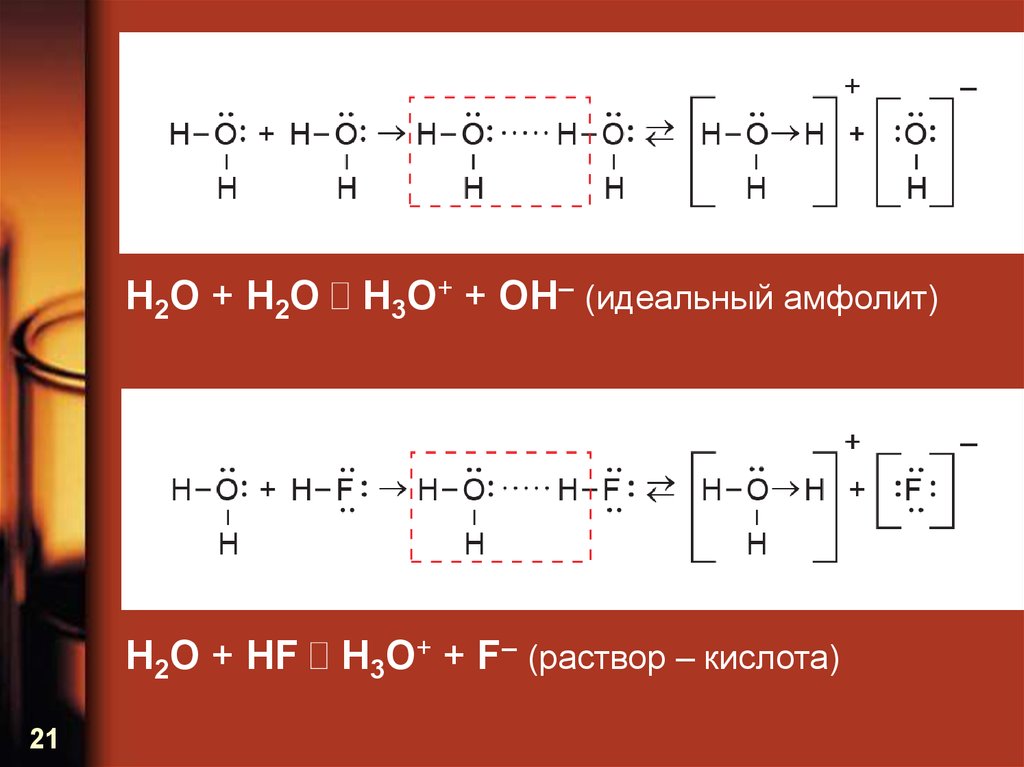
21.
H2O + H2O H3O+ + OH– (идеальный амфолит)H2O + HF H3O+ + F– (раствор – кислота)
21
22.
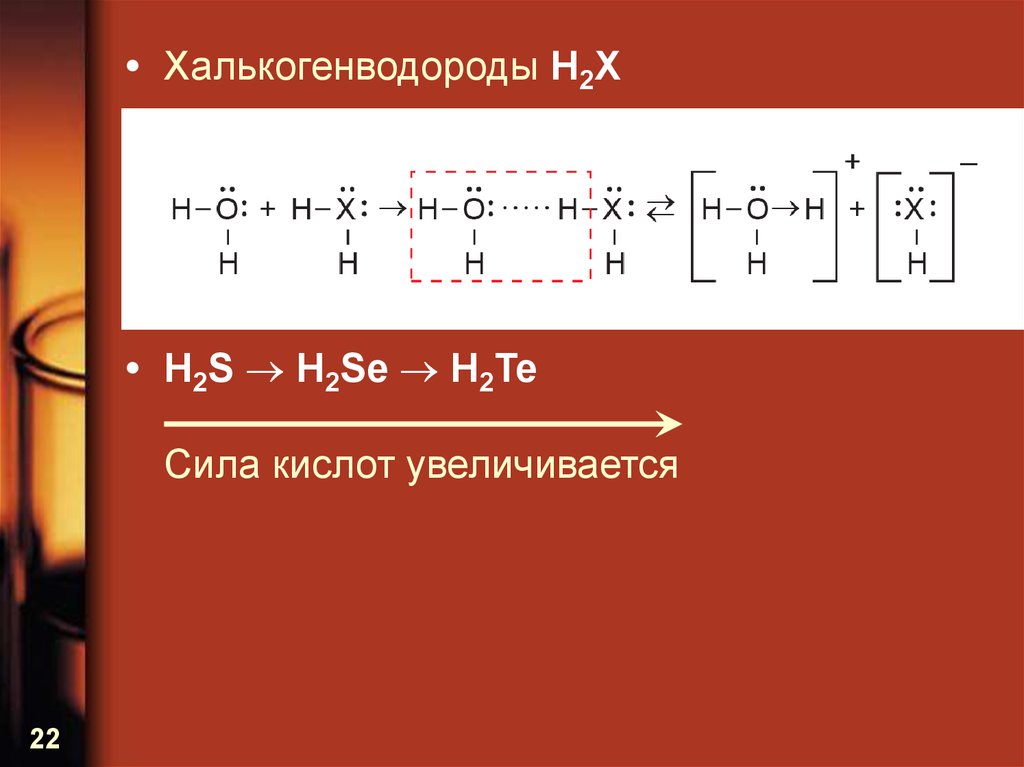
• Халькогенводороды H2X• H2S H2Se H2Te
Сила кислот увеличивается
22
23.
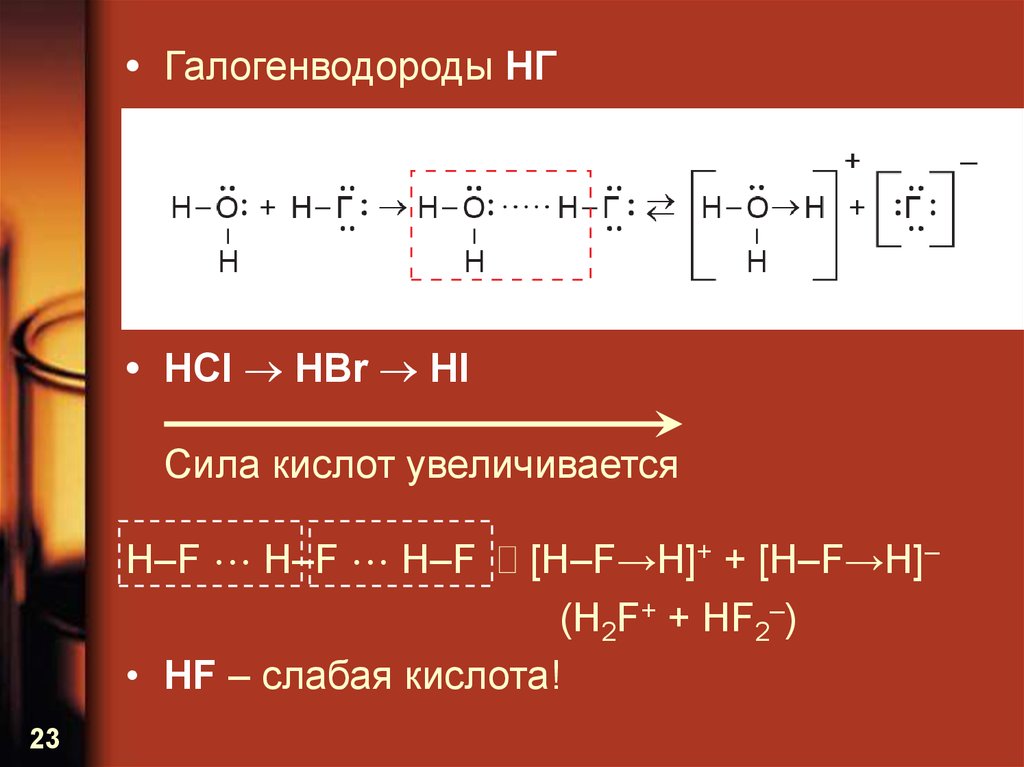
• Галогенводороды HГ• HCl HBr HI
Сила кислот увеличивается
H–F H–F H–F [H–F→H]+ + [H–F→H]–
(H2F+ + HF2–)
• HF – слабая кислота!
23
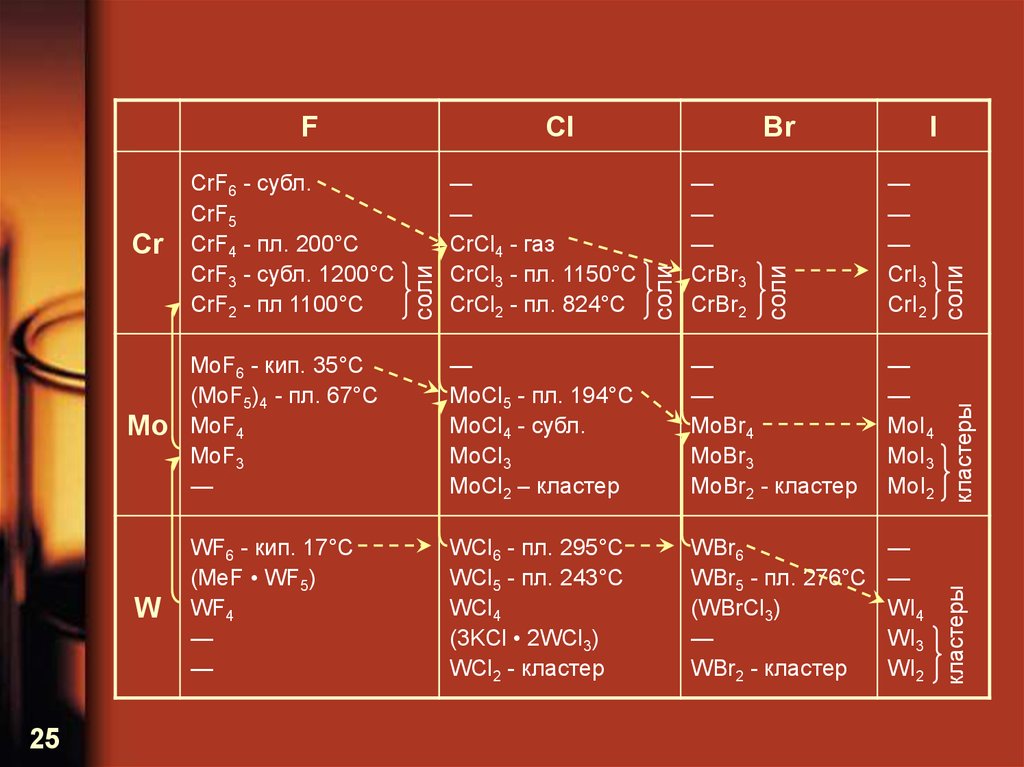
24. Бинарные соединения
Галогениды как характеристическиесоединения
25.
——
MoBr4
MoBr3
MoBr2 - кластер
—
—
MoI4
MoI3
MoI2
WF6 - кип. 17°С
(MeF • WF5)
WF4
—
—
WCl6 - пл. 295°С
WCl5 - пл. 243°С
WCl4
(3KCl • 2WCl3)
WCl2 - кластер
WBr6
WBr5 - пл. 276°С
(WBrCl3)
—
WBr2 - кластер
—
—
WI4
WI3
WI2
соли
—
MoCl5 - пл. 194°С
MoCl4 - субл.
MoCl3
MoCl2 – кластер
кластеры
Mo
MoF6 - кип. 35°С
(MoF5)4 - пл. 67°С
MoF4
MoF3
—
кластеры
Cr
соли
—
—
—
CrBr3
CrBr2
I
—
—
—
CrI3
CrI2
соли
—
—
CrCl4 - газ
CrCl3 - пл. 1150°С
CrCl2 - пл. 824°С
Br
CrF6 - субл.
CrF5
CrF4 - пл. 200°С
CrF3 - субл. 1200°С
CrF2 - пл 1100°С
W
25
Cl
соли
F
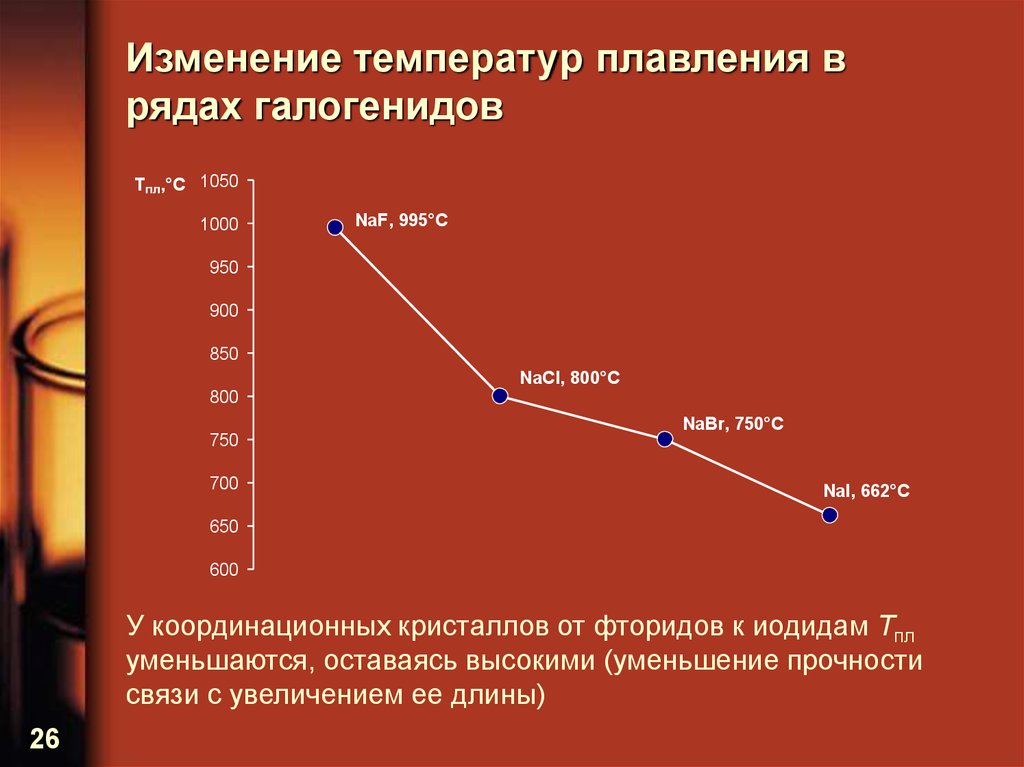
26. Изменение температур плавления в рядах галогенидов
Tпл,°С 10501000
NaF, 995°С
950
900
850
NaCl, 800°С
800
750
700
NaBr, 750°С
NaI, 662°С
650
600
У координационных кристаллов от фторидов к иодидам Tпл
уменьшаются, оставаясь высокими (уменьшение прочности
связи с увеличением ее длины)
26
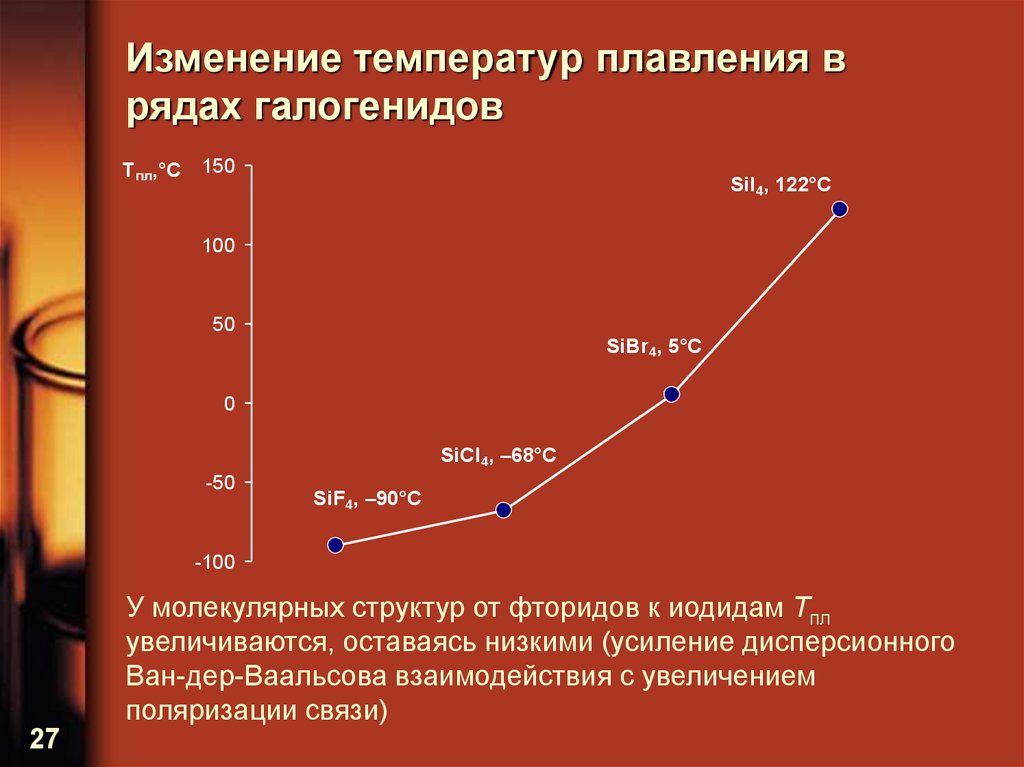
27. Изменение температур плавления в рядах галогенидов
T пл,°С150
SiI4, 122°C
100
50
SiBr4, 5°C
0
SiCl4, –68°C
-50
SiF4, –90°C
-100
У молекулярных структур от фторидов к иодидам Tпл
увеличиваются, оставаясь низкими (усиление дисперсионного
Ван-дер-Ваальсова взаимодействия с увеличением
поляризации связи)
27
28. Эволюция степеней окисления катионообразователя при нагревании
370°C435°C
581°C
583°C
PtCl4 PtCl3 PtCl2 PtCl Pt
263°C
272°C
355°C
Ptl4 Ptl3 Ptl2 Pt
28
29. Полный гидролиз «по катиону»
• BBr3 + 3H2O 3HBr + H3BO3• SiCl4 + 2H2O 4HCl + SiO2
• CCl4, SF6, NI3 в воде нерастворимы
(нет гидролиза)
29
30. Изменение восстановительных свойств в ряду галогенид-ионов
• NaF(к) + H2SO4(конц) NaHSO4 + HF• NaCl(к) + H2SO4(конц) NaHSO4 + HCl
• 2NaBr(к) + 2H2SO4(конц) Na2SO4 + Br +
SO2 + 2H2O
▪ Br– восстанавливает H2SO4 до SO2
• 8NaI(к) + 5H2SO4(конц) 4Na2SO4 + 4I +
H2S + 4H2O
▪ I– восстанавливает H2SO4 до H2S
30
31. Галогенидные ацидокомплексы
• Типичное к.ч. 4: K2[HgI4], H[AuCl4]• Для фторидов помимо к.ч. 4 есть к.ч. 6:
MeI2[BeF4], MeI3[AlF6], MeI2[SiF6],
31
32. Бинарные соединения
Кислородсодержащие соединения33. Классификация
• Соединения не подчиняющиеся правилуформальной валентности
▪ анионоизбыточные соединения
• пероксиды (Na2O2, CaO2, …)
ст.окисления кислорода –1)
• супероксиды (надпероксиды) (KO2, …)
ст.окисления –1/2)
• озониды (KO3, …) ст.окисления –1/3
▪ катионоизбыточные соединения –
металлидные фазы типа соединений
Курнакова (Ti6O, Ti3O, …)
33
34. Классификация
• Характеристические соединения –подчиняющиеся правилу формальной
валентности, оксиды с ионно-ковалентным
типом связи
▪ солеообразующие
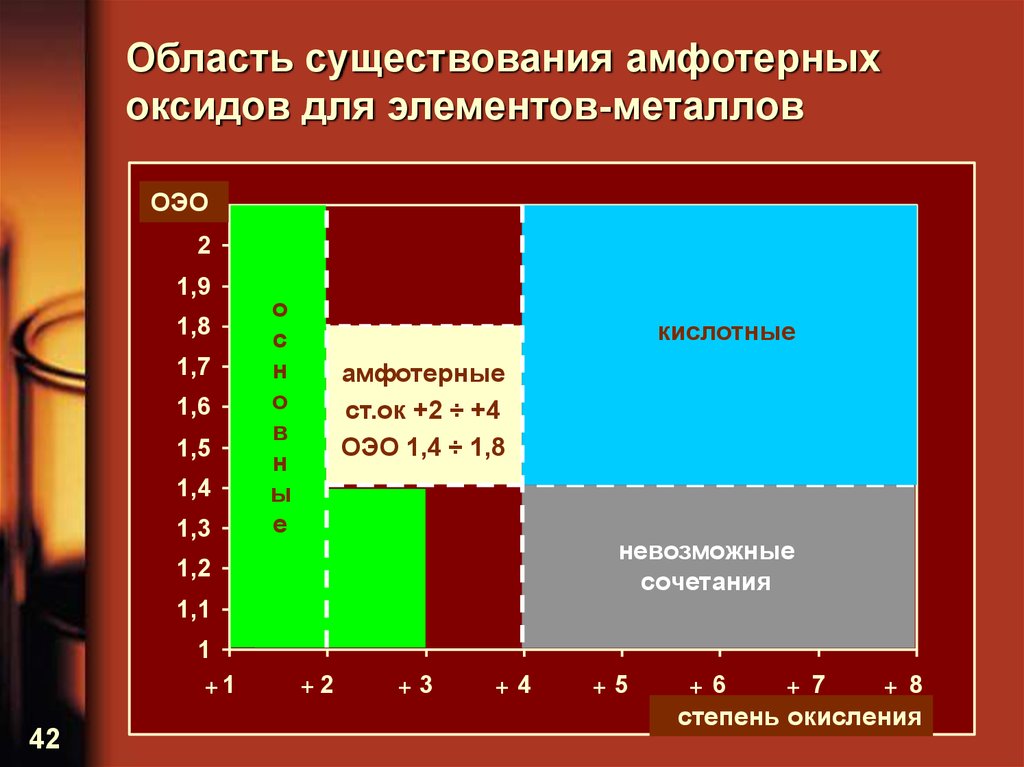
• основные (оксиды металлов в невысоких степенях
окисления)
• кислотные (оксиды неметаллов в любых степенях
окисления и металлов в высоких степенях
окисления)
• амфотерные (оксиды металлов в промежуточных
степенях окисления +2…+4 при ОЭО 1,4…1,8)
▪ несолеообразующие (CO, N2O, NO) – им не
соответствуют гидроксиды и от них не
происходят соли
34
35. Характерные структурные типы оксидов в зависимости от природы химической связи
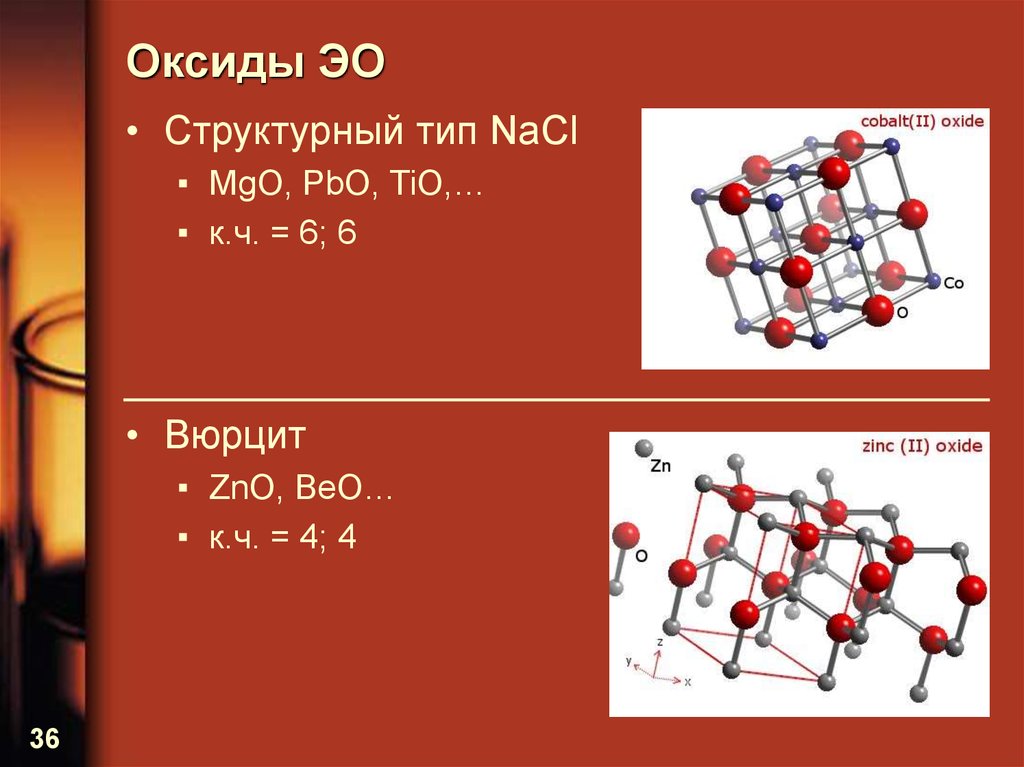
36. Оксиды ЭО
• Структурный тип NaCl▪ MgO, PbO, TiO,…
▪ к.ч. = 6; 6
• Вюрцит
▪ ZnO, BeO…
▪ к.ч. = 4; 4
36
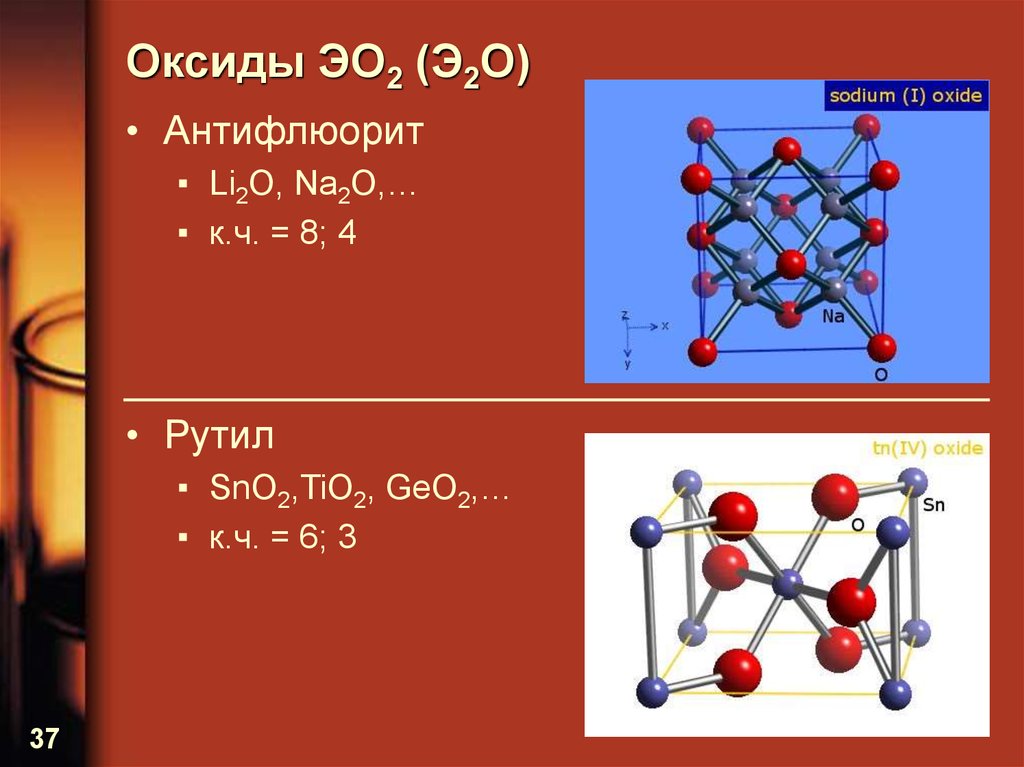
37. Оксиды ЭО2 (Э2О)
• Антифлюорит▪ Li2O, Na2O,…
▪ к.ч. = 8; 4
• Рутил
▪ SnO2,TiO2, GeO2,…
▪ к.ч. = 6; 3
37
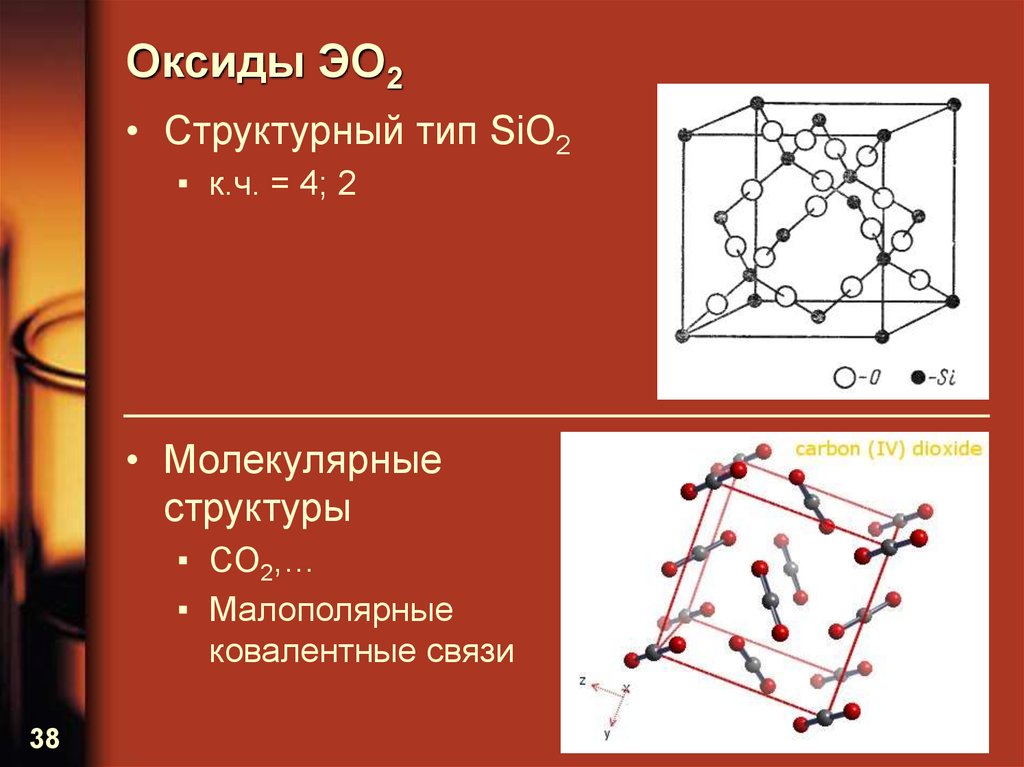
38. Оксиды ЭО2
• Структурный тип SiO2▪ к.ч. = 4; 2
• Молекулярные
структуры
▪ CO2,…
▪ Малополярные
ковалентные связи
38
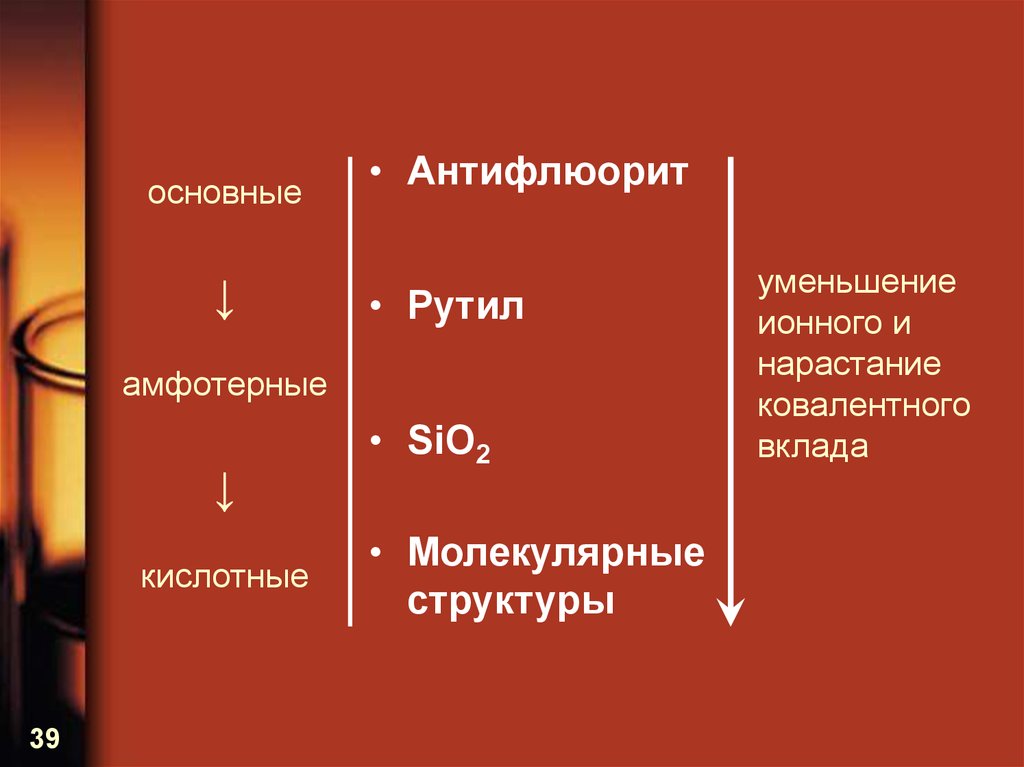
39.
основные↓
• Антифлюорит
• Рутил
амфотерные
↓
кислотные
39
• SiO2
• Молекулярные
структуры
уменьшение
ионного и
нарастание
ковалентного
вклада
40. Структуры характеристических оксидов элементов IVA-VIIA-групп
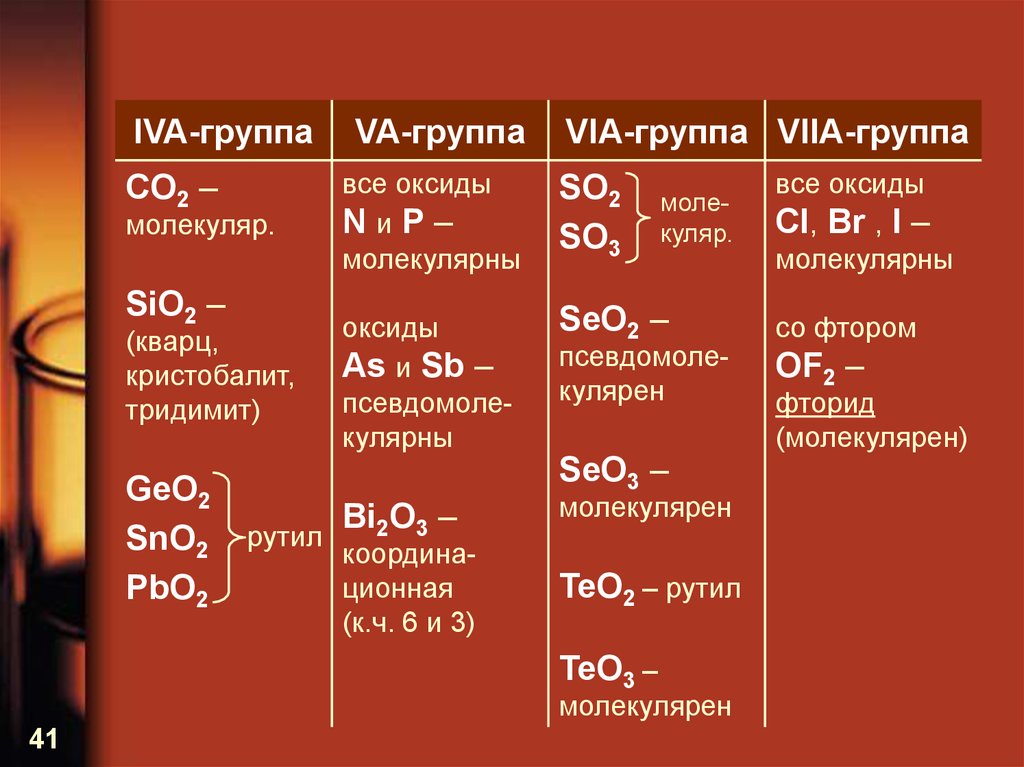
41.
IVA-группаCO2 –
молекуляр.
SiO2 –
(кварц,
кристобалит,
тридимит)
GeO2
SnO2
PbO2
рутил
VA-группа
VIA-группа VIIA-группа
все оксиды
NиP–
молекулярны
SO2
SO3
оксиды
As и Sb –
псевдомолекулярны
SeO2 –
Bi2O3 –
молекулярен
координационная
(к.ч. 6 и 3)
молекуляр.
псевдомолекулярен
SeO3 –
TeO2 – рутил
TeO3 –
молекулярен
41
все оксиды
Cl, Br , I –
молекулярны
со фтором
OF2 –
фторид
(молекулярен)
42. Область существования амфотерных оксидов для элементов-металлов
ОЭО2,1
2
1,9
1,8
1,7
1,6
1,5
1,4
1,3
о
с
н
о
в
н
ы
е
кислотные
амфотерные
ст.ок +2 ÷ +4
ОЭО 1,4 ÷ 1,8
невозможные
сочетания
1,2
1,1
1
+1
42
+2
+3
+4
+5
+6
+ 7
+ 8
степень окисления
43. Амфотерные свойства оксидов
▪ В отличие от гидроксидов многие амфотерныеоксиды (ZnO, Al2O3, Cr2O3, …), особенно
прокаленные, обладают малой реакционной
способностью – проявляют амфотерность
только в жестких условиях, при сплавлении
t, сплав.
• Al2O3 + 2NaOH(безвод.) 2NaAlO2 + H2O
t, сплав.
• Al2O3 + 3K2S2O7(безв.) Al2(SO4)3 + 3K2SO4
43






























 chemistry
chemistry








