Similar presentations:
Бинарные соединения. Лекция 3
1. Лекция 3
1. Бинарные соединения2. Многокомпонентные соединения
3. Водород
4. р-Элементы VII группы
1
2. Бинарные соединения
План1. Классификация по составу
2. Тип химической связи
3. Структуры
4. Устойчивость
5. Кислотно-основные свойства
6. Ок-вос. свойства
2
3.
Бинарные соединения1) подчиняются правилу
формал. валентности (HgCl2)
2) не подчиняются правилу
формальной валентности, т.е.
катион-катионные (Hg2Cl2) или
анион-анионные связи (H2O2)
3
4. Классификация по составу
• Оксиды (Na2O, BeO, Al2O3, ….),• Гидриды (NaH, CaH2, CsH, ...),
• Галиды (NaCl, PbI2, KBr, ...),
• Сульфиды (H2S, Na2S, MgS, ...),
• Селениды (Na2Se, H2Se, ...),
• Теллуриды (K2Te, ...),
• Нитриды (AlN, Na3N, ...),
• Арсениды (GaAs, AlAs, ...),
• Силициды (Mg2Si, FeSi, ...),
• Карбиды (B4C3, Ca2C, ...),
• Бориды (Cr B, Cr B, Cr B , ...)
4
5.
• Дваразных
элемента
могут
образовать несколько бинарных
соединений.
• Пример: N2O, NO, N2O3, NO2, и
N2O5 это соед-я пост-го состава
(молекулярные структуры).
• Fe2Si, Fe3Si2, FeSi2, и др. соединения
переменного состава
(координационные структуры).
5
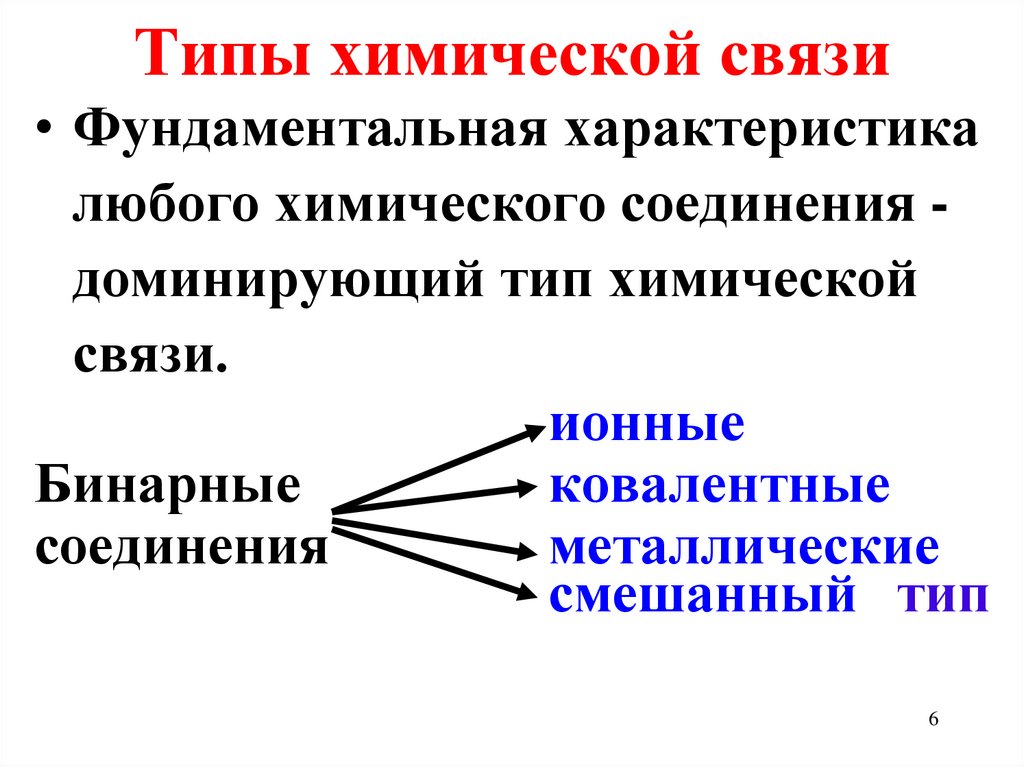
6. Типы химической связи
• Фундаментальная характеристикалюбого химического соединения доминирующий тип химической
связи.
ионные
Бинарные
ковалентные
соединения
металлические
смешанный тип
6
7.
• координационно - ковалентные• молекулярно ковалентные соед-я
• Все ионные и металл-е бинарные
соед-я - только координационные.
7
8. (а) Молекулярная структура (б) Координационная структура
(а) Алмаз(б) СO2
8
9. Тип химической связи зависит от изменения:
1. атомных и ионных радиусов2. первого ионизац. потенциала
3. электроотрицательности
4. поляризующей способности
катиона
5. поляризуемости аниона
9
10. Изменение характера химической связи для s и p- элементов
Группа IAIIA
IIIA
катион
Поляризующая
способность
моноатомных
катионов
ум-ся
Доля ионной связи
ув-ся
IVA VA VIA VIIA
анион
Поляризуемость
аниона ум-ся.
Доля ионной связи
ув-ся
10
11. Химическая связь в бинарных соединениях s- и p-элементов
• Химическая связь ионная, еслиЭО 1,8
• Щелоч. и щел-зем. металлы с
галогенами и кислородом
образуют ионные соединения.
11
12. Изменения химической связи в бинарных соединениях одного и того же типа второго периода
LiBe
B
C N
O F
Фториды LiF BeF2 BF3 CF4 NF3 OF2 (F2)
Оксиды Li2O BeO B2O3 CO2 N2O5 (O2) Нитриды Li3N Be3N2 BN C3N4 (N2) Степень полярности постепенно уменьшается
ковалентность увеличивается
12
13. Эффективный заряд на атоме кислорода в оксидах
по периоду:Li2O BeO
B2O3
CO2
N2O 5
Эф.заряд
на кислороде
0,80- 0,35- 0,24- 0,11- 0,05-
Хим. природа
оксида
сильн.
основ.
амфот. слаб.
кисл.
сред.
кисл.
сильн.
кисл.
13
14. Эффективный заряд на атоме кислорода в оксидах
• Вниз по группе:Li2O Na2O K2O Rb2O Cs2O
Эф.заряд
на кислороде
0,80- 0,81- 0,89-
0,92- 0,96-
Эффект. заряд на атоме кислорода ув-ся, так
как ув-ся доля ионной связи в соединениях
одного и того же типа
14
15. Особенности кристаллохимического строения бинарных соединений.
• Основной принцип - расположениеэлементов относительно группы IVA
1. Если оба элемента слева от этой
границы, т.е. существует дефицит
валентных электронов, то
соединение имеет металлический
тип связи (исключение - некоторые
бориды).
15
16.
2. Если оба элемента находятсясправа от этой границы, т.е.
достаточное количество вал.
эл-нов, то соединение имеет
ковалентный тип связи.
16
17.
3. Если элементы находятся поразные стороны от этой границы, то
возможно образование соединений с
различным доминирующим типом
химической связи: ковалентным,
ионным или металлическим.
• При этом существенную роль
играет ЭО
17
18. Кристаллические структуры
могут быть1. плотноупакованные для металлидов
(К.ч. = 8, 12 и более)
2. менее плотноупакованные для
солеобразных ионных кристаллов
(К.ч. = 4, 6 и 8)
3. рыхлые (К.ч. = 4, но иногда 5, 6 или 7)
для ковалентных соединений (слоистые,
цепочечные и молекулярные кристалл.
структуры).
• Это зависит от типа химической связи
18
19. Устойчивость бинарных соединений
• По периоду (-) значение G ум-ся, т.е. устойчивость галогенидов, оксидов, сульфидов ,нитридов ум-ся.
• Существуют различия в устойчивости:
• для щелочных металлов наиболее устойчивы
галогениды
• для щелочно-земельных более устойчивы
оксиды
• В целом для s-элементов ряд устойчивости
следующий: ЭF > ЭCl > ЭBr
19
20. Кислотно-основные свойства
• Каждое бинарное соединение можетвести себя как кислота или основание
Na2O: +
SO3 = Na2SO4
основание
к-та
HF: +
основание
BF3 = HBF4
к-та
20
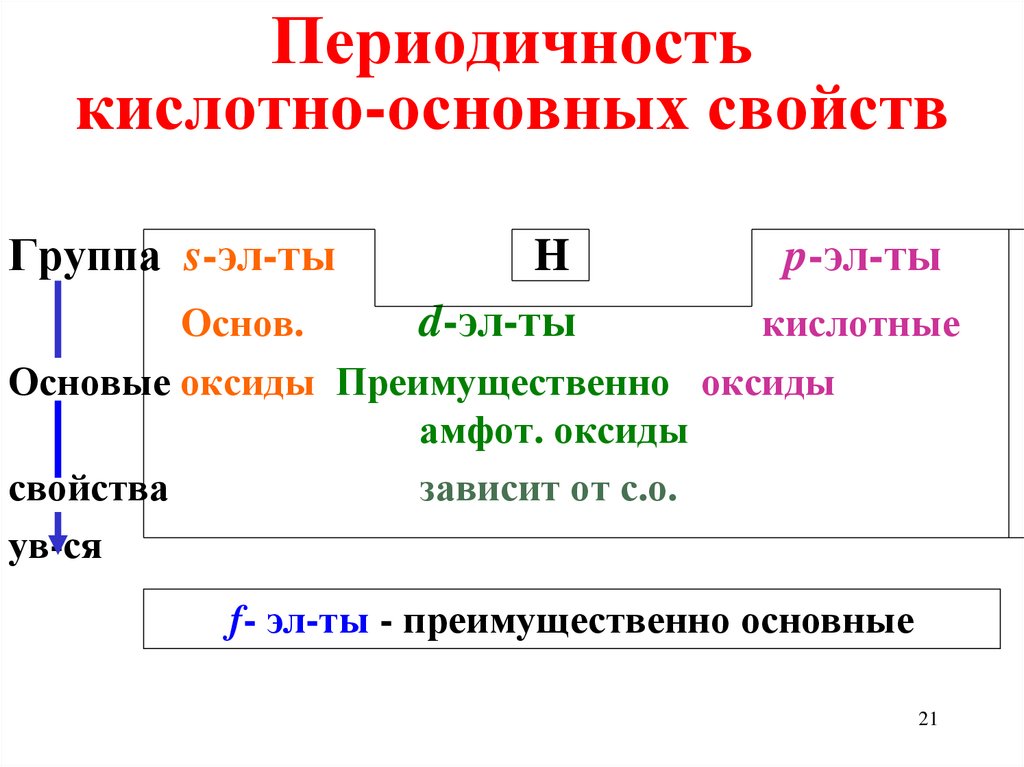
21. Периодичность кислотно-основных свойств
Группа s-эл-тыH
d-эл-ты
p-эл-ты
Основ.
кислотные
Основые оксиды Преимущественно оксиды
амфот. оксиды
свойства
зависит от с.о.
ув-ся
f- эл-ты - преимущественно основные
21
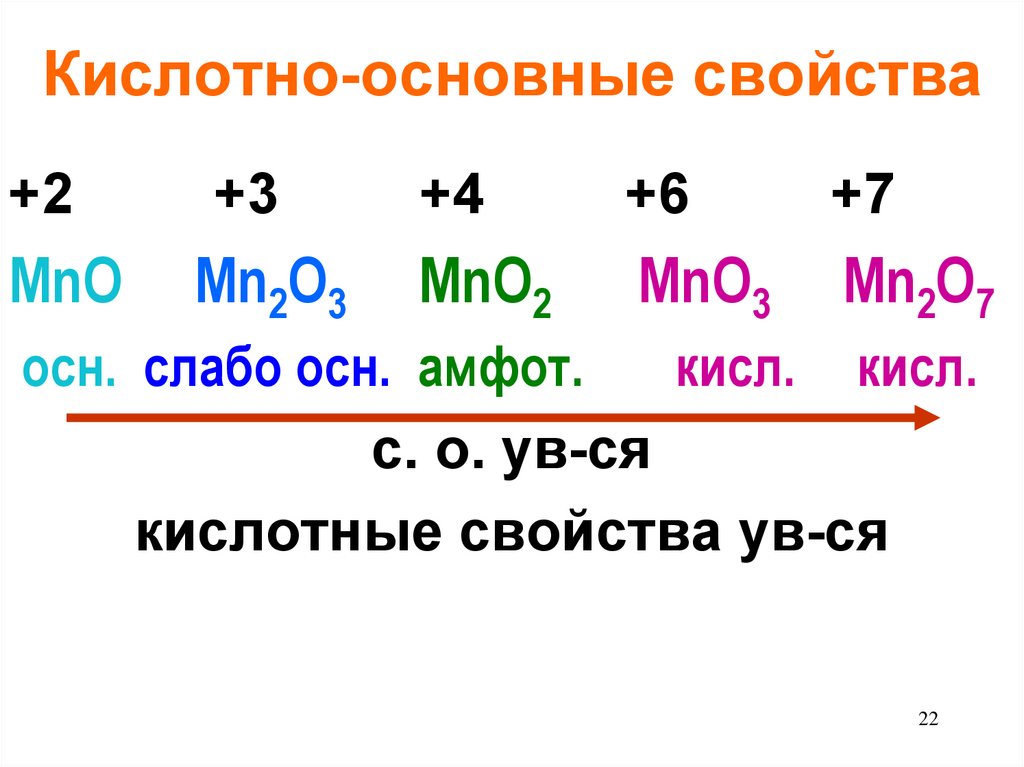
22. Кислотно-основные свойства
+2+3
+4
+6
+7
MnO
Mn2O3
MnO2
MnO3
Mn2O7
осн. слабо осн. амфот.
кисл. кисл.
с. о. ув-ся
кислотные свойства ув-ся
22
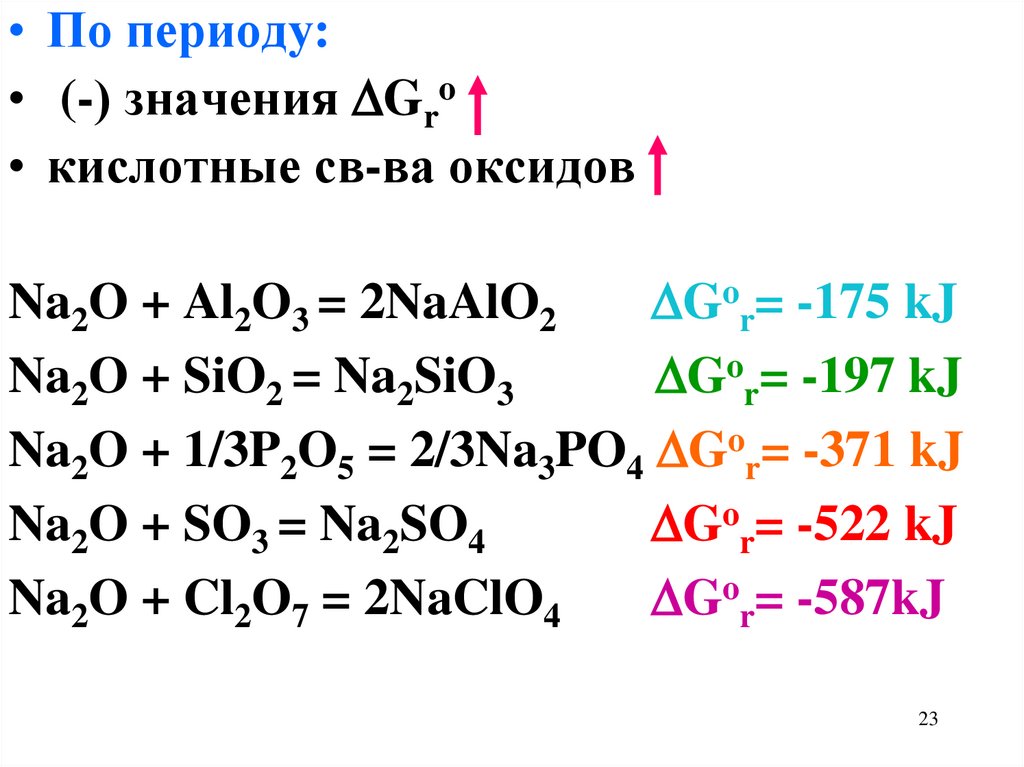
23.
• По периоду:• (-) значения Gro
• кислотные св-ва оксидов
Na2O + Al2O3 = 2NaAlO2
Gor= -175 kJ
Na2O + SiO2 = Na2SiO3
Gor= -197 kJ
Na2O + 1/3P2O5 = 2/3Na3PO4 Gor= -371 kJ
Na2O + SO3 = Na2SO4
Gor= -522 kJ
Na2O + Cl2O7 = 2NaClO4
Gor= -587kJ
23
24.
• Амфотерные оксиды могут быть каккислотами так и основаниями:
Al2O3 + P2O5 =2AlPO4,
MgO + Al2O3 = Mg(AlO2)2
• Основные, кислотные и
оксиды реагируют с водой:
амфотерные
Na2O + H2O = 2NaOH
SO3 + H2O = H2SO4
As2O3 + H2O = As(OH)3 H3AsO3
(амфолит)
• Существуют нерастворимые в воде оксиды
24
(Al2O3, Cr2O3, Fe2O3, ZnO, и др.).
25.
Кислотно-основные свойствадругих классов бинарных
соединений изменяются подобно
NaF + MgF2 = NaMgF3
NaF + 1/3 AlF3 = 1/3Na2AlF6
NaF + ½ SiF4 = ½ Na2SiF6
Go = -14 kJ
Go = -26 kJ
Go = -51 kJ
25
26.
• Соединения одного и того жетипа
показывают сходные свойства
• Например, бинарные соединения щелочных и
щел-зем. металлов не гидролизуются:
NaCl + H2O нет гидролиза
• их оксиды или сульфиды образуют щелочную
среду:
Na2O + H2O = 2NaOH
Na2S + H2O NaOH + NaHS
• гидролиз
неметаллических
соединений
протекает необратимо до образования кислот:
BCl3 + 3H2O = H3BO3 + 3HCl
B2S3 + 6H2O = 2H3BO3 + 3H2S
26
27. Ок-вос. свойства
• зависят от с. о. центрального атома иустойчивости соединения.
• Чем ниже с.о. и менее устойчиво
соединение, тем более вос-е свойства
• Чем более высокая с.о. центр. атома
и менее устойчиво соединение, тем
более сильные ок-е свойства
• Много соединений с ок-вос.
двойственностью
27
28. Многоэлементные соединения (3 и более)
• Свойства определяются хим.составом, типом хим. связи, и
кристалл. структурой.
• Любые соединения можно
охарактеризовать кислотноосновными и ок-вос. свойствами,
которые зависят от с. о.,
термической и электролитической
диссоциации, гидролиза,
образования комплексов и.т.д.
28
29.
• Традиционно эти вещества делятна 3 группы: основания, к-ты, и
соли.
• Такая классификация
рассматривает соединения,
имеющие только ионный тип
связи.
• Существуют другие соединения,
которые остаются вне данной
классификации, например,
• CdSnAs2, ZnGeP2, CuFeS2, и др.
29
30. Гидроксиды
ЭхОy + H2O = ЭОm(ОН)nЭ(ОН)n - основания
• Существует 11 сильных оснований,
называемых щелочами:
LiOH, NaOH, KOH, RbOH, CsOH,
FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2,
Ra(OH)2, и TlOH
• Гидроксиды
других
металлов
(Al(OH)3, Cd(OH)2, и др.) слабо
растворимые вещества.
30
31.
• EOm(OH)n где m = 0—3, n = 1—6.с ув-ем с.о. (и кол-ва OH групп)
основн. свойства ослабевают, а
кислотные усиливаются:
NaOH Mg(OH)2 Al(OH)3 H4SiO4 H3PO4 H2SO4 HClO4
сильн. менее сильн. амфот.
осн-е
осн-е
осн-е
оч.слаб.
к-та
слабая сильная оч.сильн.
к-та
к-та
к-та
• Причина: рост поляризующего
действия катиона в периоде, т. к. Rат
ум-ся, а с.о. ув-ся.
31
32.
• если m = 0, тогда E(OH)n может бытьосновным или кислотным
• Для E(ОН)n основной характер ув-ся
вниз по группе, т.к. ослабляется
поляризующее действие катиона из-за
ув-я его радиуса и отщепление ОНгруппы более вероятно.
H3BO3 Al(OH)3 Ga(OH)3In(OH)3TlOH
слаб
к-та
амфотерные основания
сильн.
основание
32
33.
• Гидроксиды EOm(ОH)n (m 0) имеюткислотные свойства, т.к. связь O H
поляризована и облегчается
диссоциация с отщеплением Н+
• Чем больше m, тем сильнее кислота
• m - формальный показатель силы
кислоты
• n не влияет на силу многоосновных
кислот, т.к. конц-я H+ в растворе
определяется 1-й конст. диссоциации
33
34.
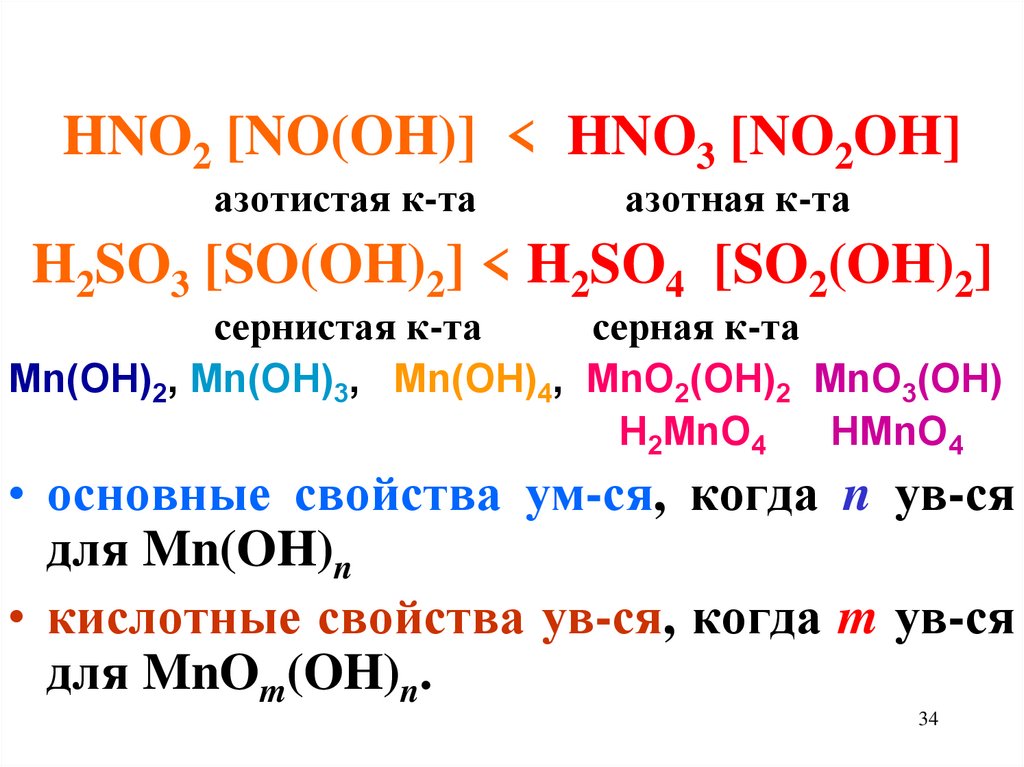
HNO2 [NO(OH)] < HNO3 [NO2OH]азотистая к-та
азотная к-та
H2SO3 [SO(OH)2] < H2SO4 [SO2(OH)2]
сернистая к-та
серная к-та
Mn(OH)2, Mn(OH)3, Mn(OH)4, MnO2(OH)2 MnO3(OH)
H2MnO4
HMnO4
• основные свойства ум-ся, когда n ув-ся
для Mn(OH)n
• кислотные свойства ув-ся, когда m ув-ся
для MnOm(OH)n.
34
35.
• Амфотерность - универсальноесвойство гидроксидов.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2+2NaOH(распл.)=Na2CuO2+2H2O
HNO3 + 2HClO4= H3O+ + NO2++2ClO4
HNO3+ 2H2SO4=H3O+ + NO2++2HSO4-
35
36.
• Ок-вос. активность гидроксидовзависит от с. о. элемента
• Окислительная способность
увеличивается, когда степень
окисления увеличивается
• Ок.-вос. активность зависит от
температуры, концентрации
окисленной и восстановленной
форм, а также pH среды
36
37. Соли оксо-кислот
• Соли более устойчивы чемкислоты, потому что связь
Ме O является более сильной
и имеет место поляризация
(связь становится более
ковалентной).
37
38. Растворимость солей
• Почти все соли моноосновныхкислот (нитраты, ацетаты,
перхлораты, и т.д.), большинство
сульфатов p- и d-элементов
растворяются в воде.
• Кислые соли (гидросульфаты,
гидрокарбонаты, и моно - и
дигидрофосфаты) очень хорошо
растворимы.
• Другие соли слегка растворимы.
38
39. Периодичность изменения свойств однотипных солей
• Температуры разложения нитратов показатель их устойчивостиNa
Mg
Al
Si, P, S, Cl
NaNO3 Mg(NO3)2 Al(NO3)3 не сущ-т
oC ~200 oC
~700
.
~70 oC
• Причины: устойчивость ум-ся с ув-ем
поляризующего действия катиона на
анион
39
40.
• В группеСоль
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
Rкат, nm 0.034 0.074 0.104 0.120 0.133
Tразл. oC
100
300
900
1200
1350
поляриз-ее действие катиона ум-ся
устойчивость ув-ся
40
41. Комплексные соединения
Образование комплексов зависит отположения элементов в периодической
таблице
p- элементы
s-элементы
Компл.соед.
d-элементы
не характерны Катионы образуют
(Be -исключение) много компл.
соед-ний
Анионы лиганды для
образования
компл.ионов
(e.g., F-,CN-, OH-,etc.)
41
42.
• [Ве(ОН)4]2-,[Ве(NH3)4]2+, и.т.д. тетраэдрические sp3-комплексы• Mg не дает устойчивых комплексов
• Al образует комплексы, но его
К.ч.= 6, sp3d2 – гибр-я, октаэдр, т. е.,
свободная 3d-орбиталь Al участвует
в образовании связи
42
43.
• Валентность элемента изменяетсяблагодаря дополнительному донорноакцепторному взаимодействию с
лигандами
• Устойчивые комплексные соединения
образуются тогда, когда КО имеет
свободные орбитали, которые являются
близкими по энергии к заполненным
или заполняющимся орбиталям
• Поэтому, более устойчивые связи
образуются, когда участвуют вакантные
2p -, 3d -, или 4f-орбитали
43
44.
• Образование комплексовстабилизирует некоторые с.о.
элементов.
• Пр: с.о. +4 для Pb неустойчива и
его соединения - сильные
окислители (PbCl4) или не сущ-т ,
как PbI4.
• H2[PbBr6]- устойчива, а PbBr4 не
существует
• (NH4)2SO4.FeSO4.6H2O более
устойчива, чем FeSO4
44
45.
• меняются кислотно-основныесвойства соединений.
• Пр: H[BF4] и H2[SiF6] более
сильные к-ты, чем HF.
45
46. Лекция 3
1. Водород2. p-Элементы VII группы
46
47. Водород
План• Атомные характеристики
• Распространенность в
природе
• Получение
• Физические свойства
• Химические свойства
• Применение
47
48.
• Водород (Н) - особый элемент• 1s1 не экранирован от ядра другими
электронами.
• I = 13,6 эВ; ЭО = 2,1
• Нет определенного места в ПС
• По количеству валент. электронов
принадлежит к I группе, образует H+
• По возможности присоединить 1е,
двухатомность и ковалентность
связи в молекуле - к 7 группе
(галогенам)
48
49. Природные ресурсы
• Кларк - 1% масс.• В виде трех изотопов:
• 11H - протий (99,984%)
• 21H – дейтерий (0,016%)
• 31H – тритий
• Н2 образуются только в верхних слоях
атмосферы
• Соединения в природе - вода,
углеводороды(нефть, газ), минералы,
живые организмы
49
50. Получение
Промышленные методы1. Конверсия метана:
СH4(г) + 2H2O(г) = 4H2 + CO2
2. Электролиз водных растворов шелочей:
2H2O = H2 + O2
3. Взаимодействие водяного пара с
раскаленным углем:
2H2O + С = 2H2 + CO2
4. Взаимодействие водяного пара с
железными стружками: H2O + Fe = H2 + FeO↓
50
51.
Лабораторные методыZn + 2HCl = ZnCl2 + H2
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6]+3H2
51
52.
Физические свойства• Бесцветный газ, без вкуса и запаха
• Ткип. = -252,80С
• Ткрист = 14К
• Во всех агрегатных состояниях в виде Н2
• Молекулы Н2 неполярны, связаны
дисперсионными силами, поэтому плохо
растворяется в воде
(в 1л воды растворяется 17.5 мл Н2)
• Очень летуч.
52
53. Химические свойства
• Водород - неметал• с.о. 0, -1, +1
• В ковалентных соед-х с.о. +1 (HCl, HBr )
• В ионных соед-х с.о. -1 (NaH, CaH2)
• При обыч. условиях малоактивен
• 2H2 + O2 =2H2O (взрывается от искры)
• H2 + F2 =2HF (H2+F2 взрывается в темноте )
• H2 + Cl2 =2HCl (хлор горит в атм. водорода)
53
54.
• 2H2 + Br2 <=> 2HBr• H2 + S(или Se) (нагревание)= H2S (H2Se)
• В обычных условиях молекул. Н2 восстанавливает только металлы с > 0,7 В
(Hg, Ag, Pd, Au)
• 2AgNO3(р) + H2(г) = 2Ag(кр) + 2HNO3(р)
• PdO(кр) + H2(г) = Pd(кр) + H2O(ж)
54
55.
• Н2 при высоких температурах активный восстановитель• GeO2 + 2H2 = Ge + 2H2O
• WO3 + 3H2 = W + 3H2O
• N2 + 3H2 = 2NH3 (t0 = 4500C, 250 ат)
• CO + 2H2 = CH3OH (t0 = 3000C, кат. Cu-Zn)
Cl2O7 + 6H2 = Cl2O + 6H2O
55
56.
• Водород особенно активен в моментвыделения в атомарном виде
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2(2H)
4H2(8Н) + NaNO3 = NH3 + NaOH + 2H2O
H2 - окислитель:
Na + H2 = NaH
Ca + H2 = CaH2
Ti + H2 = TiH2
U + H2 = UH3
• Ni, Pd, Pt хорошо растворяют водород
56
57.
+1 –1 +2 –1 +3 –1+4 -1
-3 +1
+1 -2 +1 -1
NaH MgH2 AlH3 SiH4
PH3
H2S HCl
2,1
2,5
Гидриды
0,9
1,2
1,5
1,8
Промеж.
соед-е
Кислоты
3,0
Электроотрицательности элементов
57
58.
Классификация гидридов:• ионные (солеобразные)
• ковалентные
• металлоподобные
58
59. Ионные гидриды
• Соед-я с щел. и щел.-зем. металлами:• NaH, KH, CaH2, BaH2 и др.
• Крист. в-ва с t0пл= 400 - 6000С
+
0
• NaH = Na + H (при > 600 С)
• При электролизе:
+n
• K(-) Me + ne = Me
• A(+) H- - e = H (подтверждает
существование гидридов)
59
60.
Ионные гидриды сильныевосстановители
NaH + H2O = NaOH + H2
2KH + H2S = K2S +2H2
KH + HCl = KCl + H2
KH + CO2 = HCOOK
60
61.
Ковалентные гидридысоединения с р-эл-ми
AlH3, B2H6, SiH4, SnH4, GeH4
(хим. связь - ковалентно-полярная)
• газообразные вещества
• шорошие восстановители
SiH4 + 4H2O = H4SiO4 + 4H2
SiH4 + 2O2 =SiO2 + 2H2O
SiH (to)= 2H + Si
61
62.
Металлоподобные гидридысоединения с d-элементами (бертоллиды)
TiH, TiH2, TiH1,5 и др.,
• Хим. связь - частично ионная, ков.полярная и металлическая
• Темные порошки с электрической
проводимостью, теплопроводностью и
магнитными свойствами
TiH2 (нагрев в инертной среде) = Ti + H2 ;
2TiH2 + 3O2 (горение)= 2TiO2 + 2H2O
2TiH + 6HCl = 2TiCl + 5H
62
63. Применение
• В качестве топлива (самая высокаятеплотворная способность - 33
кВт/кг)
• в пром. cинтезе NH3, HCl, CH3OH, в
органическом синтезе
• дейтерий и тритий - термоядерное
горючее
• восстановитель в металлургической
промышленности
• гидриды - компоненты ракетных
топлив
63
64.
6465. р-Элементы VII группы F, Cl, Br, I, At галогены (образующие соли)
6566.
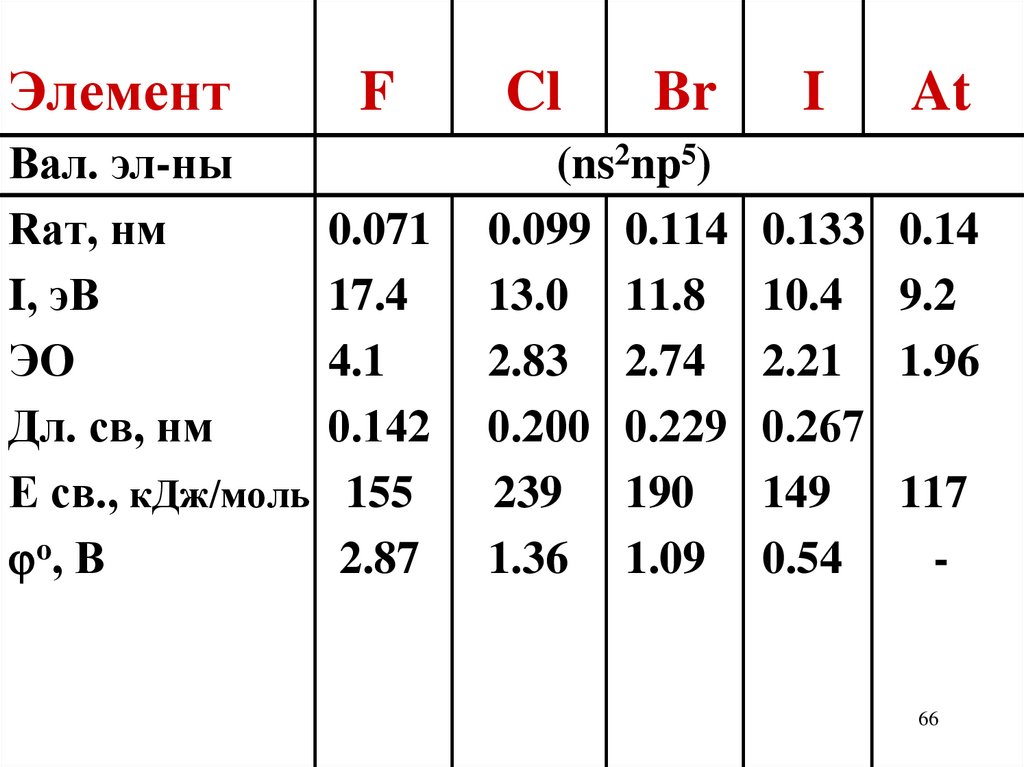
ЭлементF
Вал. эл-ны
Rат, нм
0.071
I, эВ
17.4
ЭО
4.1
Дл. св, нм
0.142
E св., кДж/моль 155
o, В
2.87
Cl
Br
(ns2np5)
0.099 0.114
13.0 11.8
2.83 2.74
0.200 0.229
239 190
1.36 1.09
I
At
0.133
10.4
2.21
0.267
149
0.54
0.14
9.2
1.96
117
-
66
67. Степени окисления
FCl
Br
I
At
-1
-1, +1, +3, +4, +5, +6, +7
-1, +1, +3, +4, +5, +6, +7
-1, +1, +3, +4, +5, +7
-1, +1, +3, +5, +7
67
68.
6869. В природе
• Из-за большой реакционной способностисуществует только в виде соединений
• CaF2 - флюорит
• Na3AlF6 - криолит
• 3Ca3(PO4)2• CaF2 - фтораппатит
• NaCl - галит
• KCl - сильвин
• KCl • MgCl2 • 6H2O - карналит
• NaCl • KCl - сильвинит
69
70.
• Br2, I2, At - рассеянные элементы• Br2, I2 получают из буровых вод
нефтяных месторождений, воды
соленых озер, морей и некоторых
морских водорослей
• At сущ-т в виде радиоактивного
изотопа 211At
70
71. Простые вещества
7172. Физические свойства
ЭлементF
Cl
Br
I
At
t0 пл, oC
-220
-101
-7
113
-
t0кип, oC
-188 -34
59 183 • F - бледно-желтый газ, с резк. запах.
• Cl - зеленовато-желтый газ, с резк. запах.
• Br - красно-бурая тяжелая жидкость
• I - темно-фиолетовые блестящие
кристаллы
Пары галогенов ядовиты
72
73. Химические свойства
7374. Отличительные особенности фтора
• отсутствие d-орбитали• малый размер атома и иона
• низкая поляризуемость
• низкая энергия дис-ции молекулы F2
• малая эн-я активации фтора в хим-х
реакциях (< 4кДж/моль)
• высокое К.ч. в ионных соединениях
74
75. Фтор
• F2 (газ) очень реакционно способно• Реагирует со всеми металлами и
неметаллами и с большинством
сложных веществ
• F2 - всегда окислитель
F Cl Br I
Ок-ная активность ум-ся
75
76.
• Фтор ок-т все элементы до макс. с.о.S + 3F2 = SF6
P4 + 10F2 = P4F10
• Аммиак, вода, стекловата горят в
атмосфере фтора:
2H2O + 2F2 = 4HF + O2
2NH3 + 3F2 = 6HF + N2
SiO2 + 2F2 = SiF4+O2
76
77.
2HNO3 + 4F2 = 2HF + 2NF3 + 3O2вос-ль
H2SO4 + 4F2 = 2HF + SF6 + 2O2
вос-ль
77
78. Хлор
• кратность связи в молекулеCl2 > 1, т.е. Сl2 прочнее F2
78
79.
• При станд. условиях Cl2 не реаг-т сC, N2, O2 и благ. газами.
• P, Na, Sb самовозгораются в атм.Cl2
• Цепная реакция Cl2 c H2
h
Cl2 2Cl
H2 + Cl = HCl + H
H + Cl2 = HCl + Cl
79
80.
8081.
8182.
8283.
Cl2 - сильный окислитель2Fe + 3Cl2 = 2FeCl3
K2MnO4 + Cl2 = KMnO4 + KCl
• Cl2 раст-ся в воде (до 1% )
• Cl2aq - хлорная вода (Сl2.xH2O)
Cl2 + H2O HCl + HClO
3Cl2 + 3H2O = 5HCl + HClO3
Cl2 + 2NaOHхол. = NaCl + NaClO + H2O
3Cl2+ 6NaOHгоряч. = 5NaCl + NaClO3 + 3H2O
83
84. Бром
• t0 кип Br2 > t0 кип F2 и Cl2• Br2 раст-ся в воде до 4%
• Br2aq - бромная вода (Br2.xH2O)
• При станд. усл-х Br2 не реагирует
с C, N2, O2 и благ. газами
84
85.
• Br2 жидкость и часто реакцииидут более энергично, чем с
Cl2
• (+) с.о. менее характерны из-за
вторичной периодичности
• Br2 диспропорционирует в
воде и щелочах как и Сl2
85
86. Йод
• I2 - тв. в-во с металл. блеском,• I2 при нагревании реагирует со
многими простыми веществами,
образуя йодиды
• I2 хорошо раст-ся в спирте
(5% р-р - йодная настойка)
• Плохо раст-ся в воде
.
• I2aq - йодная вода (I2 xH2O)
86
87.
• I2 окисляет многие металлы исоединения, разрушает резину.
• Восстановительные свойства I2
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O
87
88. Сравнение окислительной активности галогенов
5F2 + Cl2 + 6H2O = 10HF + 2HClO35Cl2 + Br2 + 6H2 = 10HCl + 2HBrO3
5Br2 + I2 + 6H2O = 10HBr + 2HIO3
88
89. Получение галогенов
• F2 - электролиз расплава HF c KH2F3• Cl2
1) электролиз NaCl (с добавлением KCl)
2) MnO2 + 4HCl (t0)= Cl2 + MnCl2 + 2H2O
3) 2AuCl3 (t0) = Au + 3Cl2
• Br2 и I2 получают из природной воды,
обрабатывая хлором
2NaI + Cl2 = 2NaCl + I2
89
90.
9091. Применение галогенов
• F2 - в технологии получения урана• фторорганические соединения (тефлон),
хладоагенты (фреоны),
электроизоляционные материалы,
инсектициды
• Cl2 -стерилизация воды, отбеливание
тканей и бумаги, производство
хлорорг.продуктов и ядохимикатов.
• Br2 и I2 - производство лекарственных
препаратов
91
92. ЛЕКЦИЯ 4
ПЛАН1. Бинарные соединеия галогенов
2. Оксо-кислоты галогенов и их
соли
93. Бинарные соединения
9394. Галогеноводороды
ПолучениеCaF2 + H2SO4conc.(3000C) = CaSO4 + 2HF
CaCl2 + H2SO4conc. = CaSO4 +2HCl
6HBr + H2SO4conc. = 3Br2 + S + 4H2O,
HI + 6HNO3conc. = HIO3 + 6NO2 + 3H2O
KBr + H3PO4 = KH2PO4 + HBr
KI + H3PO4 = KH2PO4 + HI
94
95.
гидролиз галогенидов:SiCl4 + H2O = SiO2 + 4HCl
PBr3 + 3H2O = H3PO3 + 3HBr
2P + 3I2 + 6H2O = 2H3PO3 + 6HI
95
96.
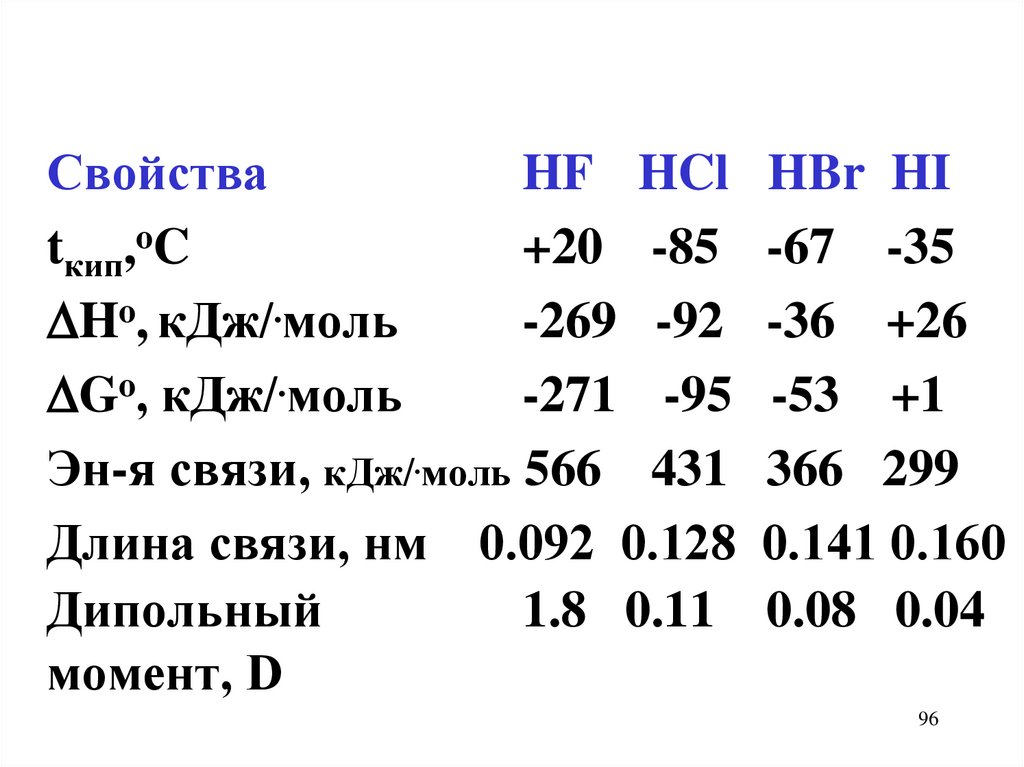
СвойстваHF HCl HBr HI
tкип,oC
+20 -85 -67 -35
Ho, кДж/.моль
-269 -92 -36 +26
Go, кДж/.моль
-271 -95 -53 +1
Эн-я связи, кДж/.моль 566 431 366 299
Длина связи, нм 0.092 0.128 0.141 0.160
Дипольный
1.8 0.11 0.08 0.04
момент, D
96
97.
• НГ - б/ц газы с резк. запахом.• Хим. связь - ков. полярная
• Водородная связь между
молекулами HF
• HF неограниченно раст-ся в
воде
97
98.
• Водор. связи нет между мол-миHCl, т.к. ковал-сть связи HCl < HF
• Водный р-р HF - к-та средн. силы
(Кд = 6.10-4)
+
HF + H2O H3O + F
F + HF HF2
• Кислые соли KHF2, NaHF2 и др.
SiO2 + 4HF = SiF4 + 2H2O
W+2HNO3+8HF = H2WF8 + 2NO+ 4H2O
98
99.
• HCl (36%), HBr(60%), HI (65%)сильные к-ты (HCl<HBr<HI)• Ок-ная активность HГ не велика,
т.к. ок-ль H+ (протон)
Zn + 2HCl = ZnCl2 + H2
• Вос-ная активность Г ионов
I > Br > Cl > F
2HBr(г) + Cl2(г) = 2HCl(г) + Br2(г)
2HI(г) + S(тв) = H2S(г) + I2(г)
99
100. Галиды (галогениды)
• С.о. галогенида = -1• Хим. связь меняется от ионной в соед-х с
металлами до ков-ой в галогенидах
неметаллов.
Соед-е
CaF2
CaCl2 CaBr2 CaI2
Gof, kДж/моль -1168.5 -749.4 -666.6 -533.1
• Фториды более устойчивы и хуже
растворимы в воде
• Хорошо растворимы KF, NaF, AgF
100
101.
• Фториды Sc и лантаноидов наиболееустойчивы среди d-элементов
• Устойчивость фторидов ум-ся вниз по группе
и растет с ув-м с.о. у d-элементов
Соед-е
TaF
TaF3
TaF5
Hof, kДж/моль +259.4
-786.6
-1903.6
Гидролиз некоторых фторидов:
SiF4 + 3H2O = H2SiO3 + 4HF
• Фториды неметаллов - газы или
жидкости с молек. структурой.
Некоторые инертны (CF4, NF3, SF6)
101
102.
Изменение кислотно-основныхсвойств фторидов
102
103.
• Устойчивость хлоридов sэлементов ув-ся вниз по группе• Для d-элементов устойчивость
ум-ся вниз по группе для низших
хлоридов и ув-ся для высших
хлоридов.
Соед-е CrCl2 MoCl2 WCl2 MoCl6 WCl6
Gof, -356.3 -274.4 -216.5 -388.6 -469.0
• Бромиды и йодиды похожи на
хлориды
103
104.
BeCl2 + SnCl4 = Be[SnCl6]основание
кислота
2KCl + BeCl2 = K2[BeCl4]
основание
кислота
2NaBr + CdBr2 = Na2[CdBr4]
основание
кислота
104
105.
• Галогениды щел. и щел-зем. мет-врастворяются в воде без гидролиза.
• Растворимые галогениды менее
активных металлов гидролизуются
обратимо
FeCl3 + 2H2O Fe(OH)2Cl + 2HCl
• Галогениды неметаллов
разлагаются водой необратимо
PCl5 + 4H2O = 5HCl + H3PO4,
SiCl4 + 3H2O = HCl + H2SiO3
PI3 + 3H2O = H3PO3 + 3HI
105
106. Получение галогенидов
Mg + HCl = MgCl2 + H2 ,ZnO + 2HCl = ZnCl2 + H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O,
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Pb(NO3)2 + 2KI = 2KNO3 + PbI2
Si + 2Cl2 = SiCl4
P4 + 10Cl2 = 4PCl5
106
107. Интергалогениды
XX’ CIF - газBrF - газ
XX3` CIF3 - газ
BrF3 - ж.
ICI - тв.
IBr - тв.
IF3 - тв.
IC13 - тв.
XX5`CIF5 - газ
BrF5 - ж.
IF5 - ж.
XX7` IF7 - газ
107
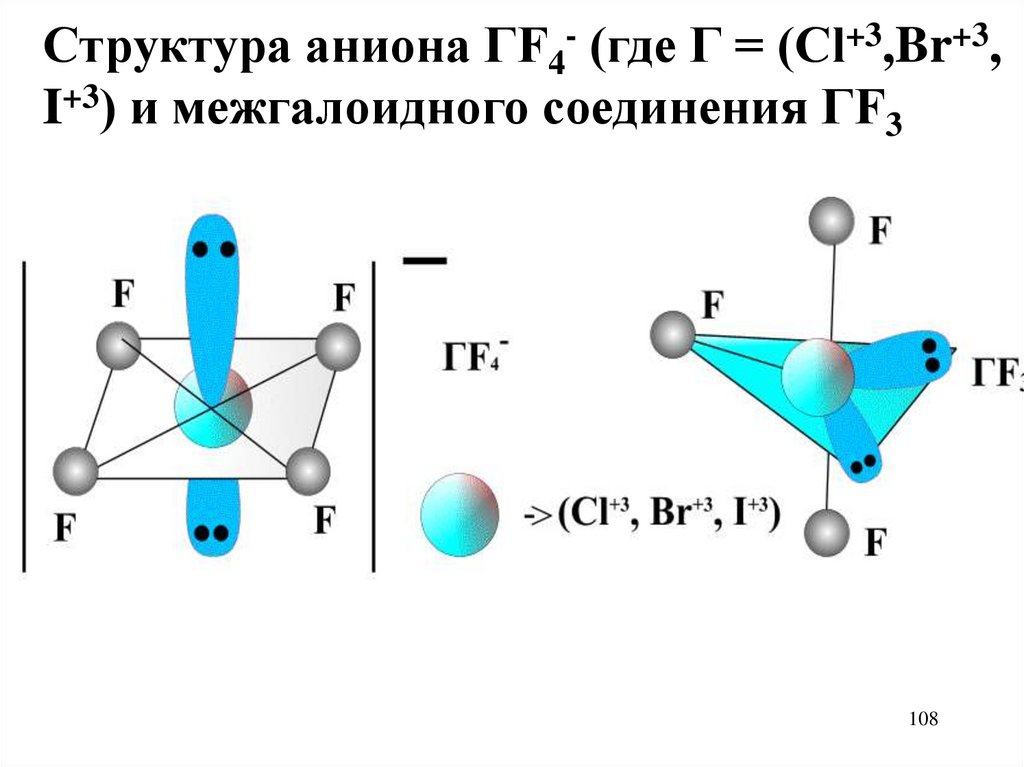
108.
Структура аниона ГF4- (где Г = (Cl+3,Br+3,I+3) и межгалоидного соединения ГF3
108
109.
• Энергия связи ум-ся с ув-м с.о.ClF - ClF3 - ClF5
устойчивость ум-ся
Диспропорционирование:
3BrF = Br2 + BrF3
Взаимодействие с водой:
IF5 + 3H2O = HIO3 + 5HF
109
110. Применение галогенидов
• NaCl - исходное в-во при полученииNaOH, Cl2, Na2CO3, Na2SO4
• KСl - удобрение и сырье для получения
KOH и солей калия
• AlCl3 - катализатор
• CCl4 - растворитель жиров и масел
• SiCl4 - исход. В-во для получнения п/п Si
• AgBr - в фотографии
• NaI, KI - в медицине
110
111. Оксиды
С.О. ФторидХлориды
Бромиды Йодиды
-1 OF2
+1
+2
+3
+4
+5
+6
+7
Cl2O
Br2O
ClO, Cl2O2 Br2O2
IO
ClO2, Cl2O4 BrO2 I2O4
Br2O5
I2O5
ClO3, Cl2O6 BrO3
I2O6
Cl2O7
(Br2O7) (I2O7)
Практическое значение имеют ClO и I O
111
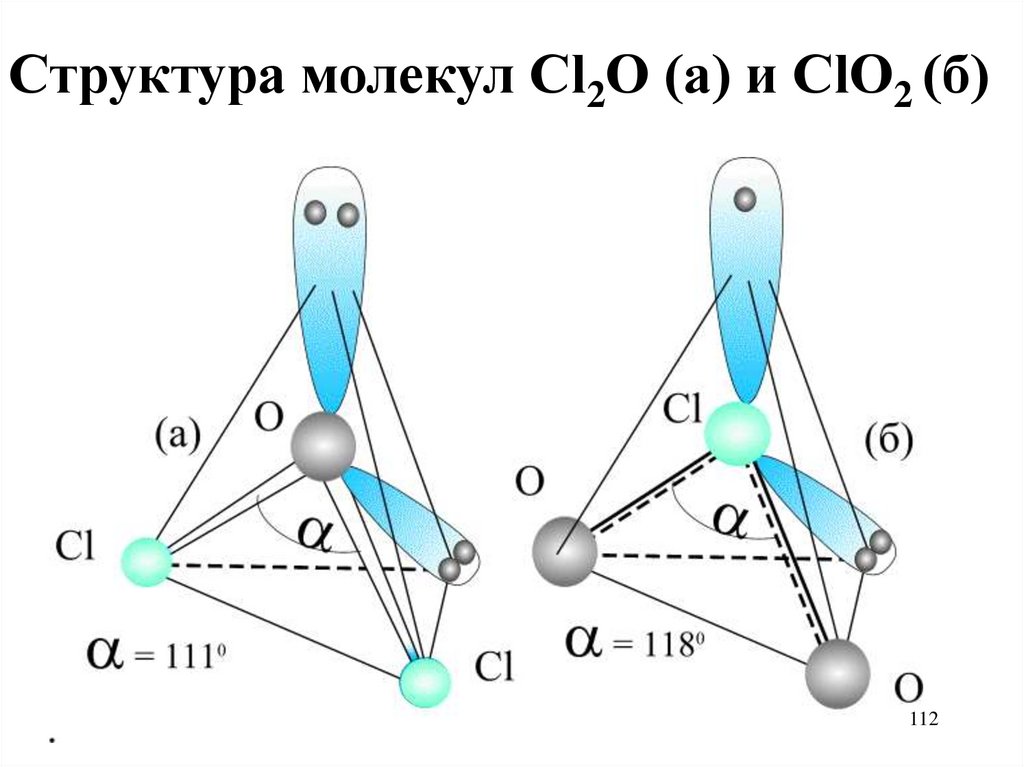
112.
Структура молекул Cl2O (a) и ClO2 (б)112
113.
Структура молекулы Cl2O7113
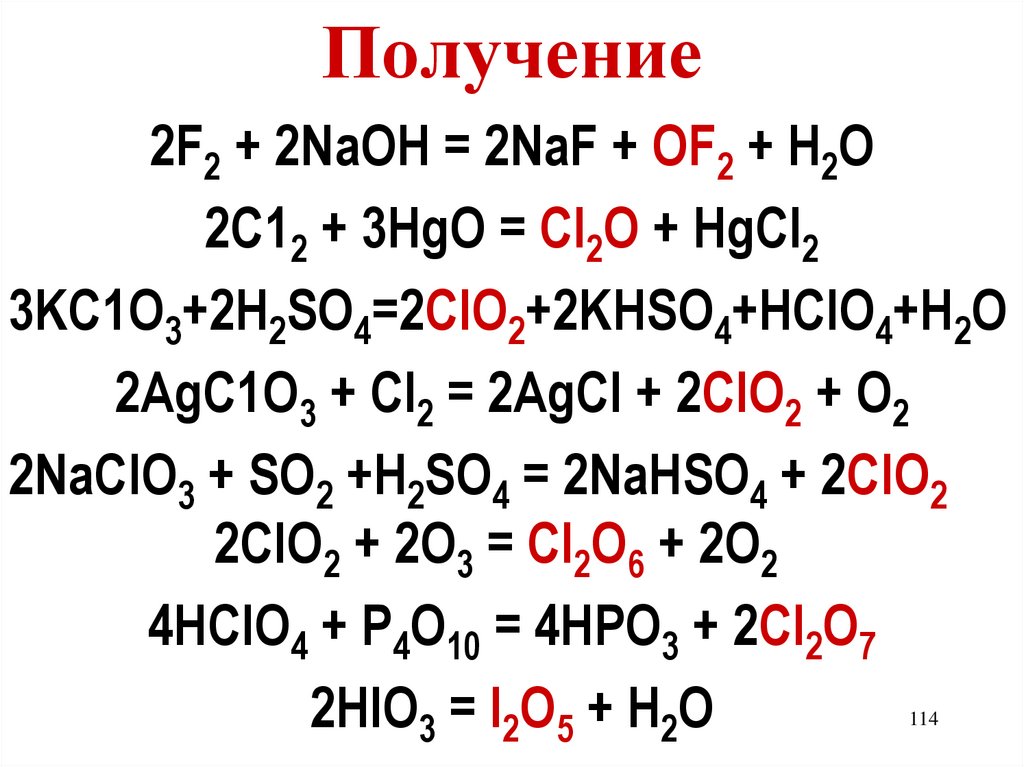
114.
Получение2F2 + 2NaOH = 2NaF + OF2 + H2O
2C12 + 3HgO = Cl2O + HgCl2
3KC1O3+2H2SO4=2ClO2+2KHSO4+HCIO4+H2O
2AgC1O3 + Cl2 = 2AgCI + 2ClO2 + O2
2NaClO3 + SO2 +H2SO4 = 2NaHSO4 + 2ClO2
2ClO2 + 2O3 = Cl2O6 + 2O2
4HClO4 + P4O10 = 4HPO3 + 2Cl2O7
2HIO3 = I2O5 + H2O
114
115. Устойчивость оксидов
• Т/д неустойчивы (кроме I2O5).• Взрываются при нагревании и
сотрясении, в присутствии орг. веществ.
• Cl2O(г), Cl2O6(ж) разлагаются при комн. to
• Сl2O7(ж) более устойчив
4Cl2O = 2ClO2 + 3Cl2
2Cl2O6 = 2ClO2 + Cl2 + 4O2
2I2O5 (>3000C) = 2I2 + 5O2
115
116. Свойства и применение
Все оксиды кислотные (кроме OF2)Cl2O+H2O = 2HCIO
3Cl2O+6NaOH = 2NaClO3+4NaCl+3H2O
ClO2 используют для дизенфекции
помещений
6ClO2 + 3H2O = 5HC1O3 + HCl
2ClO2+2NaOH = NaClO3+NaClO2+H2O
Cl2O6+2NaOH = NaClO3+NaClO4+H2O
116
117. Оксиды галогенов -сильные окислители
2NaOH + OF2 = O2 + 2NaF + H2O2Cl2O + S = SO2 + Cl2
ClO2 + P + 2H2O = H3PO4 + HCl
I2O5 - индикатор угарного газа
I2O5 + 5СO = I2 + 5CO2
117
118. Оксо-кислоты и их соли
• HOF не ионизируется в воде, солейне образует, разлагается при
комн.температуре:
HOF + H2O = H2O2 + HF
• Сl, Br,I образуют кислоты и соли
в с.о. +1, +3, +5, +7
118
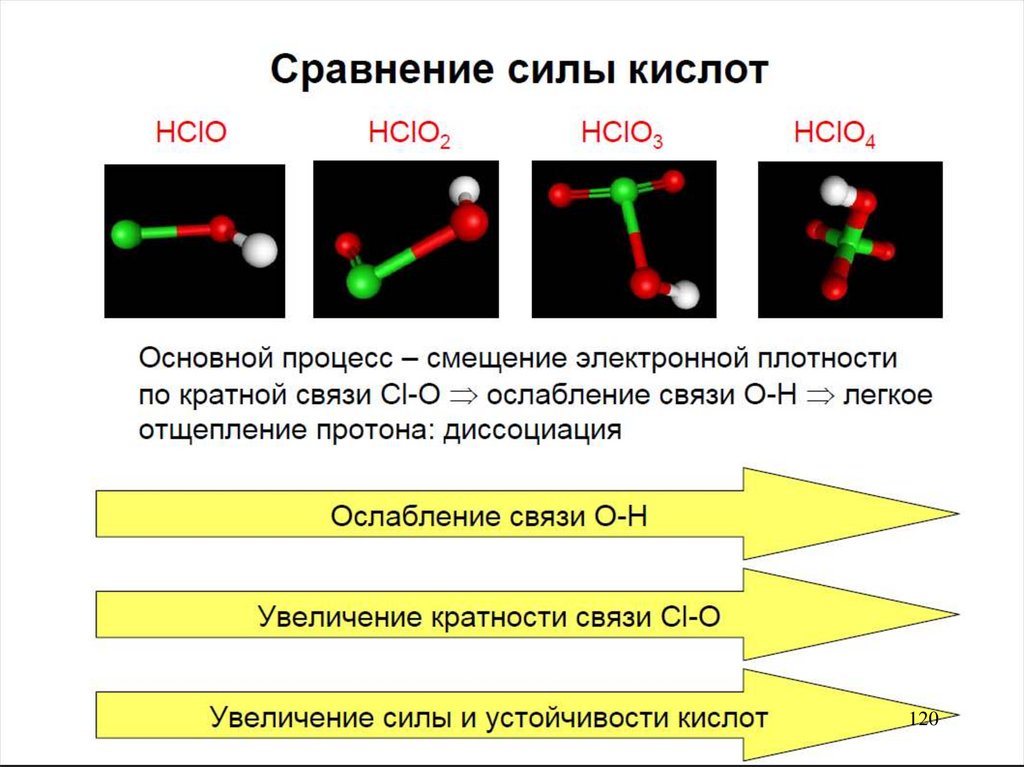
119.
с.о.+1 HCIO HBrO HIO
+3 HCIO2 +5 HCIO3 HBrO3 HIO3
Ув-е ок-й ак-ти
Ув-е ок-й ак-ти
Ум-е кисл.св-в
Ум-е устойч-ти
+7 HClO4 HBrO4 H5IO6
Ув-е ок-й ак-ти
Ув-е кислот св-в
Ум-е устойчивости
HCIO, HBrO, HIO HCIO2 - сильные окислители
HCIO3, HBrO3, HIO3, HClO4, HBrO4 - сильные
119
кислоты
120.
120121.
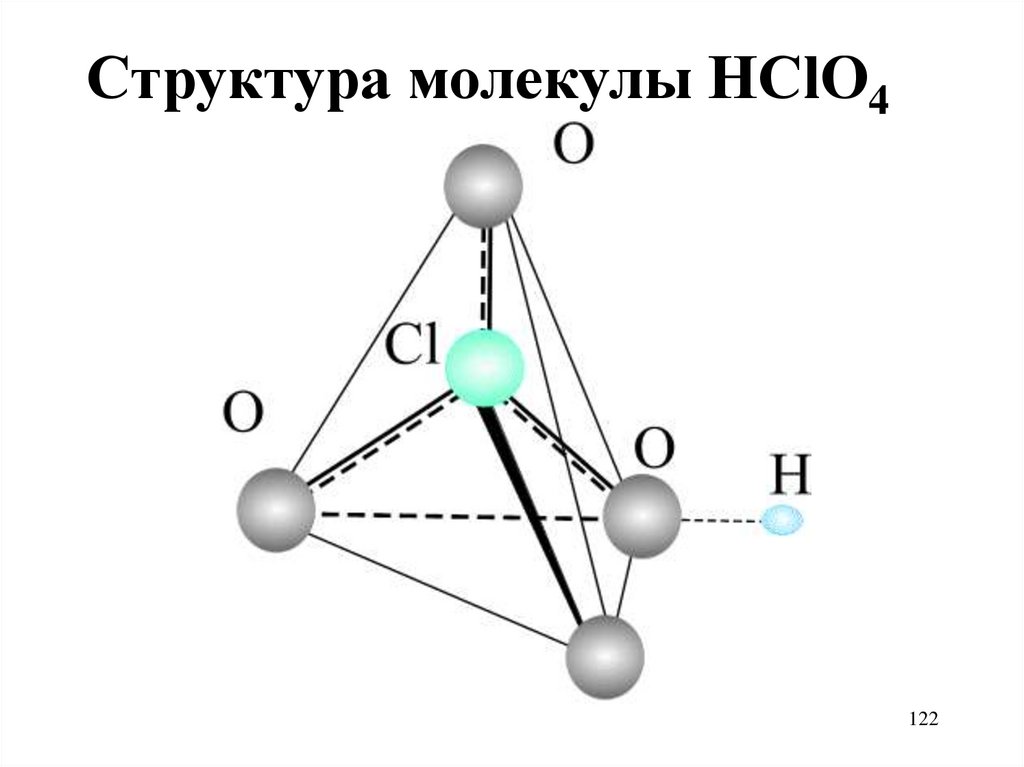
121122.
Структура молекулы HClO4122
123. Схема ок-вос. потенциалов
Кислая среда (рН = 0, o, В )+1.19
ClO4
+1.21
ClO3
+1.41
+1.64
HClO2
+1.63
HClO
+1.36
Cl
Cl2
+1.49
+1.56
+1.45
+1.38
123
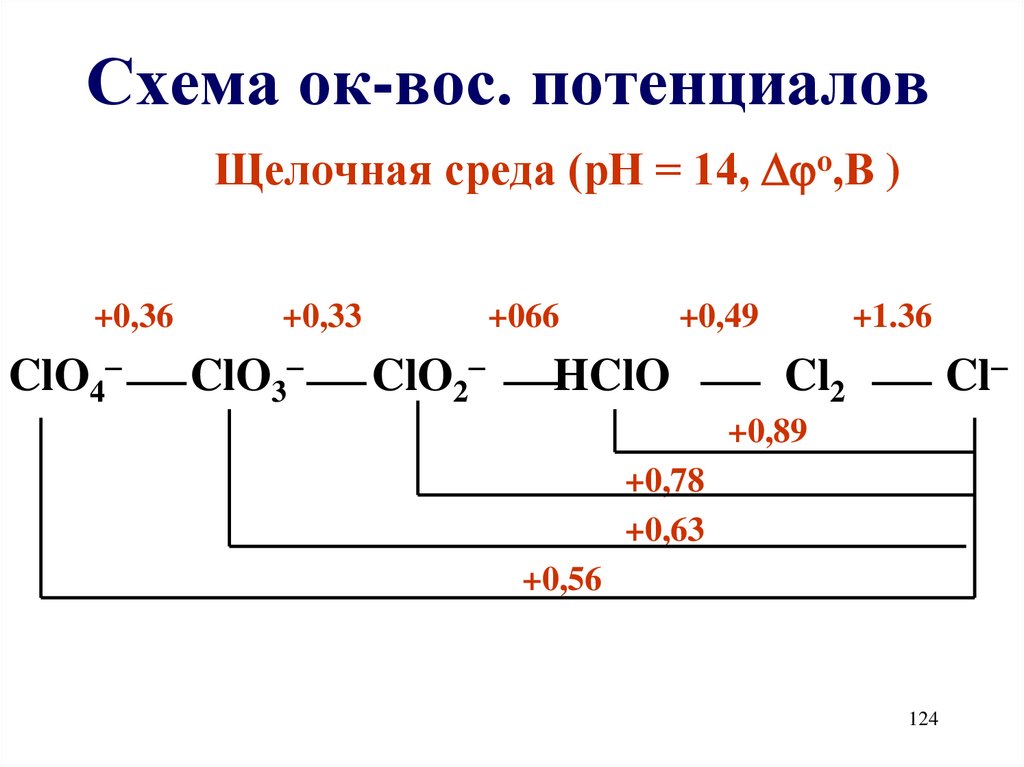
124. Схема ок-вос. потенциалов
Щелочная среда (рН = 14, o,В )+0,36
ClO4
+0,33
ClO3
+066
ClO2
+0,49
HClO
+1.36
Cl
Cl2
+0,89
+0,78
+0,63
+0,56
124
125.
• С позиций термодинамикивозможны реакции в растворе:
• 5HClO = HClO3 + 2Cl2 + H2O, o = 0.42 В
• 3HClO = HClO3 + 2HCl,
o = 0.28 В
• 2HClO2 = HClO3 + HClO,
o = 0.42 В
• 3HClO2 = 2HClO3 + HCl,
o = 0.35 В
• 2HClO3 = HClO4 + HClO2,
o = 0.02 В
• 4HClO3 = 3HClO4 + HCl,
o = 0.19 В
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + CaCl(OCl) + H2O
белильная известь125
126.
• Конц. HClO4 HBrO4 - сильные ок-ли4HClO4 + P4 =(HPO3)4 + 2Cl2 + 2O2
HBrO4 + MnSO4 = MnO2 + Br2 + H2SO4
• Разб. р-ры к-т теряют ок-е св-ва
• К-ты более сильные ок-ли, чем
соли:
2HClO + NaClO = NaClO3 + 2HCl
2NaClO + 4HCl = Cl2 + 2NaCl + 2H2O
126
127.
HIO3 + 5HI = 3I2 + 3H2OKClO3 + 6HCl = 3Cl2 + KCl + 3H2O
• В нейтрал. водных растворах ГО3 и
ГО4 ок-ми не являются.
2KClO3(кр) + 3S (t0C) = 3SO2 + 2KCl
KClO4(кр) + K2S (t0C) = K2SO4 + KCl
• H5IO6 слаб. к-та, но более сильный ок-ль
5H5IO6+2MnSO4=2HMnO4+5HIO3+
+2H2+SO4+7H2O
127
128.
• Ок-вос. р-ции для систем Br2 – H2O и I2 –H2O похожи на Cl2 – H2O, но есть и
отличия
Кислая среда (PH = 0, o, V)
+1.76
BrO4
+1.49
BrO3
+1.7
H5IO6-
+1.14
IO3
HIO
+1.19
+1.59
+1.09
HBrO
+1.52
Br2
+1.45
+0.54
I2
+1.2
Br
I
128
129.
2ClO2 + Na2O2 = 2NaC1O2 + O25HClO2 = 4ClO2 + HCl + 2H2O
KBr + 3KCIO = KBrO3 +3KCI
2KC1O3 + I2 = 2KIO3+Cl2
129
130.
Cl2 + H2O = HClO + HCl,o = -0.27 В
3Br2 + 3H2O = 5HBr + HBrO3, o = -0.45 В
3I2 + 3H2O = 5HI + HIO3,
o = -0.66 В
NaBrO3 + XeF2 + H2O = NaBrO4 + 2HF + Xe
NaBrO3+F2+2NaOH = NaBrO4+ 2NaF + H2O
130



















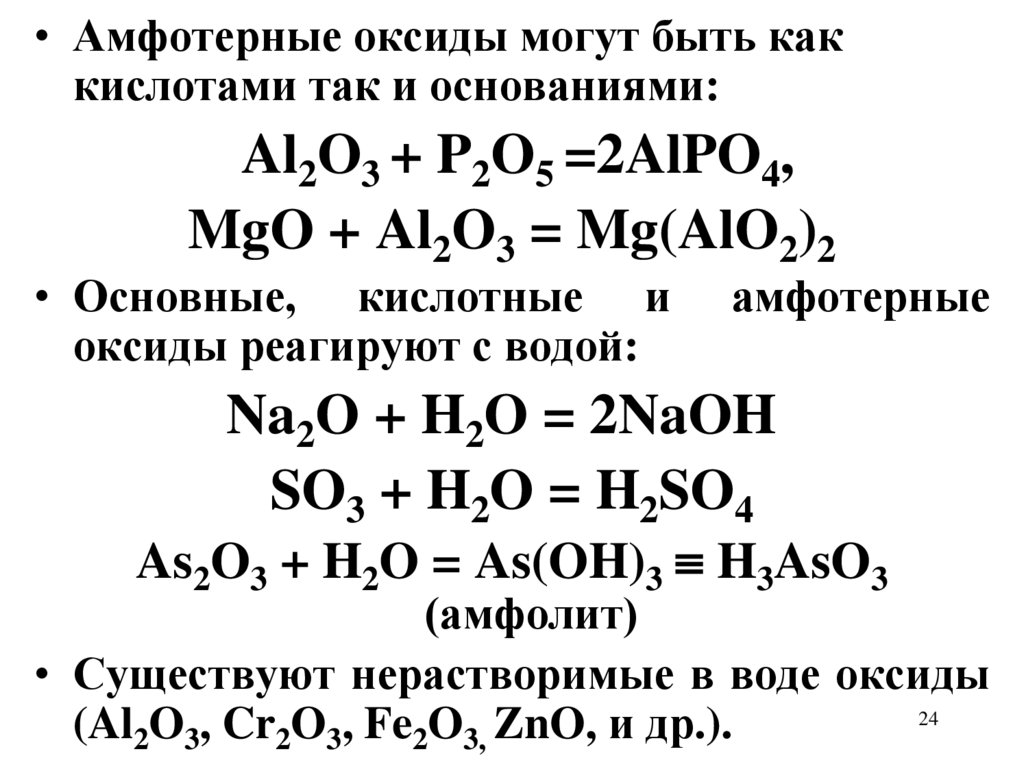


















































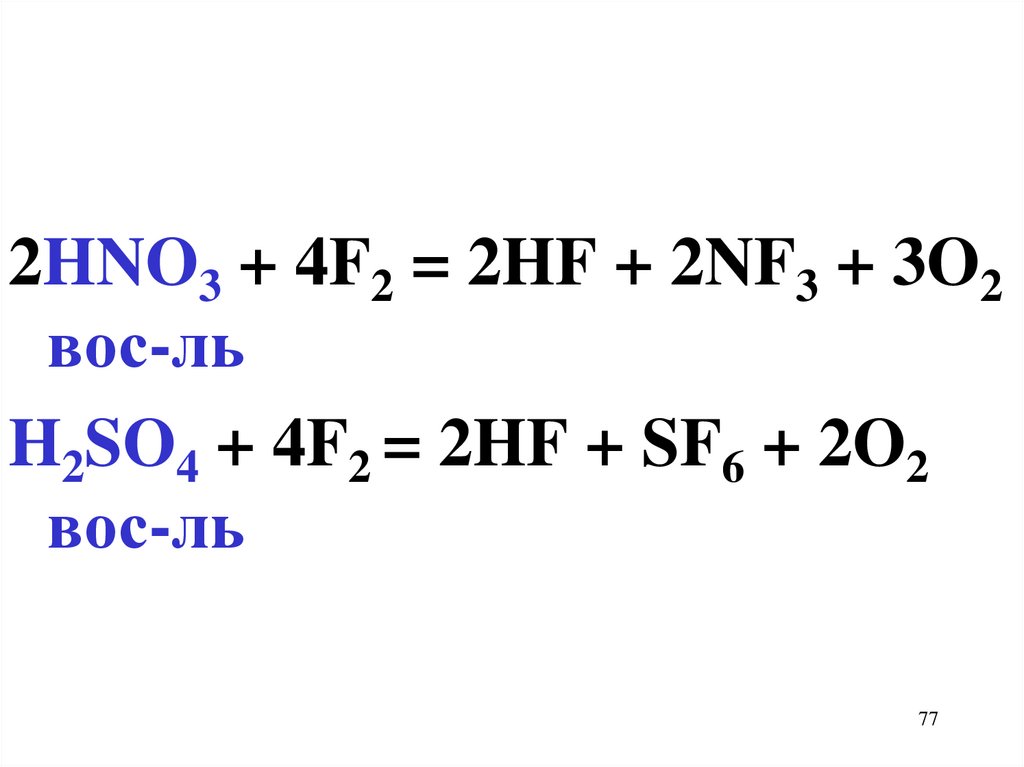









































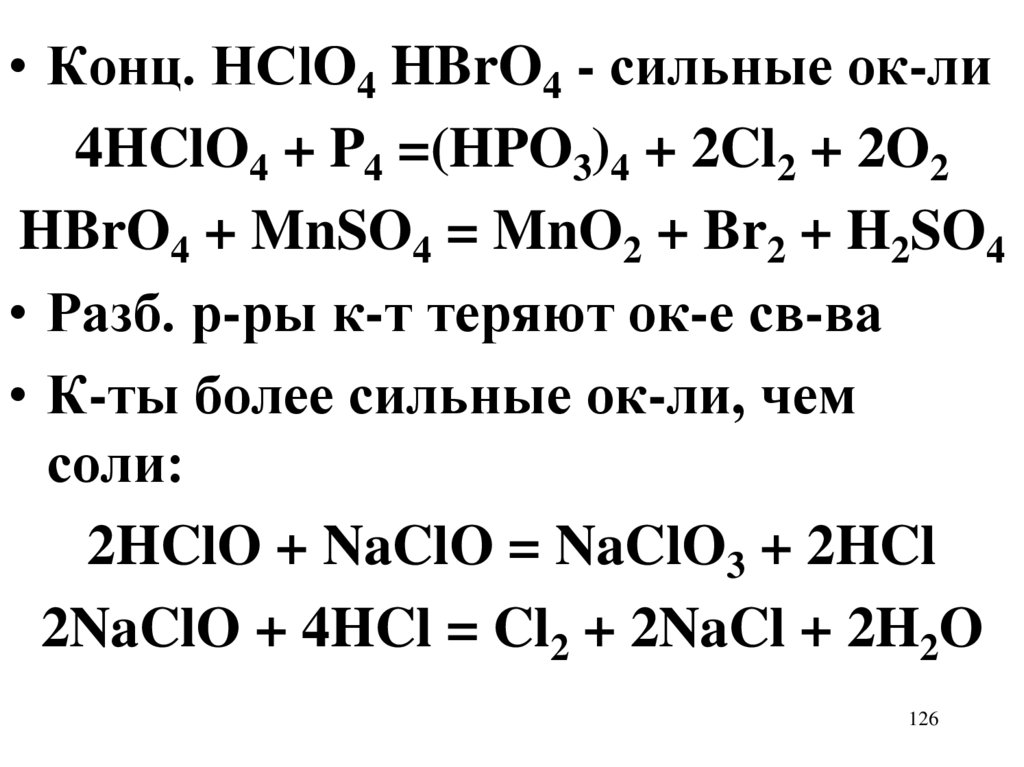


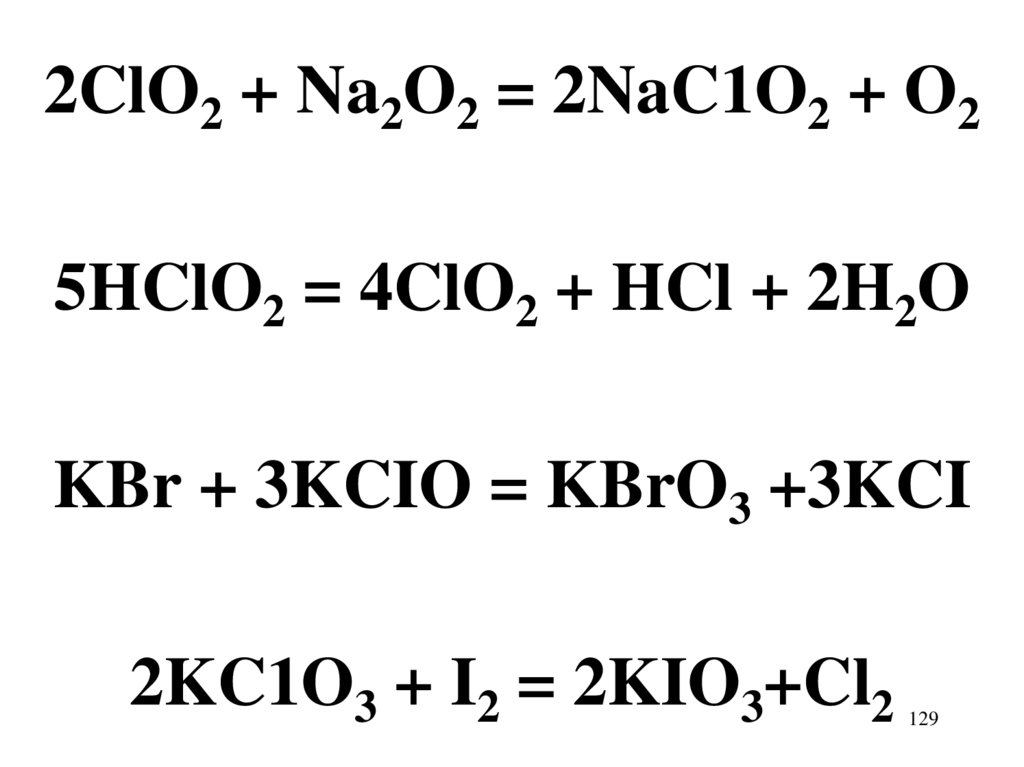


 chemistry
chemistry








