Similar presentations:
Основные характеристики химического равновесия:
1.
1Основные характеристики химического равновесия:
1. Сохранение равновесия вследствие равенства скоростей прямой и обратной
реакций.
2. Неизменностью равновесного состояния во времени при постоянных внешних
условиях.
3. Возможностью подхода к состоянию равновесия с двух сторон.
4. Подвижностью равновесия, например, самопроизвольным восстановлением
состояния равновесия, после снятия внешнего воздействия, вызвавшего
отклонение системы от положения равновесия
2.
2Влияние изменения внешних условий на положение равновесия или принцип
Ле-Шателье – Брауна (предложенного в 1884 году французским химиком Анри Луи
Ле-Шателье ) формулируется следующим образом:
Если на систему, находящуюся в состоянии равновесия воздействовать
извне, изменяя какое-либо из условий, определяющих положение
равновесия (температура, давление, концентрация), то равновесие
смещается таким образом, чтобы уменьшить изменение.
Фактически, воздействие на равновесную систему в большей степени
изменяет скорость одного из направлений – прямого или обратного, в результате
чего система переходит в новое состояние равновесия, при котором скорости
прямой и обратной реакции вновь станут равными, но будут отличаться от
первоначального значения.
Принцип Ле-Шателье мы используем для качественной оценки изменения
внешних условий на положение равновесия.
3.
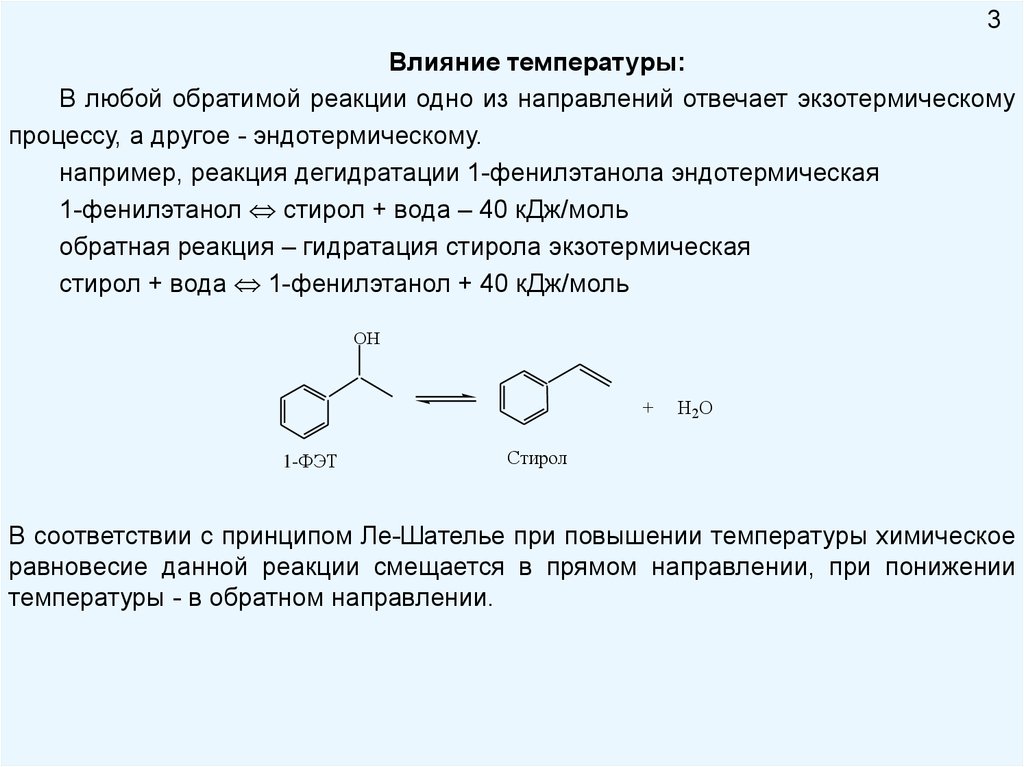
3Влияние температуры:
В любой обратимой реакции одно из направлений отвечает экзотермическому
процессу, а другое - эндотермическому.
например, реакция дегидратации 1-фенилэтанола эндотермическая
1-фенилэтанол стирол + вода – 40 кДж/моль
обратная реакция – гидратация стирола экзотермическая
стирол + вода 1-фенилэтанол + 40 кДж/моль
OН
+
1-ФЭТ
Н2О
Стирол
В соответствии с принципом Ле-Шателье при повышении температуры химическое
равновесие данной реакции смещается в прямом направлении, при понижении
температуры - в обратном направлении.
4.
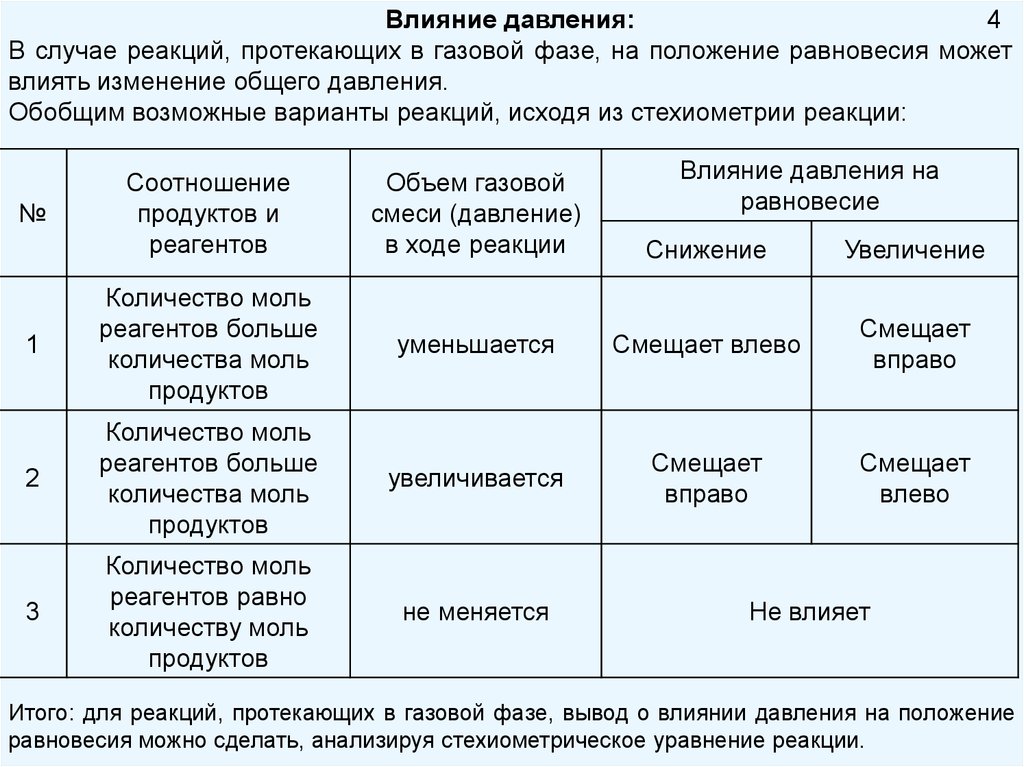
4Влияние давления:
В случае реакций, протекающих в газовой фазе, на положение равновесия может
влиять изменение общего давления.
Обобщим возможные варианты реакций, исходя из стехиометрии реакции:
Влияние давления на
равновесие
Соотношение
продуктов и
реагентов
Объем газовой
смеси (давление)
в ходе реакции
Снижение
Увеличение
1
Количество моль
реагентов больше
количества моль
продуктов
уменьшается
Смещает влево
Смещает
вправо
2
Количество моль
реагентов больше
количества моль
продуктов
увеличивается
Смещает
вправо
Смещает
влево
3
Количество моль
реагентов равно
количеству моль
продуктов
не меняется
№
Не влияет
Итого: для реакций, протекающих в газовой фазе, вывод о влиянии давления на положение
равновесия можно сделать, анализируя стехиометрическое уравнение реакции.
5.
5N2+3H2 2 NH3
C2H5OH C2H4 + H2O
C2H5OH + C2H5OH (C2H5)2O + H2O
Вопрос:
как следует изменить давление для смещения равновесия этих реакций в целевом
направлении?
6.
6Введение в газофазную систему инертного разбавителя (инертного в данных
условиях газа), при условии, что общее давление в системе не изменяется (p =
const), эквивалентно снижению общего давления:
Парциальное давление газа в смеси определяется мольной долей газа и общим
давлением (закон Дальтона):
Pi = Ni P
Уменьшение любого из сомножителей приводит к уменьшению их произведения,
а введение в систему разбавителя сопровождается снижением мольной доли
участников реакции.
7.
7N2+3H2 2 NH3
C2H5OH C2H4 + H2O
C2H5OH + C2H5OH (C2H5)2O + H2O
Вопрос:
В каком направлении сместиться равновесие этих реакций при введении в систему
инертного разбавителя?
8.
8Влияние концентрации:
Введение в равновесную систему дополнительного количества одного из
компонентов сдвигает равновесие в направлении, которое приводит к
расходованию этого компонента. Если добавляется реагент то равновесие
сместиться в сторону продуктов (вправо), если добавляется продукт реакции, то
равновесие смещается влево в сторону исходных веществ.
На практике для реакций, в которых принимает участие несколько реагентов,
увеличивают концентрацию одного из них (например, наиболее легко выделяемого
из реакционной массы или самого дешевого), и за счет этого обеспечивают
глубокое превращение другого реагента (трудно выделяемого или наиболее
дорогостоящего).
Другой подход – выведение из реакционной зоны продуктов реакции,
например равновесие реакции дегидратации 1-фенилэтанола, в случае
проведения ее в жидкой фазе может быть смещено вправо, за счет удаления воды
и стирола (температура кипения воды 100 С, стирола 141 С, 1-ФЭТ 204 С).
OН
+
1-ФЭТ
Стирол
Н2О
9.
9Количественная оценка положения равновесия
Для количественной оценки положения равновесия (влияния внешних
условий на положение равновесия) используем константу равновесия.
Способы определения константы равновесия
1. Расчет константы равновесия по термодинамическим данным.
2. Экспериментальное определение.
Периодический реактор смешения, реактор вытеснения непрерывного
действия.
Увеличиваем время пребывания реакционной смеси в аппарате до
достижения постоянного состава, далее исходя из состава равновесной
смеси рассчитываем константу равновесия.
10.
10В периодическом реакторе (простейший пример – колба с мешалкой)
проводится реакция А B, оба вещества находятся в одной фазе, состав
реакционной смеси в зависимости от времени приведен в таблице.
Вопрос: чему равна константа равновесия в условиях эксперимента?
№ пробы
Время реакции, минут
1
Концентрация компонента, моль/л
А (реагент)
В (продукт)
0
1
0
2
20
0,7
0,3
3
40
0,5
0,5
4
60
0,4
0,6
5
80
0,35
0,65
6
120
0,3
0,7
7
180
0,27
0,73
8
240
0,25
0,75
11.
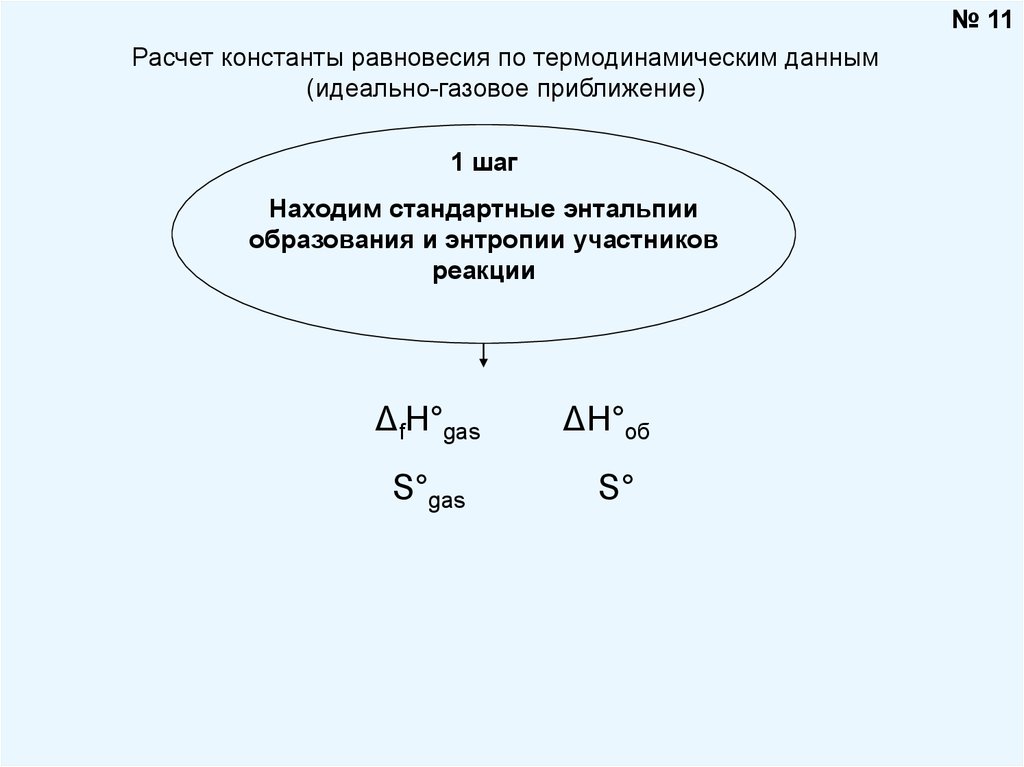
№ 11Расчет константы равновесия по термодинамическим данным
(идеально-газовое приближение)
1 шаг
Находим стандартные энтальпии
образования и энтропии участников
реакции
ΔfH°gas
ΔH°об
S°gas
S°
12.
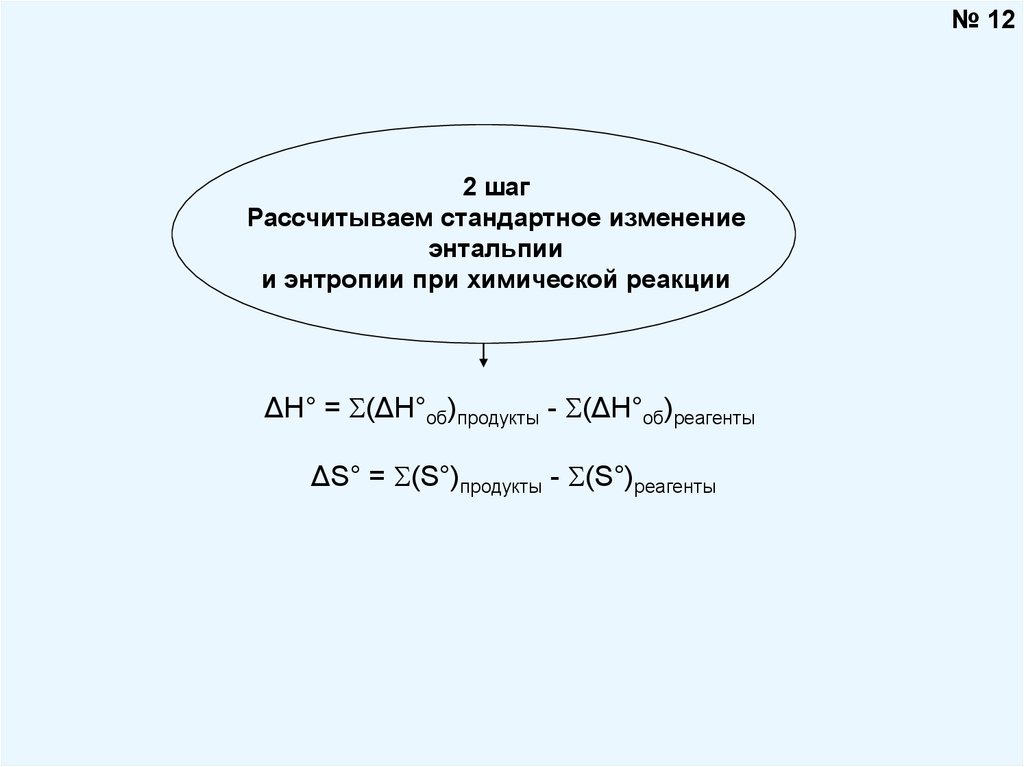
№ 122 шаг
Рассчитываем стандартное изменение
энтальпии
и энтропии при химической реакции
ΔH° = (ΔH°об)продукты - (ΔH°об)реагенты
ΔS° = (S°)продукты - (S°)реагенты
13.
№ 133 шаг
Рассчитываем изменение энергии Гиббса
при химической реакции
Строго только для 298 К:
ΔG298° = ΔH°- T ΔS° = ΔH°- 298 ΔS°
Оценочно для любой температуры при допущении что энтальпия и
энтропия не зависят от температуры (первое приближение Улиха):
ΔGТ° = ΔH298°- T ΔS298°
Точно для любых температур по методу Темкина-Шварцмана
0
0
GT0 H 298
T ( S 298
a M 0 b M 1 c M 2 d M 3 )
где a, b, c, d – сумма коэффициентов полиномиального уравнения
идеальногазовой теплоемкости реагентов и продуктов СР = a + b·Т + c·Т2 + d·Т3;
Mi – М-интегралы
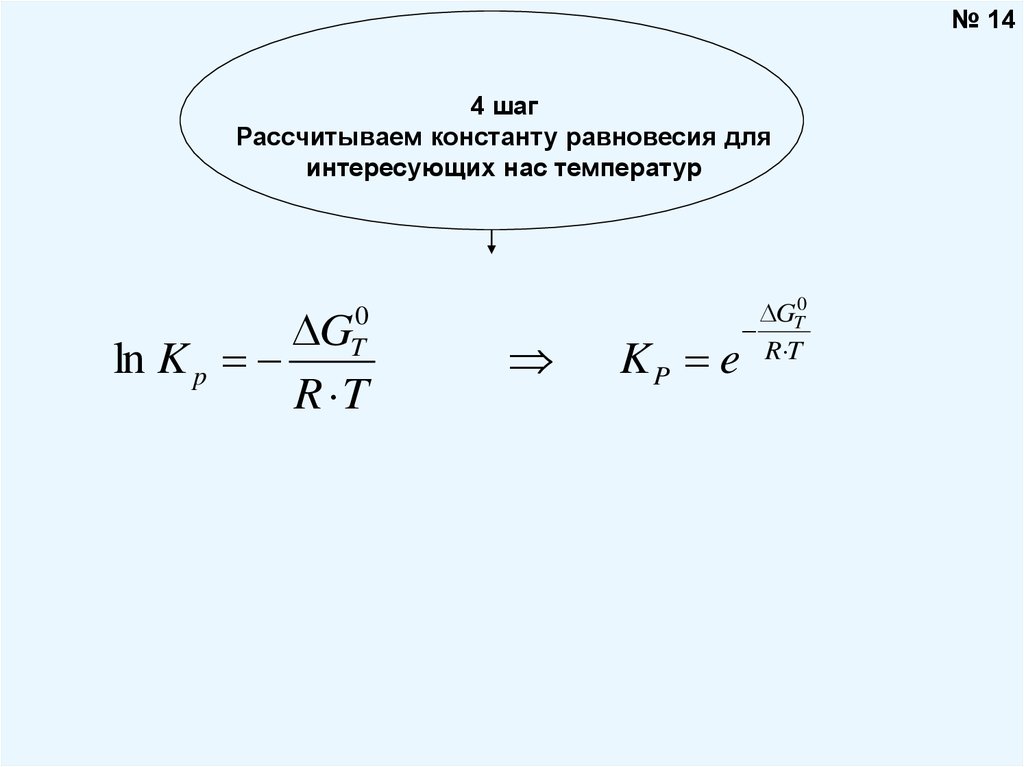
14.
№ 144 шаг
Рассчитываем константу равновесия для
интересующих нас температур
G
ln K p
R T
0
T
KP e
GT0
R T
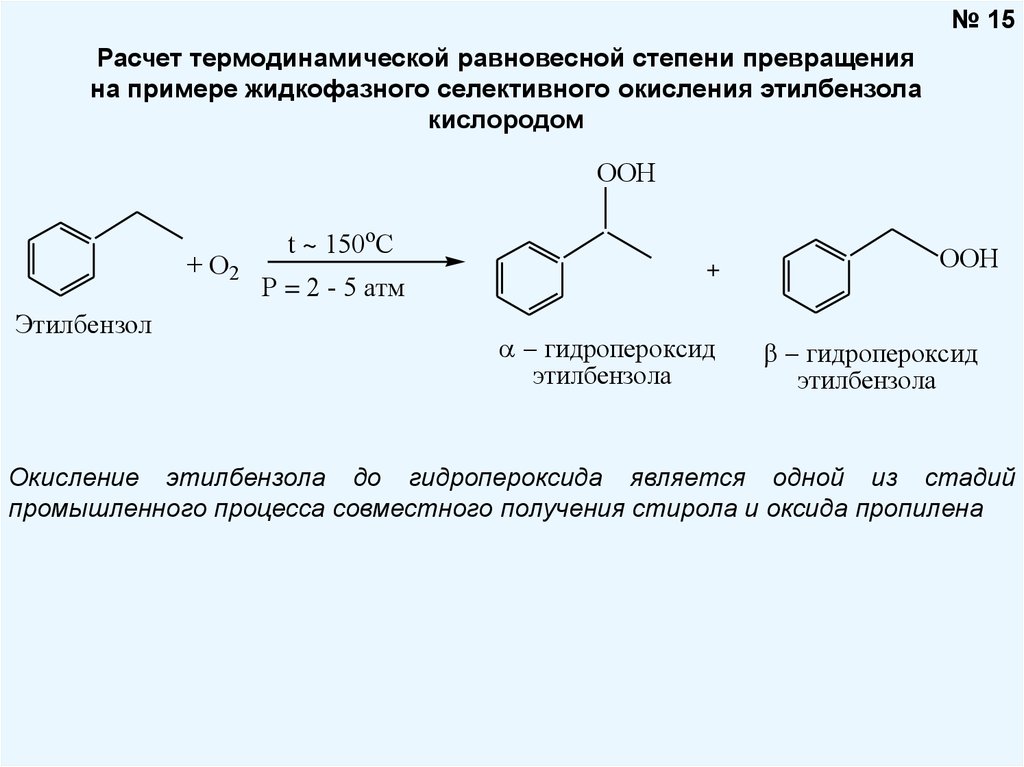
15.
№ 15Расчет термодинамической равновесной степени превращения
на примере жидкофазного селективного окисления этилбензола
кислородом
OOН
+ O2
Этилбензол
t ~ 150oC
P = 2 - 5 атм
+
гидропероксид
этилбензола
OOН
гидропероксид
этилбензола
Окисление этилбензола до гидропероксида является одной из стадий
промышленного процесса совместного получения стирола и оксида пропилена
16.
Доля технологий получения оксида пропилена (ОП) в мире:№ 16
Интегральная мощность производств по ОП:
~ 9 млн. тонн/год
ОП/
т-бутанол
(PO/TBA)
15.5%
Пероксид
водорода
(HPPO)
4.9%
ОП/Стирол
(PO/SM)
32.7%
Кумол
гидроперок
сид (СHP)
3.7%
Хлор
(CHPO)
43.2%
ОП / Стирол
(технология PO/SM)
ОП:
СТИРОЛ:
в России - 100 %
в России ~ 30 %
(в мире ~ 20 %)
ОАО «Нижнекамскнефтехим»
17.
№ 17Процесс совместного получения оксида пропилена и стирола
OOН
1. Жидкофазное окисление
этилбензола молекулярным
кислородом
+ O2
t ~ 150oC
P = 2 - 5 атм
гидропероксид
этилбензола
ГПЭБ)
Этилбензол
OH
OOН
2. Жидкофазное каталитическое
эпоксидирование пропилена
гидропероксидом этилбензола
O
t = 80-130oC
+
ГПЭБ
Пропилен
P=20-70 атм
Mo-kat
+
Оксид
1-фенилэтанол
пропилена
(метилфенилкарбинол)
(ОП)
3. Парофазная каталитическая
дегидратация 1-фенилэтанола
до стирола
OH
O
4. Жидкофазное каталитическое
гидрирование метилфенилкетона
до 1-фенилэтанола
H2, Cu-катализатор
t ~ 170oC, P ~ 50 атм
Метилфенилкетон
(ацетофенон)
1-фенилэтанол
18.
№ 18ЭБ, О2
OOН
ОКИСЛЕНИЕ
+
O2
ЭБ
ГПЭБ
β-ГПЭБ
ЭПОКСИДИРОВАНИЕ
Оксид
пропилена
2-ФЭТ
OOН
OH
+
+
Пропилен
ГПЭБ
OH
ДЕГИДРАТАЦИЯ
-H2O
2-ФЭТ
2-ФЭТ
Стирол
Стирол
2-ФЭТ
OH
ГИДРИРОВАНИЕ
2-ФЭТ
2-ФЭТ
2-фенилэтанол
(2-ФЭТ)
O
ОП
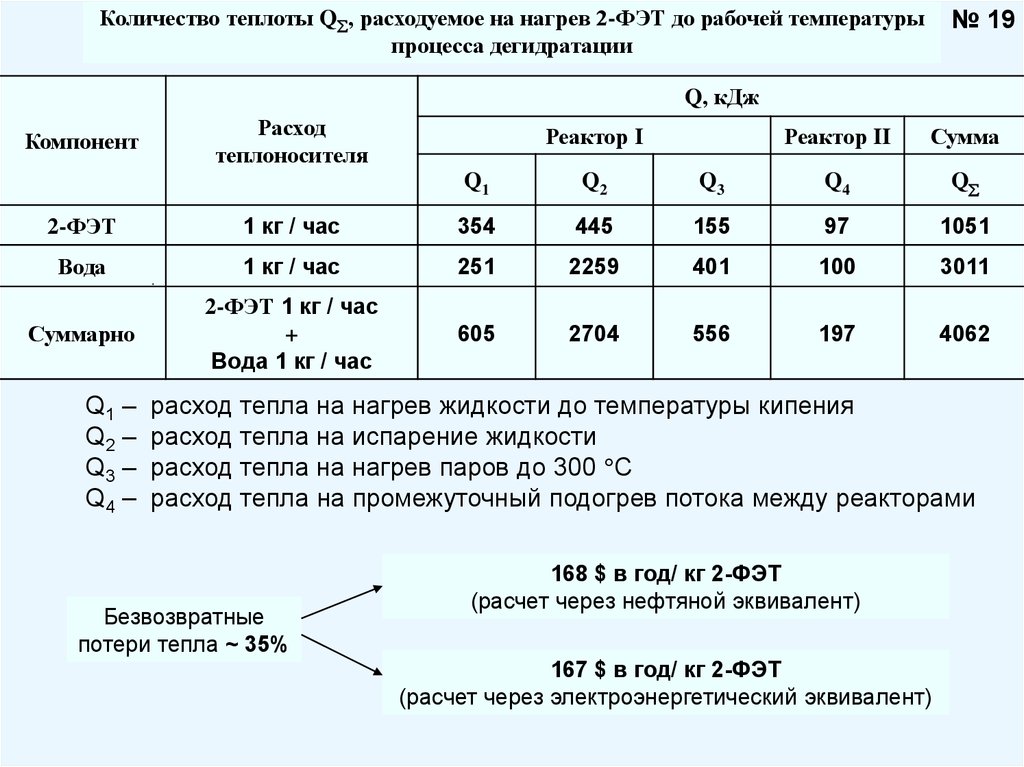
19.
№ 19Количество теплоты Q , расходуемое на нагрев 2-ФЭТ до рабочей температуры
процесса дегидратации
Q, кДж
Компонент
Расход
теплоносителя
Реактор I
Реактор II
Сумма
Q1
Q2
Q3
Q4
Q
2-ФЭТ
1 кг / час
354
445
155
97
1051
Вода
1 кг / час
251
2259
401
100
3011
Суммарно
2-ФЭТ 1 кг / час
+
Вода 1 кг / час
605
2704
556
197
4062
Q1 –
Q2 –
Q3 –
Q4 –
расход тепла на нагрев жидкости до температуры кипения
расход тепла на испарение жидкости
расход тепла на нагрев паров до 300 С
расход тепла на промежуточный подогрев потока между реакторами
Безвозвратные
потери тепла ~ 35%
168 $ в год/ кг 2-ФЭТ
(расчет через нефтяной эквивалент)
167 $ в год/ кг 2-ФЭТ
(расчет через электроэнергетический эквивалент)
20.
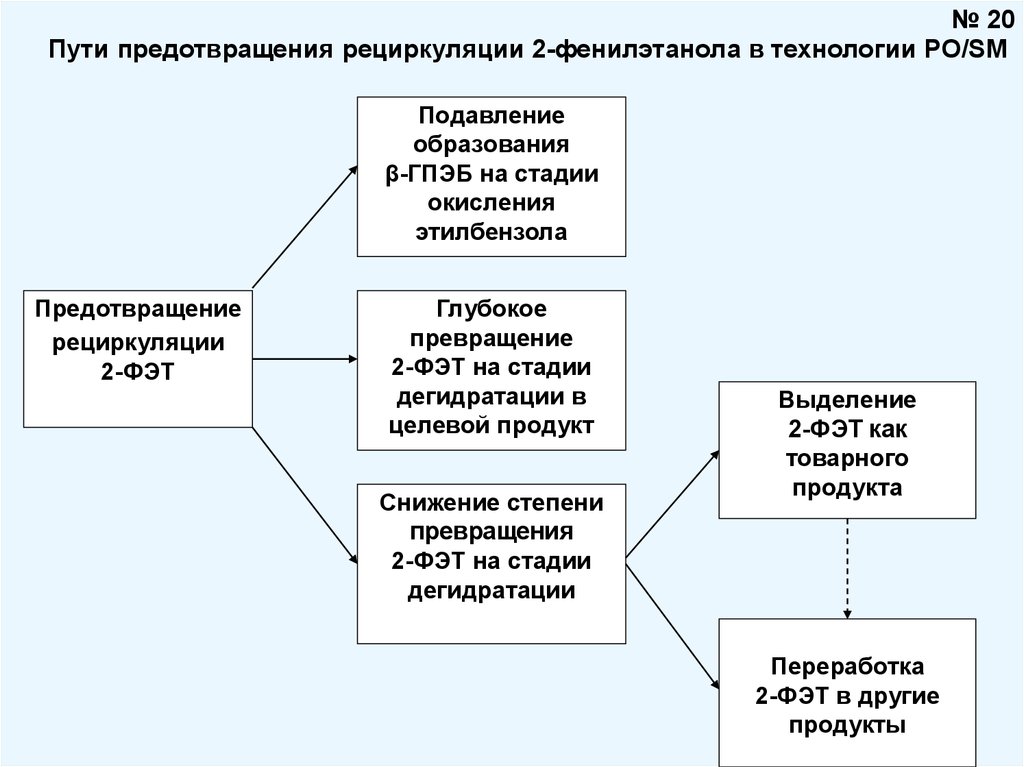
№ 20Пути предотвращения рециркуляции 2-фенилэтанола в технологии PO/SM
Подавление
образования
β-ГПЭБ на стадии
окисления
этилбензола
Предотвращение
рециркуляции
2-ФЭТ
Глубокое
превращение
2-ФЭТ на стадии
дегидратации в
целевой продукт
Снижение степени
превращения
2-ФЭТ на стадии
дегидратации
Выделение
2-ФЭТ как
товарного
продукта
Переработка
2-ФЭТ в другие
продукты
21.
№ 21Задаем состав исходной смеси как «а моль ЭБ и b моль кислорода».
Реакция окисления ЭБ протекает параллельно с образованием
α-
ГПЭБ и β-ГПЭБ.
Принимаем, что равновесная степень превращения этилбензола по
первой реакции равна х , по второй реакции равна х .
Тогда, при достижении равновесия образуется:
α-ГПЭБ
a x [моль]
β-ГПЭБ
a x [моль]
И остается не превращенным
Этилбензола
a (1-х -х ) [моль]
Кислорода
b (1-x -x ) [моль]
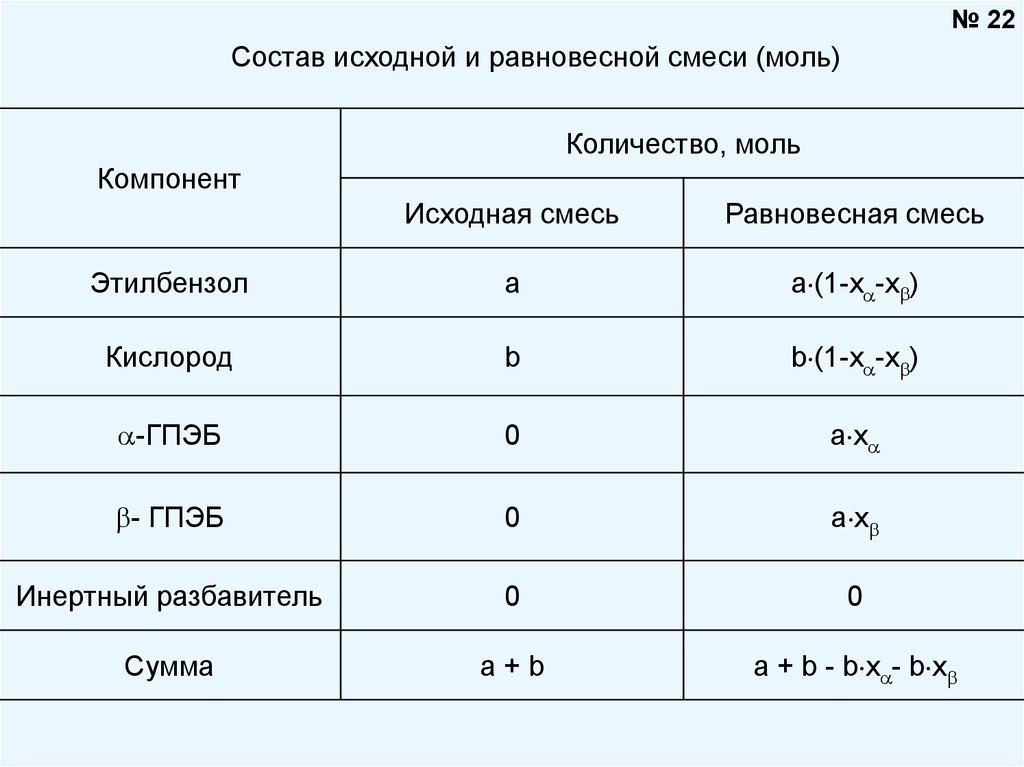
22.
№ 22Состав исходной и равновесной смеси (моль)
Количество, моль
Компонент
Исходная смесь
Равновесная смесь
Этилбензол
а
a (1-х -х )
Кислород
b
b (1-x -x )
-ГПЭБ
0
a x
- ГПЭБ
0
a x
Инертный разбавитель
0
0
Сумма
a+b
a + b - b x - b x
23.
№ 23Для реакции в идеальной газовой смеси константа равновесия может
быть выражена через парциальные давления компонентов (Рi):
РГПЭБ
Кр
РЭБ РКислород
Парциальные давления компонентов в равновесной смеси
вычисляются по закону Дальтона:
Ni
Рi
Pобщ ,
Ni
где Рi – парциальное давление i-го компонента, атм; Робщ – общее давление в
системе, атм., Ni – число молей i-го компонента, Ni – общее число молей в
системе
24.
№ 24Парциальные давления продуктов
равновесия в неявном виде:
РЭБ
и
реагентов
а (1 х x ) Робщ
( а b b х b x )
Р Кислород
Р ГПЭБ
Р ГПЭБ
b (1 х x ) Робщ
(а b b х b x )
а х Робщ
(а b b х b x )
а х Робщ
(а b b х b x )
при
достижении
25.
№ 25Константа равновесия для реакции (1)
х (а b b х b x )
Р ГПЭБ
K1
2
РЭБ РКислород
(1 х x ) b Pобщ
Константа равновесия для реакции (2)
K2
Р ГПЭБ
Р, ЭБ РКислород
х (а b b х b x )
(1 х x ) 2 b Pобщ
26.
№ 26Далее, задаваясь
составом исходной смеси (конкретные значения переменных a и b),
давлением (конкретное значение переменной Pобщ)
температурой (конкретные значения констант равновесия К1 и К2)
решаем систему из двух уравнений при ограничениях:
0 ≤ x ≤ 1;
0 ≤ x ≤ 1;
0 ≤ (x + x ) ≤ 1
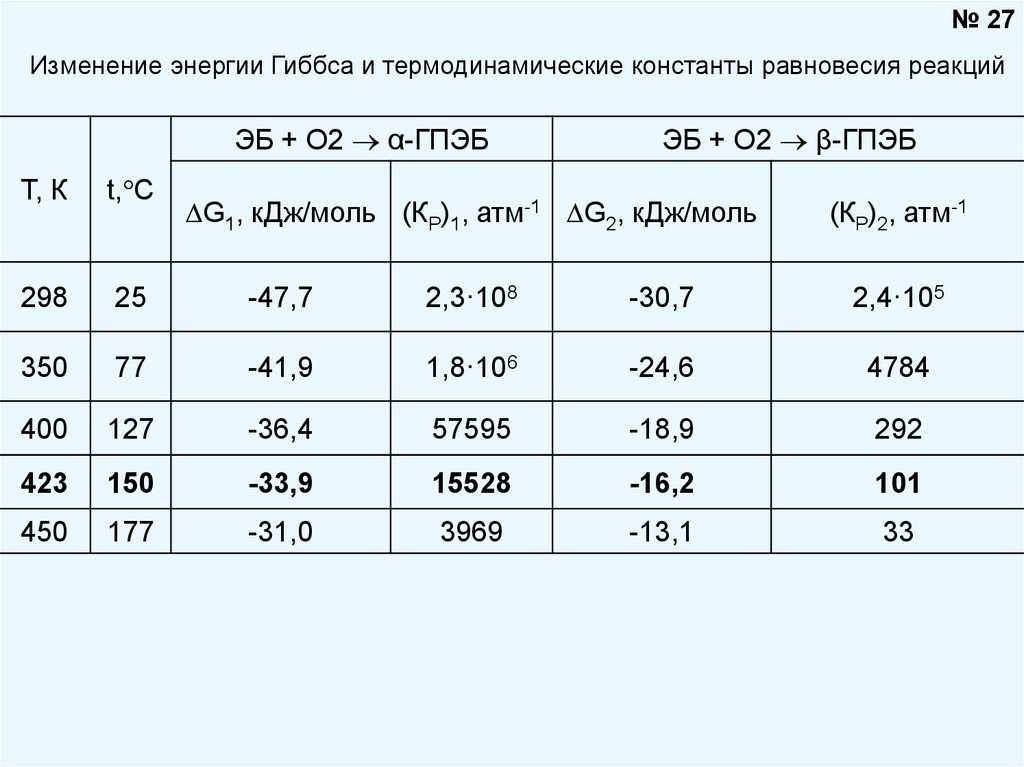
27.
№ 27Изменение энергии Гиббса и термодинамические константы равновесия реакций
ЭБ + О2 α-ГПЭБ
Т, К
t, С
298
25
350
ЭБ + О2 β-ГПЭБ
G1, кДж/моль (КР)1, атм-1 G2, кДж/моль
(КР)2, атм-1
-47,7
2,3·108
-30,7
2,4·105
77
-41,9
1,8·106
-24,6
4784
400
127
-36,4
57595
-18,9
292
423
150
-33,9
15528
-16,2
101
450
177
-31,0
3969
-13,1
33
28.
№ 28Расчетная равновесная степень превращения ЭБ при параллельно
протекающих реакциях образования - и -ГПЭБ. Молярное соотношение
ЭБ : О2 = 1:1
Температура,
К
Р=1 атм
Р=10 атм
Равновесный
выход,
%-мол
Равновесный
выход,
%-мол
-ГПЭБ
-ГПЭБ
-ГПЭБ
-ГПЭБ
298
99,89
0,10
99,89
0,10
400
99,08
0,50
99,36
0,50
423
98,56
0,64
99,10
0,64
450
97,60
0,82
98,90
0,83
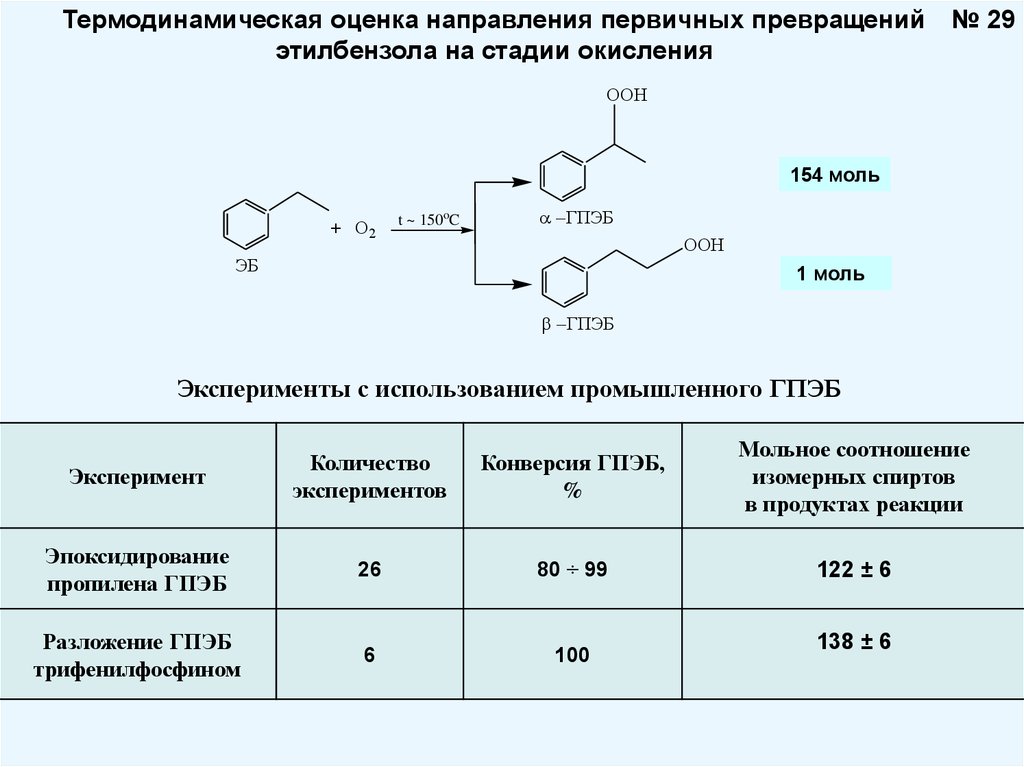
29.
Термодинамическая оценка направления первичных превращенийэтилбензола на стадии окисления
№ 29
OOН
154 моль
+ O2
t ~ 150oC
ГПЭБ
OOН
ЭБ
1 моль
ГПЭБ
Эксперименты с использованием промышленного ГПЭБ
Эксперимент
Количество
экспериментов
Конверсия ГПЭБ,
%
Мольное соотношение
изомерных спиртов
в продуктах реакции
Эпоксидирование
пропилена ГПЭБ
26
80 ÷ 99
122 ± 6
Разложение ГПЭБ
трифенилфосфином
6
100
138 ± 6
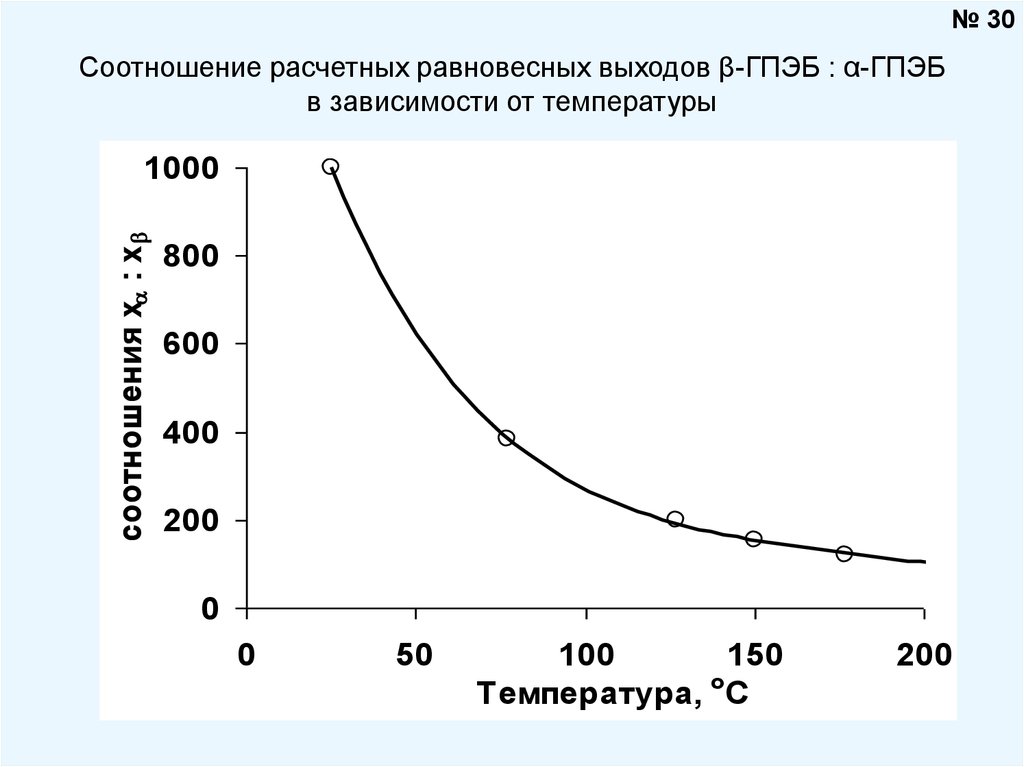
30.
№ 30Соотношение расчетных равновесных выходов β-ГПЭБ : α-ГПЭБ
в зависимости от температуры
соотношения х : х
1000
800
600
400
200
0
0
50
100
150
Температура, оС
200
31.
К вопросу об альтернативных источниках углеводородов и их производныхПроизводство биотоплива с использованием зерновых, сахарного тростника и
масличных в качестве сырья:
в 2009 году
Около 1\3 произведенной в США кукурузы,
55% процентов произведенного в Бразилии сахарного тростника
2\3 произведенных в Европе семян рапса
стали сырьем для изготовления биотоплива
Обзор рынка удобрений 2010 – 2014. 78-я Ежегодная Конференция IFA Париж
(Франция) 31 Мая – 2 Июня 2010
Данный отчет доступен на сайте IFA (http://www.fertilizer.org) или по запросу в Секретариат IFA.
32.
Рисунок 1 – Мировое производство нефти запериод с 1900 по 2012 гг.
33.
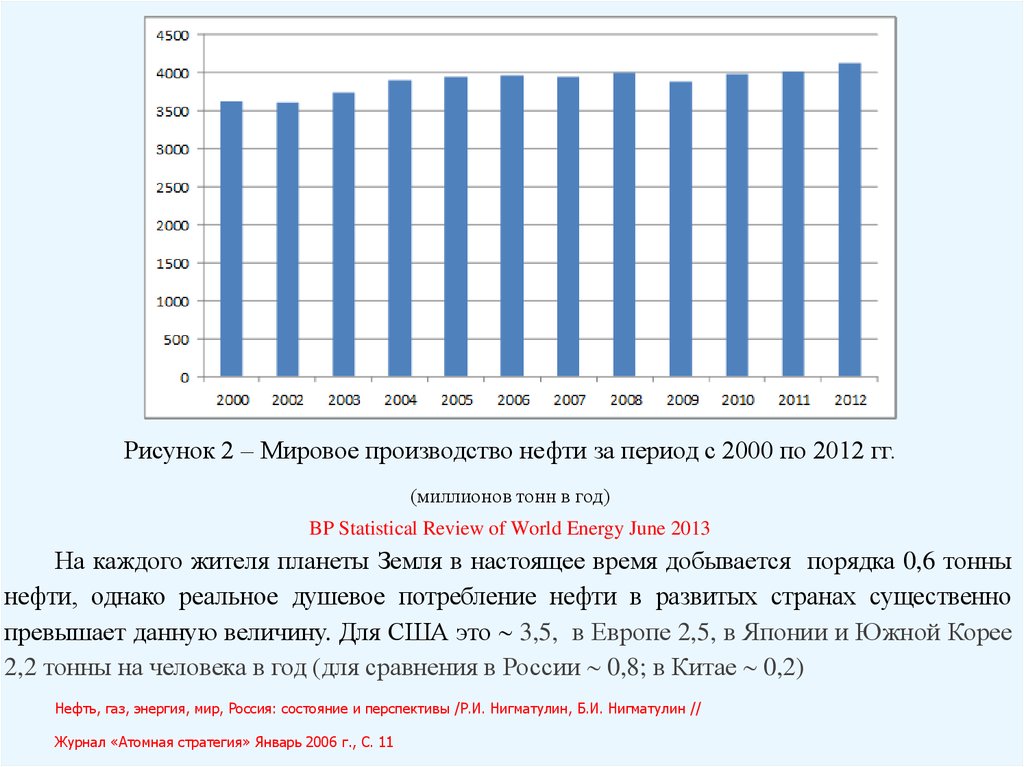
Рисунок 2 – Мировое производство нефти за период с 2000 по 2012 гг.(миллионов тонн в год)
BP Statistical Review of World Energy June 2013
На каждого жителя планеты Земля в настоящее время добывается порядка 0,6 тонны
нефти, однако реальное душевое потребление нефти в развитых странах существенно
превышает данную величину. Для США это 3,5, в Европе 2,5, в Японии и Южной Корее
2,2 тонны на человека в год (для сравнения в России 0,8; в Китае 0,2)
Нефть, газ, энергия, мир, Россия: состояние и перспективы /Р.И. Нигматулин, Б.И. Нигматулин //
Журнал «Атомная стратегия» Январь 2006 г., С. 11
34.
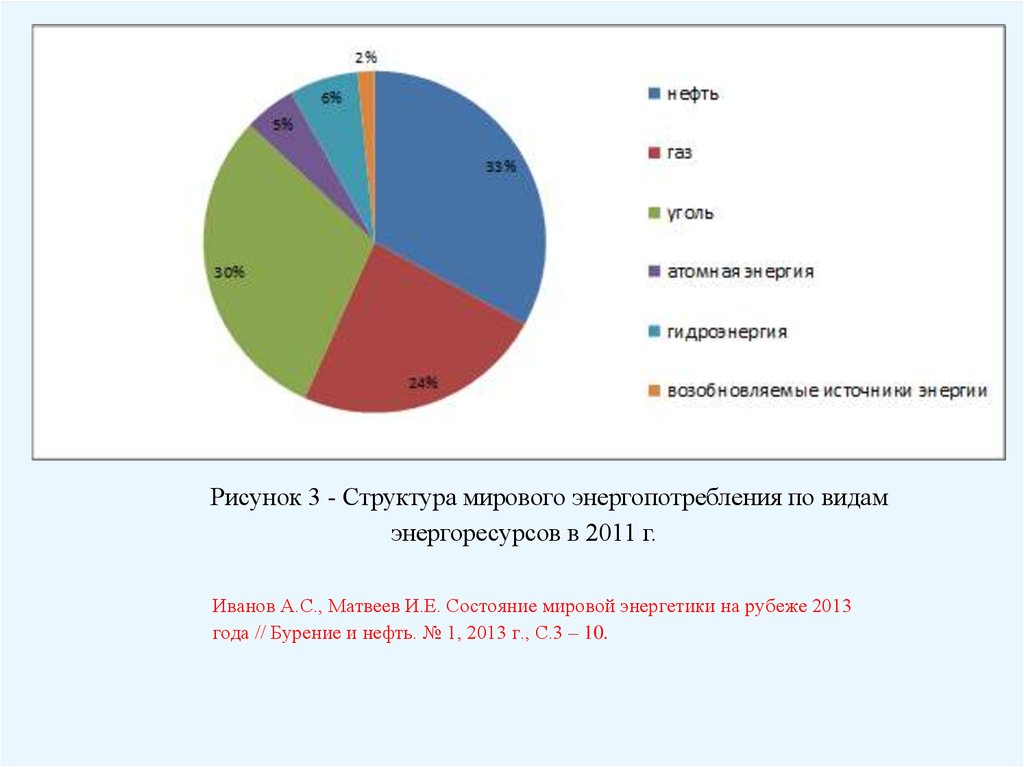
Рисунок 3 - Структура мирового энергопотребления по видамэнергоресурсов в 2011 г.
Иванов А.С., Матвеев И.Е. Состояние мировой энергетики на рубеже 2013
года // Бурение и нефть. № 1, 2013 г., С.3 – 10.
35.
36.
37.
38.
39.
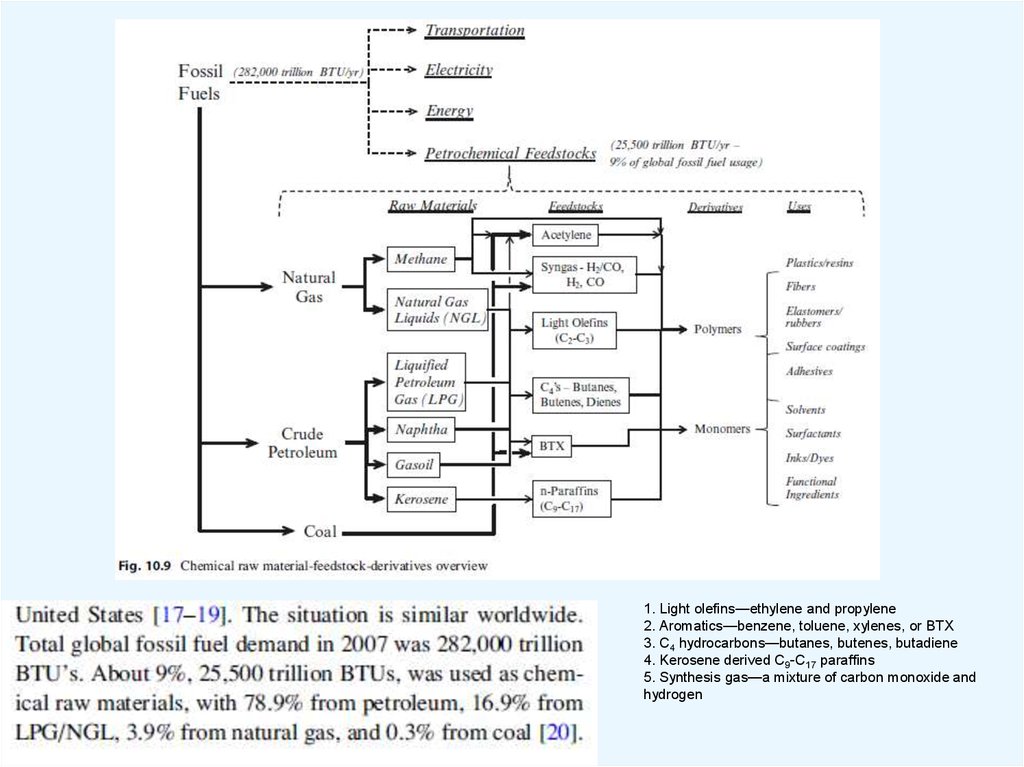
1. Light olefins—ethylene and propylene2. Aromatics—benzene, toluene, xylenes, or BTX
3. C4 hydrocarbons—butanes, butenes, butadiene
4. Kerosene derived C9-C17 paraffins
5. Synthesis gas—a mixture of carbon monoxide and
hydrogen
























 chemistry
chemistry








