Similar presentations:
Основы молекулярно-кинетической теории
1.
БИОФИЗИКАЛЕЖНЕВА НИНА ВЯЧЕСЛАВОВНА
К.Т.Н., Д.П.Н., профессор
Legneva_nv@mail.ru
2.
Основымолекулярно-кинетической
теории
Молекулярно-кинетическая теория
(МКТ) – это учение, которое объясняет
тепловые явления в макроскопических
телах и внутренние свойства этих тел
движением и взаимодействием атомов,
молекул и ионов, из которых состоят
тела
3.
В основе МКТ строения вещества лежаттри положения:
Первое положение
• Вещество состоит из частиц
– молекул, атомов и ионов.
• В состав этих частиц входят
более мелкие элементарные
частицы
4.
Первое положение МКТМолекула – наименьшая устойчивая частица
данного вещества.
Молекула обладает основными химическими
свойствами вещества.
Молекула является пределом деления
вещества, то есть самой маленькой частью
вещества, которая способна сохранять
свойства этого вещества
Атом – это наименьшая частица данного
химического элемента.
5.
Второе положение МКТ• Частицы, из которых состоит
вещество, находятся в непрерывном
хаотическом (беспорядочном)
движении
6.
Третье положение МКТЧастицы вещества взаимодействуют
друг с другом – притягиваются и
отталкиваются
7.
• График зависимости силывзаимодействия двух молекул от
расстояния между ними
На расстоянии r= r 0
результирующая сила F=0, F
т.е. силы притяжения и
отталкивания
уравновешивают друг
друга. Поэтому расстояние r 0
соответствует равновесному
расстоянию между
молекулами
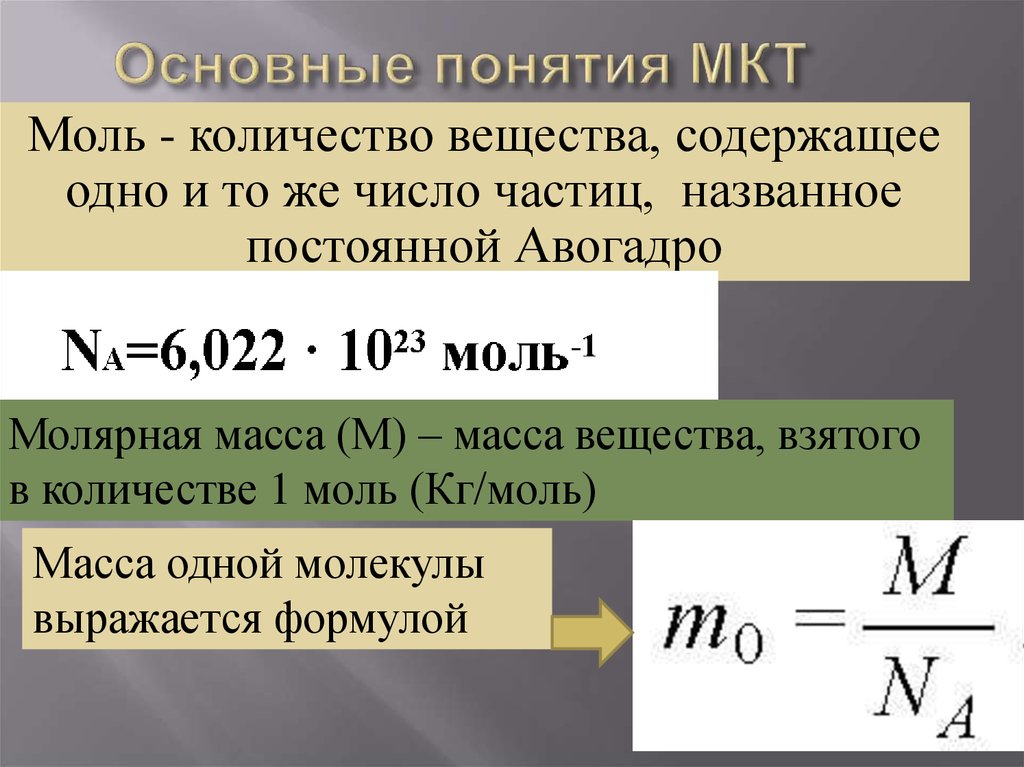
8. Основные понятия МКТ
Моль - количество вещества, содержащееодно и то же число частиц, названное
постоянной Авогадро
Молярная масса (М) – масса вещества, взятого
в количестве 1 моль (Кг/моль)
Масса одной молекулы
выражается формулой
9.
Количеством вещества ν (ню) - иногдаобозначается n
физическая величина, характеризующая
количество однотипных структурных единиц,
содержащихся в веществе.
Под структурными единицами понимаются любые
частицы, из которых состоит вещество (атомы,
молекулы, ионы, электроны или любые другие
частицы)
Единица измерения количества вещества в
Международной системе единиц (СИ) — моль
10.
Количеством вещества ν (ню)По закону Авогадро, количество газообразного
вещества можно также определить на основании
его объёма: = V / Vm, где V — объём газа при
нормальных условиях, а Vm — молярный объём
газа при тех же условиях, равный 22,4 л/моль.
11. Основные понятия МКТ
Идеальным газом называется газ, вкотором молекулы движутся свободно и
взаимодействуют между собой и со
стенками сосуда только при столкновениях
Модель идеального газа
удовлетворительно описывает
достаточно разреженные
газы.
12. Явления переноса
Нарушение равновесиясопровождается
возникновением потоков
либо молекул, либо
тепла, либо
электрического заряда и
т. п. В связи с этим
соответствующие
процессы носят название
явлений переноса
•диффузия,
•Теплопроводность
•внутреннее
трение
13. Явления переноса
1.Диффузия – это обусловленное тепловымдвижением молекул проникновение одних
веществ в объём, занятый другими веществами
Явление диффузии для
химически однородного газа
подчиняется закону Фика:
jm — плотность потока массы
D —коэффициент диффузии
dρ/dx — градиент плотности
14. Коэффициент диффузии
jm — плотность потока массыD —коэффициент диффузии
dρ/dx — градиент плотности
Коэффициент диффузии позволяет провести оценку
количества вещества, прошедшего через единицу площади
(квадратный метр) за единицу времени (секунду).
Единица измерения м²/с
Коэффициент диффузии определяется
свойствами среды и типом диффундирующих
частиц
15. Диффузия и осмос
В том случае, если диффундирующиевещества встречают на своем пути мембрану,
движение замедляется, а в некоторых случаях
прекращается. Диффузия воды по
направлению от своего большего к меньшему
химическому потенциалу через мембрану
носит название осмоса
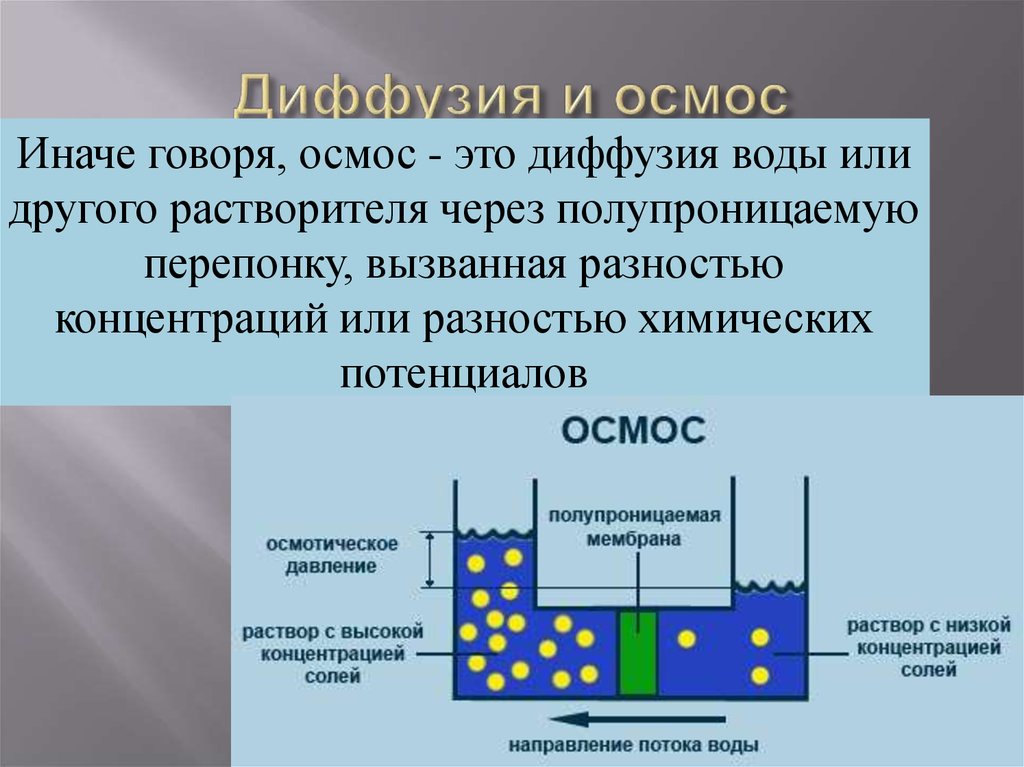
16. Диффузия и осмос
Иначе говоря, осмос - это диффузия воды илидругого растворителя через полупроницаемую
перепонку, вызванная разностью
концентраций или разностью химических
потенциалов
17.
18.
19. Закон Вант-Гоффа
Мерой интенсивности протеканияосмоса является осмотическое
давление, которое согласно закону
Вант-Гоффа (1887г.) зависит от
молярной концентрации
раствора (СМ ) и температуры (Т):
Росм=СМ∙R∙T,
Якоб Хендрик
где R – газовая
Вант-Гофф
постоянная, равная
νRT
1852-1911,
8,31Дж/моль∙К;
V
голландский
ИЛИ:
химик
20. Явления переноса
2.Теплопроводность – это процесс переносатепловой энергии, обусловленный
хаотическим движением молекул
Перенос энергии в форме теплоты подчиняется
закону Фурье:
jE - плотность теплового потока
λ –теплопроводность
- градиент температуры
21. Явления переноса
3.Внутреннее трение (вязкость) возникает вследствиепереноса импульса молекул между слоями
сила внутреннего
трения между двумя
слоями газа (жидкости)
подчиняется закону
Ньютона:
η - динамическая вязкость
dv/dx - градиент скорости,
S - площадь, на которую действует сила F.
22.
Идеальным газом называется газ, вкотором молекулы движутся свободно и
взаимодействуют между собой и со
стенками сосуда только при
столкновениях.
Модель идеального газа
удовлетворительно описывает
достаточно разреженные газы
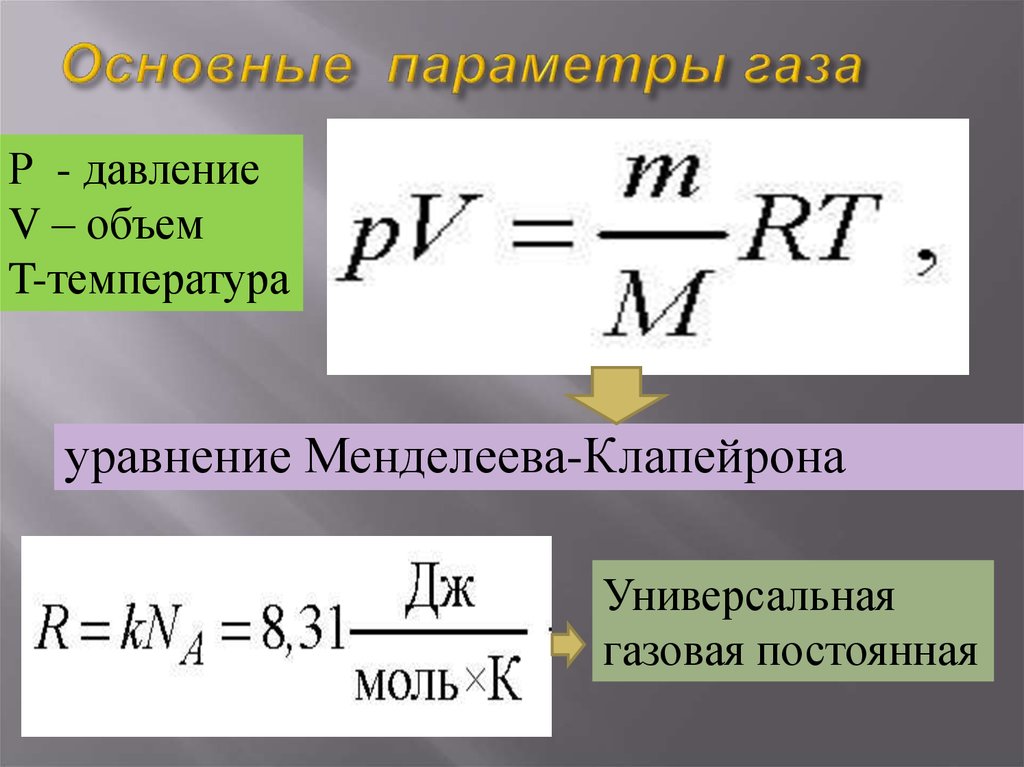
23. Основные параметры газа
Р - давлениеV – объем
T-температура
уравнение Менделеева-Клапейрона
Универсальная
газовая постоянная
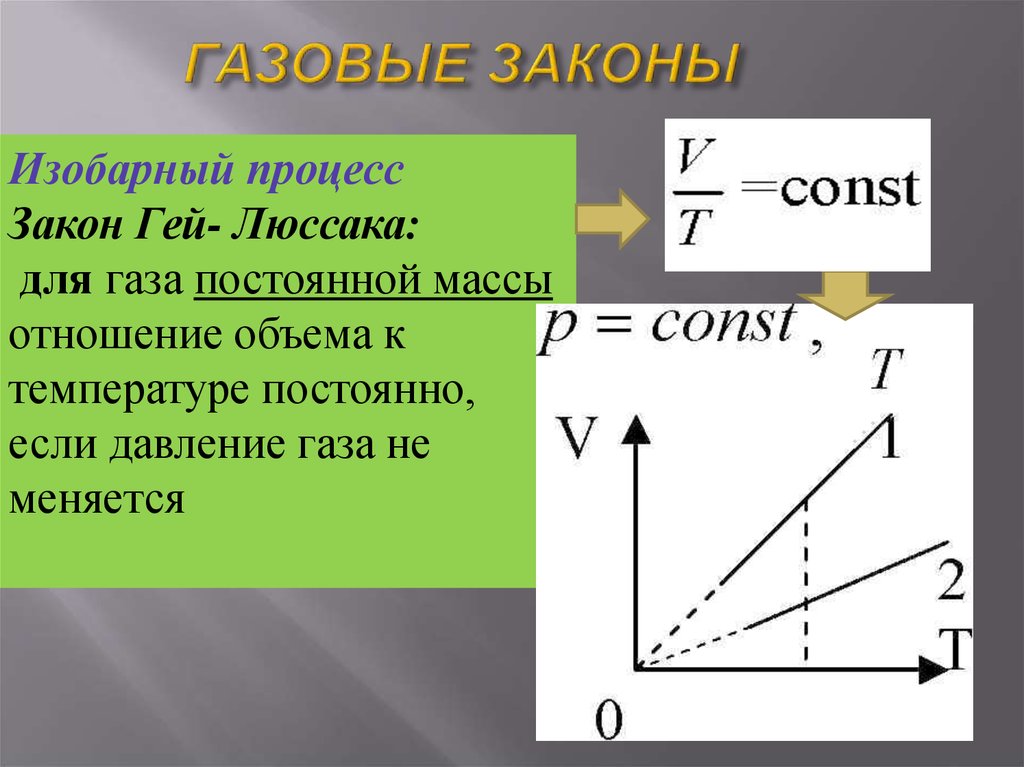
24. ГАЗОВЫЕ ЗАКОНЫ
Изобарный процессЗакон Гей- Люссака:
для газа постоянной массы
отношение объема к
температуре постоянно,
если давление газа не
меняется
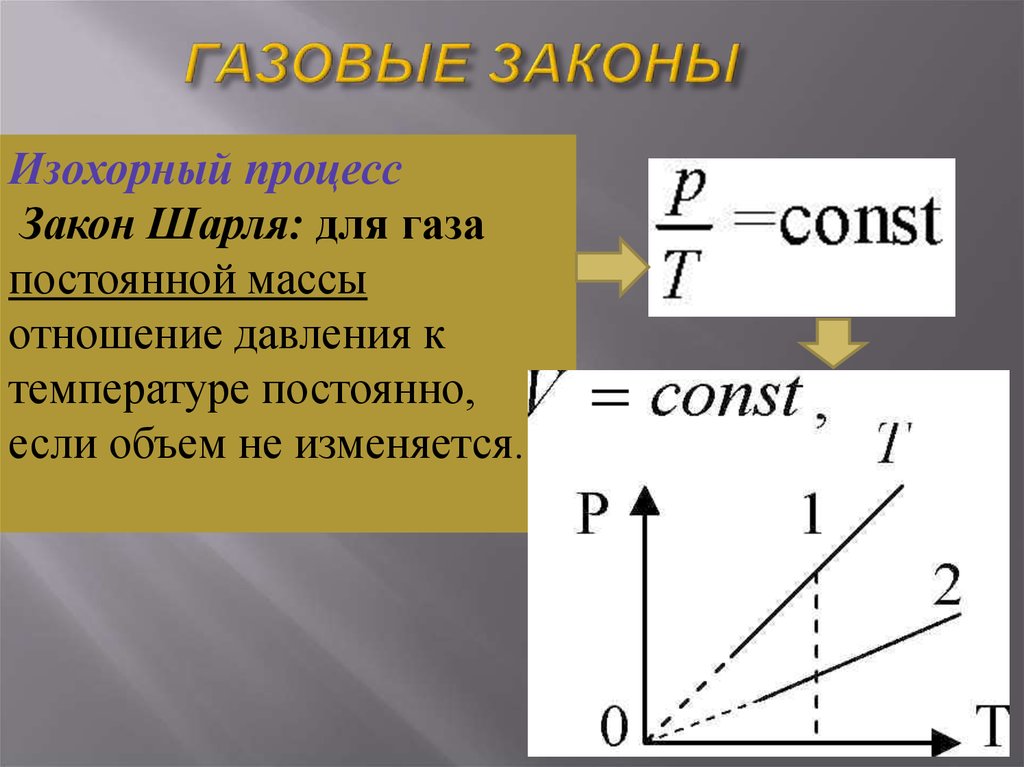
25. ГАЗОВЫЕ ЗАКОНЫ
Изохорный процессЗакон Шарля: для газа
постоянной массы
отношение давления к
температуре постоянно,
если объем не изменяется.
26. ГАЗОВЫЕ ЗАКОНЫ
Изотермический процессЗакон Бойля-Мариотта:
для газа постоянной массы
произведение давления на
объем остается
постоянным, если
температура газа не
изменяется.
открыт в 1662 году Робертом Бойлем
и независимо переоткрытый Эдмом
Мариоттом в 1676 году
Т=const
pV=const
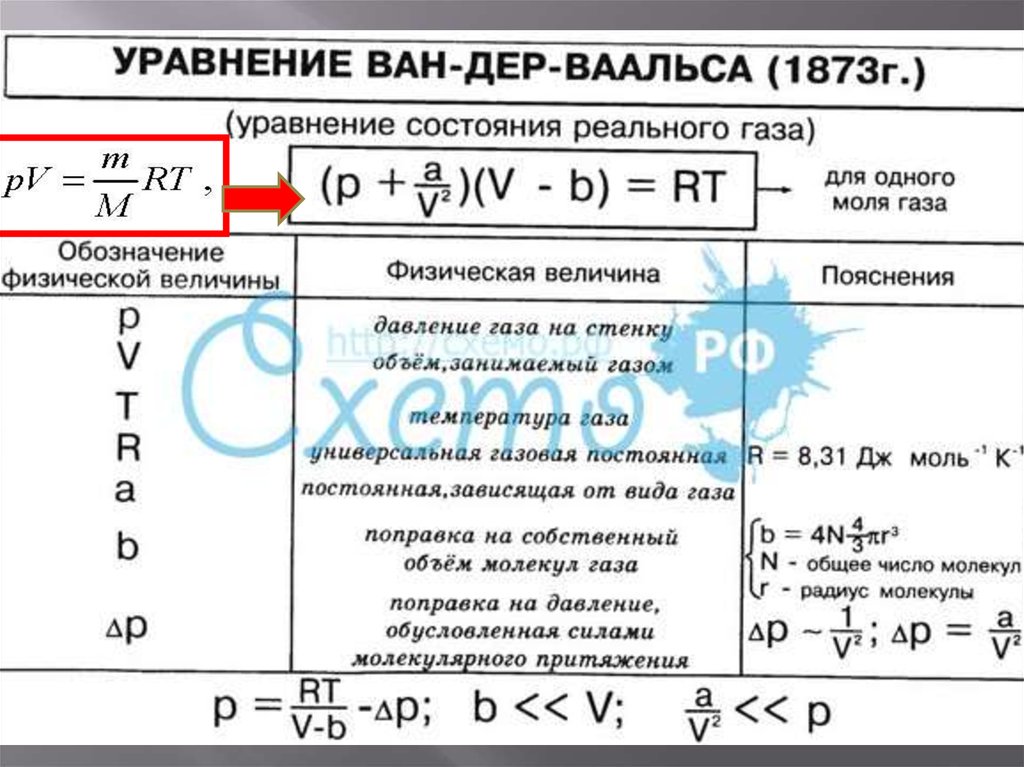
27. Уравнение Ван-дер-Ваальса
Молекул в реальной системеотлично от того, как это
описывается для идеального
газа
Йоханнес
Дидерик Ван
дер Ваальс
(1837-1923,
голландский
физик
Наибольшее распространение
вследствие простоты и
физической наглядности
получило уравнение
Ван-дер-Ваальса
28.
29. Внутренняя энергия реального газа
Внутренняя энергия газа Ван-дер-Ваальсаскладывается из его кинетической энергии
(энергии теплового движения молекул) и
потенциальной. Для одного моля газа:
где -СV молярная
теплоёмкость при
постоянном объёме,
а -поправка учитывает
которая не зависит от
силы притяжения
температуры Т
между молекулами
V -объем газа






























 physics
physics








