Similar presentations:
Общая и медицинская химия
1. ОБЩАЯ И МЕДИЦИНСКАЯ ХИМИЯ
Курс лекций для группы Б7107 «фармация»Лектор: Струппуль Надежда Эдуардовна, к.б.н, доц.
2. Рекомендуемая литература
В нашей библиотеке:• Хомченко И.Г. Общая химия, 1987
Рекомендуемая
литература
• Глинка Н.Л. Общая химия, 1987
• Глинка Н.Л. Общая химия: учебное пособие, 2013
• Кузьменко Н.Е. Общая и неорганическая химия: пособие, 1977
• Ахметов Н.С. Общая и неорганическая химия, 2014
• Карапетьянц М.Х. Общая и неорганическая химия, 1992
• Общая химия. Биофизическая химия. Химия биогенных элементов, под ред.
Ю.А. Ершова, 2002
• Егоров В.В. Неорганическая химия (биогенные и абиогенные элементы),
Есть в свободном доступе:
• Некрасов Б.В. Основы общей химии
• Реми Г. Курс неорганической химии (т.1, 2)
• Гринвуд Н.Н., Эршно А. Химия элементов (т. 1, 2)
3. Рекомендуемая литература
Есть в мире:• Общая и неорганическая химия для медиков и фармацевтов. Учебник и
практикум для вузов / под ред. Негребецкого В.В., 2015
• Хаускрофт К., Констебл Э. Современный курс общей химии. В 2-х т., 2002
• Шрайвею. Д., Эткинс. П. Неорганическая химия, в 2 т., 2004
4. Периодический закон и периодическая система
Основные понятия и закономерности5. Периодическая система
Свойства химических элементов, а также формы исвойства образуемых ими простых веществ и соединений
находятся в периодической зависимости от величины
зарядов ядер их атомов
(Д.И. Менделеев, 1869)
Графическое изображение Периодического закона на плоскости периодическая система
Наиболее распространенные формы периодической системы (ПС):
Короткая (короткопериодная) -официально отменена ИЮПАК* в 1989 году
Длинный вариант (длиннопериодная)
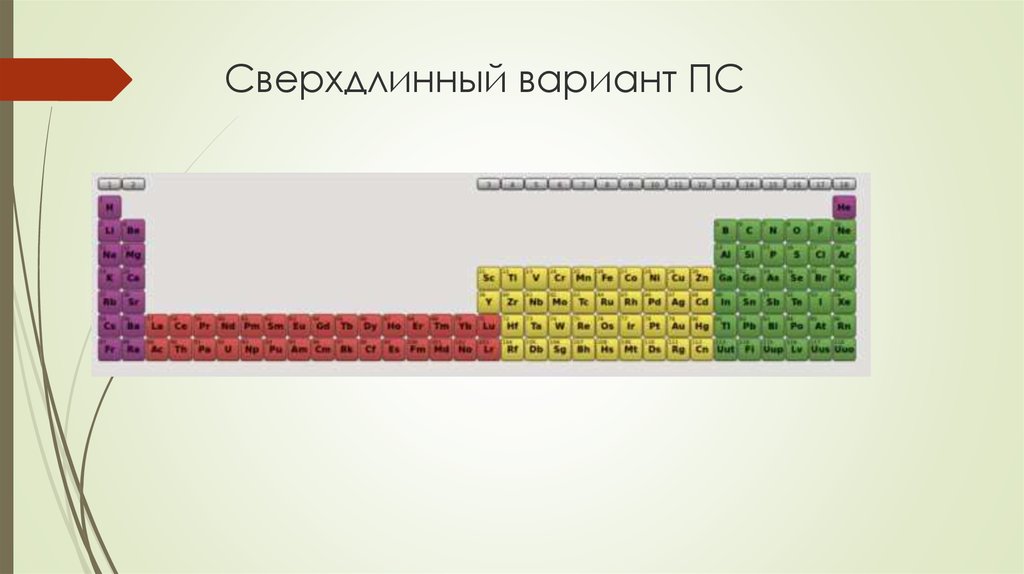
Сверхдлинный вариант
* - ИЮПАК — Международный союз теоретической и прикладной химии
IUPAC
International Union of Pure and Applied Chemistry,
6. Сверхдлинный вариант ПС
7. Длинный вариант ПС
8. Короткий вариант ПС
9. Развитие представлений о строении атома
МОДЕЛИ АТОМОВКусочки материи –Демокрит полагал, что свойства того или иного вещества определяются формой,
массой, и пр. характеристиками образующих его атомов.
Модель атома Томпсона (модель «Пудинг с изюмом»). Томпсон предложил рассматривать атом как
некоторое положительно заряженное тело с заключёнными внутри него электронами.
Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил
модель атома, построенную по аналогии с планетой Сатурн: вокруг маленького положительного
ядра по орбитам вращались электроны, объединённые в кольца.
Планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд пришёл к выводу, что
атом представляет собой подобие планетарной системы, в которой электроны движутся по орбитам
вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома
Резерфорда»). Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты,
которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических
состояниях, не излучает энергию («модель атома Бора-Резерфорда»).
Квантово-механическая модель атома. Ядро атома состоит из положительно заряженных протонов и
не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако
представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по
сколько-нибудь определённым траекториям (неопределенность координаты электрона в атоме
может быть сравнима с размерами самого атома).
10. QUANTUM NUMBERS
Quantum numbers: There are a set of four quantum numbers whichspecify the energy, size, shape and orientation of an orbital.
These are:
Principal quantum number (n)
Azimuthal quantum number (l)
Magnetic quantum number (ml)
Electron spin quantum number (ms)
An orbital is identified by the set of 3 quantum numbers: n, l, ml
An electron is identified by a set of four quantum numbers: n, l, ml, ms
Sub-shell notation: Notation of a sub-shell is written as the Principal
quantum number followed by the symbol of the respective sub-shell.
11. Principal quantum number (n)
It determines the size and to a largeextent the energy of the orbital
N
Shell no.:
1
2
3
4
K
L
M
N
Shell number of
1
2
orbitals in a shell = n
4
9
16
Maximum number
of electrons = 2n2
8
18
32
2
• It can have positive integer values of 1, 2, 3 and so on.
• As the value of n increases, the energy also increases. Hence, the electron
will be located far away from the nucleus
12. Azimuthal quantum number (l)
is also known as orbital angular momentum or subsidiaryquantum number
It identified the sushell and the three
dimensional shape of the orbital.
• It also determines the number of subshells or sub levels in a shell. Total
number of subshells in a particular shell is equal to the value of n.
l = 0, 1, 2… (n-1)
• Each subshell corresponding to different values of l are represented by
different symbols:
Value of l
0
1
2
3
Notation of symbol
s
p
d
f
13. Magnetic quantum number or Magnetic orbital quantum number (ml)
It gives information about the spatialorientation of the orbital with respect
to standard set of coordinate axis
• For any sub-shell (defined by ‘l’ value) 2l+1 values of ml are
possible.
• For each value of l, ml = – l,... 0,...+ l
14.
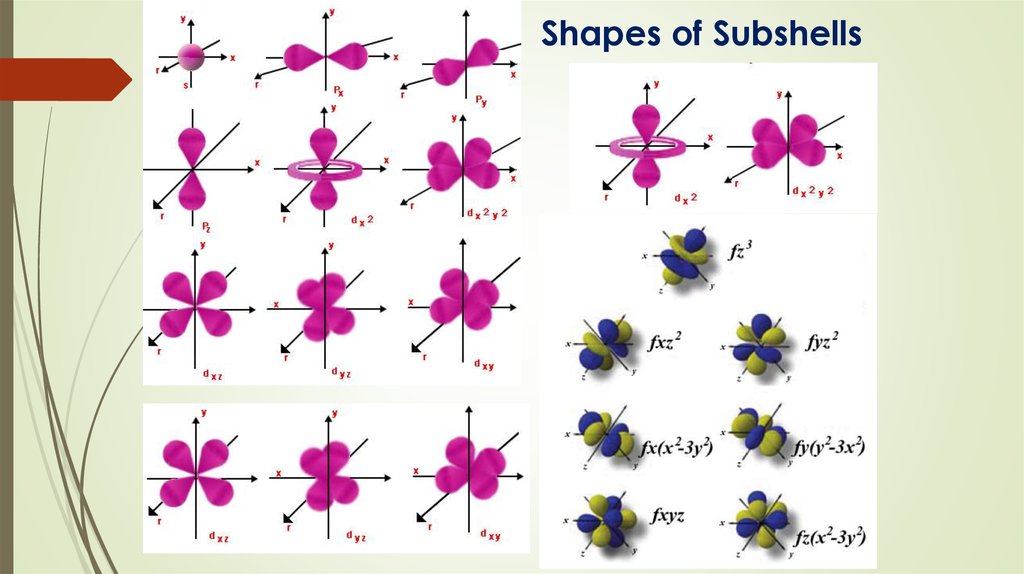
Shapes of Subshells15. Filling of Electrons
Orbitals have different energies because of mutual repulsion between electronsin a multi- electron atom.
Orbitals with lower value of (n+l) are filled first as they have lower energy.
If two orbitals have the same value of (n+l) then orbital with lower value of
n will have lower energy
The filling of electrons into the orbitals of different atoms takes place
according to:
• Aufbau principle,
• Pauli’s exclusion principle,
• the Hund’s rule of maximum multiplicity
16.
Aufbau Principle: In the ground state of the atoms, theorbitals are filled in order of their increasing energies. The
order in which the orbitals are filled is as follows:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 4f, 5d, 6p, 7s...
It is based on (n+l) rule. It states that the orbital with lower
value of (n +l) has lower energy.
Pauli Exclusion Principle: No two electrons in an atom can
have the same set of four quantum numbers. Only two
electrons may exist in the same orbital and these electrons
must have opposite spin.
Hund’s rule of maximum multiplicity (“Empty Bus Seat
Rule”): Pairing of electrons in the orbitals belonging to the
same subshell (p, d or f) does not take place until each
orbital belonging to that subshell has got one electron each
i.e., it is singly occupied.
17. Electronic configuration of atoms
The electronic configuration of different atoms can be represented in two ways.a. sapbdc ... notation: In the first notation, the subshell is represented by the respective
letter symbol and the number of electrons present in the subshell is depicted, as the
super script, like a, b, c, ... etc. The similar subshell represented for different shells is
differentiated by writing the principal quantum number before the respective subshell.
b. Orbital diagram: In the second notation, each orbital of the subshell is represented by
a box and the electron is represented by an arrow ( ) a positive spin or an arrow ( ) a
negative spin.
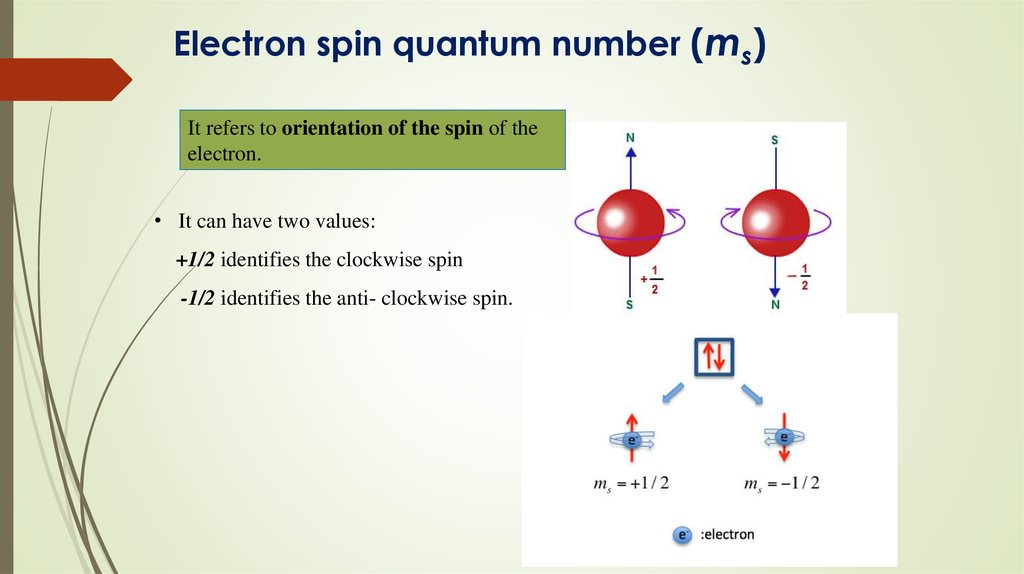
18. Electron spin quantum number (ms)
It refers to orientation of the spin of theelectron.
• It can have two values:
+1/2 identifies the clockwise spin
-1/2 identifies the anti- clockwise spin.
19. Принципы и правила заполнения орбиталей
Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s)были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c
противоположными спинами).
Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных
электронов в пределах определенного подуровня. Т.е. на орбиталях данного подуровня электроны
располагаются сначала по одному и с одинаковому спинами, а затем по второму электрону и с
противоположными спинами
Первое правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон
располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия
орбитали.
Второе правило Клечковского. Если для двух подуровней суммы значений (n + l) равны, то сначала заполняется
подуровень с меньшим значением n. Энергия орбиталей возрастает в ряду:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d > 4f < 6p < 7s.
Исключения из правила Клечковского. У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал»
электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически
более устойчивому состоянию атома,
20.
Принципы и правила заполненияорбиталей
Электронная конфигурация атома - запись, отражающая распределение электронов в
атоме химического элемента по энергетическим уровням и подуровням, называется этого
атома.
В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу
минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
Главное квантовое число n минимально;
Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем dподуровень;
Заполнение происходит так, чтобы (n + l) было минимально (правило Клечковского);
В пределах одного подуровня электроны располагаются таким образом, чтобы их
суммарный спин был максимален, т.е. содержал наибольшее число неспаренных
электронов (правило Хунда).
При заполнении атомных орбиталей выполняется принцип Паули. Его следствием
является, что энергетическому уровню с номером n может принадлежать не более
чем 2n 2 электронов, расположенных на n 2 подуровнях.
21. Правила написания электронных формул атомов
1. Число энергетических уровней или значение главного квантового числа nравно номеру периода, в котором находится данный элемент.
2. На внешнем энергетическом уровне не может быть более 8 электронов, на
предвнешнем – более 18.
3. У всех элементов 1 и 2 групп число электронов на внешнем
энергетическом уровне равно номеру группы.
4. В малых периодах (1, 2, 3), а также в нечетных рядах больших периодов,
сумма электронов, находящихся на подуровнях s- и p- внешнего
энергетического уровня равна номеру группы.
5. В четных рядах больших периодов (начиная с 3 группы) сумма электронов,
находящихся на s-подуровне внешнего энергетического уровня и dподуровне предвнешнего энергетического уровня, равна номеру группы.
22. Условная классификация простых веществ
Металлына внешнем уровне 1-3 электрона (искл.: Н, В, Не).
характерна положительная степень окисления, не образуют отрицательных
ионов.
s-, d-, f- и некоторые p-элементы (Al, Ga, In, Tl, Sn, Pb, Sb, Bi, Po).
Неметаллы
на внешнем уровне 4-7 электронов. Сюда же относятся Н и В.
способны образовывать отрицательные ионы.
кроме Н, все относятся к р-элементам
Благородные газы
имеют внешнюю конфигурацию ns2 np6 , кроме Не (1s2 ).
p-элементы (искл.: Не – это s-элемент ).
23. Основные характеристики химических элементов
радиус атомов и ионов,энергия ионизации,
энергия сродства к электрону,
относительная электроотрицательность
степени окисления
24. Радиусы атомов и ионов
Радиус свободного атома (r) –это расстояние от ядра домаксимальной электронной плотности
внешних энергетических оболочек.
Атомы и ионы не имеют точного размера (волновой характер), поэтому определяют условные
(эффективные) радиусы атомов.
Различают:
ковалентные,
металлические,
ван-дер-ваальсовы
ионные радиусы
r = k(n2/Z*)
r – радиус атома, пм;
k – эмпирическая постоянная;
n – количество энергетических
уровней в атоме;
Z * – эффективный заряд ядра,
действующий на электрон)
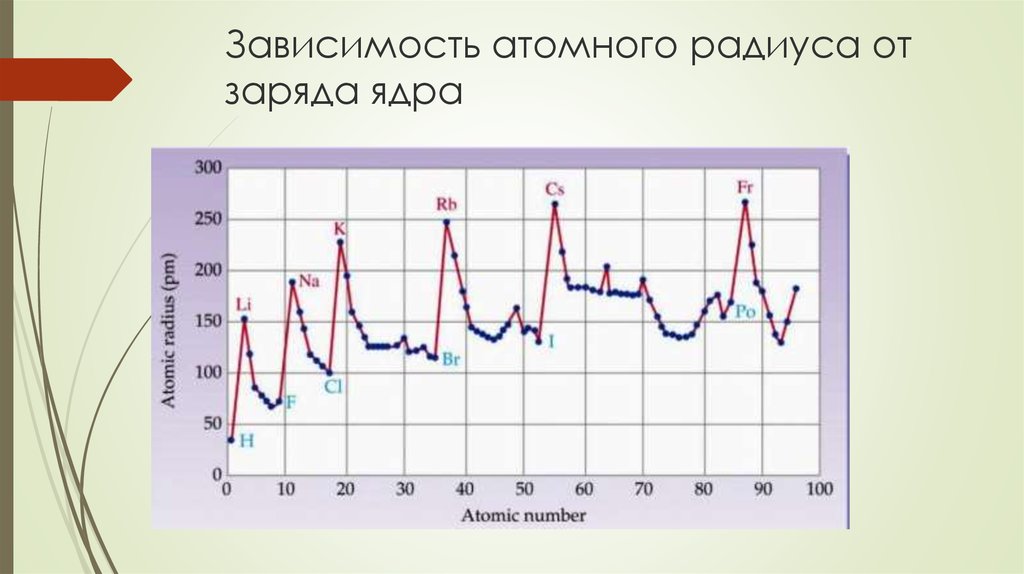
25. Зависимость атомного радиуса от заряда ядра
26. Зависимость атомного радиуса от заряда ядра
По периоду.r уменьшается, т.к. при одинаковом значении n эффективный заряд ядра
возрастает, силы кулоновского притяжения электронных оболочек к ядру растут.
Резко меняется r у s- и p-элементов, т.к. у них заполняется внешний уровень.
11Na…18Ar
171…66
У d- и f-элементов r уменьшается плавно, т.к. заполняются электронами внутренние
оболочки.
21Sc…30Zn
157…107
Каждый дополнительный законченный внутренний слой электронов экранирует
внешние электроны от действия ядра и атом «раздувается», т.е. каждый новый период
начинается с глобального максимума
He → Li, Ne → Na, Ar → K и т.д.
Начало и середина заполнения каждого нового подуровня дают изломы (локальные
экстремумы) на графике
Be → B, Ca → Sc,
Zn → Ga,
As → Se и т.д.
27. Зависимость атомного радиуса от заряда ядра
По подгруппам.В главной подгруппе r увеличивается сверху вниз, т.к. увеличивается число
энергетических уровней в атоме, а эффективный заряд ядра почти не изменяется.
Аналогично себя ведут элементы побочной 3 группы.
В побочной подгруппе начиная с 4 группы r меняется сложным образом, т.к. у
элементов, стоящих после лантана наблюдается f-сжатие.
Радиусы ионов отличны от радиусов атомов: для катионов они меньше, для анионов –
больше. Чем выше заряд, тем больше отличие в радиусе.
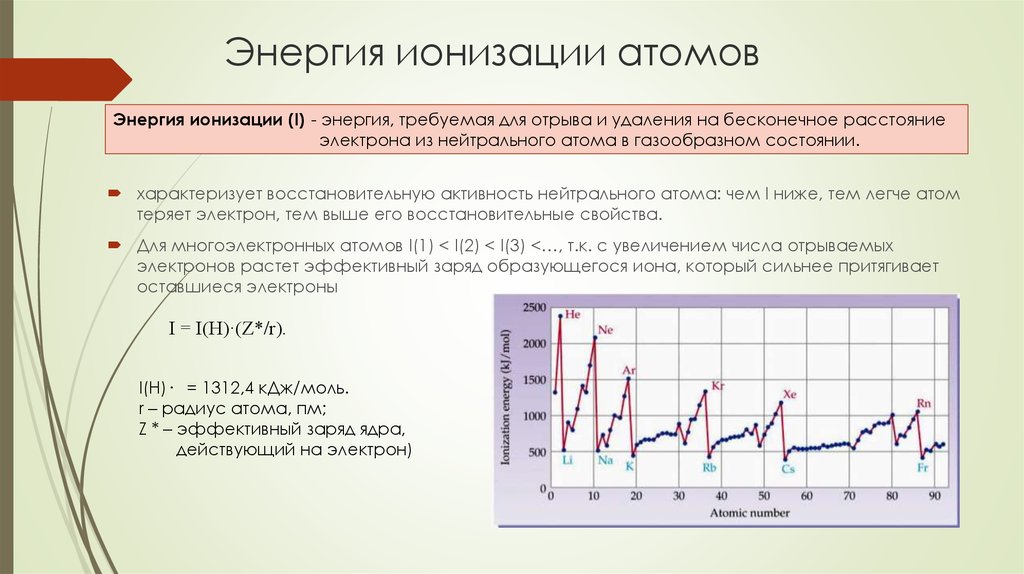
28. Энергия ионизации атомов
Энергия ионизации (I) - энергия, требуемая для отрыва и удаления на бесконечное расстояниеэлектрона из нейтрального атома в газообразном состоянии.
характеризует восстановительную активность нейтрального атома: чем I ниже, тем легче атом
теряет электрон, тем выше его восстановительные свойства.
Для многоэлектронных атомов I(1) < I(2) < I(3) <…, т.к. с увеличением числа отрываемых
электронов растет эффективный заряд образующегося иона, который сильнее притягивает
оставшиеся электроны
I = I(H)·(Z*/r).
I(H)· = 1312,4 кДж/моль.
r – радиус атома, пм;
Z * – эффективный заряд ядра,
действующий на электрон)
29. Периодичность энергии ионизации
По периоду.Энергия ионизации растет, т.к. уменьшается радиус и растет эффективный заряд
ядра.
Локальные минимумы связаны с особенностями электронной конфигурации
атомов
первая энергия ионизации уменьшается при начале заполнения р-орбиталей
B > Al > Ga
и при появлении первой пары электронов на внешних р-орбиталях
O > S > Se
для s- и р-элементов величина первой энергии ионизации уменьшается
для d-элементов изменяется немонотонно из-за увеличения эффективного
заряда ядра при незначительном изменении радиуса, а также степени
экранирования внешних электронов внутренними (эффект инертной s-пары).
30. Периодичность энергии ионизации
По подгруппамнаблюдается сложная зависимость, определяемая электронным строением и
радиусом атомов.
Радиус растет, эффективный заряд ядра
падает из-за экранирования внешних
электронов внутренними.
Радиус атома серебра почти равен радиусу атома золота
(f-сжатие).
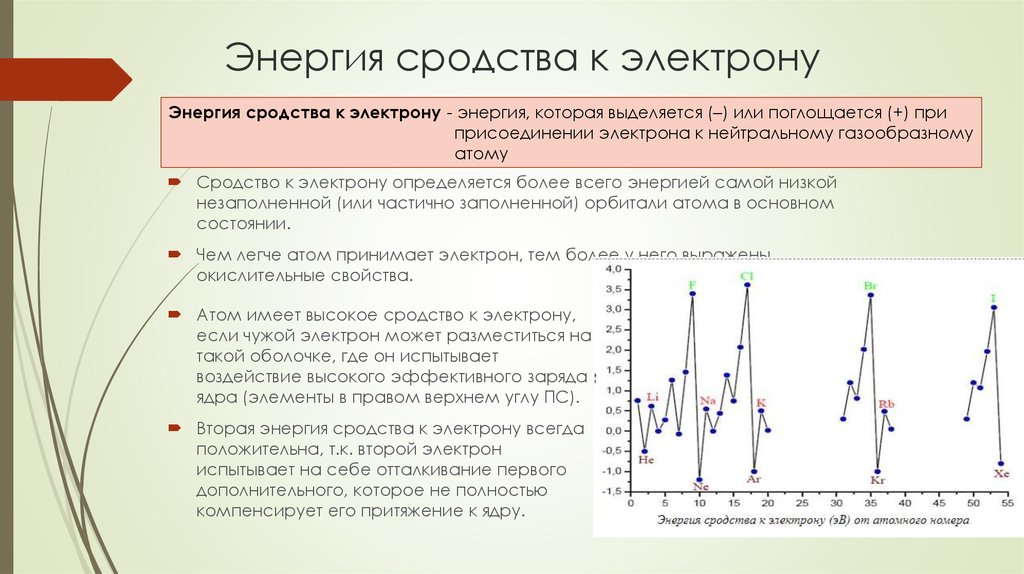
31. Энергия сродства к электрону
Энергия сродства к электрону - энергия, которая выделяется (–) или поглощается (+) приприсоединении электрона к нейтральному газообразному
атому
Сродство к электрону определяется более всего энергией самой низкой
незаполненной (или частично заполненной) орбитали атома в основном
состоянии.
Чем легче атом принимает электрон, тем более у него выражены
окислительные свойства.
Атом имеет высокое сродство к электрону,
если чужой электрон может разместиться на
такой оболочке, где он испытывает
воздействие высокого эффективного заряда
ядра (элементы в правом верхнем углу ПС).
Вторая энергия сродства к электрону всегда
положительна, т.к. второй электрон
испытывает на себе отталкивание первого
дополнительного, которое не полностью
компенсирует его притяжение к ядру.
32. Периодичность энергии сродства к электрону
По периодукак правило энергия сродства к электрону увеличивается (кроме случая атомов с
устойчивой конфигурацией электронов (4Ве 2s2).
По подгруппам
В целом уменьшается, но есть исключения.
33. Относительная электроотрицательность атомов
Чем выше ЭО атома, тем в меньшей степени у неговыражены восстановительные способности, и тем
в большей – окислительные
Шкалы электроотрицательности (более 20):
Электроотрицательность ( )способность атома в молекуле
оттягивать электроны на себя
По Полингу П
• рассматривает ЭО как свойство атома, а не связи, но это свойство атома в молекуле, а не
фундаментальное свойство отдельного атома
По Малликену М
• может быть вычислена, исходя из свойств атома, связанных с образованием катионов и анионов –
первого потенциала ионизации и сродства к электрону.
По Оллреду-Рохову ОР
• основана на эффективном ядерном заряде атома Z*
По Сандерсону
Основана на идее выравнивания электроотрицательностей атомов при образовании химической связи между ними
Практическая шкала по Луи-Бенсону ЛБ
• Электроотрицательность рассматривается как величина, пропорциональная энергии притяжения
валентного электрона, находящегося на расстоянии r от атомного ядра, «ковалентный потенциал»
34. Относительная электроотрицательность атомов по Полингу
По периодуЭлектроотрицательность увеличивается.
По группам
Электроотрицательность уменьшается
Значения ЭО по Полингу П:
• от 0,7 для атомов франция до 4,0 для атомов фтора.
• Активные щелочные и щёлочноземельные металлы имеют наименьшие значения
электроотрицательности, лежащие в интервале 0,7…1,2,
• Галогены имеют наибольшие значения, находящиеся в интервале 4,0…2,5.
• Электроотрицательность типичных неметаллов близка к 2 или немного больше 2.
• Электроотрицательность водорода принята равной 2,1.
• Для большинства переходных металлов значения лежат в интервале 1,5…2,0.
• Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных
подгрупп.
35. Практическая шкала электроотрицательности атомов
В основу практической шкалы электроотрицательностей атомов
взята концепция Луо-Бенсона, использующая понятие ковалентного
радиуса r.
По физическому смыслу электроотрицательность атома ЛБ - это
величина, пропорциональная энергии притяжения валентного
электрона, находящегося на расстоянии r от атомного ядра:
ЛБ=(m+n)/r,
где m и n — число p- и s- электронов в валентной оболочке атома
r – ковалентный радиус.
Для расчета электроотрицательностей d- и f-элементов, введено
число внешних электронов, равное двум.
Значение электроотрицательности для водорода в этой шкале
ЛБ (H)=2,7 определяет чёткую границу между металлами (М) и
неметаллами [Н]: ЛБ(М) < ЛБ[Н].
Исключение составляют постпереходные металлы (Sn, Bi, Po)
36. Относительная электроотрицательность атомов
Элементу нельзя приписать постоянную электроотрицательность.На электроотрицательность оказывают влияние:
Валентное состояния атома,
Степень окисления,
Тип соединения,
Координационное число,
природа лигандов, составляющих окружение атома в молекулярной системе, и др.
В последнее время все чаще для характеристики электроотрицательности используют так
называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали,
участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята
атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным
электроном или является вакантной
37. Степени окисления
Степень окисления атома соответствует числу электронов, которое следуетприсоединить к положительному, чтобы восстановить его до нейтрального атома, или отнять от отрицательного, чтобы окислить его до
нейтрального атома
Максимальная степень окисления в большинстве случаев равна номеру группы в
короткопериодном варианте таблицы Менделеева.
Исключения:
8-я группа, кислород и фтор, для которых максимальная степень окисления меньше номера
группы,
элементы побочной подгруппы 1-й группы, для которых максимальная СО больше номера группы.
Соединения с максимальной степенью окисления элементов одной группы, но разных
подгрупп (Mn и Cl, например) проявляют сходные химические свойства.
Минимальная отрицательная степень окисления для элементов 4…7 групп главных
подгрупп может быть определена как (8 – N), где N – номер группы.
Металлы побочных подгрупп обычно имеют степень окисления равную +2, кроме
элементов, обладающих эффектом провала электронов на внешнем энергетическом
уровне: Cu, Ag, Au. У них степень окисления может быть равно +1
38. Основы химической термодинамики
Закономерности протекания химических реакций39. Основные понятия химической термодинамики
Химическая термодинамика – раздел химии, изучающийЗадачи химической термодинамики:
энергетику химических и фазовых превращений и
направление протекания процессов в физикохимических системах.
- наука о движении тепла.
определение термодинамической вероятности протекания процесса
определение термодинамических параметров процесса, например, теплового эффекта
при протекании реакции в системе.
Объект исследования в термодинамике - произвольно выделяемая система. Все, что
находится вовне – окружающая среда.
Термодинамическая система – совокупность тел, способных обмениваться друг с
другом энергией и веществом и по-разному взаимодействующих со средой
Система может быть трёх типов:
Закрытая система обменивается с окружающей средой энергией, но не веществом.
Открытая система обменивается с окружающей средой энергией и веществом.
Изолированная система не обменивается с окружающей средой ни энергией, ни
веществом.
40. Основные понятия химической термодинамики
Параметры – величины, характеризующие термодинамическую систему:интенсивные (величина которых не зависит от количества вещества) – Т, р, См.;
экстенсивные (величина которых зависит от количества вещества) – m, V.
Взаимосвязь параметров системы описывается уравнением состояния
Температура (Т) - мера нагретости тела.
- основной интенсивный параметр ТС
Изменение температуры тела происходит при передаче/отборе теплоты – молекулярном
способе передачи энергии от системы к системе.
Удельная теплоемкость (с)- количество теплоты, необходимое
для нагревания 1 кг вещества на 1 К
1 терм./хим. кал = 4,1840 Дж;
1 техн. кал = 4,1868 Дж
с = ΔQ/(mΔT)
Молярная теплоемкость – количество теплоты, необходимое для нагревания нагревании 1
моля вещества
Термодинамический процесс - любое изменение одного или нескольких параметров ТС.
Его можно изобразить совокупностью точек, называемой диаграммой состояния системы.
Замкнутые диаграммы состояния, соответствующие процессу возвращения в начальное
состояние называются циклами.
41. Начала термодинамики
Нулевое начало термодинамики:Начала - система общефизических законов
две системы, находящиеся в термическом равновесии с третьей системой, состоят в
термическом равновесии друг с другом.
Первое начало термодинамики:
Теплота, подводимая к системе извне, тратится на изменение внутренней энергии
системы и совершение системой работы против внешних сил
Энергия не создается и не уничтожается.
В любой изолированной системе общее количество энергии постоянно
Второе начало термодинамики:
в изолированных системах самопроизвольно идут процессы, при которых происходит
увеличение энтропии
Теплота сама по себе не может перейти от более холодного тела к более тёплому
Невозможен круговой процесс, единственным результатом которого было бы производство
работы за счет охлаждения теплового резервуара
Третье начало термодинамики:
Приращение энтропии при абсолютном нуле температуры стремится к конечному
пределу, не зависящему от того, в каком равновесном состоянии находится система
абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с
изменением энтропии
42. Первое начало термодинамики
Теплота, подводимая к системе извне, тратится наизменение внутренней энергии системы и совершение
системой работы против внешних сил
Q = ΔU + A = ΔU + pΔV.
внутренняя энергия системы U – определяется суммарным запасом энергии
составляющих систему молекул, атомов, электронов, ядер и т.д. и складывается в
основном из кинетической энергии указанных частиц и энергии взаимодействия
между ними.
Абсолютное значение внутренней энергии U ни измерить, ни рассчитать нельзя,
можно только определить ее изменение в результате термодинамического
процесса ΔU.
ΔU является функцией состояния системы – величина не зависит от пути процесса и
определяется только начальным и конечным состоянием системы ΔU = U2 – U1.
43.
Ни работа, ни теплота не являются функциями состояния и зависятот пути процесса (функции пути процесса).
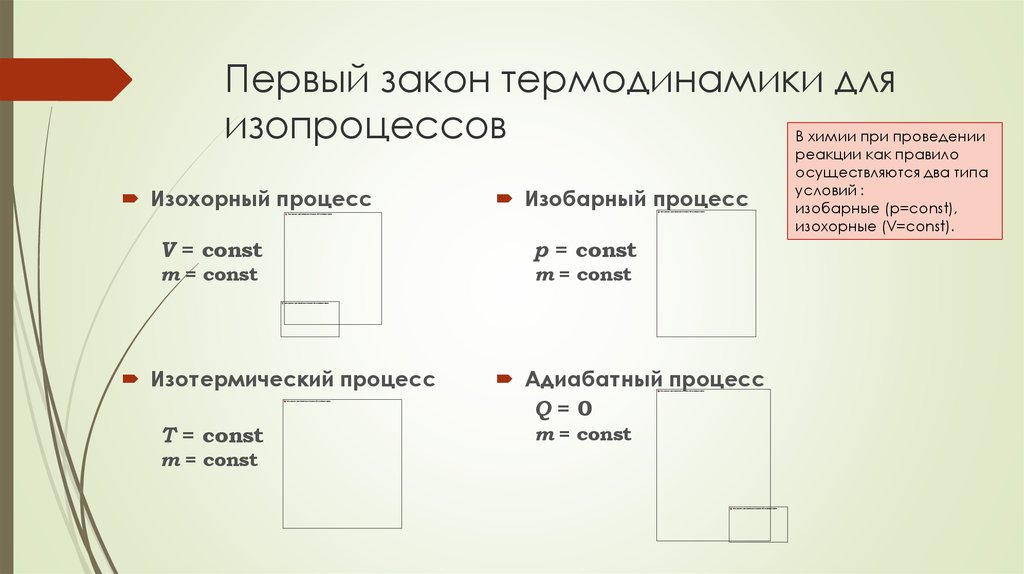
44. Первый закон термодинамики для изопроцессов
Изохорный процессИзобарный процесс
V = const
p = const
m = const
m = const
Изотермический процесс
T = const
m = const
Адиабатный процесс
Q=0
m = const
В химии при проведении
реакции как правило
осуществляются два типа
условий :
изобарные (р=const),
изохорные (V=const).
45. Первый закон термодинамики для изопроцессов
46. Термохимия
Термохимия - раздел химической термодинамики, вкотором изучаются теплоты химических реакций и их
зависимость от различных физико-химических
параметров
Энтальпия – функция, характеризующая состояние системы в термодинамическом равновесии при выборе
в качестве независимых переменных давления, энтропии и числа частиц.
- энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
(E2 + pV2) – (E1 + pV1) = Q = ΔH
в экзотермическом процессе Q > 0, ΔH<0,
в эндотермическом процессе Q<0, ΔH>0.
Закон Гесса: Тепловой эффект химической реакции не зависит от промежуточных стадий реакции (пути
процесса), а определяется только состоянием исходных веществ и продуктов реакции.
Тепловой эффект реакции равен разности между теплотами
образования всех веществ, указанных в правой части уравнения
(продуктами), и теплотами образования всех веществ в левой части
(реагентами), взятых со стехиометрическими коэффициентами.
Стандартная энтальпия реакции образования вещества в стандартных условиях (ΔfH°298) – это тепловой
эффект образования 1 моль соединения из простых веществ в их устойчивой модификации при
температуре 25° С (298,15 К), и в стандартном состоянии, т.е. при р = 1 атм (101325 Па).
Герман Иванович
Гесс
1802 - 1850
Стандартное состояние вещества – состояние, наиболее стабильное при
стандартных условиях: р = 1 атм и температуре, выбранной за стандартную
(искл. белый фосфор).
Стандартная энтальпия образования элемента принята равной нулю.
ΔfH°298(простых веществ) = 0.
47. ЭНТРОПИЯ
Энтропия - свойство системы, изменение которого при обратимом процессе равноотношению теплоты к температуре протекания процесса:
ΔS = Q/T
- мера неупорядочности частиц: число микросостояний, посредством которых
осуществляется данное микросостояние, связано с термодинамической вероятностью, которая
определяет энтропию системы; она тем выше, чем больше существует способов реализации
макросостояния.
S = k·lnω (ур. Больцмана),
ω – термодинамическая вероятность данного
состояния системы (число микросостояний для
данного макросостояния),
k – постоянная Больцмана (1,38·10–23 Дж/К).
Рудольф Юлиус
Эмануэль
Клаузиус
1822 - 1888
Людвиг
Больцман
1844 - 1906
Всякому веществу можно приписать абсолютное
значение энтропии, т.к. в идеальном кристалле
при 0 К атомы должны находиться в единственном,
самом низком энергетическом состоянии,
вероятность которого равна 1, а энтропия – 0
(постулат Планка или 3-й закон термодинамики).
Энтропия правильно
сформированного кристалла
чистого вещества при
абсолютном нуле равна нулю
(М. Планк, 1911)
48.
1) энтропия всегда увеличивается при переходе изконденсированного состояния в газообразное;
2) она возрастает при растворении твердого или жидкого
вещества;
3) чем сложнее состав вещества, тем больше его
энтропия;
4) в химических реакциях энтропия возрастает, если в
результате увеличивается количество газообразных
веществ.
49. Второе начало термодинамики
в изолированных системах самопроизвольно идут процессы, прикоторых происходит увеличение энтропии.
50. Энергия Гиббса
Любая система стремится к минимуму энтальпии и максимуму энтропии.В термодинамике имеется функция состояния, объединяющая энергетический
(ΔH<0) и энтропийный (ΔS>0) факторы самопроизвольности процесса –
изменение энергии Гиббса G.
ΔG = ΔH – TΔS.
Величина ΔG характеризует ту часть изменения внутренней энергии, которая
может быть превращена в полезную работу.
Её изменение при постоянной температуре и давлении определяет
термодинамическую вероятность протекания данного процесса в
определенном направлении.
Если ΔG<0 – прямая реакция идет самопроизвольно;
ΔG = 0 – в системе достигнуто состояние равновесия;
ΔG > 0 – самопроизвольная прямая реакция при данных условиях невозможна.
Рудольф Юлиус
Эмануэль
Клаузиус
1822 - 1888
51. Кинетика химических реакций
Закономерности протекания химических реакций52. Химическая кинетика изучает закономерности протекания химических реакций во времени, с ее помощью можно оптимизировать процессы
иизучать их механизм.
Основные задачи химической кинетики:
1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости
концентраций реагирующих веществ от времени (прямая задача);
2) определение механизмов реакций по кинетическим кривым (обратная задача).
Основные различия между химической термодинамикой и кинетикой:
1. В химической термодинамике нет времени, она предсказывает только конечный
результат процесса.
Химическая кинетика изучает только изменяющиеся (динамические) системы.
2. Равновесные свойства определяется состоянием как исходных веществ, так и продуктов
реакции.
Для термодинамики важны левая и правая части химического уравнения. Скорость
реакции определяется только состоянием исходных веществ.
Для кинетики важна только левая часть уравнения реакции.
3. Термодинамические свойства определяются термодинамической активностью веществ,
кинетические свойства – их концентрацией.
53.
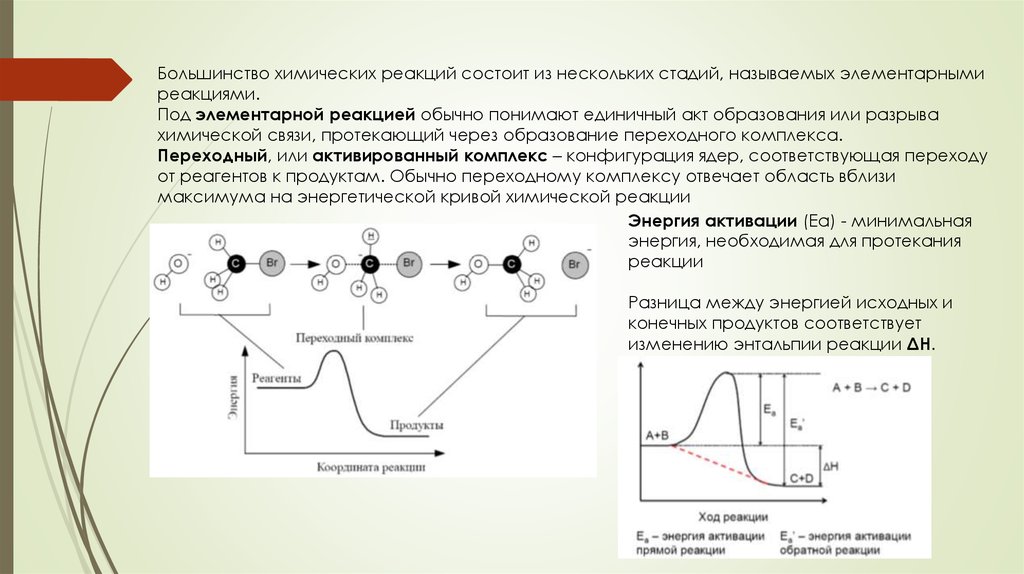
Большинство химических реакций состоит из нескольких стадий, называемых элементарнымиреакциями.
Под элементарной реакцией обычно понимают единичный акт образования или разрыва
химической связи, протекающий через образование переходного комплекса.
Переходный, или активированный комплекс – конфигурация ядер, соответствующая переходу
от реагентов к продуктам. Обычно переходному комплексу отвечает область вблизи
максимума на энергетической кривой химической реакции
Энергия активации (Еа) - минимальная
энергия, необходимая для протекания
реакции
Разница между энергией исходных и
конечных продуктов соответствует
изменению энтальпии реакции ΔН.
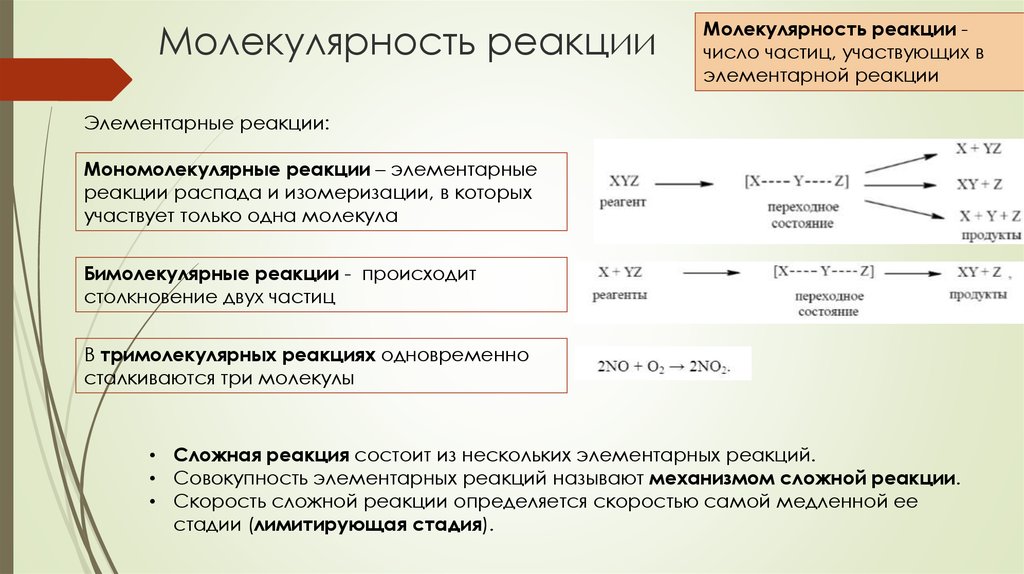
54. Молекулярность реакции
Молекулярность реакции число частиц, участвующих вэлементарной реакции
Элементарные реакции:
Мономолекулярные реакции – элементарные
реакции распада и изомеризации, в которых
участвует только одна молекула
Бимолекулярные реакции - происходит
столкновение двух частиц
В тримолекулярных реакциях одновременно
сталкиваются три молекулы
• Сложная реакция состоит из нескольких элементарных реакций.
• Совокупность элементарных реакций называют механизмом сложной реакции.
• Скорость сложной реакции определяется скоростью самой медленной ее
стадии (лимитирующая стадия).
55. Скорость химической реакции
Скорость химической реакции в газовой фазе или растворе определяется какизменениием числа молекул (или числа молей) вещества в единице объема в
единицу времени.
υ = ±(1/V)(dn/dτ).
Знак плюс используют, если скорость определяют по продукту, а минус – по
исходному веществу.
Если реакция протекает при постоянном объеме, то скорость выражают через
молярную концентрацию: С = n/V, которая имеет размерность моль⋅л–1.
Если в реакции участвует несколько веществ, то скорость можно выражать через
концентрацию любого из них, так как концентрации остальных веществ связаны с
ней стехиометрическими соотношениями.
Скорость в момент времени t
(мгновенная)
Средняя скорость
Для реакций, протекающих в газовой
фазе, скорость можно определять
также через парциальные давления
веществ.
Скорость реакции выражают в
различных единицах: моль⋅л–1⋅с–1,
моль⋅см–3⋅с–1, Па⋅с–1 и др.
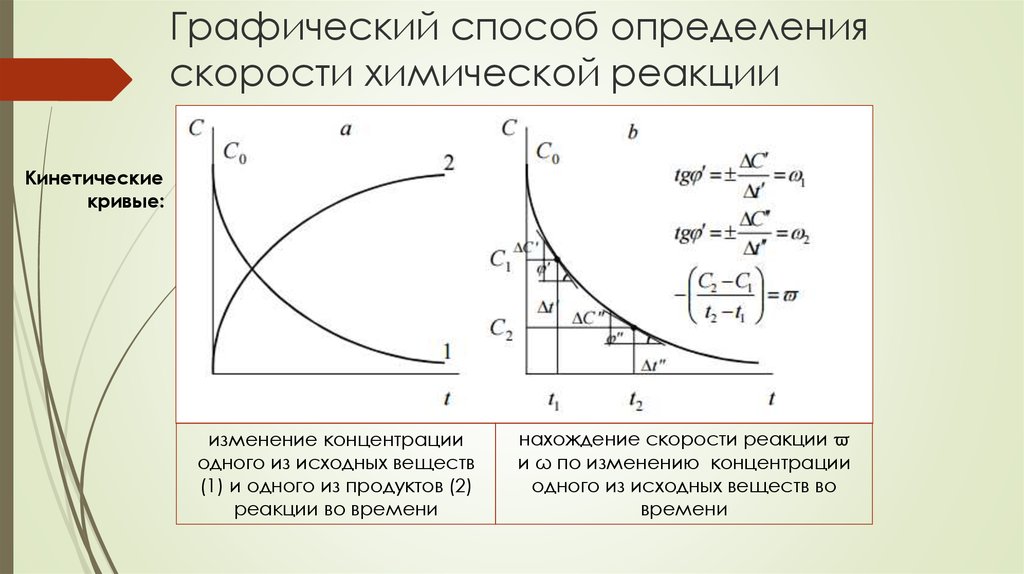
56. Графический способ определения скорости химической реакции
Кинетическиекривые:
изменение концентрации
одного из исходных веществ
(1) и одного из продуктов (2)
реакции во времени
нахождение скорости реакции ϖ
и ω по изменению концентрации
одного из исходных веществ во
времени
57.
Факторы, влияющие на скоростьхимической реакции
природа реагирующих веществ;
концентрация реагирующих веществ;
температура;
наличие катализатора;
ЗДМ: Скорость химической реакции
при постоянной температуре прямо
пропорциональна произведению
мольных концентраций реагирующих
веществ, возведенных в определенные
степени
1867 г., К. Гульдберг и П Вааге
величина поверхности раздела (для
гетерогенных реакций);
прочие энергетические воздействия (свет,
радиация, механические деформации и т.д.).
АВ + С → А + ВС
υ = k[C]m[AB]n
[C], [AB] – мольные концентрации реагентов (моль/л);
k – константа скорости реакции, равная скорости реакции при концентрациях реагирующих веществ,
равных 1 моль/л;
величины m и n (показатели степеней) определяются экспериментально и не всегда совпадают со
стехиометрическими коэффициентами уравнения химической реакции.
Сумму m+n называют общим порядком реакции,
m или n в отдельности – частные порядки по конкретным реагентам.
• Порядок реакции может быть положительным или отрицательным, целым или дробным.
• Показатели m и n равны стехиометрическим коэффициентам в уравнении реакции только в том
случае, когда она является элементарной, или кинетическое уравнение записано для элементарной
стадии реакции.
58. Формальная кинетика
Формальная кинетика - разделкинетики, в котором скорости реакций
определяют на основании закона
действующих масс
Для элементарных реакций константа скорости зависит только от температуры, а
порядок по веществу совпадает со стехиометрическим коэффициентом.
Для сложных реакций экспериментально измеряемая константа скорости является
комбинацией констант скорости отдельных стадий и, кроме того, может зависеть не
только от температуры, но и от концентрации.
Размерность константы скорости зависит от порядка реакции.
Порядок реакции (макрохарактеристика) и молекулярность (микрохарактеристика)
– совершенно разные понятия.
Порядок реакции устанавливается экспериментально и основан на решении
кинетического уравнения: –dC/dτ = kCn
В зависимости от порядка реакции линейными являются графики функции υ = f(С) в
различных координатах.
59. Кинетика реакций целого порядка
Реакции 0-го порядка:скорость реакции не зависит от концентрации данного компонента
при большом избытке одного из реагентов, когда он одновременно служит растворителем
Период полураспада (полупревращения) - промежуток
времени, в течение которого прореагирует половина
исходного количества вещества.
60.
Реакции 1-го порядка:реакции типа A → С.
скорость прямо пропорциональна концентрации
период полураспада τ1/2.
61.
Реакции 2-го порядка:скорость прямо пропорциональна произведению концентраций
начальные концентрации веществ: [A]0 = a, [B]0 = b;
текущие концентрации: [A] = a – x(τ), [B] = b – x(τ).
При решении этого уравнения различают два случая:
1. Одинаковые начальные концентрации веществ A и B: a = b.
Кинетическое уравнение имеет вид:
Решение уравнения записывают в различных формах:
Период полураспада A и B одинаков и равен:
2. Начальные концентрации веществ A и B различны: a ≠ b.
Кинетическое уравнение имеет вид :
Решение уравнения:
Периоды полураспада веществ A и B различны
62.
Реакции 3-го порядкаА+В+С → продукты или 2А+В → продукты, 3А → продукты и т.д.
63.
Реакции n-го порядкаА+В+С......→ продукты реакции
64. Метод определения порядка реакции
интегральныедифференциальные
используют интегральные
кинетические уравнения для
обработки экспериментальных
данных о зависимости
концентраций реагирующих
веществ от времени
используют дифференциальные
кинетические уравнения для
обработки экспериментальных
данных о зависимости
концентраций реагирующих
веществ от времени
Метод подстановки
Метод Вант-Гоффа
Метод Раковского
метод изолирования Оствальда,
(метод понижения порядка
реакции)
65. Метод подстановки (метод проб и ошибок)
АналитическийЭкспериментальные данные последовательно
подставляют в интегральные кинетические
уравнения для реакций целых порядков (от
нулевого до третьего) и рассчитывают
константу скорости.
Графический
Представляют экспериментальные
данные в соответствующих координатах
для целых порядков.
Если для выбранного порядка рассчитанные
значения k приблизительно постоянны (с
учетом разброса экспериментальных данных),
то изучаемая реакция имеет данный порядок.
Если рассчитанные значения константы
скорости систематически возрастают или
убывают, то расчет повторяют для другого
порядка.
Если ни одно из кинетических уравнений не
дает удовлетворительного результата, т.е.
порядок реакции не является целым, это
означает, что реакция описывается более
сложным кинетическим уравнением
Если в координатах, соответствующих
одному из порядков, получается
линейная зависимость от времени, то
изучаемая реакция имеет данный
порядок.
Одновременно из тангенса угла
наклона прямой в этом случае можно
получить значение константы скорости
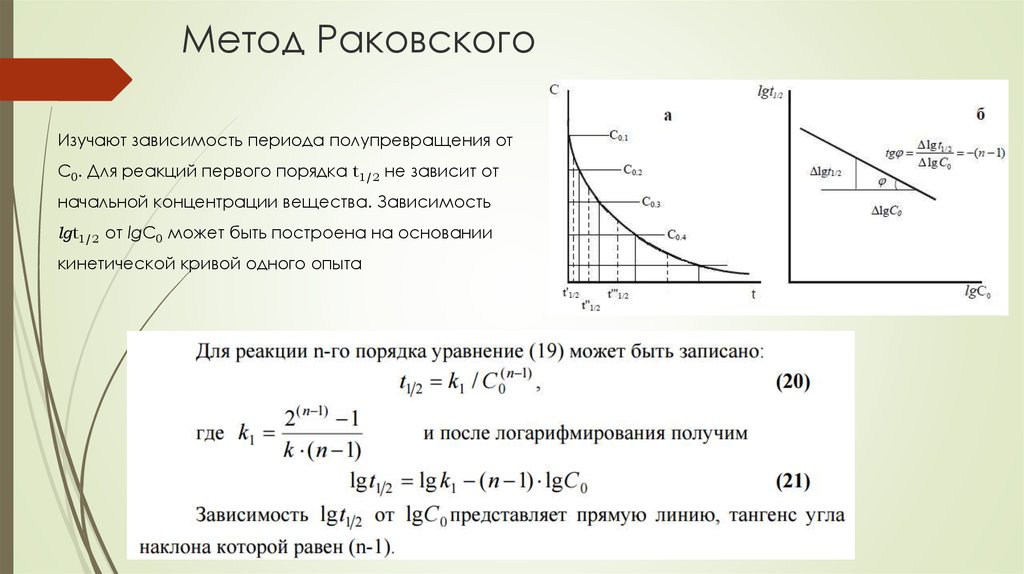
66. Метод Раковского
Изучают зависимость периода полупревращения отС0. Для реакций первого порядка t1/2 не зависит от
начальной концентрации вещества. Зависимость
lgt1/2 от lgC0 может быть построена на основании
кинетической кривой одного опыта
67. Метод Вант-Гоффа
АналитическийГрафический
Cтроят зависимость lnυ от ln[A].
Из тангенса угла наклона полученной прямой определяют
порядок реакции, а из отсекаемого отрезка – константу
скорости.
Различные значения υ и [A] могут быть получены из одной
кинетической кривой, однако более надежные результаты (с
учетом ошибок эксперимента) получают, используя значения
начальных скоростей при разных начальных концентрациях
реагентов.
а- определение скорости реакции в
различные моменты времени,
б- определение порядка реакции
68.
Метод изолирования Оствальдазависимость скорости реакции от начальной концентрации одного из реагентов (например,
A) изучают при большом избытке второго реагента. В таком случае концентрация реагента B
в течение реакции остается практически постоянной, и уравнение
приобретает вид
Порядок реакции α по веществу A находят одним из рассмотренных выше методов. Затем
аналогичным образом определяют порядок реакции β по веществу B.
69. Зависимость скорости реакции от температуры
правило ВантГоффа: при увеличении температуры на каждые 10 градусов скоростьвозрастает в 2…4 раза.
Грубо (приблизительно)
описывает экспериментальные
данные
применимо только в очень
ограниченном интервале
температур.
Уравнение Аррениуса:
где А = Z0·P (предэкспоненциальный множитель, который не зависит от температуры, а определяется
только видом реакции);
Z0 – число, пропорциональное количеству соударений, зависящее от массы и размера частиц,
Р – стерический множитель, показывающий вероятность столкновений в
направлении, которое благоприятно для перераспределения связей.
ЕА - энергия активации. Для большинства реакций
в растворе ЕА = 50…100 кДж⋅моль–1.
R – универсальная газовая постоянная,
R ≈ 8,314 Дж/(моль·К)
Т – температура, К
70. Химическая связь. Гибридизация.
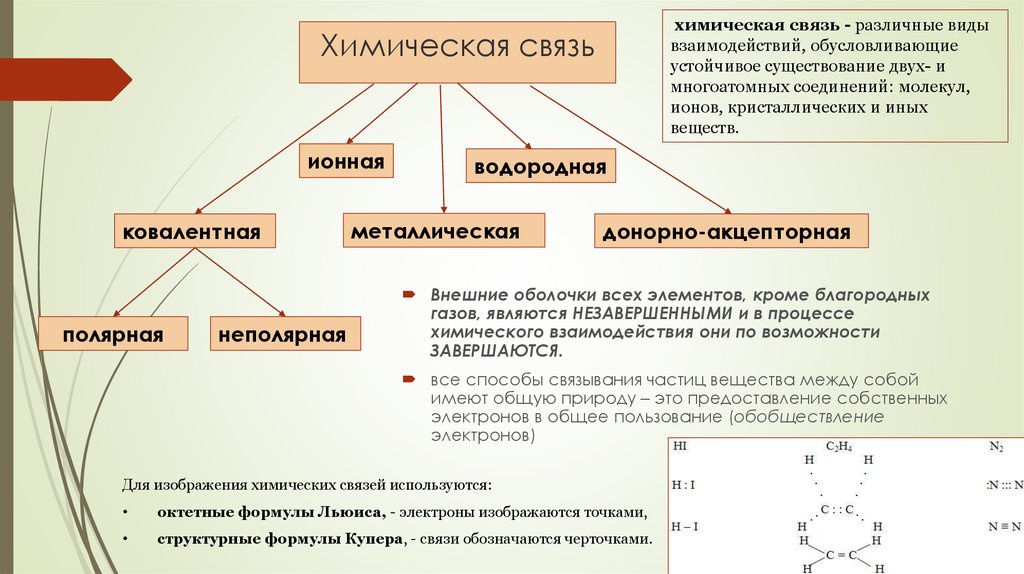
71. Химическая связь
химическая связь - различные видывзаимодействий, обусловливающие
устойчивое существование двух- и
многоатомных соединений: молекул,
ионов, кристаллических и иных
веществ.
Химическая связь
ионная
ковалентная
полярная
неполярная
водородная
металлическая
донорно-акцепторная
Внешние оболочки всех элементов, кроме благородных
газов, являются НЕЗАВЕРШЕННЫМИ и в процессе
химического взаимодействия они по возможности
ЗАВЕРШАЮТСЯ.
все способы связывания частиц вещества между собой
имеют общую природу – это предоставление собственных
электронов в общее пользование (обобществление
электронов)
Для изображения химических связей используются:
октетные формулы Льюиса, - электроны изображаются точками,
структурные формулы Купера, - связи обозначаются черточками.
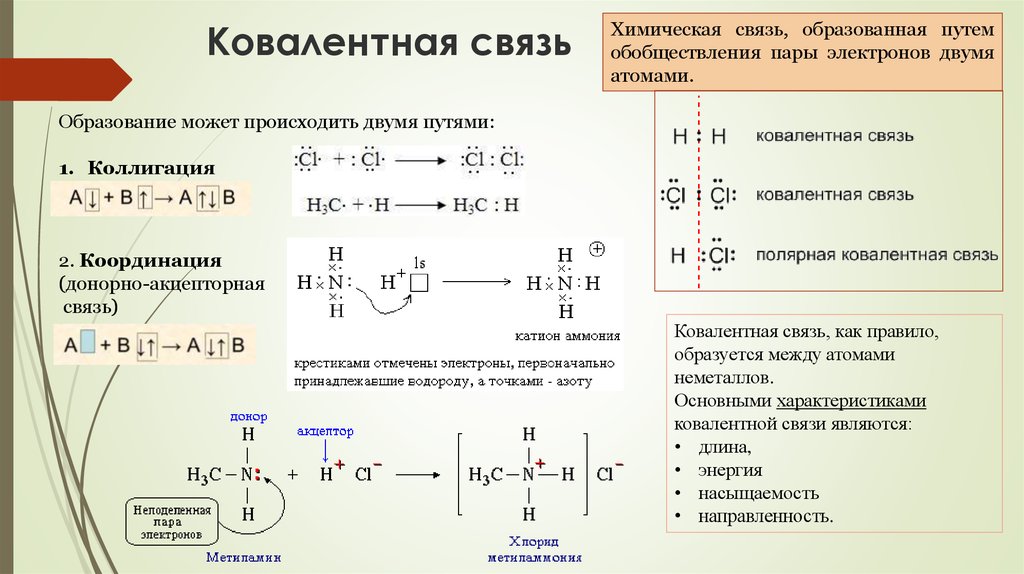
72. Ковалентная связь
Химическая связь, образованная путемобобществления пары электронов двумя
атомами.
Образование может происходить двумя путями:
1. Коллигация
2. Координация
(донорно-акцепторная
связь)
Ковалентная связь, как правило,
образуется между атомами
неметаллов.
Основными характеристиками
ковалентной связи являются:
• длина,
• энергия
• насыщаемость
• направленность.
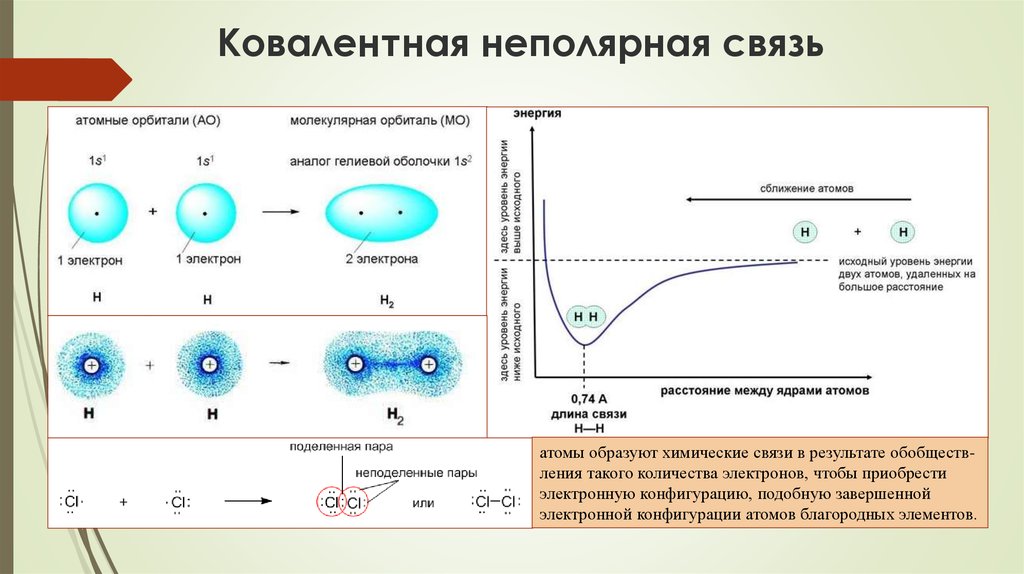
73. Ковалентная неполярная связь
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрестиэлектронную конфигурацию, подобную завершенной
электронной конфигурации атомов благородных элементов.
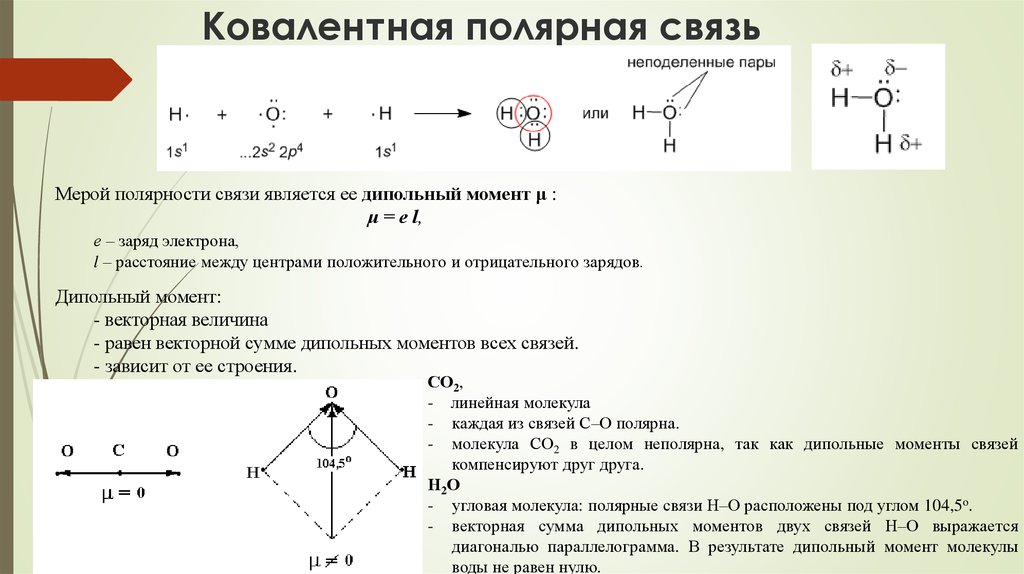
74. Ковалентная полярная связь
Мерой полярности связи является ее дипольный момент μ :μ = е l,
е – заряд электрона,
l – расстояние между центрами положительного и отрицательного зарядов.
Дипольный момент:
- векторная величина
- равен векторной сумме дипольных моментов всех связей.
- зависит от ее строения.
СО2,
- линейная молекула
- каждая из связей С–О полярна.
- молекула СО2 в целом неполярна, так как дипольные моменты связей
компенсируют друг друга.
Н2О
- угловая молекула: полярные связи Н–О расположены под углом 104,5o.
- векторная сумма дипольных моментов двух связей Н–О выражается
диагональю параллелограмма. В результате дипольный момент молекулы
воды не равен нулю.
75. Ионная связь
Ионная химическая связь представляет собойэлектростатическое взаимодействие положительных и
отрицательных заряженных ионов в химическом
соединении. Такая связь возникает лишь в случае
большой разности в электроотрицательности атомов,
например LiF, K2O, NaCl. Проявляется в твердых
веществах с ионной кристаллической решеткой.
1. Ионная связь является прочной химической связью. Энергия этой связи составляет величины
порядка 300 – 700 кДж/моль.
2. В отличие от ковалентной связи, ионная связь является ненаправленной, поскольку ион может
притягивать к себе ионы противоположного знака в любом направлении.
3. В отличие от ковалентной связи, ионная связь является ненасыщенной, так как
взаимодействие ионов противоположного знака не приводит к полной взаимной компенсации их
силовых полей.
4. В процессе образования молекул с ионной связью не происходит полной передачи электронов,
поэтому стопроцентной ионной связи в природе не существует. В молекуле NaCl химическая
связь лишь на 80% ионная.
5. Соединения с ионной связью – это твердые кристаллические вещества, имеющие высокие
температуры плавления и кипения.
6. Большинство ионных соединений растворяются в воде. Растворы и расплавы ионных
соединений проводят электрический ток.
76. Полярность связи
Критерийполярности
–
разница электроотрицательностей
ΔX
Для чисто ковалентной связи Δ X = 0.
Если величина Δ X меньше, чем 0,4 – такую связь тоже условно называют ковалентной.
связь F—F в молекуле фтора F2: ΔX = (3,98 - 3,98) = 0
связь O=O в молекуле кислорода O2: Δ X = (3,44 - 3,44) = 0
При разности электроотрицательностей от 0,4 до 2,0 связь называют полярной ковалентной:
связь H—F в молекуле фтороводорода HF: Δ X = (3,98 - 2,20) = 1,78
связь C—Cl в молекуле CСl4: Δ X = (3,16 - 2,55) = 0,61
связи с разностью электроотрицательностей больше 2,0 считаются ионными:
связь Na—Cl в соединении NaCl: Δ X = (3,16 - 0,93) = 2,23
связь K—O в соединении K2O: Δ X = (3,44 - 0,82) = 2,62
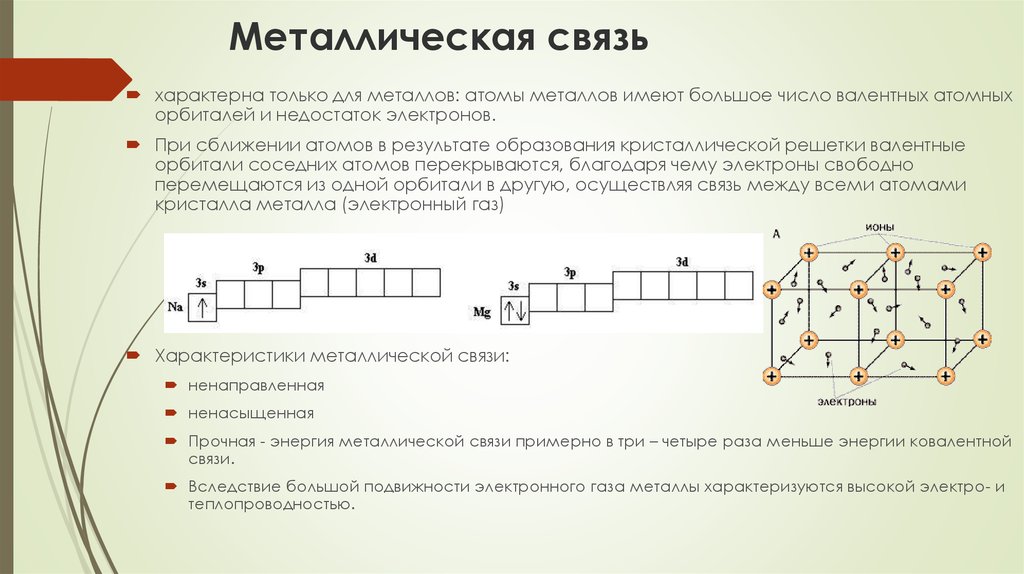
77. Металлическая связь
характерна только для металлов: атомы металлов имеют большое число валентных атомныхорбиталей и недостаток электронов.
При сближении атомов в результате образования кристаллической решетки валентные
орбитали соседних атомов перекрываются, благодаря чему электроны свободно
перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами
кристалла металла (электронный газ)
Характеристики металлической связи:
ненаправленная
ненасыщенная
Прочная - энергия металлической связи примерно в три – четыре раза меньше энергии ковалентной
связи.
Вследствие большой подвижности электронного газа металлы характеризуются высокой электро- и
теплопроводностью.
78. Водородная связь
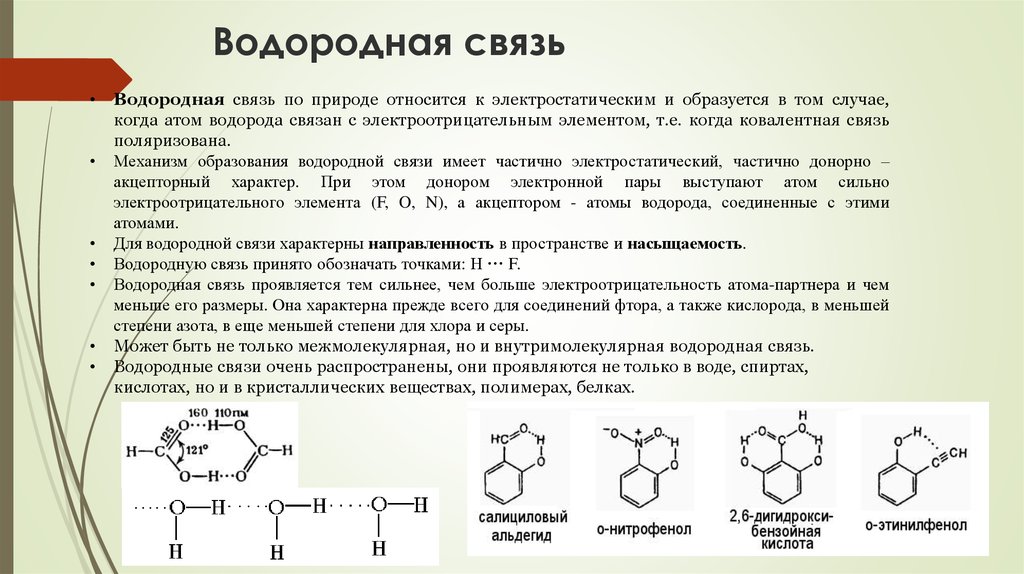
Водородная связь по природе относится к электростатическим и образуется в том случае,
когда атом водорода связан с электроотрицательным элементом, т.е. когда ковалентная связь
поляризована.
Механизм образования водородной связи имеет частично электростатический, частично донорно –
акцепторный характер. При этом донором электронной пары выступают атом сильно
электроотрицательного элемента (F, O, N), а акцептором - атомы водорода, соединенные с этими
атомами.
Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь принято обозначать точками: Н ··· F.
Водородная связь проявляется тем сильнее, чем больше электроотрицательность атома-партнера и чем
меньше его размеры. Она характерна прежде всего для соединений фтора, а также кислорода, в меньшей
степени азота, в еще меньшей степени для хлора и серы.
Может быть не только межмолекулярная, но и внутримолекулярная водородная связь.
Водородные связи очень распространены, они проявляются не только в воде, спиртах,
кислотах, но и в кристаллических веществах, полимерах, белках.
79. Примеры водородной связи
Спираль ДНКСтруктура
воды
Белки
80. Характеристики химической связи
Полярность связи - степень смещения электронной плотности, приводящего к возникновениюразнополярных полюсов. Молекула с ковалентной связью может быть неполярной, если связанные
этой связью атомы имеют одинаковые электроотрицательности:
Н3С - СН3
Н-Н
Если же один из атомов обладает большей электроотрицательностью, то электронная плотность в
этом случае будет смещена в его сторону. Такая молекула будет полярной. Например,
Н3С → Cl
Поляризуемость - способность связи изменять свою полярность под действием внешнего
электромагнитного поля. Такое поле может создавать и атакующий реагент, и растворитель.
Направленность - образование связи происходит не в любых направлениях пространства, а только
в определенных. Углы, которые образуют ковалентные связи между собой, - валентные углы.
Длина связи (l; [нм, Ã]) - расстояние между ядрами атомов.
Кратность связи - количество электронных пар, связывающих два атома или группу атомов. Чем
больше кратность, тем меньше длина связи и больше энергия.
Энергия (Е, кДж/моль) - это та энергия, которая выделяется при образовании химической связи или
поглощается при ее разрыве. Чем выше энергия связи, тем прочнее связь.
81. Метод валентных связей (МВС)
Основные положения:Атомы
в
молекуле
сохраняют
свою
индивидуальность.
Электронная
пара
заселяет орбиталь то одного, то другого атома
(В. Гейтлер и Ф. Лондон, 1927 г.)
Ковалентную химическую связь образуют два электрона с противоположными спинами,
принадлежащие двум атомам.
При образовании ковалентной химической связи происходит перекрывание волновых функций
электронов (электронных орбиталей), при этом связь будет тем прочнее, чем больше это
перекрывание.
Ковалентная химическая связь располагается в том направлении, в котором возможность
перекрывания волновых функций электронов, образующих связь будет наибольшей.
Валентность атома определяется:
в нормальном (невозбужденном) состоянии
•числом неспаренных электронов, участвующих в образовании общих электронных пар с
электронами других атомов;
•наличием донорной способности (за счёт одной неподелённой электронной пары).
В возбужденном состоянии:
•числом неспаренных электронов;
•числом вакантных орбиталей, способных акцептировать электронные пары доноров.
Валентность выражается небольшими целыми числами и не имеет знака.
Мерой валентности является число химических связей, которыми данный атом соединён с
другими.
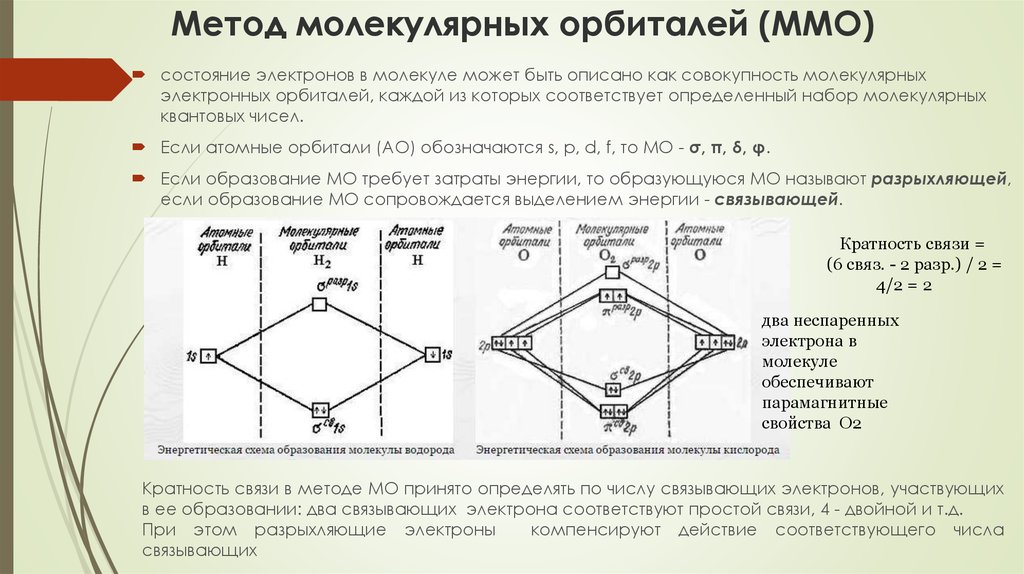
82. Метод молекулярных орбиталей (ММО)
состояние электронов в молекуле может быть описано как совокупность молекулярныхэлектронных орбиталей, каждой из которых соответствует определенный набор молекулярных
квантовых чисел.
Если атомные орбитали (АО) обозначаются s, p, d, f, то МО - σ, π, δ, φ.
Если образование МО требует затраты энергии, то образующуюся МО называют разрыхляющей,
если образование МО сопровождается выделением энергии - связывающей.
Кратность связи =
(6 связ. - 2 разр.) / 2 =
4/2 = 2
два неспаренных
электрона в
молекуле
обеспечивают
парамагнитные
свойства О2
Кратность связи в методе МО принято определять по числу связывающих электронов, участвующих
в ее образовании: два связывающих электрона соответствуют простой связи, 4 - двойной и т.д.
При этом разрыхляющие электроны
компенсируют действие соответствующего числа
связывающих
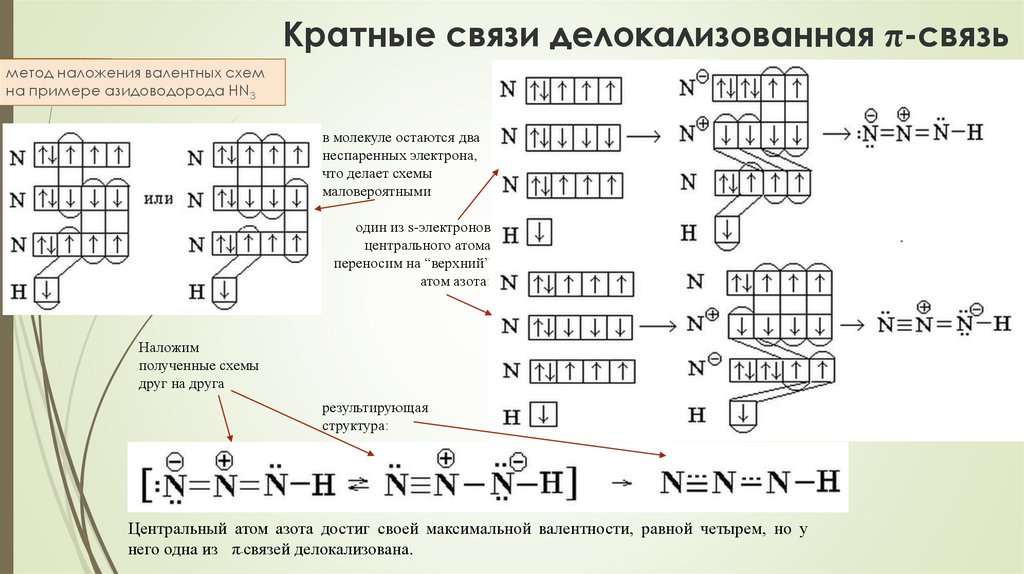
83. Кратные связи делокализованная π-связь
метод наложения валентных схемна примере азидоводорода HN3
в молекуле остаются два
неспаренных электрона,
что делает схемы
маловероятными
один из s-электронов
центрального атома
переносим на “верхний”
атом азота:
Наложим
полученные схемы
друг на друга
результирующая
структура:
Центральный атом азота достиг своей максимальной валентности, равной четырем, но у
него одна из π-связей делокализована.
84. Гибридизация электронных орбиталей
Теориягибридизации
была
предложена американскими учеными
Л. Полингом и Ж. Слейтером в 1931 г.
По своему состоянию, в том числе энергетическому, атомы углерода в основном и в возбужденном состоянии
неравноценны. Эксперимент же показывал, что все 4 валентности атома С одинаковы.
Чтобы согласовать теорию с экспериментом Л. Полинг предложил термин "гибридизация" - смешение и
выравнивание электронных облаков.

































































 chemistry
chemistry








