Similar presentations:
1. 22.09.2017 Классная работа Урок №3 Теория строения органических соединений
12. Урок №3. Теория строения органических соединений
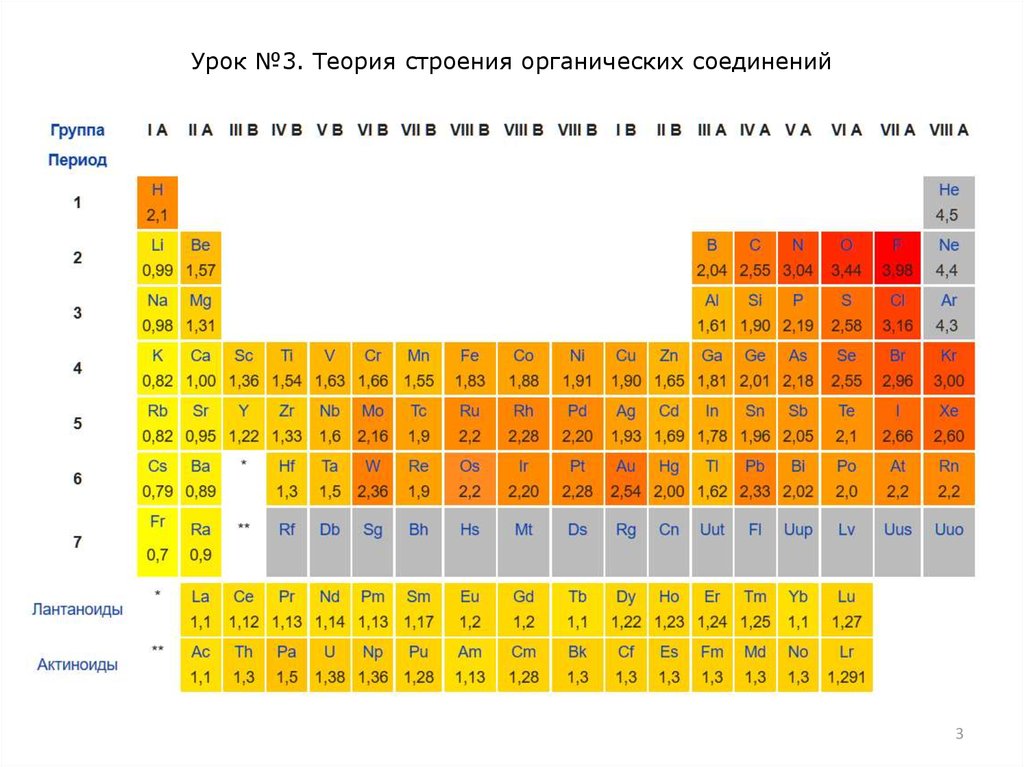
Эле́ктроотрица́тельность (χ) (относительная
электроотрицательность) – фундаментальное химическое
свойство атома, количественная характеристика способности
атома в молекуле смещать к себе общие электронные пары, то
есть способность атомов оттягивать к себе электроны других
атомов.
Самая высокая степень электроотрицательности у галогенов и
сильных окислителей (p-элементов, F, O, N, Cl), а низкая — у
активных металлов (s-элементов I группы).
2
3. Урок №3. Теория строения органических соединений
34. Теория строения органических соединений
45. Урок №3. Теория строения органических соединений
56. Урок №3. Теория строения органических соединений
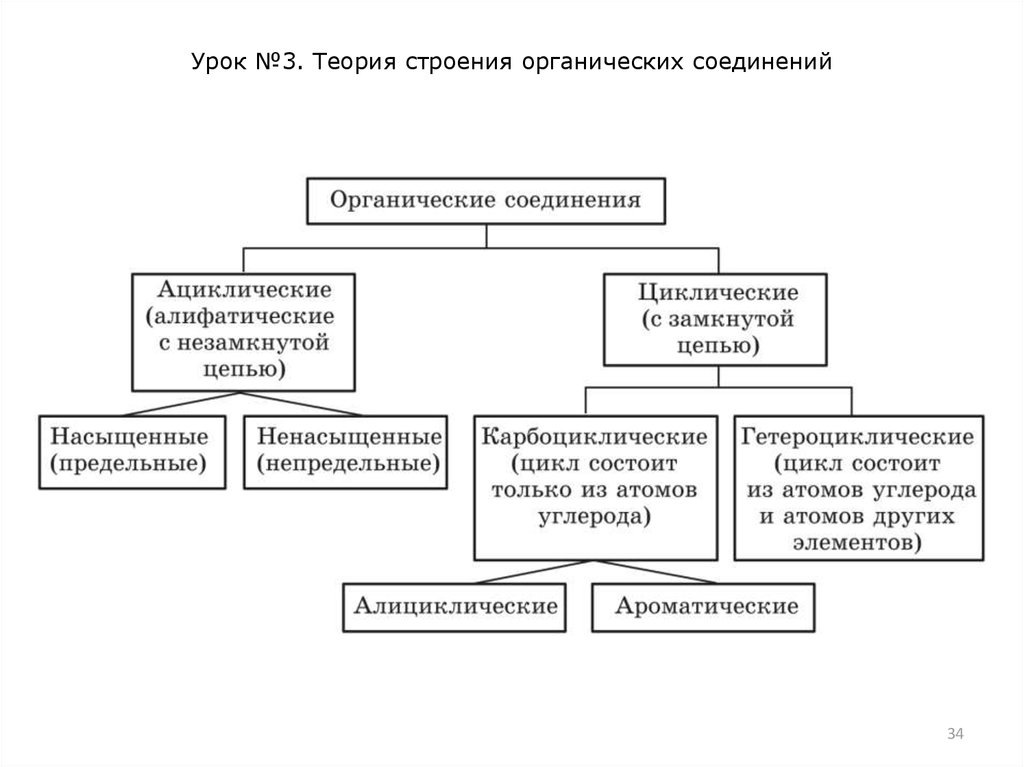
Причины многообразия органических соединений
1. Соединение атомов углерода в цепи разной длины.
2. Образование атомами углерода простых, двойных и тройных
связей с другими атомами и между собой.
3. Разный характер углеродных цепочек: линейные,
разветвленные, циклические.
4. Множество элементов, входящих в состав органических
веществ.
5. Явление изомерии органических соединений.
6
7. Урок №3. Теория строения органических соединений
На съезде немецких естествоиспытателей и врачей 19
сентября 1861 года был прочитан доклад, называвшийся
«Нечто в химическом строении тел». Автором доклада был
профессор Казанского университета Александр Михайлович
Бутлеров.
Именно это самое «нечто» и составило теорию химического
строения, которая легла в основу наших современных
представлений о химических соединениях.
Бутлеров определял понятие химического строения так:
Исходя от мысли, что каждый химический атом, входящий в
состав тела, принимает участие в образовании этого
последнего и действует здесь определённым количеством
принадлежащей ему химической силы (сродства), я называю
химическим строением распределение действия этой силы,
вследствие которой химические атомы, посредственно или
непосредственно влияя друг на друга, соединяются в
химическую частицу.
7
8. Урок №3. Теория строения органических соединений
89. Урок №3. Теория строения органических соединений
Теория строения органических соединенийОсновные положения этой теории (иногда ее называют
структурной) сводятся к следующему:
1) атомы в молекулах соединены между собой в определенном
порядке химическими связями согласно их валентности;
углерод во всех органических соединениях четырехвалентен;
2) свойства вещества определяются не только качественным
составом, но и его строением, взаимным влиянием атомов, как
связанных между собой химическими связями, так и
непосредственно не связанных;
3) строение молекул может быть установлено на основе
изучения их химических свойств.
9
10. Урок №3. Теория строения органических соединений
Важным следствием теории строения был вывод о том, что
каждое органическое соединение должно иметь одну
химическую формулу, отражающую его строение. Такой вывод
теоретически обосновывал хорошо известное уже тогда
явление изомерии, открытое в 1830 г., – существование
веществ с одинаковым молекулярным составом, но
обладающих различными свойствами.
Теперь органическая химия получила прочную научную
основу, обеспечившую ее стремительное развитие в
последующее столетие вплоть до наших дней. Предпосылками
для ее создания послужили успехи в разработке атомномолекулярного учения, представлений о валентности и
химической связи в 50-е годы XIX века. Эта теория позволила
предсказывать существование новых соединений и их
свойства.
Понятие о химическом строении или, в конечном итоге, о
порядке связи атомов в молекуле позволило объяснить такое
загадочное явление, как изомерия.
10
11. Урок №3. Теория строения органических соединений
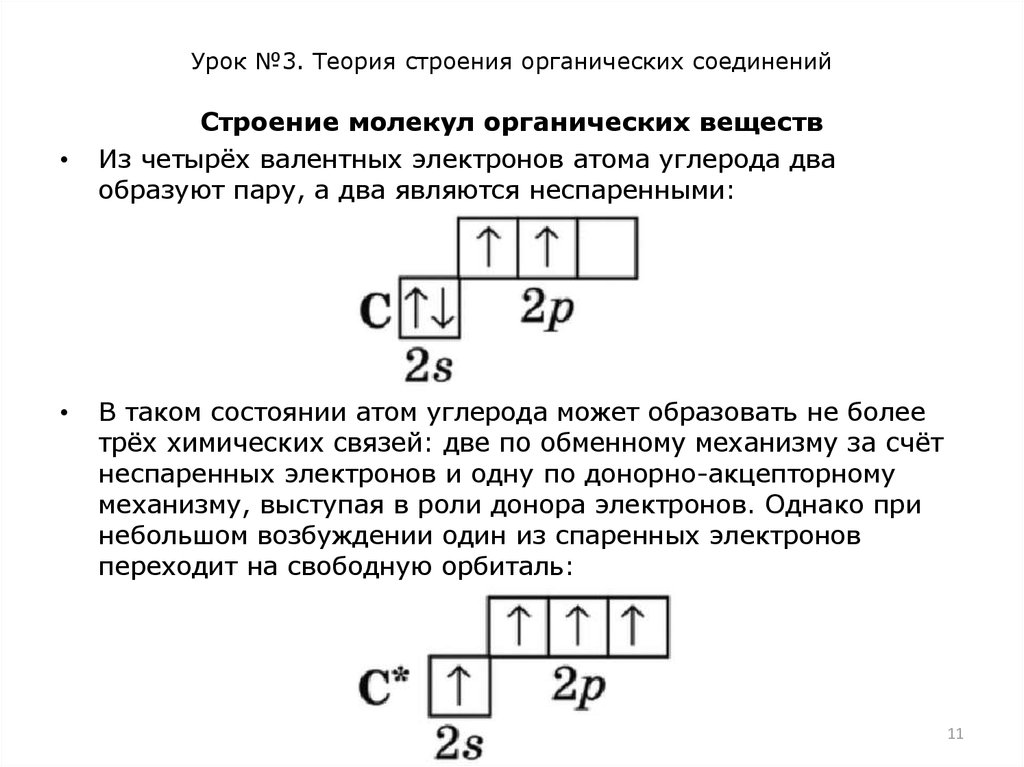
Строение молекул органических веществ
Из четырёх валентных электронов атома углерода два
образуют пару, а два являются неспаренными:
В таком состоянии атом углерода может образовать не более
трёх химических связей: две по обменному механизму за счёт
неспаренных электронов и одну по донорно-акцепторному
механизму, выступая в роли донора электронов. Однако при
небольшом возбуждении один из спаренных электронов
переходит на свободную орбиталь:
11
12. Урок №3. Теория строения органических соединений
В возбуждённом состоянии (обозначено звёздочкой) в атоме
углерода все четыре электрона на внешнем уровне –
неспаренные, и он может образовать четыре ковалентные
связи, отдавая для каждой связи по одному электрону в общее
пользование. Почти во всех органических соединениях углерод
четырёхвалентен.
Это было известно ещё в XIX в., задолго до открытия
электрона и электронной теории валентности. Интересно, что и
после создания квантовой механики химики-органики долгое
время скептически относились к этой теории. Так, один из
ведущих российских химиков, академик А.Е. Чичибабин, в
1932 г. писал в своём учебнике по органической химии:
«Электронная теория ничего не предсказывает того, чего
нельзя предположить и без этой гипотезы... Пока эта гипотеза
всё ещё пересказ фактов органической химии на язык
электронных представлений». За прошедшие с тех пор годы
электронные представления позволили предсказать многие
факты в органической химии и стали неотъемлемой частью её
теоретического фундамента.
12
13. Урок №3. Теория строения органических соединений
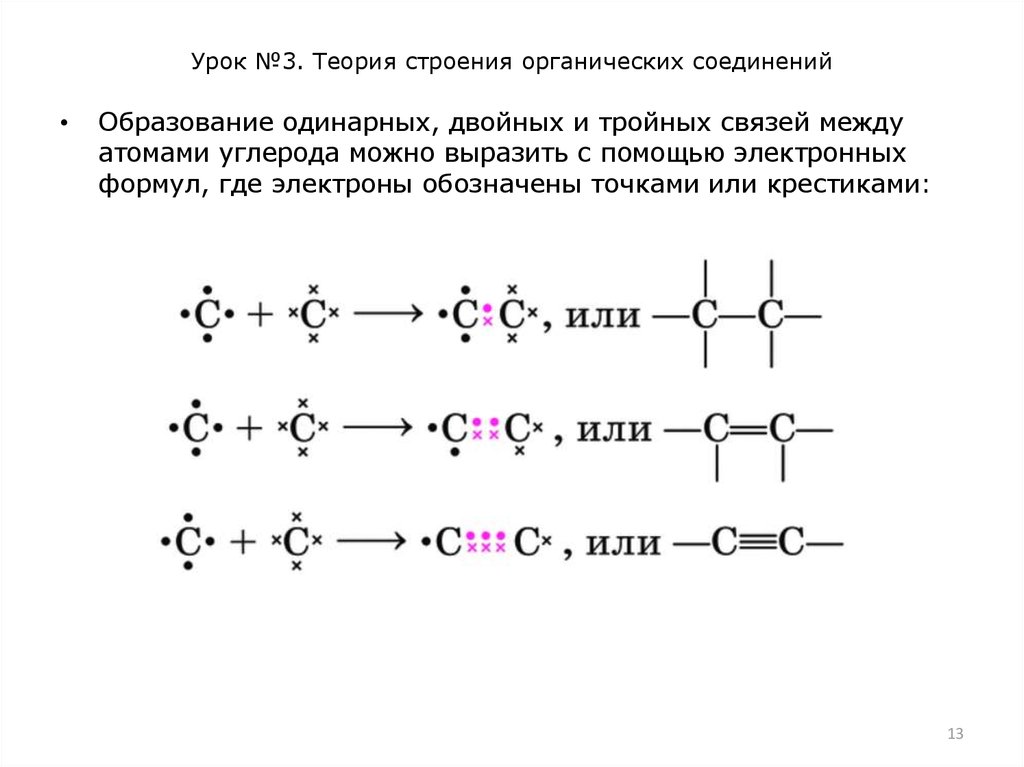
Образование одинарных, двойных и тройных связей между
атомами углерода можно выразить с помощью электронных
формул, где электроны обозначены точками или крестиками:
13
14. Урок №3. Теория строения органических соединений
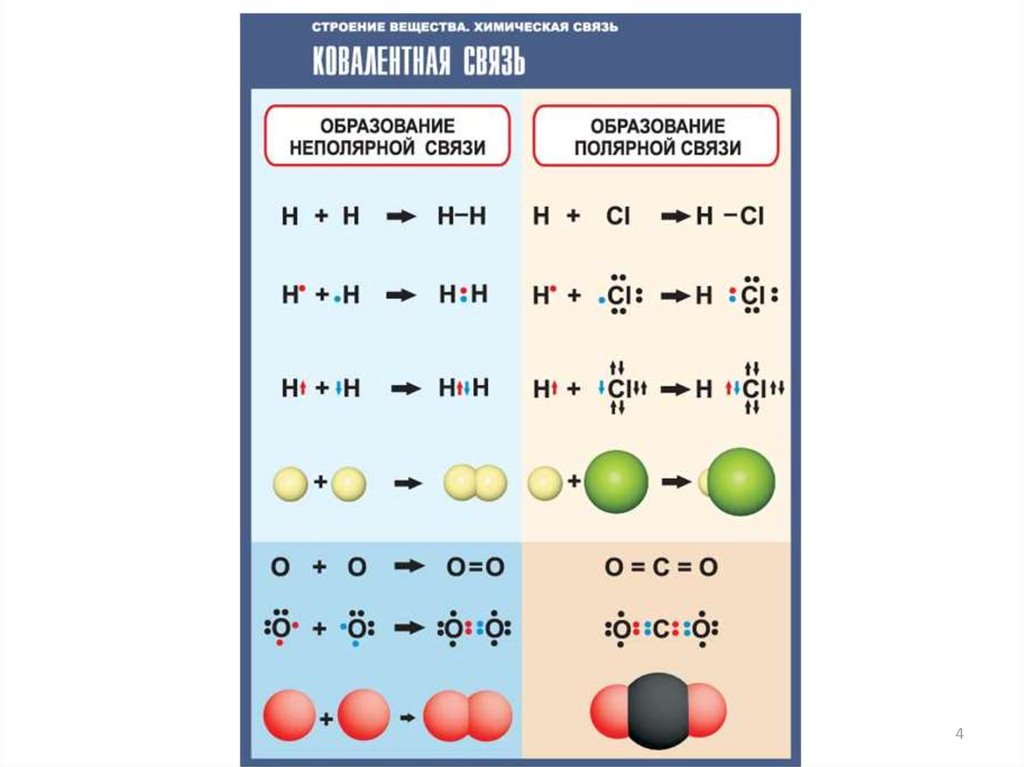
Химическая связь между атомами углерода – ковалентная
неполярная, т.е. электронное облако расположено
симметрично относительно обоих атомов. Если же углерод
образует связь с атомом другого элемента, то электронное
облако (электронная плотность) смещается к одному из атомов
– тому, который имеет большую электроотрицательность, – и
связь становится полярной.
Сравнивая электроотрицательности атомов углерода и других
неметаллов, можно сделать вывод, что электронное облако
связи С−Н смещено к атому углерода, а связей С−Сl, С−О,
С−N – от него.
В первом случае из-за избытка электронной плотности на
атоме углерода образуется частичный отрицательный заряд, а
в остальных случаях – частичный положительный (рис. 1).
14
15. Урок №3. Теория строения органических соединений
1516. Урок №3. Теория строения органических соединений
Чем больше разность электроотрицательностей атомов, тем
сильнее смещено облако. Смещение электронной плотности в
молекуле под действием различных атомов или групп атомов
называют электронными эффектами. Они играют важную роль
в предсказании химической активности органических
соединений.
В атоме углерода четыре неспаренных электрона находятся на
разных орбиталях – одной s и трёх р. Исходя из этого, можно
было бы ожидать, что химические связи, образованные этими
электронами, тоже будут отличаться друг от друга. На самом
деле это не так. Например, в молекуле метана СН4 все четыре
связи С−Н одинаковы. Чтобы объяснить это противоречие,
американский химик Л. Полинг (1901–1994) предложил
теорию гибридизации орбиталей.
16
17. Урок №3. Теория строения органических соединений
Согласно этой теории, в образовании химических связей атома
углерода участвуют не атомные s- и р-орбитали, а так
называемые гибридные орбитали. В формировании гибридных
орбиталей участвуют 2s-орбиталь и от одной до трёх 2рорбиталей атома углерода. Число гибридных орбиталей равно
числу атомных, из которых они образуются. Химические связи
возникают при перекрывании гибридных орбиталей с
орбиталями других атомов. Углы между связями определяются
из условия, что гибридные орбитали должны быть
расположены на максимальном удалении друг от друга.
Рассмотрим основные типы гибридизации атома углерода,
характерные для органических соединений.
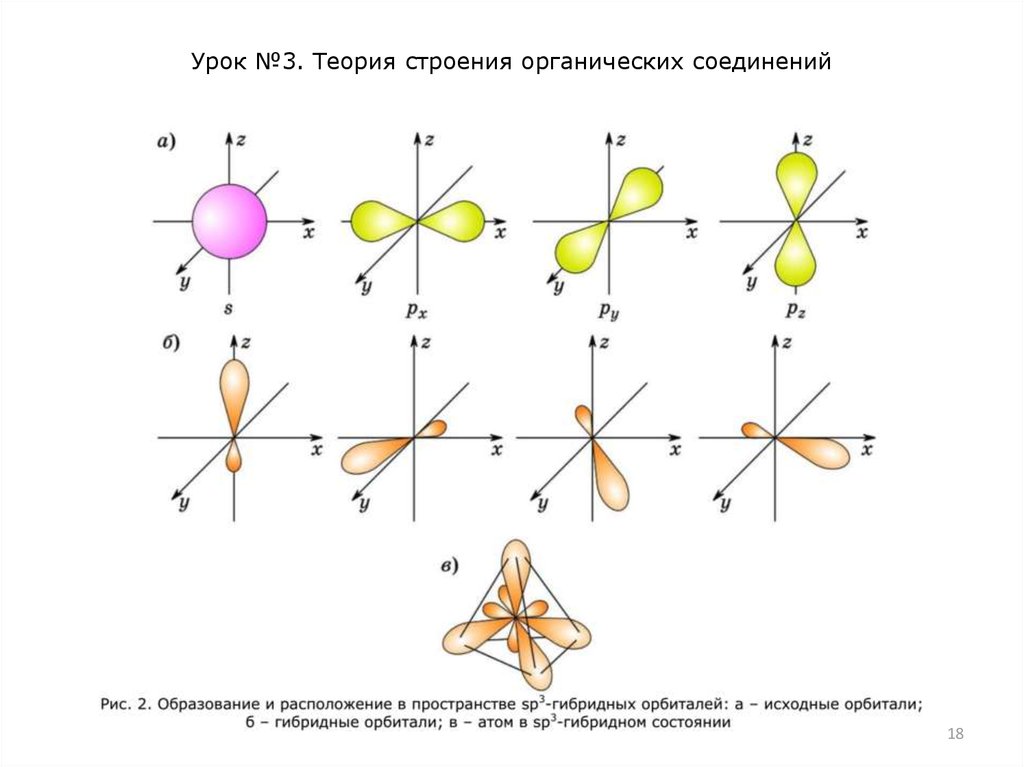
sр3-Гибридизация характерна для предельных органических
соединений. В этом случае одна 2s- и три 2р-орбитали в
результате перемешивания образуют четыре одинаковые sр3гибридные орбитали. Максимальное удаление орбиталей друг
от друга достигается, если они расположены под углом 109,5°
друг к другу и направлены к вершинам тетраэдра, в центре
которого находится ядро атома углерода (рис. 2). На рисунке
видно, что гибридная орбиталь отличается по форме от
17
атомных орбиталей – она вытянута в одну сторону от ядра.
18. Урок №3. Теория строения органических соединений
1819. Урок №3. Теория строения органических соединений
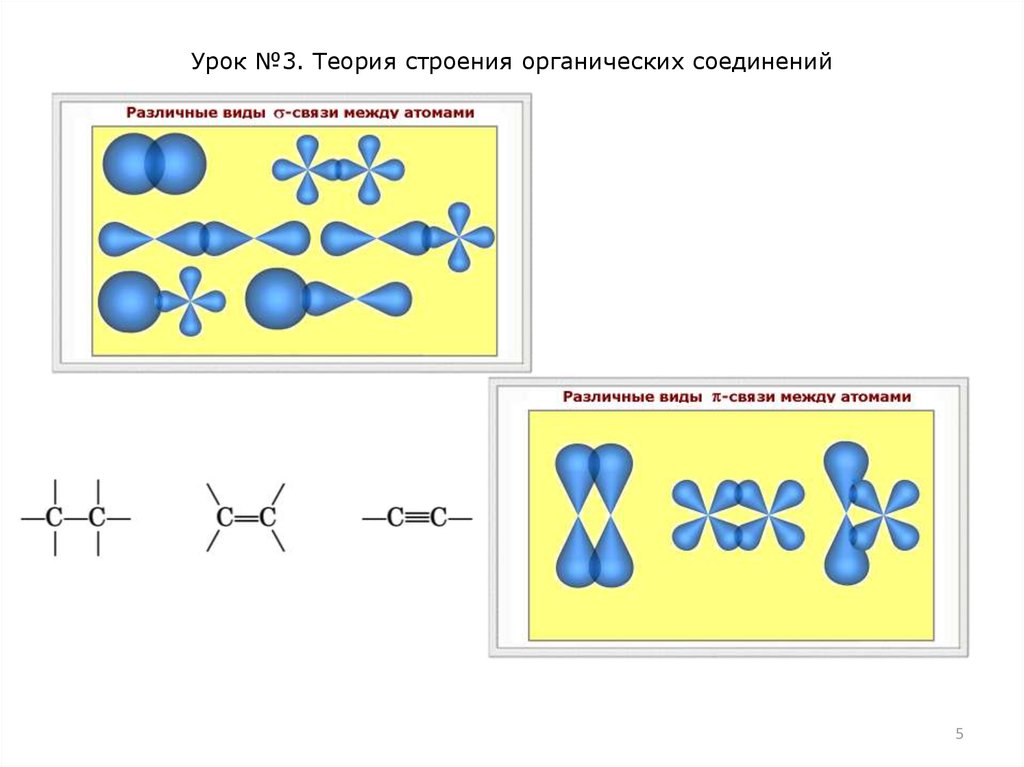
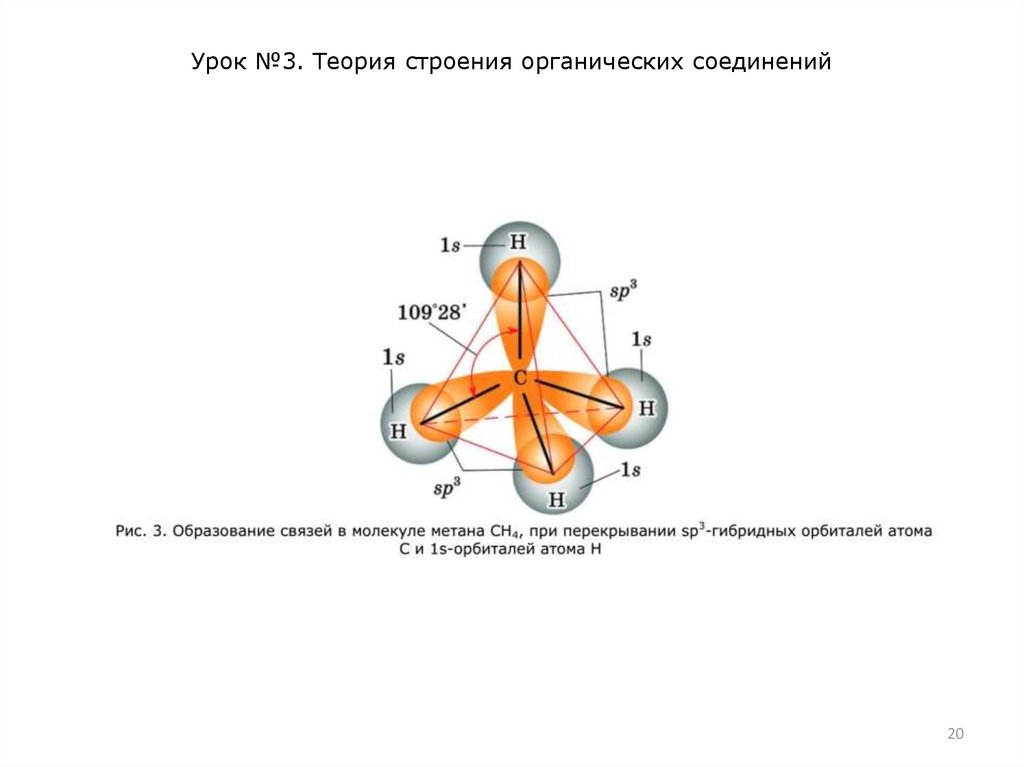
Образовавшиеся гибридные орбитали могут перекрываться с
орбиталями других атомов, например 1s-орбиталями атомов
водорода (рис. 3). При этом образуются четыре -связи
(вспомните, что такое -связь).
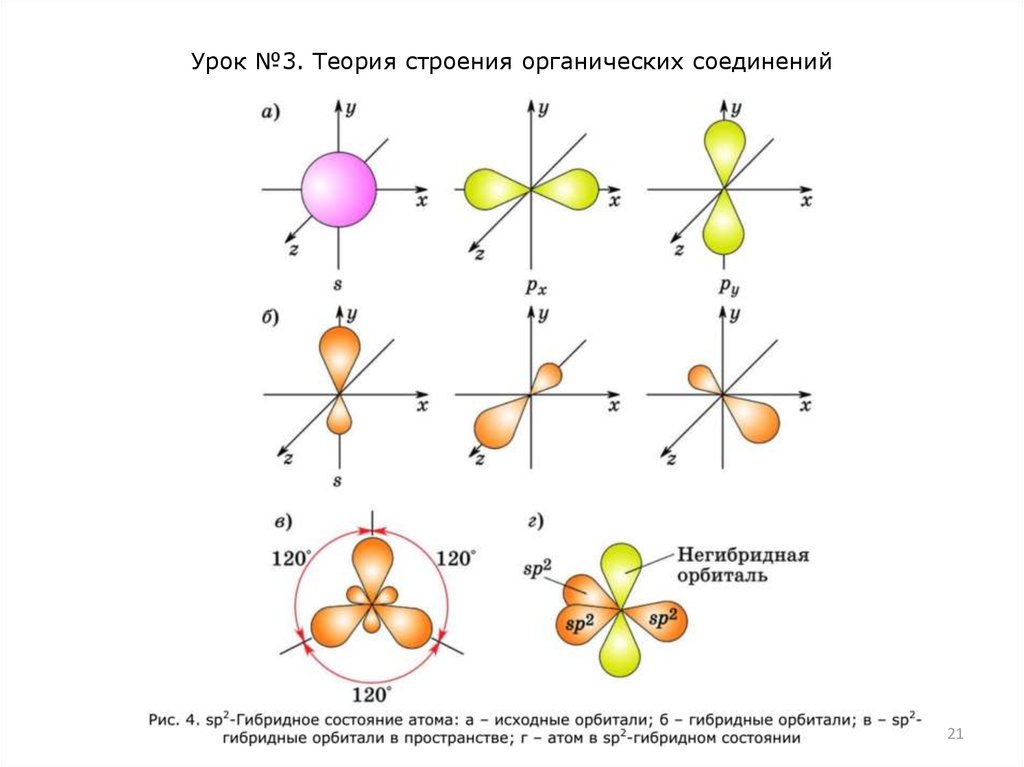
sp2-Гибридизация характерна для органических соединений,
содержащих двойную связь. В этом случае одна 2s- и две 2pорбитали атома углерода образуют три одинаковые sр2гибридные орбитали. Они расположены под углом 120° друг к
другу и направлены к вершинам правильного треугольника, в
центре которого находится ядро атома углерода (рис. 4).
19
20. Урок №3. Теория строения органических соединений
2021. Урок №3. Теория строения органических соединений
2122. Урок №3. Теория строения органических соединений
Три sр2-гибридные орбитали атома углерода образуют три связи при перекрывании с 1s-орбиталями атомов водорода или
орбиталями других атомов.
2р-Орбиталь атома углерода, не участвующая в гибридизации,
направлена перпендикулярно плоскости вр2-гибридных
орбиталей. Она участвует в образовании -связи. Таким
образом, двойная связь С=С включает одну -связь и одну связь.
-Связи менее прочны, чем -связи, электронное облако связи более подвижно, чем облако -связи, и может легко
смещаться в ту или иную сторону под действием различных
атомов или групп атомов (электронные эффекты).
22
23. Урок №3. Теория строения органических соединений
Атом углерода, участвующий в образовании одной тройной или
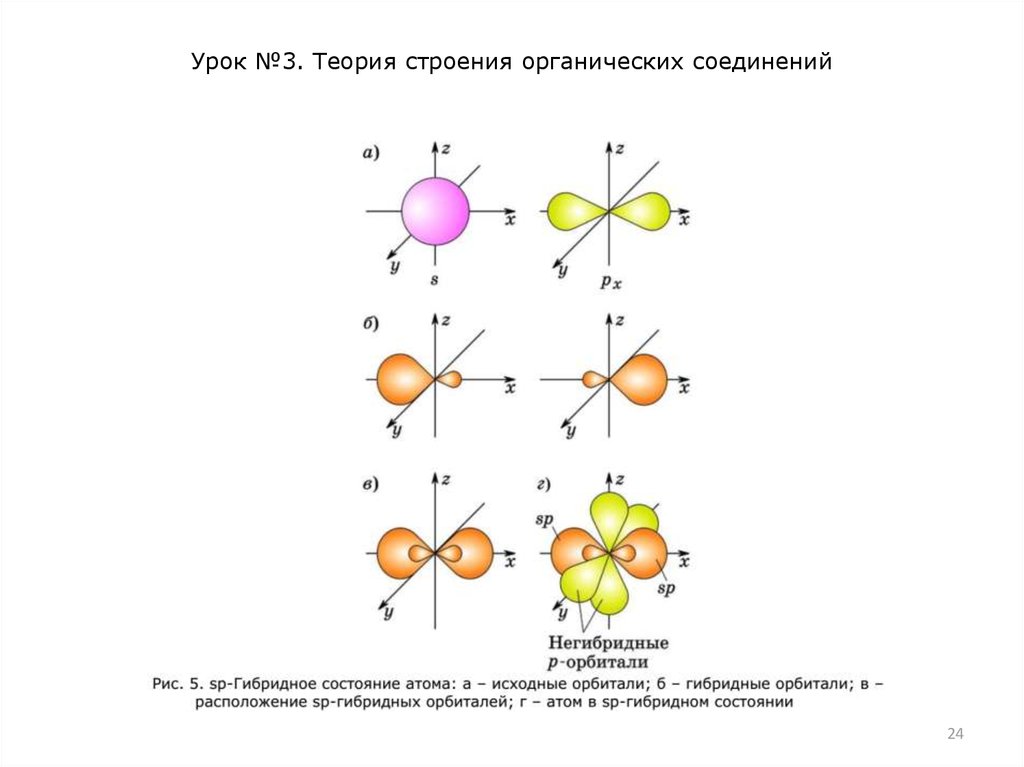
двух двойных связей, находится в состоянии sp-гибридизации.
В этом случае одна 2s- и одна 2р-орбиталь атома углерода
образуют две одинаковые sp-гибридные орбитали, которые
расположены под углом 180° друг к другу (рис. 5). Эти две spгибридные орбитали атома углерода участвуют в образовании
-связей, а две 2р-орбитали атома углерода, не участвующие в
гибридизации, могут перекрываться с такими же негибридными
2р-орбиталями другого атома углерода, образуя две -связи.
Тройная связь С≡С включает одну -связь и две -связи.
23
24. Урок №3. Теория строения органических соединений
2425. Урок №3. Теория строения органических соединений
Теория гибридизации орбиталей позволила объяснить
экспериментальные данные о пространственном строении
большого числа молекул. Эту теорию применяют не только в
органической, но и в неорганической химии.
Необходимо особо подчеркнуть, что гибридизация, т.е.
перемешивание орбиталей – это не физическое явление, а,
скорее, математический приём, который позволил согласовать
представления о форме атомных орбиталей с данными о
пространственном строении молекул.
25
26. Урок №3. Теория строения органических соединений
ИЗОМЕРИЯ И ГОМОЛОГИЯ
Явление изомерии было известно с 1823 года. Берцелиус
(1830 год) предложил назвать изомерами вещества, имеющие
качественный и количественный состав, но обладающие
различными свойствами. К примеру, было известно около 80
разнообразных веществ, отвечающих составу C6H12O2.
В 1861 году загадка изомерии была разгадана.
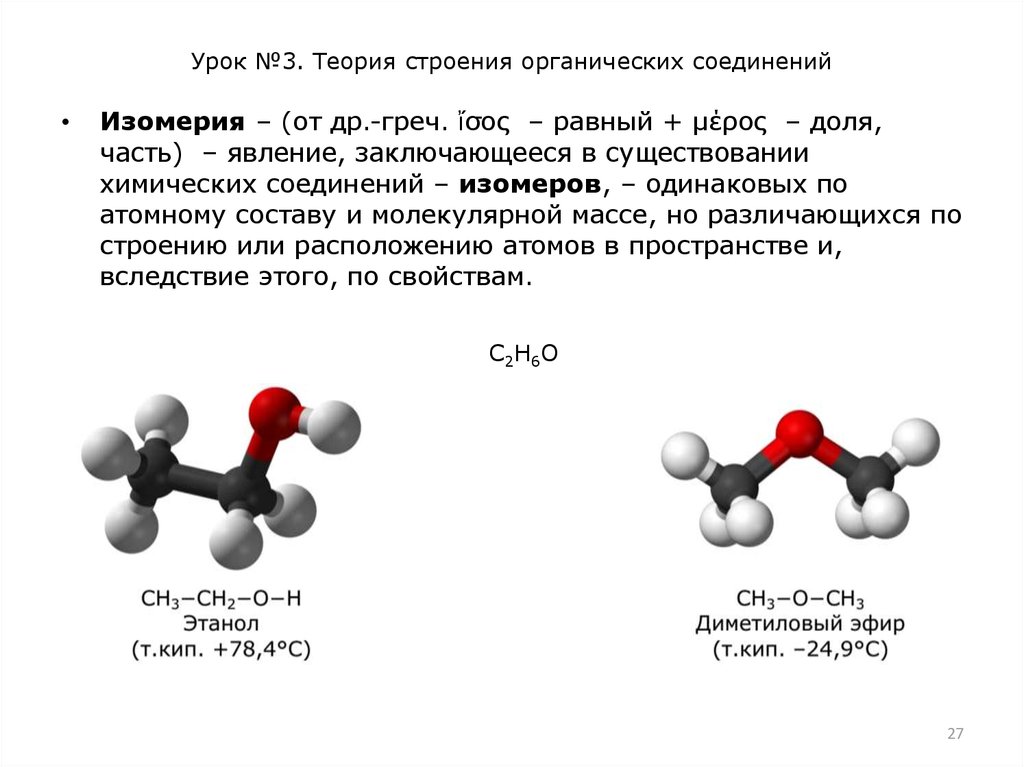
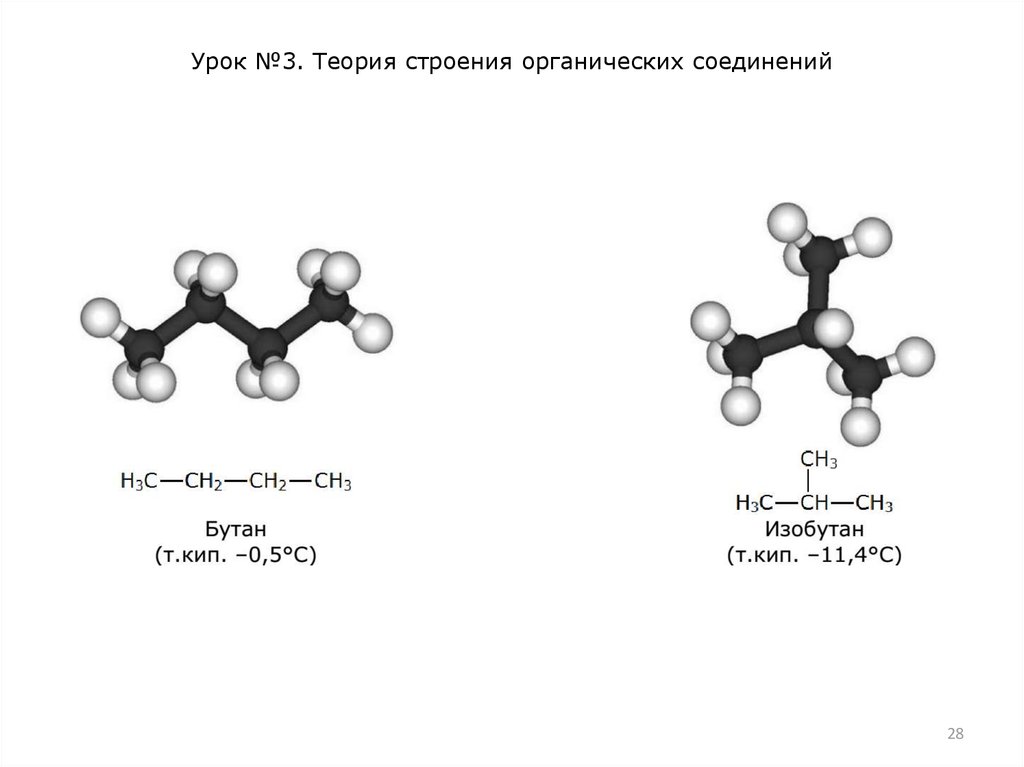
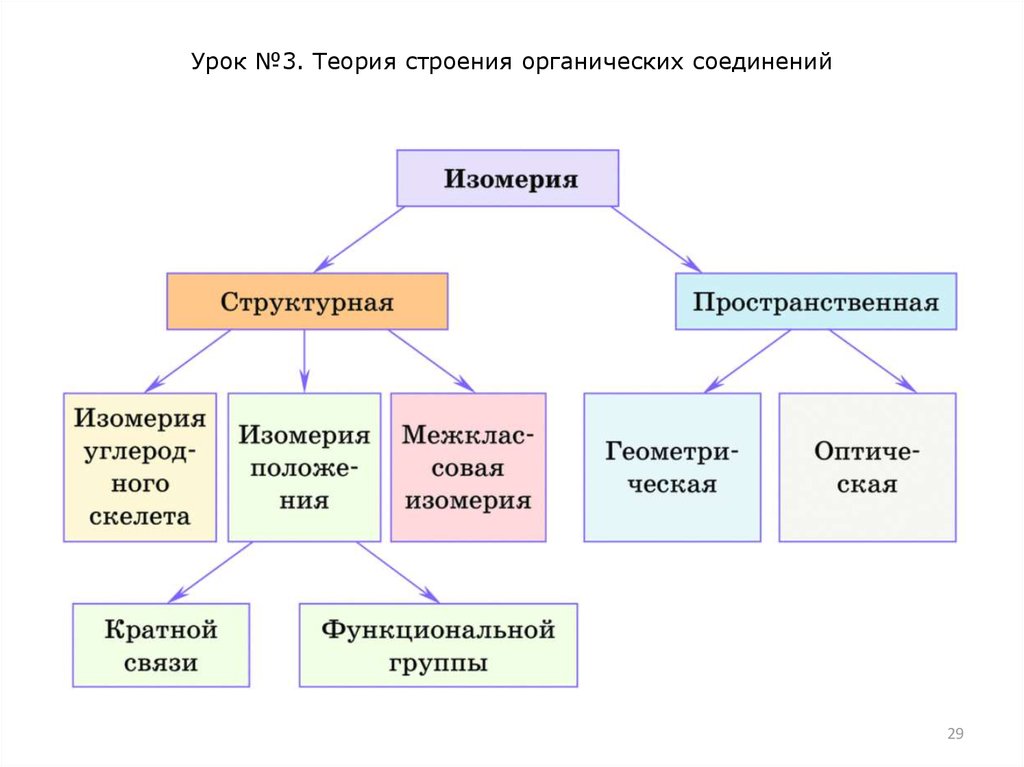
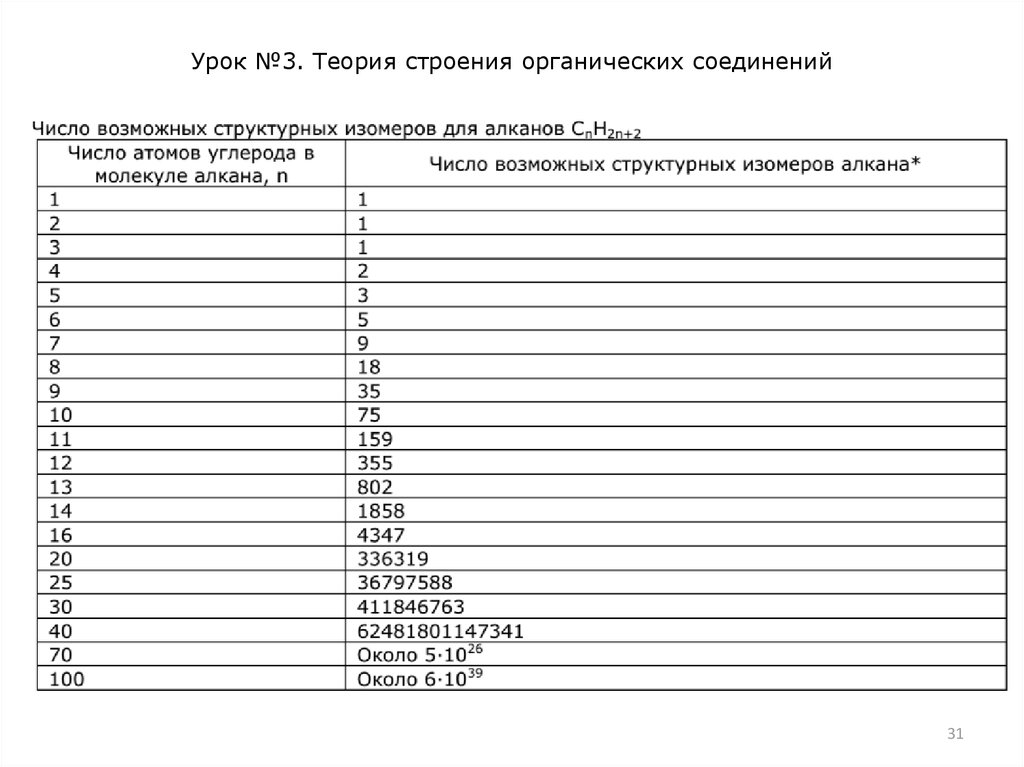
Различают два основных типа изомерии – структурную и
пространственную. Структурная изомерия вызвана разным
порядком соединения атомов в молекуле. Например, два атома
углерода и один атом кислорода можно соединить друг с
другом в открытую цепь двумя способами: С−С−О и С−О−С.
Поэтому соответствующие вещества – этиловый спирт
СН3−СН2−ОН и диметиловый эфир СН3−О−СН3 обладают
совершенно разными физическими и химическими свойствами.
В пространственных изомерах порядок соединения атомов
один и тот же, однако положение атомов в пространстве
относительно других атомов отличается.
26
27. Урок №3. Теория строения органических соединений
Изомерия – (от др.-греч. ἴσος – равный + μέρος – доля,
часть) – явление, заключающееся в существовании
химических соединений – изомеров, – одинаковых по
атомному составу и молекулярной массе, но различающихся по
строению или расположению атомов в пространстве и,
вследствие этого, по свойствам.
С2Н6О
27
28. Урок №3. Теория строения органических соединений
2829. Урок №3. Теория строения органических соединений
2930. Урок №3. Теория строения органических соединений
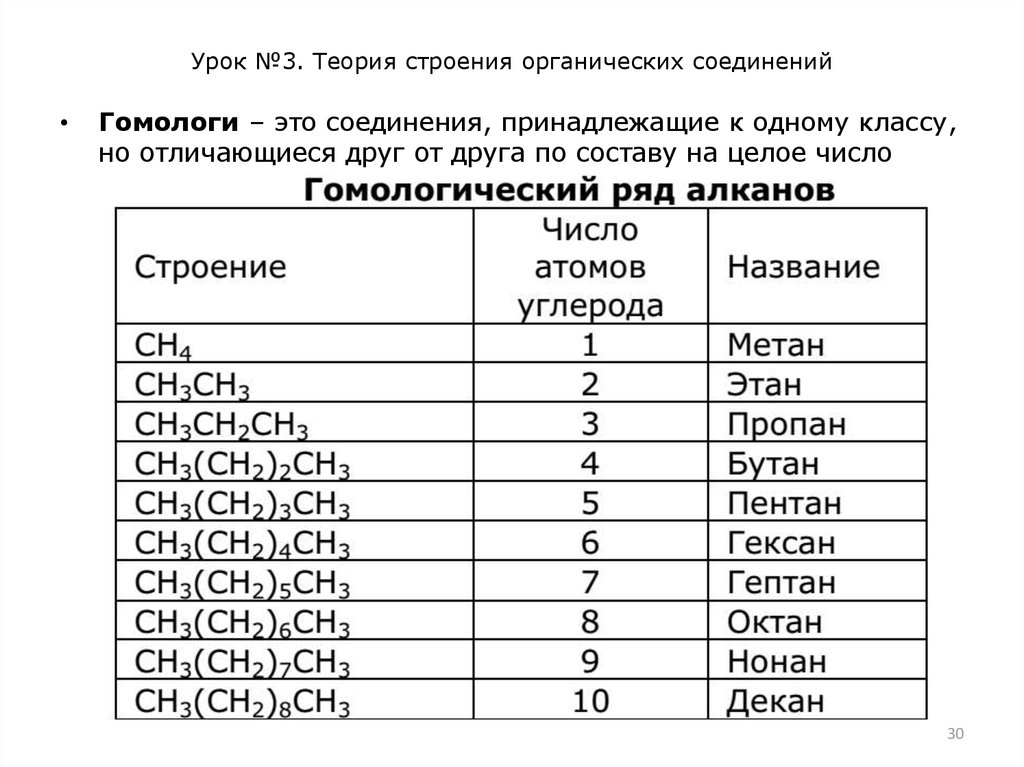
Гомологи – это соединения, принадлежащие к одному классу,
но отличающиеся друг от друга по составу на целое число
групп СН2. Совокупность всех гомологов образует
гомологический ряд.
30
31. Урок №3. Теория строения органических соединений
3132. Урок №3. Теория строения органических соединений
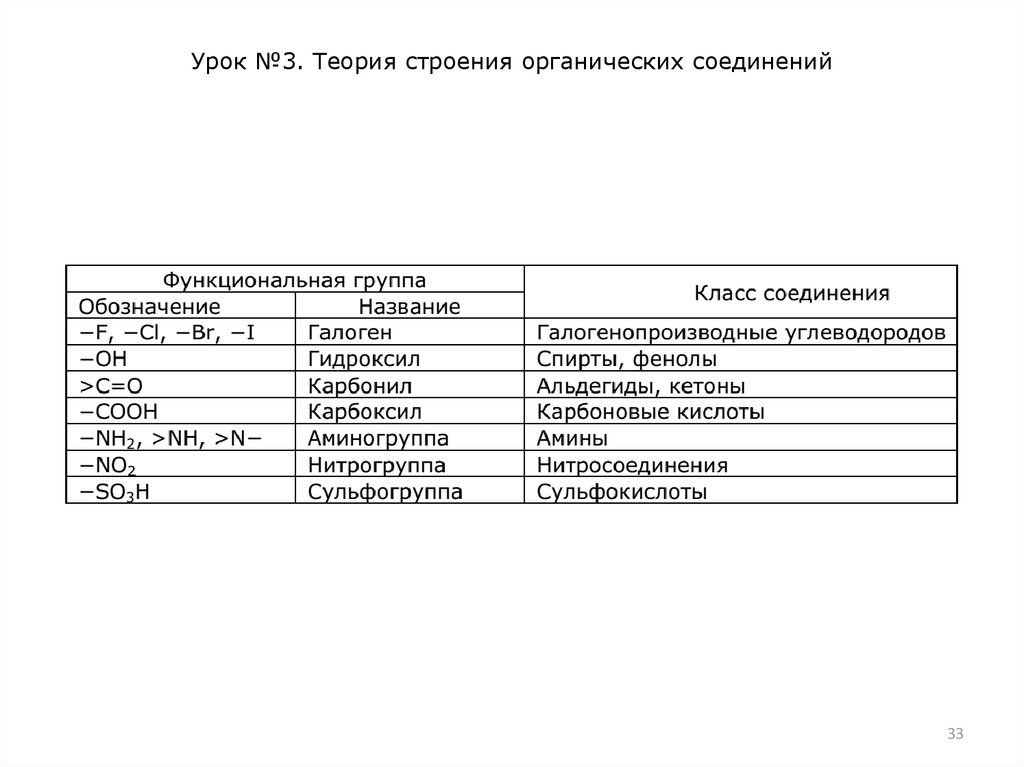
Функциональные группы. В большинстве органических
соединений, кроме атомов углерода и водорода, содержатся
атомы других элементов (не входящие в скелет). Эти атомы
или их группировки, во многом определяющие химические и
физические свойства органических соединений, называют
функциональными группами.
Функциональная группа – признак, по которому соединения
относят к тому или иному классу. Важнейшие группы
приведены в табл.
Соединения, которые содержат несколько функциональных
групп, называют полифункциональными.
Соединения, имеющие одинаковые функциональные группы,
но различающиеся числом атомов углерода, обладают весьма
похожими физическими и химическими свойствами.
32
33. Урок №3. Теория строения органических соединений
3334. Урок №3. Теория строения органических соединений
3435. Урок №3. Теория строения органических соединений
Тренировочные упражнения
1. При сгорании некоторой массы неизвестного углеводорода
образовалось 7,7 г углекислого газа и 3,6 г воды. Определите
молекулярную формулу углеводорода и его массу.
2. Определите простейшую формулу углеводорода,
содержащего 83,33% углерода.
35
36. Урок №3. Теория строения органических соединений
Домашнее задание
Учить §2, 6.
Выполнить задания
§2 №1, 2 (устно),
№4 (письм.);
§6 №5
36




















 chemistry
chemistry








