Similar presentations:
Использование иммунологических реакций: реакции агглютинации, гемагглютинации, связывания комплемента, нейтрализации
1. Прикладные аспекты иммунологии
Использование иммунологическихреакций: реакции агглютинации,
гемагглютинации, связывания
комплемента, нейтрализации
к.х.н., доцент кафедры
микробиологии
Герловский Денис Олегович
Минск, 2014
2.
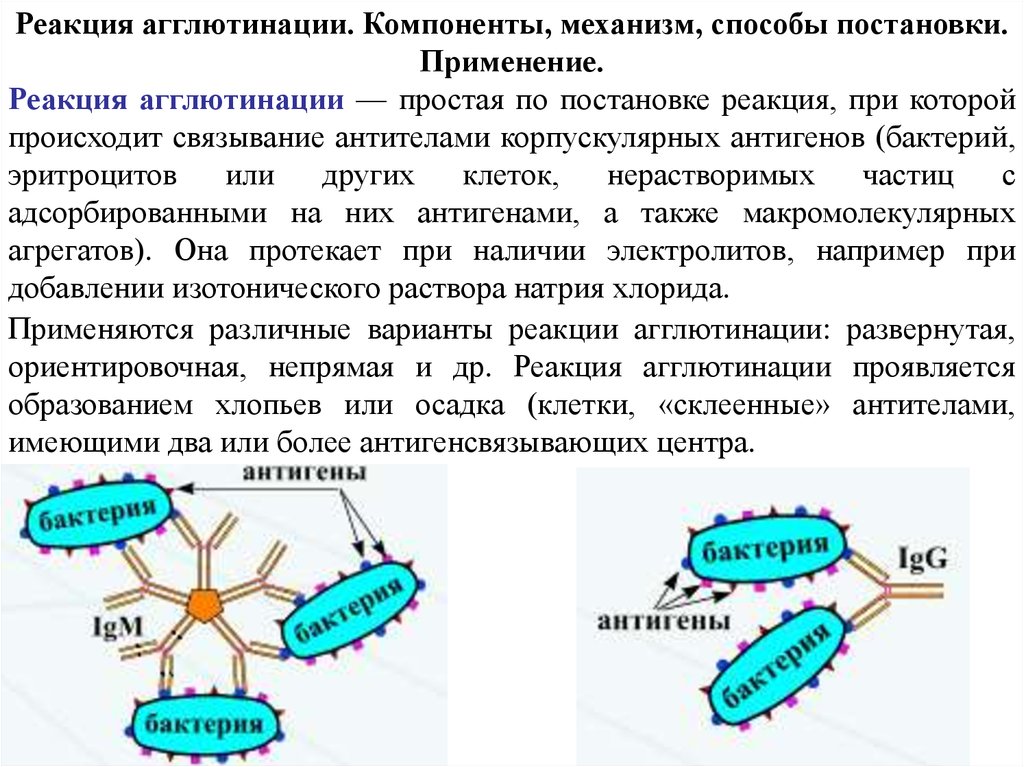
Реакция агглютинации. Компоненты, механизм, способы постановки.Применение.
Реакция агглютинации — простая по постановке реакция, при которой
происходит связывание антителами корпускулярных антигенов (бактерий,
эритроцитов
или
других
клеток,
нерастворимых
частиц
с
адсорбированными на них антигенами, а также макромолекулярных
агрегатов). Она протекает при наличии электролитов, например при
добавлении изотонического раствора натрия хлорида.
Применяются различные варианты реакции агглютинации: развернутая,
ориентировочная, непрямая и др. Реакция агглютинации проявляется
образованием хлопьев или осадка (клетки, «склеенные» антителами,
имеющими два или более антигенсвязывающих центра.
3.
Ориентировочнаяреакция
агглютинации
на
стекле.
К
капле
агглютинирующей сыворотки (разведение 1 : 20) добавляют взвесь бактерии,
выделенных от больного животного. Образуется хлопьевидный осадок.
Для ее постановки на поверхность обычного предметного стекла (или в лунки
специальных стекол) наносят капли цельной или незначительно разведенной
сыворотки и затем вносят в каждую каплю корпускулярный антиген в растворе
электролита (например, физиологическом растворе). В качестве контролей на
стекло должны быть нанесены отдельные капли, содержащие только антиген или
только сыворотку. В случае соответствия антигена антителам сыворотки в
опытных каплях в течение 5–15 мин образуется видимый глазом осадок, который
не наблюдается в контрольных каплях. В такой реакции неизвестным может быть
антиген (например, выделенные в ходе исследования бактерии), и в этом случае
используются промышленно производимые антисыворотки, содержащие антитела
к антигенам бактерий конкретных видов или сероваров (серотипов, серогрупп).
Применить эту реакцию можно и для анализа сыворотки, полученной, например,
от конкретного пациента. В этом случае используются промышленно
производимые взвеси антигенов, называемые обычно диагностикумами.
4.
Развернутая реакция агглютинации.Применение этой реакции основано на обсужденных ранее особенностях
агглютинации: хорошо фиксируемые визуально комплексы образуются только
при соответствующих концентрациях реагирующих антигенов и антител. Для
постановки реакции анализируемую сыворотку разводят физиологическим
раствором в зависимости от предполагаемого в ней количества анализируемых
антител либо в 10 или в 100 раз, а затем несколько раз двукратно, либо сразу
начинают с серии последовательных двукратных разведений. Пробирок с
минимальным разведением сыворотки обычно приготавливают две – одна из них
будет служить в качестве контроля на выпадение в осадок самой сыворотки.
Кроме того, готовят одну пробирку, в которой будет содержаться только
используемый для разведения сыворотки физиологический раствор. Объем
жидкости во всех пробирках должен быть одинаковым. Далее в каждую пробирку
(кроме контрольной на выпадение в осадок сыворотки) вносят равные объемы
суспензии антигена в таком же физиологическом растворе, перемешивают и
помещают в термостат с температурой 37ºС на 1–4 часа. При отсутствии видимых
осадков после инкубирования в термостате, как правило, оставляют пробирки
при комнатной температуре до следующего дня. Учет результатов проводят
визуально, отмечая, при каких разведениях сыворотки образуются осадки.
Наибольшее разведение (например, 1 : 3200), при котором осадок образовался,
считается показателем и называется титром сыворотки.
5.
Развернутая реакция агглютинации с возбудителем, выделенным от больногоживотного. К разведениям агглютинирующей сыворотки добавляют взвесь
бактерий, выделенных от больного.
Развернутая реакция агглютинации с сывороткой крови. К разведениям
сыворотки добавляют диагностикум.
Агглютинация с О-диагностикумом (бактерии, убитые нагреванием, сохранившие
O- антиген) происходит в виде мелкозернистой агглютинации.
Агглютинация с Н - диагностикумом (бактерии, убитые формалином,
сохранившие жгутиковый Н-антиген) - крупнохлопчатая и протекает быстрее.
6.
Реакции гемагглютинации.Собственно феномен гемагглютинации заключается в объединении эритроцитов в
видимые невооруженным глазом агрегаты и более быстром, чем оседание свободных
эритроцитов, осаждении их из раствора. Помимо открытых еще К. Ландштейнером
агглютининов α и β агрегирование эритроцитов могут вызывать антитела к
различным эритроцитарным антигенам, лектины растительного происхождения,
антигены и жгутики бактерий некоторых видов, некоторые вирусы, в том числе и
вирусы человека.
Прямая гемагглютинация. Реакция прямой гемагглютинации (РПГА) используется для
выявления поверхностных антигенов микроорганизмов и эритроцитов, а также
антител к ним.
К стандартным сывороткам, содержащим антитела, добавляют исследуемый материал
(кровь). Скорость прямой реакции агглютинации связана с количеством исследуемого
материала, количеством и концентрацией сыворотки, температурой окружающей
среды.
Непрямая гемагглютинация. Реакцию непрямой гемагглютинации проводят для
выявления антител в крови пациента с помощью эритроцитарного диагностикума.
Реагент представляет собой эритроциты, на поверхности которых расположен антиген
(белки микроорганизмов, токсинов, аллергенов и др.).
Сыворотку крови пациента разводят 0,9 %-ным раствором натрия хлорида, затем
добавляют эритроцитарный диагностикум и отслеживают результат. Этот
высокочувствительный способ диагностики выявляет антигены даже в небольших
концентрациях.
7.
Осаждение эритроцитов лучше всего наблюдать в небольших объемах, вносимых вспециальные углубления (лунки) на поверхности стеклянных пластинок или
полистироловых планшетов для иммунологических реакций. Дно таких углублений имеет
форму сферы, поэтому при естественном (без агглютинации) оседании эритроцитов на дне
такой лунки в центре образуется плотный осадок с ровными краями, занимающий
небольшую площадь (так называемая «пуговка»). Такой результат в реакциях учитывают
как отрицательный. При наличии агглютинации в зависимости от ее степени осадок
появляется на большей, чем «пуговка», площади и края осадка выглядят размытыми. При
самой эффективной агглютинации осадок покрывает практически все сферическое дно,
формируя так называемый «зонтик» (название связано со сходством наблюдаемой картины
с красным перевернутым зонтом).
8.
Реакция Кумбса — антиглобулиновый тест для определения неполныхантиэритроцитарных антител. Тест Кумбса используется для выявления антител к
резус-фактору у беременных женщин и определения гемолитической анемии у
новорождённых детей с резус-несовместимостью, влекущей разрушение
эритроцитов. Основы метода описаны в 1908 году Мореши, в 1945 году Кумбсом, Мураном и Рэйсом,впоследствии получил название «реакция Кумбса».
Прямая реакция. Антитела, находящиеся на поверхности эритроцитов, могут
быть как в статичном, так и в свободном состоянии в плазме крови. В
зависимости от состояния антител проводится прямая или непрямая реакция
Кумбса. Если есть основания для предположения, что антитела зафиксированы на
поверхности эритроцитов, проводится прямой тест Кумбса. В этом случае тест
проходит в один этап — добавляется антиглобулиновая сыворотка. Если на
поверхности эритроцитов присутствуют неполные антитела, происходит
агглютинация эритроцитов.
Непрямая реакция. Кумбса протекает в 2 этапа. Сначала необходимо
искусственно осуществить сенсибилизацию эритроцитов. Для этого эритроциты
и исследуемую сыворотку крови инкубируют, что вызывает фиксацию антител на
поверхности эритроцитов. После чего проводится второй этап теста Кумбса —
добавление антиглобулиновой сыворотки.
9.
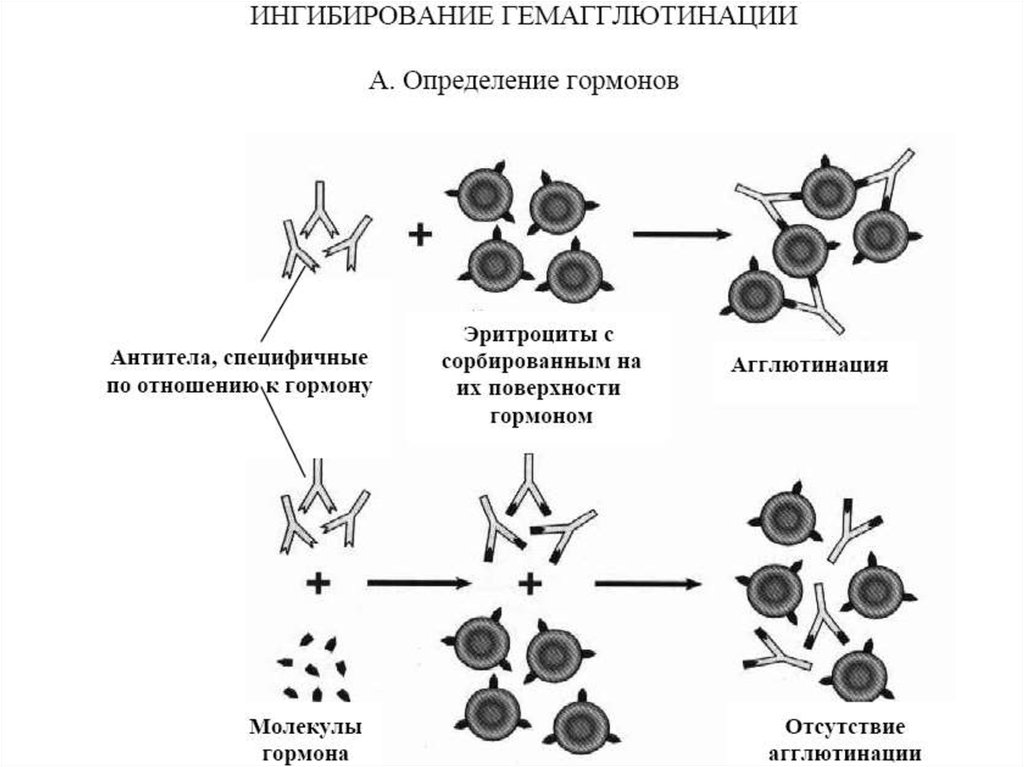
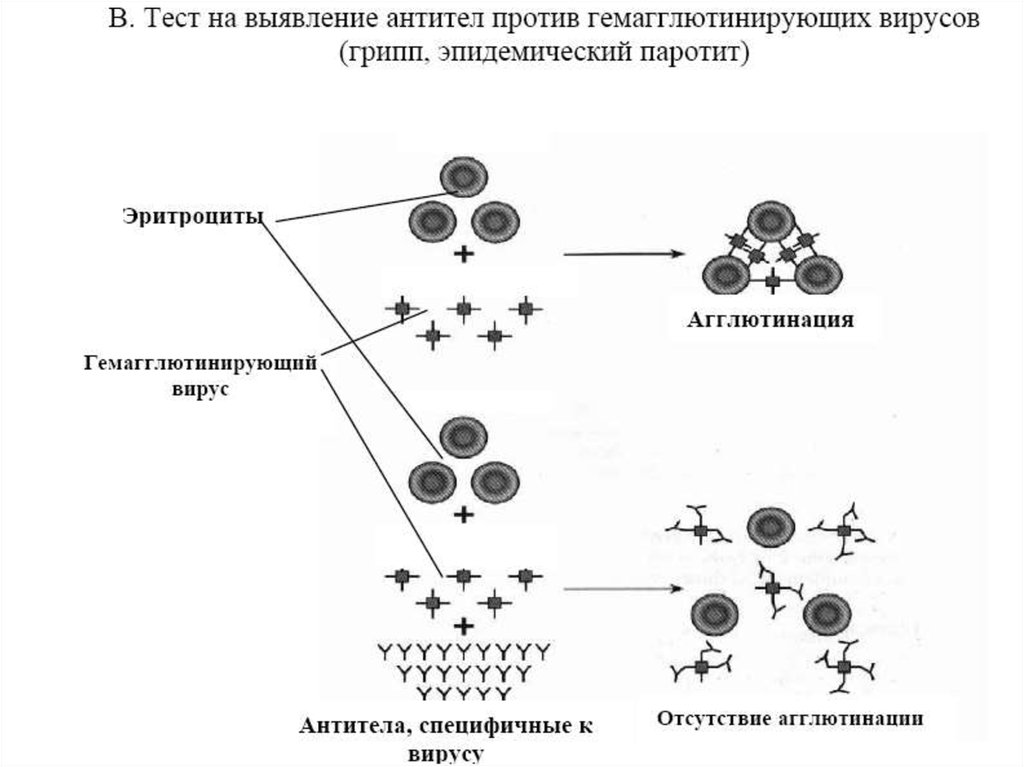
Гемагглютинацию можно использовать для выявления определенныхвозбудителей болезней и антител, вырабатываемых под их воздействием. В
первом случае ставится реакция прямой активной гемагглютинации. Например,
для выявления в анализируемой жидкости пара- и ортомиксовирусов ее
смешивают с 1 % суспензией отмытых физиологическим раствором куриных
эритроцитов. Их агглютинация будет свидетельствовать о наличии вируса. Такая
реакция фактически не относится к реакциям с применением антител, поскольку
здесь собственно вирусы являются агглютинирующим фактором. Во втором
случае используется торможение (ингибирование) геамагглютинации. Для ее
постановки в систему прямой гемагглютинации, содержащую конкретный
гемагглютинирующий вирус и куриные эритроциты, вносят анализируемую
сыворотку.
10.
11.
12.
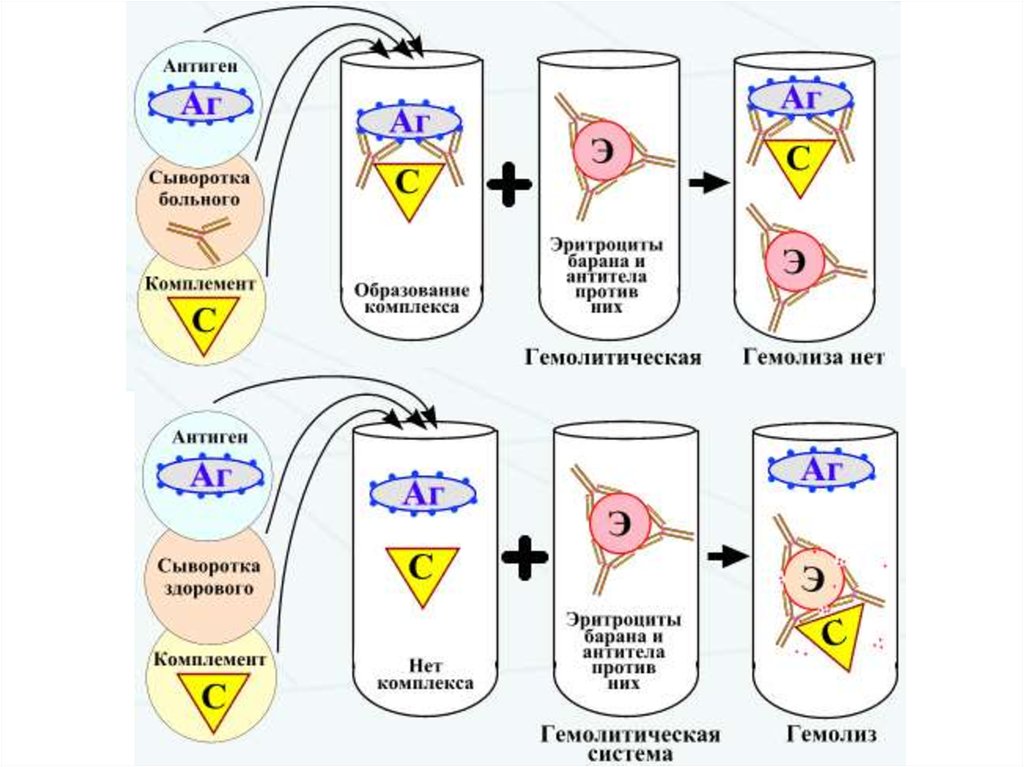
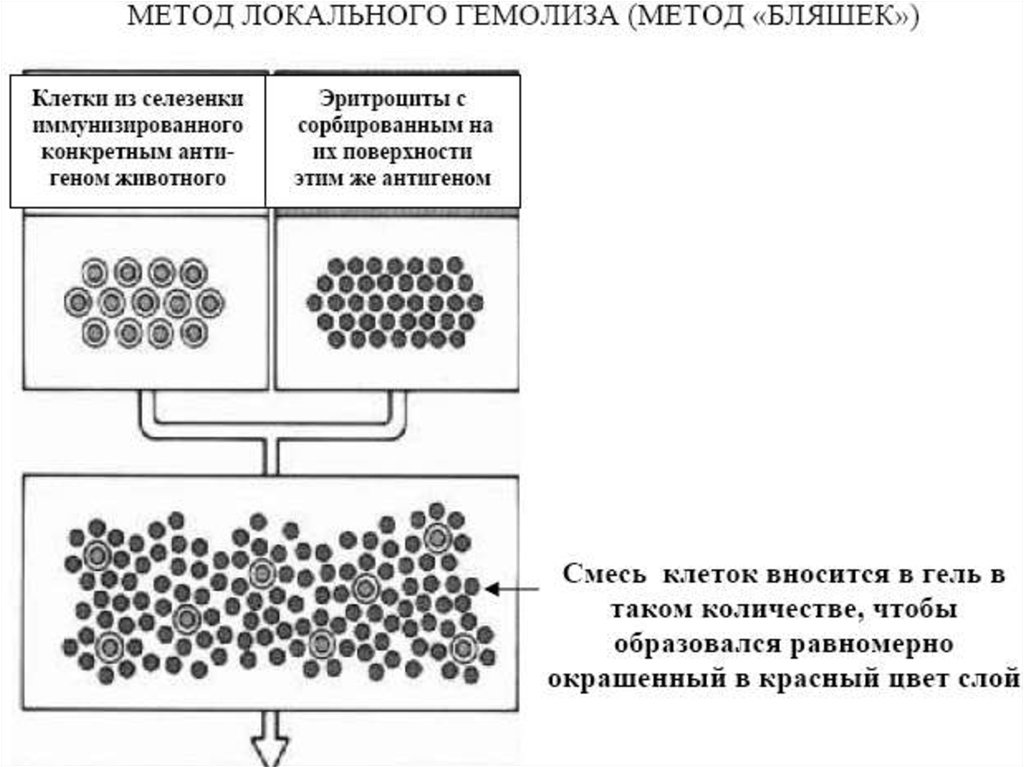
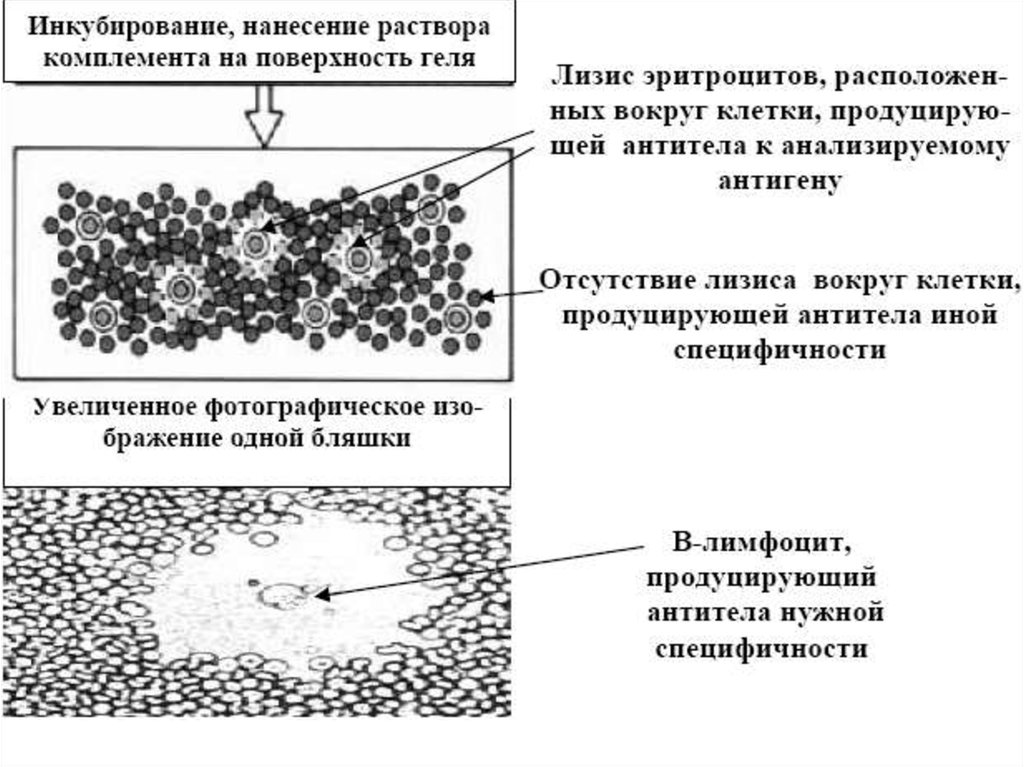
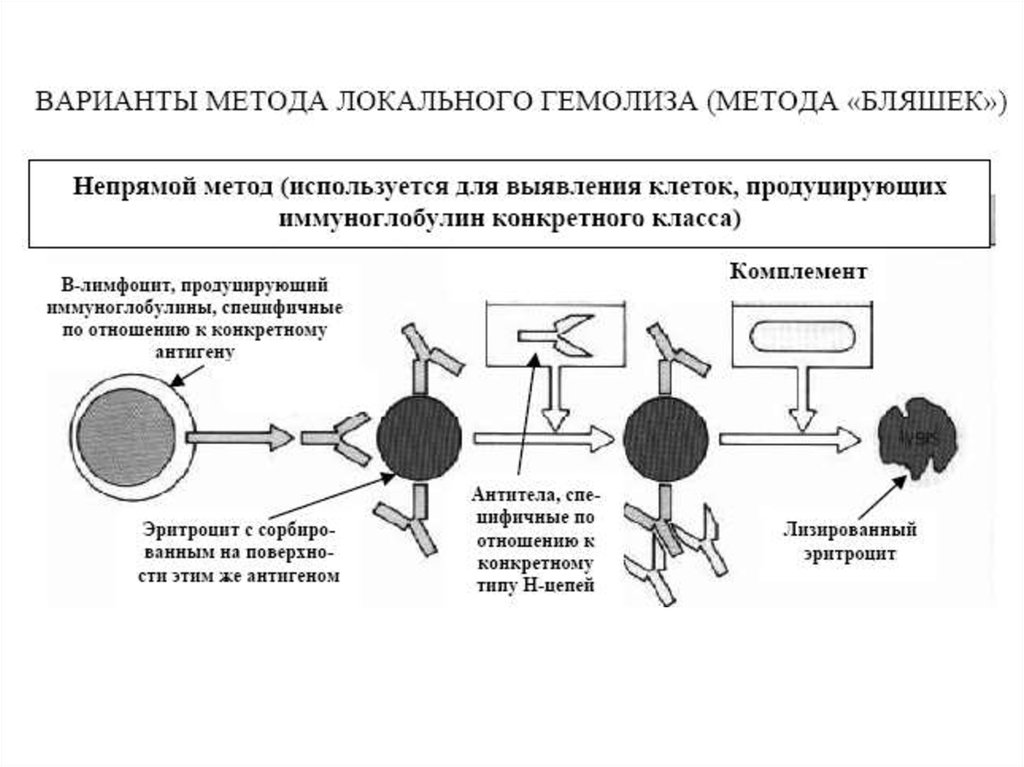
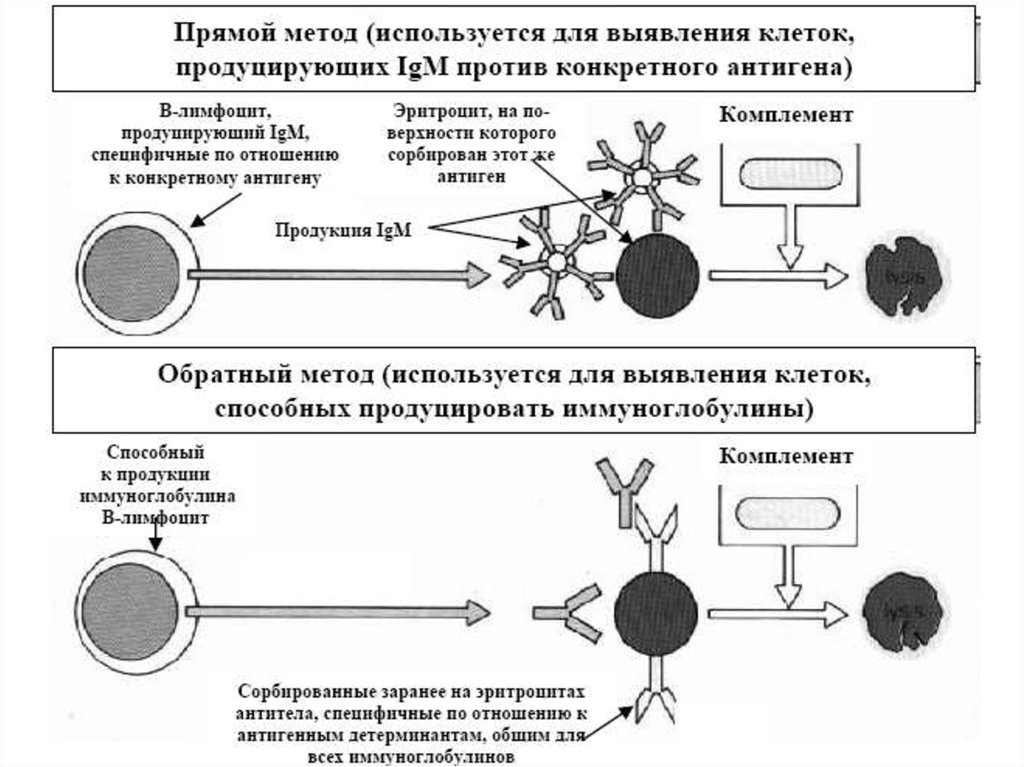
Реакция связывания комплемента (РСК)Реакция связывания комплемента (РСК) заключается в том, что при соответствии
друг другу антигенов и антител они образуют иммунный комплекс, к которому
через Fc-фрагмент антител присоединяется комплемент (С), т.е. происходит
связывание комплемента комплексом антиген - антитело. Если же комплекс
антиген - антитело не образуется, то комплемент остается свободным. PCK
проводят в две фазы 1-я фаза - инкубация смеси, содержащей антиген + антитело
+ комплемент, 2-я фаза (индикаторная) - выявление в смеси свободного
комплемента путем добавления к ней гемолитической системы, состоящей из
эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В
1-й фазе реакции при образовании комплекса антиген - антитело происходит
связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных
антителами эритроцитов не произойдет (реакция положительная). Если антиген и
антитело не соответствуют друг другу (в исследуемом образце нет антигена или
антитела), комплемент остается свободным и во 2-й фазе присоединится к
комплексу эритроцит - антиэритроцитарное антитело, вызывая гемолиз (реакция
отрицательная).
13.
14.
15.
16.
17.
18.
19.
Реакции нейтрализации.Эта группа реакций была введена в практику одной из первых, еще в конце XIX
века, но до сих пор не утратила своей актуальности. С помощью реакций
нейтрализации можно выявлять наличие антител и оценивать эффект их
действия, а также идентифицировать микроорганизмы или их факторы
патогенности. Особенностью реакций этой группы является использование для
визуализации результатов взаимодействия антиген-антитело живых тест-систем.
Под этим термином понимают целостный организм взрослого животного,
куриные эмбрионы, поддерживаемые в культуре клетки животных или человека.
Выбор тест-системы определяется, прежде всего, свойствами антигенов, которые
используются в конкретной реакции.
20.
Реакции нейтрализации могут быть использованы для идентификациипатогенных микроорганизмов и определения их количества в анализируемых
пробах. В этом случае необходимо наличие антисывороток или суспензий
моноклональных антител, специфичных по отношению к конкретным видам или
штаммам. Испытываемую жидкость смешивают с антителами, выдерживают
необходимое для взаимодействия антиген-антитело время, и вводят в живую тестсистему. В качестве контроля используют введение в такую же тест-систему
смеси нормальной сыворотки и анализируемой пробы. Сравнивая состояние тестсистем в опыте и контроле, делают вывод о наличии или отсутствии
нейтрализации и, соответственно, о видовой или штаммовой принадлежности
патогена. Для некоторых микроорганизмов, в частности, болезнетворных
вирусов, реакции нейтрализации до сих пор являются фактически единственным
методом их идентификации.
Практически такой же метод может быть использован для оценки иммунного
ответа организма на присутствие возбудителя, но в этом случае используются
стандартные штаммы микроорганизмов и сыворотки крови пациента или
иммунизированного животного.
21.
По сходному принципу осуществляются и реакции, позволяющие исследовать немикроорганизмы, а их токсины и обладающие антитоксическим действием
антитела (антитоксины). В таких реакциях различают варианты in vitro и in vivo.
Первый практически не отличается от реакций, описанных выше, а при втором
используют в качестве опытной тест-системы иммунизированных таким
токсином животных и в качестве контрольной - интактных животных.
Фактически тесты на определение уровня антитоксического иммунитета у людей
(проба Дика при скарлатине или реакция Шика при дифтерии) также являются
вариантом реакции нейтрализации токсинов in vivo.
Если реакции проводятся как количественные (т. е. с соблюдением упомянутых
выше правил), то результатом их будет индекс нейтрализации.
К реакциям нейтрализации относят и такие, в которых исследуются факторы
патогенности бактерий, являющиеся не токсинами, а ферментами (лецитиназами,
гиалорунидазами, коллагеназами и др.) или специфичные по отношению к ним
антитела. Отличительной чертой этой группы реакций нейтрализации является
то, что в них не используются живые тест-системы, а для визуализации
результатов взаимодействия антиген-антитело достаточно проверки воздействия
фермента на его субстрат.
22.
ИММУНОМАГНИТНАЯ СЕПАРАЦИЯНеобходимым условием проведения иммуномагнитной сепарации клетокмишеней из суспензии является наличие:
иммуномагниточувствительных микросфер (ИММС);
моноклональных антител (МКАТ);
магнитного сепаратора;
лабораторного оборудования, посуды и растворов.
Магниточувствительные микросферы
Магниточувствительные микросферы (ММС) являются суперпарамагнитными
монодисперсными полимерными частицами. Они содержат в своей структуре
равномерно распределенный по объему магнитный материал, который под
действием внешнего магнитного поля приобретает собственый магнитный
момент (намагничивается до насыщения). Полимер тонким слоем покрывает
частицы магнетита и определяет поверхностные характеристики микросфер
(форму, размер). Микросферы являются твердофазными носителями МКАТ. Они
конъюгированы с панелью моно- поликлональных антител, обладающих
специфической иммунологической восприимчивостью к определенным клеткам в
зависимости от наличия на их поверхности типа кластеров дифференцировки —
CD. Это дает возможность образовывать комплексы микросферы — клетка
(КМК) посредством связи антиген-антитело, а наличие включения в них
магнетита позволяет быстро и избирательно выделять КМК с помощью
магнитного сепаратора.
23.
Различают:Первичнопокрытые ММС (ПММС). Готовы к использованию и добавляются
непосредственно к клеточной суспензии. Они могут быть покрыты первичными
МКАТ, которые прямо посажены на поверхность микросферы, или через
вторичные антитела, специфические к первичным.
Вторичнопокрытые ММС (ВММС). Различные мышиные, крысиные или
кроличьи поликлональные или моноклональные антитела, которые могут быть
использованы в клеточной сепарации после инкубации их с ВММС.
Непокрытые активированные ММС (АММС). На АММС перед экспериментом
могут быть посажены специфические поли- или моноклональные антитела и
лиганды.
Типы иммуномагнитной сепарации.
Прямой метод — при котором магнитные микросферы, первично покрытые
МКАТ, добавляют непосредственно к суспензии клеток. В процессе инкубации
образуются комплексы ИММС с клетками-мишенями. Эти комплексы могут быть
удалены из суспензии с помощью магнитного сепаратора.
Непрямой метод — при этом методе клетки-мишени метятся первичными MKT,
которые добавляют к суспензии клеток. После периода инкубации свободные
несвязавшиеся МКАТ отмывают центрифугированием и только затем к этой
суспензии клеток добавляют магнитные микросферы, покрытые вторичными
моно- или поликлональными антителами.
24.
В процессе инкубации ВММС связываются с клетками, меченными первичнымиМКАТ. Эти комплексы также могут быть удалены с помощью магнитного
сепаратора. Таким образом, прямой метод более экономичен по использованию
количества МКАТ и времени для проведения полной сепарации, однако непрямой
метод более эффективен при одновременном выделении нескольких клетокмишеней из суспензии.
Позитивная сепарация — выделение и концентрация интересующих клеток из
исследуемого объекта. Она используется обычно в прямом методе и позволяет
выделять клетки с высокой степенью очистки.
Негативная сепарация — метод, с помощью которого клеточная популяция
очищается путем удаления всех других типов клеток из исследуемого материала.
Негативная изоляция может быть проведена как прямым, так и непрямым
методом.
Достоинства метода
•Высокий уровень корреляции с проточной цитометрией
•Высокая чувствительность: 10-20 клеток на мкл
•Экономичность, нет необходимости в дорогостоящем оборудовании
•Абсолютный счет, нет необходимости в определении формулы крови
•Нет необходимости в калибровке, возможность исследования единичных образцов
•Хорошая внутрилабораторная и межлабораторная воспроизводимость результатов
•Время анализа: 45-60 минут
•Готовые к использованию реагенты
•Легкость в освоении
25.
26.
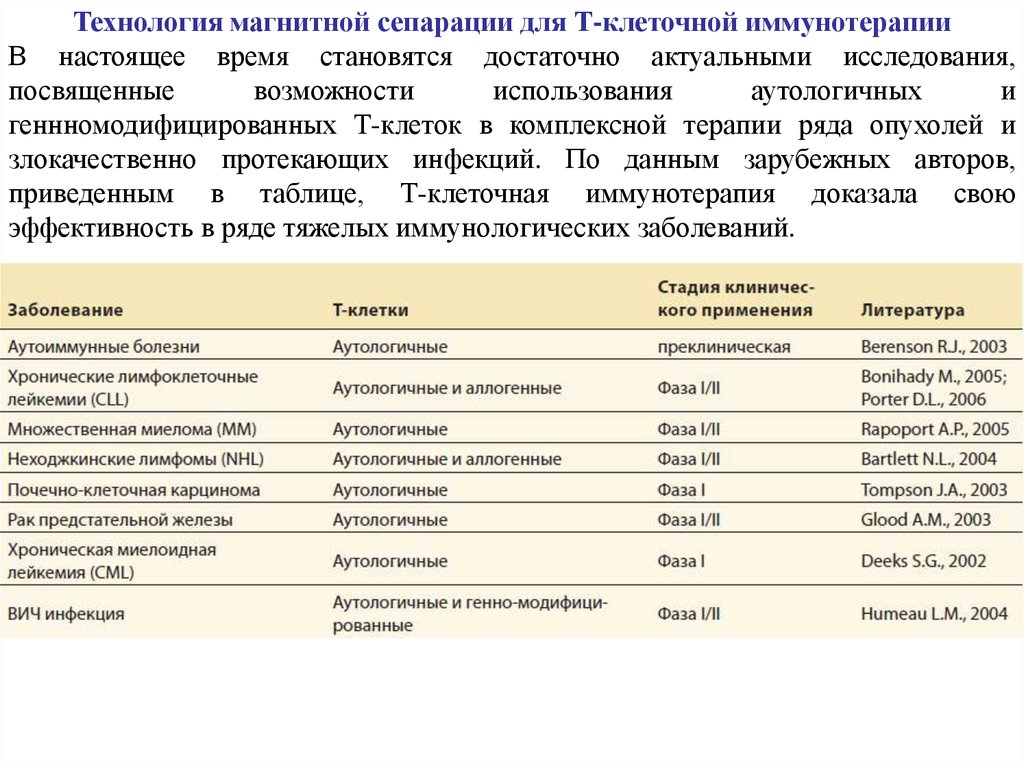
Технология магнитной сепарации для Т-клеточной иммунотерапииВ настоящее время становятся достаточно актуальными исследования,
посвященные
возможности
использования
аутологичных
и
геннномодифицированных Т-клеток в комплексной терапии ряда опухолей и
злокачественно протекающих инфекций. По данным зарубежных авторов,
приведенным в таблице, Т-клеточная иммунотерапия доказала свою
эффективность в ряде тяжелых иммунологических заболеваний.
27.
Для выделения специфичной Т-клеточной популяции и ее пролиферации традиционноиспользовали
достаточно
длительную
процедуру
концентрации
и
культивирования Т-клеток в сочетании с антигенной стимуляцией. Благодаря развитию
технологии иммуномагнитной сепарации сегодня появился новый методологический
подход к получению Т-клеток с целью их пролиферации и генетической модификации для
Т-клеточной иммунотерапии. В системе in vivo распознавание антигена и активация Тклетки происходит посредством поверхностных рецепторов CD3 и CD28.
Технология иммуномагнитной активации Dynal основана на использовании
специальных парамагнитных частиц Dynabeads ClinExVivo CD3/CD28, при
контакте с которыми T-лимфоциты получают сигнал к активации и
пролиферации. Для обеспечения стерильных условий выделения и
культивирования вся процедура осуществляется на базе специализированной
магнитной установки Dynal ClinExVivo МРС.
28.
Цельную кровь, костный мозг или лимфоцитарную суспензию помешают на
стойке для первичного биоматериала. Затем добавляют реагент Dynabeads
ClinExVivo CD3/CD28
Смесь инкубируют при постоянном перемешивании 30 мин.
Образовавшиеся Dynabeads-клеточные комплексы фиксируются на основной
магнитной платформе DynalClinExVivo МРС; не связавшаяся с частицами фракция
переносится во вторичный мешок для сбора супернатанта.
В мешок, содержащий связанные с частицами клетки, добавляют культуральную
среду. Целевые клетки переносят в культуральный бокс для Т-клеточной пролиферации.




















 medicine
medicine








