Similar presentations:
Вольфрам және молибден
1. Вольфрам және молибден
Орындаған: Амангелді АҒазизова Сабина
Мақаева Нұрсая
2. Молибденнің ашылу тарихы
«молибден» атауы грек тіліндегі«молибдос»сөзінен шығады,
аудармасы қорғасын дегенді
білдіреді..
1778 г.
К. В. Шееле ашқан жаңа элемент –
молибден.
Молибденитті азот қышқылысмен әрекеттестіре отырып, молибден
қышқылын,үштотықты және молибден тұзын алды.Р
1782 г. П. Гельем көмірмен үштотықты молибденді
тотықсыздандыра отырып, молибден ұнтағын алды.
Таза металлды үштотықты молибденді сутекпен тотықсыздандырып
1817 г. И. Берцелиус алды.
3. Вольфрамның ашылу тарихы
1781 ж. Шееле, шеелитминералын зерттей
отырып, кальций мен белгісіз қышқылмен
қосылысын анықтады. (қазір ол вольфраматты
деп аталады).
1783 жылы осы қышқылды ағайынды д'Элуяр
вольфрамның басқа минералынан анықтады.
Вольфрамиттен осы қышқылды ала отырып,
ағайындылар оттек көмегімен жаңа элементті таза
металл күйінде бөліп алды. Аналог ретінде
вольфрам деп аталынды.
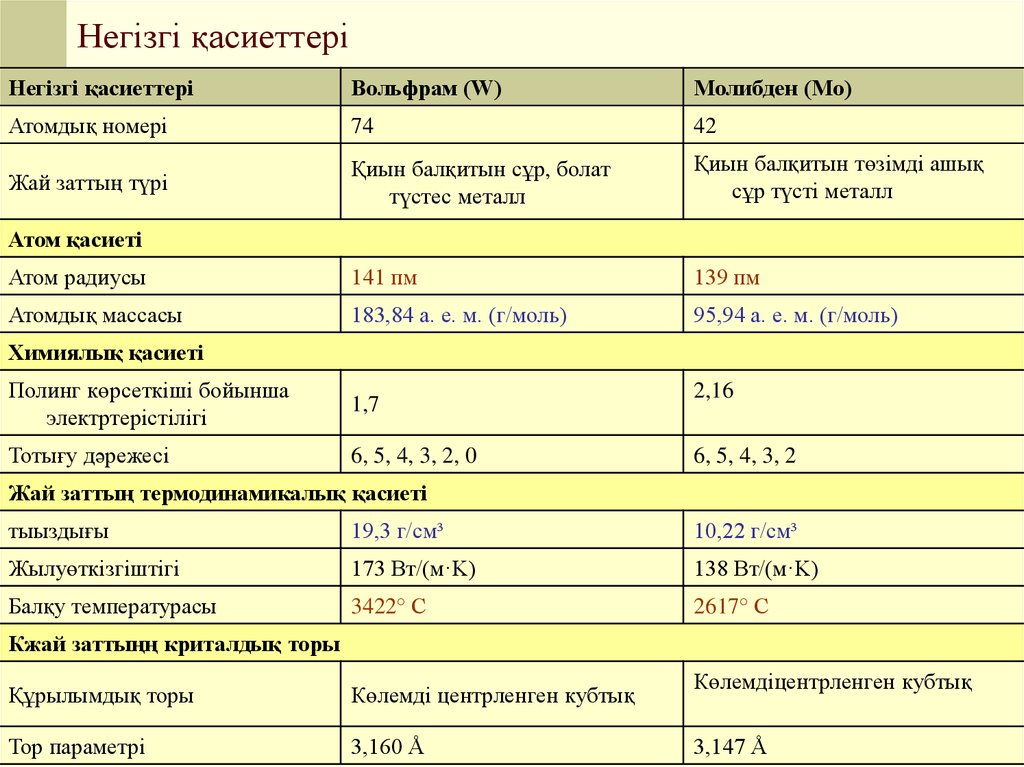
4. Негізгі қасиеттері
Негізгі қасиеттеріВольфрам (W)
Молибден (Mo)
Атомдық номері
74
42
Жай заттың түрі
Қиын балқитын сұр, болат
түстес металл
Қиын балқитын төзімді ашық
сұр түсті металл
Атом радиусы
141 пм
139 пм
Атомдық массасы
183,84 а. е. м. (г/моль)
95,94 а. е. м. (г/моль)
Атом қасиеті
Химиялық қасиеті
Полинг көрсеткіші бойынша
электртерістілігі
1,7
Тотығу дәрежесі
6, 5, 4, 3, 2, 0
2,16
6, 5, 4, 3, 2
Жай заттың термодинамикалық қасиеті
тыыздығы
19,3 г/см³
10,22 г/см³
Жылуөткізгіштігі
173 Вт/(м·K)
138 Вт/(м·K)
Балқу температурасы
3422° С
2617° С
Кжай заттыңң криталдық торы
Құрылымдық торы
Көлемді центрленген кубтық
Тор параметрі
3,160 Å
Көлемдіцентрленген кубтық
3,147 Å
5. Молибденнің негізгі қасиеттері
Ауада қалыпты температура кезінде молибден тұрақты. 400 °Стемпературада тотығады. 600 °С бастап, молибден MoO3 түзе тотығады..
700 °С сулы буы MoO2 дейін тотығады.
Температура жоарылатқан кезде молибден селенмен, күкіртпен, азотпен,
оттекпен, сынаппен, сондай-ақ металл емес элементтермен әрекеттеседі.
80—100 °С молибден тұз және күкірт қышқылында ериді. Азот
қышқылында, патша сұйығында және сутектің асқын тотыында қыздыран
кезде ериді. Ең жақсы еріткіш ретінде азот пен күкірт қышқылының
қоспасы болып табылады.
6. Вольфрамның негізгі қасиеттері
Қалыпты кезде вольфрам химиялық тұрақты.400—500°С WO3-ке дейін тотығады..
600°С су буы WO2 дейін тотығады..
Галогендер, күкірт, оттек, кремний, бор жоғары температурада
әрекеттеседі.
Қалыпты жадайда вольфрам тұз, күкірт, азот және ерітһген (HF)
қышқылдарынды, және патша сұйығында ериді.
Азот қышқылында тез ериді.
Вольфрам қосылыстары 2 және 6 валенттіліті көрсетеді, жоғары
валенттілік көрсететін қосылыстары тұрақты.
7. Вольфрам химиялық қасиеті
2 және 6 валентті болады.Соның ішіндегі ең тұрақтысы 6 валенттілігі. 3және 2 валентті вольфрам валенттігі тұрақсыз және де теориялық түрде
маңызды емес.
Сұйылтылған азот қышқылында
оңай ериді.
Вольфраматтар оңай әрі тез
полимерлі анион түзеді.
Ең қатты маңыздылары: үшоксидті
вольфрам және вольфрам ангидриді,
вольфраматтар.
8. Сутекпен әрекеттесуі
Балқу температурасына дейінәрекеттеспейді
Азотпен әрекеттесуі
t > 2000 0С вольфрама нитридін WN2
түзеді
8
9. Оттекпен және оттекті қосылыстармен әрекеттесуі
t =1000 -1200 оС әрекеттеседіWC және W2C түзеді
9
10. Галогенидтермен
Фтормен бөлметемпературасында
Хлормен t = 800 0С
Күкіртпен t > 400 0С
Химические свойства вольфрама
10
11. Қышқылдармен әрекеттесуі
НF мен HNO3 қоспасындажақсы ериді
азот қышқылы мен патша
сұйығында тез ериді
11
12. Сілтілермен
Сілті ерітіндісінде ерімейдіБалқытылған сілтілерде
әрекеттеседі
12
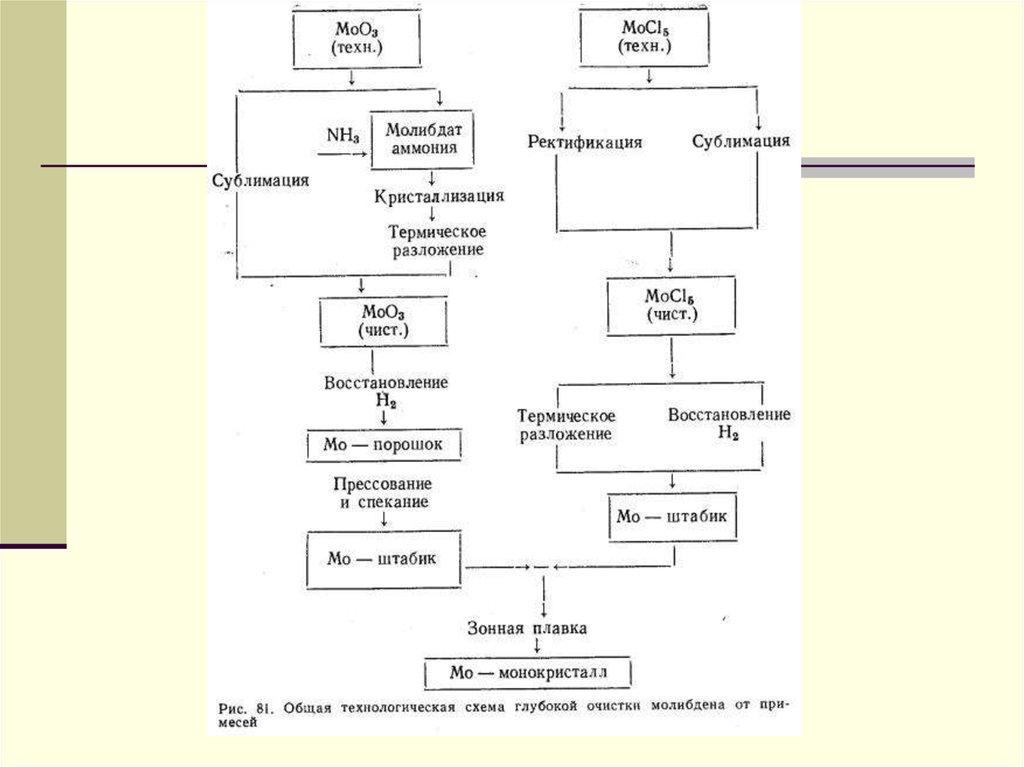
13. Молибденді бөліп алу әдістері
1. Экстракция2. храмотография
3. сорбция
4. тұндыру
14.
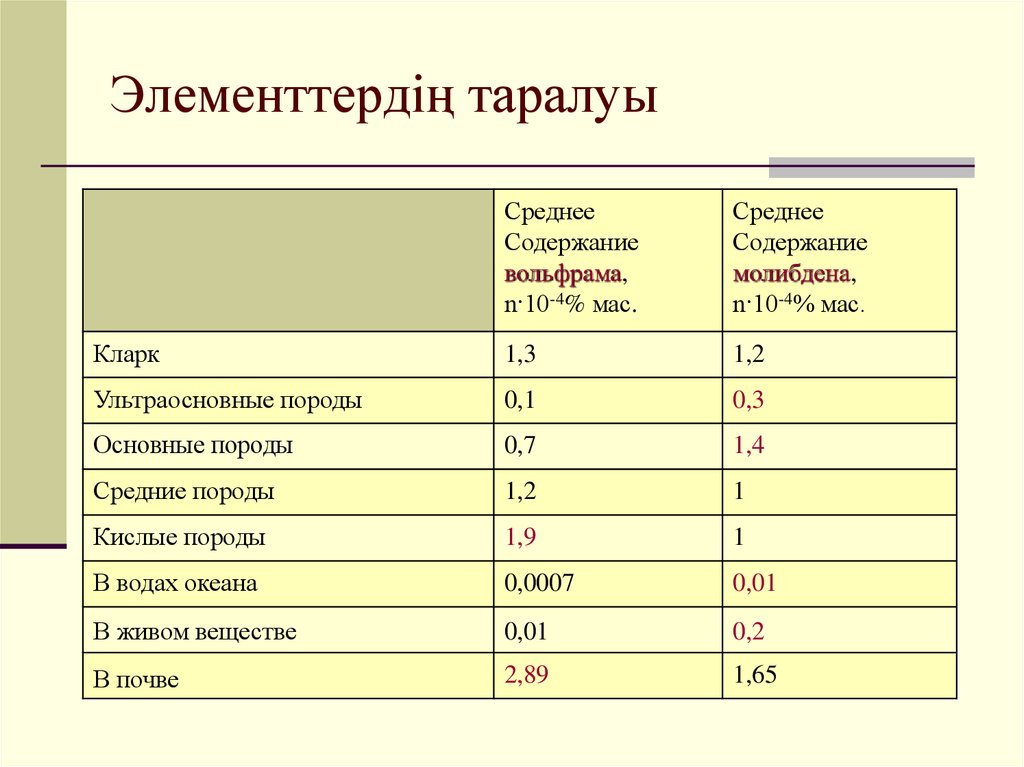
15. Элементтердің таралуы
СреднееСодержание
вольфрама,
n·10-4% мас.
Среднее
Содержание
молибдена,
n·10-4% мас.
Кларк
1,3
1,2
Ультраосновные породы
0,1
0,3
Основные породы
0,7
1,4
Средние породы
1,2
1
Кислые породы
1,9
1
В водах океана
0,0007
0,01
В живом веществе
0,01
0,2
В почве
2,89
1,65
16. Молибденнің минералдары
Молибденнің 20-дан астам минералы белгілі . Ең көпкездесетіндері:
- молибденит МоS2;
- повеллит СаМоO4;
- молибдит (ферримолибдит) Fе2(МоO4)3· nН2O;
- вульфенит PbМо04;
- молибдо-шеелит Са(W,Мо)O4;
- чиллагит Рb(Мо,W)04;
- кёхлинит Вi2(Мо04)02;
- линдгренит Сu3(МоO4)2(ОН)2;
- ильземанит МоO3·SO3·5Н2O;
- ураномолибдат UO2·UO3·2МоO3 и др.
Бастапқы төрт минерал өндірісте орасан зор рөл
алады.
17.
11)Вульфенит PbМо04
2)Молибденит МоS2
3)Повеллит СаМо04
3
2
18. Вольфрама минералдары
20 түрлы минералы бар. Ең көп кездесетін минералывольфрамитті топтары MnWO4 – FeWO4 және шеелит
CaWO4, өндірістік мағынасы бар.
Көп кездесетін вольфрам сульфиді - тунгстенит WS2,
және қышқылды қосылысының бірі- тунгстит, феррожәне купротунгстит, гидротунгстит..
Экзогенді ортада вульфенит топтары : штольцит βРbWO4 түзсе, изоструктуралық шеелитпен және оның
моноклинді түрі - распит - αРbWO4.
19.
12
1)Вольфрамит
MnWO4 – FeWO4
2)Шеелит CaWO4
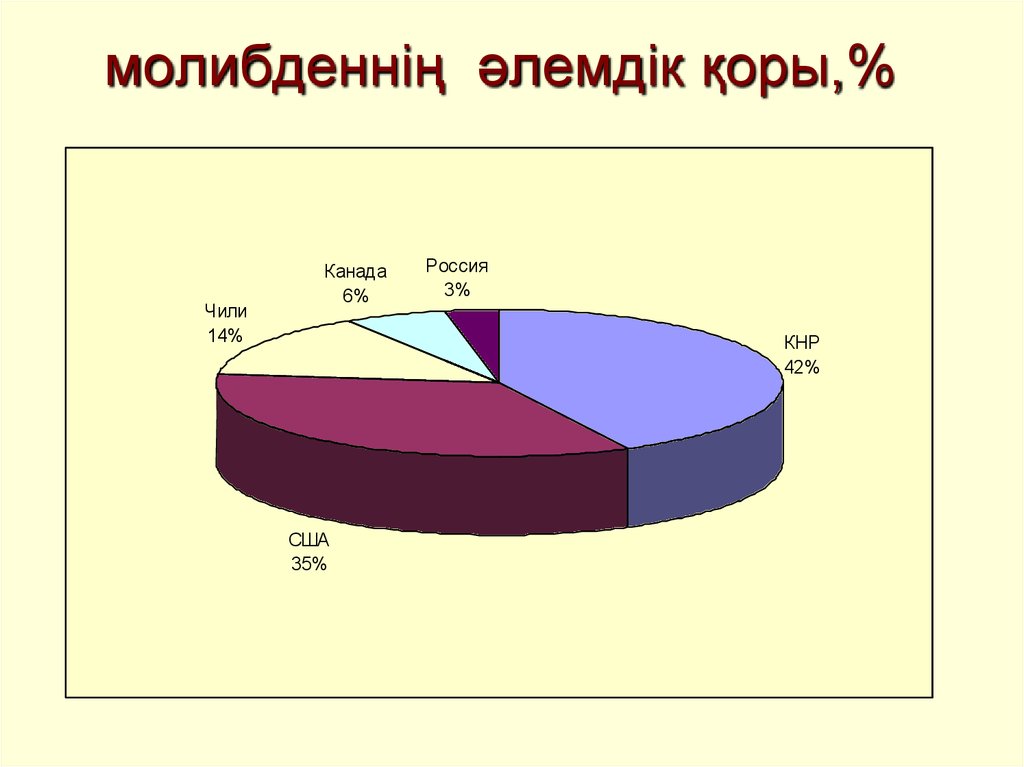
20. молибденнің әлемдік қоры,%
Чили14%
Канада
6%
Россия
3%
КНР
42%
США
35%
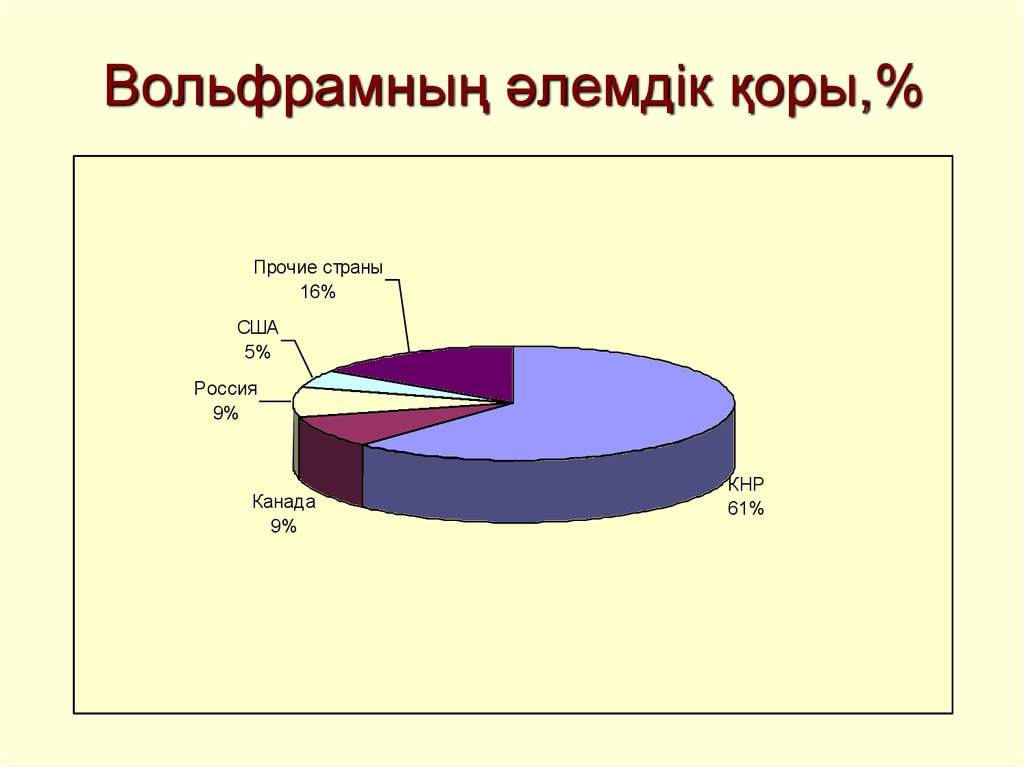
21. Вольфрамның әлемдік қоры,%
Прочие страны16%
США
5%
Россия
9%
Канада
9%
КНР
61%
22. Молибденнің қолдану аясы
АвтомобильАвиация
Инструменттер және бөлшектер
Өндірісте
Металлдық молибден
электрлік лампа
Радиоламп
Рентгендік түтікше
Электрлік пеште қолданылатын проволка.
Молибден қосылыстары — сульфидтер, оксидтер,
молибдаттар — катализатор ретінде , бояғышар
пигменттері ретінде.
Тез еритін молибден қосылыстары жер өңдеуге
қолданылады.
23. Вольфрамның қолдану аясы
Металдық вольфрам электролампаларда қолданылатын электрлікжіпше, сваркада электрод ретінде, электрпештерінде қыздырыш
ретінде 3000 ° С, термопар, ротор ретінде , рентгендік түтікше
,электровакуумды аппаратурада, радиоприборда, шаш түзегіш және
гальвонометрде.
Бояғыш ретінде, электротхникада.
24. Қоланылан әдебиеттер тізімі
Иванов В.В. Экологическая геохимия элементов: Справочник: В6 кн./ Под ред. Э.К. Буренкова. – М.: Экология, 1997. - Кн.5:
Редкие d-элементы. - 576с.:илл.
Зеликман А.Н. Молибден – М.: Металлургия, 1970,440с.
Чернов Б.С., Белов С.В., Бронницкая Л.С. и др. Минеральное
сырье. Вольфрам// Справочник. – М.: ЗАО "Геоинформмарк",
1998. - 37 с.
Перельман А.И. Геохимия – М.: Высш. шк.,1989. - 528 с.:илл.
Покалов В.Т. Минеральное сырье. Молибден// Справочник. –
М.: ЗАО Теоинформмарк", 1997. - 44 с.
Douglas G. Brookins Eh-pH Diagrams for Geochemistry – SpringerVerlag, 1998.
http://www.mineral.ru



















 chemistry
chemistry