Similar presentations:
Водородный электрод
1. Водородный электрод
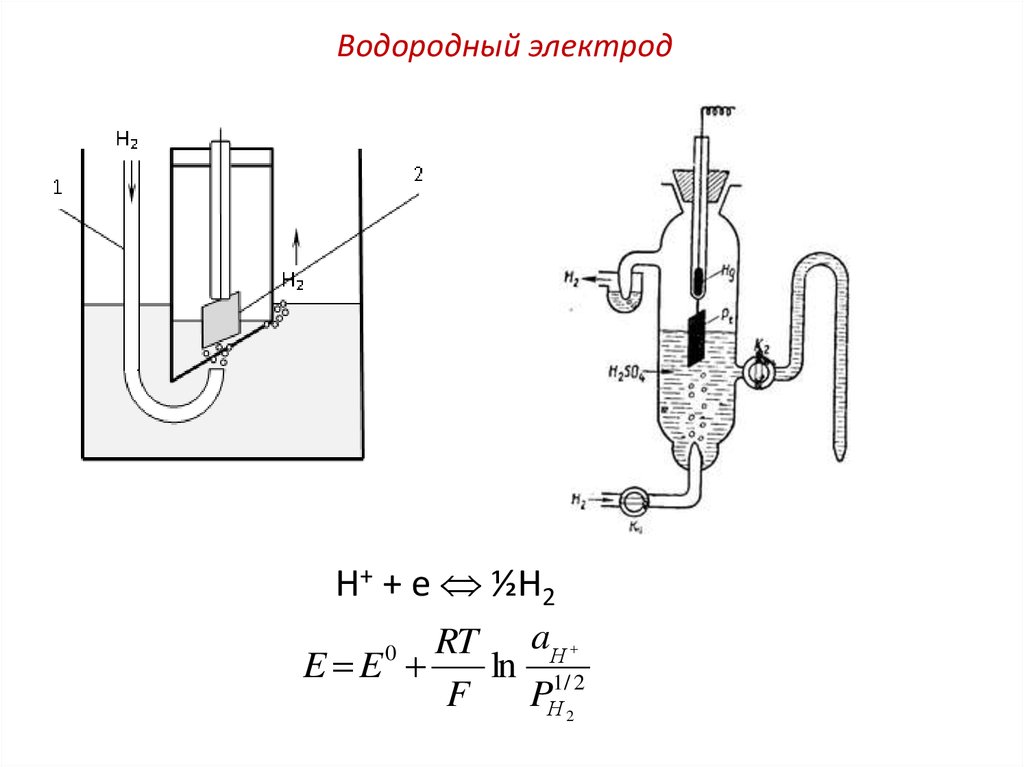
Схема устройства водородногоэлектрода
Стандартный водородный электрод — электрод,
использующийся в качестве электрода сравнения при различных
электрохимических измерениях и в гальванических элементах.
Водородный электрод (ВЭ) представляет собой стеклянный
сосуд с двумя трубками для пропускания водорода и трубкой,
служащей электролитическим ключом для соединения с другим
электродом (с помощью крана К2). Сосуд заполнен 2-н. раствором
Н2SO4. Сверху он закрывается пришлифованной пробкой, в
которую вставлена стеклянная трубка с впаянной на конце
платиновой пластинкой. Для обеспечения контакта трубку
заливают ртутью. Перед употреблением платину обязательно
платинируют т.е покрывают слоем платиной черни. Для
насыщения платинированной платины водородом через сосуд в
течении 20 – 30 мин пропускается тщательно очищенный водород
со скоростью 2 - 3 пузырька в секунду.
+ Между адсорбированным на платинированном
платиновом электроде
2 газообразным водородом и Н-ионами в
растворе устанавливается равновесие:
+
0
НH 2↔2H +2e
1/ 2
Н2
Н + е ½Н
RT a
E E
ln
F
P
2. Хингидронный и сурьмяный электроды
3.
Стандартные электродные потенциалы и ихпрактическое значение
Стандартный потенциал электрода E0 – это ЭДС
системы, составленной из этого электрода в стандартных
условиях (aox = ared = 1, t = 25 °C) и стандартного водородного
электрода.
Стандартный потенциал зависит от природы электрода и
природы растворителя.
Стандартные потенциалы в водородной шкале для многих
электродов сведены в таблицы и широко используются в
электрохимии.
Использование таблицы стандартных потенциалов:
1) Для расчета равновесного потенциала по уравнению
Нернста.
RT
E
0
,
76
ln a 2
Например, для цинкового электрода:
Zn
р
2F
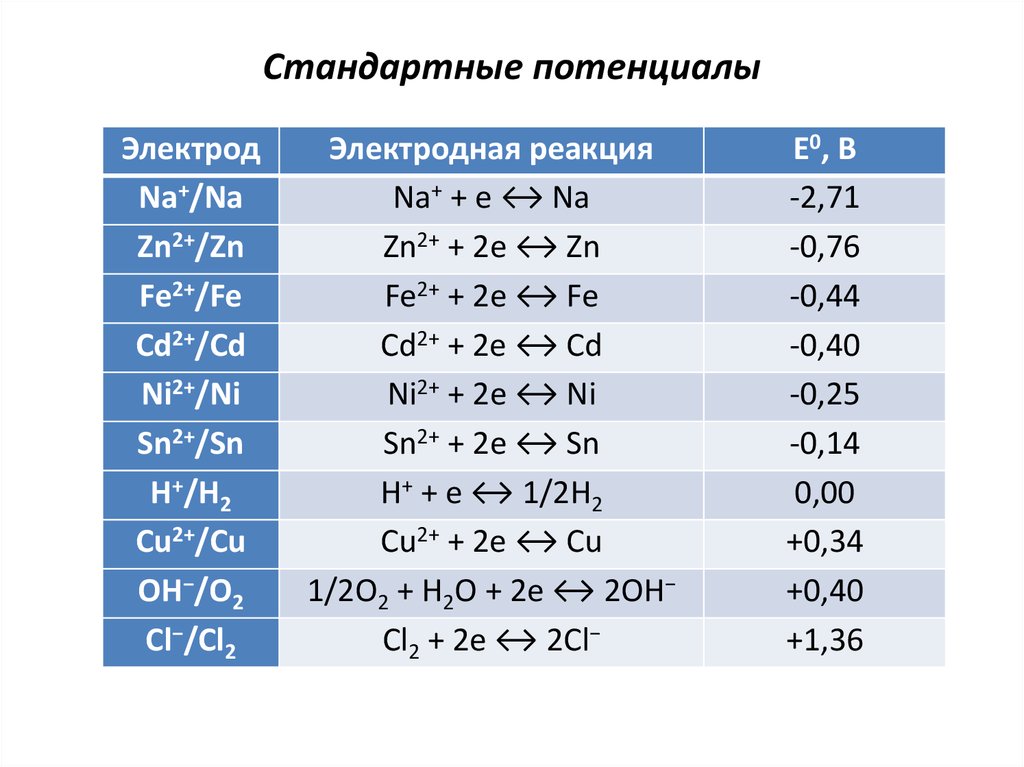
4. Стандартные потенциалы
ЭлектродNa+/Na
Zn2+/Zn
Fe2+/Fe
Cd2+/Cd
Ni2+/Ni
Sn2+/Sn
H+/H2
Cu2+/Cu
OH−/O2
Cl−/Cl2
Электродная реакция
Na+ + e ↔ Na
Zn2+ + 2e ↔ Zn
Fe2+ + 2e ↔ Fe
Cd2+ + 2e ↔ Cd
Ni2+ + 2e ↔ Ni
Sn2+ + 2e ↔ Sn
H+ + e ↔ 1/2H2
Cu2+ + 2e ↔ Cu
1/2O2 + H2O + 2e ↔ 2OH−
Cl2 + 2e ↔ 2Cl−
Е0, В
-2,71
-0,76
-0,44
-0,40
-0,25
-0,14
0,00
+0,34
+0,40
+1,36
5.
2) Для правильной записи элементов и определениянаправления реакции в них.
Согласно Международной конвенции справа записывают
электрод с более положительным потенциалом, а слева – с
более отрицательным.
В качестве примера рассмотрим, систему, состоящую из
меди, цинка и растворов, содержащих их ионы:
Zn │ZnSO4║CuSO4│Cu.
0
ECu
2
Cu
0,34 B;
0
EZn
2
Zn
0,76 B;
Процессу окисления на левом электроде соответствует
реакция восстановления на правом.
Лев. эл.: Zn – 2e = Zn2+
Пр. эл.: Cu2++2e = Cu
Суммарное уравнение в элементе: Zn + Cu2+ = Zn2+ + Cu.
6.
3) Для определение константы равновесия.На примере той же системы: Zn │Zn2+║Cu2+│Cu рассчитаем
ее стандартную ЭДС:
0
E 0 ECu
2
0
E
Cu
Zn 2
Zn
0,34 0,76 1,1 B.
Константа равновесия суммарной реакции: Cu2+ + Zn = Cu + Zn2+
K равн
a
Zn 2
a
Cu 2
Тогда в соответствии с уравнением Е0 = RT/zF ln Kр.
0,059 aZn 2
1,1
lg
2
aCu 2
a
a
2, 2
Zn 2 10 0.059
1037
Cu 2
В условиях равновесия отношение концентраций ионов цинка и
меди в растворе должно быть равным 1037.
7.
Если взятые концентрации не равны равновесным, то вэлементе самопроизвольно пойдет процесс в сторону
достижения равновесных концентраций.
Следовательно, знание стандартных потенциалов позволяет
оценить те концентрации, до достижения которых один металл
будет вытеснять другой металл (или водород) из раствора его
ионов. В общем случае:
Z
( E20 E10 )
a M1
K p 1 10 0,059
a M2
2
Отношение равновесных концентраций тем больше, чем
больше разность стандартных потенциалов. Причем металл с
более отрицательным потенциалом будет вытеснять из раствора
металл с более положительным потенциалом и это вытеснение
тем полнее, чем дальше расположены друг от друга металлы в
таблице стандартных потенциалов.
8.
На этом свойстве основан контактный способ очисткирастворов путем цементации одного металла другим.
Например, промышленный раствор для электрорафинирования
никеля получается при анодном растворении чернового никеля
и содержит много ионов меди. Очистка от меди происходит
путем цементации ее железом – в раствор при перемешивании
засыпается железный порошок или крупка. Возникает
обменная реакция (цементации):
Fe + Cu2+ Cu + Fe2+
она пойдет до наступления равновесия, при котором
потенциалы соответствующих электродов становятся равными.
0,059
0,059
0,34
lg aCu 2 0.44
lg a Fe 2 ;
2
2
a 2
0,059 a Fe 2
2
lg
aCu 2
0,34 0,44 0,78 B;
Fe
10
2 0,78
0,059
1026.
a 2
Cu
Практически полная очистка раствора от ионов меди.
9.
Если металл находится в растворе, содержащем ионы этогометалла разной степени окисления, то, используя стандартные
потенциалы, можно рассчитать равновесные концентрации этих
z2
ионов.
a
z1
z2
z1
K равн Mz
z1M M z2 M
a 1 z
M
2
Например, для системы Cu2+,Cu+│Cu, где протекает реакция:
Сu2+ + Cu 2Cu+
a2
Cu
a
10
2
0,34 0,52
0,059
10 6.
Cu 2
Таким образом, если медь находится в равновесии с
раствором, содержащим ее ионы, концентрация ее
одновалентных ионов в 103 раз меньше, чем двухвалентных.
10.
Поскольку электрохимические реакции идут с заметнойскоростью при концентрациях не ниже 10-8 - 10-10 M,
применение
термодинамических
уравнений
к
электрохимическим реакциям имеет смысл в растворах с
концентрацией не ниже 10-6 M.
Расчет константы равновесия позволяет правильно выбрать
реактив для проведения титрования в аналитической химии.
Например, растворы солей олова (II) применяют для
количественного определения ионов Fe3+. В равновесном
состоянии, как это следует из стандартных потенциалов, почти
все растворенное железо будет присутствовать в форме Fe2+.
2
aFe
3 a
Sn2
a
2
Fe2
aSn4
10
2 ( 0 ,15 0 , 77 )
0 , 059
10
20, 7
11.
4) Для создания ХИТов с целью получения максимальновозможной ЭДС необходимо брать электроды как можно
дальше отстоящие друг от друга в таблице стандартных
потенциалов. Однако это не всегда возможно сделать, так как
не все электроды термодинамически устойчивы.








 chemistry
chemistry