Similar presentations:
Термодинамика поверхностных явлений. (Часть 2)
1. Термодинамика поверхностных явлений часть 2
Физическая и коллоидная химияТЕРМОДИНАМИКА
ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
ЧАСТЬ 2
1
2.
Адсорбция — увеличение концентрации вещества награнице раздела фаз.
лат. ad — на
sorbeo — поглощаю
Причина - избыток свободной поверхностной энергии
G.
В результате адсорбции вещества на границе раздела
фаз G уменьшается,
процесс адсорбции энергетически выгоден.
2
3.
Жидкость или твердое тело, на поверхности которыхпроисходит адсорбция - адсорбент.
Адсорбируемое вещество до адсорбции -адсорбтив,
уже адсорбированное — адсорбат.
адсорбтив
адсорбат
адсорбент
3
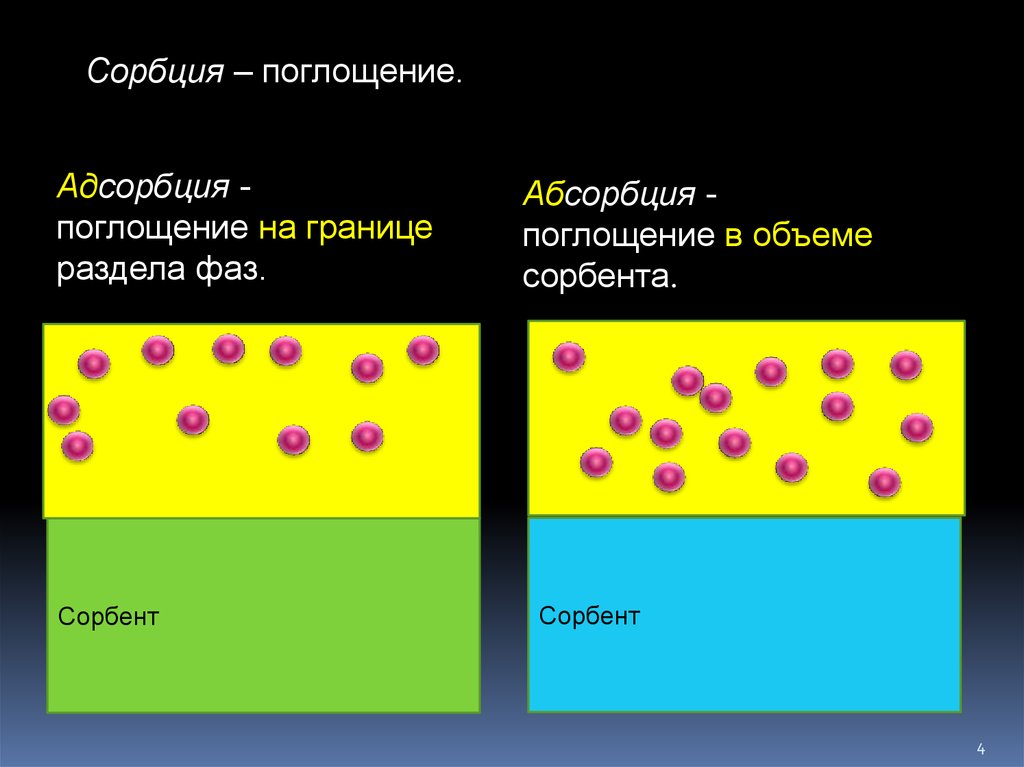
4.
Сорбция – поглощение.Адсорбция поглощение на границе
раздела фаз.
Сорбент
Абсорбция поглощение в объеме
сорбента.
Сорбент
4
5.
http://sci-humor.blogspot.com/2009/05/blogpost_25.html5
6.
Часть молекул с поверхности может перейти обратнов объем.
Процесс, обратный процессу адсорбции- десорбция.
При равенстве скорости адсорбции и десорбции адсорбционно-десорбционное равновесие.
адсорбция
десорбция
адсорбент
6
7. Количественное выражение адсорбции
Избыточная (Гиббсова) адсорбция Г (моль/м2) - избытокколичества вещества адсорбата на поверхности адсорбента
по сравнению с объемом фазы.
n n моль
Г S V 2
S м
или
nS nV моль
Г
m кг (удельная Г)
Абсолютная адсорбция a (моль/м2) - количество
вещества адсорбата на поверхности адсорбента
nS
a
S
моль
м2
или
nS
а
m
моль
кг
(удельная а)
Удельная адсорбция (моль/кг или моль/г) – адсорбция Г или а,
отнесенная не к единице площади, а к единице массы (для
пористых тел и порошков)
7
8.
Если nS >> nV , то Г ≈ аnV
nS
адсорбент
8
9.
Физическая адсорбцияобусловлена силами межмолекулярного
взаимодействия адсорбент — адсорбат.
Молекулы адсорбата сохраняют свою
индивидуальность.
Теплота физической адсорбции до 20 кДж/моль.
Физическая адсорбция обратима.
9
10.
Химическая адсорбция (хемосорбция)обусловлена химическим взаимодействием
адсорбент — адсорбат,
сопровождается образованием поверхностных
соединений.
Теплота хемосорбции более 80 кДж/моль
(активированная сорбция).
Хемосорбция, как правило, необратима.
10
11.
Изотерма адсорбции – зависимость величиныадсорбции от концентрации при постоянной
температуре.
а или Г
С, или P, или Р/РS
(для газов)
11
12.
Адсорбция на границе раздела «жидкость – газ»энергетически выгодна адсорбция тех веществ,
которые снижают σ
поверхностно-активные вещества (ПАВ),
снижают σ, адсорбируются самопроизвольно. Примеры :
мыло (смесь Na солей жирных карбоновых кислот —
олеата, стеарата и т. п.) и СМС (синтетические моющие
средства), спирты, карбоновые кислоты, амины и т. п.
поверхностно-инактивные (ПИВ или ПИАВ)
повышают σ, Примеры : водные растворы электролитов
(кислот, щелочей и солей).
поверхностно-неактивные (ПНВ)
не влияют на σ. Примеры: глюкоза и фруктоза.
12
13.
σГ
ПИВ
σо
1
ПАВ
Г∞
ПНВ
3
ПНВ
0
ПАВ
ПИВ
С
С
изотермы
пов. натяжения
изотермы
адсорбции
13
14.
Для ПАВ – низших гомологов алифатических кислот испиртов (до С7-С8)
эмпирическое уравнение Шишковского:
σ=σ0–Вln (1+Ac),
где А и В – эмпирические константы,
σ0– поверхностное натяжение чистого растворителя.
А возрастает в 3-3,5 раза при переходе к каждому
следующему гомологу и характеризует относительную
адсорбционную активность члена ряда.
Константа В постоянна для гомологического ряда:
B=RTГ∞.
14
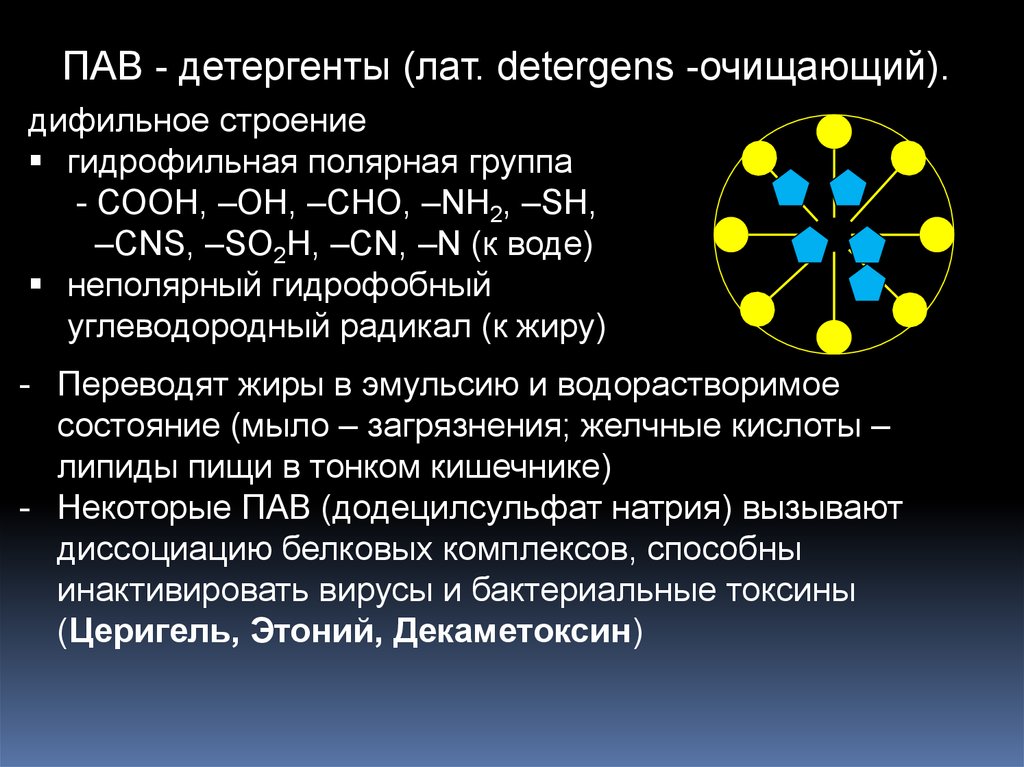
15.
ПАВ - детергенты (лат. detergens -очищающий).дифильное строение
гидрофильная полярная группа
- СООН, –ОН, –СНО, –NH2, –SH,
–CNS, –SO2H, –CN, –N (к воде)
неполярный гидрофобный
углеводородный радикал (к жиру)
- Переводят жиры в эмульсию и водорастворимое
состояние (мыло – загрязнения; желчные кислоты –
липиды пищи в тонком кишечнике)
- Некоторые ПАВ (додецилсульфат натрия) вызывают
диссоциацию белковых комплексов, способны
инактивировать вирусы и бактериальные токсины
(Церигель, Этоний, Декаметоксин)
16.
Адсорбция — самопроизвольный энергетически выгодный процесс.Уравнение адсорбции Гиббса
Адсорбция – самопроизвольный энергетически выгодный
процесс. Причина – стремление системы к уменьшению
избыточной поверхностной энергии.
Снижение поверхностной энергии (G = σ·S) происходит за
счет изменения химического состава поверхности (μ·n)
Снижение
поверхностной
энергии
σ - удельная
поверхностная
энергия (Дж/м2),
S – площадь
поверхности
адсорбента (м2)
S n
за счет изменения
химического состава
поверхности
S d n d
μ – химический
потенциал
(Дж/моль),
n – количество
вещества адсорбата
(моль) n=(nS–nV)
16
17.
nd d
S
n
2
Г ( моль / м )
S
d C
Г
dC RT
RT ln C
dC
d RTd ln C RT
C
фундаментальное
уравнение
адсорбции Гиббса
17
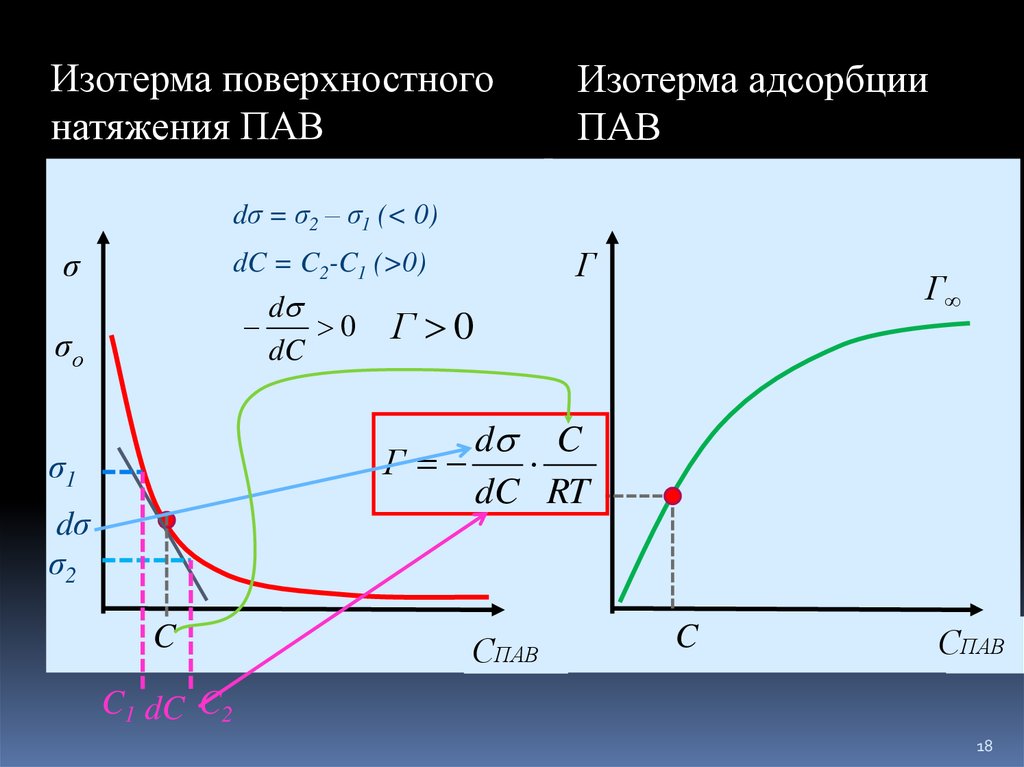
18.
Изотерма поверхностногонатяжения ПАВ
Изотерма адсорбции
ПАВ
dσ = σ2 – σ1 (< 0)
σ
Г
dC = C2-C1 (>0)
d
0
dC
σо
Г∞
Г 0
d C
Г
dC RT
σ1
dσ
σ2
C
СПАВ
C
ССПАВ
ПАВ
C1 dC C2
18
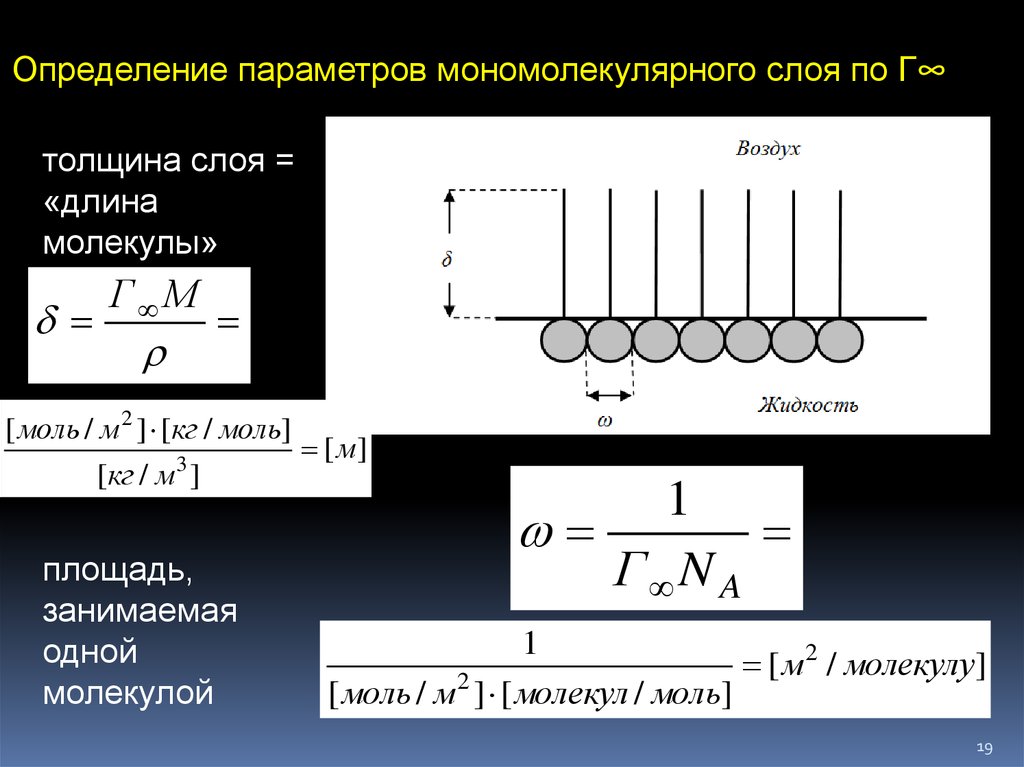
19.
Определение параметров мономолекулярного слоя по Г∞толщина слоя =
«длина
молекулы»
Г М
[ моль / м2 ] [кг / моль]
[ м]
3
[кг / м ]
площадь,
занимаемая
одной
молекулой
1
Г N A
1
2
[
м
/ молекулу]
2
[ моль / м ] [ молекул / моль]
19
20.
Поверхностная активностьОдной из главных задач при исследовании адсорбции
является установление связи между адсорбционной
способностью и составом вещества.
d
g Дж м
моль
dC
Поверхностная активность g - способность
вещества при адсорбции
снижать σ в зависимости от его C в объеме.
Значение g непостоянно и зависит от концентрации
растворенного вещества С.
20
21.
Обычно сравнивают g при С → 0 (gmax )(тогда это пост. величина и ее можно
использовать для сравнения адс. способности
веществ)
gmax= tgα
21
22.
ddC
d
0
dC
ПАВ (σ уменьшается с ростом С,
адсорбция самопроизвольна)
d
0
dC
ПИАВ
d
0
dC
ПНВ
22
23.
правило Дюкло — ТраубеПоверхностная активность соединения тем выше, чем
сильнее выражена полярная ассиметрия молекулы.
Поверхностная активность увеличивается в
гомологическом ряду в 3,2 раза при удлинении
углеводородного радикала на одну СН2 группу
23



















 physics
physics chemistry
chemistry








