Similar presentations:
Физико - химические основы поверхностных явлений
1.
ФИЗИКО-ХИМИЧЕСКИЕОСНОВЫ
ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
Все
биологические
системы
представляют
собой
гетерогенные системы, состоящие из двух или более фаз,
которые отделены друг от друга поверхностью раздела, где
свойства системы изменяются скачкообразно.
Поэтому на поверхности раздела фаз наблюдаются
различные поверхностные явления:
поверхностное натяжение,
сорбция,
адгезия,
смачивание,
капиллярная конденсация.
1
2.
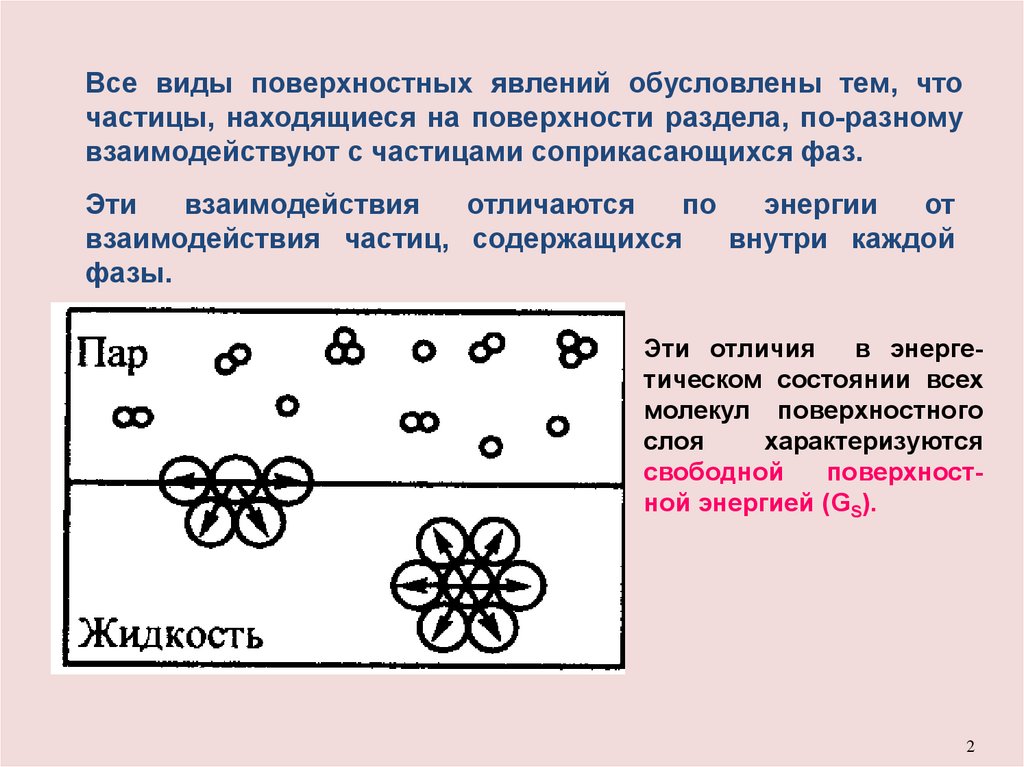
Все виды поверхностных явлений обусловлены тем, чточастицы, находящиеся на поверхности раздела, по-разному
взаимодействуют с частицами соприкасающихся фаз.
Эти
взаимодействия
отличаются
по
энергии
от
взаимодействия частиц, содержащихся
внутри каждой
фазы.
Эти отличия
в энергетическом состоянии всех
молекул поверхностного
слоя
характеризуются
свободной
поверхностной энергией (GS).
2
3.
Свободнойповерхностной
энергией
называется
термодинамическая функция, характеризующая энергию
межмолекулярного взаимодействия частиц на поверхности
раздела фаз с частицами каждой из контактирующих фаз
Свободная поверхностная энергия зависит от количества
частиц на поверхности раздела и прямо пропорциональна
площади раздела фаз и удельной энергии межфазного
взаимодействия:
GS S
где
σ - удельная свободная поверхностная энергия, которая
характеризует энергию межфазного взаимодействия
единицы площади поверхности раздела фаз, кДж/м2 ;
S- площадь поверхности раздела фаз, м2 .
3
4.
От агрегатного состояния контактирующих фаз различаютповерхностные явления на подвижной и неподвижной
поверхности раздела.
Удельную свободную поверхностную энергию для подвижных
поверхностей
раздела
фаз
называют
коэффициентом
поверхностного натяжения и обозначают σг\ж или σж\ж.
С повышением температуры коэффициент поверхностного
натяжения понижается, т.к. уменьшается различие в энергии
межмолекулярного взаимодействия контактирующих фаз.
При температуре кипения σ = 0.
Коэффициент поверхностного натяжения понижается при
увеличении давления
4
5.
Все самопроизвольные процессы протекают в направлении,приводящем к уменьшению энергии Гиббса. И все
поверхностные явления происходят самопроизвольно только
когда свободная поверхностная энергия системы уменьшается.
GS S
Т.к. свободная поверхностная энергия
параметров – σ и S,
зависит от двух
то все поверхностные явления совершаются самопроизвольно,
если при этом
а. снижается удельная свободная энергия (∆σ <0)
б. уменьшается площадь поверхности раздела фаз (∆S < 0) или
в. происходит такое изменение этих величин, чтобы
∆GS = ∆σ ∆S < 0
5
6.
К самопроизвольным поверхностным явлениям, которыесопровождаются уменьшением
GS за счет уменьшения
площади поверхности (S), относятся:
коалесценция – слияние капель жидкости или пузырьков газа и
коагуляция – слипание частиц в дисперсных системах.
К
самопроизвольным
поверхностным
явлениям,
которые
сопровождаются уменьшением
GS за счет снижения удельной
свободной поверхностной энергии (σ), относятся сорбция и ее
последствия : смачивание, эмульгирование и др.
6
7.
СОРБЦИЯ И ЕЕ ВИДЫСорбция
гетерогенный процесс самопроизвольного
поглощения твердым телом или жидкостью веществ из
окружающей среды.
Твердые тела или жидкости, способные поглощать
вещества из окружающей среды, называются сорбентами, а
поглощающее вещество – сорбатом.
В зависимости от степени связывания поглощаемого
вещества сорбентом сорбция может быть обратимой и
необратимой.
Чаще всего сорбция является обратимым процессом, т.е.
наряду с сорбцией протекает десорбция:
Сорбент + сорбат
сорбция
Сорбционный
десорбция
комплекс
7
8.
Процесс сорбции может сопровождаться диффузиейвещества в глубь сорбента. Такой вид сорбции называется
абсорбцией.
К процессам абсорбции можно отнести растворение
веществ в растворителе, который можно назвать
абсорбентом
Абсорбция подчиняется закономерности «подобное с
подобным». Полярное вещество хорошо абсорбируется
полярной фазой, а неполярное вещество – неполярной фазой.
Процесс
сорбции,
который
сопровождается
концентрированием поглощаемого вещества на поверхности
сорбента называется адсорбцией.
АДСОРБЦИЯ
поглощаемое
вещество
(адсорбат)
концентрируется на поверхности раздела контактирующих фаз
(адсорбент).
8
9.
Различают физическую и химическую адсорбцию.Физическая адсорбция обусловлена межмолекулярным
взаимодействием
за
счет
сил
Ван-дер-Ваальса:
ориентационных, индукционных и дисперсионных или
водородной связи.
Для физической адсорбции характерны:
а. обратимость,
б. неспецифичность, которая подчиняется общей
закономерности «подобное с подобным»,
в. экзотермичность
Физической адсорбции способствуют:
а. снижение температуры,
б. увеличение концентрации поглощаемого вещества,
в. повышение давления в системе при адсорбции газа или
пара.
Физическая
адсорбция
ухудшается
при
уменьшении
удельной
свободной
поверхностной
( σ)
энергии
поверхности адсорбента.
9
10.
Хемосорбция практическилокализована.
необратима, специфична и
Повышение температуры при хемосорбции приводит к
большему связыванию адсорбата.
Количественной характеристикой адсорбции является
величина удельной адсорбции Г.
Удельная адсорбция – это равновесное количество
поглощаемого вещества, приходящееся на единицу
поверхности или массы адсорбента.
n – количество адсорбата, моль
n
Г ( моль \ г ) m – масса адсорбента, г
m
Адсорбция на твердых адсорбентах
10
11.
Количество поглощенного газа или параадсорбентом зависит от следующих факторов:
твердым
1. От природы и площади поверхности адсорбента.
Адсорбция газов на твердой поверхности зависит прежде
всего от свободной поверхностной энергии. Адсорбент
тем эффективней, чем мельче он измельчен и чем выше
его пористость.
2. От природы и поглощаемого газа или пара.
Адсорбируемость газа или пара определяется его
сродством
к поверхности адсорбента.
Полярные
вещества лучше
адсорбируются
на
полярных
адсорбентах,
а
неполярные
–
на неполярных
адсорбентах.
3. От концентрации или давления газа или пара
11
12.
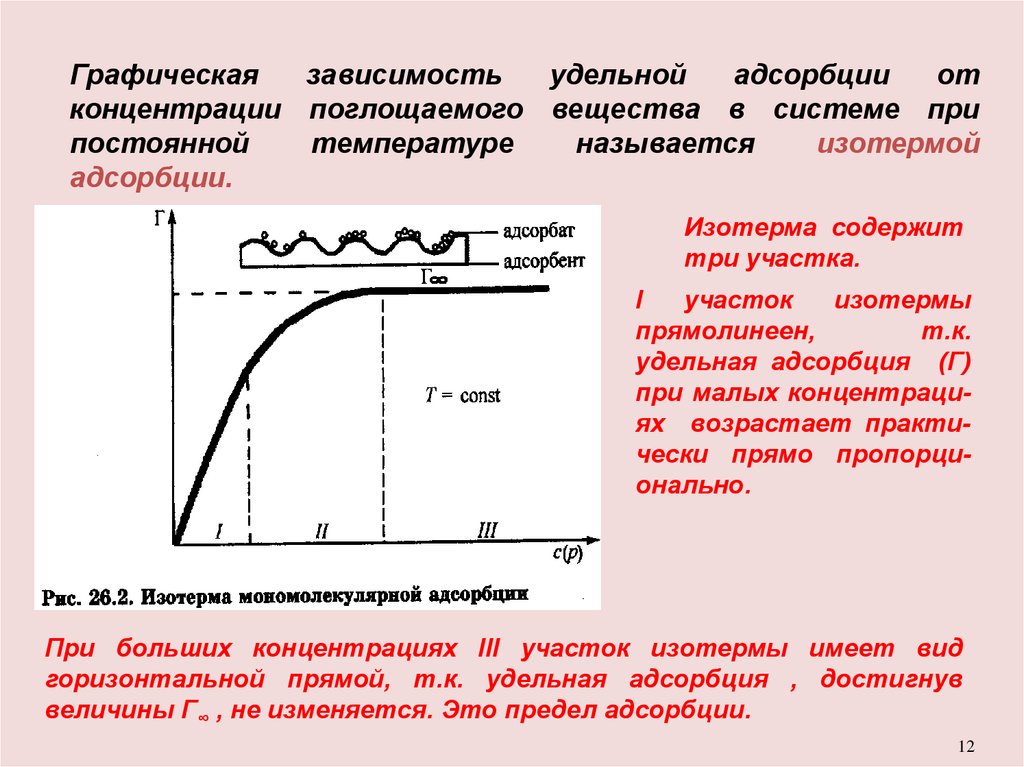
Графическаязависимость
удельной
адсорбции
от
концентрации поглощаемого вещества в системе при
постоянной
температуре
называется
изотермой
адсорбции.
Изотерма содержит
три участка.
I
участок
изотермы
прямолинеен,
т.к.
удельная адсорбция (Г)
при малых концентрациях возрастает практически прямо пропорционально.
При больших концентрациях III участок изотермы имеет вид
горизонтальной прямой, т.к. удельная адсорбция , достигнув
величины Г∞ , не изменяется. Это предел адсорбции.
12
13.
• адсорбция молекул происходит не на всей поверхностиадсорбента, а только на адсорбционных центрах (вершины
неровностей и узкие поры)
• каждый адсорбционный центр может удерживать только одну
молекулу адсорбата, при этом адсорбированные молекулы не
вступают во взаимодействие со свободными молекулами, что
приводит к образованию мономолекулярного слоя поглощаемого
вещества.
• процесс адсорбции обратим и носит динамический характер.
Ленгмюр предложил уравнение адсорбции:
Кс
Г Г
1 Кс
Где: Г∞ - предельная адсорбция;
с - равновесная концентрация;
К - константа адсорбционного равновесия.
13
14.
4. От температуры.Повышение
температуры
уменьшает
физическую
адсорбцию т.к. она является экзотермическим процессом.
МОЛЕКУЛЯРНАЯ АДСОРБЦИЯ ИЗ РАСТВОРОВ
НА ТВЕРДОМ АДСОРБЕНТЕ
Существенное отличие адсорбции из растворов от адсорбции из
газовой фазы состоит в конкуренции между растворенным веществом
и
растворителем
за
возможность
взаимодействовать
с
адсорбционными центрами на поверхности твердого адсорбента.
Молекулярная адсорбция зависит:
1. От природы адсорбента.
Гидрофильные адсорбенты (силикагель, глины, пористые стекла)
хорошо поглощают полярные вещества, а гидрофобные (сажа,
активированный уголь) – неполярные вещества.
2. От природы растворителя.
14
15.
3. От природы адсорбата.1-е правило. «Подобное взаимодействует с подобным» что указывает
на необходимость сродства между адсорбатом и адсорбентом.
2-е правило. Правило Шилова.
Чем больше растворимость вещества в данном растворителе, тем
хуже оно адсорбируется на поверхности твердого адсорбента.
3-е правило. Правило Ребиндера.
На поверхности раздела фаз прежде всего адсорбируются те
вещества, при адсорбции которых происходит выравнивание
полярностей соприкасающихся фаз, причем с увеличением разности
полярности фаз способность к адсорбции этих веществ возрастает.
15
16.
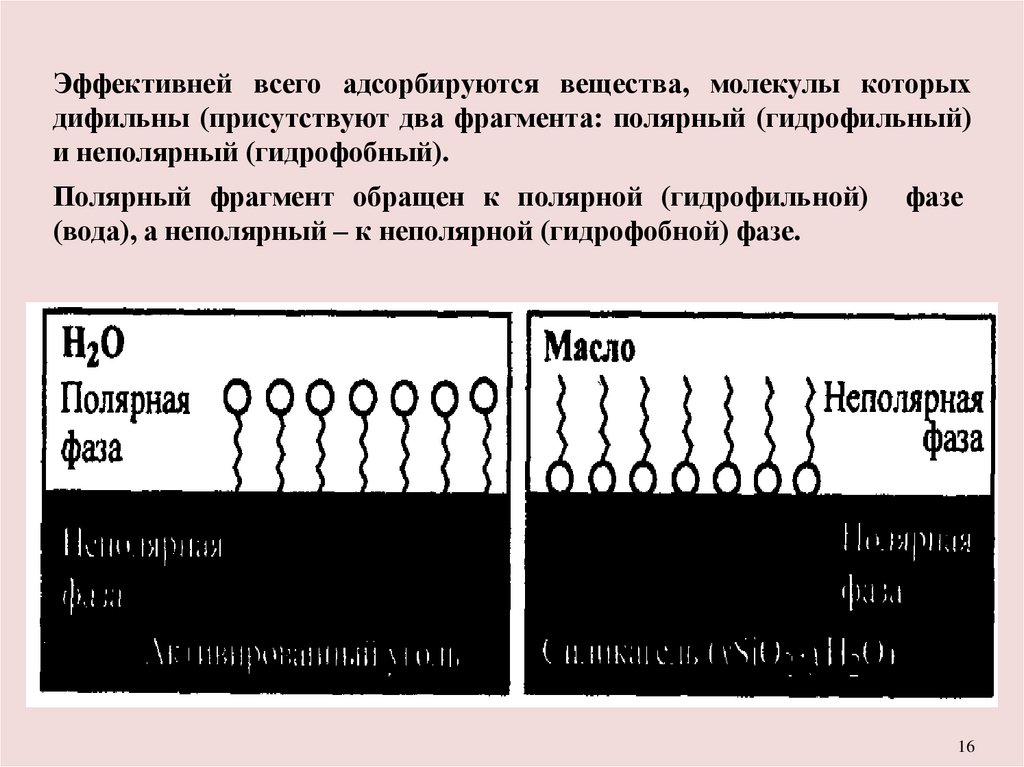
Эффективней всего адсорбируются вещества, молекулы которыхдифильны (присутствуют два фрагмента: полярный (гидрофильный)
и неполярный (гидрофобный).
Полярный фрагмент обращен к полярной (гидрофильной)
(вода), а неполярный – к неполярной (гидрофобной) фазе.
фазе
16
17.
4. От концентрации растворенного вещества.Влияние концентрации растворенного вещества на адсорбцию из
раствора при постоянной температуре описывается уравнением
Ленгмюра.
Кс
Г Г
1 Кс
5. При повышении температуры адсорбция вещества из раствора
уменьшается.
Молекулярная адсорбция из растворов на твердом адсорбенте
используется в медицинской практике. При отравлениях применяется
активированный уголь, способный адсорбировать газы, алкалоиды,
барбитураты, токсины из пищеварительной системы.
Одна таблетка активированного угля массой 0,25 г имеет
адсорбционную поверхность около 100 м2. С его помощью
осуществляют также сорбционную детоксикацию крови и лимфы
путем перфузии.
17
18.
В санитарно-гигиенической практике молекулярнаяадсорбция
используется для очистки питьевой воды и сточных вод
промышленных предприятий.
Фильтрующие адсорбенты на основе природных глин широко
используются в пищевой промышленности для очистки пищевых
растворов, сиропов, соков и растительных масел.
АДСОРБЦИЯ НА ПОДВИЖНОЙ ПОВЕРХНОСТИ
РАЗДЕЛА ФАЗ
Согласно II началу ТД свободная поверхностная энергия жидкостей
стремится к минимуму. В чистых жидкостях уменьшение этой
энергии происходит только путем сокращения поверхности.
18
19.
В растворах свободная поверхностная энергия может понижаться засчет уменьшения удельного поверхностного натяжения в результате
адсорбции растворенного вещества в поверхностном слое жидкости,
приводящей к изменению его состава.
Адсорбция растворенных веществ на поверхности жидких
адсорбентов описывается уравнением Гиббса – зависимость между
концентрацией вещества на единице поверхности раздела фаз и
концентрацией его в объеме раствора.
C d
Г
RT dc
Г - удельная адсорбция растворенного вещества (
количество моль этого вещества, приходящихся
на единицу площади поверхности адсорбента,
моль/дм2 ).
С - равновесная молярная концентрация растворенного вещества, моль/л
d
dc
- понижение удельного поверхностного натяжения, вызванного
повышением
концентрации
растворенного
вещества
в
поверхностном слое
19
20.
ddc
называют поверхностной активностью (g), которая служит
характеристикой поведения растворенного вещества при его
адсорбции поверхностью раздела.
Поверхностная активность может быть положительной или
отрицательной.
Если с увеличением концентрации вещества удельное поверхностное
натяжение на границе раздела фаз понижается, т.е. поверхностная
активность уменьшается , то такое вещество называют поверхностноактивным (ПАВ)
В этом случае адсорбция растворенного вещества положительна
(Г>0); концентрация растворенного вещества в поверхностном слое
больше, чем в объеме раствора.
Если с увеличением концентрации вещества удельное поверхностное
натяжение на границе раздела фаз повышается, т.е. поверхностная
активность увеличивается , то такое вещество называют
поверхностно-инактивным (ПИВ)
20
21.
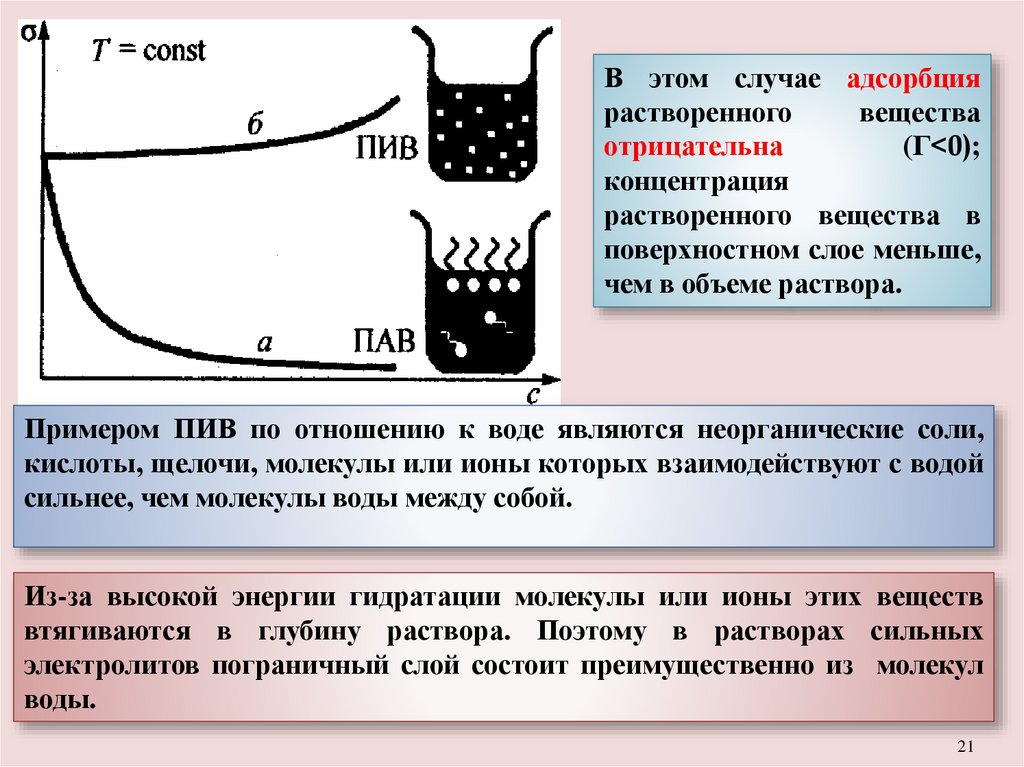
В этом случае адсорбциярастворенного
вещества
отрицательна
(Г<0);
концентрация
растворенного вещества в
поверхностном слое меньше,
чем в объеме раствора.
Примером ПИВ по отношению к воде являются неорганические соли,
кислоты, щелочи, молекулы или ионы которых взаимодействуют с водой
сильнее, чем молекулы воды между собой.
Из-за высокой энергии гидратации молекулы или ионы этих веществ
втягиваются в глубину раствора. Поэтому в растворах сильных
электролитов пограничный слой состоит преимущественно из молекул
воды.
21
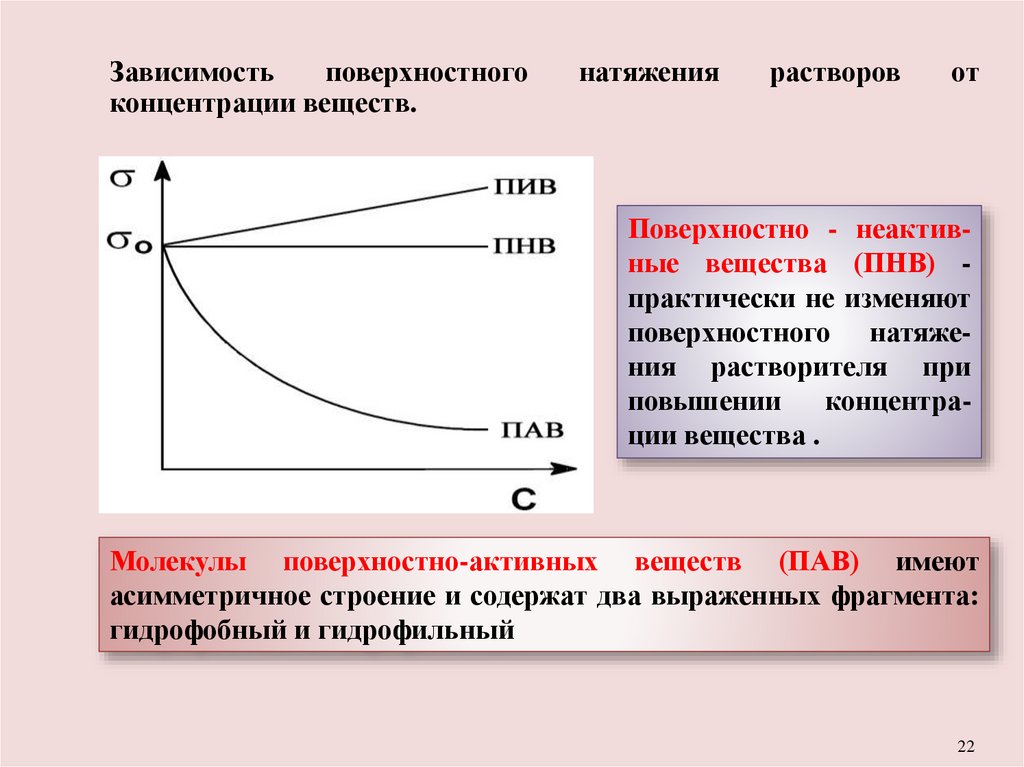
22.
Зависимостьповерхностного
концентрации веществ.
натяжения
растворов
от
Поверхностно - неактивные вещества (ПНВ) практически не изменяют
поверхностного натяжения растворителя при
повышении
концентрации вещества .
Молекулы поверхностно-активных веществ (ПАВ) имеют
асимметричное строение и содержат два выраженных фрагмента:
гидрофобный и гидрофильный
22
23.
гидрофильная часть - «голова» ,гидрофобная часть – «хвост»
Различают
ИОНОГЕННЫЕ
НЕИОНОГЕННЫЕ ПАВ
и
Ионогенные ПАВ диссоциируют в
растворе на ионы, одни из которых
обладают
адсорбционной
активностью,
другие
(противоионы) - адсорбционно не
активны.
Если адсорбционно активны анионы, ПАВ называют анионными,
или анионактивными.
1. Анионактивные ПАВ, полярная группа –кислотная:
- соли высших карбоновых кислот СnH2n+1COONa– мыла (n>10);
- алкиларилсульфонаты CnH2n+1C6H4OSO3Na (n>10);
- алкилсульфаты CnH2n+1OSO3Na (n>10);
23
24.
в противоположном случае - катионными, или катионактивнымиПАВ
2. катионактивные ПАВ, полярная группа –катион
- cоли тетраалкиламмония [CnH2n+1N(R)3]+X- (n>8,
триметилцетиламмонийхлорид [C16H33N(СН3)3]+Сl-
например
- cоли алкилпиридиния [CnH2n+1NС5H5]+Xцетилпиридинийбромид [C16H33NС5Н5]+Br-
например
(n>8,
Некоторые ПАВ содержат как кислотные, так и основные группы.
Такие ПАВ обладают амфотерными свойствами. Их называют
амфотерными или амфолитными ПАВ.
3. Неионогенные ПАВ не диссоциируют при растворении на ноны;
носителями гидрофильности в них обычно являются гидроксильные
группы и полигликолевые цепи различной длины:
- Спиртов СnH2n+1O(CH2CH2O)mH
- Кислот СnH2n+1COO(CH2CH2O)mH
- Фенолов С6H5-O(CH2CH2O)mH
n > 10,
m>6
24
25.
К природным ПАВ относят фосфолипиды, сфинголипиды, желчныекислоты, белки и гликолипиды.
У дифильных молекул с короткой углеводородной цепью «хвостом»
и эффективной полярной частью «голова»
преобладают
гидрофильные свойства, и поэтому они хорошо растворимы в воде
(низшие спирты , карбоновые кислоты).
С удлинением углеводородной цепи усиливаются гидрофобные
свойства молекул и понижается растворимость в воде.
Влияние природы ПАВ на их поверхностную
описывается правилом Дюкло-Траубе.
активность
Поверхностная активность ПАВ в разбавленных водных растворах
при одинаковой молярной концентрации увеличивается в 3-3,5 раза
при удлинении гидрофобной части на одну метиленовую группу (СН2-) .
25
26.
Для характеристики поверхностной активности молекул ПАВиспользуют их гидрофильно-липофильный баланс (ГЛБ).
В молекуле любого ПАВ имеется определенное соотношение между
активностями гидрофильных и гидрофобных групп от чего зависит
пригодность ПАВ для той или иной цели.
Так, для пеногасителей
нужны ПАВ , у молекул которых
гидрофобные свойства значительно превышают гидрофильные
Для получения эмульсий масла в воде необходимы ПАВ, у молекул
которых гидрофобные свойства еще сильно преобладают, но
гидрофильные свойства уже становятся заметными.
26
27.
Для получения эмульсий воды в масле необходимы ПАВ, умолекул которых гидрофобные и гидрофильные свойства
выражены примерно одинаково.
При использовании ПАВ в качестве моющих средств применяют
вещества , в молекулах которых
гидрофобные свойства
выражены несколько меньше, чем гидрофильные.
ПАВ благодаря дифильным свойствам исграют важную роль в
природе, т.к. позволяют совместить между собой гидрофильные
и гидрофобные системы, т.е. то, что принято считать
несовместимыми.
27
28.
СМАЧИВАНИЕ- это поверхностное явление, заключающееся во взаимодействии
жидкости с поверхностью твёрдого тела или другой жидкостью
при условии, что присутствует третья (обычно, но не обязательно,
газовая) фаза, причём происходит одновременный контакт всех
этих трёх не смешивающихся фаз.
Естественная форма всякой жидкости –
шар. Обычно сила тяжести мешает
жидкости принимать эту форму, и жидкость
либо растекается тонким слоем, если сосуда
нет, либо же принимает форму сосуда.
Находясь внутри другой жидкости такой же
плотности,
жидкость
принимает
естественную, шарообразную форму.
28
29.
Смачивание бывает двух видов:1. Иммерсионное (вся поверхность твёрдого тела контактирует с
жидкостью)
2. Контактное (состоит из трех фаз - твердая, жидкая,
газообразная)
Смачивание зависит от соотношения между силами сцепления
молекул жидкости с молекулами (или атомами) смачиваемого тела
АДГЕЗИЯ и силами взаимного сцепления молекул жидкости
КОГЕЗИЯ.
Явление смачивание/не смачивание объясняется
взаимодействием молекул тела и жидкости.
различным
Если молекулы жидкости притягиваются к телу сильнее, чем друг
к другу, то такая жидкость смачивает тело.
Если же молекулы жидкости притягиваются друг к другу сильнее,
чем к телу, то жидкость не будет смачивать данное тело.
29
























 chemistry
chemistry








