Similar presentations:
Физико-химия поверхностных явлений
1. ФИЗИКО-ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
2.
Явления,поверхности
называются
явлениями.
происходящие
на
раздела
фаз
поверхностными
Поверхностный слой, возникающий на
границе различных фаз, представляет
собой промежуточную фазу толщиной
в несколько молекулярных диаметров.
В
этом
слое
свойства
сильно
различаются от точки к точке.
Если
поверхностный
слой
имеет
толщину, примерно равную диаметру
молекулы,
то
его
называют
мономолекулярным.
3. ТЕРМОДИНАМИЧЕСКАЯ ФАЗА
термодинамическиоднородная по составу и
свойствам
часть
термодинамической системы,
отделенная от других фаз
поверхностями раздела, на
которых
скачкообразно
изменяются
некоторые
свойства системы
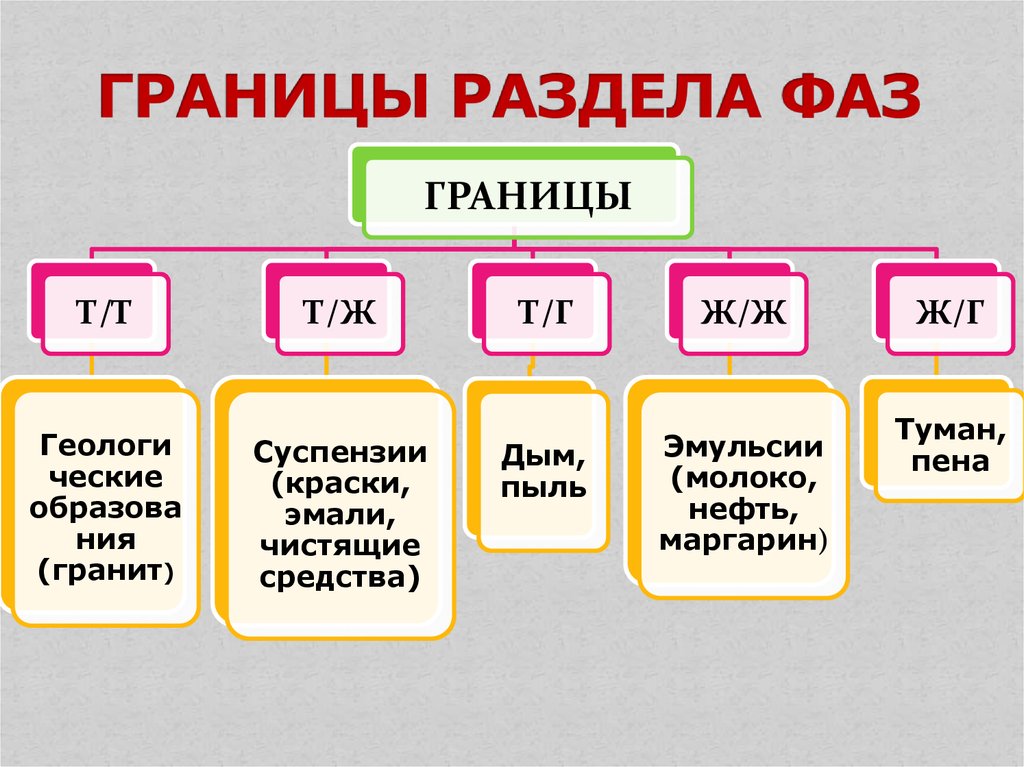
4. ГРАНИЦЫ РАЗДЕЛА ФАЗ
ГРАНИЦЫТ/Т
Геологи
ческие
образова
ния
(гранит)
Т/Ж
Суспензии
(краски,
эмали,
чистящие
средства)
Т/Г
Ж/Ж
Дым,
пыль
Эмульсии
(молоко,
нефть,
маргарин)
Ж/Г
Туман,
пена
5.
Адсорбция - это явлениеконцентрирования вещества на
поверхности раздела фаз.
Адсорбент - вещество, на
поверхности которого происходит
адсорбция.
Адсорбат (адсорбтив) - это
вещество, адсорбирующееся на
поверхности адсорбента.
Поверхность, приходящаяся на 1 г
адсорбента, называется удельной
поверхностью адсорбента (Sуд).
6.
Непористые тела имеют удельнуюповерхность от нескольких
квадратных метров до сотен
квадратных метров на грамм
(пигменты, например, ТіО2,
наполнители: аэросил, сажи).
Пористые тела имеют удельную
поверхность до нескольких сотен и
даже до тысяч квадратных метров
на грамм (активированный уголь,
силикагель, пористые кристаллы
цеолитов).
7.
Типы адсорбционныхвзаимодействий
Физическая адсорбция обусловлена
силами Ван-дер-Ваальса,
возникающими между частицами
адсорбата и адсорбента. Она
обратима и уменьшается с ростом
температуры.
Химическая адсорбция
(хемосорбция) обусловлена
химическими силами. Она
необратима и увеличивается с ростом
температуры (например, адсорбция
кислорода на поверхности металла).
8.
Адсорбцияпроисходит
на
поверхности раздела
газ/твердое тело,
раствор/твердое тело,
газ/жидкость,
жидкость/жидкость.
Адсорбция бывает
мономолекулярная (на поверхности
раздела образуется слой адсорбата
толщиной в одну молекулу) и
полимолекулярная (на поверхности
раздела образуется
полимолекулярный слой адсорбата).
9.
Изотермы адсорбцииВеличина адсорбции Г (гамма)
выражается в моль/г адсорбента или
в моль/1см2 (м2) его поверхности.
Зависимость величины адсорбции Г от
концентрации или давления адсорбата
в газовой фазе при Т = const
выражается уравнением изотермы
адсорбции.
Для получения простейших
закономерностей используют
однородные поверхности (например,
сажу, прокаленную при 30000С).
10.
Часто при адсорбции газовобразуется мономолекулярный
слой.
При
адсорбции
на
однородной
поверхности
концентрация
адсорбата
в
любой
точке
поверхности
постоянна.
Рассмотрим
несколько
изотерм адсорбции.
11.
1. Изотерма ГенриПри малых давлениях (концентрациях)
адсорбата величина адсорбции Г
пропорциональна давлению или концентрации
адсорбата:
Г = kР
или
Г = kС .
Это уравнение изотермы адсорбции Генри.
Часто величину адсорбции характеризуют
степенью заполнения поверхности данным
адсорбатом
Θ. Тогда уравнение Генри может
быть выражено через
Θ = kP
Θ:
или
Θ = kC ,
т. е. заполнение поверхности пропорционально
давлению адсорбата в газовой фазе Р или его
концентрации С в «области Генри», т. е. в
области небольших Р или С.
12.
2. Изотерма Ленгмюра.Адсорбция бывает
нелокализованная (молекулы
адсорбата могут свободно
перемещаться вдоль поверхности
адсорбента).
Локализованная адсорбция - это
химическая или сильная
физическая адсорбция, при которой
адсорбированная молекула прочно
связана с адсорбентом и не может
перемещаться вдоль поверхности.
13.
Мономолекулярная локализованнаяадсорбция описывается уравнением
изотермы адсорбции Ленгмюра:
где Г - величина адсорбции газа,
Г∞ - максимально возможное количество
адсорбированного вещества при
образовании мономолекулярного слоя
адсорбата, т. е. предельная адсорбция,
в - константа адсорбционного
равновесия,
Р - равновесное давление газа.
14.
Уравнение изотермы, выраженноечерез степень заполнения Θ, имеет
вид
Степень заполнения определяется
по соотношению:
Θ = Г/Г∞ .
15.
Площадь поверхности 1 гадсорбента Sуд – удельная
поверхность:
Vm N A
S уд
S0
22,4
где NA - число Авогадро,
Vm – максимально возможный объем
адсорбата,
полностью
покрывающего
поверхность 1 г адсорбента,
22,4 л - мольный объем газа при н.у.,
S0 - площадь, которую на поверхности
адсорбента
занимает
1
молекула
адсорбата.
16.
Адсорбция из раствора описываетсяуравнением Ленгмюра вида
вС
Г Г
1 вС
где С – равновесная концентрация
адсорбированного
вещества
в
растворе.
17.
Адсорбция на границе газ-жидкость.Изотерма Гиббса.
Молекулярные
силы
притяжения
молекул поверхностного слоя жидкости
ненасыщенны,
так
как
со
стороны
газовой
фазы
силы
эти
неуравновешенны,
в
отличие
от
глубинных
молекул,
силовые
поля
которых
полностью
насыщенны
и
равнодействующая которых равна нулю.
Равнодействующая
неуравновешенных
сил притяжения поверхностных молекул
направлена в сторону жидкой фазы от ее
поверхности.
18.
Наличие огромных сил притяжения,направленных
вглубь
жидкости,
приводит
к
самопроизвольному
сокращению ее поверхности, так как
втягивание
молекул
с
поверхности
внутрь жидкости идет с гораздо большей
скоростью,
чем
обратное
«выталкивание» их из глубины на
поверхность,
обусловлены
поступательным
движением
молекул.
Поэтому для увеличения поверхности
жидкости необходимо затратить работу
на преодоление этих сил.
19.
Величина работы, необходимой длясоздания единицы площади новой
поверхности, называется
поверхностным натяжением,
которое выражается в Дж/м2 и
обозначается буквой (сигма).
= А/S
Поверхностное натяжение равно
величине свободной
поверхностной энергии,
приходящейся на 1 см2 (1м2)
поверхности.
20.
Подвлиянием
поверхностного
натяжения масса жидкости, при
отсутствии внешних сил, всегда
стремится принять форму шара, так
как поверхность шара является
наименьшей
поверхностью,
ограничивающей данный объем, и,
следовательно,
поверхностная
энергия системы при этом будет
минимальной.
21. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
сила,отнесенная
к
единице
длины, или работа, затрачиваемая
на создание единицы площади
поверхности раздела фаз при
постоянной температуре.
Поверхностное натяжение (σ) выражает
тенденцию поверхностей к стягиванию
22.
Величинаповерхностного
натяжения чистой жидкости при
данной температуре на данной
границе раздела есть величина
строго определенная.
Величина поверхностного
натяжения растворов зависит от
- природы растворителя,
-природы растворенного вещества,
- от концентрации раствора.
23.
При растворении возможны 3 случая.Введем обозначения:
- поверхностное натяжение раствора,
- поверхностное натяжение чистого
растворителя.
0
0
0
(растворы сахара в воде)
(растворы электролитов)
(растворы полярных
органических веществ в воде:
жирных кислот, их солей, спиртов,
аминов, сульфокислот и др.)
24.
В 1-м случае вещества не влияютна поверхностное натяжение
растворителя и распределяются
равномерно между поверхностным
слоем и объемом раствора
Во 2-м случае растворенные
вещества носят название
поверхностно-инактивных,
а в 3-ем – поверхностно-активных
(ПАВ).
.
25.
Поверхностно-инактивные веществастремятся уйти с поверхности жидкости
в объеме.
Поверхностно-активные вещества,
наоборот, стремятся накапливаться в
поверхностном слое.
Накопление вещества поверхностным
слоем называется адсорбцией.
Характерной особенностью всех
поверхностно-активных веществ
является их дифильность, то есть то,
что они состоят из двух частей –
полярной группы и неполярного
углеводородного или ароматического
радикала.
26.
ПАВ- это органические кислоты, спирты,
эфиры, амины, кетоны, мыла и другие
моющие
средства.
Молекулы
ПАВ
при
внесении их в воду стремятся выйти на
границу раздела вода/пар, где каждая из
указанных частей молекул ориентируется
соответственно своей природе: полярная
группа - в сторону полярной среды (в воду),
неполярная - в воздух.
а
б
Рис. Ориентация ПАВ на границе раздела водный
раствор/воздух:
а - ненасыщенный адсорбционный слой;
б - насыщенный мономолекулярный слой ПАВ
27.
Для поверхностно-активных веществуменьшается с концентрацией, то есть
Для поверхностно-инактивных веществ
увеличивается с концентрацией то есть
Если
не зависит от концентрации
Величина -
называется
поверхностной активностью
g = - dσ/dC
(g).
28.
Накопление ПАВ в поверхностном слоераствора выражается величиной
адсорбции Г, которая выражается в
моль/м2.
Связь величины Г с концентрацией
поверхностно-активного вещества (ПАВ) в
растворе (С) и поверхностным
натяжением ( ) на границе раствор-газ
дается уравнением изотермы
адсорбции Гиббса:
С d
Г
RT dC
29.
1. Г > 0, если dσ /dC < 0.Т.е. положительная адсорбция
всегда наблюдается при
уменьшении поверхностного
натяжения с ростом концентрации
адсорбата на поверхности раздела
фаз.
Такие вещества называются
поверхностно-активными (ПАВ).
30.
2. Г < 0, если dσ/dC > 0.Адсорбция
отрицательна,
а
подобные вещества называются
поверхностно-инактивными.
3. Г = 0 при dσ/dC = 0.
Адсорбция вещества отсутствует.
31.
Накопление ПАВ на поверхности раздела фазвызывает понижение поверхностного натяжения
раствора. Это понижение σ связано с
концентрацией ПАВ в растворе в соответствии с
уравнением Шишковского:
σ0 - σ =аln(1 + вC),
где σ0 и σ - поверхностное натяжение
растворителя и раствора соответственно, а и в константы, причем константа «а», мало
зависящая от природы поверхностно-активного
вещества (одинаковая для всех членов данного
гомологического ряда ПАВ), связана с
константой Г∞ уравнения Ленгмюра
соотношением
а = Г∞RТ
и имеет постоянное значение для всего
гомологического ряда ПАВ,
32.
Константа «в» имеет то жезначение, что и в уравнении
изотермы Ленгмюра, характеризуя
поверхностную активность
вещества и называемая удельной
капиллярной активностью, имеет
определенное значение для
каждого ПАВ и закономерно
изменяется в гомологическом
ряду, увеличиваясь, в среднем, в
3,2 раза при переходе к каждому
вышестоящему гомологу (правило
Траубе).
33. ПРАВИЛО ТРАУБЕ
вгомологическом
ряду
поверхностно-активных
веществ
поверхностная
активность
и
адсорбция возрастают при переходе
к каждому последующему члену
гомологического ряда примерно в
3,2 раза
*Это правило справедливо только для весьма
разбавленных растворов и исключает три
первых члена гомологического ряда
34.
Зная величину Г∞, можно вычислитьплощадь, занимаемую одной
молекулой в насыщенном
адсорбционном слое, т. е. поперечное
сечение молекулы So. Так как на 1 кв.м
адсорбировано Г∞ моль или Г∞∙NА
молекул, следовательно,
S0 = 1/( Г∞∙NА) кв.м.
Толщина
адсорбционного
слоя
h,
соответствующая осевой длине его
ориентированной
молекулы,
рассчитывается по формуле:
h = Г∞∙М/ρ,
где ρ - плотность ПАВ.
35.
Закономерности адсорбции на твердойповерхности из раствора.
Ионнообменная адсорбция.
Адсорбция на твердой поверхности из
раствора
зависит
от
природы
растворенного
вещества.
Большое
влияние
оказывает
на
адсорбцию
соотношение полярностей адсорбента и
растворителя. Это выражается правилом
уравнивания полярностей Ребиндера:
Величина
адсорбции
растворенного
вещества
тем
больше,
чем
больше
разность полярностей между адсорбентом
и растворителем.
36.
В случае ионной адсорбции один из ионовчасто адсорбируется избирательно.
Правила
избирательной
адсорбции
были
сформулированы Песковым и Фаянсом:
1. На поверхности твердого адсорбента
преимущественно адсорбируются ионы,
имеющие с этим адсорбентом общую атомную
группировку.
2. Если поверхность адсорбента имеет заряд,
то, преимущественно, будут адсорбироваться
ионы с противоположным зарядом, а также
ионы, образующие с поверхностью
нерастворимые соединения.
37.
Обменная адсорбция – адсорбция, прикоторой адсорбент поглощает из раствора
определенные ионы, а взамен посылает в
раствор эквивалентное количество ионов
другого вида.
Например, алюмосиликаты поглощают из
раствора ионы кальция и магния, а
посылают в раствор ионы натрия и калия,
следовательно, происходит умягчение
воды. Наиболее широкое применение
этот способ получил после
синтезирования фенолформальдегидных
смол, способных как к катионному
(катиониты), так и к анионному
(аниониты) обмену.
38.
Изобары и изостерыадсорбции.
Изобара адсорбции – зависимость
количества
адсорбированного
вещества (или степени заполнения
поверхности) от температуры при
постоянном давлении адсорбата в
газовой фазе.
Изостера адсорбции – зависимость
равновесного давления адсорбата от
температуры
для
определенного
количества адсорбированного газа.
39.
Изостеры адсорбции используютсядля определения теплоты адсорбции
графическим методом. Для этого
строят
несколько
изотерм
для
разных температур, а затем находят
значения соответствующих давлений
адсорбата при постоянной величине
адсорбции.
После
этого
строят
зависимость
ln
P
от
1/Т
при
постоянной
степени
заполнения
поверхности. Тангенс угла наклона
прямой равен –Qадс/R.
40.
Хроматография.Хроматография – метод разделения
веществ при прохождении раствора или
газа через колонку с адсорбентом. Метод
хроматографии широко используется для
веществ, в том числе и неокрашенных.
Для этого используют длинные тонкие
капилляры с пористыми стенками или
заполняют более широкие трубки
зернами пористого адсорбента (оксида
алюминия, оксида магния, древесного
угля и др.).
41.
Это приводит к возникновению большойповерхности
раздела
фаз,
следовательно,
при
медленном
прохождении
газа
осуществляются
многократно повторяющиеся процессы
адсорбции
и
десорбции
молекул
компонентов
газовой
смеси.
Это
позволяет получить разные времена
выходов компонентов из колонки или
разные времена удерживания. Такой вид
хроматографии
называют
газоадсорбционной хроматографией.
42.
Если же крупные поры адсорбентазаполнить неподвижной жидкостью,
то вместо различий в
адсорбируемости можно
использовать различия в
растворимости отдельных
компонентов газовой смеси –
газожидкостная хроматография.
Хроматографическое разделение
смесей веществ может
осуществляться разными способами:
43.
1 способ: в колонку с адсорбентом вводятгазовую смесь с постоянной
концентрацией компонентов. У выхода из
колонки появляются наименее
адсорбирующийся или наименее
растворимый компонент, затем смесь
этого компонента с несколько более легко
адсорбирующимся компонентом, затем
смесь двух компонентов с еще более
легко адсорбирующимся и т.д. вплоть до
исходной газовой смеси. Такой анализ
называют фронтальным. Недостатком его
является то, что в чистом виде можно
получить только первый компонент.
44.
2 способ: через колонку с адсорбентомпропускают непрерывный поток
практически неадсорбирующегося газа
(газ-носитель), в который у входа в колонку
вносят небольшую порцию анализируемой
смеси. В этом случае у выхода из колонки в
токе газа-носителя сначала появляется
наименее адсорбирующийся компонент
газовой смеси, затем газ-носитель, затем
смесь первого компонента с более легко
адсорбирующимся газом, затем газноситель и т.д. Таким образом, зоны выхода
компонентов на хроматограмме
оказываются разделенными газомносителем. Такой анализ называется
проявительной хроматографией.
45.
Применение адсорбционныхпроцессов в медицине
Адсорбция
лежит
в
основе
клинического анализа крови на СОЭ
(скорость осаждения эритроцитов).
Так,
при
инфекционных
заболеваниях в крови происходит
обменная адсорбция: вместо ионов
электролитов
поверхность
эритроцитов занимают молекулы
белков. При этом заряд эритроцитов
понижается
и
они
быстрее
объединяются и оседают.
46.
Адсорбционная терапия применяетсядля удаления токсинов и вредных
веществ из пищеварительного тракта.
Такие адсорбенты, как гидроксид
алюминия, оксид магния, фосфат
алюминия,
входят
в
состав
препаратов альмагель, фосфалюгель.
Активированный
уголь
давно
применяется как адсорбент газов
(при метеоризме), токсинов (при
пищевых
токсикоинфекциях),
алкалоидов и тяжелых металлов (при
отравлениях).
47.
Хорошей адсорбирующей способностьюобладает
клетчатка.
Содержание
клетчатки у больных сахарным диабетом
должно быть не меньше 25 г/1000 ккал:
клетчатка
замедляет
всасывание
сахаров,
компенсируя
повышение
концентрации глюкозы в плазме после
приема пищи. На основе оксида кремния
создан
препарат
полисорб
–
неселективный
полифункциональный
энтеросорбент.
Его
применяют
для
выведения из организма патогенных
бактерий
и
их
токсинов,
пищевых
аллергенов, солей тяжелых металлов,
радионуклидов, этанола, а также ядов
различного происхождения.














































 chemistry
chemistry








