Similar presentations:
Физическое материаловедение
1. Суриков В.И.
ФИЗИЧЕСКОЕМАТЕРИАЛОВЕДЕНИЕ
2. ПРОБЛЕМЫ И ДОСТИЖЕНИЯ МАТЕРИАЛОВЕДЕНИЯ
Существует тесная зависимость эффективности современного машиностроения от достиженийматериаловедения. Наиболее актуальные проблемы современного материаловедения и
успехи на пути их решения:
-повышение прочности материалов – важнейшая задача материаловедения во все времена.
к началу ХХI века прочность основных машиностроительных материалов возросла в 8 ..10 раз
по сравнению с началом ХХ , напряжения, при которых происходит разрушение высокопрочных
сталей, превышает 100 МПа. Перед наукой стоит задача сделать высокопрочные материалы
надежными и недорогими.
-высокопрочные материалы (твердые сплавы, карбиды, бориды, технические алмазы м пр.) в
Значительной мере характеризуют техническую мощь страны . Они не поддаются обработке
традиционными методами . Технологические трудности были преодолены только во второй
ХХ века с помощью явления «сверхпластичности».
-тенденция машиностроения к уменьшению эффективной массы изделий обуславливает
Необходимость разработки материалов высокой прочности с малой плотностью ( сплавы
магния, лития, бериллия). Изделия из этих материалов превосходят конструкции из стали и
титана. В
современной
технике
широко используются
газонаполненные
материалы.
В некоторых материалах при тепловом воздействии обнаруживается «эффект памяти»
3. продолжение
«эффект памяти» – восстановление первоначальной формы пластическидеформированного образца в результате нагревания (полимеры, сплавы
на основе титана). Механизм этого явления обусловлен структурными
превращениями материала. Используется, в частности, при раскрытии
под действием солнечного тепла антеннах космических кораблей.
Переход авиации на реактивные двигатели придал актуальность
проблеме создания материалов, сохраняющих исходную прочность при
высоких температурах – решается путем переработки металлов в
гранулы методом высокоскоростной кристаллизации при сверхбыстром
охлаждении с последующим прессовании гранул в изделия.
Материалы, устойчивые к воздействию ядерного излучения и
окислительных сред – ядерные реакторы и МГД- генераторы.
Материалы для криогенной техники, сверхпроводящие материалы.
Сверхчистые
материалы
(ядерная энергетика, полупроводниковая
техника)
Композиционные материалы.
4. Атом
Атом – наименьшая частица химического элемента, обладающая его свойствами.Он состоит из элементарных частиц, которым на сегодняшнем уровне научных
научных представлений отведена роль первичных кирпичиков мироздания.
Протоны и нейтроны составляют положительно за ряженное ядро, а электроны
движутся вокруг
ядра. Электрон – первая элементарная частица, открытая
человеком имеет массу покоя и является
носителем
элементарного
электрического заряда (кванта электричества). Ядро атома и окружающие его
электроны находятся в электростатическом и электромагнитном взаимодействии,
образуя устойчивую пространственную систему. Изолированный атом не имеет
заряда. В результате удаления или присоединения к нему электрона атом
превращается в ион (положительно или отрицательно заряженный).
Энергия атома может принимать лишь определенные (дискретные) значения,
называемые уровнями энергии (энергия атома квантуется). Уровни соответствуют
устойчивым состояниям атома и изменяются скачкообразно путем квантовых
переходов.Последние обусловлены воздействие на атомные частицы(атомы,ионы)
электромагнитного излучения. (Нейтрон – частица нестабильная)
5. продолжение
Кванты электромагнитного поля – фотоны – являются носителями минимальновозможных при данной частоте поля энергии и импульса. Поглощая фотоны,
атомные частицы переходят в возбужденное состояние, из которого, испуская
фотон, переходят в состояние с меньшей энергией (на более низкий уровень
энергии).Уровень, соответствующий минимальной энергии атома,назван основным
остальные – возбужденными. Совокупность уровней представляют энергетический
спектр атома. Оптические спектры свободных (слабосвязанныз) атомов состоят из
отдельных спектральных линий и группируются в спектральные серии. Они несут
информацию об атомной структуре вещества.
Атомы разных химических элементов отличаются электронной конфигурацией,
т.е. распределением электронов по уровням энергии. Состояние электрона в атоме
характеризуется четырьмя квантовыми числами: главным квантовым числом «n»,
определяющим среднее удаление электрона от ядра (n = 1, 2, 3, …), орбитальным
«l», определяющим форму орбиты электрона в кулоновском поле ядра (l = 0, 1, 2, ..
(n – 1)), магнитным квантовым числом «m», определяющим проекцию момента
импульса на направление внешнего поля (m = -l, …,0, …+l) и спиновым квантовым
числом «S», определяющим собственный момент импульса электрона ( S = + 1/2,
-1/2). Энергия электрона в основном определяется n и l (более n).
6. продолжение
Согласному одному из законов квантовой механики (принцип Пвули) в одном атомелюбые два электрона должны отличаться хотя бы одним из четырех квантовых
чисел. Совокупность возможных квантовых состояний с одинаковым главным
квантовым числом n составляет электронный слой, заполненный не более чем 2n²
электронами, который состоит из оболочек, характеризуемым значениями «l».
Приняты обозначения:
слои …. K, L, M, N, O, P, Q
оболочки ….. s, p, d, f
n …………1, 2, 3, 4, 5, 6, 7
l………………..0, 1, 2, 3
Атомы элементов Периодической системы не имеют оболочек с l > 3. Чем
слабее электрон связан с
ядром, тем выше уровень его энергии в
соответствующей оболочке.
Большинство химических и физических свойств атомов обусловлено структурой
его внешних электронных оболочек, в которых электроны связаны друг с другом
относительно слабо. Информацию о строении внутренних оболочек получают,
изучая взаимодействие атомов и быстрых частиц или фотонов высокой энергии.
Электростатическое взаимодействие атомов при сближении может привести к
перекрытию их электронных оболочек. Это проявляется в поляризуемости атомов
(способности атома приобретать дипольный момент), обусловлена смещением
электронов относительно ядер. Свойства ионов отличаются от свойств атомов.
7. ХИМИЧЕСКАЯ СВЯЗЬ
Под химической с вязью понимают взаимодействие между атомными частицами,обусловленное совместным «использованием» их электронов. Считая движение
электронов независимым от движения ядер, можно представить образование
химической связи как результат притяжения положительно заряженных ядер к
электронному «облаку», сконцентрированному в межядерном пространстве.
Химическая связь - общее определение сил и взаимодействий, обуславливающих
существование двух- и многоатомных соединений – молекул, ионов, радикалов,
кристаллов. Главные особенности химической связи:
1) значение полной энергии многоатомной системы меньше, чем сумма энергий
несвязанных атомных частиц, из которых она образована;
2) электронные плотности (вероятные количества электронов в элементарном
объеме) заметно отличаются в поле сил химической связи и между несвязанными
атомными частицами, которые сближены на расстояние связи.
Природа химической с вязи
определяется
электрическим кулоновским
взаимодействием ядер и электронов, однако распределение электронов при
образовании химической связи подчиняется законам квантовой механики. При
образовании связи электроны распределяются так, что силы, стремящиеся
сблизить и оттолкнуть ядра, уравновешиваются.
8. продолжение
Согласно классической теории валентности,каждой связи между атомами соответствует
одна пара электронов. В зависимости от
способа ее
образования различают
несколько видов химической связи.
Ковалентную связь образуют атомы или
группы атомов, на валентных орбиталях
которых имеются неспаренные электроны.
Обобществление последних ведет
к
формированию
электронной
пары.
Важнейшие свойства ковалентной связи:
1) насыщенность
–
существование
некоторого
предельного
количества
двухцентрового двухэлектронных связей,
образуемых атомом;
2) направленность – строго определенная
пространственная структура молекул, ионов,
радикалов с ковалентной связью.
9. продолжение
Так, в образовании ковалентной связи в молекуле этилена участвуют 4 электронаатомов углерода , остальные связаны с электронами атомов водорода.
Молекулярные орбитали имеют специфическую форму, которая определена
направленностью ковалентной связи. Электронное облако окружает оба ядра
атомов углерода.
Координационная связь (донорно-акцепторная)–химическая связь, реализуемая в
координационных (комплексных) соединениях. Последние образуются путем
присоединения к центральному атому (комплексообразователю) молекул и ионов Так называемых лигандов. Возникновение такой связи обусловлено передачей
электронной пары с целиком заполненной орбитали лиганда на вакантную
орбиталь центрального атома и образованием общей молекулярной орбитали.
Частным случаем координационной связи является водородная связь.
Разнообразие координационных связей обуславливает огромное разнообразие
структурных типов молекул координационных соединений, а также кристаллической
структуры твердых тел.
Ионная связь – химическая связь, энергия которой определяется преимущественно
кулоновским взаимодействием (притяжением) противоположно заряженных ионов.
Так, при образовании ионной связи в молекуле NaCl электроны переходят с
3s-орбитали атома Na на 3р-орбиталь атома Cl.
10. СХЕМА ОБРАЗОВАНИЯ ИОННОЙ СВЯЗИ В МОЛЕКУЛЕ ХЛОРИСТОГО НАТРИЯ
11. продолжение
Признаком соединений с ионной связью является свойство разлагаться на ионы вПолярных растворителях,т.к.энергия сольватации превышает энергию ионной связи.
Предельный случай делокализации электронных орбиталей – металлическая связь.
Она обусловлена перемещением валентных электронов металла во всем
пространстве, занятом его положительными ионами. Металлы можно представить
как ионной упорядоченный каркас, погруженные в «электронный газ», состоящий
из обобществленных электронов.
Прочность химической связи определяется ее энергией (от 10 до 1000 кДж/моль).
12. МОЛЕКУЛА
Молекула – наименьшая частица вещества, обладающая всеми его химическимисвойствами и состоящая из атомов, соединенных химическими связями.
Она
электрически нейтральна и, как правило, не имеет неспаренных электронов.
Молекулярный ион возникает в результате присоединения к молекуле или
отщепления от нее электрона. В состав молекулы входит от двух до многих сотен
и тысяч атомов (полимеры – макромолекулы). Соответственно размеры молекул
от десятых долей нанометра до нескольких микрон. Структура молекулы каждого
вещества не зависит от способа его получения. Состав молекулы передает бруттоформула (H2O, CH4, HCl и т.п.)., которую устанавливают химическим анализом.
Структурные формулы отражают последовательность и порядок связей между
атомами. Каждая молекула имеет определенную пространственную форму. Форма
молекул определяется электрическим зарядом и размером ионов (ионные
соединения) или конфигурацией электронных орбиталей (ковалентные связи).
Определенная и более сложная геометрическая структура характерна для молекул
с координационными связями.
Молекулы с одинаковой брутто – формулой могут различаться расположением
атомов в пространстве.
13. ГЕОМЕТРИЧЕСКИЕ ФОРМЫ МОЛЕКУЛ С КООРДИНАЦИОННЫМИ СВЯЗЯМИ (СОЕДИНЕНИЯ КОБАЛЬТА) а – плоский квадрат, б – тетрагональная пирамида,
в – октаэдр,г – тетраэдр, д - бипирамида
14. продолжение
Изомерия - явление,заключающееся в
существовании
химических соединений,
одинаковых по составу и молекулярной массе,
Но отличающихся строением и вследствие
этого физическими и химическими свойствами
( соединения изомеры ).
Различают
структурные и пространственные изомеры.
Явление, когда два (или более) структурных
изомера самопроизвольно переходят друг в
друга и между ними существует неустойчивое
равновесие, называется таутометрией. При
установившемся
равновесии
вещество
содержит
одновременно
молекулы
таутомеров в определенном соотношении.
Пространственные
формы
молекул –
- конформации - могут
возникнуть
в
результате вращения фрагментов молекулы
вокруг простых связей.
15. продолжение
В 1940-х годов были созданы методы исследований,позволяющие
определить
пространственную
структуру молекул.
Молекулы находятся в непрерывном движении.
Энергия молекулы складывается в основном из
энергий ее поступательного движения и вращения,
взаимодействия
электронов и атомных ядер,
Колебательного движения ядер. Эти составляющие,
за исключением энергии поступательного движения,
меняются дискретно (квантуются). При переходе
молекулы из одного квантового состояния в другое
испускается или поглощается квант энергии порядка
10 …100 кДж/моль. Такой переход может произойти в
результате вращения
фрагментов молекулы,
разрыва связей и по другим механизмам. Усреднение
энергии молекул по всем возможным квантовым
состояниям дает ее среднюю энергетическую
характеристику, называемую иногда
энергией
диссоциации молекулы на атомы.
16. продолжение
Молекулы электронейтральны, однако если «центры тяжести» положительных иотрицательных зарядов не совпадают, они полярны. В этом случае они обладают
собственным электрическим дипольным моментом. Неполярные молекулы
поляризуются во внешнем электрическом поле. В подавляющем большинстве они
диамагнитны Парамагнитными молекулами являются молекулярные радикалы
(молекулы, имеющие неспаренные электроны).
В результате взаимодействия одинаковых или близких по природе молекул
возникают более сложные образования – ассоациты (димеры, тримеры и т.п.).
Изучение структуры и свойств молекул имеет фундаментальное значение для
естествознания в целом и для материаловедения особенно.
17. ФАЗОВОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Физические свойства веществ можно изучать на основе анализа происходящих вних преобразований энергии. Состояние термодинамической системы, в которое
Она самопроизвольно приходит в течение достаточно большого промежутка
времени при неизменных внешних условиях, называют равновесным. Фаза –
термодинамически равновесное состояние вещества, отличающееся свойствами от
других возможных равновесных состояний того же вещества.Иногда неравновесное
(метастабильное) состояние вещества также называют фазой (метастабильной).
Любой однофазный материал характеризуется отсутствием поверхностей раздела
между составляющими его структурными образованиями, т.е. является гомогенным
Гетерогенный материал содержит как минимум две фазы.
Фазовый переход – переход вещества из одной фазы в другую при изменении
внешних условий. Значение температуры, давления, напряженности магнитного ,
электрического поля или другой физической величины, при которой происходит
фазовый переход называют точкой перехода. Различают фазовые переходы двух
родов.
Фазовые переходы I –го рода – сопровождаются скачкообразным изменением
термодинамичческих характеристик вещества (плотности, концентрации и др.) при
непрерывном изменении его внешних параметров.
18. продолжение
В веществе выделяется или поглощается определенное количество теплоты,называемое теплотой фазового перехода. К переходам I рода относят испарение и,
конденсацию, плавление и затвердевание, сублимацию и конденсацию в твердой
фазе, некоторые структурные переходы в твердых телах.
В отсутствии внешних полей и химических реакций состояние фазы, содержащей
k- компонентов, определяется (k + 1) независимыми параметрами: температурой,
давлением и (k – 1) молекулярными долями компонентов. Функции этих
параметров,
характеризующие
фазу,
называют
термодинамическими
параметрами. К последним относят так называемый изобарно – изотермический
потенциал, или потенциал Гиббса: G = H - TS, где H–энтальпия (теплосодержание)
H = U + pV (U – внутренняя энергия системы, p- давление, V – объем системы); T –
Температура; S – ‘энтропия или мера необратимой рассеянной энергии: dS = δQ/T;
где dS – дифференциал энтропии, δQ – количество теплоты, сообщенное системе
в изотермическом процессе.
При температуре абсолютного нуля и фиксированном давлении термодинамически
равновесной является фаза с минимальным значением G. В точке перехода фазы
с одинаковыми значениями G находятся в равновесии.
19. продолжение
При фазовых переходах I рода может возникать метастабильная фаза, в которойвещество может длительное время, не переходя в устойчивую фазу. Например,
жидкость можно нагреть выше точки кипения или переохладить ниже точки
замерзания.Это связано с особенностями кинетики фазовых переходов. Последние
начинаются с возникновения зародышей новой фазы – появления пузырьков пара
при кипении, микрокристалликов при кристаллизации и т.п. Для образования
Зародышей требуется энергия, которая расходуется на создание поверхностей
раздела фаз. Это может задержать переход материала из метастабильной фазы в
более устоичивую.
При фазовых переходах II рода плотность и термодинамические функции веществ
непрерывны, а скачок испытывают производные этих функций по давлению и
температуре, например теплоемкость при постоянном давлении, магнитные
фазовые переходы, переход
материала из нормального состояния в
сверхпроводящее и пр.
Фазовые переходы первого рода часто являются агрегатными. Признаком того
или иного агрегатного считают значение величины ε( р, Т) – отношение средней
потенциальной энергии взаимодействия молекул в веществе к их кинетической
энергии.
20. Агрегатные состояния
Проблема структуры макротел связана с агрегатным состоянием объекта. Газ –агрегатное состояние вещества, в котором частицы не вязаны или слабо связаны
силами взаимодействия и хаотически движутся, заполняя весь объем. Для газов
ε( р, Т) << 1, при этом тело не обладает определенной формой, и заполняет весь
объемом. Ионизированный газ, в котором плотности положительных зарядов и
отрицательных практически одинаковы, - плазму - считают четвертым агрегатным
состоянием вещества. Газ считают идеальным, если силами межмолекулярного
взаимодействия можно пренебречь. Для сжижения газов используют эффект
охлаждения, происходящий при их расширении без теплообмена с окружающей
средой. Если газовая фаза находится в равновесии с жидкой или твердой фазой
того же вещества то это насыщенный пар.
Жидкости – вещества, сочетающие свойства газов и твердых тел. Для них ε( р, Т)
≈ 1. Тепловое движение молекул (атомов) жидкости представляет собой сочетание
сочетание малых колебаний около положения равновесия и перескоков из одного
положения равновесия в другое.Жидкости практически не сжимаемы. Их испарение
фазовый переход 1 рода и характеризуется энергией – теплотой парообразования.
По мере охлаждения движение молекул жидкости замедляется, а когда они
фиксируются в определенных положениях, жидкость превращается в твердое тело
21. продолжение
Процесс плавления характеризуется теплотой плавления. Внутри жидкости каждаямолекула испытывает притяжение со стороны соседних молекул, равнодействующая
сила равна нулю. Силы притяжения, приложенные к молекуле, лежащей на поверх –
ности жидкости, не скомпенсированы притяжением сверху, поэтому поверхность
жидкости на границе с газом подобна натянутой пленке. Поверхностное натяжение
жидкости – это работа, которую нужно совершить, чтобы увеличить при данной температуре на единицу площадь поверхность поверхности раздела жидкости с ее насыщенным паром. Смачивание – явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или другой жидкости. Оно является результатом молекулярного взаимодействия на границе раздела фаз и обуславливает растекание жидкости по поверхности сопряженного тела, искривление ее свободной по верхности вблизи границы соприкосновения (мениск), пропитывание жидкостью по –
ристых твердых тел и порошков и т.д.
Вязкость – или внутреннее трение – свойство текучих веществ оказывать сопротивление перемещение одной их части относительно другой. Текучесть – величина,
обратная вязкости.
22. твердое тело
.Твердое тело характеризуется стабильностью форм, т.к. образующие его атомы совершают лишь малые(тепловые) колебания около фиксированных положений равновесия.Для твердых тел ε( р, Т) >> 1. Твердые тела относятся к системам сильно взаимодействующих частиц. Физические свойства твердых тел в значительной мере определяются
степенью пространственного упорядочения их частиц.
Кристаллы – твердые тела с трехмерной периодической атомной структурой, имеющие
форму правильных симметричных многогранников. Кристаллизация, т.е. образование
кристаллов происходит при нарушении термодинамического равновесия в маточной
среде: жидкостях (раствор или расплав), газовой фазе (пар) или твердое тело.
Кристаллическая решетка – регулярное расположение в кристаллах частиц (атомов,
ионов, молекул), характеризующееся периодической повторяемостью в трех измерениях. При этом достигается уравновешение сил притяжения и отталкивания, соответствующее минимуму потенциальной энергии твердого тела. Для веществ в конденсированном состоянии (находящихся в жидком и твердом агрегатном состоянии) характерна
согласованность в расположении соседних частиц – ближний порядок, который
проявляется на расстояниях, сравнимых с межатомным. Кристаллические вещества
имеют дальний порядок – строгую повторяемость во всех направлениях одного и того
же структурного элемента на протяжении сотен и тысяч периодов кристаллической решетки. Представление о строении кристалла дает элементарная ячейка - часть атомной структуры кристалла, путем трансляции которой (т.е. переноса в пространстве параллельно самой себе построить всю кристаллическую решетку.
23. продолжение
Ребра элементарных ячеек обозначаютбуквами «a, b, c» и называют периодами кристаллической решетки или (в вектороной форме) векторами трансляции.
Каждая атомная плоскость кристаллической решетки, пересекаясь с осями
координат, отсекает на них отрезки, соответствующие периодам решетки. Величины, обратные длине этих отрезков,
обозначают буквами h, k, l и называют
кристаллографическими
индексами
граней и атомных плоскостей. Большинство кристаллов имеет грани со значениями индексов от 0 до 3, например (100),
(110), (311). Выбор осей координат производят по особым правилам а соответствии с симметрией кристаллов и правилами преобразований симметрии (поворотов,отражений,параллельныхпереносов пр
24.
25. продолжение
Любому атому в элементарной ячейке кристалла соответствует трансляционно-эквивалентныйатом в каждой другой ячейке.По признаку точечной симметрии элементарной ячейки все крис таллы группируются в семь сингоний –подраз –
делений кристаллов, различающихся формой
элементарной ячейки (см. выше). Сингонии ха –
рактеризуются длинами ребер a, b, c ячейки и
углами α, β, γ между ними. Каждая сингония, в
свою очередь, включает несколько пространственных групп симметрии. Всего насчитывается
230 пространственных групп. Структура любого
из многих тысяч известных кристаллов соответтвует какой-либо из этих групп.
26. продолжение
Твердые материалы являются, как правило, поликристаллическими, т.е. состоят измножества беспорядочно ориентированных мелких монокристаллических зерен кристаллитов. Крупные одиночные кристаллы называют монокристаллами. При
неравновесной кристаллизации форма кристаллов отклоняется от формы правильного многогранника. Эту особенность используют для выращивания монокристаллов
повторяющих форму технических изделий – труб, пластин и т.п.
Для кристаллов характерно упорядоченное расположение атомов, ионов или
молекул; однако оно, как правило, не совершенно из-за разнообразных дефектов
кристаллов.Нарушение порядка неустранимо, что связано с непрерывным тепловым
колебанием. Элементов решетки. Частоты колебаний зависят только от массы эле ментов решетки и от действующих между ними сил, амплитуда колебаний растет с
ростом температуры.Колебания не прекращаются даже при абсолютном нуле, ибо
материя и движение неотделимы.
Элементы кристаллической решетки в разных направлениях находятся на разном
расстоянии, поэтому физические свойства в разных направления различны анизотропия кристаллов. При нагревании кристаллы расплавляются. Четко опредеопределенная точка плавления–это температура, при которой амплитуда колебаний
элементов решетки достигает такой величины и соседние элементы решетки начиначинают сталкиваться настолько
сильно, что кристаллическая
решетка
разрушается. Возникает жидкость. Анизотропия, как правило, иччезает.
27.
Особое положение занимает поверхность. Свойства поверхности отличаются отсвойств вещества в объеме тела. Поверхностные явления используют для улучше ния технологии переработки материалов и повышения работоспособности технических изделий.
Полиморфизм – свойство некоторых веществ существовать в нескольких кристаллических модификациях с разной структурой.
Устойчивость кристаллической структуры зависит от типа связей между частицами в кристалле
Существуют состояния, отличающиеся от классических агрегатных состояний.
Стеклообразное состояние – промежуточное положение между кристаллом и
жидкостью (нет дальнего порядка, но твердое) – стекло, многие окислы и пр.
Промежуточное состояние между кристаллическим и газообразным (положение молекул упорядочено, но они совершают и вращательное движение при некоторых
температурах).
Сложные тела могут возникать путем увеличением числа атомов в молекулах –
макромолекулы (белок, целлюлоза, нейлон и т.п.) объединяют тысячи и миллионы
атомов. С увеличением числа атомов в молекуле проявляются качественно новые
физические и химические свойства. Макрамолекулярные вещества не относятся ни
к одному из агрегатных состояний.
28. Типы кристаллических решеток
Исходя из вида элементов решетки действующих между нимисил кристаллы можно разделить на четыре большие группы:
1. Ионные кристаллы (ионная решетка) - содержит в качестве
элементов решетки ионы (положительные и отрицательные) с
соответствующим кулоновским взаимодействием.
29.
Большая частьсолей, окислов,
сульфидов образуют ионные
решетки. Электрические силы
между ионами
велики, поэтому
такие кристаллы
Сульфит цинка
Сульфат кальция
плавятся при высоких температурах, их летучесть незначительна. Почти все ионные кристаллы диэлектрики. Многие
ионные кристаллы являются сильными магнетиками, к таким
относятся ферриты – окислы металлов с общим составом
Ме(2+)Fe2(2+)O4(2-).
30.
2. Атомные кристаллы (атомная решетка) – состоит изнейтральных атомов неметаллических элементов, удержи вающих друг друга силами ковалентной связи. К таким крис –
таллам принадлежат алмаз, графит. В
решетке алмаза каждый атом углерода
окружен четырьмя другими атомами,
находящимися от него на одинаковом
расстоянии (~1,54 Ǻ), так что эти 4 атома
образуют вершины тетраидра в центре Алмаз
Графит
которого находится рассматриваемый атом. Каждый из этих
четырех атомов находится в центре другого тетраидра. В алмазе не имеется молекул, так как все атомы углерода равноравномерно связаны между собой.
Связь между атомами углерода в плоскости такая же боль шая, как и в алмазе.
31.
3. Молекулярные кристаллы (молекулярная решетка) – элементами решетки являются молекулы, связанные силамиВан-дер-Ваальса или силами водородной связи. Молекулы,
находящиеся в узлах решетки, относительно самостоятельны
и связаны между собой слабыми
Ван-дер-Ваальсовыми силами, а
иногда водородными связями.
Поэтому кристаллы с молекулярной решеткой имеют довольно
Двуокись
Карбамид
низкую температуру плавления и
углерода CO(NH(2))(2)
легко испаряются. Имеются молекулярные кристаллы, эле менты которых связаны ориентированными весьма слабыми
силами химической связи.
К таким веществам относится, в частности, лед. Его молеку –
лы соединены между собой посредством водородных связей.
Молекулы воды в кристалле упакованы неплотно, но даже
В столь рыхлой структуре связи, исходящие из атомов
кислорода, ориентированы.
32.
В кристалле льда каждый атом кислорода окружен в тетраэдрическомпорядке четырьмя атомами водо –
рода. Два из них лежат на расстоянии 1 ангстема (силы валентности),
два других, связанных слабыми силами водородных связей, находятся
На расстоянии 1,7 ангстрема.
4. Металлические кристаллы (решетка металлов) – элементы
решетки положительные ионы металла, связанные между
собой свободными электронами. Металлическая связь занимает промежуточное положение между ионной и ковалентной
связями. В узлах решетки находятся ионы (ионный характер
связи), а связь осуществляется электронами, принадлежащих
одновременно многим атомам (ковалентный характер связи).
Однако в металлах электроны связывают не по одной паре
атомов, а принадлежат одновременно многим атомам.
33. Дефекты кристаллической решетки.
В идеальном кристалле элементы решетки расположены встрогом порядке, распространенном на весь кристалл, но
такие кристаллы не существуют в действительности. Кроме
беспорядка, связанного с тепловым движением, в реальном
кристалле неизбежны отклонения другого рода, нарушающие
порядок и они означают уже настоящие дефекты решетки.
Особо важную роль играют незанятые узлы решетки (вакантные узлы, дырки). За их образование в первую очередь также
ответственно тепловое движение (энергия отдельных элементов решетки становится достаточно большой и они вырыва –
ются из предписанного им места, оставив после себя «дырку»
(пустоту).
34.
Если дефект образуется вблизиповерхности кристалла, то он
достигает и может
принять
участие в дальнейшем росте
кристалла (дефект по Шоттки).
Кристалл NaCl
Если элемент решетки покидает
свое место внутри кристалла, то
он вклинивается между другими
элементами решетки, вызывая
образование дырки и межреше –
точное замещение (дефект по
Кристалл AgBr
Френкелю).
Дырки могут блуждать, с поверхности могут переходить в
глубину кристалла, создавая т.н. дефекты конфигурации.
35.
Дефекты решетки возникают также в том случае, если вотдельных ее узлах или между ними находятся посторонние
атомы или ионы. В т.н. бертоллидах значительное отклонение
от стехиометрии не оказывает скачкообразного изменения
на химические свойства в отличии от дальтонидов. Так в хлористом натрии при отличии отношения масс его составных
частей от 22,989 : 35,453 кроме свойств соли обнаруживаются
свойства металлического натрия или хлора.
Отклонения от стехиометрии имеют существенное значение
для кристаллов металлических сплавов.
Дырки и особенно межрешетчатые включения локально искажают кристаллическую решетку, что влияет на механические
свойства, окраску и т.д.
36.
Наряду с локальными дефектами решетки существуют т.н.дислокации (замещения), образующиеся по одному какому-либо направлению вследствие
неправильного положения мно –
гих элементов решетки (линейные дефекты решетки). Дислокации возникают в процессе кристаллизации под влиянием загрязСхемы различных
нений, а также при деформации
смещений в одной
кристалла. Реальные кристаллы
плоскости решетки
состоят из мозаичных блоков, зерен (из-за дислокаций), нес –
колько отличающихся по ориентации, что существенно влияет на механические свойства. Многие твердые вещества в
действительности являются поликристаллическими.
37.
В случае образования сплавов могут реализоваться и другие точечные дефекты кристал –лической решетки, например, химические
примеси. Это инородные атомы.
Если эти атомы замещают атомы основного,
то они называются примесями замещения
(рисунки «а» и «б»). Если они внедряются в
Промежутки между узлами кристаллической
решетки, то их называют примесью внедрения
(рисунок «в»).
38. Силы в кристаллической решетке
Между элементами кристаллическойрешетки действуют большие силы
притяжения. Следствием этого яв ляется когезия (сцепление), которая
делает кристалл твердым и проч –
ным. Однако кристаллы обладают
большим сопротивлением и на сжатие, т.е. в кристалле действуют зна –
чительные силы отталкивания. Природа сил зависит от рода вещества.
В покое равнодействующая сил равна нулю. Результирующая сил при Силы, действующие между
меньших расстояниях – сила оттал элементами решетки
кивания, при больших – сила притяжения.
39.
С увеличением межатомного расстояния сила притяжениярастет только до определенного предела. При расстояниях,
больших α’ сила притяжения уменьшается и этой силы дос –
точно, чтобы разрушить кристалл - прочность на разрыв.
Как видно из рисунка, кривая равнодействующей силы, действующей на атомы, ассиметрична, т.е. сила, действующая на
атом, больше силы притяжения. Вследствие этого средняя
точка колебаний с возрастанием их амплитуды сдвигается из
положения А в сторону больших расстояний между атомами,
т.е. температурное расширение кристаллов – следствие ас симетрии кривой результирующей силы. Чем ниже температура, тем меньше ассиметрия. Коэффициент линейного расши рения (β) тем больше, чем меньше крутизна кривой. Ясно, что
чем больше β, тем ниже температура плавления кристалла.
40. Металлы и их сплавы.
В изолированных атомах щело- чных металлов один валентныйэлектрон, совокупность которых
в кристалле образуют газ сво –
бодных электронов. Щелочные
металлы имеют объемноцент –
рированную кубическую кристаллическую решетку (о.ц.к.).
В ней кристаллизуются многие
другие металлы (на рис. атомы
Решетка типа W или
изображены сферами, размеры котоо.ц.к. решетка
рых здесь и далее для наглядноси
уменьшены по сравнению с размерами элементарной ячейки).
41.
Еще чаще металлы обладаютгранецентрированной кубической (г.ц.к.) решеткой, в которой
кристаллизуются, например,
медь и алюминий.
На
рисунках представлено
положение атомов и соответствующее им пространственное
заполнение
кристалла при
наиболее плотной упаковке в
г.ц.к. решетке.
42.
В качестве еще одного примераследует назвать магний; он кристаллизуется в гексагональной решетке, в так называемой компактной гексагональной шаровой упа –
ковке.
На рисунках представлена решетка
типа Mg.
Приведенные три кристаллические решетки наиболее часто встречающиеся
у металлов структурные типы; в них
кристаллизуется более ¾ всех чистых
металлов.
43.
Решающее значение для технического применения металловимеет их исключительная способность образовывать сплавы.
Сплавы позволяют получить такой широкий спектр свойств,
который едва ли достижим другим способом.
Сплав – смесь нескольких металлов, образующих связное тело (смесь порошков – не сплав). В отношении растворимости
два предельных случая:
1. Компоненты сплава не образуют твердых растворов (гетерогенная смесь). Пример: медь – свинец.
2. Компоненты сплава обладают неограниченной раствори –
мостью (гомогенный сплав – твердый раствор).
Возможно образование соединений с кристаллической решеткой, отличной от решеток исходных компонентов. В этом случае – интерметаллические соединения или промежуточные
Фазы. Пример: PbMg(2).
44. ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ ОБЩИЕ УСЛОВИЯ РАВНОВЕСИЯ
Многие металлы и сплавы в зависимости от внешних условиймогут иметь различные кристаллические решетки и разную
степень дефектности. Каково состояние системы при данных
условиях?
Под системой будем понимать совокупность веществ, в дан –
ном случае металлов, находящихся в физико-химическом взаимодействии. Любую систему можно разделить на произвольно малые объемы. Если отдельные объемы не различаются
по составу и свойствам, систему называют гомогенной, в противном случае она будет гетерогенной. Взятые в отдельности
гомогенные области называют фазами. Гомогенная область
всегда однофазна (слиток меди, твердый раствор Cu – Al.
45.
Гетерогенная смесь всегда многофазна ( смесь жидкой и твердой меди и т.п.). В приведенных примерах на первый взгляд
нельзя обнаружить связи между числом фаз системы и чис –
лом ее компонентов.
Состояние системы считается заданным, если известны хи –
мический состав, давление Р и температура Т. Обозначим через К число компонентов, а через Ф – число фаз. Такие величины, как объем V, масса М, энергия U, энтропия S, которые
пропорциональны количеству вещества, называют экстенсивными величинами, те же, которые не удовлетворяют этому
условию, например, плотность ρ или температура Т – интен –
сивные величины. Частное двух экстенсивных (М/V = ρ) – интенсивная величина. Экстенсивная величина для гетерогенно
й смеси получается суммированием составляющих:
Ψ = ΣΨi
46.
Как показывает термодинамическое рассмотрение, для рав –новесия недостаточно, чтобы какая-нибудь из функций сос –
тояния (скажем, энергия или энтропия) имели экстремальное
значение. Однако принцип экстремальности применим в том
случае, когда на сравниваемые состояния наложены определенные ограничения (например, состояния с одинаковым давлением и постоянной температурой). При таких ограничени –
ях равновесное состояние системы определяется условием
минимума термодинамического потенциала Гиббса:
G = U + pV – TS = H – TS,
Н – этальпия. Следовательно, в системе с данным количеством вещества могут происходить лишь такие такие процессы,
при которых термодинамический потенциал не растет. Они
прекращаются, как только G достигает минимума – это означает наступление термодинамического равновесия.
47.
В случае, если заданы не «р» и Т, а используются другие пе –менные, целесообразно применять другие функции. Напрмер,
для заданных V и Т используют F – свободную энергию (Гельгольца): F = U – TS. Найдем дифференциал обеих частей:
dF = dU - TdS - SdT ≤ - pdV – SdT.
Неравенство dU - TdS ≤ - pdV – результат совместного анализа 1 и 2 Начал термодинамики. Поскольку dV = dT = 0, то и
dF = 0 и, следовательно, F → min. Это означает, что термодинамическому равновесию из всех состояний при данных V и
Т отвечает лишь то, которое обладает минимальной свобод –
ной энергией.
48. МОДЕЛИРОВАНИЕ СТРУКТУРЫ МАТЕРИАЛОВ
Моделирование – метод научного исследования, состоящий в замене изучаемого объекта ему подобным, но более простым объектом – моделью. Разработка новыхматериалов, как правило, начинается с построения моделей их структуры на атомном, молекулярном и макроуровнях. Различают функциональное моделирование
материалов, моделирование их атомно-молекулярной структуры и структуры компо
зитов на нано-, микро- и макроуровнях. В порядке усложнения эксплуатационных
функций материалы образуют ряд: однофункциональные – многофункциональные
– активые - «умные». Многофункцмональные материалы выполняют в машинах не
одну, а несколько функций. Например, бронза является конструкционным и триботехническим материалом в машиностроении. Многие пластмассы используют для
защиты металлических деталей от коррозии и для создания в изделии электрической изоляции. Активные материалы, выполняя в машинах присущие обычным техническим материалам функции, оказывают на сопряженные части машин и окружающую среду воздействия физической, химической или биологической природы.
Примеры активных материалов. Магнитострикция – изменение размеров и формы
кристаллического тела при намагничивании. Магнитострикционные металлические
материалы, проявляющие эффект Виллари, обратный магнитострикции, являются
активными материалами.При большоим механическом нагружении в них генериру ются магнитные поля,которые сигнализируют о высоких уровнях напряжений в узле
49.
Химическую активность проявляет фильтрующий материал на основе углеродной ткани, пропитанной комплексонами. Они вступают в реакцию с катионами, образуя с ними устойчивыекоординационные соединения. Активный материал механически улавливает содержащиеся
в фильтруемой жидкости твердые частицы загрязнений и химически связывает сольватиро ванные в нем ионы тяжелых металлов, которые являются очень опасны в экологическом
смысле и трудноуловимы. Пример биологически активного материала – носитель микроор –
ганизмов в биологических фильтрах.«Умные» материалы – это активные материалы с обратной связью. Обратная связь – воздействие нового состояния окружающей среды,измененной
материалом, на интенсивность изменяющихся свойств. Одна из современных идей создания «умного» материала состоит в предании ему способности производить самодиагности –
ку (мониторинг) и осуществлять самовосстановление. Так, при обнаружении микротрещины
в «умном» материале срабатывает механизм самовосстановления путем перераспределе ния вещества. Разрабатываются методы самозалечивания микротрещин с помощью частиц
нанометрового диапазона. Моделирование физико-химической структуры материала бази –
руется на методах квантовой механики. Основы квантовой механики были заложены в нача –
ле ХХ века. Планк, Эйнштен, Бор показали, что электроны и атомы имеют стационарные и
возбужденные состояния, переходы между которыми сопровождаются излучением или пог –
лолощением квантов энергии (света). В 1924 г. Луи де Бройль описывать свободное движе –
ние частицы (с энергией Е и импульсом Р) той же функцией ψ(r, t) = C exp I (Pr – Et) / ħ, что и
перемещение волны в пространстве и времени t. Здесь r –радиус–вектор частицы, i –мнимая
единица, С – постоянный множитель, ħ – постоянная Планка. Забегая вперед, заметим, что
тем самым он предсказал дифракцию таких частиц при рассеянии на кристаллах. В 1926 г.
Шредингер разработал дифференциальное уравнение, решением которого являются ψ(r, t) ,
50.
получивших название волновых функций и уровни энергий исследуемой системы частиц.Были разработаны методы квантовой химии, составившие основу моделирования материалов. Гайтлер и Лондон на примере молекулы водорода дали квантово-механическую интерпретацию ковалентной связи. Их подход в дальнейшем получил название метода валентных
связей. С его помощью удалось получить приближенные решения уравнений Шредингера
для многоатомных молекул. Позднее был разработан метод молекулярных орбиталей, который широко применяется при моделировании материалов, позволяя рассчитать волновые
функции, энергетические уровни и свойства молекул. Одновременно Хартри и Фок разработали метод самосогласованного поля. Название этого метода связано с тем, энергетическое
состояние каждой частицы, входящей в молекулу,определяется усредненным полем,которое
создается всеми остальными частицами, т.е. состояние молекулы согласуется с состоянием
ее атомов, ионов, электронов. Был разработан метод конфигурационного воздействия. С его
помощью можно решить уравнение Шредингера для молекулы, находящейся в основном и
возбужденном состоянии. Наконец, была разработана теория кристаллического поля,согласно которой низшие по энергии состояния молекулы описываются как состояния одного атома
находящегося в электрическом поле, созданном другими частицами. Прогресс вычислительной техники стимулировал развитие методов квантовой химии и позволил с высокой точностью прогнозировать свойства «проектируемых» молекул.
Основы математических методов квантовой химии и их применение в компьютерных экспериментах составляют содержание специальных курсов для студентов соответствующих специальностей.
Моделирование композиционных материалов, являющихся структурно-неоднородными средами, базируются на макро- и микромеханическом подходах.
51. Механические свойства
Механические свойства материалов характеризуют возможность их использования в изделиях, эксплуатируемых в условиях воздействия механических нагрузок. Основными показателями таких свойств служат параметры прочности, твердость и триботехнические характеристики. Они зависят нетолько от природы материалов, но и от формы, размеров и
состояния поверхности образцов и условий эксплуатации образцов.
Прочность – свойство материалов сопротивляться разрушению, а также необратимому изменению формы образца под
воздействием внешних нагрузок. Прочность определяется силами взаимодействия атомов, составляющих материал.
52.
Критическому расстоянию α’ соответствует максимальная поабсолютной величине сила притяжения F(γ). Если при растяжении образца внешняя сила, действующая на пару атомов,
превосходит F(γ), атомы будут удаляться друг от друга. Чтобы
разделить образец на части, такая сила должна действовать
на каждую пару атомов. Напряжение σТ ,отвечающее силе
F(γ), соответствует теоретической прочности. Если в твердом материале на участке, размер которого соизмерим с межатомным расстоянием, действует напряжение, большее σТ, то
на этом участке образуется трещина. Напряжения особенно
велики у краев трещин, где концентрация напряжений растет
с увеличением размера трещины. Рост трещины продолжается до тех пор, пока в результате слияния с другой трещиной
одна из трещин не распространится на все сечение образца,
что приведет к его разрушению.
53.
Деформирование - изменение относительного расположениячастиц в материале. Наиболее простые его виды – растяжение, сжатие, изгиб, кручение, сдвиг. Деформация - изменение
формы и размеров образца в результате деформирования.
Параметры деформирования - относительное удлинение:
ε = (L – L0)/L0, (L и L0 - длина образца исходная и после деформирования, угол сдвига - изменение прямого угла между
лучами, исходящими из одной точки в образце, при его деформировании. Для описания деформирования твердых тел
произвольной формы используют тензор деформации. Его
образуют шесть величин: относительные удлинения микро –
объема материала в направлениях осей прямоугольной сис –
темы координат и углы сдвига этих осей при деформировании
тела. Деформацию называют упругой, если она исчезает после снятия нагрузки, или пластической, если не исчезает.
54.
55.
Из-за дефектов в материале экспериментальная прочностьзначительно меньше теоретической, поскольку нагрузка распределяется неравномерно по сечению образца. Материалы
характеризуются технической прочностью, основные характеристики которой удобно рассмотреть с помощью выше приведенной диаграммы растяжения. Предел пропорциональностиэто характеристика, обозначаемая σПП , является верхней границей области напряжений, где реализуется закон Гука.
Предел упругости - напряжение, при котором остаточные деформации достигают значения, установленного техническими
условиями (σУ ). Он ограничивает область упругой деформа –
ции. При простом растяжении (сжатии) σ = Е ε, где Е – модуль
Юнга или модуль продольной упругости, который характеризует сопротивление материалов упругой дефоормации (растя
жению, сжатию); ε – относительная деформация.
56.
При сдвиге в материале по направлению сдвига и по нормалик нему действуют только касательные напряжения τ = Gγ, где
G – модуль сдвига, характеризующий упругость материала
при изменении форму образца, объем которого остается постоянным; γ – угол сдвига. При всестороннем сжатии в мате –
риале по всем направлениям действует нормальное напря –
жение σ = КΔ, где К – модуль объемной упругости, который
характеризует сопротивление материала изменению объема
образца, не сопровождающемуся изменением формы; Δ –
относительное объемное сжатие.
Постоянной величиной, характеризующей упругость материала при одноосном растяжении, является коэффициент Пуассона: ν = l ε´l/ ε, где ε´ - относительное поперечное сжатие, εотносительное продольное удлинение образца.
57.
Для однородных изотропных тел модули упругости одинаковыпо всем направлениям и связаны соотношениями:
G = Е/[2(1 + ν)],
К = Е/[3(1 - 2 ν)].
Следовательно, упругие свойства изотропных материалов определяются двумя независимыми постоянными «Е» и «ν».
Для большинства металлов ν = 0,3. Для несжимаемого мате-
риала ν = 0,5, поэтому G = Е/3 и К → ∞. У анизотропных ма –
териалов «Е», «G» и «ν» зависят от направления действия
нагрузки.
Предел текучести – напряжение, при котором в образце начинает развиваться пластическая деформация. Она отвечает
нижнему положению площадки текучести на диаграмме σ =
= f (ε) для материалов, разрушению которых предшествует
заметная пластическая деформация (либо условный предел
текучести, определяемый ТУ).
58.
Предел прочности – напряжение, соответствующее максима –льному (в момент разрушения образца) значению нагрузки.
Отношение наибольшей силы, действующей на образец, к исходной площади его поперечного сечения называют условным пределом прочности, а также временным сопротивлением, разрушающим напряжением. Истинный предел прочности – отношение растягивающей силы непосредственно
перед разрывом к наименьшей площади поперечного сечения образца в шейке.
59. Динамические характеристики
Динамическая прочность – сопротивление материала нагрузкам, значение, направление и точка приложения которыхбыстро изменяются во времени. При этом появляется запаздывание текучести - явления, при котором при мгновенном
(очень быстром)приложении нагрузки, вызывающей текучесть
материала при статическом напряжении, пластическая деформация возникает не тотчас, а по истечении некоторого промежутка времени – периода запаздывания текучести t. Если нагрузку снять до истечения этого периода, остаточная деформация не возникает, т.е. материал деформируется упруго.
Ударная вязкость измеряется работой разрушения надрезанного образца при ударном изгибе и служит для оценки t.
60.
Усталость - процесс накопления повреждений в материале под длительным действием циклически изменяющихся напряжений σ < σУ. Усталостное напряжение кристаллических материалов вначалепроявляется в локальном увеличении плотности дислокаций
и вакансий и концентрации напряжений. Наследующей стадии
в твердом теле возникают трещины, скорость роста которых зависит от накопления повреждений, что обуславливает уменьшение прочности тела.
Выносливость - свойство твердых материалов противостоять
61.
усталости. Усталостный процесс характеризуется зависимостью между накопленным в образце повреждением и числом Nциклов нагружения, график которой называют кривой усталости. Цикл нагружения – совокупность переменных значений
напряжений и деформаций, происходящих за один период их
изменения, повторяющийся в процессе длительного нагружения образца. Предел выносливости – наибольшая величина
напряжения σR, которая не приводит к разрушению образца
при базе испытаний N(б).
На выносливость образца влияют концентрация повреждений
на поверхности образца, температура и физико – химическая
активность среды.
Усталостные повреждения зарождаются в местах нарушения
регулярности структуры материала, из которого изготовлен
образец. Характеристики усталости подчиняются теории ве –
62.
Твердость является механической характеристикой материалов, комплексно отражающей их прочность, пластичность, атакже свойства поверхностного слоя образцов. Она выража –
ется сопротивлением материала местному пластическому деформированию, возникающему при внедрении в образец более твердого тела – индентора. В зависимости от способа
внендрения и свойств индентора твердость материалов оце –
нивают по различным критериям, в соответствии с одним из
трех методов: а) вдавливание индентора, б) динамические
инденторы, в) царапание. Существует несколько ГОСТов определения твердости материалов (см. ниже диаграмму).
63.
64.
Триботехнические характеристики содержат информацию обэффективности применения материалов в узлах трения. Проблемы триботехники считают одними из важнейших в машиностроении.
Внешнее трение - сопротивление относительному перемещению двух соприкасающихся тел, находящихся в одной или в
разных фазах, в плоскости их касания, которое сопрвождается рассеянием энергии.
Изнашивание - процесс разрушения и отделения материала с
поверхности твердого тела и (или) накопления его остаточной
деформации при трении, проявляющейся в изменении размеров и (или) формы тела. Износ - результат изнашивания.
Смазывание - действие смазочного материала, в результате
которого уменьшается сила трения и (или) интенсивность
изнашивания.
65.
Основные триботехнические характеристики твердых материалов - износостойкость, прирабатываемость и коэффициенттрения.
Износостойкость – свойство материала оказывать сопротивление изнашиванию в определенных условиях трения. Вели –
чину износа выражают в единицах длины, объема или массы.
Отношение величины износа «u» к интервалу времени «t», в
течение которого он возник, или к пути «L», на котором происходило изнашивание, представляют собой соответственно
скорость изнашивания ν = u/t и интенсивность изнашива –
ния I = u/L. Износостойкость материалов оценивают величи –
ной, обратной скорости и интенсивности изнашивания. Выделяют три стадии изнашивания: I – начальное изнашивание,
Наблюдаемое при приработке деталей узлов трения, которое
сопровождается изменением геометрии поверхности трения,
66.
структуры поверхностных слоев материала и протекает с замедляющейся скоростью; II – установившееся (нормальное)изнашивание, для которого характерна небольшая и постоянная скорость изнашивания, III – резкое возрастание скорости
изнашивания (катастрофическое изнашивание).
Прирабатываемость – свойство твердого материала уменьшать силу трения, температуру и интенсивность изнашивания
в процессе приработки, т.е. начальный период трения пары.
Обеспечение износостойкости связано с предупреждением
катастрофического изнашивания. Существует классификация
видов изнашивания (абразивное, адгезионное, усталостное и
прочие). Основная причина всех видов изнашивания – работа
сил трения. Как правило, предсказать триботехнические ха –
рактеристики материалов, зная другие параметры механических свойств (напр., деформационно-прчностные) нельзя.
67. Напряжения и деформации
При нагружении в металлах и сплавах возникают механические напряжения, определяющие напряженно-деформированное состояние. Равновесное состояние материала можетстать неравновесным вследствие неравномерного нагревания, неоднородных структурных превращений в материале
или под воздействием физических полей. В зависимости от
масштаба элементов структуры материала, на которых локализованы напряжения, последние разделяют на три категории: микронапряжения 1-го рода, уравновешенные в объеме
всего образца; 2-го рода, уравновешенные в объеме кристаллитов (зерен) или их частей и 3-го рода, локализованные в
объеме кристаллической ячейки при нарушении ее порядка.
68.
С возрастанием механических нагрузок напряженно-дефор мированное состояние металлического материала изменяется следующим образом: вначале возникает упругая деформация, затем она превращается в пластическую и, наконец, припревышении определенного порога напряжений наступает
разрушение материала.
Механизм упругой деформации металлов состоит в незначи –
тельном и полностью обратимом смещении атомов, которое
нарушает баланс сил их взаимодействия в кристаллической
решетке.
Пластичческая деформация монокристаллов металла связана с необратимыми смещениями атомов в его кристалличес –
кой решетке, в результате которого части кристалла сдвига –
ются относительно друг друга (скольжение) или перестраиваются в кристаллическую структуру, зеркально симметричную
69. Схема деформаций металла при сдвиге: а) – исходный кристалл; б) – упругая деформация; в) – скольжение после достижения предела
упругости70. Схема деформаций металла при сдвиге: г) проявление сдвига; д) двойникование (пунктиром обозначены плоскости скольжения и
двойникования)71.
В идеальном кристалле, не имеющем дефектов структуры, длясдвига атомного слоя на одно межатомное расстояние требу –
ются очень большие касательные напряжения, вызывающие
одновременный разрыв связей у всех пар атомов в плоскости
скольжения. Это критическое напряжение соответствует теоретической прочности кристалла:
τ(к) = σ/2π = 0,16σ,
где σ – модуль упругости при сдвиге.
В технических металлах для сдвига кристаллов на одно межатомное расстояние требуется напряжение в ~ 1000 раз меньшее, что объясняется наличием дефектов структуры.
72. Термическая обработка
Термическую обработку мы разберем на примере стали – широко широко используемого материала. Термической обработкой называют процесс , состоящий из операций нагревания изделий и заготовок до определенной температуры, вы –держке при этой температуре и охлаждении с заданной ско –
ростью. Термическая обработка позволяет изменять в желательном направлении структуру и свойства металлического
материала, причем диапазон изменений может быть очень
широким. Термическую обработку часто сочетают с химичес –
ким воздействием или пластической деформацией металла,
что расширяет возможности термической обработки. Т.о. основана на протекании процессов перекристаллизации.
73. Характерный вид графика термической обработки металлической детали
Основными факторами любоговида термической обработки
являются температура и вре –
мя, поэтому удобно процесс
представлять в виде графика,
показывающего
изменение
температуры во времени (рис.)
Скорости нагревания или ох –
лаждения соответствуют тан –
генсу угла (α, β) наклона линий
зависимости
температуры
изделия от времени. Общая
длительность процесса термообработки складывается из
времени нагревания изделия
74.
от исходной температуры Т(0) до заданной температуры Т(1),времени выдержки при этой температуре и времени охлаждения до заданной температуры Т(2). Далее деталь выдерживают при температуре Т(2) и охлаждают до температуры Т(0). В
результате термической обработки в металлах и сплавах происходят структурные изменения, обуславливающие равновесное (стабильное) или неравновесное (метастабильное) состояния их структуры. Существуют чисто термическая обработка и ее сочетание с пластической деформацией и химическим
воздействием. Наибольшее распространение получили сле –
дующие виды термической обработки.
Отжиг 1-го рода- нагревание, выдержка, охлаждение изделия
с целью снятия остаточных напряжений и искажений кристаллической решетки.
Отжиг 2-го рода- нагревание выше температуры фазового
75.
превращения и медленное охлаждение, приводящее сплав вравновесное состояние.
Закалка- нагревание до температуры более высокой, чем тем
пература фазового превращения, выдержка при этой темпера
туре и быстрое охлаждение, после которого фиксируется состояние сплава, соответствующее температуре фазового превращения.
Отпуск- нагревание закаленного изделия до температуры ниже критической температуры фазового превращения и охлаждение. Это приводит к снятию остаточных напряжений после
закалки. Отпуск, проводимый при комнатной температуре или
несколько ее превышающей, называют старением.
76. Наноматериалы
Наноструктурные материалы, или наноматериалы, содержат структурные элементы (кристаллы, волокна, слои, поры)размер которых составляет 0,1 … 100 нм, по крайней мере, в
одном направлении. Благодаря уникальным свойствам наноматериалов проблемы их создания стали предметом актуального и перспективного направления современного материаловедения. Наноматериалы получают нетрадиционными методами, совокупность которых получило название нанотехнология.
История наноматериаловедения началась с идей американского физика Р.Фейнмана, который предложил «конструировать материалы методами молекулярной архитектуры (1959 г)
77.
В 1969 г. советский физикохимик П.А.Рибиндер выдвинул концепцию упрочнения материалов посредством измельчения ихструктурных компонентов. Термин «нанотехнология» впервые
был использован в 1974 г. японцем Танигуче при обсуждении
проблем обработки хрупких материалов. Американский материаловед Глейтер ввел (1981) понятие «нанокристаллические
материалы» и предложил метод их получения путем испарения – конденсации металлов, вакуумной консолидации in situ
(месте нахождения) ультрадисперсных частиц и формировании из них материалов при высоких давлениях.В это же время
при производстве транзисторов были впервые использованы
тонкие пленки толщиной порядка 10 нм. Событием стало создание на этой основе так называемого полевого транзисторауниполярного транзистора, в котором изменение тока происходит под действием перпендикулярного ему электрического
78.
В 1981 г. был создан сканирующий туннельный микроскоп, спомощью которого стало возможно изучать материалы в на –
нометровом масштабе.
Интерес к наноматериалам вызван следующим:
методы нанотехнологии позволяют получить принципиально
Новые материалы с характеристиками, значительно превосходящими сегодняшний уровень лучших материалов;
нанотехнология объединила усилия специалистов в области
физики, химии, материаловедения, биологии, медицины, компьютерной техники, экономики, социологии и пр., что не могло
не привести к замечательным результатам;
решение проблем нанотехнологии выявило много пробелов в
теоретическом и прикладном материаловедении.
Во многих странах, в том числе и в России, приняты государственные программы, предусматривающие развитие наномате
79.
В настоящее время считают приоритетными направлению:Молекулярный дизайн материалов с заданными свойствами;
Нанопроцессоры (устройства, выполняющие арифметические
и логические операции, заданные программой преобразования информации) с низким уровнем энергопотребления;
Нанопроцессоры с рекордной производительностью;
Миниатюрные запоминающие устройства с огромным объемом памяти;
Новые лекарственные препараты, применяемые в сверхмалых дозах и методы их адресной доставки к определенным
органам;
Новые методы мониторинга (оперативного контроля) окружающей среды и организма человека с ромощью наносенсоров
(чувствительных элементов).
Оборот мирового рынка наноматериалов в 2002 достиг $300
80. Классификация наноматериалов
Консолидированные наноматериалы - конструкционные материалы, разновидности фольги и покрытия из металлов и ихсплавов, состоящие из наночастиц, прочность связи между
которыми достаточно высока. Конструкционные материалы
получают методами порошковой металлургии, разновидности
фольги – интенсивным пластическим деформированием тон –
кого слоя наночастиц, покрытия – конденсацией металлов из
газовой фазы. Полупроводниковые наноматериалы используют в консолидированном виде и в виде отдельных наночастиц, вхоодящих в состав коллоидных систем.
Фуллерены - новая (обнаружена в 1980 –е гг.) аллотропная
форма углерода, имеющая шарообразые молекулы С(60) или
81.
С(70). Их поверхность состоит из 5- и 6-угольников, образованных атомами С. Диаметр полой молекулы С(60) близок к 1нм.
Название фуллеренам дано по имени американского архитектора Р.Б.Фллерона, разработавшего конструкцию куполообразной крыши («геодезический купол»), составленный из 5и 6-угольников, наподобие футбольного мяча. В 1991 г. япо –
нец С.Ишима обнаружил углеродные нанотрубки - тубулены в
продуктах электродугового испарения графита.
Нанопористые материалы различной природы характеризуются наличием в их структуре пор размером менее 100 нм. Их
основное назначение – системы фильтрования, а именно
мембранные фильтроэлементы.
Катализаторы, используемые при гетерогенном (контактном)
катализе, тем более активны, чем больше их удельная поверхность – это нанодисперсные частицы активного вещества,
82.
Супрамолекулярные структуры в большей мере (лат. supra –над, выше) – наноструктуры, получаемые в результате так
называемого нековалентного синтеза полимеров с образова –
нием слабых (ван-дер-ваальсовых, водородных и др.) связей
между молекулами и их ансамблями. Чаще всего их модифицируют ионами металлов, придавая фотохимическую, электрохимическую активность и другие свойства.
Дендримеры - (от греческого dendr – дерево) высокомолеку –
лярные структуры, состоящие из центральной молекулы, от
которой растут и разветвляются макромолекулярные ветви.
Дендримеры имеют нанометровые размеры, в их структуре
есть полости («молекулярные контейнеры»), в которые можно
помещать наночастицы, например, лекарственных веществ.
Таким образом, удается адресно доставлять лекарства к
заданным органам человека.
83. Свойства наноматериалов
Свойства наноматериалов в большой мере определяютсяразмерными эффектами – явлениями, которые имеют место,
когда размеры наночастицы соизмеримы с одной из характерных длин – длиной свободного пробега носителей заряда,
длиной волны де Бойля, диффузной длиной и т.д. Именно
размерные эффекты обуславливают немонотонность зависимостей свойство – размер наночастицы. Существенное влияние на эти зависимости оказывает распределение в наночастице дефектов, примесей, нанопор и механических напряжений. Механизмы проявления размерных эффектов внутри н
ночастицы и на поверхностях раздела наноматериала, состоящего из этих частиц, различны.
84.
Переход от крупнокристаллических к наноструктурным полу –проводникам сопровождается увеличением ширины запре щенной зоны. С уменьшением размера частицы увеличивается доля составляющих ее атомов, которые расположены в ее
поверхностном слое. Это также обуславливает изменение
электрических свойств наноматериалов, а также влияет на их
оптические и магнитные свойства. Наличие большого количества атомов на поверхности раздела оказывает большое влияние на температурные характеристики наноматериалов.
Экспериментально установлено повышение теплоемкости,
понижение температуры плавления наноматериалов на основе металлов и керамики, а также температуры стеклования
полимерных наноматериалов по сравнению с анологичными
макроматериалами.Следовательно,переход к наноструктурам
позволяет регулировать физические свойства материалов.
85.
Границы раздела между частицами являются препятствиямина пути распространия дислокаций и трещин, что обуславли –
вает повышение твердости в 5 … 6 раз для металлических и
в 2 … 3 раза для керамических наноматериалов. Наноматериалы в большинстве случаев термодинамически неравновесны
из-за обилия поверхностей раздела, наличия нестабильных
фаз, микропор и механических напряжений. Это эволюционирует наноструктуры и приводит к изменению их свойств. Стабилизация наноструктур является актуальной проблемой наноматериаловедения.
Методы нанотехнологии в классическом варианте предполо –
гают «конструирование» материала с заданными свойствами
путем манипуляций с отдельными атомами или молекулами.
Схема такого процесса показана ниже. С помощью зонда удаляют из исходного ансамбля частиц атом примеси и «вставля-
86. Схема «конструирования» структуры материала методом нанотехнологии: 1.- зонд; 2. – атом исходного вещества; 3.- атом примеси;
4.- дефект решетки; 5.- исходное вещ-во87. КОМПОЗИЦИОННЫЕ МАТЕРИАЛЫ Основные определения и классификация
Композиционные материалы представляют собой многофазные системы, которые состоят издвух или более компо нентов, сохраняющих
индивидуальность (струк
Туру и свойства) своего
вещества в составе композита. Чаще всего композит сочетание химически разнородных фаз.
1. Матрица
2. Армирующие компоненты
3. Переходный слой на границе
раздела компонентов
88.
Размер фазовых включений в композите обычно превышаетразрешающую способность электронного микроскопа (~ 0,3
мкм). Переходные поверхностные слои (на рис. обозначены 3)
расположены на границах раздела матрицы и наполнителей.
Свойства вещества переходного слоя (иногда его называют
третьей фазой) отличаются от свойств вещества основных
фаз. К идее о целесообразности 3-го фазы как средстве улучшения взаимодействия несовместимых веществ пришел еще
Платон (428 – 348 гг до нашей эры). Древнегреческий философ
разрабатывал эту идею для объяснения того, как Вселенная
может быть построена из несовместимых земли, воды, огня и
воздуха. Свойства переходного слоя, прежде всего прочность
сцепления (адгезия) с компонентами, в большей мере определяют эксплуатационные характеристики композита и их ста –
бильность во времени. При нагружении напряжения достигают
наибольших значений на границах раздела компонентов.
89.
Главная функция переходного слоя состоит в том, чтобы сни зить локальные напряжения и обеспечить равномерную передачу нагрузки на границе раздела. Поэтому переходный слойне должен разрушаться под действием усадочных напряже ний, которые появляются при отверждении матрицы, а также
термических напряжений, возникающих при эксплуатации композита из-за разницы в температурных коэффициентах линейного расширения матрицы и наполнителей.
В материаловедении используют термин аддитивность, который означает, что величина какого-либо параметра сложного
объекта равна сумме значений этого параметра, соответствующих его частям. Применяя этот термин, можно утверждать,
что свойства композита не аддитивны свойствам его компонетов. Композиты разрабатывают потому, что им присущ
синергизм.
90.
Синергизм (в медицине) - объединенное действие двух лекарственных препаратов, которое является более сильным, чемсумма действий этих двух лекарств
Т.о., значение каждого из основных параметров композита
превышает сумму соответствующих значений всех его компонентов.
Композиты встречаются природные и искуственные и синтетические.
По назначению композиты разделяют на общетехнические и
специального назначения. Первые предназначены для восп –
приятия и передачи механической нагрузки. Вторые выполняют в составе изделий специальные функции: снижают трение
и изнашивание, звуко- и теплоизоляция и т.п.
По материалу матрицы различают:
а) Полимерные композиты (термопластичные, на основе
91.
б) Металлические композиты (в том числе получаемые методом порошковой металлургии и сплавы, состоящие из макронеоднородных фаз);
в) Керамические и другие неорганические композиты (на основе неорганических полимеров, на минеральной, углеродной
оксидной и других неорганических матрицах);
г) Комбинированные (полиматричные) композиты.
По природе компонентов, вводимых в матрицу, композиты разделяют на наполненные и армированные.
Наполненные композиты содержат в матрице наполнители –
дисперсные частицы неорганических или органических ве –
ществ, которые могут находиться в любой фазе. Наполнители
выполняют в композитах следующие функции: 1) изменяют механические показатели композитов и придают им специальные
свойства (электрические, химические, звукопоглощающие и пр
92.
2) улучшают технологичность композитов, т.е. их приспособленность к переработке в изделия (например, антифрикционные компоненты улучшают прессуемость порошковых смесей,активные добавки усиливают адгезию компонентов т.п.);
3) снижают стоимость изделий, т.к. наполнители, как правило,
дешевле связующих.
Армированные композиты имеют в составе арматуру (армирующие элементы) более прочную, чем матрица. С помощью
наполнителей прочность изделий можно увеличить в 1,5 … 2
раза, а путем армирования – на порядок и более. Вклад армирующих элементов в свойства композитов нередко является
определяющим. Поэтому в названиях композитов часто находит отражение химическая природа арматуры – графитопласты, металлокерамика, стекловолокниты и т.п. В состав композитов могут входить и наполнители, и армирующие элементы.
93.
По размеру фазовых включений разработчики материалов изНачально отличали композиты от однородных по структурематериалов. Типичным признаком композита являлись различимые в его структуре невооруженным глазом разнородные
включения. По мере совершенствования технологии получения материалов компоненты становились все более мелкими
и различать их приходилось с помощью микроскопа (~ 1 мкм).
В настоящее время возникла тенденция формирования ком –
позиционных материалов из частиц нанометрового размера.
Благодаря значительному поверхностному слою свойства наночастицы значительно отличаются от свойств материала ее
составляющего. Высокая прочность композитов, высокая ударная вязкость обусловлены тем, что сила удара поглащается
миллионами наночастиц, что приводит к диссипации (рассеиванию) энергии во множестве микротрещин, которые не нару-
94.
95.
96. Теплоемкость. Общие сведения.
Под теплоемкостью тела, С, понимают количество теплотыкоторое нужно сообщить телу, чтобы нагреть его на 1 К вблизи данной температуры. Теплоемкость – величина скалярная.
Часто для анализа пользуются понятием удельной теплоемкости (расчет ведется на 1 кг) или молярной теплоемкостью
(расчет на 1 моль). Ниже мы чаще всего будем иметь дело с
молярной теплоемкостью. Из определением молярной теплоемкости можно записать:
• СР = δQ/(m/µ)dT = δA/(m/µ)dT + dU/(m/µ)dT = pdV/(m/µ)dT +
dU/(m/µ)dT, (1.1)
97.
Где СР – молярная теплоемкость при постоянном давлении,δQ – теплота, сообщенная телу, m – масса тела, µ - масса
моля, dT – изменение температуры, δA – работа,
совершаемая телом, dU – изменение внутренней энергии
тела, p – внутреннее давление, dV – изменение объема тела.
98.
Электронная теплоемкость при гелиевых температурах можетзначительно превышать теплоемкость кристаллической ре –
решетки. Однако при более высоких температурах электрон ная теплоемкость составляет лишь малую долю решеточной
теплоемкости. Экспериментально обычно определяют теплоемкость при постоянном давлении, СР, которая превышает
теплоемкость при постоянном объеме, СV, за счет работы,
производимой при расширении против внутреннего давления
Для идеального газа разность СР – CV = R (R – газовая постоянная). Поскольку коэффициенты расширения конденсиро –
ванных сред меньше, чем газовых систем, то и разность СР –
CV для твердых тел (в том числе и металлов) будет меньше.
Она находится с помощью измерений сжимаемости, опреде –
ния температур плавления и т.д.
99.
Анализ имеющегося в литературе большого количества экс периментальных данных позволяет сделать некоторые обоб-щающие выводы.
В частности, теплоемкость твердых тел составляет при ком натной температуре ~ 25 Дж/моль К (закон Дюлонга – Пти). С
повышением температуры теплоемкости зачастую незначи тельно увеличивается (прежде всего за счет роста электрон ной теплоемкости). С понижением температуры теплоемкость
уменьшается, стремясь к нулю при Т → 0 К. Правило Неймана
– Коппа указывает на то, что во многих случаях теплоемкость
соединений складывается аддитивно из теплоемкостей их
компонентов. Объяснение уменьшения теплоемкости с пони жением температуры нельзя объяснить в рамках классичес кой статистической механики. Напротив, классическая статис тика обосновывает закон Дюлонга – Пти. Согласно этой тео рии, внутренняя энергия одного моля U = 3RT, а СV, соответственно, равна dU/dT = 3R ≈ 25 Дж/мольК.
100.
Уменьшение теплоемкости при понижении температуры –чисто квантовый эффект, как это впервые показал Эйнштейн
в 1907 г. Он предположил, что средняя энергия линейного
гармонического осциллятора равна не kТ (k – постоянная
Больцмана), а как это предложил в 1900 г. М.Планк:
< Е > = ħω/(exp(ħω/kT) – 1),
где ω – собственная частота осциллятора. Такой подход позволил рассчитать вклад в теплоемкость за счет колебаний
осциллятора, Сω:
Сω = R(Ө/Т)2exp(Ө/Т)/( exp(N) – 1)2 ,
где Ө = ħω/T получило название характеристической темпе –
ратуры Эйнштейна. Эта модель получила хорошую экспери –
ментальную проверку для газовых систем. Однако для крис таллических конденсированных структур модель не дает
хорошего согласия с опытом.
101.
Дебай в 1912 г. установил необходимость учета связей атомовв кристалле. При этом даже при наличии атомов одного сорта
в кристалле получается целый спектр колебаний вместо единственной частоты, характерной для свободной молекулы газа.
Дебай получил удовлетворительное приближение на основе
континуальной модели, т.к. большая часть колебаний отвечает
длинам волн, значительно превышающим межатомные расс тояния. Согласно модели Дебая, спектр колебаний должен
быть обрезан на частоте ωO, которая определяется из соотношения, устанавливающего максимально возможное число
колебаний в кристалле. Несложный логический анализ (вкупе
с достаточно простыми математическими преобразованиями)
позволяют получить два приближения для молярной теплоемкости кристаллической решетки.
Для низких температур: CV РЕШ= 233,8R(Т/ ӨD)3.
Для высоких температур CV РЕШ= 3R – (3/20)R(ӨD/T)2.
Где ӨD = ħωO/T носит название характеристической температуры Дебая (функции Дебая).
102.
Опыт показывает, что с помощью этой функции можно в большинстве случаев удовлетворительно описать температурнуюзависимость теплоемкости кристаллической решетки (обусловленную лишь ее колебаниями, но не движением свободных
электронов, процессами упорядочения и т.п.). Таким образом,
при низких температурах (опыт показывает, что до Т ≤ ӨD/12)
решеточная теплоемкость описывается «законом Т3»:
CV РЕШ = βТ3.
103. Свободные электроны в металле
Природа носителей тока в металлах долгое время была неизвестна. Для выяснения этого вопроса были предприняты специальные опыты.Рикке, пропуская длительное время ток через составной проводник (медь – алюминий), установил, что носители тока свободные частицы, не связанные с атомами вещества и одинаковые для всех металлов. Друде и Лоренц предположили, что
это свободные электроны, а Мандельштамм и Папалекси
(Россия, 1913 г.) и Толмэн и Стюарт (США, 1916) экспериментально (методом регистрации разности потенциалов с концов
резко заторможенного проводника) показали это.
Как отмечалось выше, при образовании кристаллической
104.
Как отмечалось выше, при образовании кристаллической ре –шетки валентные электроны легко отрываются от своих ато –
мов и становятся свободными. Атомы, «потерявшие» электроны, превращаются в положительно заряженные ионы. МожНо оценить концентрацию свободных электронов :
n = (D/A)NA,
где D – плотность металла, А – масса килоатома, NA – число
Авогадро.
По порядку величины концентрация свободных электронов
составляет (1028 – 1029) 1/м3 .
В основе классической электронной теории лежит модель
идеального электронного газа.
Предполагается, что электроны не взаимодействуют на расстоянии ни друг с другом, ни с ионами решетки.
105.
В отсутствие электрического поля в проводнике свободныеэлектроны двигаются хаотично, случайно сталкиваясь с узлами решетки. В результате столкновений между решеткой и
электронным газом устанавливается тепловое равновесие.
Скорость хаотического движения можно оценить из уравнения
(mv2/2) = (3/2)kT и v ≈ 105 м/с.
При наличии электрического поля на хаотическое движение
накладывается упорядоченное движение (дрейф) в направ лении, противоположном направлению поля.
Вектор плотности тока j, концентрация n, средняя дрей вовая скорость <u> и заряд электрона е связаны между
собой: j = n<u>е.
По порядку величины <u> ~ 0,5·10-3 м/с,
106. Закон Ома в классической электронной теории
Непосредственной причиной электрического сопротивления,по представлениям классической электронной, являются механические столкновения свободных электронов с ионами
кристаллической решетки.
Друде полагал, что при каждом столкновении электрон пол –
ностью теряет свою скорость направленного движения (абсо–
лютно неупругий удар), на некоторое время «захватывается»
ионом (иначе он не сможет отдать всю энергию за один удар
его масса много меньше массы иона). В промежутках между
столкновениями электрон движется равноускоренно со сред –
ней «дрейвовой» скоростью <u> = umax/2 = a<τ> , где a – ускорение электрона, <τ> - среднее время свободного пробега.
107.
По второму закону Ньютона а = F/m = Ee/m где Е – напряженность поля в проводнике, e и m – заряд и масса электрона.<τ> = <λ>/(<u> + <V>) ≈ <λ>/ <V> ,
т.к. <V> на много больше <u>. Здесь <λ> - средняя длина свободного пробега электрона, <V> - средняя скорость теплового движения электрона. Тогда <u> = e<λ>E/2m<V>, где
e<λ>/2m<V> = b – подвижность электронов. Учитывая, что
j = n<u>е, можно записать: j = (ne2<λ>/2m<V>) E = σ E, где
(ne2<λ>/2m<V>) = σ – электропроводность металла.
Величина 1/σ = R - электросопротивление металла.
При соударении электрона с узлом кристаллической решетки
электрон передает часть энергии, связанной с направленным
движением решетки, в результате чего металл нагревается
(джоулево тепло). Можно показать, что тепловая энергия, выделяющаяся в единице объема металла в единицу времени
численно равна w = σE2.
108.
В рамках классической электронной теории доказывается, чтотеплопроводность металла также, как и электропроводность,
обусловлена свободными электронами (закон Видемана –
Франца).
109. Затруднения классической теории металлов
Классическая электронная теория не в состоянии объяснитьряд экспериментальных фактов.
1.Опыт показывает, что электросопротивление в широком ин–
тервале температур пропорционален температуре в первой
степени. Согласно теории, R ~ (Т)1/2 .
2. Согласно теории, теплоемкость кристаллической решетки
равно 3R (R – газовая постоянная). У металла, кроме того,
есть свободные электроны – их теплоемкость равна (3/2)R,
т.е. теплоемкость металлов должна быть в 1,5 раза больше,
чем диэлектрика. На практике они практически одинаковы.
3. Чтобы согасовать теоретические и экспериментальные значения R, нужны комбинации с <λ>.
4. Сверхпроводимость не объясняется никак.
110. ЭЛЕМЕНТЫ КВАНТОВОЙ ТЕОРИИ ТВЕРДЫХ ТЕЛ Основные положения теории
1. Идея о двойственной, корпускулярно волновой природеэлектронов. Согласно классическим представлениям – электрон – частица с резко очерченными границами. По квантовым
представлениям – электрон обладает не только свойствами,
присущими микроскопическим телам, - корпускулярными
свойствами, но и свойствами, присущими волнам - волновыми
свойствами.
2. Идея о дискретности значений энергии электронов. Классическая электронная теория металлов постулирует, что энер –
гия свободных электронов в металле (полная или кинетичес –
кая) является функцией теплового состояния системы, может
меняться непрерывно, принимая какие угодно значения.
111.
Квантовая теория утверждает, что энергия свободных электронов в металле может принимать не любые, а только некоторые, дискретные значения, изменения ее происходят пор –циями – квантами.
3. Идея о неразличимости электронов в металле. По классической статистике Максвелла – Больцмана частицы, образующие макроскопическую систему, обладают индивидуальнос –
тью, могут быть пронумерованы. Квантовая теория полагает,
что частицы неразличимы и подчиняются не классической
статистике Максвелла – Больцмана, а квантовой статистике
Ферми – Дирака.
4.Принцип Паули. По квантовой теории состояние электрона и
в атоме и в кристалле определяется набором четырех квантовых чисел. Согласно принципу в атоме, в кристалле не может
быть даже двух электронов с одинаковыми набором чисел.
112. Квантование энергии свободных электронов в металле
Полная энергия любого свободного электрона в металле –- сумма потенциальной и кинетической энергий. Металл
Представляет для свободных электронов своеобразную потен
циальную яму, поскольку на электрон, покинувший металл,
действуют силы зеркального отображения и двойного электрического слоя. Поскольку силы, действующие на любой свободный электрон, покидающие металл одинаковы, то и потенциальная энергия всех свободных электронов в металле одинакова. По знаку она отрицательна. Ход потенциальной энергии в металле и за его пределами представлен на следующем
рисунке.
113.
114.
При образовании из отдельных атомов кристаллического телаатомы сближаются на столь малые расстояния, что их электронные оболочки перекрываются, между атомами начинается
взаимодействие. Это взаимодействие приводит к тому, что
соответствующие энергетические уровни отдельных атомов
смещаются относительно друг друга – в результате вместо
одного одинакового для всех атомов уровня возникает N (N число атомов,объединившихся в кристалл) весьма близких,но
не совпадающих уровней. Образуется полоса или зона разрешенных энергетических уровней. Ширина образовавшейся полосы может достигать нескольких электрон – вольт.
Расстояние между соседними уровнями в зонах очень мало
- порядка 10-22 – 10-23 эВ. В любом твердом теле зоны разрешенных значений энергии разделены зонами запрещенных
энергии.
115.
t116.
Заполнение разрешенных энергетических уровне происходитв соответствии с принципом Паули.
Особую роль в твердых телах играет валентная зона. Это зона, образовавшаяся в результате расщепления самого верхнего занятого электронами уровня (в изолированном атоме на
нем находятся валентные электроны). Число возможных квантовых состояний в валентной зоне больше числа электронов,
поэтому часть энергетических уровней оказываются свобод –
ными. Валентную зону в металлах и сплавах называют еще
зоной проводимости, поскольку электроны именно этой зоны
ответственны за тепло- и электропроводность в указанных
материалах. Заполнение валентной зоны начинается с самых
низких уровней. Итак, свободные электроны в металле обладают одинаковой потенциальной, но разной кинетической, а
следовательно, и полной энергией.
117.
Если классические частицы должны при температуре 0 К занимать нулевой энергетический уровень (шкала Кельвин) т.е.неподвижны, то по квантовой теории это невозможно(принцип
Паули) и электроны при 0 К обладают колоссальной энергией
не теплового происхождения. Максимальная кинетическая
Энергия свободных электронов называется энергией Ферми.
На рисунке схематично изображены энергетические зоны металла, п/проводника и
диэлектрика. При Т≠ 0 К в зо
не проводимости п/проводника появляются электронны. Их появление обусловлено тепловым движением.
118.
Функция распределения электронов по энергетическим состояниям была найдена Ферми и Дираком.
Густота уровней в зонах разрешенных значений энергии определяется плотностью состояний. Плотность состояний - это
число возможных квантовых состояний, приходящихся на
единичный интервал энергии в единице объемы металла.
Следует отметить, что кинетические свойства электронной
подсистемы определяются электронами, находящимися вбли
зи уровня Ферми.
119. Теплоемкость электронов в металле и п/проводнике
В рамках классической электронной теории Друде - Лоренца,рассматривая электроны как идеальный газ, молярную электронную теплоемкость можно определить:
CVЭЛ = (3/2)R.
В 1028 г. А.Зоммерфельд предложил модель, согласно которой распределение свободных электронов в металле описывается распределением Ферми - Дирака, а нераспределением Больцмана, как это следует из теории Друде. В рамках модели Зоммерфельда
CVЭЛ = ((πk)2NА/2µ)T = γТ,
где NА – число Авогадро, µ - энергия Ферми, γ – коэффициент
электронной теплоемкости.
120.
Надо отметить, что коэффициент электронной теплоемкости связан с плотностью электронных состояний вблизи уровняФерми g0(µ) (при Т = 0 К) выражением:
γ = (2/3) (πk)2 g0(µ).
Таким образом, для молярной теплоемкости металла CV име
ем при низких температурах (Т ≤ ӨD/12):
CV = CVЭЛ + CVРЕШ = γТ + βТ3.
Особенности электронного строения переходных металлов и
их соединений, обладающих высокой плотностью электронных состояний вблизи уровня Ферми, приводят к тому, что
температурные зависимости электронной теплоемкости этих
материалов в области низких температур могут носить не традиционный характер.
121.
Так, в рамках модели Лаббе - Фриделя для случая почти пустой d-полосы показано, что при низких температурах электронная теплоемкость пропорциональна температуре и можетбыть описана выражением:
CVЭЛ = (π2/6kQTµ}T,
Где Q – число электронов, содержащихся в рассматриваемой
подполосе, а Tµ - температура Ферми.
При этом высокотемпературный предел электронной теплоемкости оказывается равным:
CVЭЛ ∞ = (1/2) kQ.
Подобное поведение теплоемкости электронов может быть
связано с весьма низкой температурой снятия вырождения.
Температурный интервал, пределах которого меняется электронная теплоемкость от CVЭЛ = γТ до CVЭЛ ∞ = const весьма
узок.













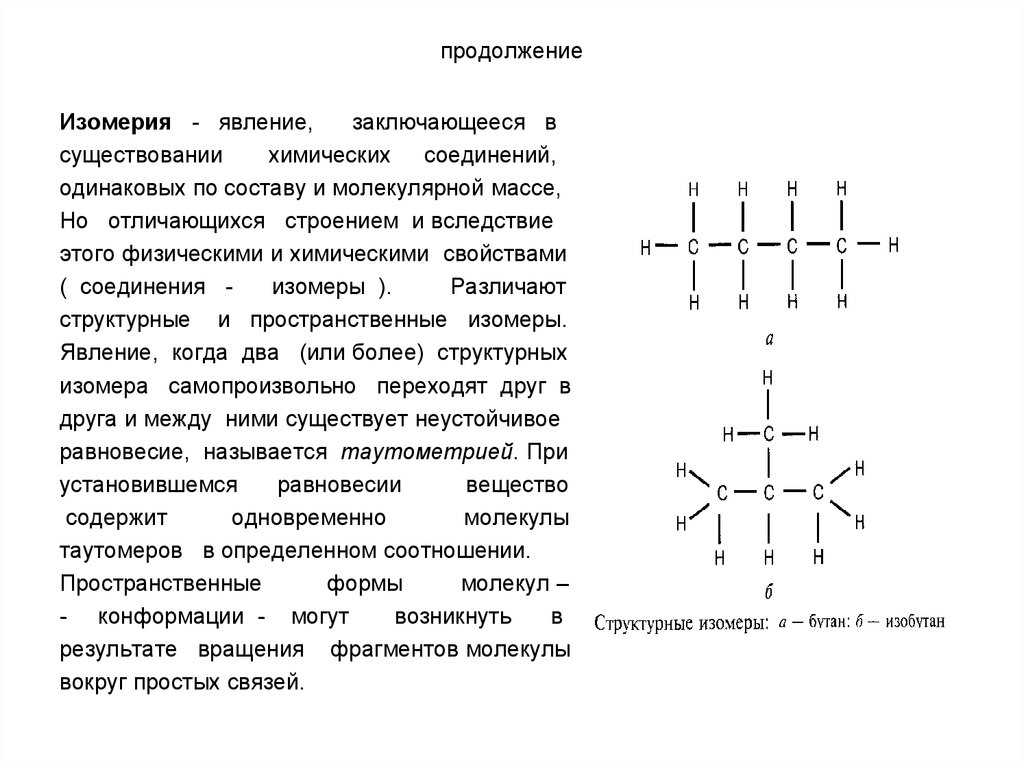








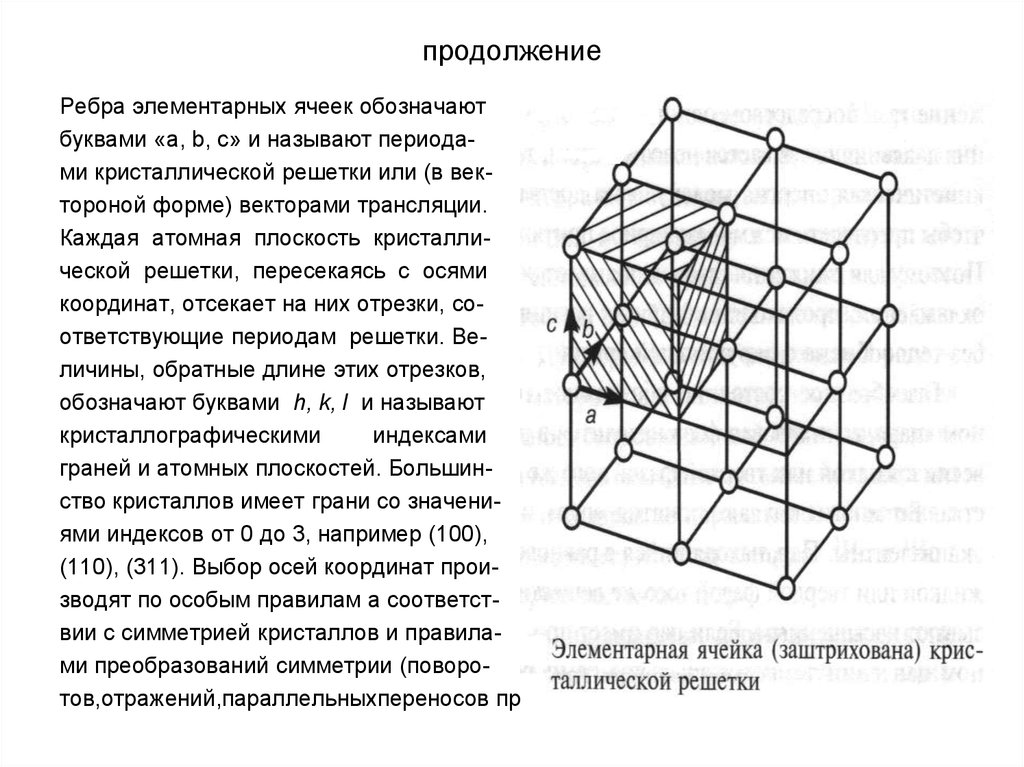
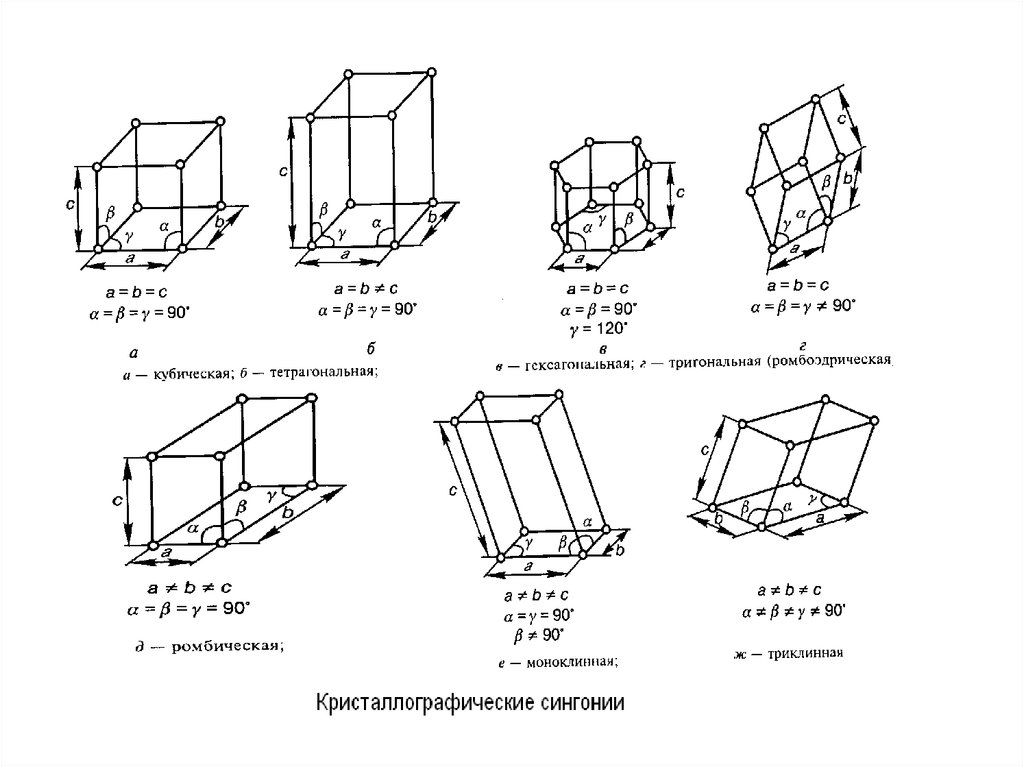
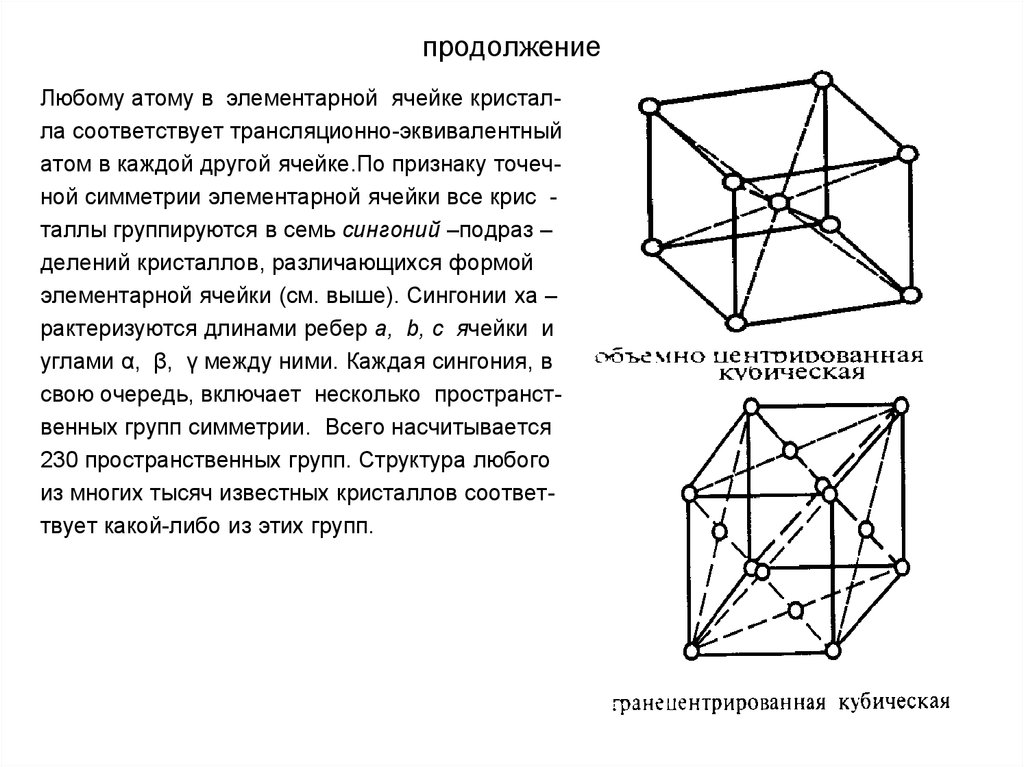



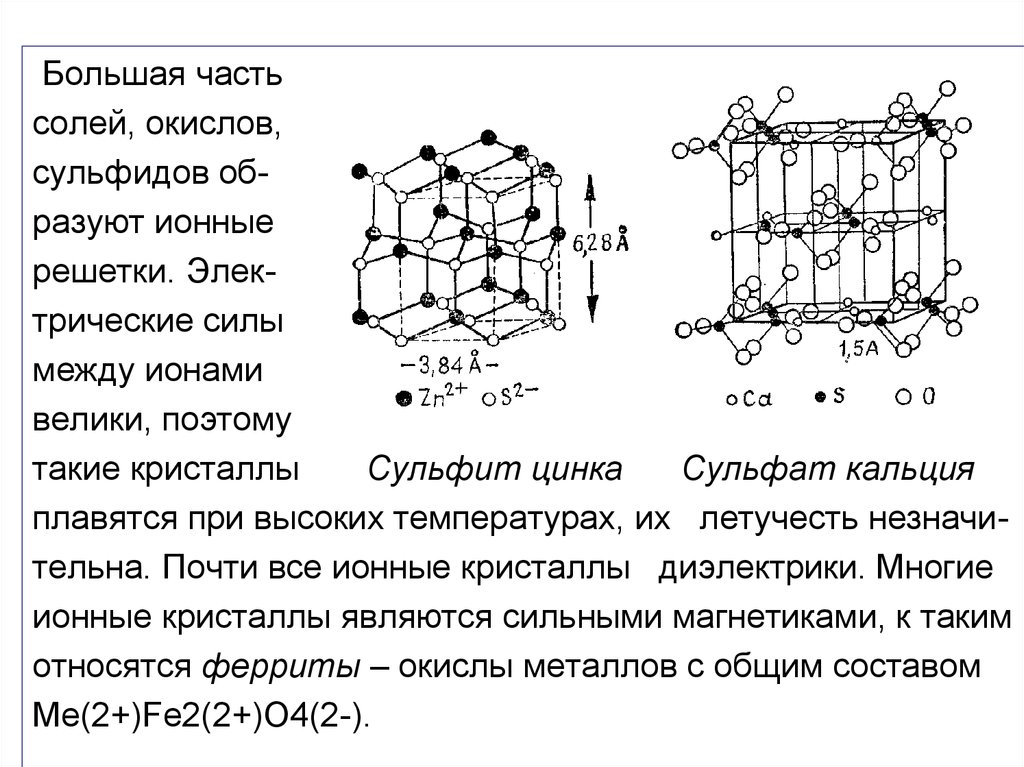


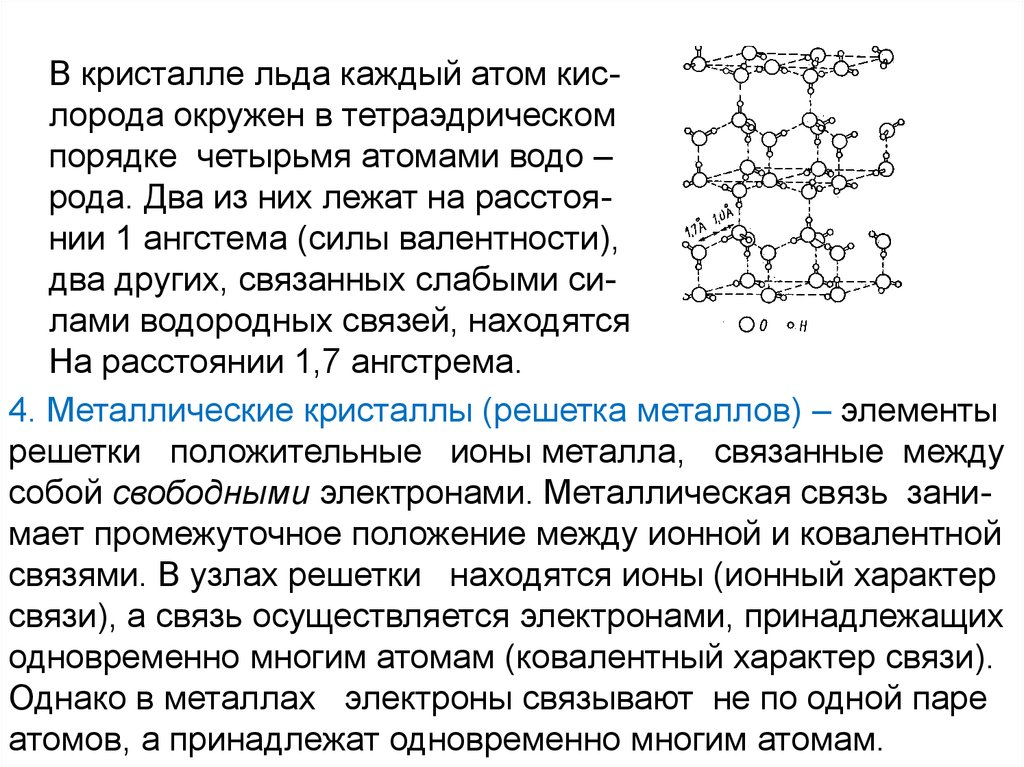





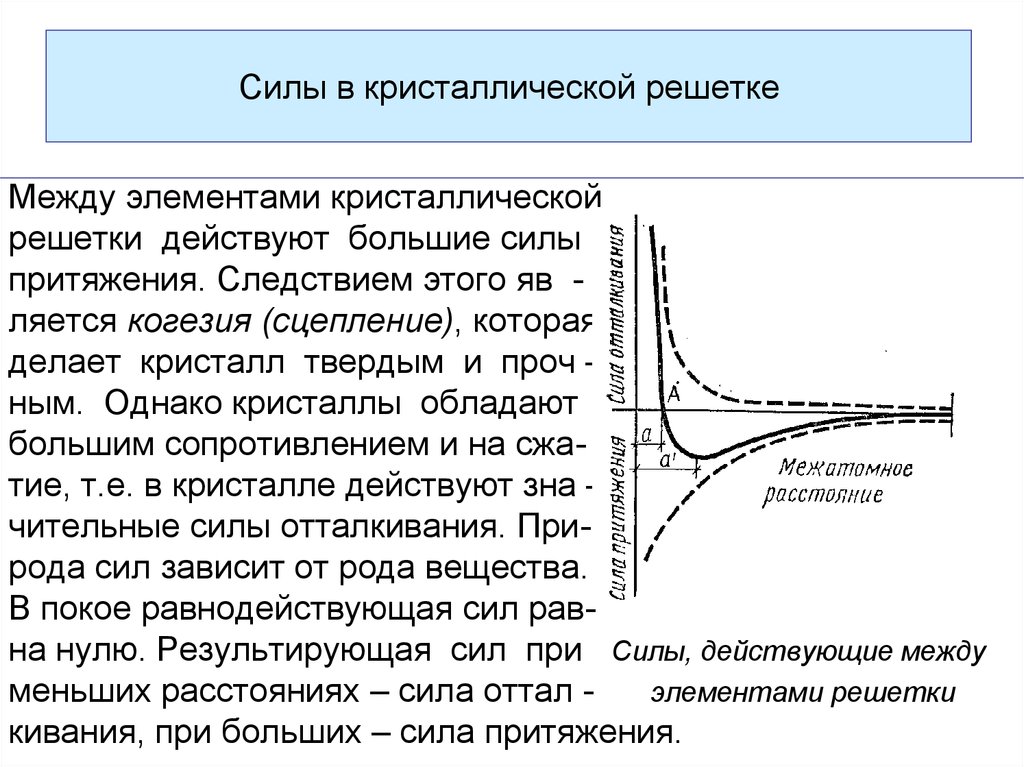


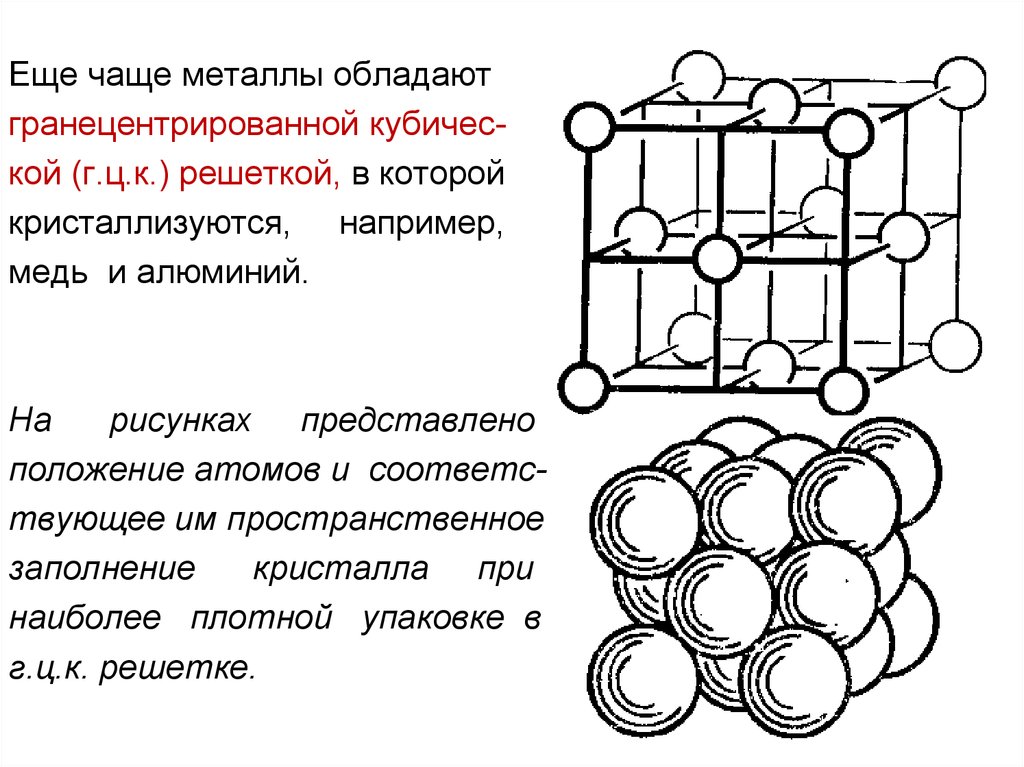
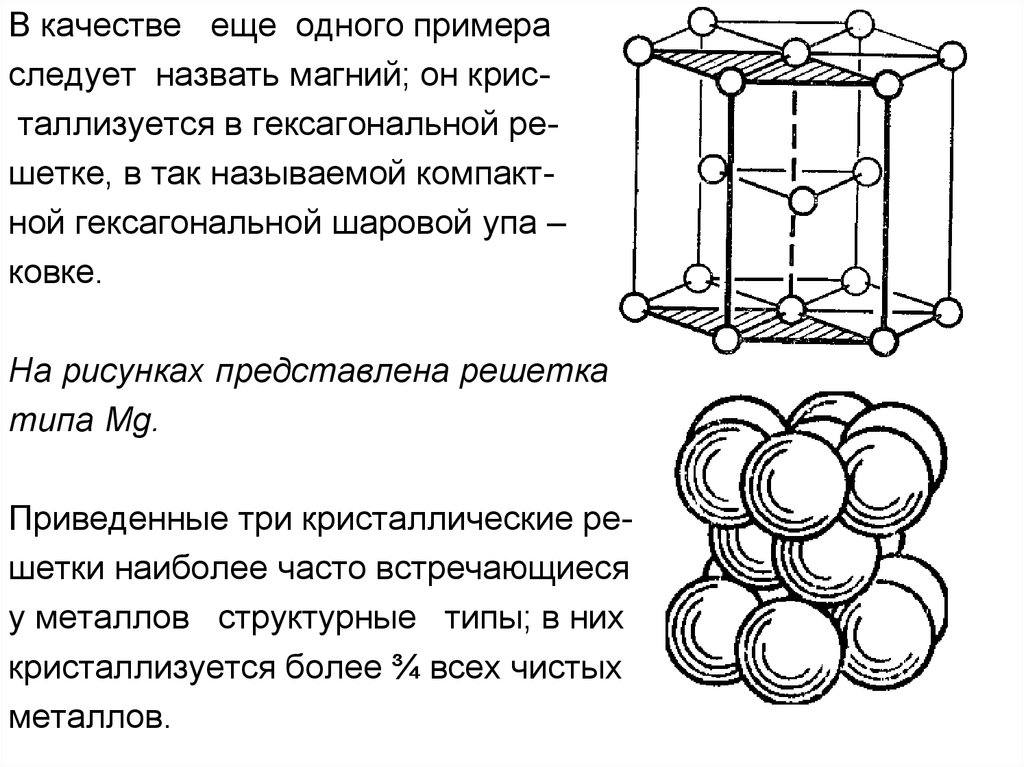











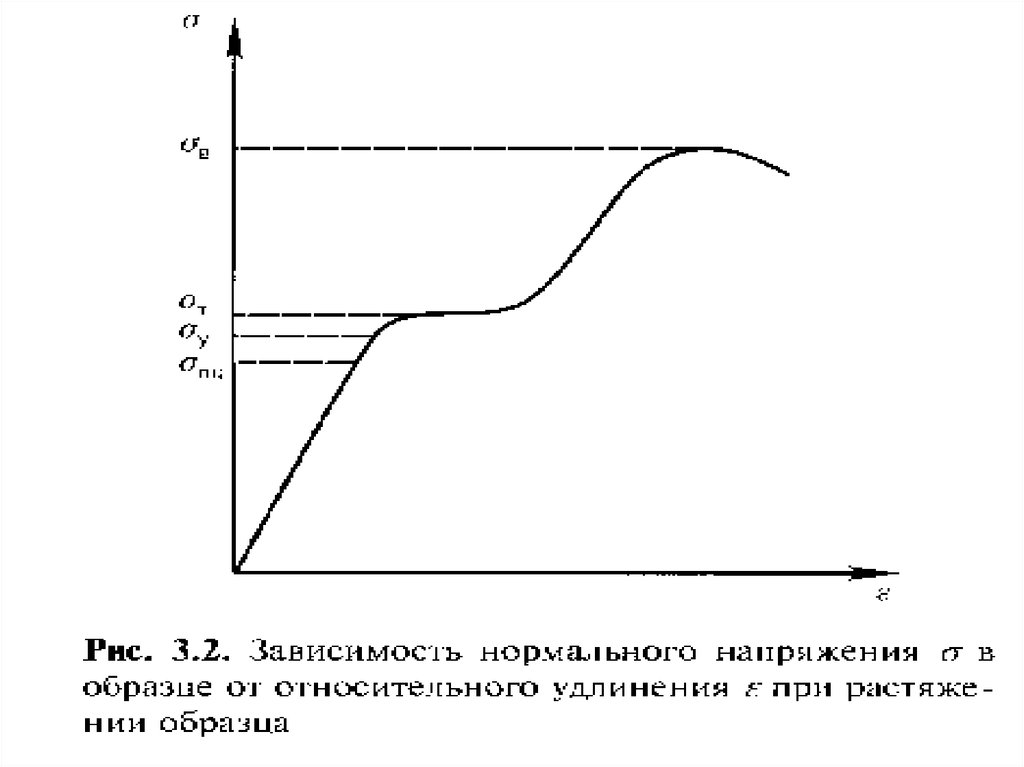








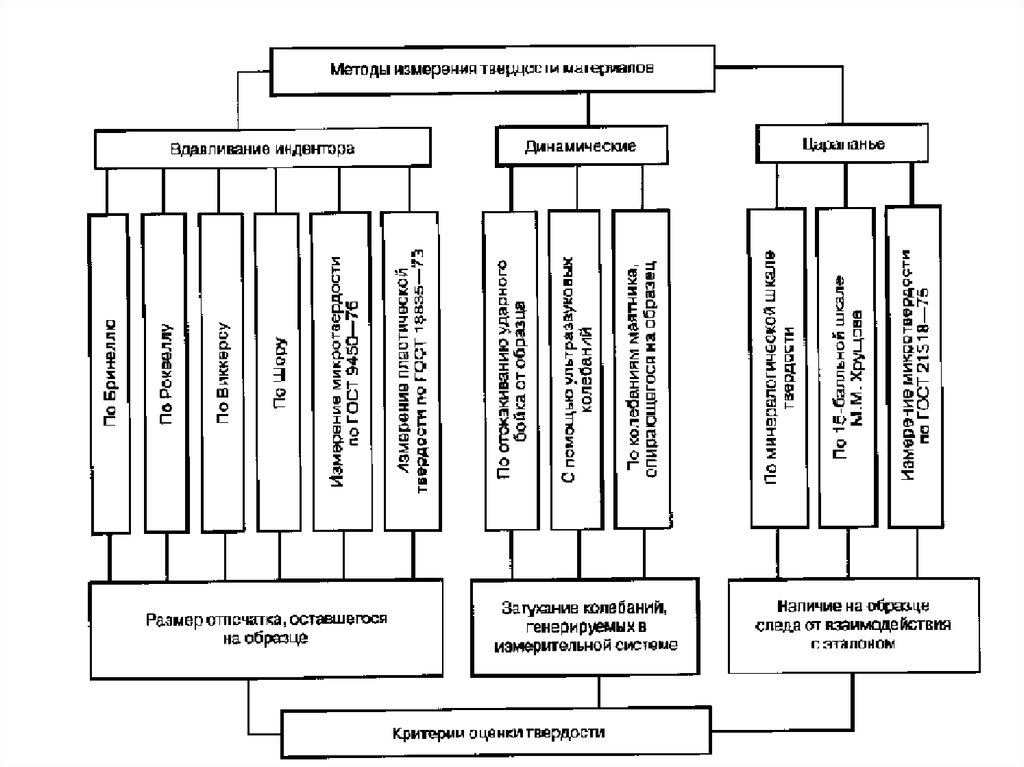






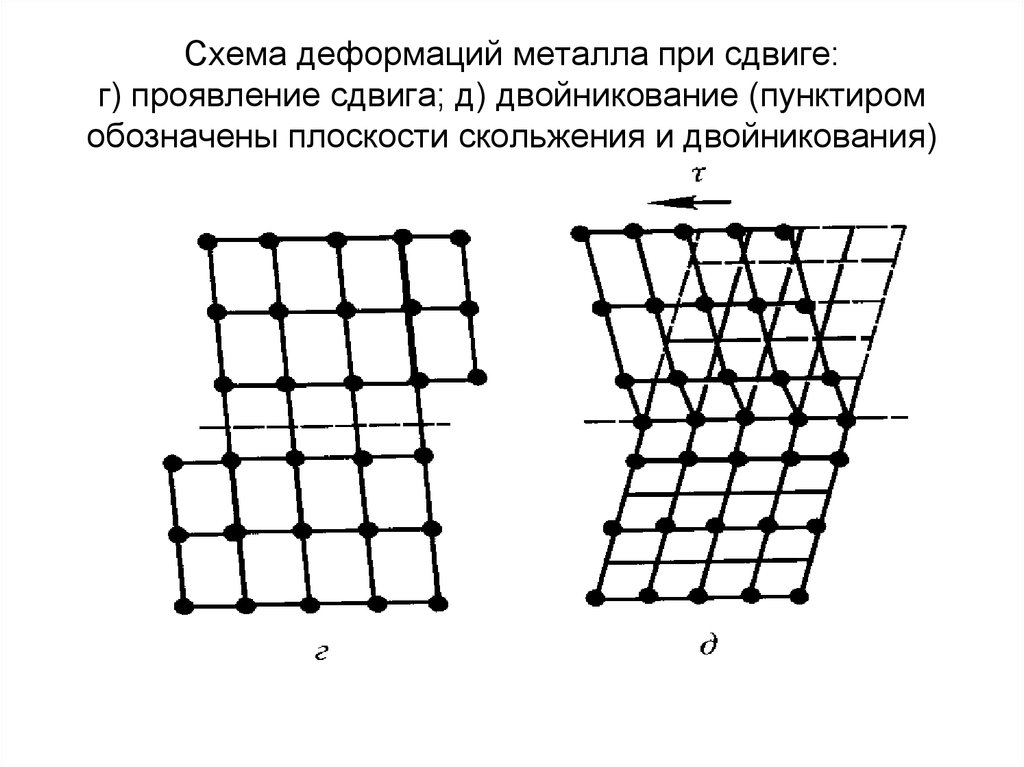


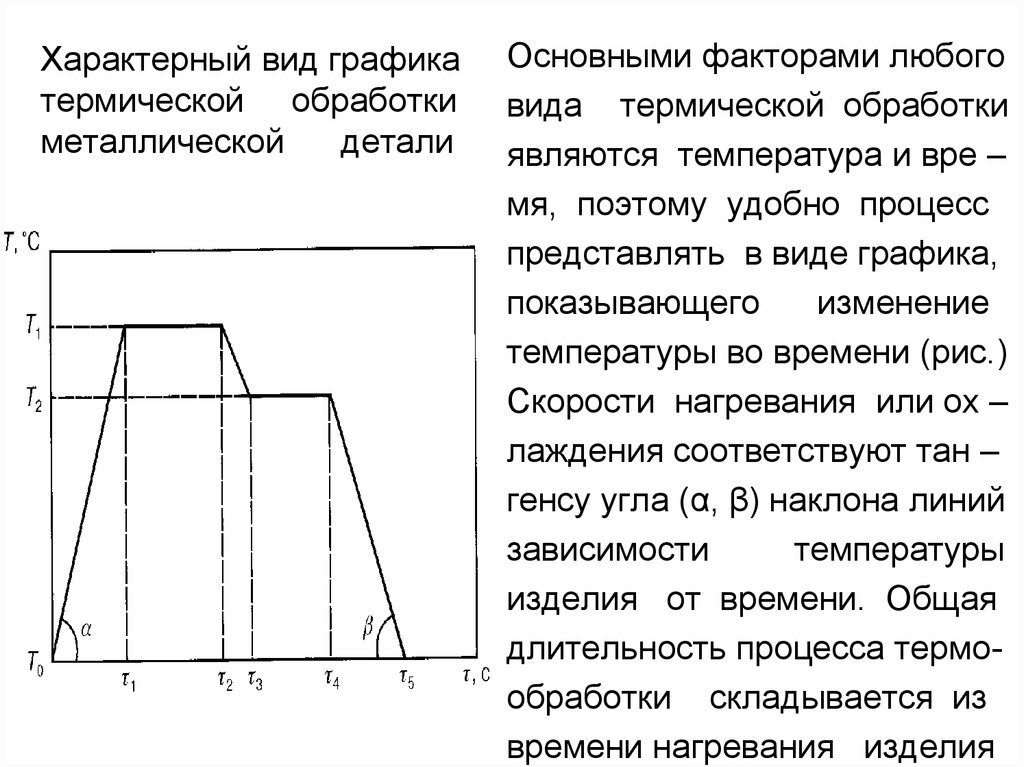












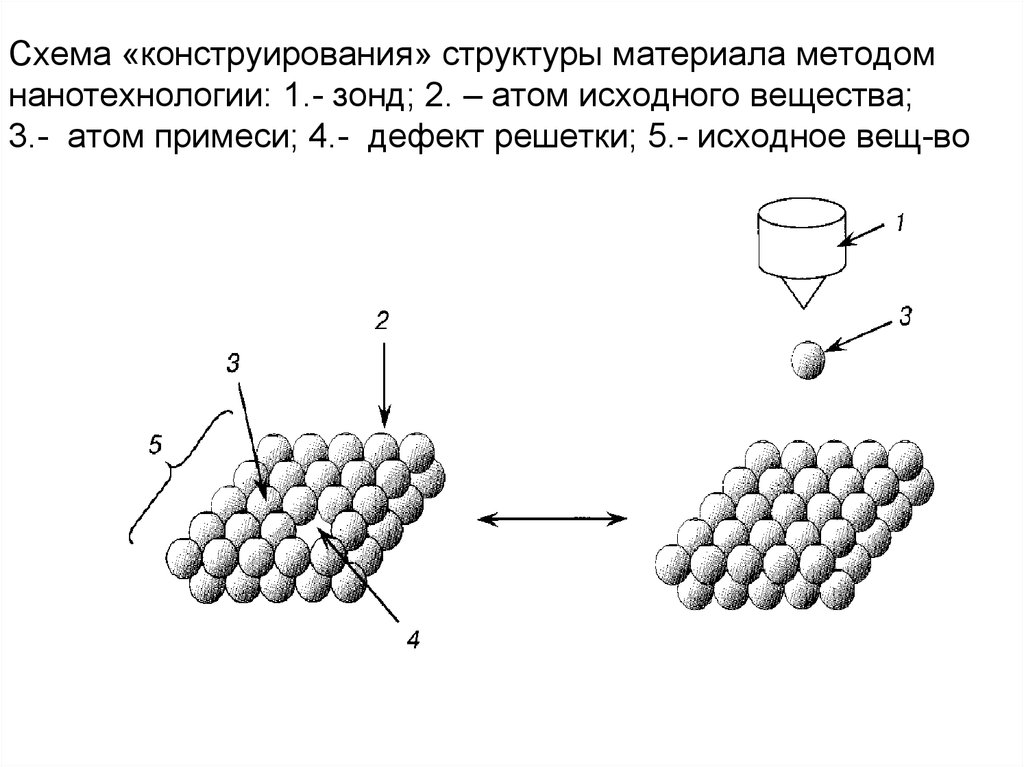
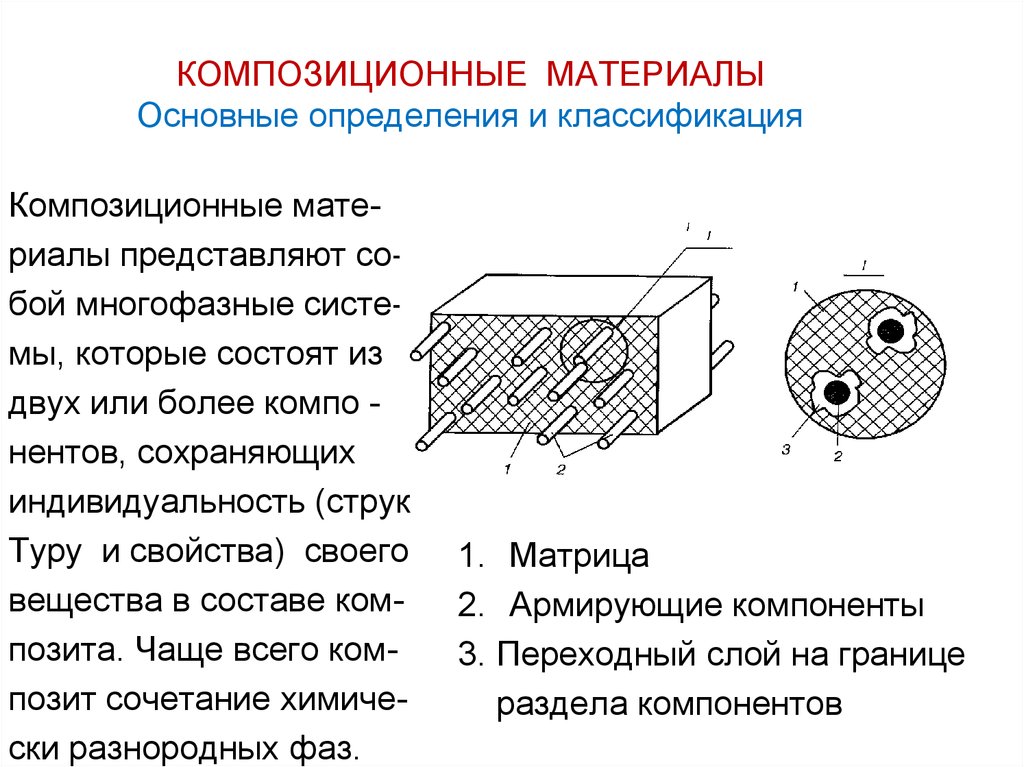







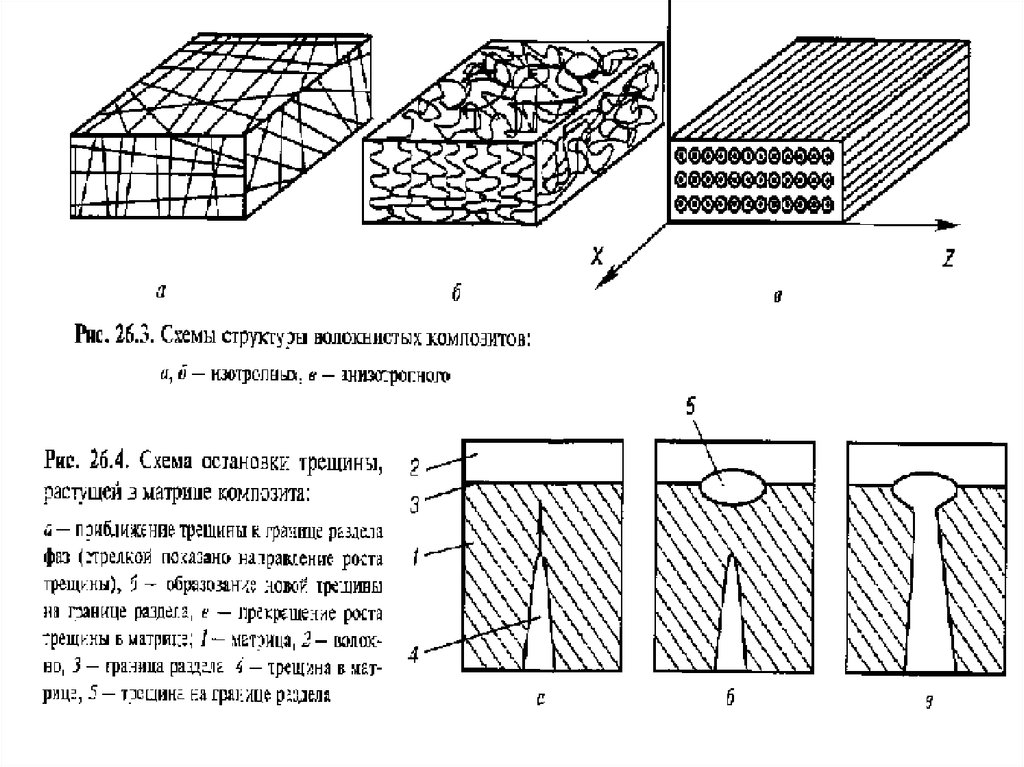



















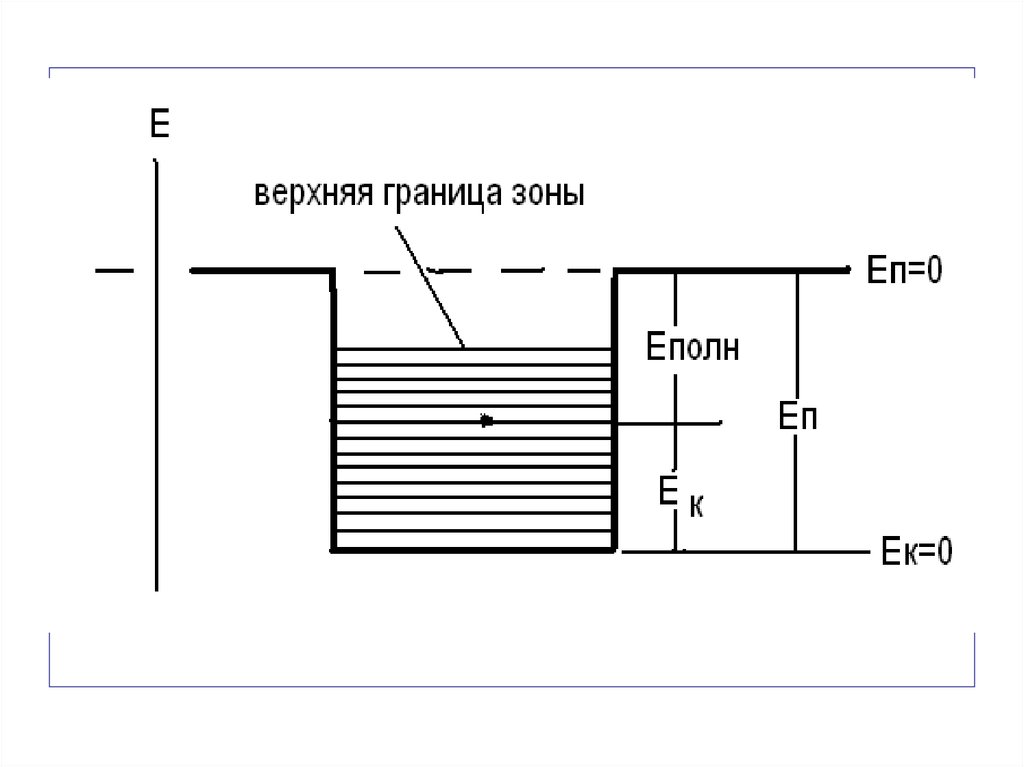







 physics
physics








