Similar presentations:
Неорганические вещества. Минеральные соли и кислоты
1. Неорганические вещества. Минеральные соли и кислоты
2. Для поддержания жизнедеятельности клеток и организма необходимы минеральные соли.
3. В живых организмах минеральные соли находятся или в растворенном виде (диссоциированы на ионы), либо в твердом состоянии.
4. Наиболее важные катионы:
K+
Na
Ca
+
2+
Mg
2+
5. Наиболее важные анионы:
Cl-
HCO3
HPO4
2-
H2PO4
-
6. Концентрация ионов К и Na внутри и снаружи клеток приводит к возникновению разности электрических потенциалов на мембране
+Концентрация ионов К и Na
внутри и снаружи клеток
приводит к возникновению
разности электрических
потенциалов на мембране
+
(важно для передачи нервных
импульсов и транспорта веществ
через мембрану)
7. Ионы необходимы для синтеза веществ: HPO4 - нуклеотиды и АТФ; Fe - гемоглобин; Mg – хлорофилл.
Ионы необходимы длясинтеза веществ:
+
HPO4 - нуклеотиды и АТФ;
Fe - гемоглобин;
Mg – хлорофилл.
2+
2+
8. Ионы NO3 и NH4 являются источниками азота, SO4 – атомов серы.
-+
Ионы NO3 и NH4 являются
источниками
азота,
2SO4 – атомов серы.
9. Ионы Са и Mg выполняют регуляторную функцию и активизируют многие ферменты. Ионы Mg активизируют энергетический обмен и синтез
2+2+
Ионы Са и Mg выполняют
регуляторную функцию и
активизируют многие
ферменты.
2+
Ионы Mg активизируют
энергетический обмен и
синтез АТФ
10. Соединения кальция входят в состав раковин моллюсков, панцирей ракообразных.
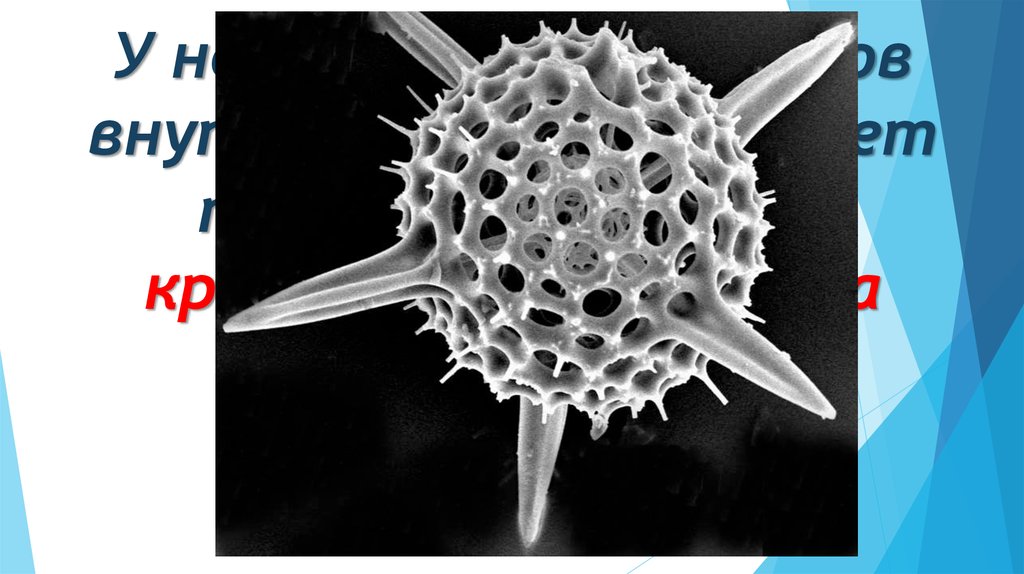
11. У некоторых протистов внутриклеточный скелет построен из оксида кремния или сульфата стронция.
12. В желудке позвоночных животных соляная кислота создает кислую среду.
13. Угольная кислота и ее анионы формирует бикарбонатную буферную систему.
14. Анионы фосфорной кислоты формируют фосфатную буферную систему.
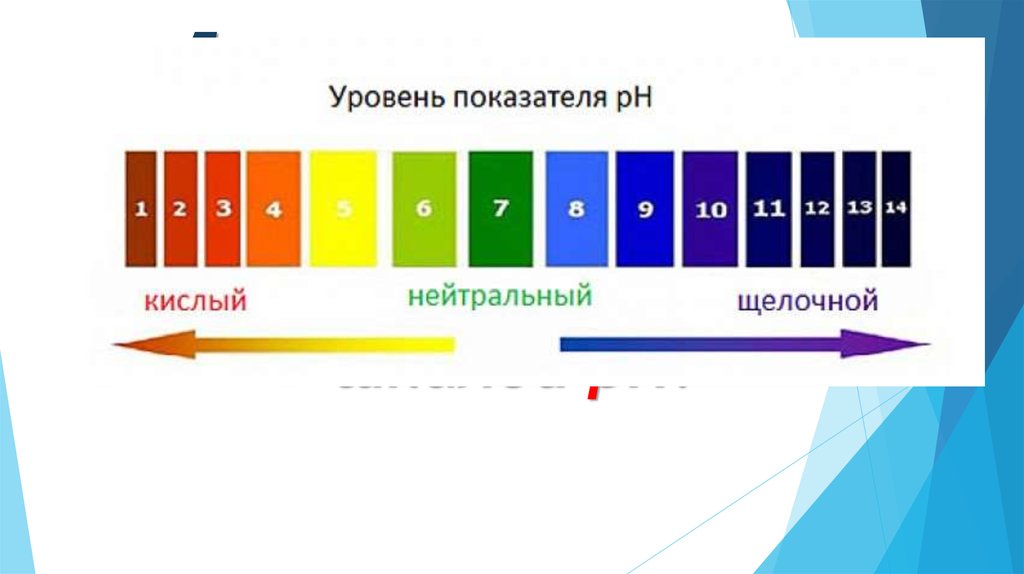
15. Кислотность среды
16. На протекание биохимических реакций в живых организмах оказывает влияние концентрация ионов водорода – кислотность среды.
17. В нейтральных растворах концентрация ионов водорода составляет 10 моль/л.
В нейтральных растворахконцентрация ионов водорода
-7
составляет 10 моль/л.
18. Для характеристики кислотности среды удобно пользоваться водородным показателем рН (пэ-аш) и шкалой рН.
19. Буферные растворы
20. Живые организмы в целом и их отдельные клетки обладают способностью поддерживать кислотность среды на определенном уровне.
21. В поддержании слабощелочной реакции внеклеточной среды участвует угольная кислота (Н2СО3)и гидрокарбонат ион (НСО3).
22. Угольная кислота – слабый электролит, в растворе определенная часть ее молекул диссоциирована и наблюдается баланс:
33
23. Если по какой либо причине концентрации ионов Н+ в растворе увеличивается (среда становится более кислой), анионы НСО3-
Если по какой либо причинеконцентрации ионов Н+ в
растворе увеличивается (среда
становится более кислой), анионы НСО3связывают их:
3
3
24. Если кислотность среды снижается, молекулы угольной кислоты диссоциируют, высвобождая дополнительные ионы водорода:
33
25. Буферный раствор – это раствор, в котором при изменении состава среды обеспечивается относительное постоянство концентрации
ионов водорода(Н+).
26. Домашнее задание:
Параграф2, стр. 15-17
























 chemistry
chemistry