Similar presentations:
Окислительно-восстановительные равновесия и процессы
1.
Окислительновосстановительныеравновесия и процессы
Электрохимия и электрохимические
методы исследования в физиологии и
медицине
2.
Электрохимия - раздел физическойхимии, изучающий процессы
превращения энергии химической
реакции в электрическую и, наоборот,
электрической в химическую
3.
Основные разделы электрохимии:Учение об электролитах (главным образом о
водных растворах электролитов)
Термодинамика электродных процессов(учение
об электрохимических равновесиях на
поверхности раздела)
Кинетика электродных процессов ( учение о
скоростях процессов, проходящих на поверхности
раздела фаз)
4.
Практической значениеэлектрохимии как науки:
Глубокая очистка веществ с помощью электролиза
Электросинтез
Получение тонких пленок, контактов, защитных
покрытий
Создание химических источников тока
(гальванический элемент, аккумулятор)
Развитие и разработка электрохимических методов
анализа (полярография, кондуктометрия,
потенциометрия и др. - имеют широкое применение в
медико-биологических исследованиях)
5.
Электрохимические явления лежат воснове важнейших биохимических
процессов:
Превращение химической энергии питательных
(органических) веществ в электрохимическую
энергию (зарядка клеточных аккумуляторов)
Возникновение биопотенциалов и перенос
веществ через мембраны
Передача нервных импульсов и т.д.
6.
Биоэлектрохимия — изучениеэлектрохимических основ работы живых
систем: биоэлектрохимии мембран,
биоэлектрокатализа, электрохимии
функционирования нервной системы,
электропунктурной рефлексотерапии.
7.
Электрическая проводимость растворовэлектролитов
Проводники 1 рода — носителями электричества
являются электроны (электронная
проводимость). К ним относятся металлы.
Проводники 2 рода — перенос электричества в
них осуществляется ионами (ионная
проводимость). Это растворы и расплавы
электролитов.
Электрохимия изучает проводники 2 рода
8.
Величина, характеризующая способность веществапроводить электрический ток, называется
электропроводимостью.
Величина, обратная сопротивлению.
Электропроводимость
Сопротивление
ρ
9.
Сопротивление обычно измеряют с помощьюприборов -кондуктометров по схеме Кольрауша
10.
зависимость молярнойэлектрической проводимости от
разбавления
зависимость удельной
электрической проводимости от
разбавления
1 – слабый электролит
2 – сильный электролит
11.
Электропроводимость зависит от:Природы электролита
Свойств растворителя
Температуры
Концентрации раствора
Молярная электропроводимость (λ) –
электрической проводимость обьема раствора,
содержащего 1 моль эквивалента вещества и
заключенного между электродами, отстоящими
друг от друга на расстоянии 1м
12.
молярная электропроводимостьОм-1 ∙ м2∙ моль-1
2
C
__
λ
K=
λ∞(λ∞ - λ)
Константа диссоциации
13.
λ уменьшается при увеличении концетрациираствора:
для слабых электролитов это связано с
уменьшением количества ионов в растворе (т.к. α
уменьшается)
для сильных электролитов зависимость
определяется силами межионного взаимодействия
и диэлектрической проницаемости среды.
14.
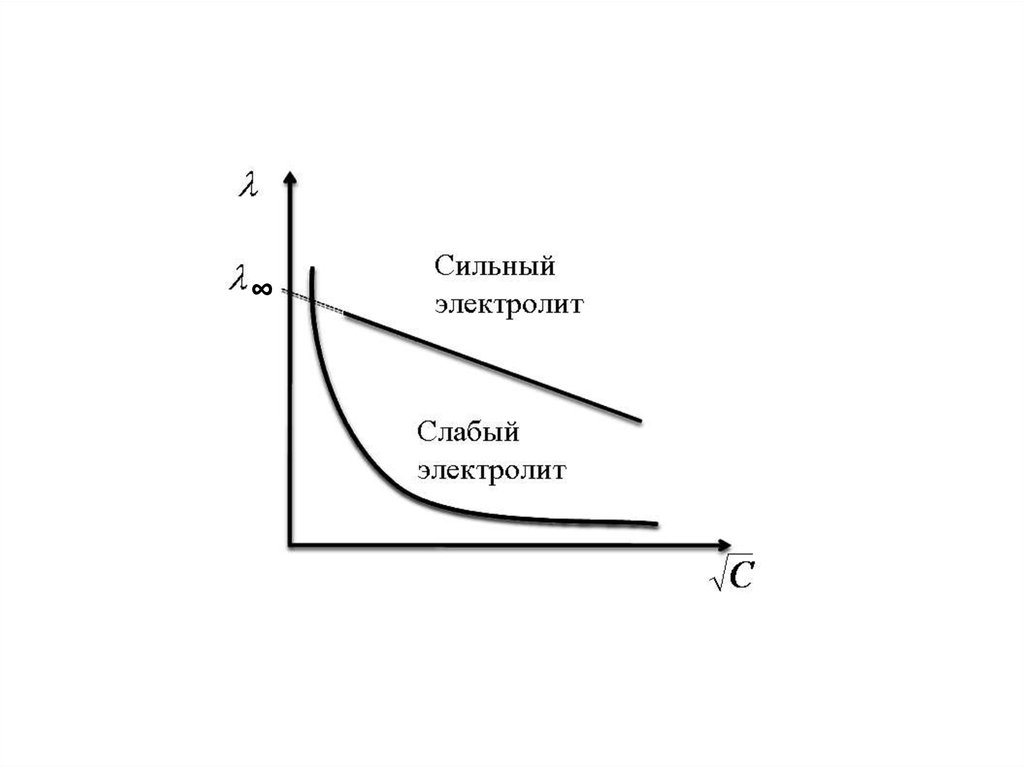
Зависимость λ от √c для сильных электролитовпрямолинейна и выражается уравнением:
λ = λ∞ - a√c
где λ∞ - молярная электропроводность при
бесконечном разведении ( с → 0 )
a – постоянная, зависящая от природы
растворителя.
15.
Закон Кольрауша:λ∞ = l∞An + l∞Kt
Предельная молярная электрическая
проводимость- (λ∞) раствора электролита
равна сумме молярных подвижностей
анионов (l∞An) и катионов (l∞Kt), входящих
в состав этого электролита.
16.
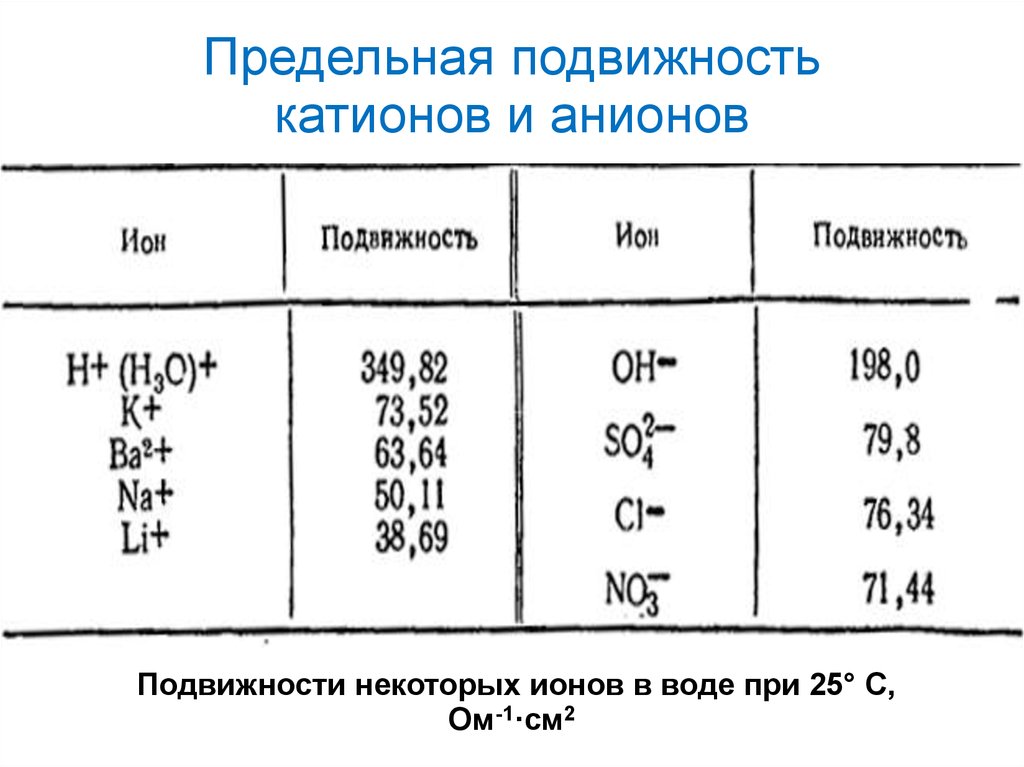
∞17.
Предельная подвижностькатионов и анионов
Подвижности некоторых ионов в воде при 25° C,
Ом-1·см2
18.
Кондуктометрия – физико-химический методисследования различных
систем,основанный на измерении их
электрической проводимости.
Прямые и косвенные кондуктометрические
измерения
Кондуктометрическое титрование (реакции
нейтрализации, замещения и осаждения)
19.
Кондуктометрическая кривая титрованияисследуемого раствора одного соединения
состоит из двух ветвей,пересекающихся в точке
эквивалентности. Характер кривых титрования
зависит от силы электролитов, присутствующих в
системе, и подвижности их ионов.
Тэкв
Тэкв
Рис. А
Рис. Б
20.
Кривые кондуктометрического титрованияа) сильной кислоты сильным основанием
l0 (H+) > l0 (Na+)
l или U
б) слабой кислоты сильным основание
21.
Электродныепотенциалы
22.
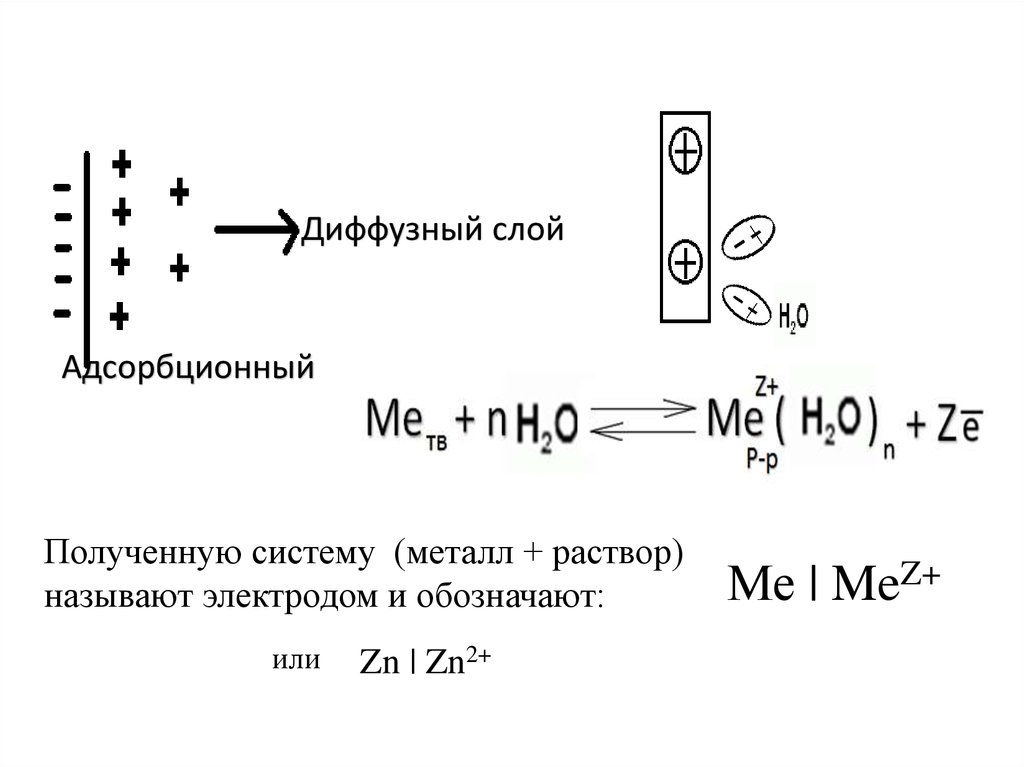
Диффузный слойАдсорбционный
Полученную систему (металл + раствор)
называют электродом и обозначают:
или
Zn | Zn2+
Ме | MeZ+
23.
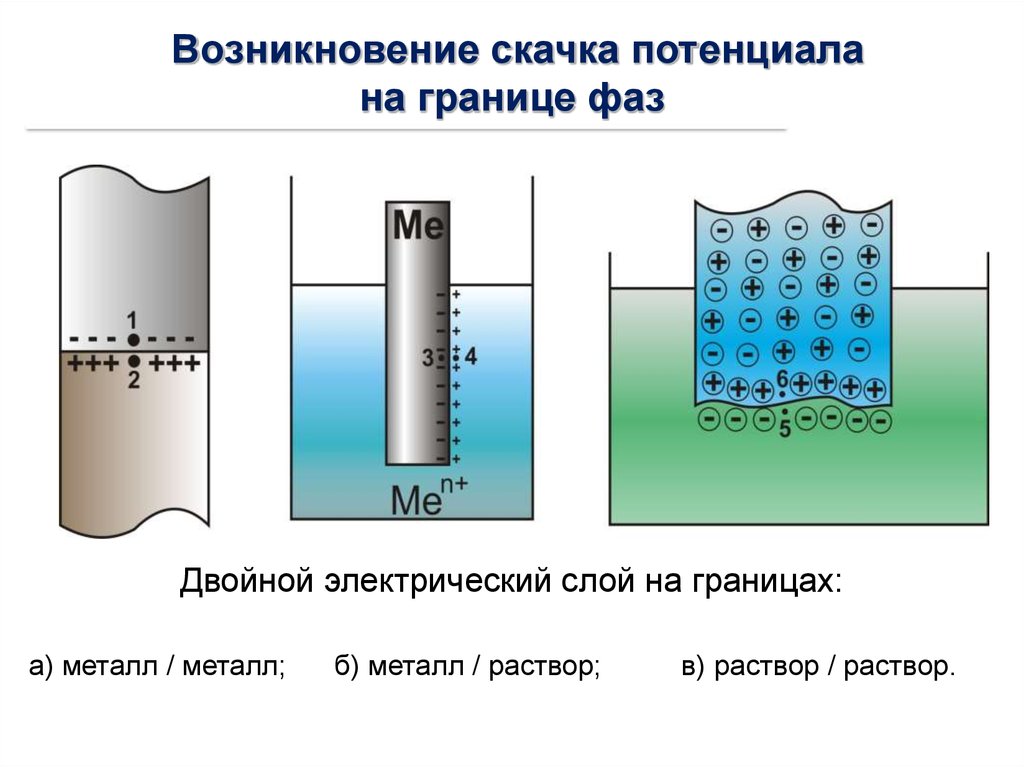
Возникновение скачка потенциалана границе фаз
Двойной электрический слой на границах:
а) металл / металл;
б) металл / раствор;
в) раствор / раствор.
24.
2+25.
Схема гальванического элементаДаниэля-Якоби
26.
4.1.Электрохимические
ГЭ растворов;
Роль солевого
мостика:
- препятствует смешению
- способствует
сообщению растворов.
Гальванический элемент
Даниэля-Якоби
2ē
_
+
Zn
Zn2+
ZnSO4
KCl
Cu
Cu2+
CuSO4
27.
ПРАВИЛО ЗАПИСИ ГЭ:Слева всегда пишется электрод с меньшим стандартным
потенциалом, этот электрод называется АНОДОМ (А) и на
нем происходит процесс окисления (-е).
Справа пишется электрод с большим стандартным
потенциалом, этот электрод называется КАТОДОМ (К) и на
нем происходит процесс восстановления (+е).
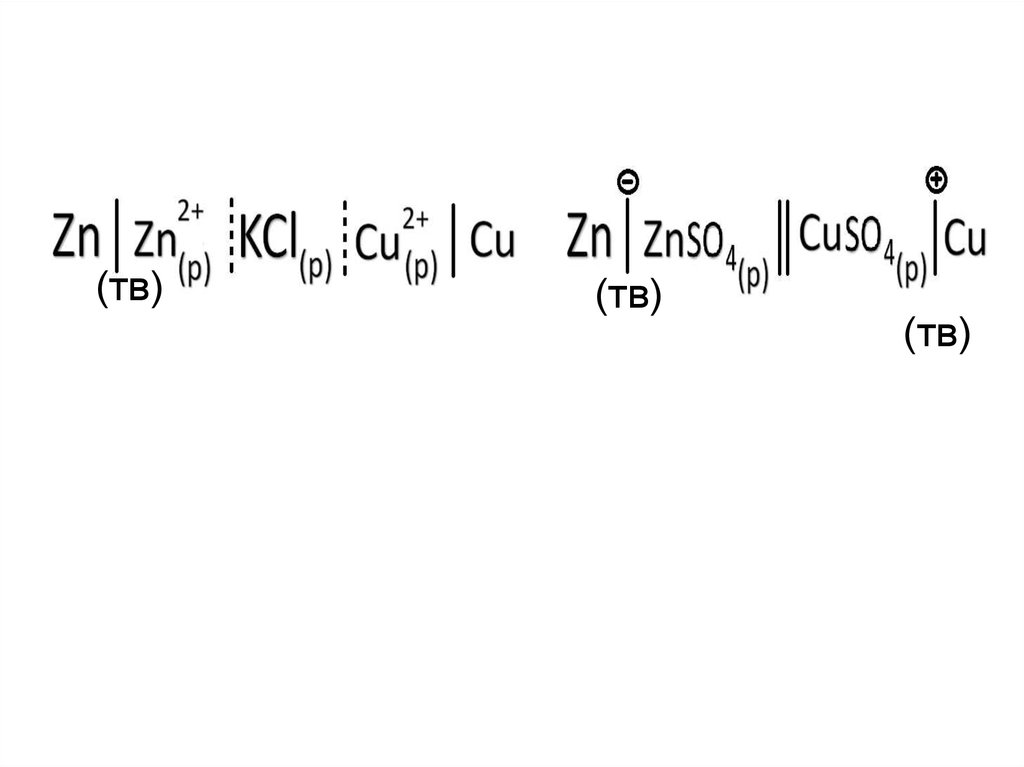
Например: Привести схему ГЭ, составленного из двух
электродов I рода: цинкового и медного.
Zn │ZnSO4;
φ0 = -0,76 В
АНОД
Cu │CuSO4;
φ0 = 0,34 В
КАТОД
28.
(тв)(тв)
(тв)
29.
Уравнение НЕРНСТА(B)
φ (Mez+, Me) – электродный потенциал металла Me в растворе, содержащем
катионы Men+, вольт
φo (Mez+, Me) – стандартный электродный потенциал, вольт
R – универсальная газовая постоянная, Дж\моль∙К
Т – абсолютная температура, К
n – число электронов, участвующих в электродном процессе,
F – постоянная Фарадея,
a – активность ионов металла в растворе (для разбавленных растворов ее заменяют
на концентрацию с), моль/дм3
30.
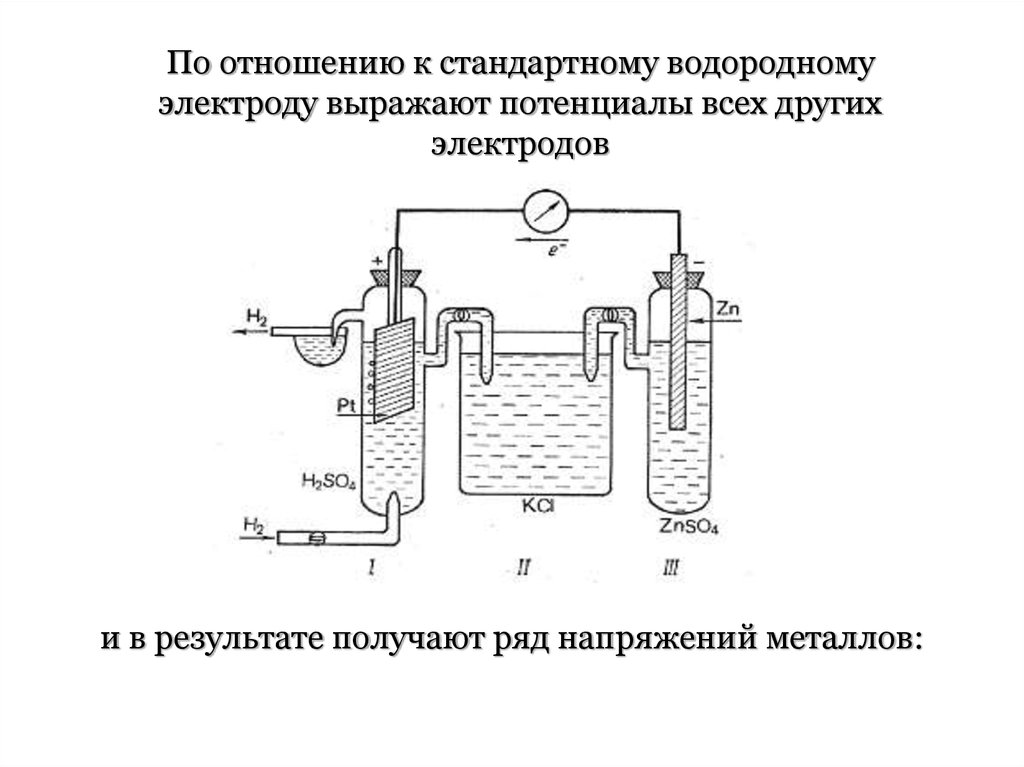
Измерение электродных потенциаловЭлектродные потенциалы измеряют с помощью
стандартного водородного электрода.
Условная запись электрода:
РH 2 1атм
(Pt) H2 | H+
или
(Pt) H2 | H2SO4
Токообразующая реакция:
2Н+
aH 1
H2 - 2ē
При стандартных условиях
(t = 298К, Р=1 атм, а (Н+)=1 моль/дм3)
0
( Pt ) H 2 | H
0
31.
Уравнение Нернста для водородного электрода:( Pt ) H
/
H
2
0
( Pt ) H 2 | H
0,059 CH
lg
n
PH2
( Pt ) H |H 0,059lg CH
2
( Pt ) H |H 0,059 pH
2
32.
По отношению к стандартному водородномуэлектроду выражают потенциалы всех других
электродов
и в результате получают ряд напряжений металлов:
33.
Электрохимический ряд напряжений металловАктивные
Средней активности
Благород
ные
Уменьшение химической активности металла
Увеличение потенциала
Усиление окислительных свойств
34.
Окислительно – восстановительныесистемы
35.
в кислой среде:,
36.
Системы 1 типа:Системы 2 типа:
37.
38.
Окислительно-восстановительный электродсистема, в которой инертный металл (Pt, Au)
погружен в раствор, содержащий ионы в разных
степенях окисления:
Pt
Условная запись:
Pt│Fe2+, Fe3+
Электродная реакция:
Fe3+ + ē
Fe2+
Уравнение Нернста:
FeSO4 +
Fe2(SO4)3
Fe
3
, Fe2
0
Fe
3
, Fe2
3+).
cC(Fe
окисл
0, 059
lg
2+).
n
сC(Fe
восст
39.
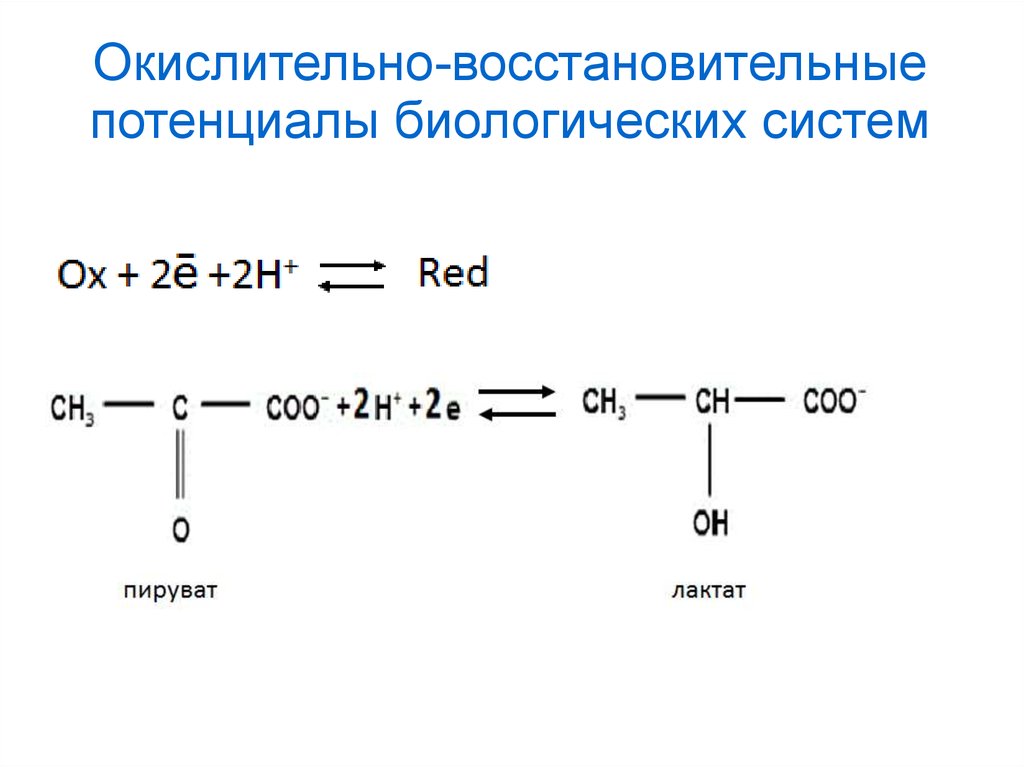
Окислительно-восстановительныепотенциалы биологических систем
40.
41.
42.
Расчет ЭДС гальванического элементаЭлектродвижущая сила (ЭДС) –
это разность электродных потенциалов
катода и анода в разомкнутом ГЭ
ЭДС(Е)
Еº=φºок. - φºвосст.
Еº>0
43.
Направление протеканияокислительно-восстановительных
реакций
Е° = 0 – условие возникновения хим. равновесия
G° = -2,3RT Ig Kp
G° = -zFE°
44.
Электроды:a) I рода
Ионно-металлические и водородный показатель
б) II рода
в) Окислительно-восстановительные эл-ды
г) мембранные
45. Потенциометрия
Потенциометрические методы анализа основаны наизмерение электрохимических потенциалов,возникающих на
погруженных в раствор индикаторных электродах.
Индикаторным называется электрод, по потенциалу
которого судят о концентрации определяемых ионов.
Значение величины потенциала индикаторного электрода
определяют с помощью электрода сравнения, потенциал
которого известен и практически постоянен.
Е –ЭДС составленного гальванического элемента
- Потенциал электрода сравнения
46. Потенциометрическое титрование
47.
48.
Ионоселективные эл-ды. Стеклянный электродвнутр. эл-д сравнение
внешн. эл-д сравнение
49.
Хлорсеребряный электродДля насыщ. KCl:
50.
Хлорсеребряный электрод - электрод сравненияВ насыщенном растворе KCl при температуре 25оС
потенциал хлорсеребряного электрода φ = 0,22 В
51.
Каломельный электродДля насыщенного раствора KCl:






























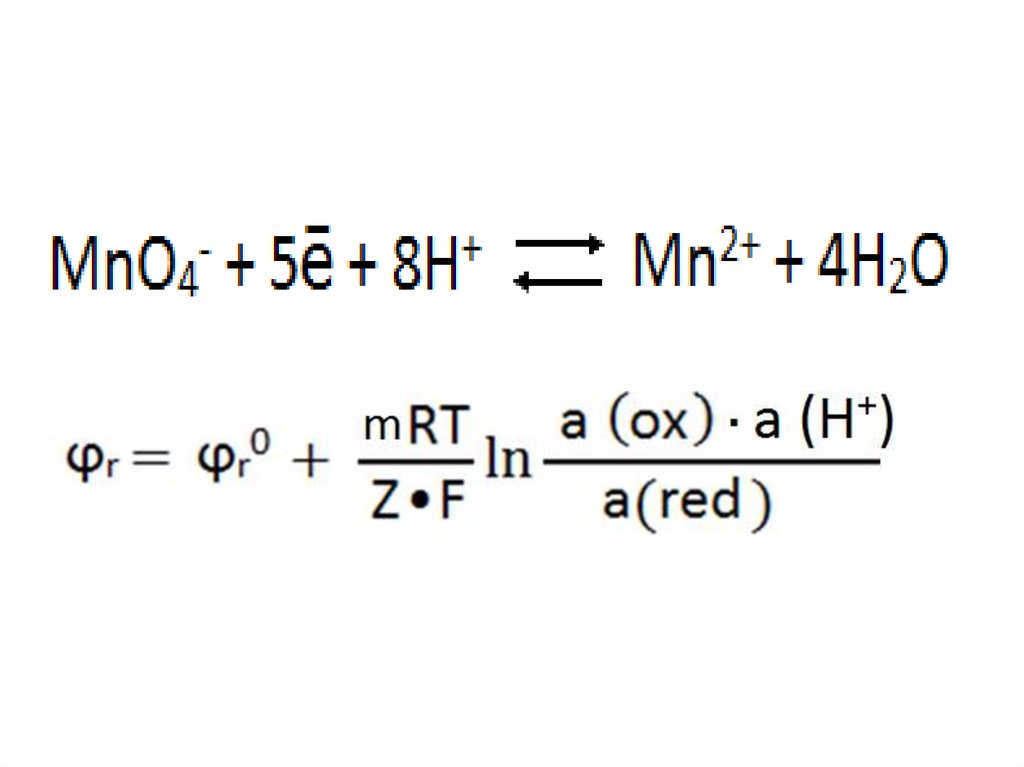








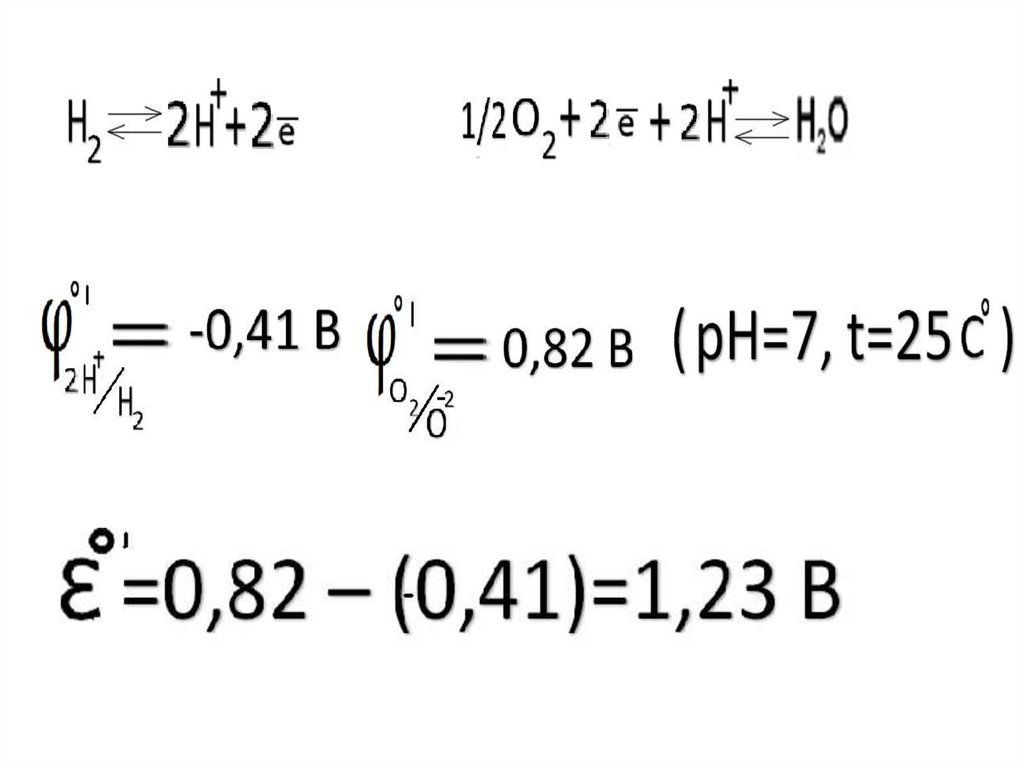




 chemistry
chemistry