Similar presentations:
Молекулярная структура потенциал-зависимых каналов
1. Молекулярная структура потенциал-зависимых каналов
По химическому строению все потенциал-зависимые ионные каналыявляются мембранными гликопротеинами. Эти каналы образуют
водную пору, и их называют pore-loop channels.
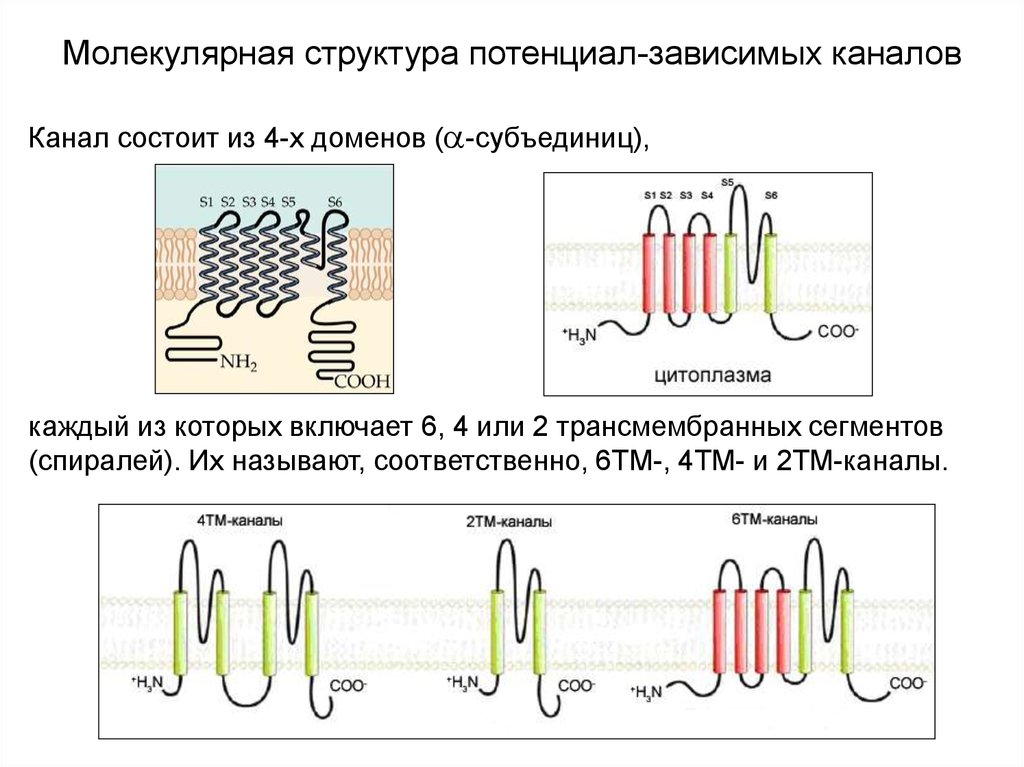
2. Молекулярная структура потенциал-зависимых каналов
Канал состоит из 4-х доменов ( -субъединиц),каждый из которых включает 6, 4 или 2 трансмембранных сегментов
(спиралей). Их называют, соответственно, 6ТМ-, 4ТМ- и 2ТМ-каналы.
3. Молекулярная структура потенциал-зависимых каналов
Их общим признаком является гидрофобный участок между 5 (S5) и 6(S6) (или М1 и М2) трансмембранными сегментами каждого из доменов.
Каждый домен этих каналов включает внеклеточную повторно
входящую в мембрану петлю, а конфигурация этих доменных петель
формирует водную пору, высокоселективную к определенному иону.
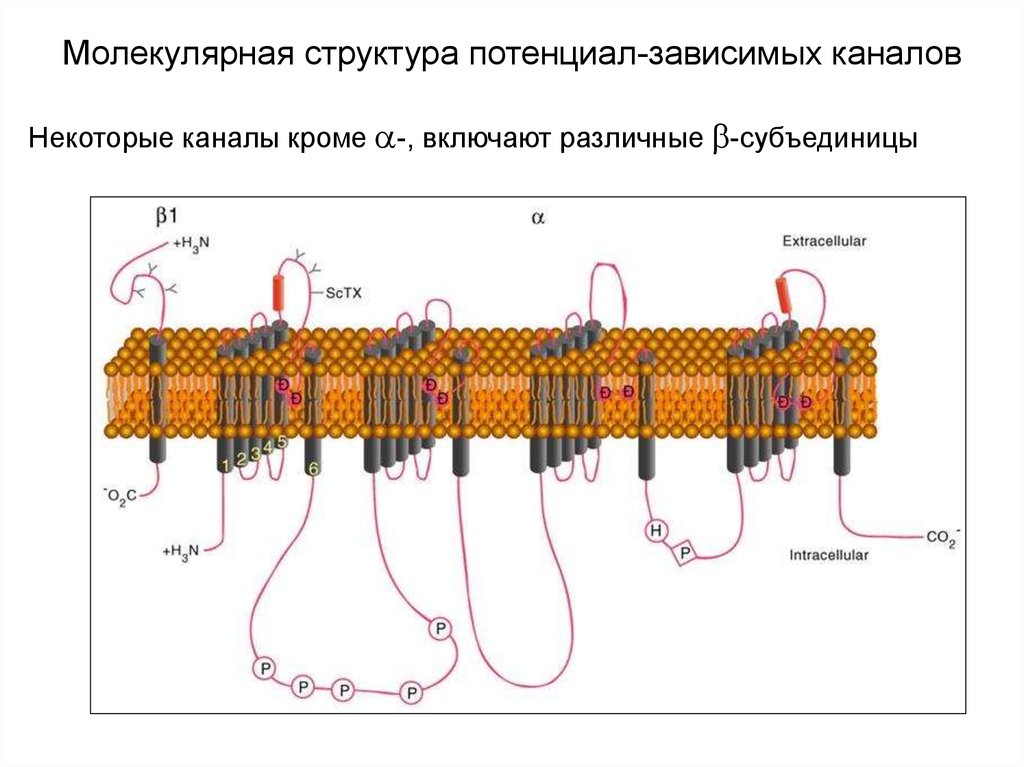
4. Молекулярная структура потенциал-зависимых каналов
Некоторые каналы кроме -, включают различные -субъединицы5. Филогенез потенциал-зависимых каналов
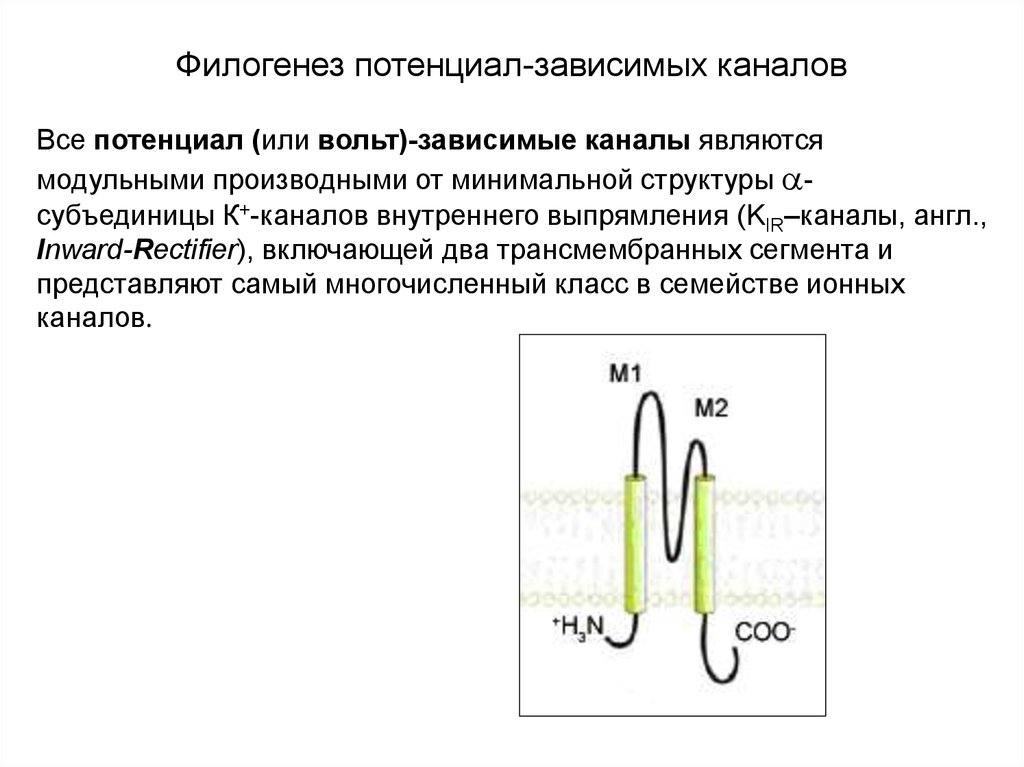
Все потенциал (или вольт)-зависимые каналы являютсямодульными производными от минимальной структуры субъединицы К+-каналов внутреннего выпрямления (KIR–каналы, англ.,
Inward-Rectifier), включающей два трансмембранных сегмента и
представляют самый многочисленный класс в семействе ионных
каналов.
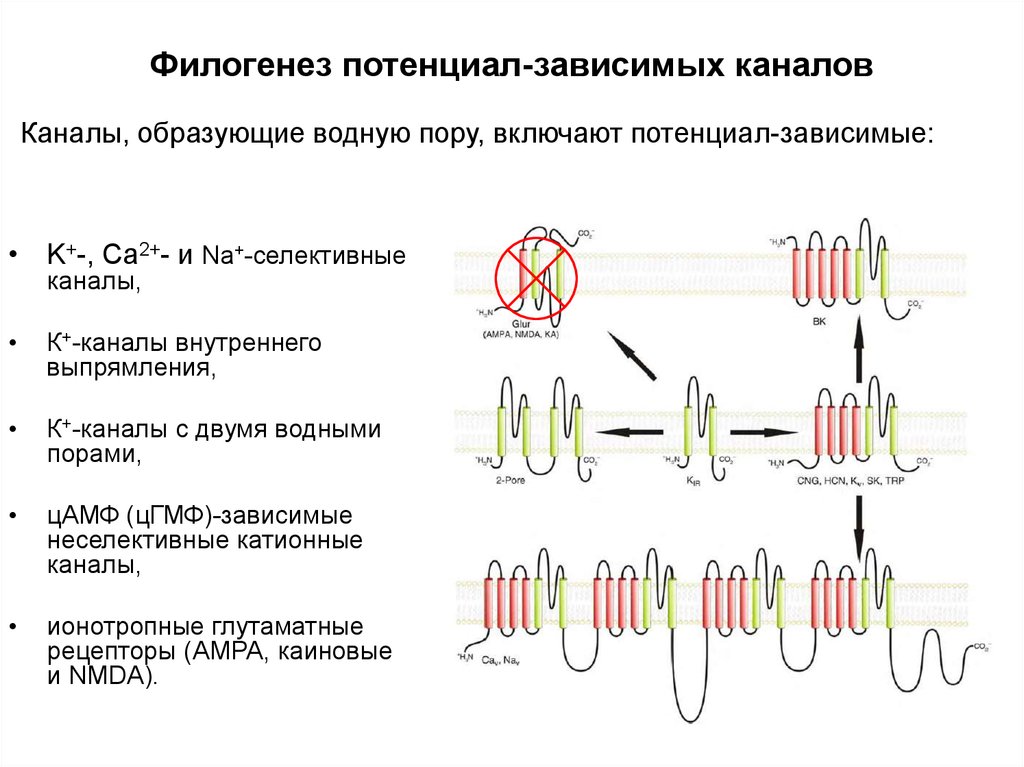
6. Филогенез потенциал-зависимых каналов
Каналы, образующие водную пору, включают потенциал-зависимые:K+-, Ca2+- и Na+-селективные каналы
К+-каналы внутреннего выпрямления (KIR)
потенциал-независимые:
• К+-каналы с двумя водными порами
• Na+-каналы (Na+ ток утечки)
каналы, состояние которых зависит от связывания с различными
внутриклеточными лигандами:
АТФ-активируемые К+-каналы,
Са2+ или Nа+ (Са2+(Nа+)-зависимые КСа(Na)-каналы)
Са2+-каналы, активируемые комплексом Са2+-калмодулин
цАМФ (цГМФ)-зависимые неселективные катионные каналы
К+-каналы, активируемые с участием G-белков
!!! внеклеточными лигандами:
• ионотропные глутаматные рецепторы (AMPA, каиновые и NMDA)
7. Филогенез потенциал-зависимых каналов
Каналы, образующие водную пору, включают потенциал-зависимые:• K+-, Ca2+- и Na+-селективные
каналы,
К+-каналы внутреннего
выпрямления,
К+-каналы с двумя водными
порами,
цАМФ (цГМФ)-зависимые
неселективные катионные
каналы,
ионотропные глутаматные
рецепторы (AMPA, каиновые
и NMDA).
8.
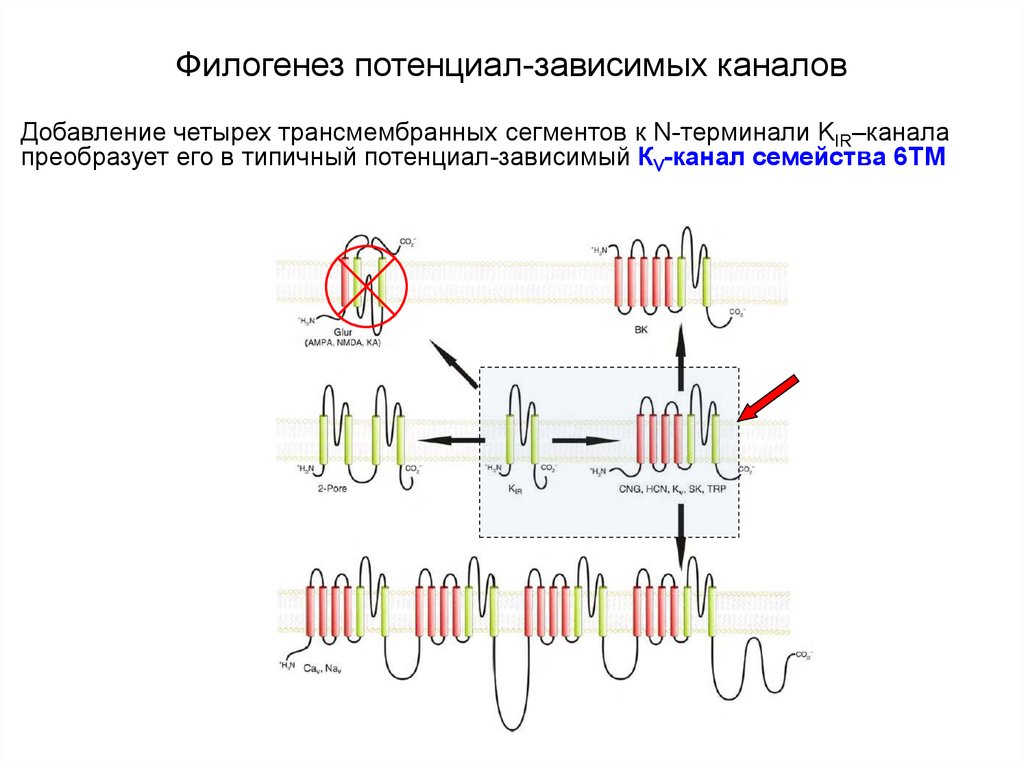
Филогенез потенциал-зависимых каналов9. Филогенез потенциал-зависимых каналов
Добавление четырех трансмембранных сегментов к N-терминали KIR–каналапреобразует его в типичный потенциал-зависимый КV-канал семейства 6ТМ
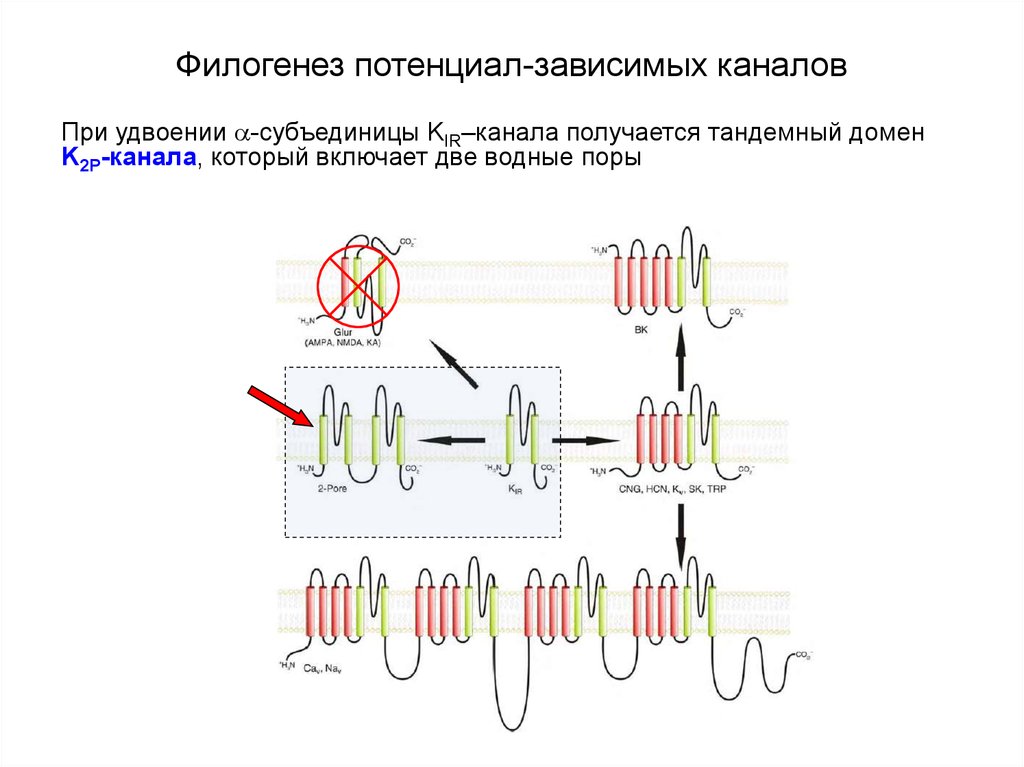
10. Филогенез потенциал-зависимых каналов
При удвоении -субъединицы KIR–канала получается тандемный доменK2P-канала, который включает две водные поры
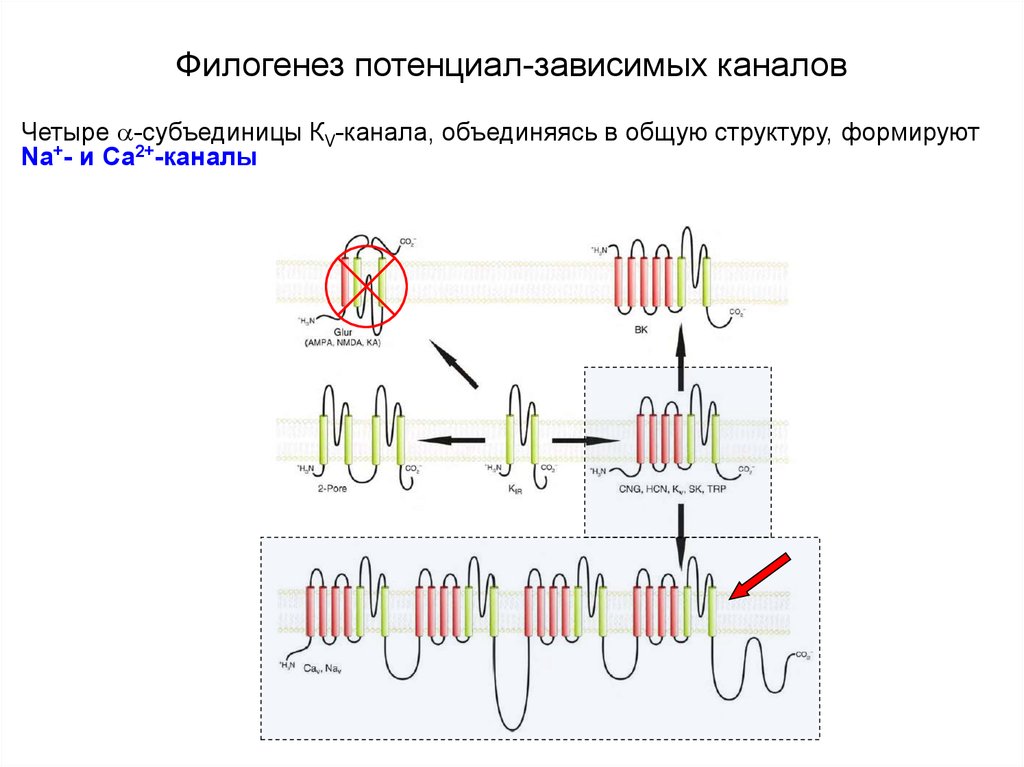
11. Филогенез потенциал-зависимых каналов
Четыре -субъединицы КV-канала, объединяясь в общую структуру, формируютNa+- и Ca2+-каналы
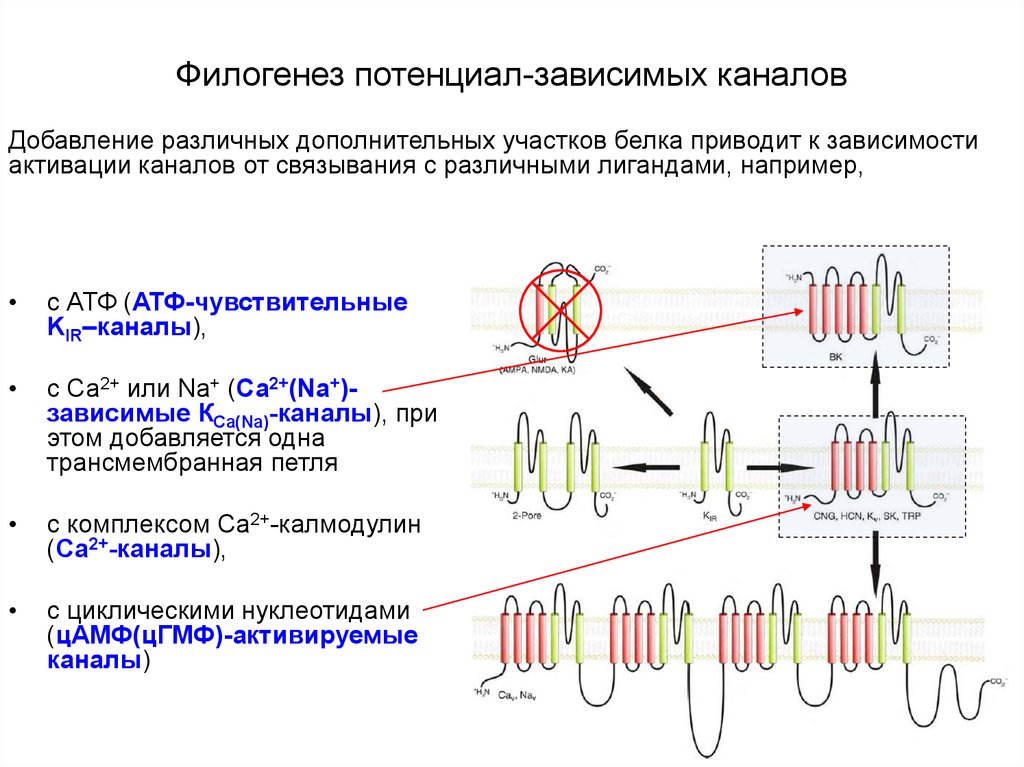
12. Филогенез потенциал-зависимых каналов
Добавление различных дополнительных участков белка приводит к зависимостиактивации каналов от связывания с различными лигандами, например,
с АТФ (АТФ-чувствительные
KIR–каналы),
с Са2+ или Nа+ (Са2+(Nа+)зависимые КСа(Na)-каналы), при
этом добавляется одна
трансмембранная петля
с комплексом Са2+-калмодулин
(Са2+-каналы),
с циклическими нуклеотидами
(цАМФ(цГМФ)-активируемые
каналы)
13. Филогенез потенциал-зависимых каналов
Лиганд-активируемые ионотропные глутаматные рецепторы сходнымобразом формируются из модулей потенциал-активируемых каналов.
Субъединица таких глутаматных рецепторов, по-видимому, происходит от
инвертированной -субъединицы KIR–канала, к которой присоединяется
дополнительный домен (TM4).
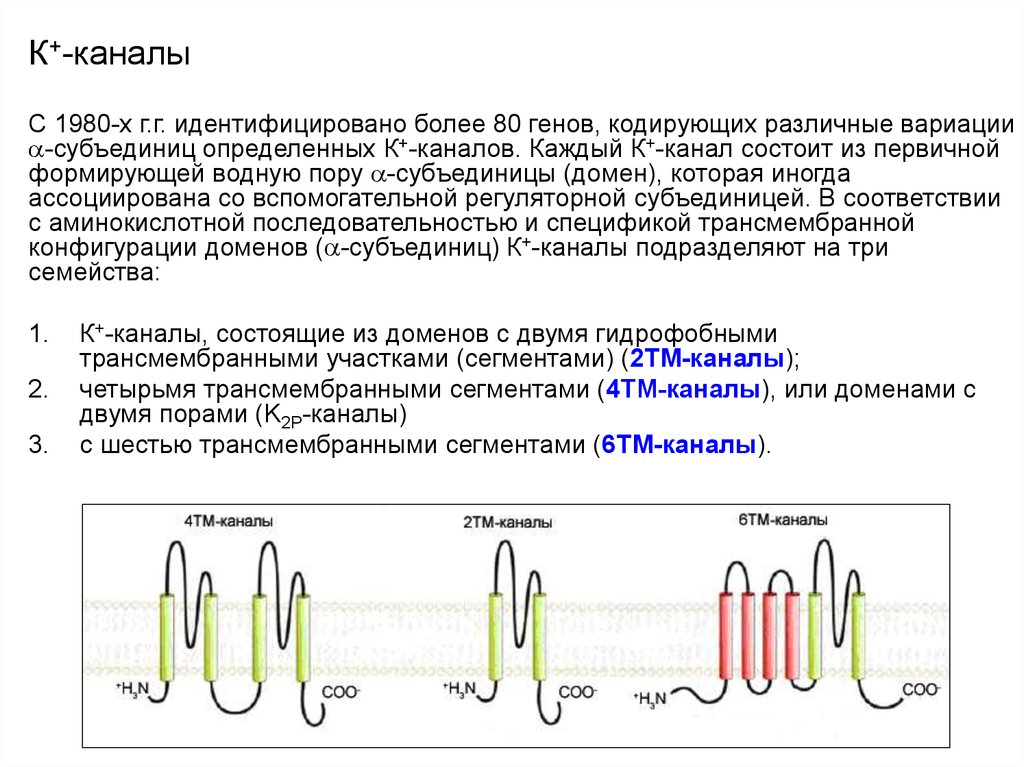
14. К+-каналы
С 1980-х г.г. идентифицировано более 80 генов, кодирующих различные вариации-субъединиц определенных К+-каналов. Каждый К+-канал состоит из первичной
формирующей водную пору -субъединицы (домен), которая иногда
ассоциирована со вспомогательной регуляторной субъединицей. В соответствии
с аминокислотной последовательностью и спецификой трансмембранной
конфигурации доменов ( -субъединиц) К+-каналы подразделяют на три
семейства:
1.
2.
3.
К+-каналы, состоящие из доменов c двумя гидрофобными
трансмембранными участками (сегментами) (2ТМ-каналы);
четырьмя трансмембранными сегментами (4ТМ-каналы), или доменами с
двумя порами (K2P-каналы)
с шестью трансмембранными сегментами (6ТМ-каналы).
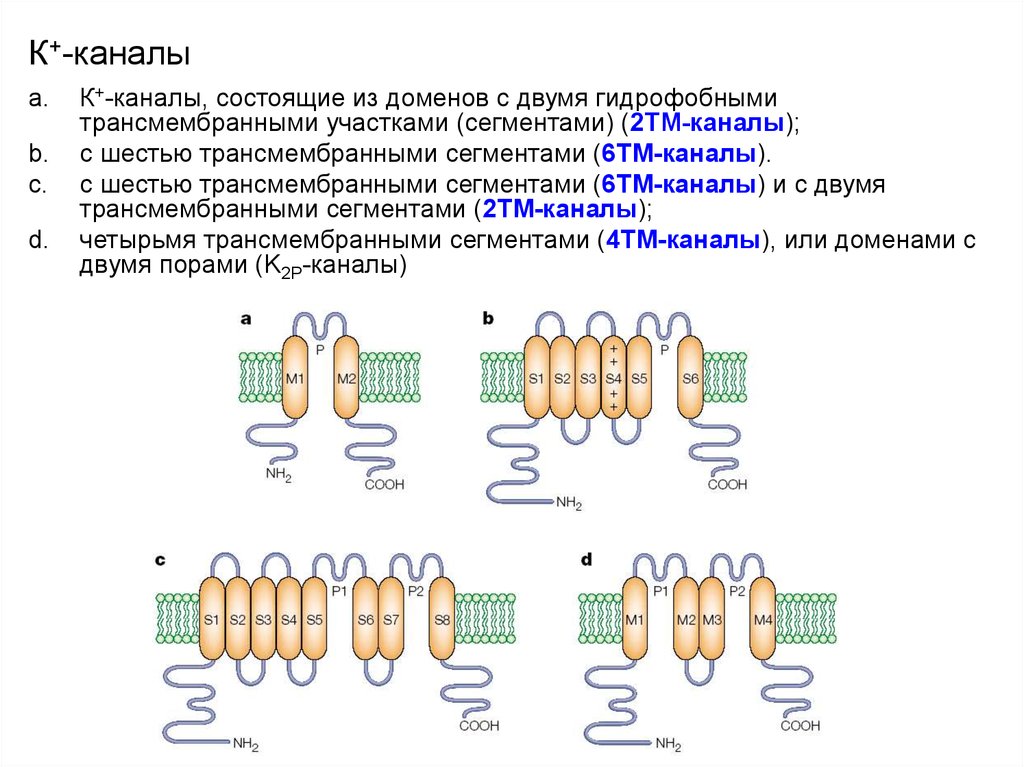
15. К+-каналы
a.b.
c.
d.
К+-каналы, состоящие из доменов c двумя гидрофобными
трансмембранными участками (сегментами) (2ТМ-каналы);
с шестью трансмембранными сегментами (6ТМ-каналы).
с шестью трансмембранными сегментами (6ТМ-каналы) и c двумя
трансмембранными сегментами (2ТМ-каналы);
четырьмя трансмембранными сегментами (4ТМ-каналы), или доменами с
двумя порами (K2P-каналы)
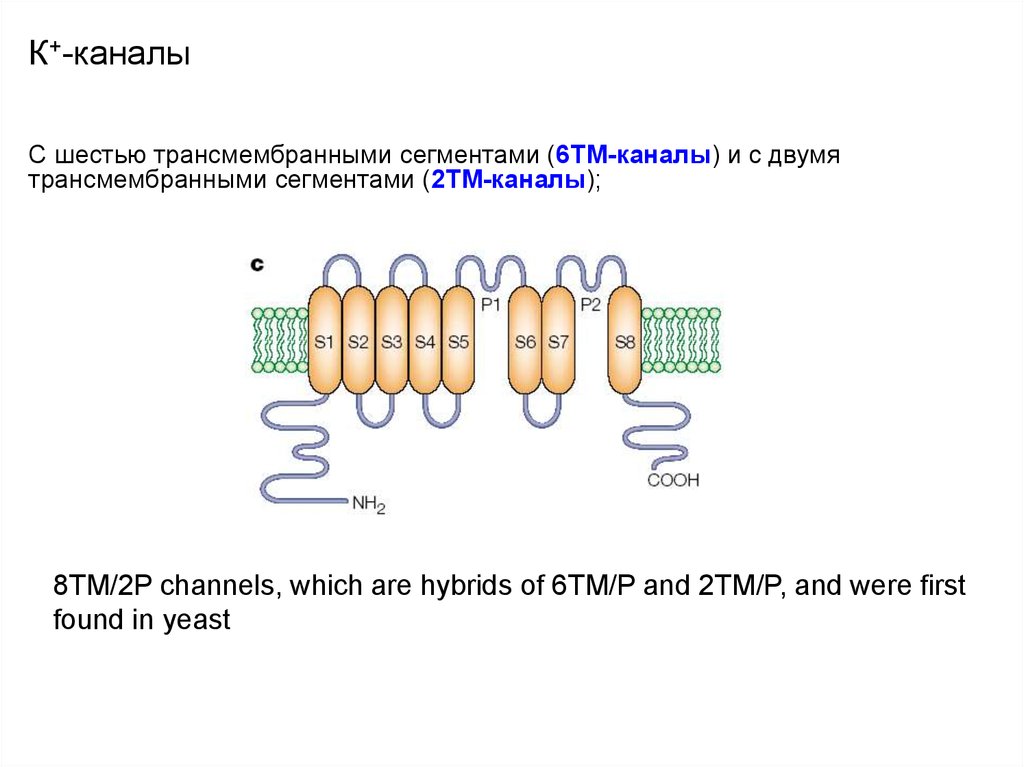
16. К+-каналы
C шестью трансмембранными сегментами (6ТМ-каналы) и c двумятрансмембранными сегментами (2ТМ-каналы);
8TM/2P channels, which are hybrids of 6TM/P and 2TM/P, and were first
found in yeast
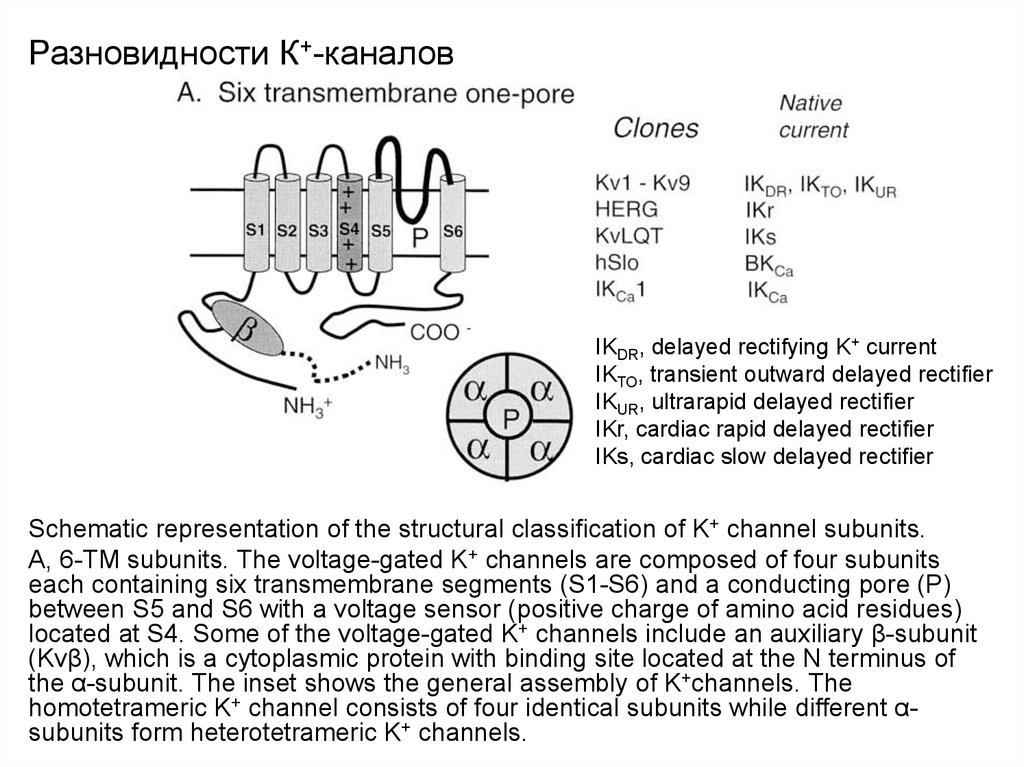
17. Разновидности К+-каналов
IKDR, delayed rectifying K+ currentIKTO, transient outward delayed rectifier
IKUR, ultrarapid delayed rectifier
IKr, cardiac rapid delayed rectifier
IKs, cardiac slow delayed rectifier
Schematic representation of the structural classification of K+ channel subunits.
A, 6-TM subunits. The voltage-gated K+ channels are composed of four subunits
each containing six transmembrane segments (S1-S6) and a conducting pore (P)
between S5 and S6 with a voltage sensor (positive charge of amino acid residues)
located at S4. Some of the voltage-gated K+ channels include an auxiliary β-subunit
(Kvβ), which is a cytoplasmic protein with binding site located at the N terminus of
the α-subunit. The inset shows the general assembly of K+channels. The
homotetrameric K+ channel consists of four identical subunits while different αsubunits form heterotetrameric K+ channels.
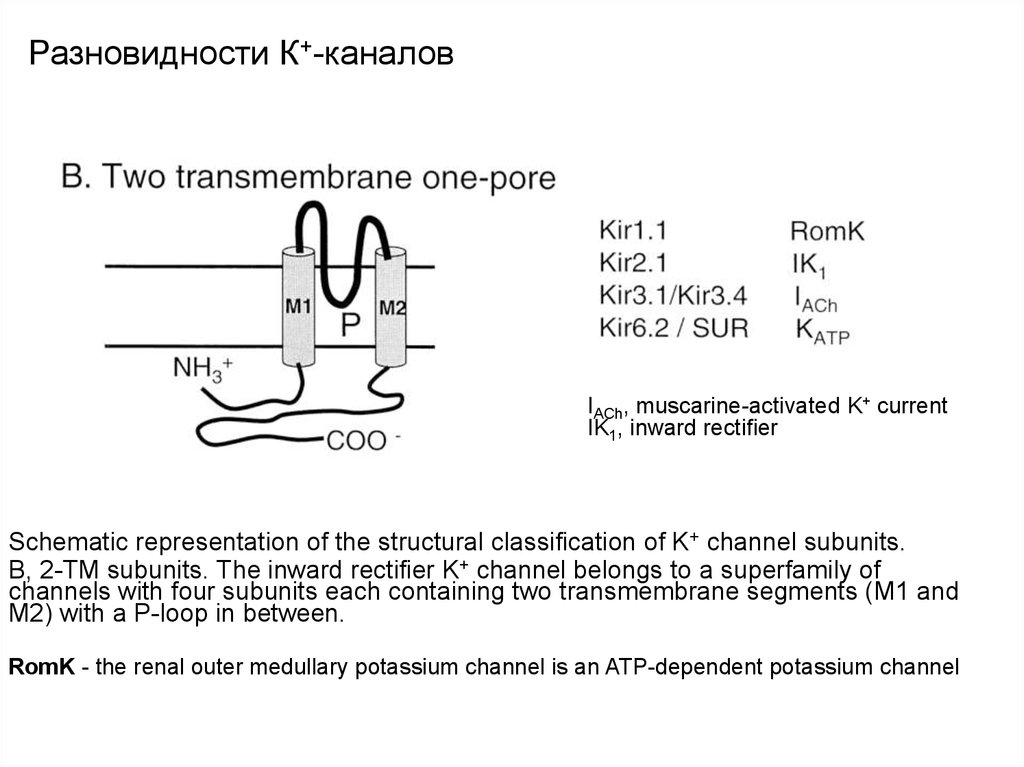
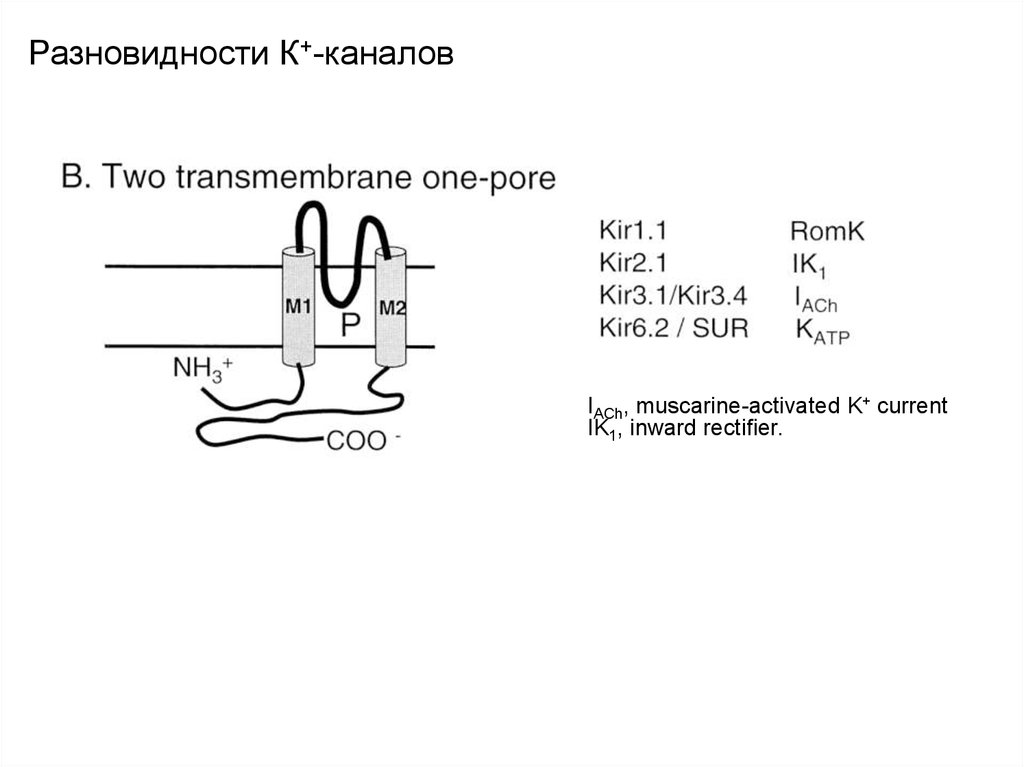
18. Разновидности К+-каналов
IACh, muscarine-activated K+ currentIK1, inward rectifier
Schematic representation of the structural classification of K+ channel subunits.
B, 2-TM subunits. The inward rectifier K+ channel belongs to a superfamily of
channels with four subunits each containing two transmembrane segments (M1 and
M2) with a P-loop in between.
RomK - the renal outer medullary potassium channel is an ATP-dependent potassium channel
19. Разновидности К+-каналов
Schematic representation of the structural classification of K+ channel subunits.C, 4-TM subunits. This represents a class of the K+ channels that has four
transmembranes with two P-loops.
TWIK, two-pore weak inward rectifier
TASK, TWIK-related acid-sensitive K+ channel
TRAAK, TWIK-related arachidonic acid-stimulated K+channel
TREK channels are opened by a variety of physical (stretch, acidosis and heat) and
chemical stimuli (polyunsaturated fatty acids, lysophospholipids and volatile
anaesthetics) and are regulated by phosphorylation
.
20. К+-каналы 2ТМ-семейства
Все многообразие потенциал-зависимых каналов в эволюции происходит отканалов этого семейства, которые найдены и всесторонне исследованы в
мембранах прокариот (бактерий).
Это семейство представлено К+-каналами так называемого внутреннего
выпрямления (KIR, англ., inward-rectifier) и включает семь групп разновидностей,
насчитывающих в свою очередь много подтипов -субъединиц.
21.
Разнообразие К+-каналов 2ТМ-семейства22. Разновидности К+-каналов
IACh, muscarine-activated K+ currentIK1, inward rectifier.
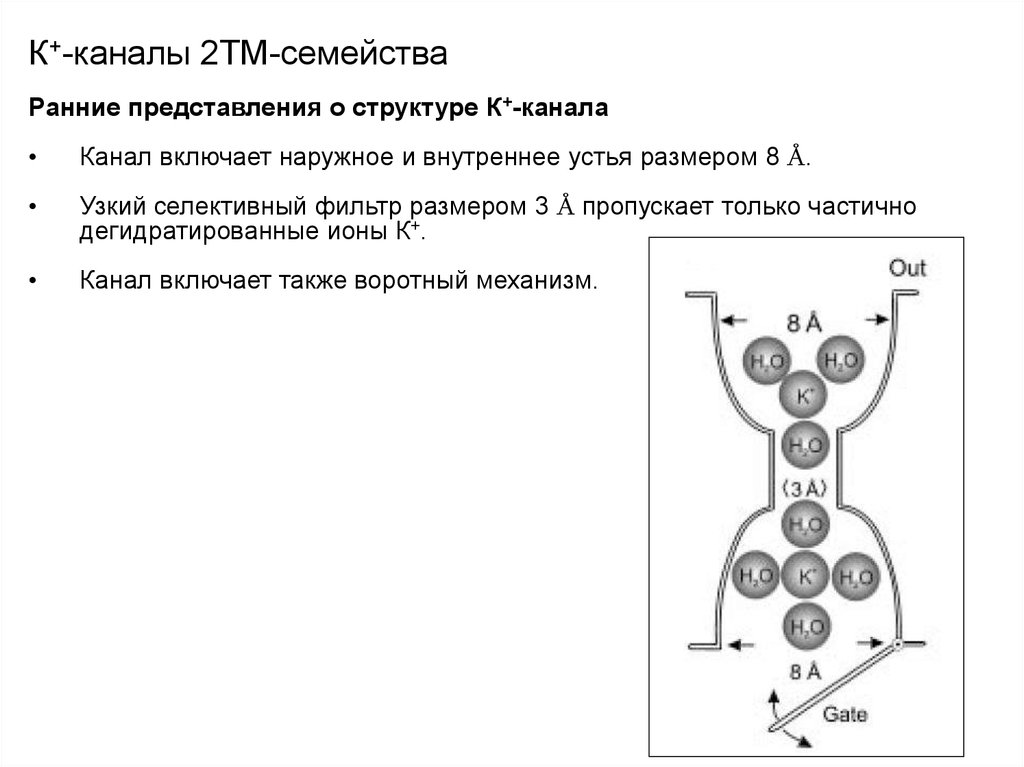
23. К+-каналы 2ТМ-семейства
Ранние представления о структуре К+-каналаКанал включает наружное и внутреннее устья размером 8 Å.
Узкий селективный фильтр размером 3 Å пропускает только частично
дегидратированные ионы К+.
Канал включает также воротный механизм.
24. К+-каналы 2ТМ-семейства
Сведения о структурной организации этих каналов в настоящее время ограниченыстроением K+-канала, представленного одиночным бактериальным белком KCSA,
мембран бактерий Streptomyces lividans, выявленным методом рентгеновской
кристаллографии. Канал KCSA воспроизводит топологию KIR-канала эукариот.
-субъединица состоит из наружного и внутреннего трансмембранных участков и петли
между ними, погруженной в мембрану и образующей водную пору. Трансмембранные
участки М1 и М2 KCSA-( KIR)-каналов являются структурными эквивалентами сегментов
S5 и S6 KV-каналов.
25. К+-каналы 2ТМ-семейства
Путь ионов К+ через канал включает относительно обширную водную полость,связанную с узким селективным фильтром.
Отрицательно заряженные (отмечено красным) выступы спиральных доменов
канала обращены внутрь водной полости, что обеспечивает дегидратацию
ионов К+ (обозначены зеленым) и тем самым их проникновение через
селективный фильтр.
внешняя среда
цитоплазма
26. К+-каналы 2ТМ-семейства
Токи через эти каналы активируются при гиперполяризации и текутпредпочтительно в направлении внутрь клетки, смещая потенциал мембраны к
равновесному потенциалу для К+.
Это семейство включает:
1) К+-каналы устойчивого внутреннего выпрямления,
2) К+-каналы, активируемые с участием G-белков,
3) АТФ-активируемые К+-каналы.
Водная пора этих каналов сформирована тетрамером из четырех субъединиц.
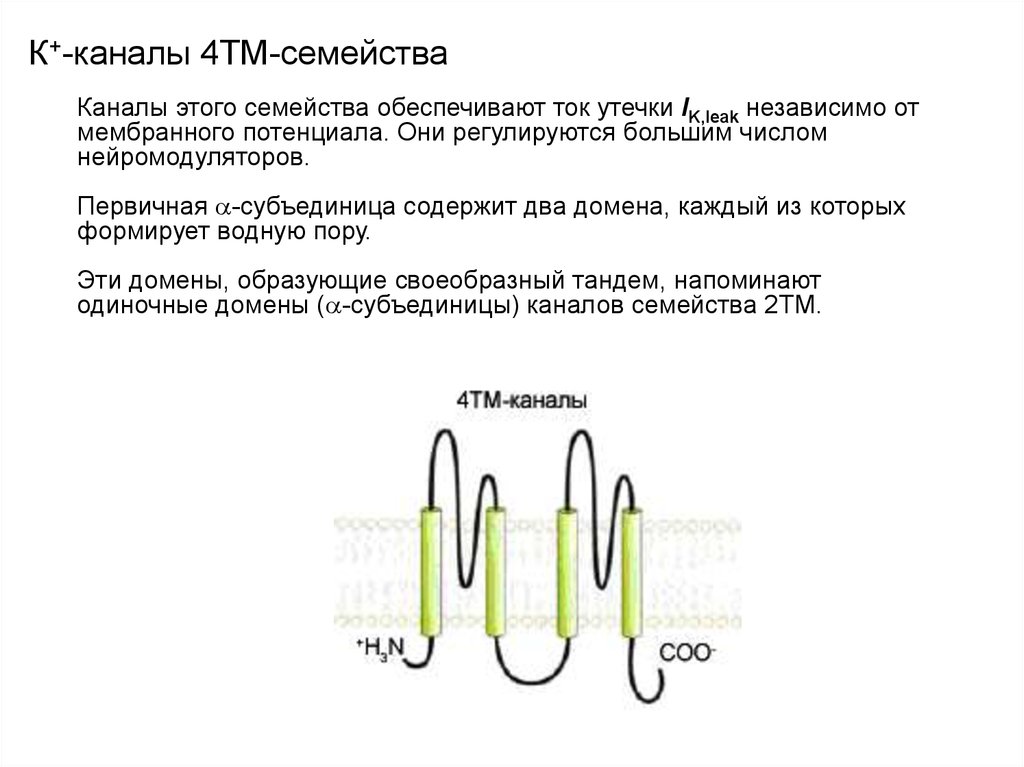
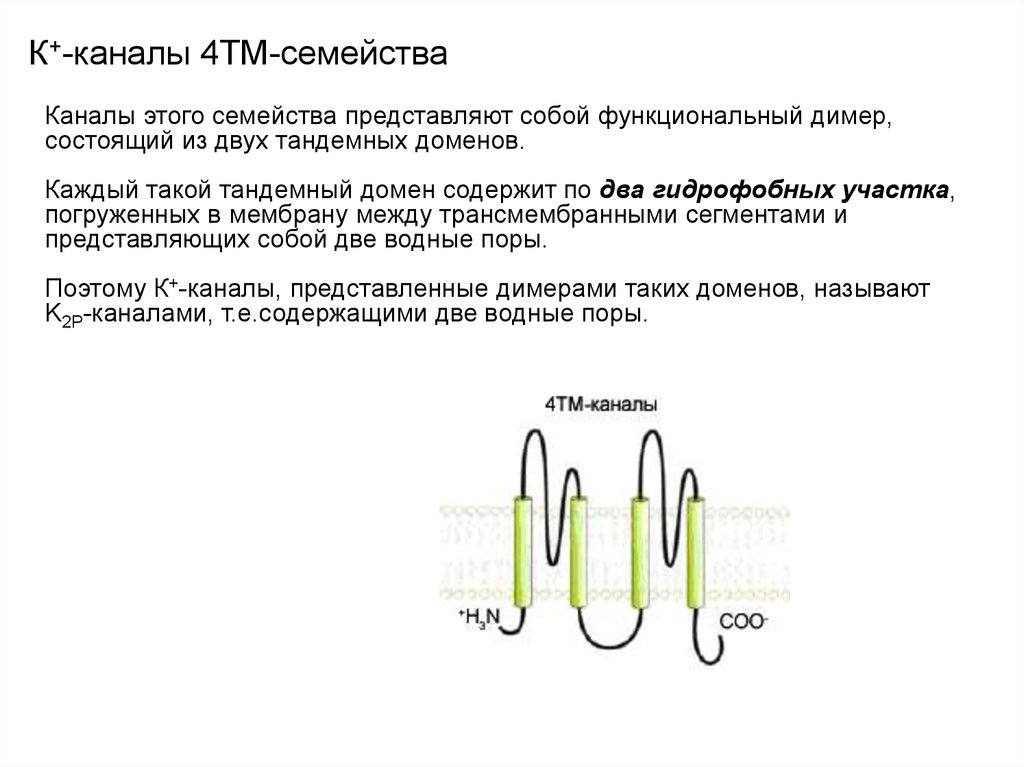
27. К+-каналы 4ТМ-семейства
Каналы этого семейства обеспечивают ток утечки IK,leak независимо отмембранного потенциала. Они регулируются большим числом
нейромодуляторов.
Первичная -субъединица содержит два домена, каждый из которых
формирует водную пору.
Эти домены, образующие своеобразный тандем, напоминают
одиночные домены ( -субъединицы) каналов семейства 2ТМ.
28. К+-каналы 4ТМ-семейства
Каналы этого семейства представляют собой функциональный димер,состоящий из двух тандемных доменов.
Каждый такой тандемный домен содержит по два гидрофобных участка,
погруженных в мембрану между трансмембранными сегментами и
представляющих собой две водные поры.
Поэтому К+-каналы, представленные димерами таких доменов, называют
K2P-каналами, т.е.содержащими две водные поры.
29. К+-каналы 4ТМ-семейства
30. Разновидности К+-каналов
TWIK, two-pore weak inward rectifier;TASK, TWIK-related acid-sensitive K+ channel;
TRAAK, TWIK-related arachidonic acid-stimulated K+channel.
TREK channels are opened by a variety of physical (stretch, acidosis and heat)
and chemical stimuli (polyunsaturated fatty acids, lysophospholipids and
volatile anaesthetics) and are regulated by phosphorylation
31.
Разновидности К+-каналов. TREK channels.TREK channels are opened by a variety of physical (stretch, acidosis and
heat) and chemical stimuli (polyunsaturated fatty acids, lysophospholipids
and volatile anaesthetics) and are regulated by phosphorylation
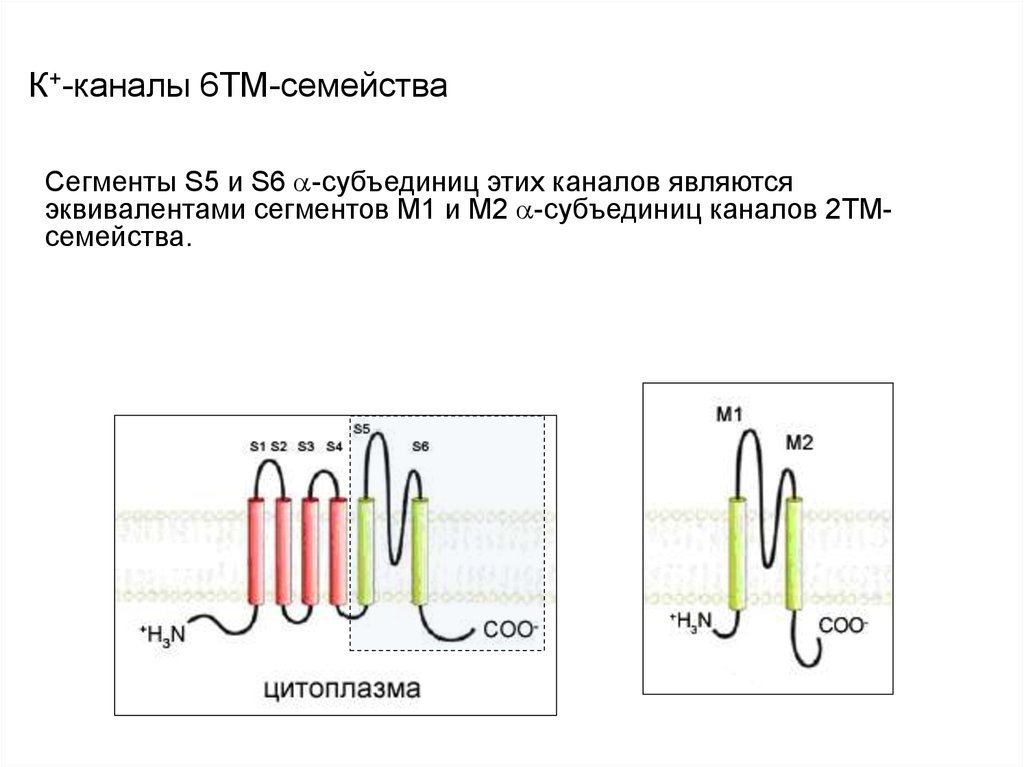
32. К+-каналы 6ТМ-семейства
Сегменты S5 и S6 -субъединиц этих каналов являютсяэквивалентами сегментов М1 и М2 -субъединиц каналов 2ТМсемейства.
33. К+-каналы 6ТМ-семейства
Включает два основных подсемейства:1) потенциал-зависимые KV-каналы
2) потенциал/Са2+-зависимые или только Са2+-зависимые
К-каналы (КСа-каналы).
Каждое из этих подразделений содержит много подтипов субъединиц, и некоторые из них (KV1) могут быть ассоциированы с
двумя разновидностями ( 1 и 2) вспомогательной регуляторной субъединицы.
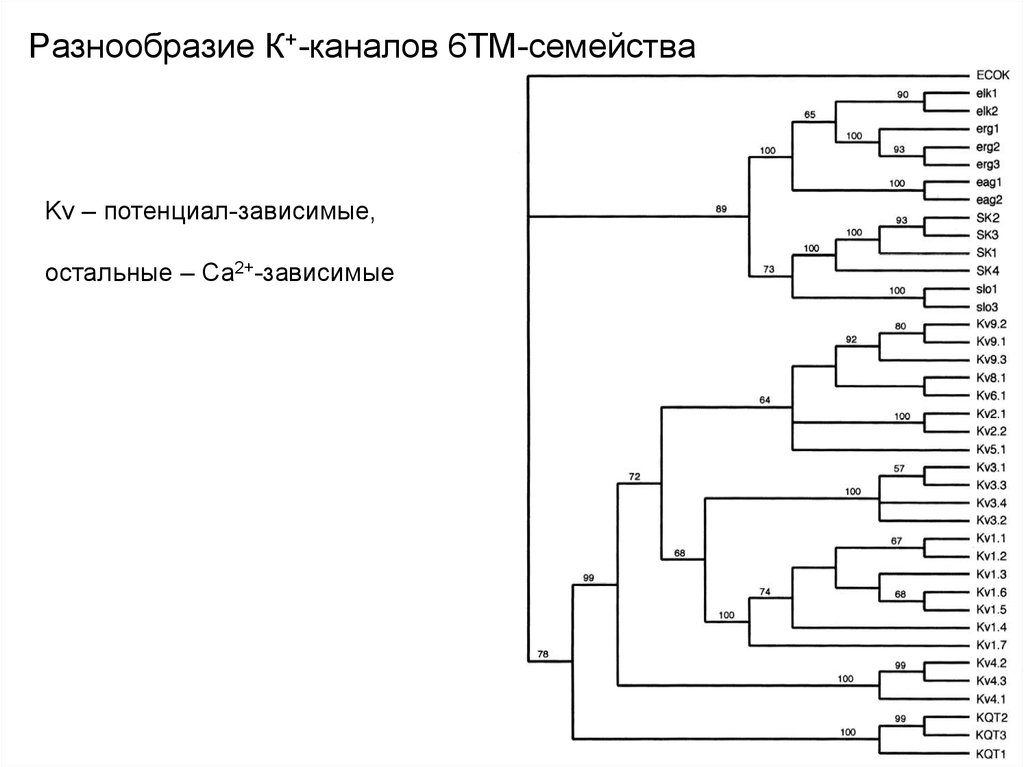
34.
Разнообразие К+-каналов 6ТМ-семействаKv – потенциал-зависимые,
остальные – Са2+-зависимые
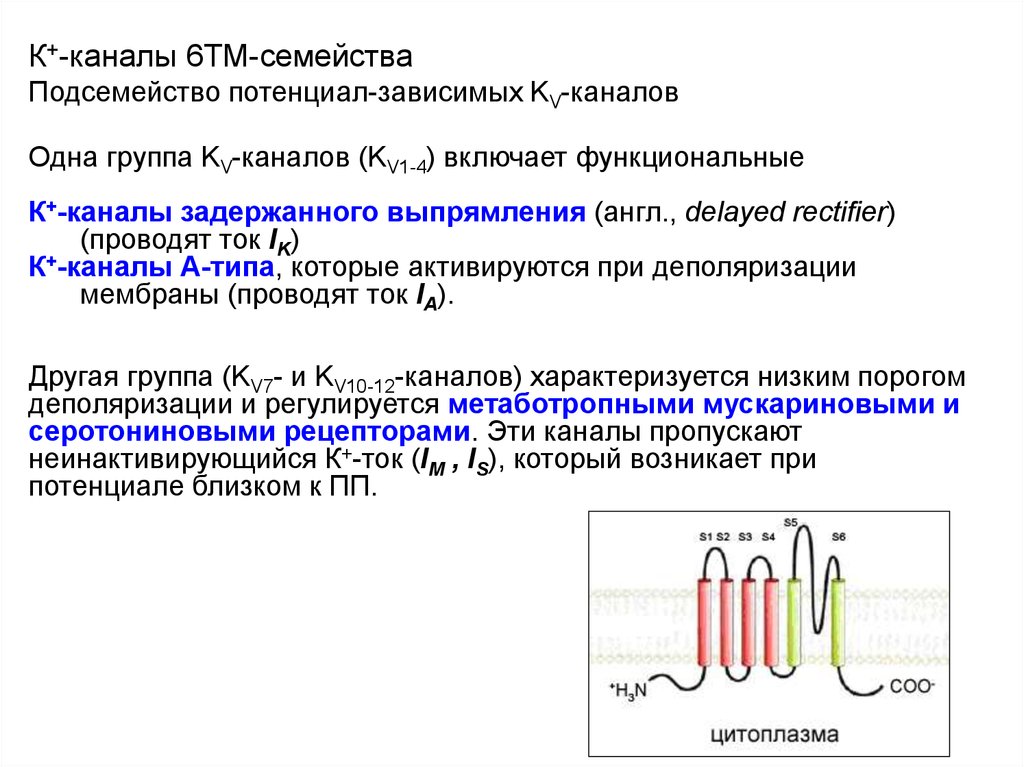
35. К+-каналы 6ТМ-семейства Подсемейство потенциал-зависимых KV-каналов
Одна группа KV-каналов (KV1-4) включает функциональныеК+-каналы задержанного выпрямления (англ., delayed rectifier)
(проводят ток IK)
К+-каналы А-типа, которые активируются при деполяризации
мембраны (проводят ток IA).
Другая группа (KV7- и KV10-12-каналов) характеризуется низким порогом
деполяризации и регулируется метаботропными мускариновыми и
серотониновыми рецепторами. Эти каналы пропускают
неинактивирующийся К+-ток (IМ , IS), который возникает при
потенциале близком к ПП.
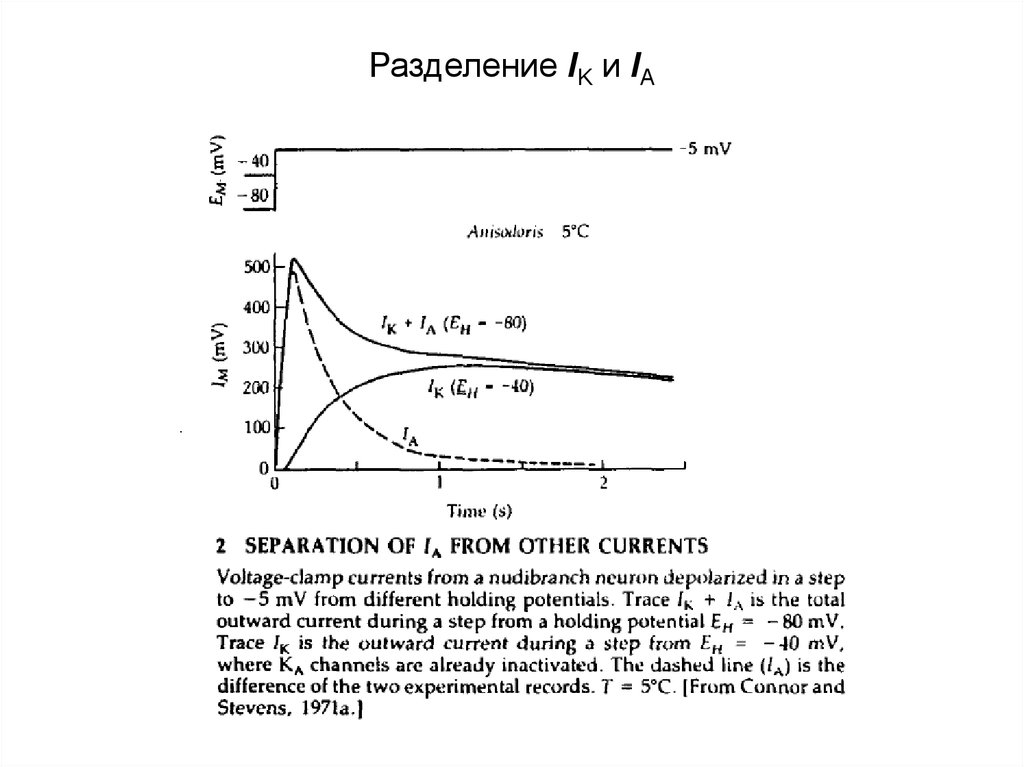
36. Разделение IK и IA
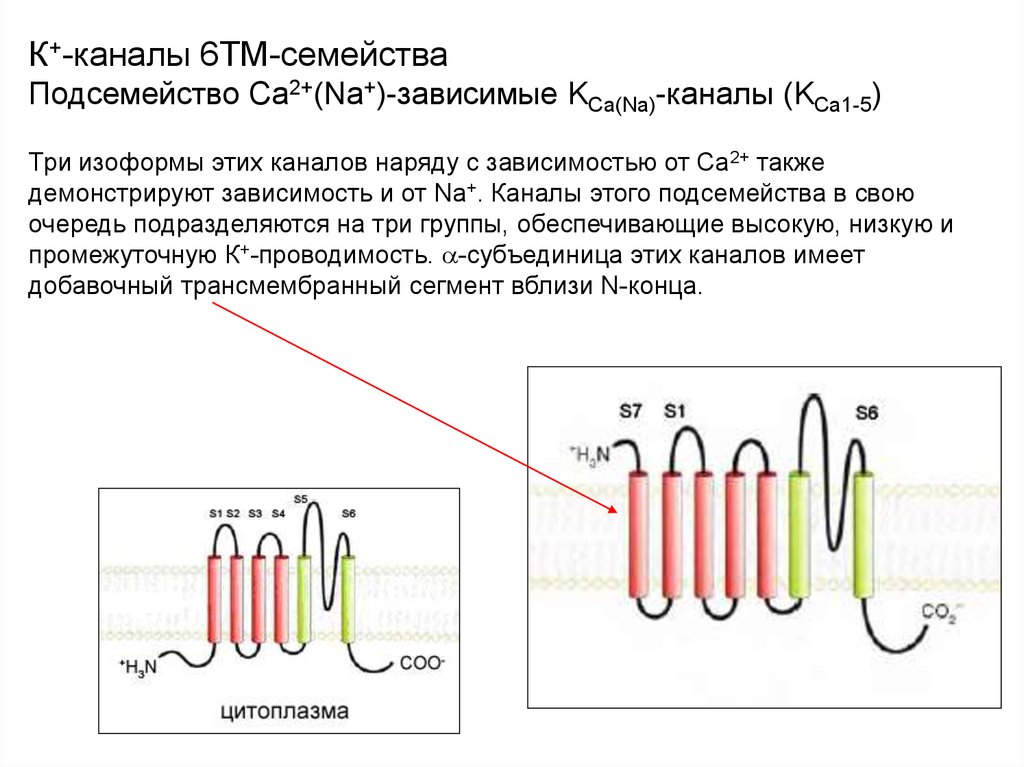
37. К+-каналы 6ТМ-семейства Подсемейство Са2+(Nа+)-зависимые KСа(Na)-каналы (KСа1-5)
Три изоформы этих каналов наряду с зависимостью от Са2+ такжедемонстрируют зависимость и от Nа+. Каналы этого подсемейства в свою
очередь подразделяются на три группы, обеспечивающие высокую, низкую и
промежуточную К+-проводимость. -субъединица этих каналов имеет
добавочный трансмембранный сегмент вблизи N-конца.
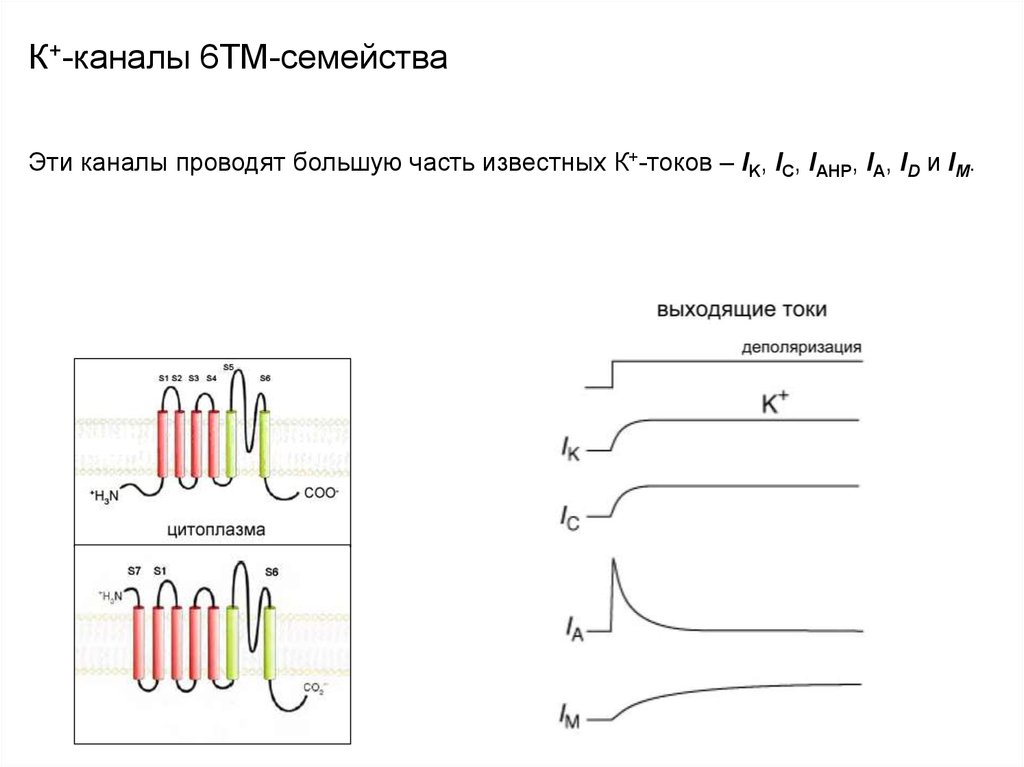
38. К+-каналы 6ТМ-семейства
В семействе 6TM водная пора представлена тетрамером из четырех субъединиц. В редких случаях в состав тетрамера могут входить субъединицы разных подтипов.KV
KСа
39. К+-каналы 6ТМ-семейства
Эти каналы проводят большую часть известных К+-токов – IK, IC, IAHP, IA, ID и IM.40. Селективный фильтр К+-каналов
Уникальный и консервативный селективный фильтр представлен пятьюкислотными остатками (-COO-), которые образуют кольцо из атомов
кислорода их карбоксильных групп и формируют своеобразный
«трафаретный кислородный каркас».
Этот каркас имитирует расположение молекул воды вокруг
гидратированного иона К+. Из-за этого ион К+ легко проникает в
селективный фильтр в результате диффузии в водном растворе.
Гидратированные ионы Na+ (хотя и меньшие по диаметру) имеют другое
расположение молекул воды вокруг них и из-за этого не могут проникать
в область селективного фильтра.
41. К+-каналы
Свойства другого участкасемейств К+-каналов.
значительно
варьируют
среди
различных
Этот участок чувствителен к некоторым агентам, которые влияют на
активность К+-канала:
- потенциал мембраны,
- внутриклеточный Са2+,
- фосфорилирование,
- активные субъединицы G-белков.
Например, трансмембранный сегмент S4 домена потенциал-зависимого KVканала содержит множество положительно заряженных остатков
аминокислот,
которые
предположительно
являются
потенциалчувствительными сенсорами.
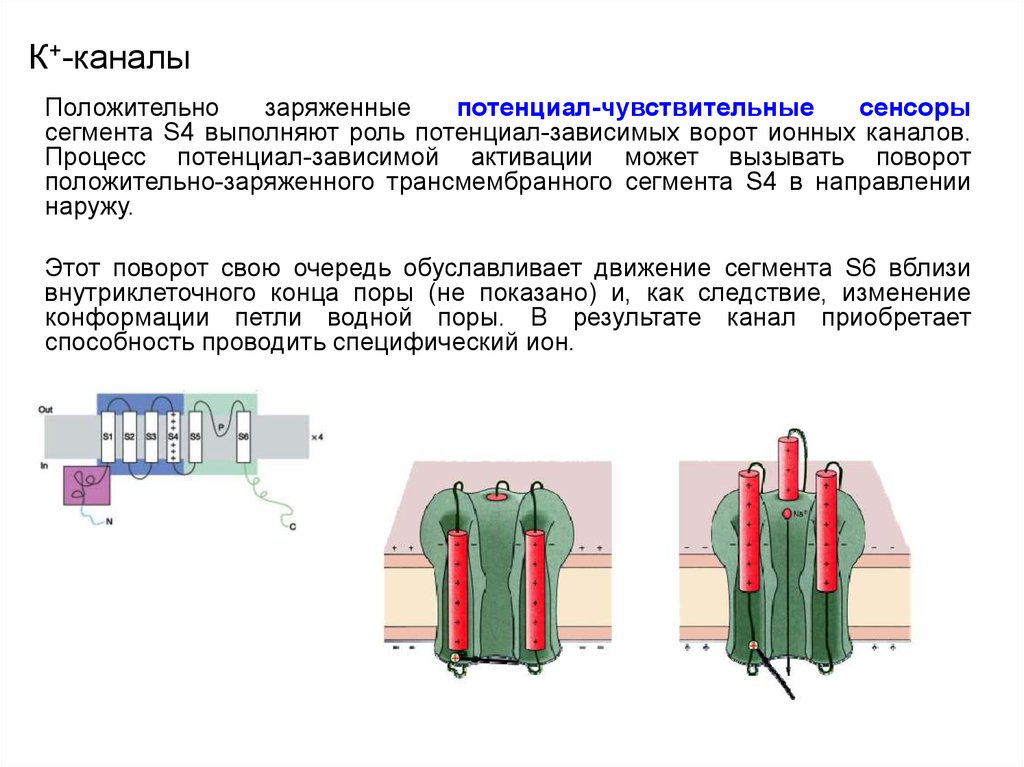
42. К+-каналы
Положительнозаряженные
потенциал-чувствительные
сенсоры
сегмента S4 выполняют роль потенциал-зависимых ворот ионных каналов.
Процесс потенциал-зависимой активации может вызывать поворот
положительно-заряженного трансмембранного сегмента S4 в направлении
наружу.
Этот поворот свою очередь обуславливает движение сегмента S6 вблизи
внутриклеточного конца поры (не показано) и, как следствие, изменение
конформации петли водной поры. В результате канал приобретает
способность проводить специфический ион.
43. К+-каналы
Положительнозаряженные
потенциал-чувствительные
сенсоры
сегмента S4 выполняют роль потенциал-зависимых ворот ионных каналов.
Процесс потенциал-зависимой активации может вызывать поворот
положительно-заряженного трансмембранного сегмента S4 в направлении
наружу.
Этот поворот свою очередь обуславливает движение сегмента S6 вблизи
внутриклеточного конца поры (не показано) и, как следствие, изменение
конформации петли водной поры. В результате канал приобретает
способность проводить специфический ион.
44. Инактивация К+-канала
45. К+-каналы
Свойства других участковсемейств К+-каналов.
значительно
варьируют
среди
различных
Этот участок чувствителен к некоторым агентам, которые влияют на
активность К+-канала:
- потенциал мембраны,
- внутриклеточный Са2+,
- фосфорилирование,
- активные субъединицы G-белков.
У некоторых из семейства KV-каналов внутриклеточная
терминали мобильна и взаимодействует с участком водной
канал открыт. Такое взаимодействие приводит к инактивации
называемая инактивация N-типа), которая функционально
быструю инактивацию К+-тока А-типа (IA).
область Nпоры, когда
К+-тока (так
напоминает
46.
Калиевый канал (KV-типа)(слайд 25-летней давности)
В отличие от натриевого - не имеет механизма инактивации, т.е. остается
открытым в течение всего процесса деполяризации. Воротные токи К+канала также не измерены, но предполагается, что в нем также существуют воротный механизм и селективный фильтр. Проницаемость К+-канала
не коррелирует с ионным радиусом.
Ионная проницаемость К+-канала
----------------------------------------------------------------------------Ион
Радиус
Относительная
иона (нм)
проницаемость P/PK
----------------------------------------------------------------------------Li+
0.120
0.018
+
Na
0.190
0.010
+
K
0.266
1.000
+
Tl
0.280
2.300
+
Rb
0.296
0.910
Аммоний
0.300
0.130
Гидразиний
0.330
0.029
+
Cs
0.338
0.077
Метиламмоний 0.360
0.021
Формамидий
0.360
0.020
Гуанидиний
0.480
0.013
-----------------------------------------------------------------------------
47.
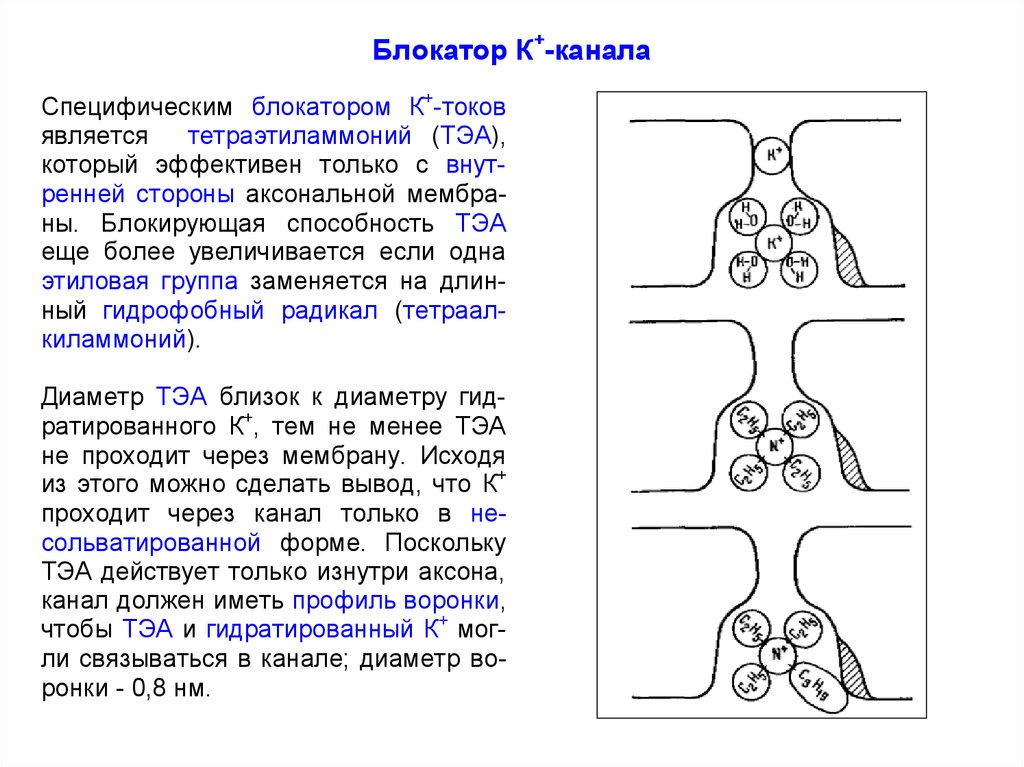
Блокатор К+-каналаСпецифическим блокатором К+-токов
является
тетраэтиламмоний (ТЭА),
который эффективен только с внутренней стороны аксональной мембраны. Блокирующая способность ТЭА
еще более увеличивается если одна
этиловая группа заменяется на длинный гидрофобный радикал (тетраалкиламмоний).
Диаметр ТЭА близок к диаметру гидратированного К+, тем не менее ТЭА
не проходит через мембрану. Исходя
из этого можно сделать вывод, что К+
проходит через канал только в несольватированной форме. Поскольку
ТЭА действует только изнутри аксона,
канал должен иметь профиль воронки,
чтобы ТЭА и гидратированный К+ могли связываться в канале; диаметр воронки - 0,8 нм.
48.
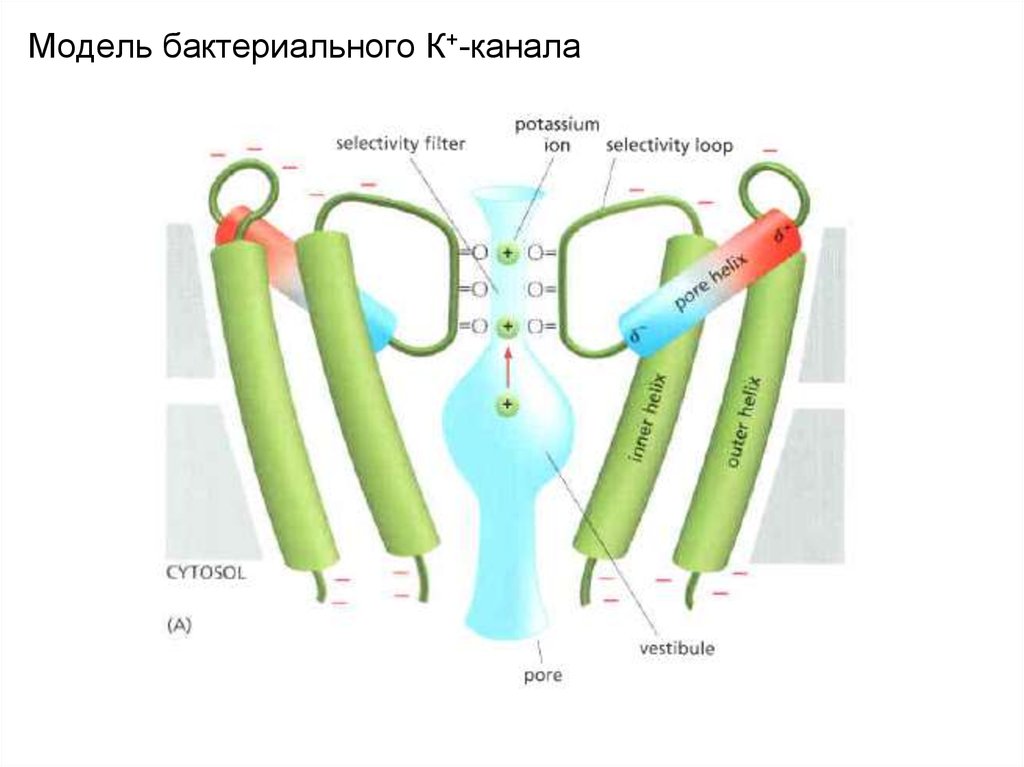
Модель бактериального К+-канала49.
Модель селективного фильтра К+-каналовОписание - на след. странице
50.
Оригинальное описание селективного фильтра К+-каналовK+ specificity of the selectivity filter in a K+ channel. The drawing shows K+ and
Na+ ions (A) in the vestibule and (B) in the selectivity filter of the pore viewed in
cross section. In the vestibule the ions are hydrated. In the selectivity filter they
have lost their water, and the carbonyl oxygens are placed precisely to
accommodate a dehydrated K+ ion. The dehydration of the K+ ion requires
energy, which is precisely balanced by the energy regained by the interaction of
the ion with the carbonyl oxygens that serve as surrogate water molecules
Because the Na+ ion is too small to interact with the oxygens, it can enter the
selectivity filter only at a great energetic expense. The filter therefore selects K+
ions with high specificity. (Adapted from D.A. Doyle et al., Science 280:6977,1998. With permission from AAAS.)
На след стр. свободный перевод.
51. Селективный фильтр К+-каналов
Уникальный и консервативный селективный фильтр представлен пятьюкислотными остатками (-COO-), которые образуют кольцо из атомов
кислорода их карбоксильных групп и формируют своеобразный
«трафаретный кислородный каркас».
Этот каркас имитирует расположение молекул воды вокруг
гидратированного иона К+. Из-за этого ион К+ легко проникает в
селективный фильтр в результате диффузии в водном растворе.
Гидратированные ионы Na+ (хотя и меньшие по диаметру) имеют другое
расположение молекул воды вокруг них и из-за этого не могут проникать
в область селективного фильтра.
52.
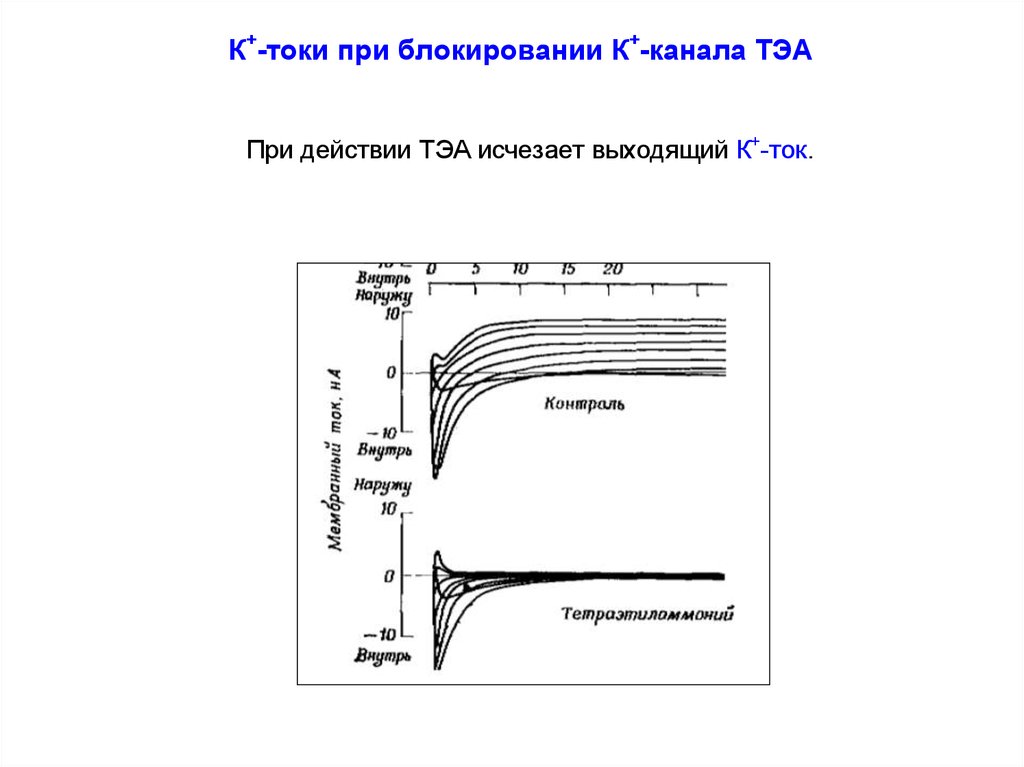
К+-токи при блокировании К+-канала ТЭАПри действии ТЭА исчезает выходящий К+-ток.
53.
54.
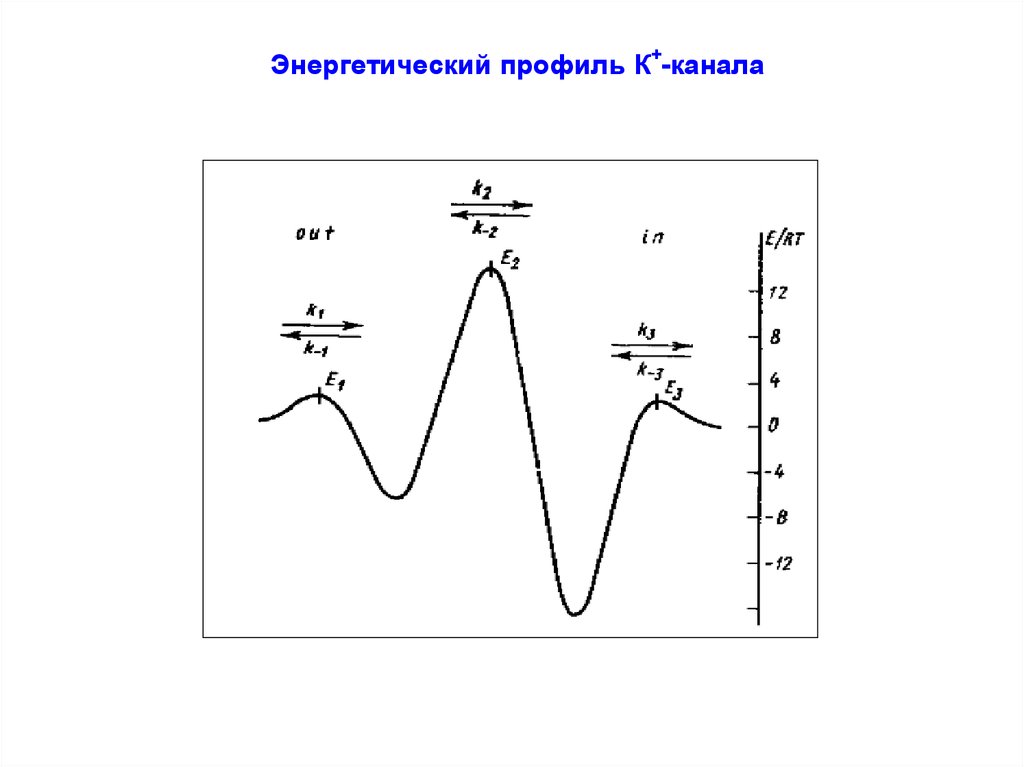
Энергетический профиль К+-канала55. Энергетический профиль К-канала
56. Энергетический профиль К-канала
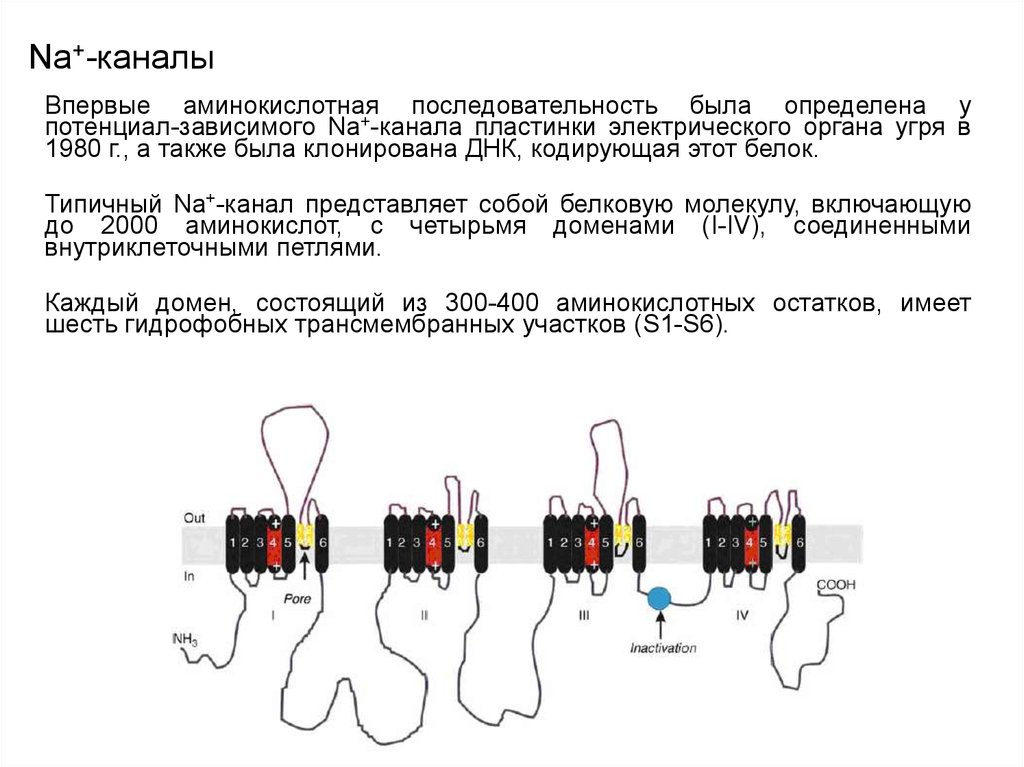
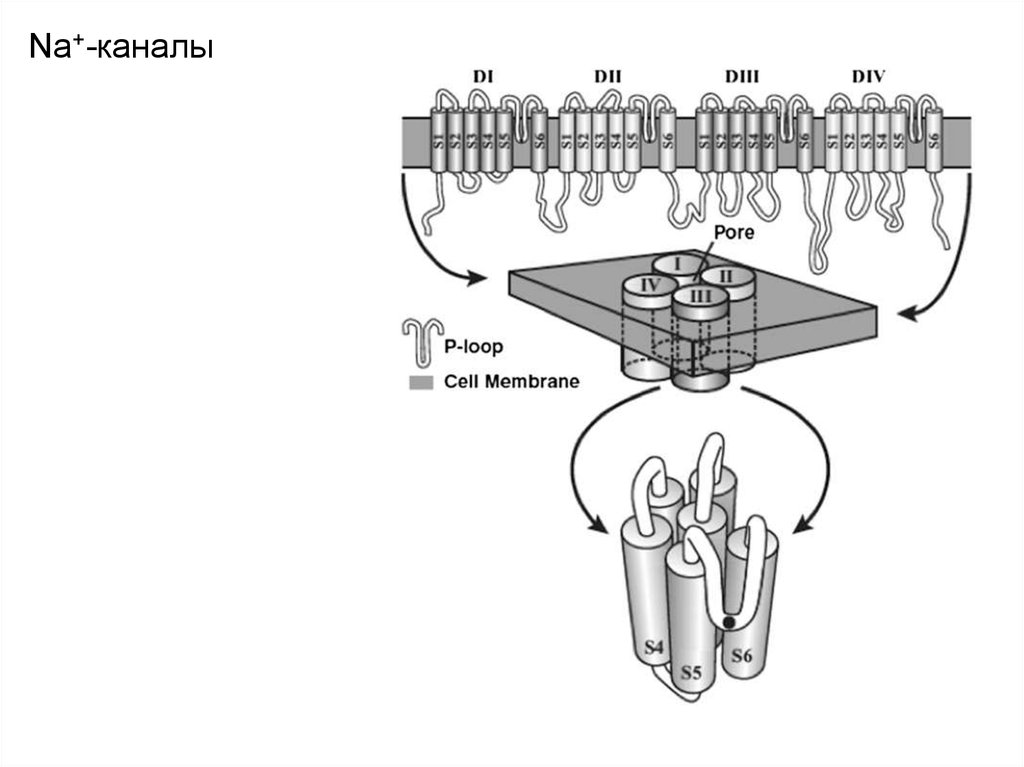
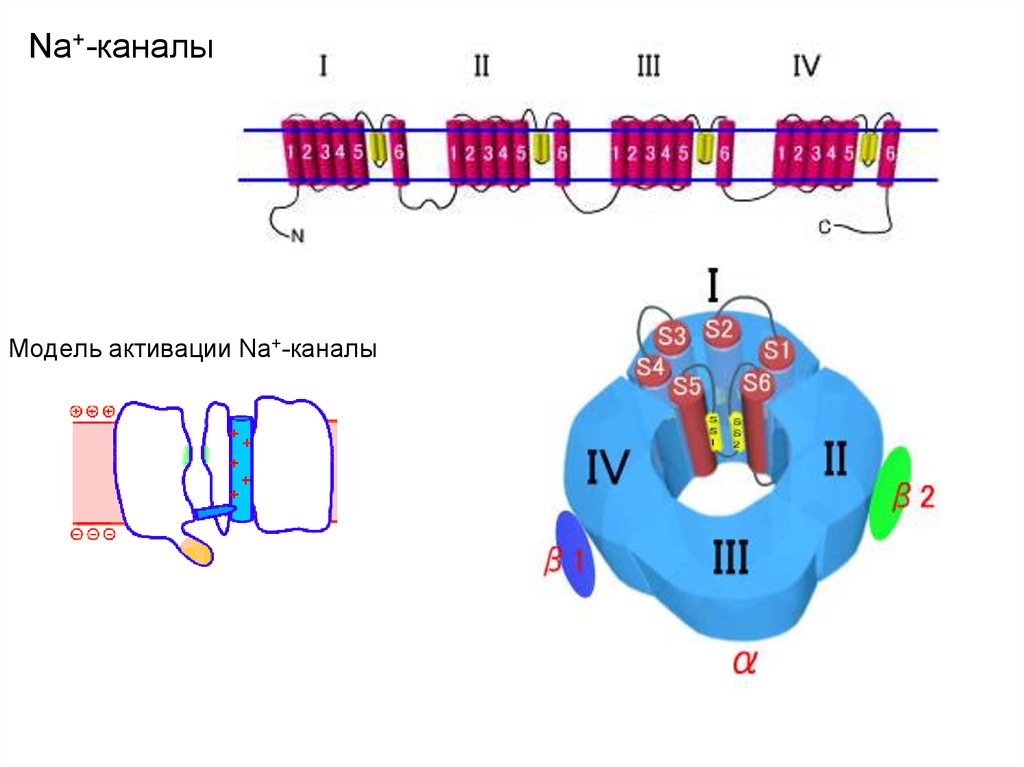
57. Na+-каналы
Впервые аминокислотная последовательность была определена употенциал-зависимого Na+-канала пластинки электрического органа угря в
1980 г., а также была клонирована ДНК, кодирующая этот белок.
Типичный Na+-канал представляет собой белковую молекулу, включающую
до 2000 аминокислот, с четырьмя доменами (I-IV), соединенными
внутриклеточными петлями.
Каждый домен, состоящий из 300-400 аминокислотных остатков, имеет
шесть гидрофобных трансмембранных участков (S1-S6).
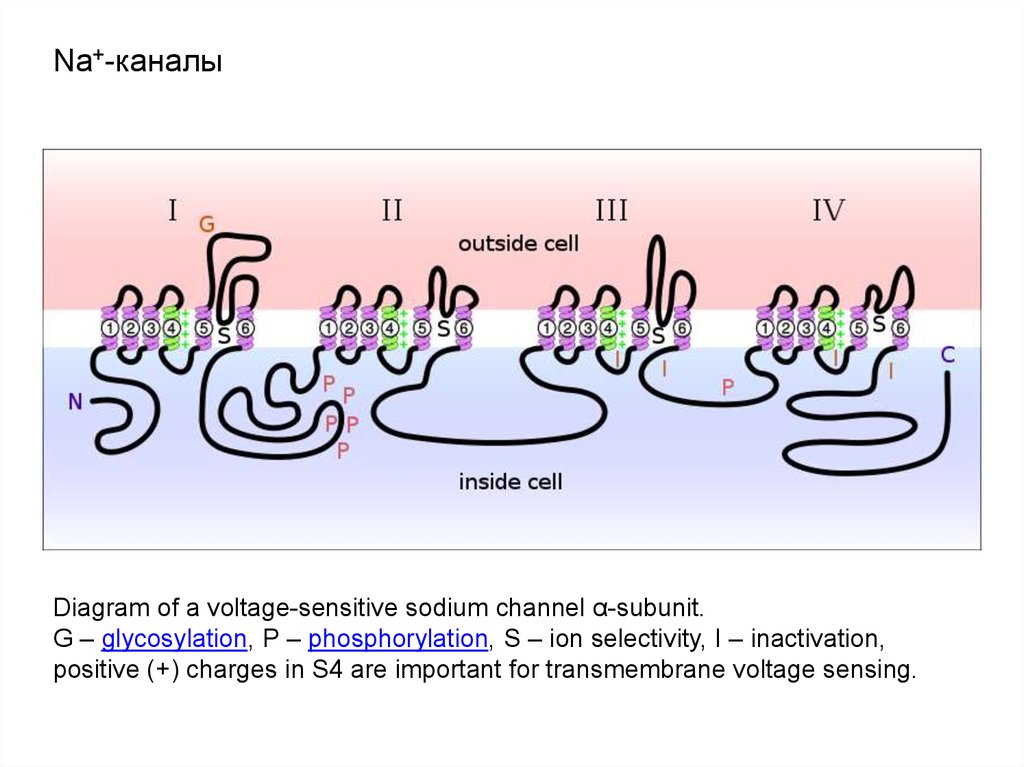
58. Na+-каналы
Diagram of a voltage-sensitive sodium channel α-subunit.G – glycosylation, P – phosphorylation, S – ion selectivity, I – inactivation,
positive (+) charges in S4 are important for transmembrane voltage sensing.
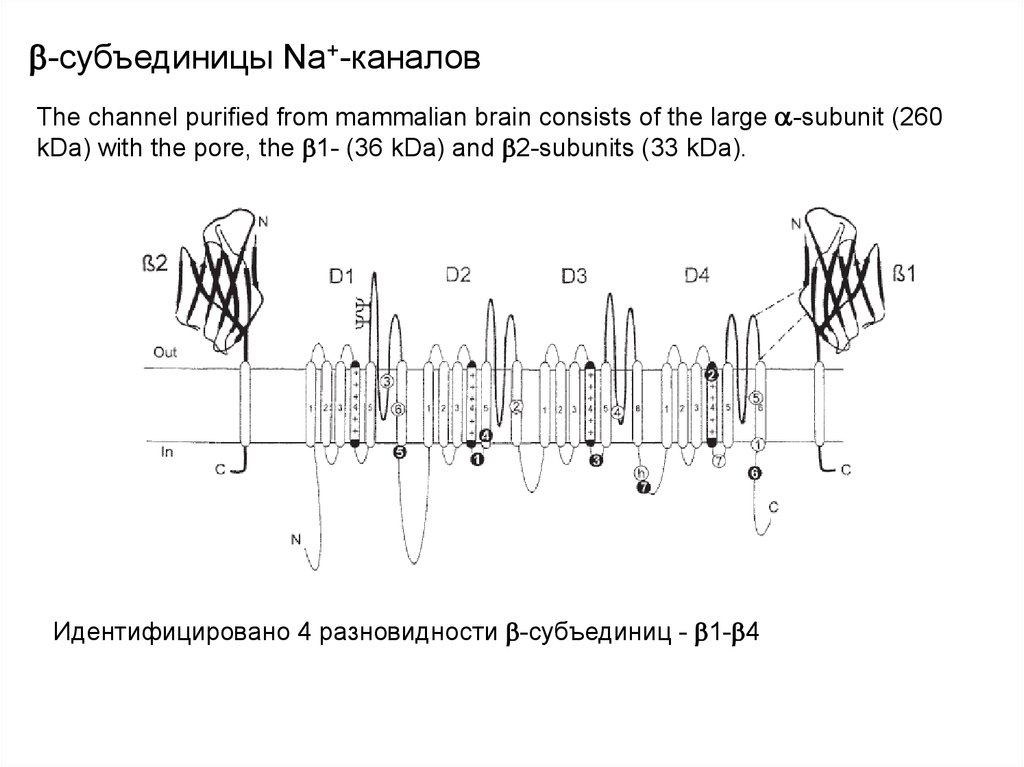
59. -субъединицы Na+-каналов
-субъединицы Na+-каналовThe channel purified from mammalian brain consists of the large -subunit (260
kDa) with the pore, the 1- (36 kDa) and 2-subunits (33 kDa).
Идентифицировано 4 разновидности -субъединиц - 1- 4
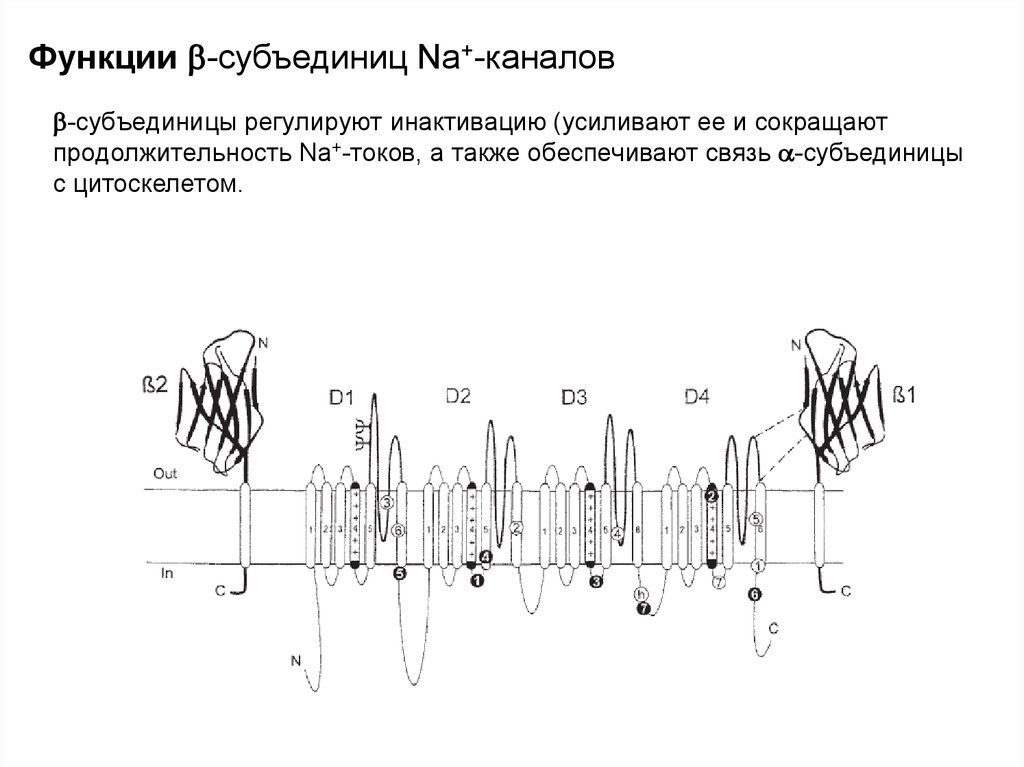
60. Функции -субъединиц Na+-каналов
Функции -субъединиц Na+-каналов-субъединицы регулируют инактивацию (усиливают ее и сокращают
продолжительность Na+-токов, а также обеспечивают связь -субъединицы
с цитоскелетом.
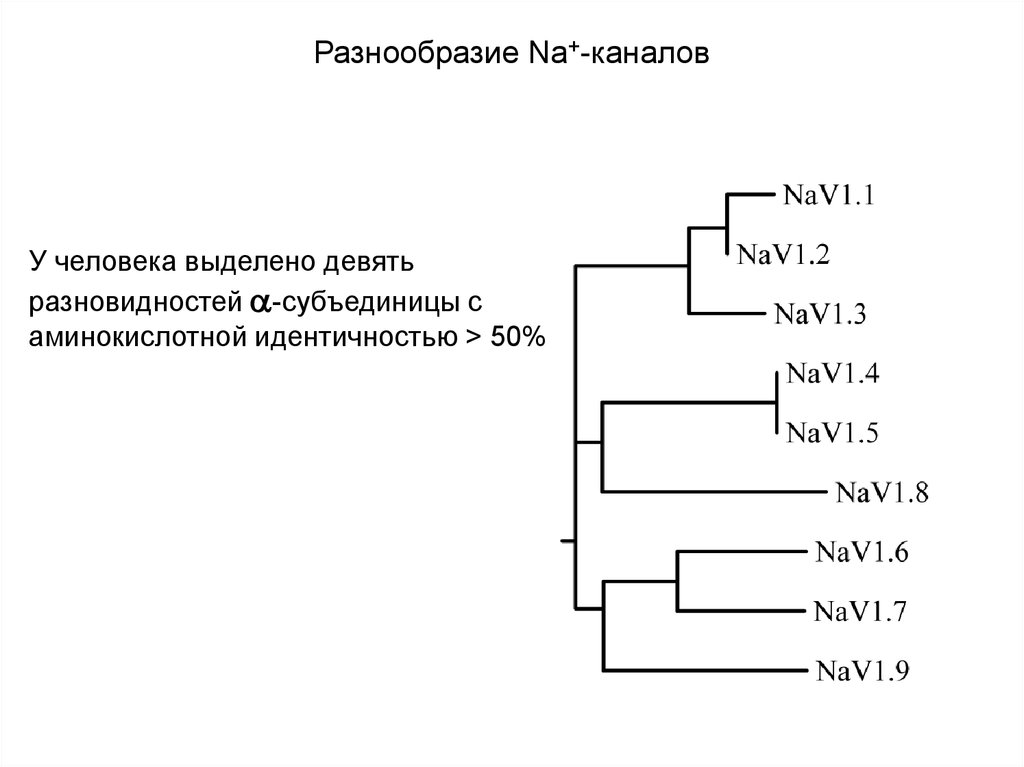
61. Разнообразие Na+-каналов
У человека выделено девятьразновидностей -субъединицы с
аминокислотной идентичностью > 50%
62.
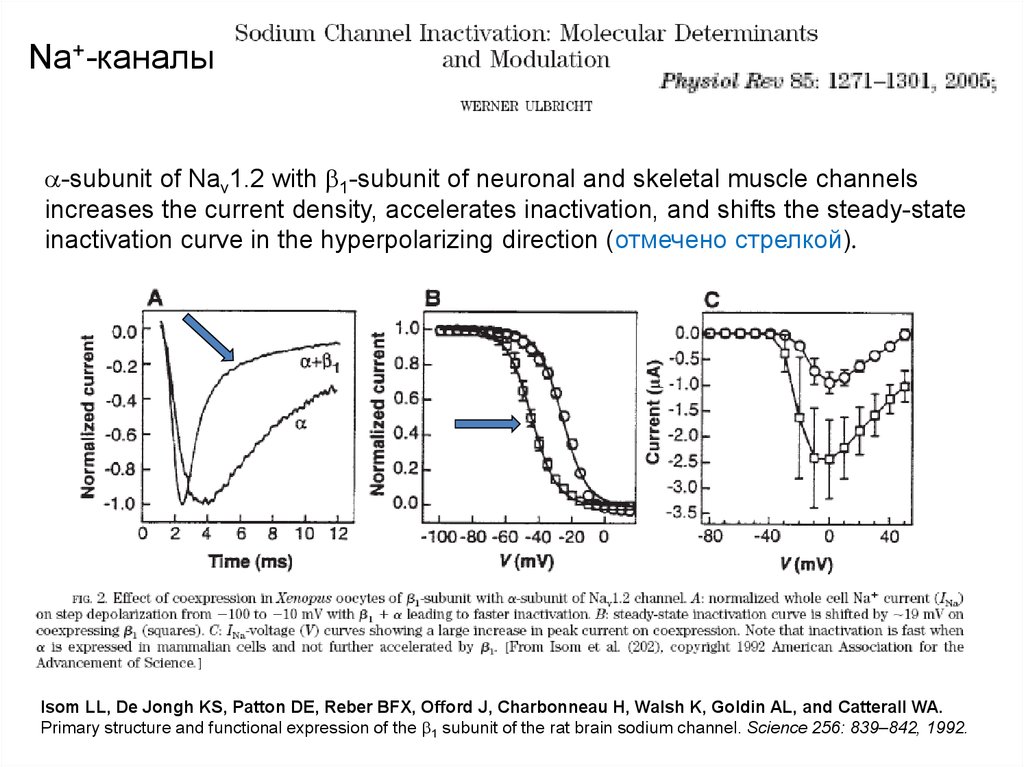
non-voltage-gated NaX63. Na+-каналы
-subunit of Nav1.2 with 1-subunit of neuronal and skeletal muscle channelsincreases the current density, accelerates inactivation, and shifts the steady-state
inactivation curve in the hyperpolarizing direction (отмечено стрелкой).
Isom LL, De Jongh KS, Patton DE, Reber BFX, Offord J, Charbonneau H, Walsh K, Goldin AL, and Catterall WA.
Primary structure and functional expression of the 1 subunit of the rat brain sodium channel. Science 256: 839–842, 1992.
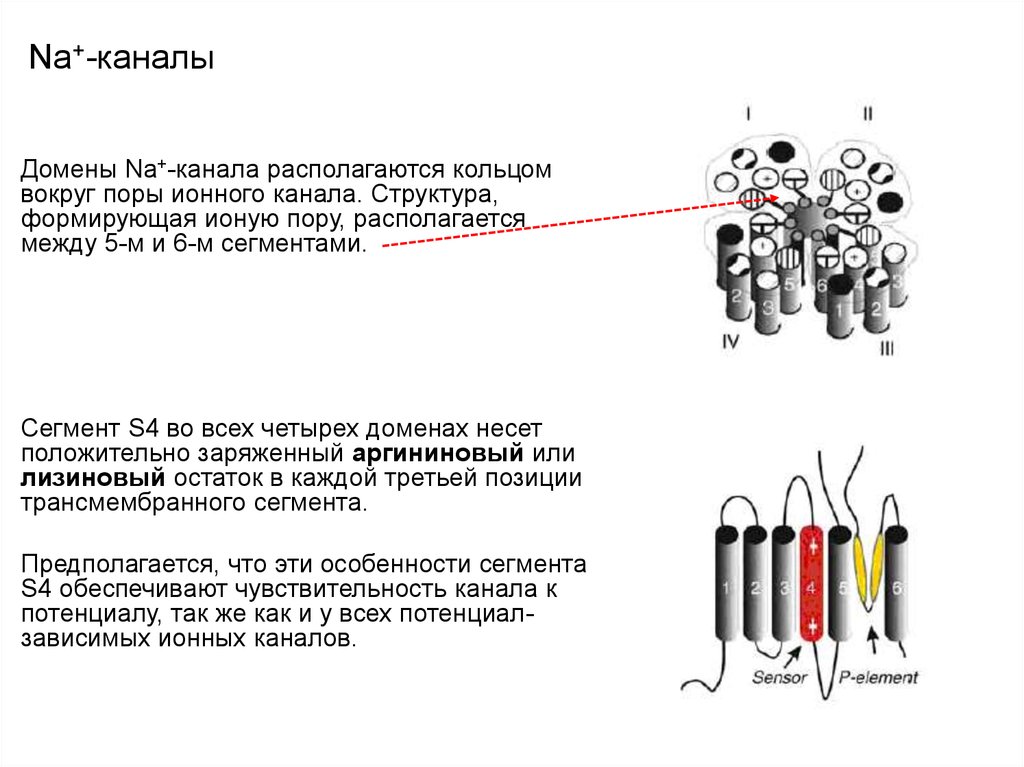
64. Na+-каналы
Домены Na+-канала располагаются кольцомвокруг поры ионного канала. Структура,
формирующая ионую пору, располагается
между 5-м и 6-м сегментами.
Сегмент S4 во всех четырех доменах несет
положительно заряженный аргининовый или
лизиновый остаток в каждой третьей позиции
трансмембранного сегмента.
Предполагается, что эти особенности сегмента
S4 обеспечивают чувствительность канала к
потенциалу, так же как и у всех потенциалзависимых ионных каналов.
65.
Na+-каналы66.
Na+-каналыМодель активации Na+-каналы
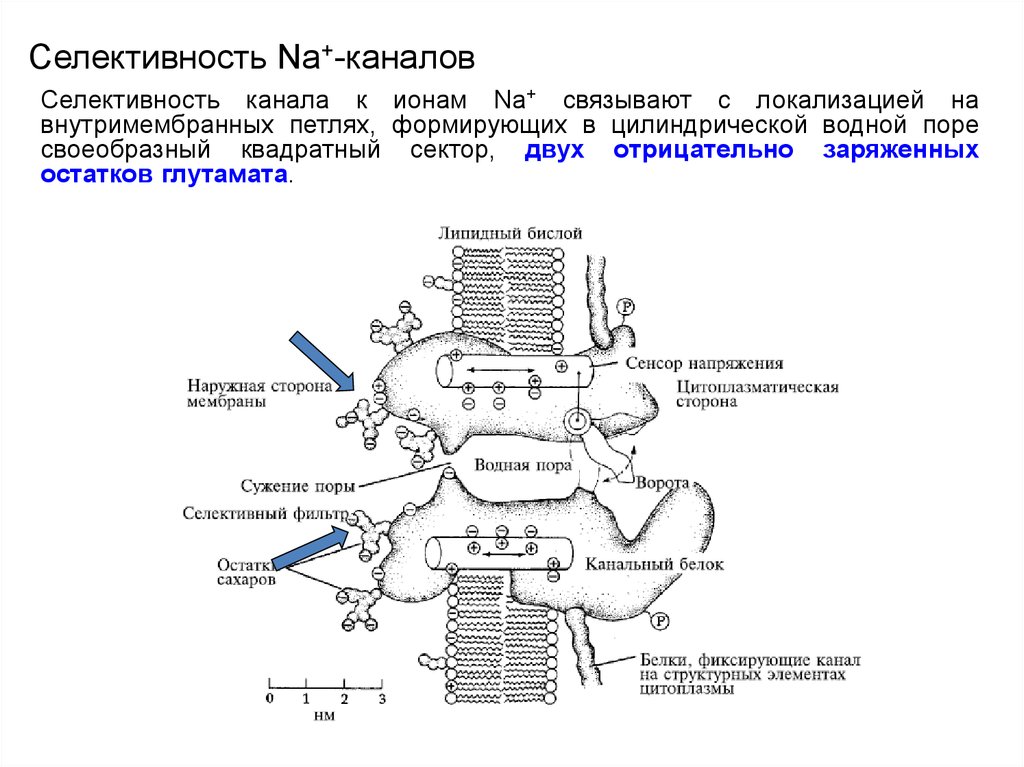
67. Селективность Na+-каналов
Селективность канала к ионам Na+ связывают с локализацией навнутримембранных петлях, формирующих в цилиндрической водной поре
своеобразный квадратный сектор, двух отрицательно заряженных
остатков глутамата.
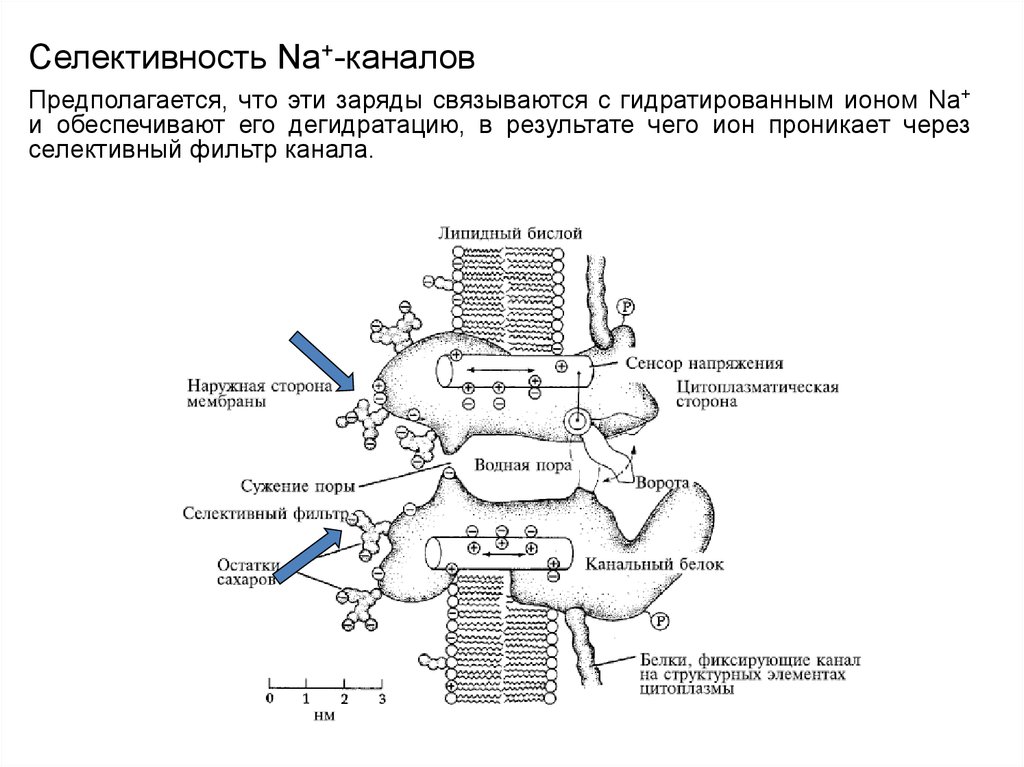
68. Селективность Na+-каналов
Предполагается, что эти заряды связываются с гидратированным ионом Na+и обеспечивают его дегидратацию, в результате чего ион проникает через
селективный фильтр канала.
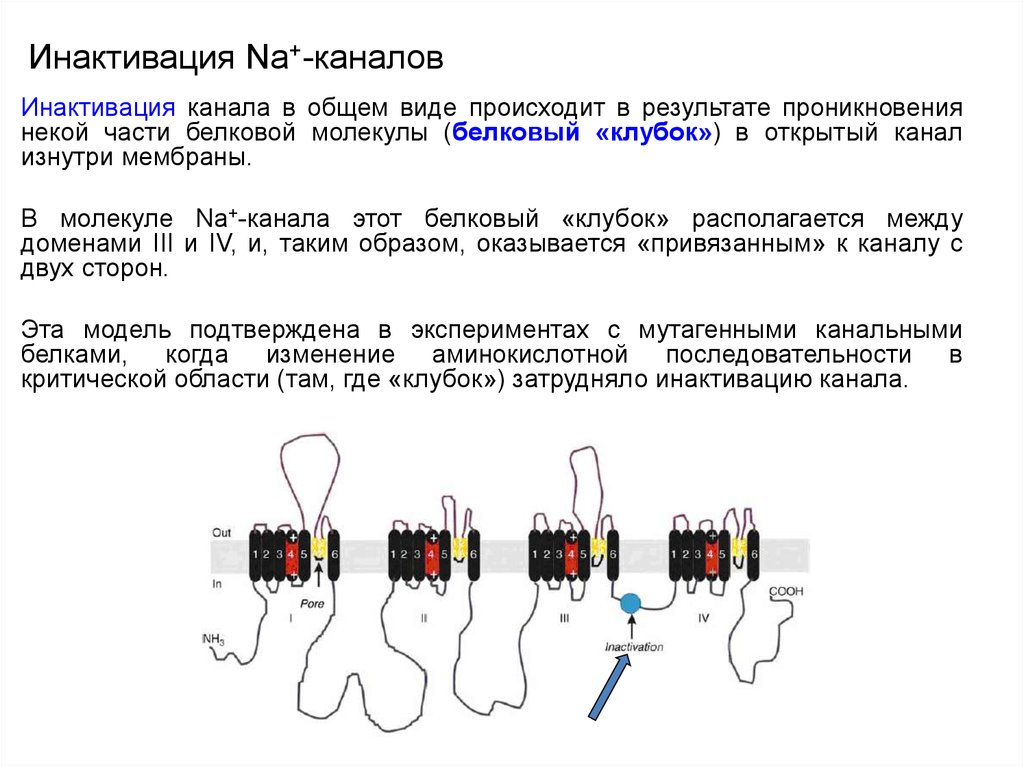
69. Инактивация Na+-каналов
Инактивация канала в общем виде происходит в результате проникновениянекой части белковой молекулы (белковый «клубок») в открытый канал
изнутри мембраны.
В молекуле Na+-канала этот белковый «клубок» располагается между
доменами III и IV, и, таким образом, оказывается «привязанным» к каналу с
двух сторон.
Эта модель подтверждена в экспериментах с мутагенными канальными
белками, когда изменение аминокислотной последовательности в
критической области (там, где «клубок») затрудняло инактивацию канала.
70.
Натриевые каналыДля исследования ионных каналов используются специфические
блокаторы. Na+-каналы блокируются тетродотоксином (ТТХ) и сакситоксином (STX).
Молекулы токсинов гуанидиновой группировкой «затыкают» канал как
пробка бутылку.
Исходя из размеров этой группировки размер наружного устья Na+каналов составляет 0,6х1.0 нм.
гуанидиновая
группировка
71.
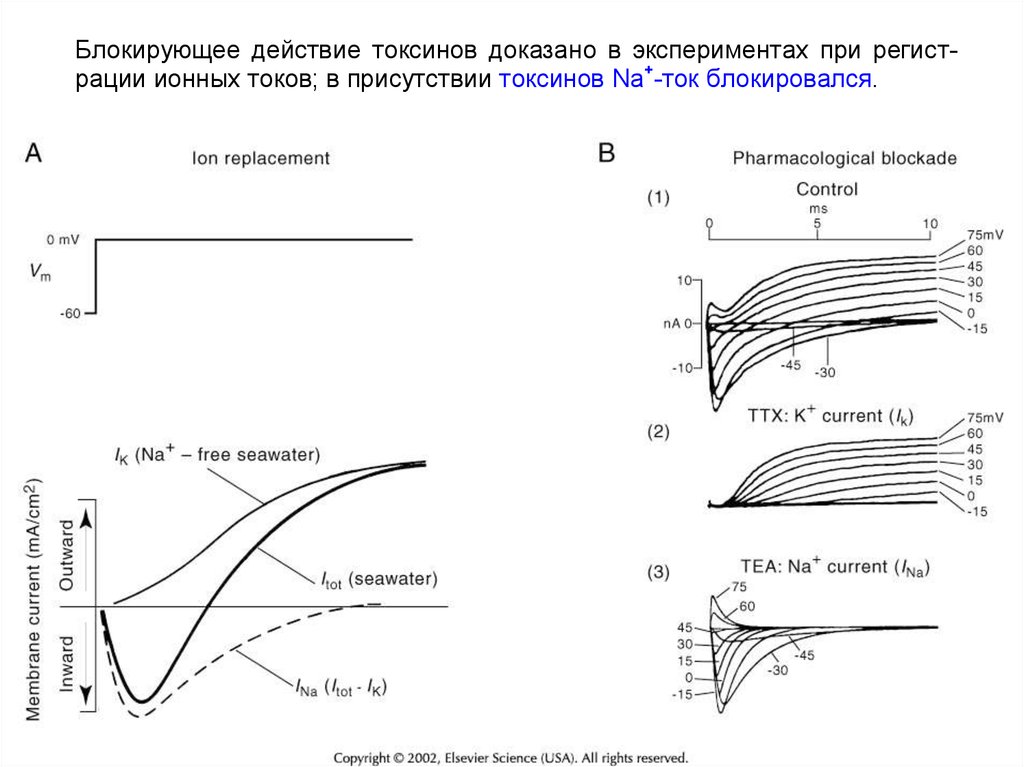
Блокирующее действие токсинов доказано в экспериментах при регистрации ионных токов; в присутствии токсинов Na+-ток блокировался.72.
Селективный фильтр натриевого каналаНаряду с воротным механизмом необходим еще один функциональный
элемент ионного канала - селективный фильтр, определяющий специфичность канала.
Проницаемость канала для Na+ в 12 раз выше, чем для К+, и примерно такая же для Li+. Проницаемость канала для ионов уменьшается с увеличением радиуса иона, поэтому селективный фильтр может рассматриваться
как сито. Но для К+ канала это несправедливо, т.к. этот канал непроницаем
для мелких ионов Li+ и Na+.
Ионная проницаемость натриевого канала
------------------------------------------Ион
Относительная
проницаемость P/PNa
------------------------------------------Li+
1.1
+
Na
1.0
+
K
0.083
+
Rb
0.025
+
Cs
0.016
-------------------------------------------
73.
Ионная проницаемость натриевого каналаБ. Хилле (1975) исследовал проницаемость Na+-канала для различных щелочных металлов и органических катионов. Он определил размер Na+канала 0,3х0,5 нм и пришел к выводу, что канал окружен кольцом атомов
кислорода, входящих в состав гидроксильных групп мембранного белка.
Селективность канала зависит не только от размеров проникающих ионов,
но и от их способности образовывать водородные связи. Б. Хилле сравнивал проницаемости трех ионов:
гидроксиламмоний
гидразиний
метиламмоний
H3N+-OH
H3N+-NH2
H3N+-CH3
Радиусы гидроксильной, амино- и метильной групп примерно одинаковы и
составляют 0.37-0.38 нм, однако проницаемость H3N+-OH в 100 раз выше,
чем для H3N+-CH3. Такие различия объясняются тем, что метильные группы не образуют водородных связей. Длина водородной связи 0.08 нм, поэтому через канал проникают ионы размером 0.30 нм. На основании своих
данных Хилле заключил, что ионы проникают через канал не путем простой диффузии, а в результате последовательной дегидратации и связывания с компонентами канала. Гидратированные ионы преодолевают несколько энергетических барьеров, из которых критическим является
фильтр селективности.
74.
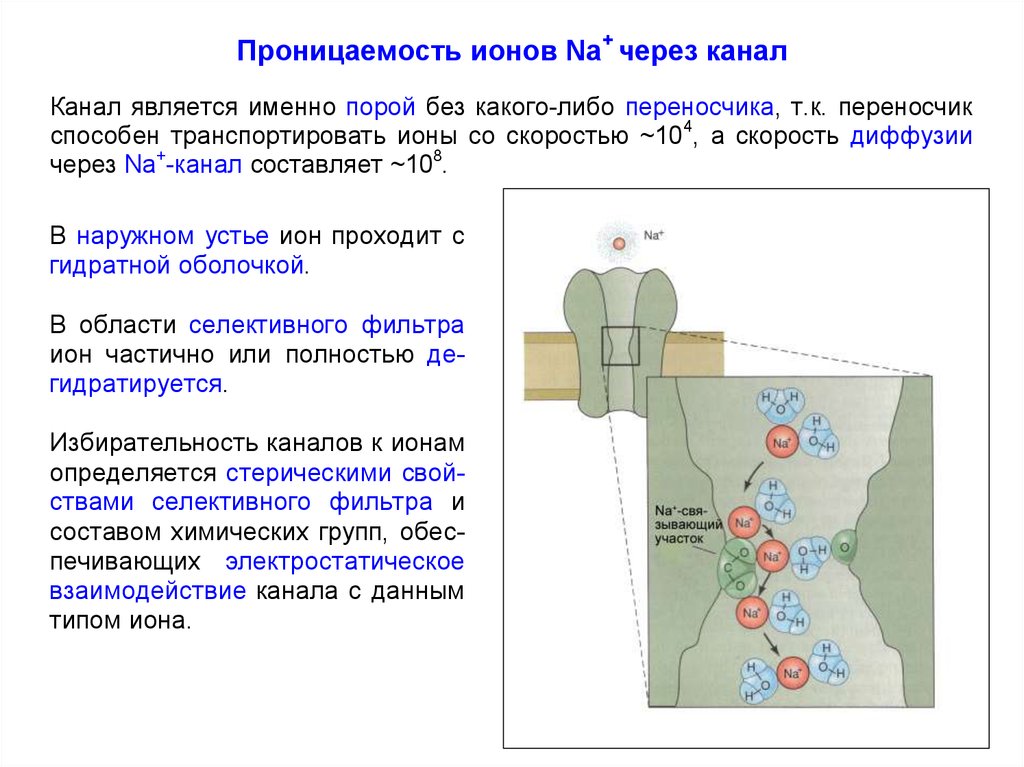
Проницаемость ионов Na+ через каналКанал является именно порой без какого-либо переносчика, т.к. переносчик
способен транспортировать ионы со скоростью ~104, а скорость диффузии
через Na+-канал составляет ~108.
В наружном устье ион проходит с
гидратной оболочкой.
В области селективного фильтра
ион частично или полностью дегидратируется.
Избирательность каналов к ионам
определяется стерическими свойствами селективного фильтра и
составом химических групп, обеспечивающих электростатическое
взаимодействие канала с данным
типом иона.
75.
Проницаемость ионов Na+ через каналAt the binding site the positive charge of
the ion is stabilized by a negatively charged
amino acid residue on the channel wall and
also by a water molecule that is attracted to
a second polar amino acid residue on the
other side of the channel wall. It is thought
that a K+ ion, because of its larger
diameter, cannot be stabilized as effectively
by the negative charge and therefore will
be excluded from the filter. (Modified from
Hille 1984.)
76.
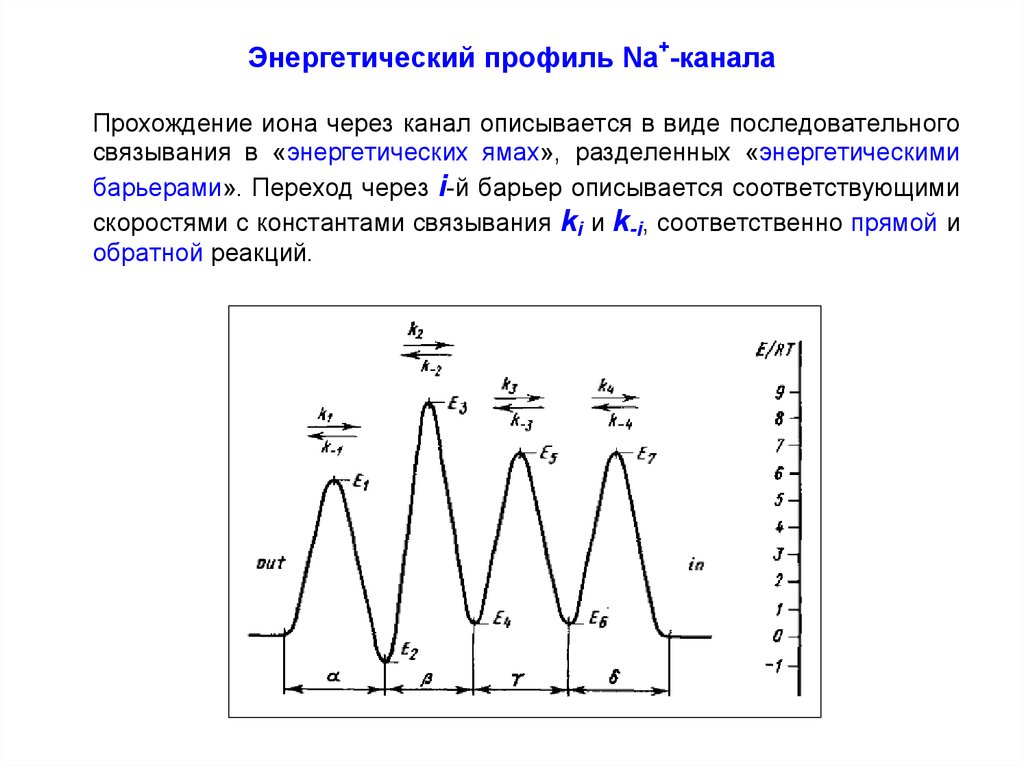
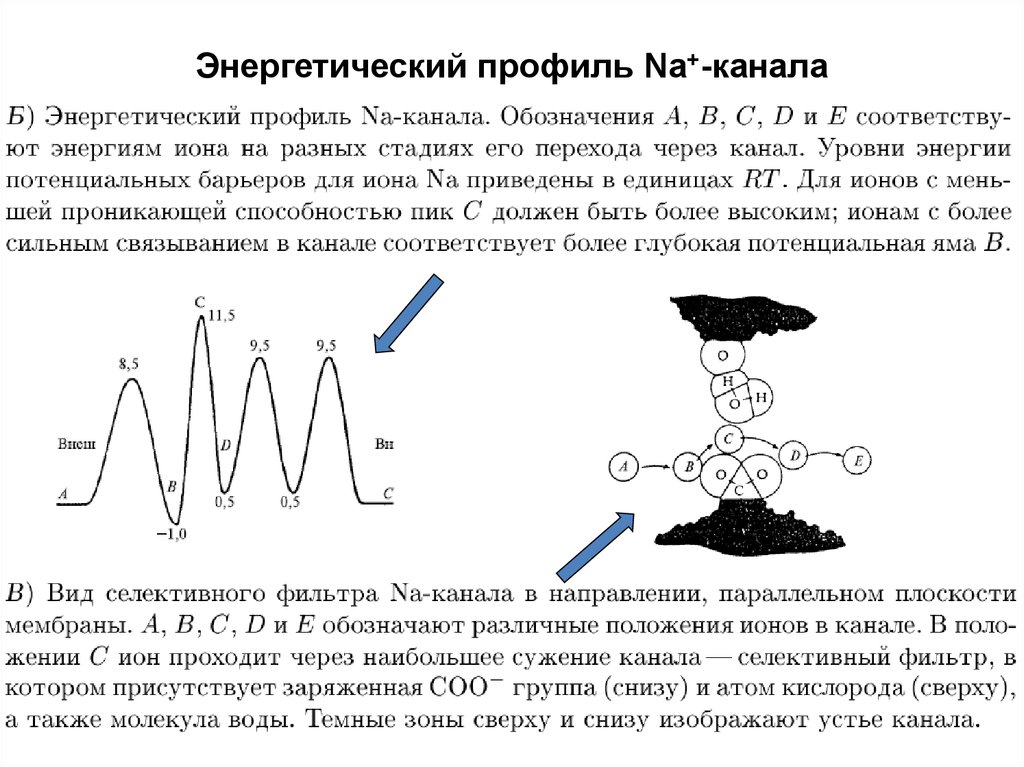
Энергетический профиль Na+-каналаПрохождение иона через канал описывается в виде последовательного
связывания в «энергетических ямах», разделенных «энергетическими
барьерами». Переход через i-й барьер описывается соответствующими
скоростями с константами связывания ki и k-i, соответственно прямой и
обратной реакций.
77. Энергетический профиль Na+-канала
78.
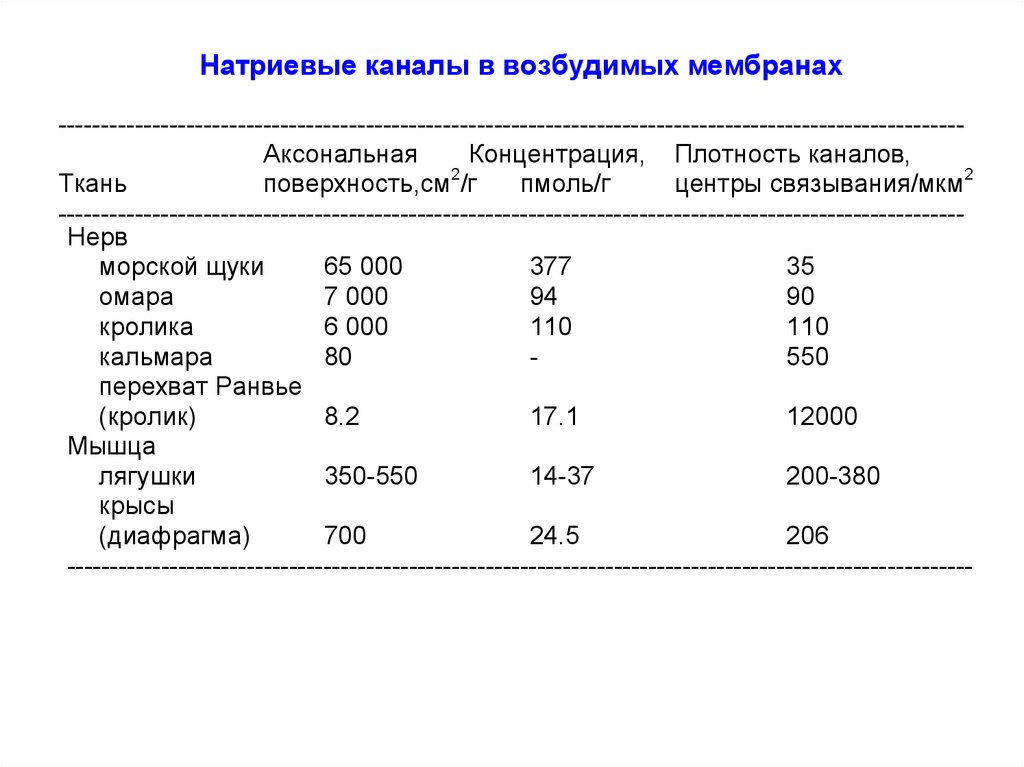
Натриевые каналы в возбудимых мембранах---------------------------------------------------------------------------------------------------------Аксональная
Концентрация, Плотность каналов,
2
Ткань
поверхность,см /г
пмоль/г
центры связывания/мкм2
---------------------------------------------------------------------------------------------------------Нерв
морской щуки
65 000
377
35
омара
7 000
94
90
кролика
6 000
110
110
кальмара
80
550
перехват Ранвье
(кролик)
8.2
17.1
12000
Мышца
лягушки
350-550
14-37
200-380
крысы
(диафрагма)
700
24.5
206
----------------------------------------------------------------------------------------------------------
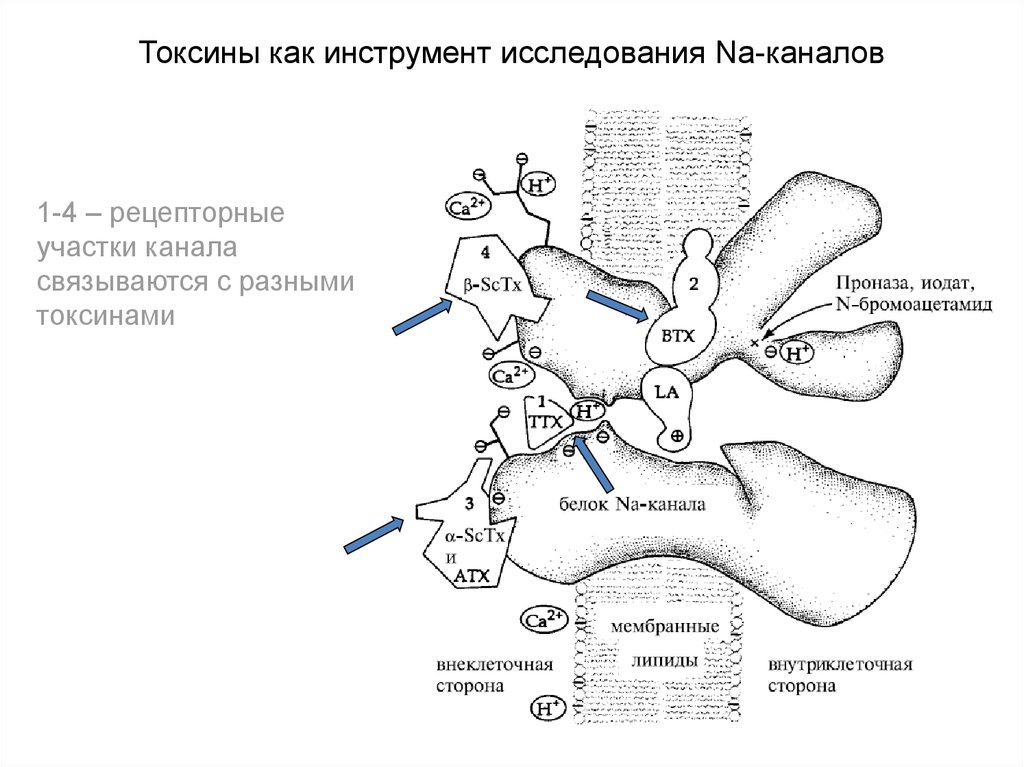
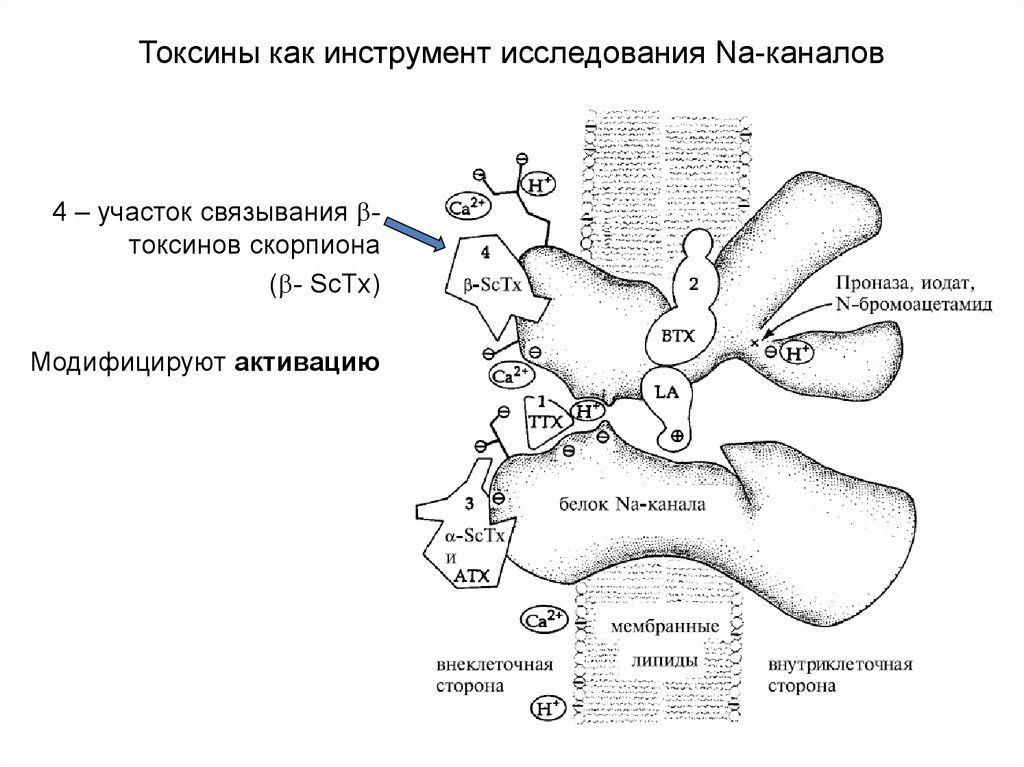
79. Токсины как инструмент исследования Na-каналов
1-4 – рецепторныеучастки канала
связываются с разными
токсинами
80. Токсины как инструмент исследования Na-каналов
1 – участок связывания стетродотоксина и
сакситоксина
Влияют на проводимость
81. Токсины как инструмент исследования Na-каналов
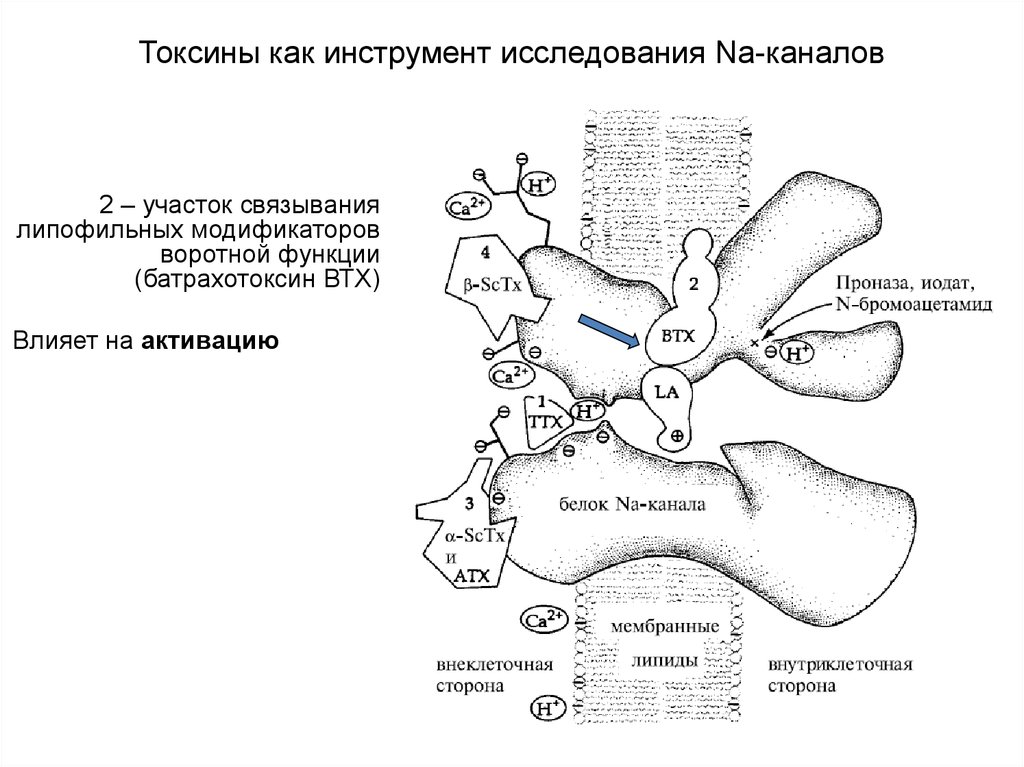
2 – участок связываниялипофильных модификаторов
воротной функции
(батрахотоксин ВТХ)
Влияет на активацию
82. Токсины как инструмент исследования Na-каналов
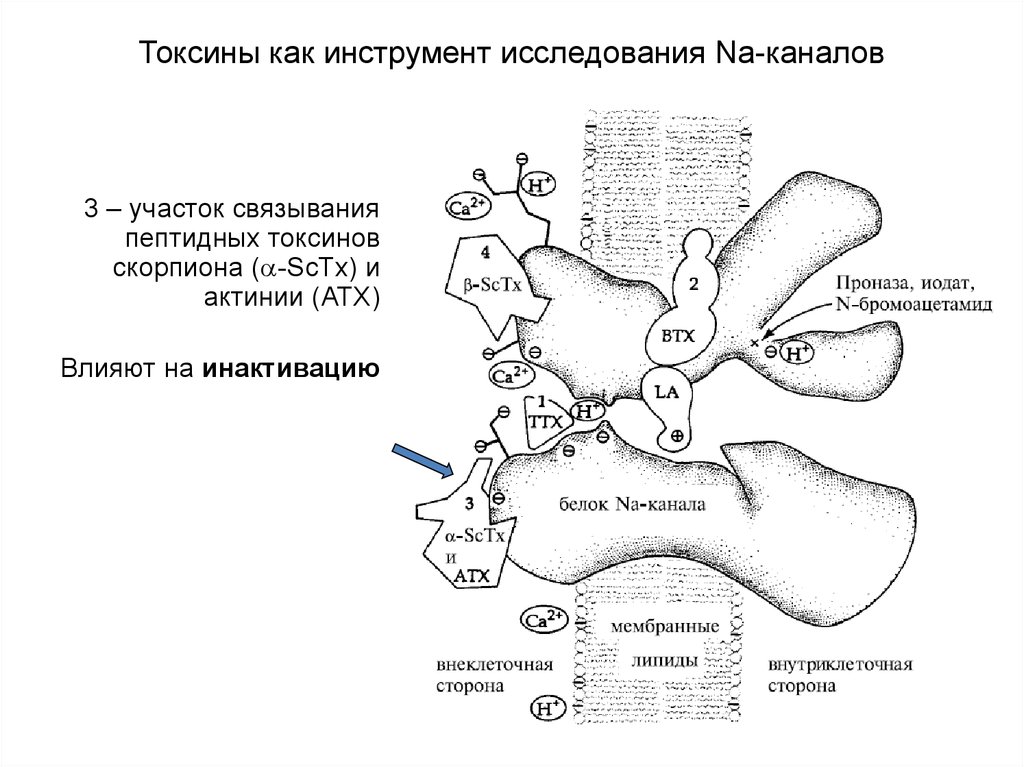
3 – участок связыванияпептидных токсинов
скорпиона ( -ScTx) и
актинии (ATX)
Влияют на инактивацию
83. Токсины как инструмент исследования Na-каналов
4 – участок связывания токсинов скорпиона( - ScTx)
Модифицируют активацию
84. Токсины как инструмент исследования Na-каналов
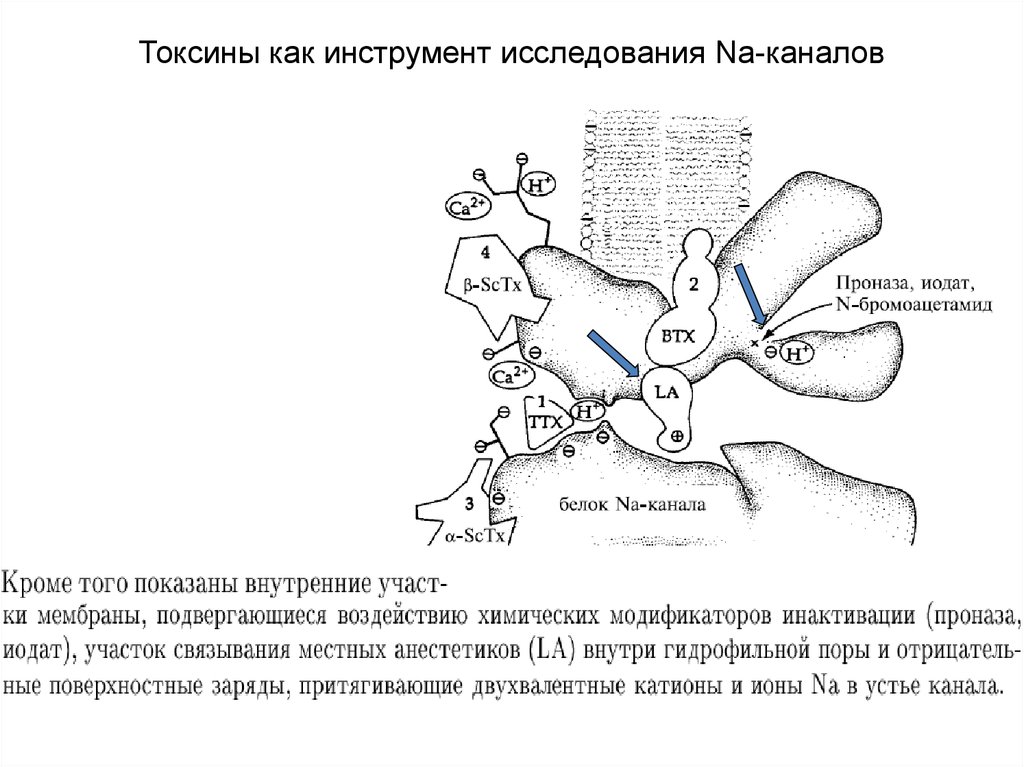
85.
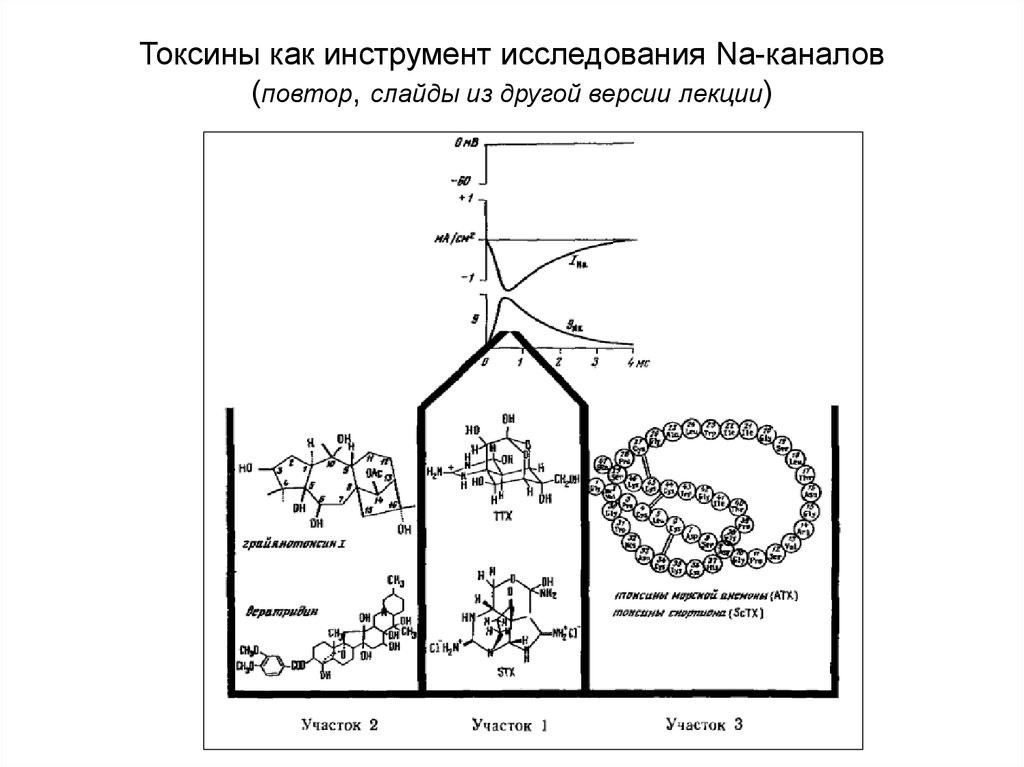
Токсины как инструмент исследования Na-каналов(повтор, слайды из другой версии лекции)
86.
Нейротоксины как инструменты для исследованияионных каналов
Во время потенциала действия выделяют три фармакологически различных процесса:
- активацию (открытие) канала,
- ионный транспорт через пору и
- инактивацию (закрытие) канала.
Нейротоксины, влияющие на потенциал зависимые Na+-каналы, действуют через три различные участка
канала:
1 - относится к транспорту ионов;
2 - регулирует активацию канала;
3 - регулирует инактивацию канала.
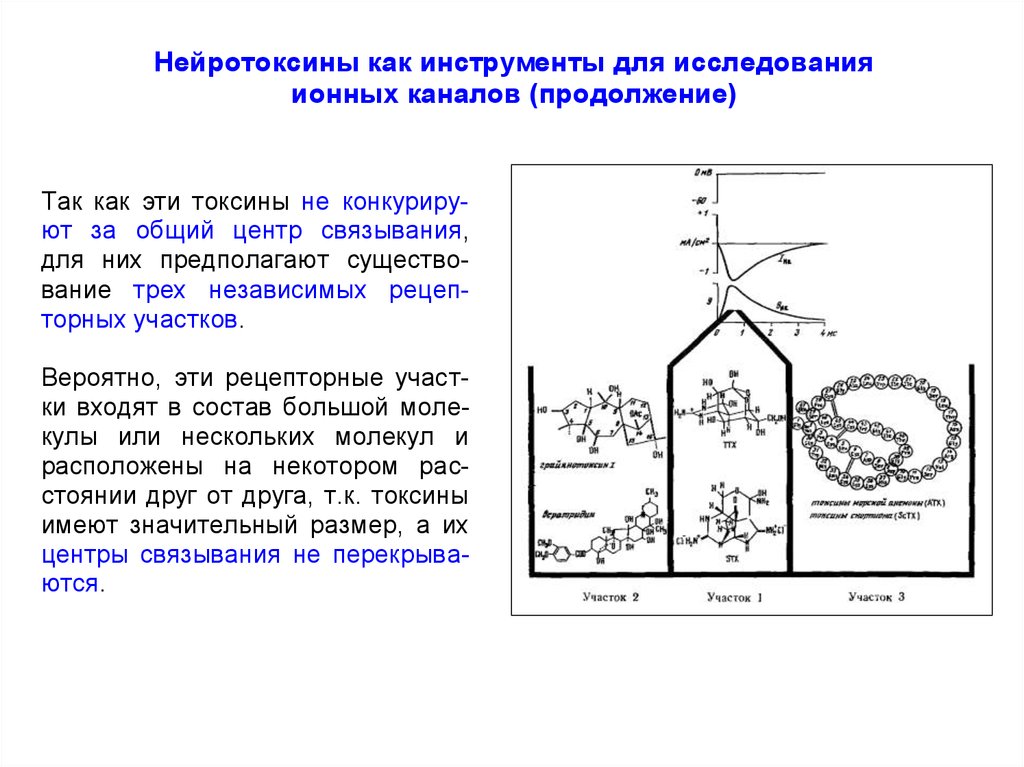
87.
Нейротоксины как инструменты для исследованияионных каналов (продолжение)
Так как эти токсины не конкурируют за общий центр связывания,
для них предполагают существование трех независимых рецепторных участков.
Вероятно, эти рецепторные участки входят в состав большой молекулы или нескольких молекул и
расположены на некотором расстоянии друг от друга, т.к. токсины
имеют значительный размер, а их
центры связывания не перекрываются.
88.
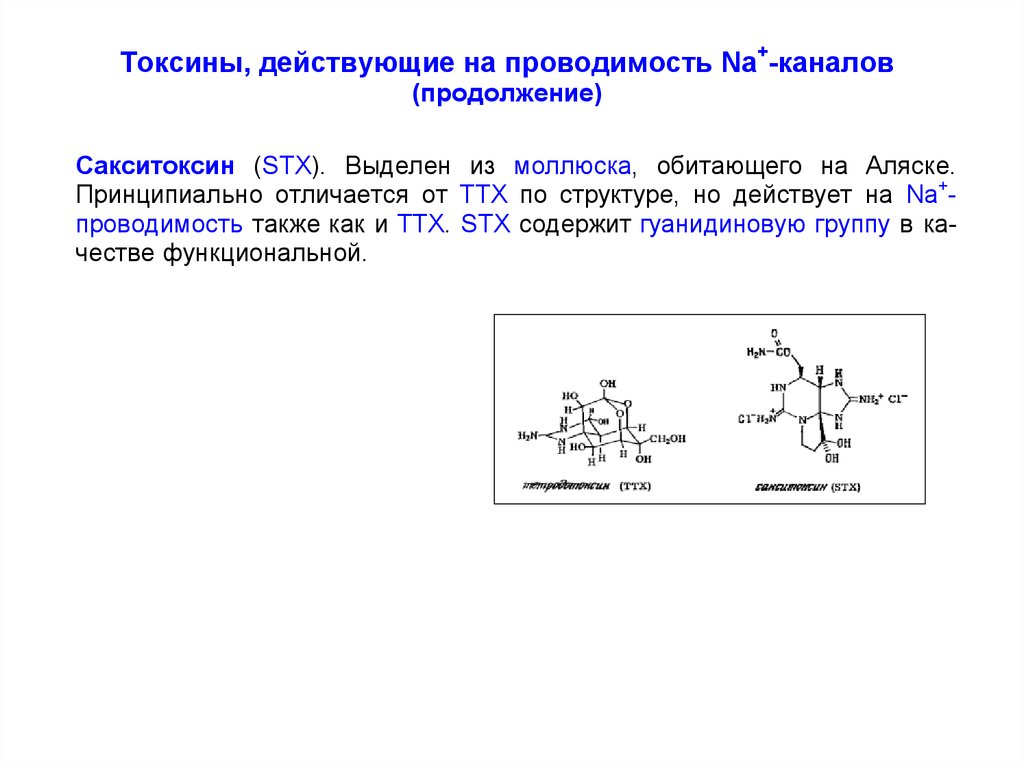
Токсины, действующие на проводимость Na+-каналовТетродотоксин (TTX). Выделен из печени и яичников рыбы фуга (Tetrodontidae). В Японии ежегодно умирают
люди, использующие в пищу эту рыбу.
Этот токсин выделен также из калифорнийского тритона и из икры лягушки, обитающей в Коста-Рике.
ТТХ специфично блокирует Na+-проводимость в мембране аксона, но не
влияет на проводимость К+. Наиболее существенные особенности действия ТТХ следующие:
1. ТТХ действует только на внешней стороне мембраны аксона.
2. ТТХ уменьшает максимальную проводимость иона Na+, но не влияет на
воротный механизм.
3. Действие ТТХ обратимо.
4. Небольшие модификации структуры ТТХ уменьшают его активность.
Сравнение со структурой аналогично действующего сакситоксина (STX)
показывает, что активность этих токсинов связана с наличием гуанидиновой группы.
5. ТТХ влияет на металлсвязывающий центр ионного канала.
89.
Токсины, действующие на проводимость Na+-каналов(продолжение)
Сакситоксин (STX). Выделен из моллюска, обитающего на Аляске.
Принципиально отличается от ТТХ по структуре, но действует на Na+проводимость также как и ТТХ. STX содержит гуанидиновую группу в качестве функциональной.
90.
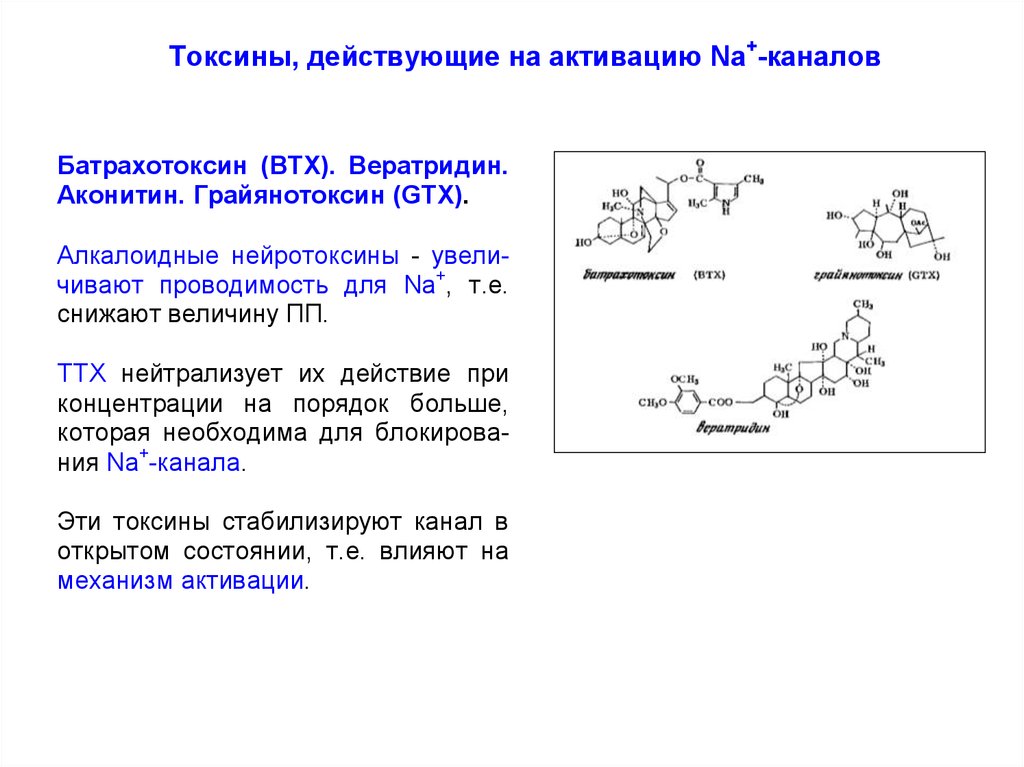
Токсины, действующие на активацию Na+-каналовБатрахотоксин (BTX). Вератридин.
Аконитин. Грайянотоксин (GTX).
Алкалоидные нейротоксины - увеличивают проводимость для Na+, т.е.
снижают величину ПП.
ТТХ нейтрализует их действие при
концентрации на порядок больше,
которая необходима для блокирования Na+-канала.
Эти токсины стабилизируют канал в
открытом состоянии, т.е. влияют на
механизм активации.
91.
Токсины, действующие на инактивацию Na+-каналовТоксины морской анемоны (актинии)
(ATX). Выделены из стрекательных
клеток морской анемоны. Тормозят
инактивацию Na+-каналов и тем самым
усиливают устойчивую активацию.
Выделено три токсина АТХ (I, II и III), содержащих 46, 47 и 27 аминокислот,
соответственно. Канал, который стабилизируется в открытом состоянии под
действием этих токсинов, тем не менее блокируется ТТХ.
По-видимому, эти токсины действуют на механизм инактивации, тогда как
ТТХ действует только на проводимость Na+-каналов, что доказывает разную
локализацию этих функциональных частей канала.
Токсин АТХ II действует на внешней стороне мембраны, хотя проназы действуют изнутри аксона. Эта особенность действия токсина объясняется тем,
что он глубоко проникает в мембрану благодаря длинным гидрофобным частям.
92.
Токсины, действующие на инактивацию Na+-каналовТоксины скорпиона (ScTX). Выделено несколько видов нейротоксинов.
Состоят из 65-66 аминокислотных остатков. Их действие менее специфично. Например, ScTX I ингибирует инактивацию Na+-проводимости и активацию калиевой. Другие токсины избирательно действуют на активацию Na+канала.
93.
АнестетикиАнастезия - обратимое снижение чувствительности к боли путем блокировки проводимости нерва.
Анестетики - обезболевающие средства отличаются от токсинов по вызываемому
эффекту количественно (но не по качественному действию). Анестетиков очень
много, и их действие не может быть описано с помощью одного молекулярного
механизма.
94.
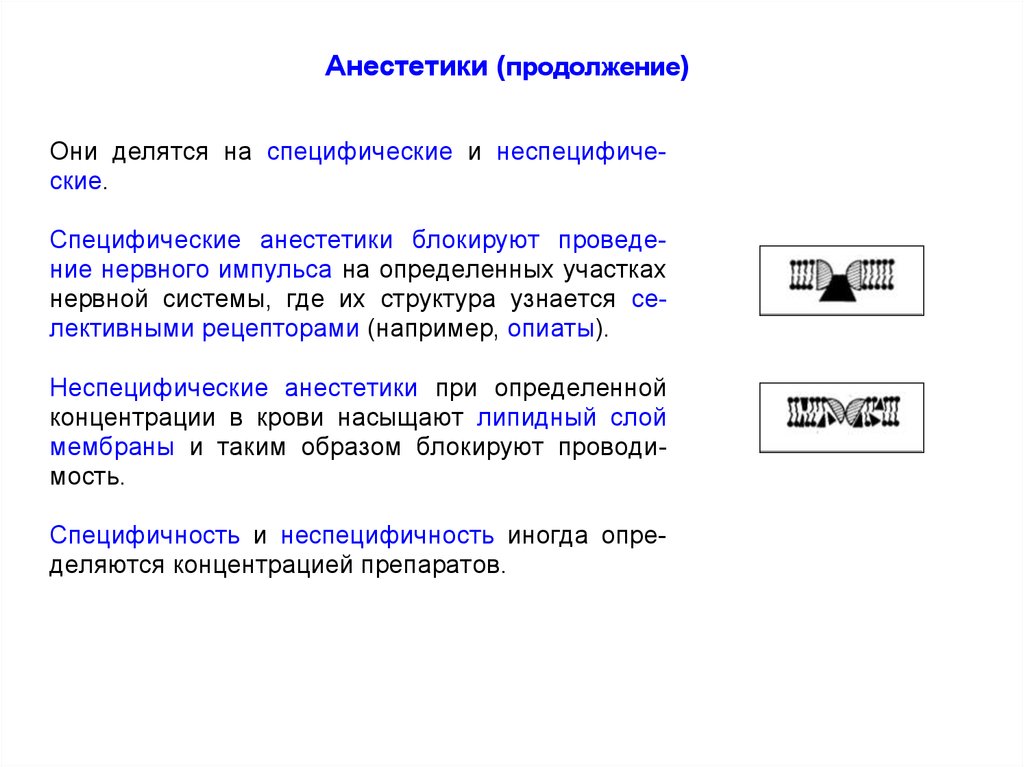
Анестетики (продолжение)Они делятся на специфические и неспецифические.
Специфические анестетики блокируют проведение нервного импульса на определенных участках
нервной системы, где их структура узнается селективными рецепторами (например, опиаты).
Неспецифические анестетики при определенной
концентрации в крови насыщают липидный слой
мембраны и таким образом блокируют проводимость.
Специфичность и неспецифичность иногда определяются концентрацией препаратов.
95. Токсины как инструмент исследования Na-каналов
Участок,связывающий
токсин
Лиганд
Физиологический эффект
1
Тетродотоксин (TTX)
Сакситоксин (STX)
Блокирует транспорт
2
Батрахотоксин (BTX)
Вератридин
Аконитин
Грайянотоксин (GTX)
Вызывает устойчивую
активацию
Влияет на активацию и
инактивацию
3
Токсин скорпиона (ScTX)
Токсин морской анемоны
(ATX)
Ингибирует инактивацию
Усиливает устойчивую
активацию
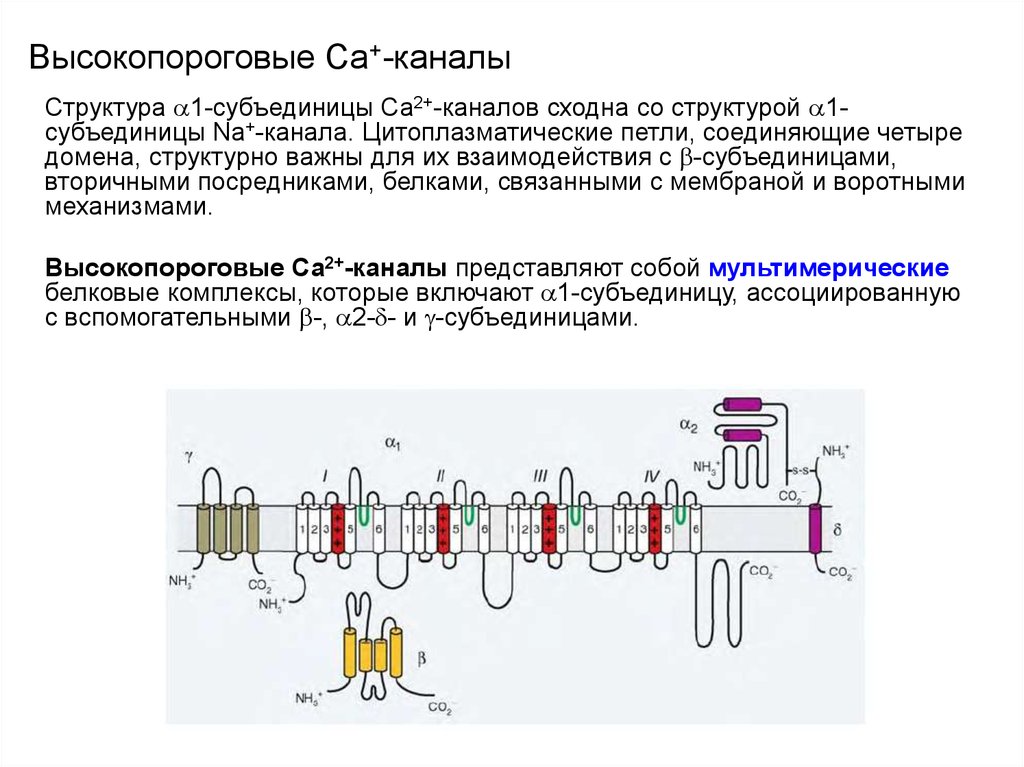
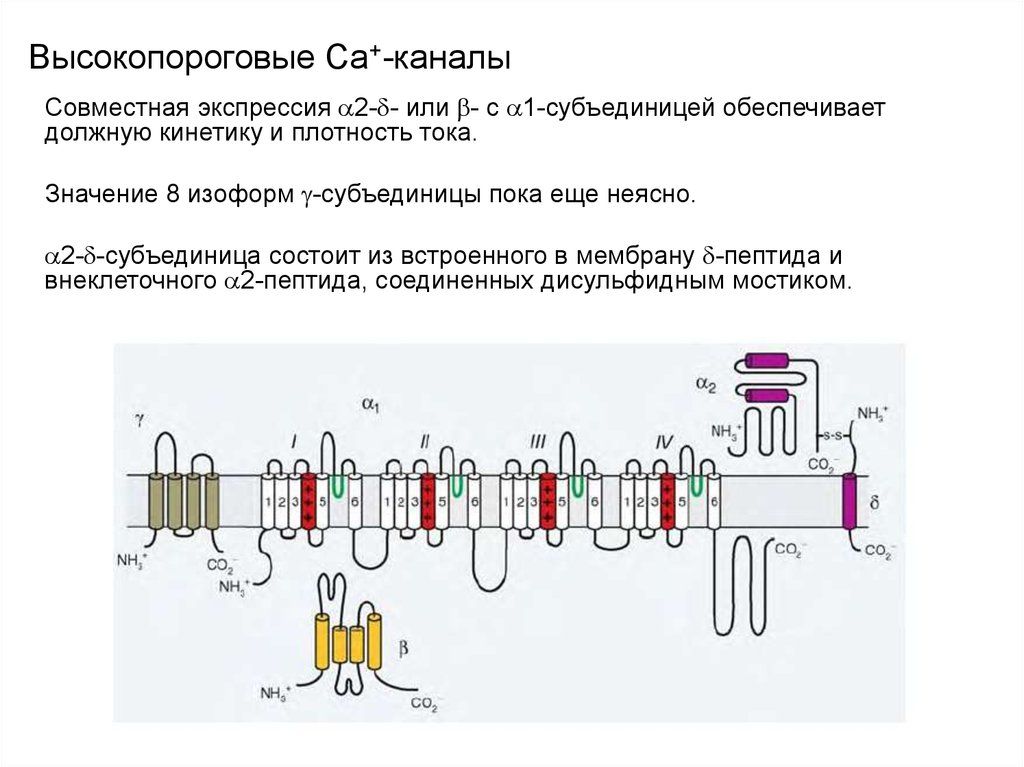
96. Высокопороговые Сa+-каналы
Структура 1-субъединицы Са2+-каналов сходна со структурой 1субъединицы Na+-канала. Цитоплазматические петли, соединяющие четыредомена, структурно важны для их взаимодействия с -субъединицами,
вторичными посредниками, белками, связанными с мембраной и воротными
механизмами.
Высокопороговые Са2+-каналы представляют собой мультимерические
белковые комплексы, которые включают 1-субъединицу, ассоциированную
с вспомогательными -, 2- - и -субъединицами.
97. Высокопороговые Сa+-каналы
Совместная экспрессия 2- - или - с 1-субъединицей обеспечиваетдолжную кинетику и плотность тока.
Значение 8 изоформ -субъединицы пока еще неясно.
2- -субъединица состоит из встроенного в мембрану -пептида и
внеклеточного 2-пептида, соединенных дисульфидным мостиком.
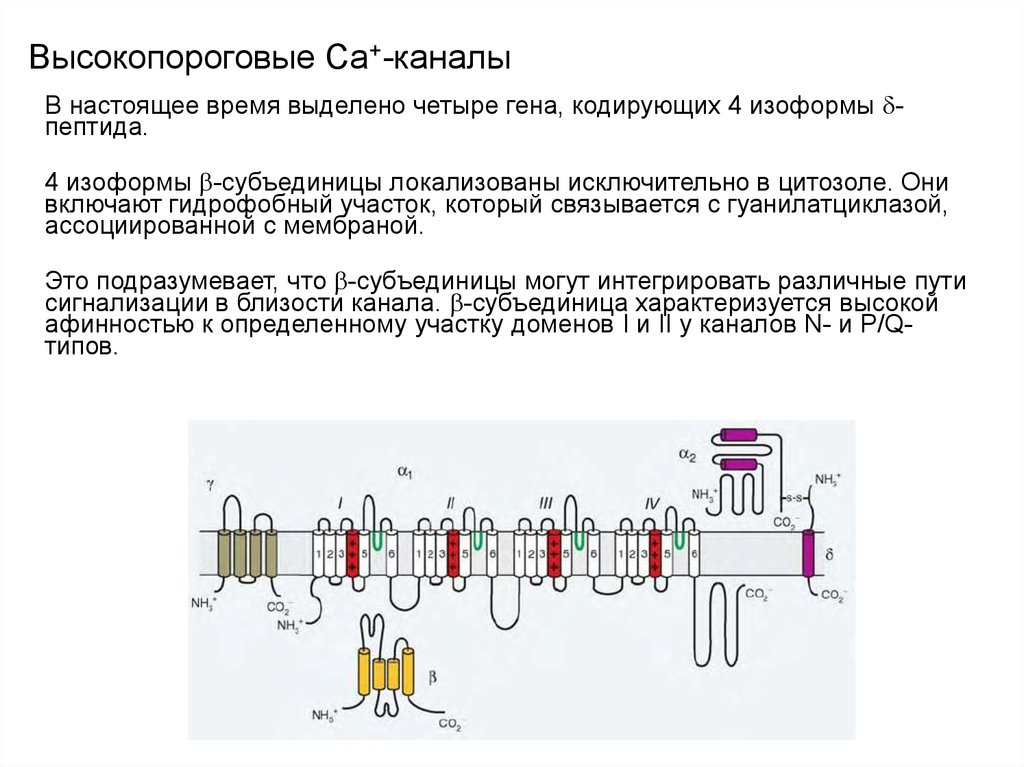
98. Высокопороговые Сa+-каналы
В настоящее время выделено четыре гена, кодирующих 4 изоформы пептида.4 изоформы -субъединицы локализованы исключительно в цитозоле. Они
включают гидрофобный участок, который связывается с гуанилатциклазой,
ассоциированной с мембраной.
Это подразумевает, что -субъединицы могут интегрировать различные пути
сигнализации в близости канала. -субъединица характеризуется высокой
афинностью к определенному участку доменов I и II у каналов N- и P/Qтипов.
99. Сa+-каналы
Методом клонирования Са2+-каналов выявлено 10 различных 1субъединиц, близким по своим фармакологическим и биофизическимсвойствам к эндогенным Са2+-каналам, выделенным в большинстве тканей.
Состав аминокислотных
последовательностей демонстрирует
строгую гомологию внутри каждого
типа и значительную дивергенцию
между различными типами Са2+каналов.
Так, два класса, составляющие
высоко- (HVA) и низкопороговые
(LVA) Са2+-каналы, демонстрируют
сходство аминокислотных
последовательностей менее 30%.
100. Сa+-каналы
Структурная организация высоко- и низкопороговых Са2+-каналов.Высокопороговые Са2+-каналы
представляют собой
мультимерические белковые
комплексы, которые включают 1субъединицу, ассоциированную с
вспомогательными -, 2- - и субъединицами.
Низкопороговые Са2+-каналы
представлены исключительно 1субъединицей.
101. Селективность Сa+-каналов
Селективная проницаемость Са2+-каналов обеспечиваетсяспециализированной областью, содержащей кольцо отрицательных
заряженных групп (остатков определенных аминокислот) внутри водной
поры.
Химическая и пространственная конфигурация четырех отрицательных
зарядов в петлях водной поры определяет некоторые вариации таких свойств
каналов, как их селективность и специфичность блокаторов.
Низкопороговый Т-тип каналов имеет меньший размер водной поры, чем канал
L-типа (5,1 против 6,2 Å). Такие различия, по-видимому, объясняют различную
Са2+/Ва2+-селективность и блокирующую активность Cd2+ и Ni2+ у высоко- и
низкопороговых каналов:
• высокопороговые каналы больше проницаемы для Ва2+, чем для Са2+ и
более чувствительны к блокатору Cd2+,
• а низкопороговые каналы характеризуются одинаковой проницаемостью
для Ва2+ и Са2+ и более чувствительны к блокатору Ni2+.
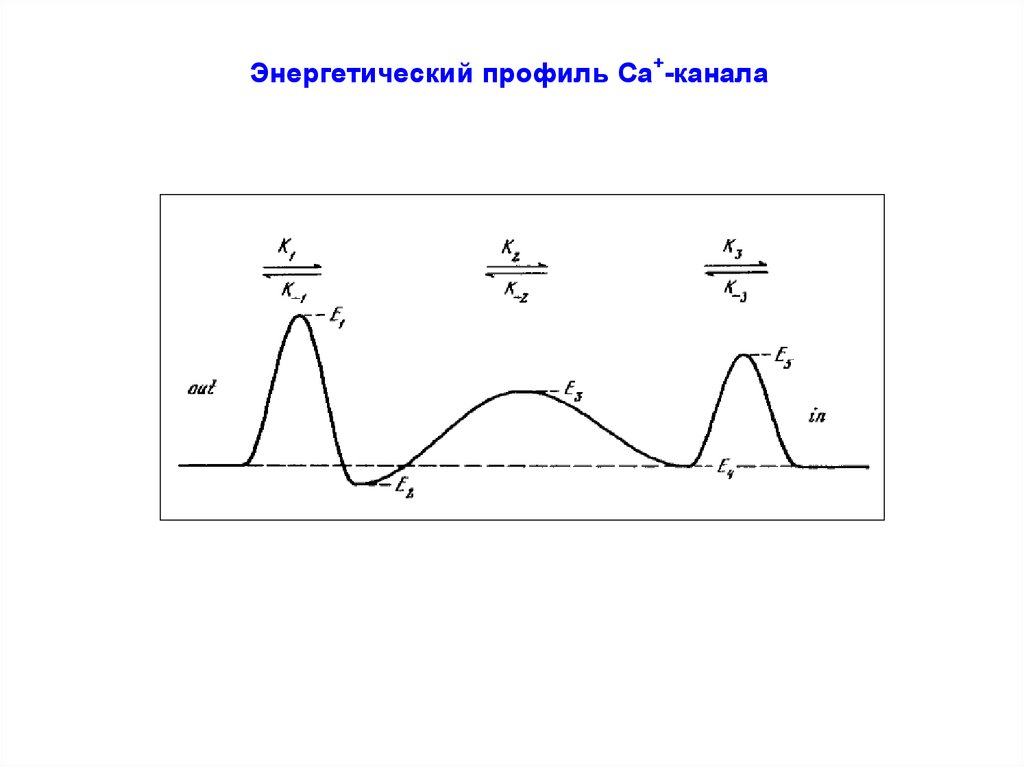
102.
Энергетический профиль Са+-канала103. цАМФ (цГМФ)-зависимые катионные каналы
Активность этих каналов зависит от их связывания с циклическиминуклеотидами цАМФ и цГМФ. Они подразделяются на два семейства:
1) облигатно зависят от цАМФ (цГМФ),
2) активируются при гиперполяризации мембраны, а циклические
нуклеотиды усиливают их активность, влияя таким образом на их
потенциал-зависимые свойства. Поэтому собственно потенциалзависимыми являются именно каналы второго семейства.
Эти каналы являются неселективными в отношении катионов и проводят Na+,
K+ (с проницаемостью 1:4) и, в меньшей степени, Са2+.
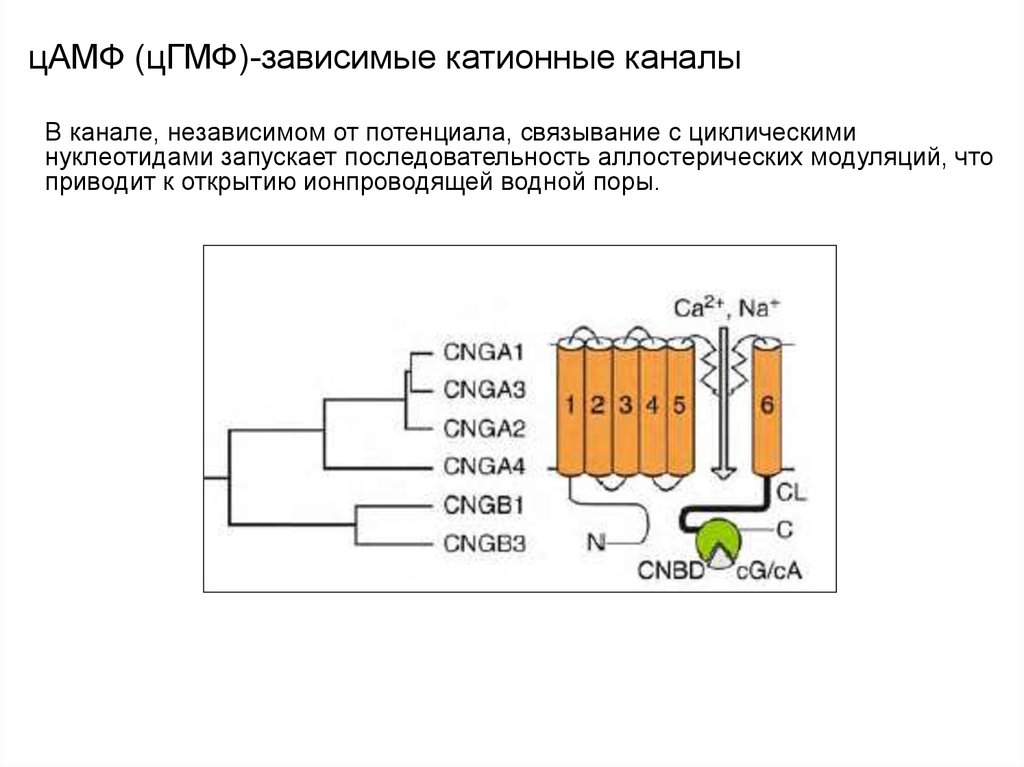
104. цАМФ (цГМФ)-зависимые катионные каналы
Их молекулярная структура принципиально совпадает со структурой другихпотенциал-зависимых каналов.
Сегмент 4 у каналов, активирующихся при гиперполяризации (HCN,
Hyperpolarization-activated Cyclic Nucleotide-gated), содержит достаточно
положительных зарядов и является своеобразным сенсором потенциала.
Механизм активации проводимости напоминает таковой, описанный у других
потенциал-зависимых каналов.
Сегмент 4 у каналов, зависящих только от
циклических нуклеотидов (CNG, Cyclic
Nucleotide Gated), содержит недостаточно
зарядов, и его активация слабо зависит от
потенциала.
CNBD - cyclic nucleotide-binding domain
105. цАМФ (цГМФ)-зависимые катионные каналы
В канале, независимом от потенциала, связывание с циклическиминуклеотидами запускает последовательность аллостерических модуляций, что
приводит к открытию ионпроводящей водной поры.
106. цАМФ (цГМФ)-зависимые катионные каналы
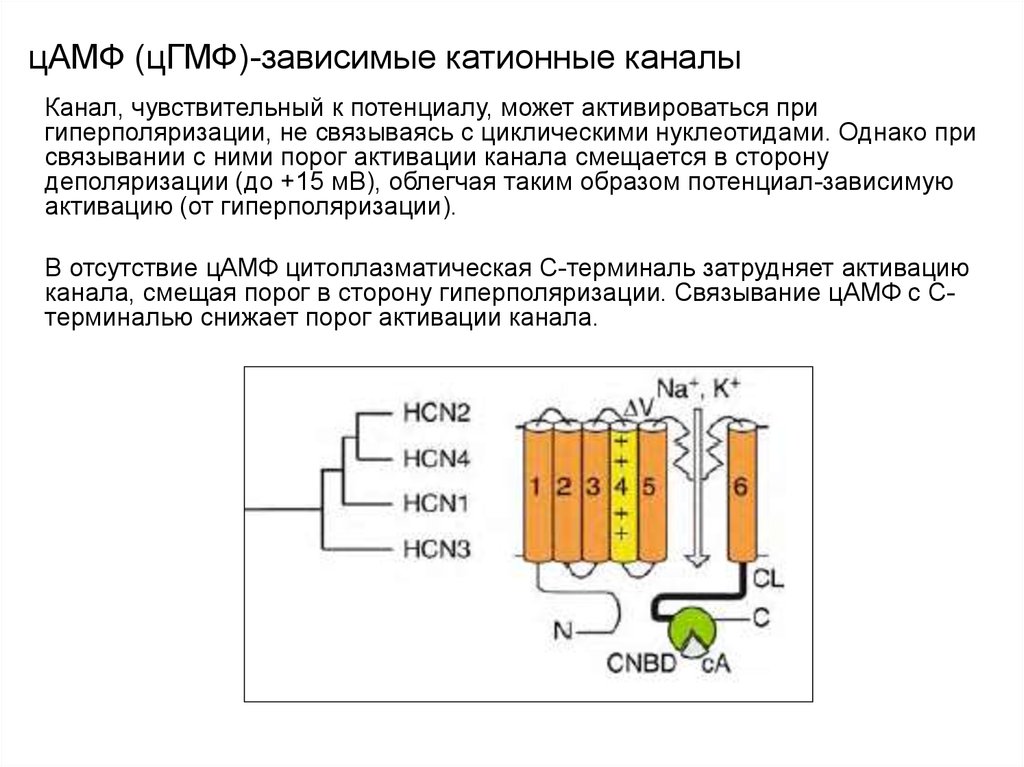
Канал, чувствительный к потенциалу, может активироваться пригиперполяризации, не связываясь с циклическими нуклеотидами. Однако при
связывании с ними порог активации канала смещается в сторону
деполяризации (до +15 мВ), облегчая таким образом потенциал-зависимую
активацию (от гиперполяризации).
В отсутствие цАМФ цитоплазматическая С-терминаль затрудняет активацию
канала, смещая порог в сторону гиперполяризации. Связывание цАМФ с Стерминалью снижает порог активации канала.
107. цАМФ (цГМФ)-зависимые катионные каналы
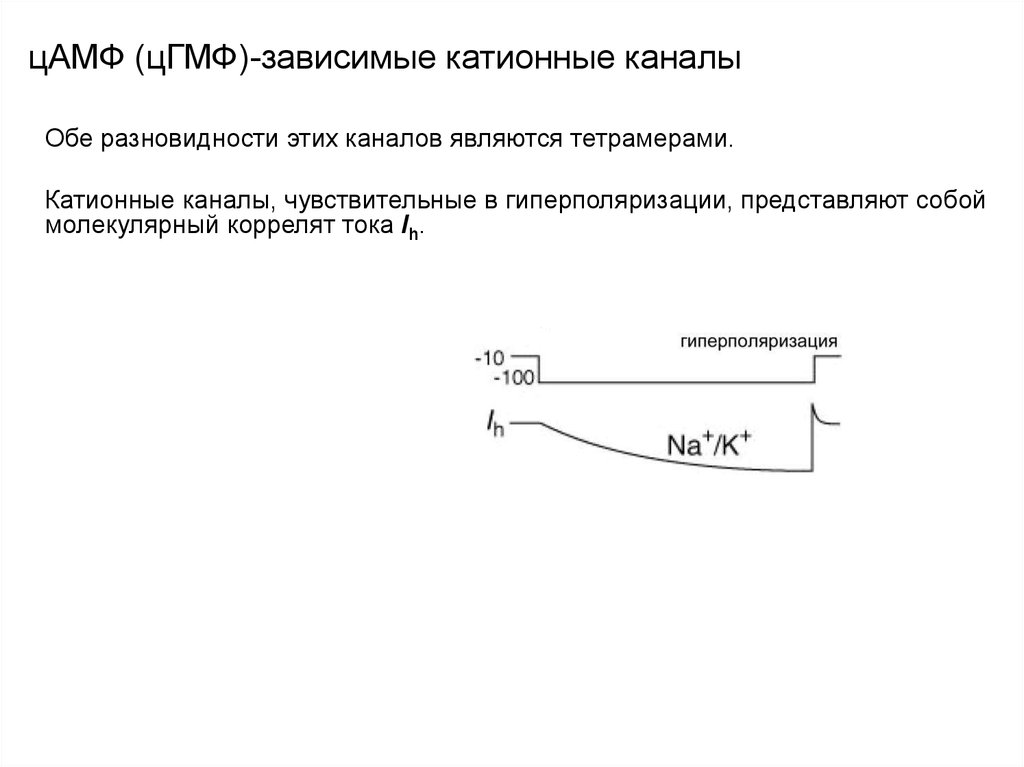
Обе разновидности этих каналов являются тетрамерами.Катионные каналы, чувствительные в гиперполяризации, представляют собой
молекулярный коррелят тока Ih.
108. Сl--каналы
В скелетных мышцах Cl--каналы (CLC-1, от англ., ChLoride Channels),открываясь при деполяризации саркоплазмы во время мышечного
сокращения, пропускают ионы Cl- в саркоплазму, которые обеспечивают
быструю реполяризацию мембраны.
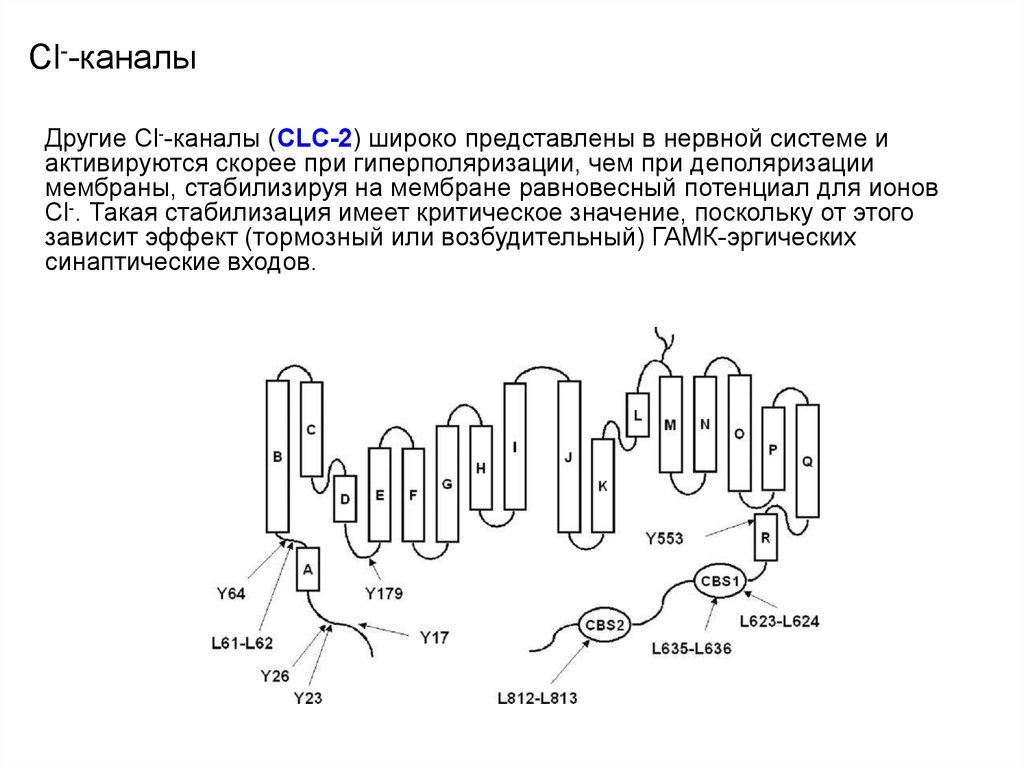
Другие Cl--каналы (CLC-2) широко представлены в нервной системе и
активируются скорее при гиперполяризации, чем при деполяризации
мембраны, стабилизируя на мембране равновесный потенциал для ионов
Cl-. Такая стабилизация имеет критическое значение, поскольку от этого
зависит эффект (тормозный или возбудительный) ГАМК-эргических
синаптические входов.
Таким образом, потенциал-зависимые Cl--каналы непосредственно не
участвуют в механизмах генерации ПД, а лишь обеспечивают нормальное
функциональное состояние мембраны.
109.
Сl--каналыВ скелетных мышцах Cl--каналы (CLC-1, от англ., ChLoride Channels),
открываясь при деполяризации саркоплазмы во время мышечного
сокращения, пропускают ионы Cl- в саркоплазму, которые обеспечивают
быструю реполяризацию мембраны.
CLC-1
110. Сl--каналы
Другие Cl--каналы (CLC-2) широко представлены в нервной системе иактивируются скорее при гиперполяризации, чем при деполяризации
мембраны, стабилизируя на мембране равновесный потенциал для ионов
Cl-. Такая стабилизация имеет критическое значение, поскольку от этого
зависит эффект (тормозный или возбудительный) ГАМК-эргических
синаптические входов.
111.
Структура потенциал-активируемых Cl-- каналовИзвестно несколько изоформ Cl--каналов:
1. Играют ведущую роль в проводимости мембраны мышечных волокон. В частности, стабилизируют заряд мембраны на уровне потенциала покоя.
2. Ассоциированы с регуляцией объема клетки и обладают чувствительностью к растяжению мембраны.
3. Отвечают за реабсорбцию хлорида в почках.
















































 biology
biology








