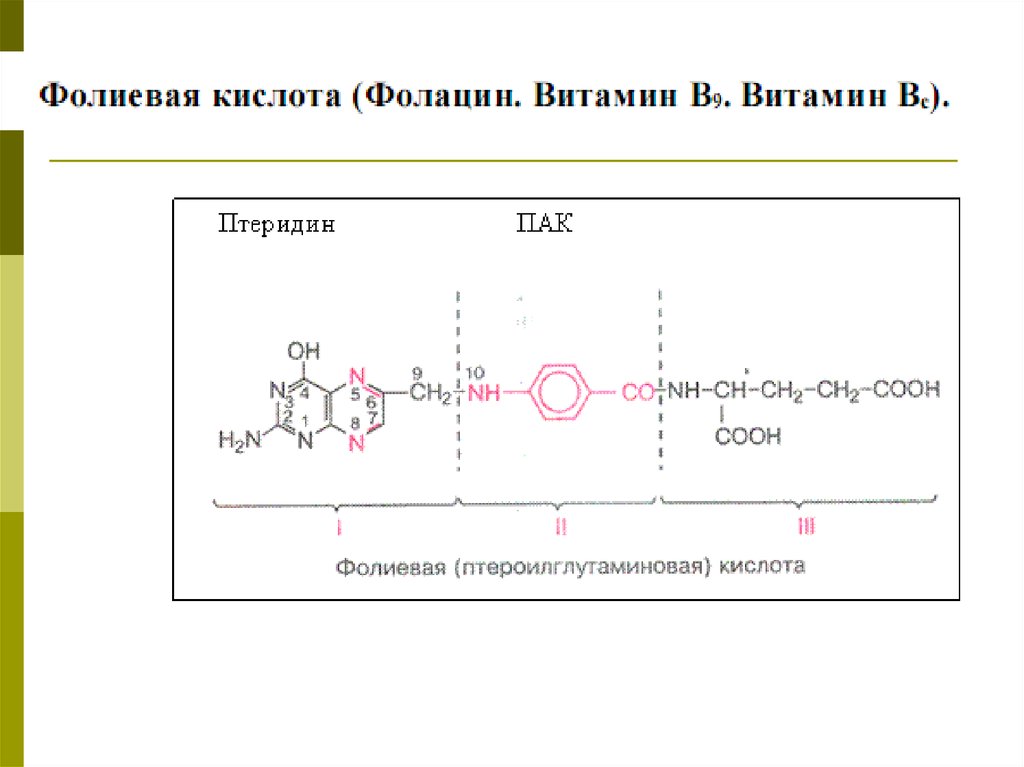
Similar presentations:
Спирты (карбинолы)
1.
OHКачественные реакции на спирты:
OH
OH
OH
OH
OH
этиленгликоль
OH
OH
OH
OH
OH
OH
глицерин
HO
OH
HO
сорбит
пентаэритрит
-яд
2014
2.
При отравлении в организмеобразуются очень токсичные
соединения –формальдегид и
муравьиная кислота.
Спирты (карбинолы)
метанол (древесный спирт)
1. сухая перегонка древесины 2.
CO + H2
этанол (этиловый, питьевой спирт)
t
CH3OH
Cr2O3/ZnO
антидот
1. гидратация этилена 2. ферментативные
превращения углеводов
Этанол лучше связывается с
ферментом
алкогольдегидрогеназой.
Это тормозит праврещение
метанола и этиленгликоля в
метаболиты. Метаболиты
выводится в неизменном виде.
Анализ крови на алкоголь
3.
4.
OHOH
этиленгликоль
и продукты его
метаболизма
OH
OH
HO
•Отравление
происходит
при
OH
OH
OH
пероральном приеме
технической
OH
HO
OH
жидкости вместо этилового спирта,
глицерин
сорбит
пентаэритрит
даже
не предполагая,
насколько
она
токсична
Диагностика затруднительна, т.к. клиника на 1-ом этапе
сходна с алкогольном опьянением.
•Проникая в клетку, молекула этиленгликоль увлекает за
собой жидкость, нарушая клеточную структуру вплоть до ее
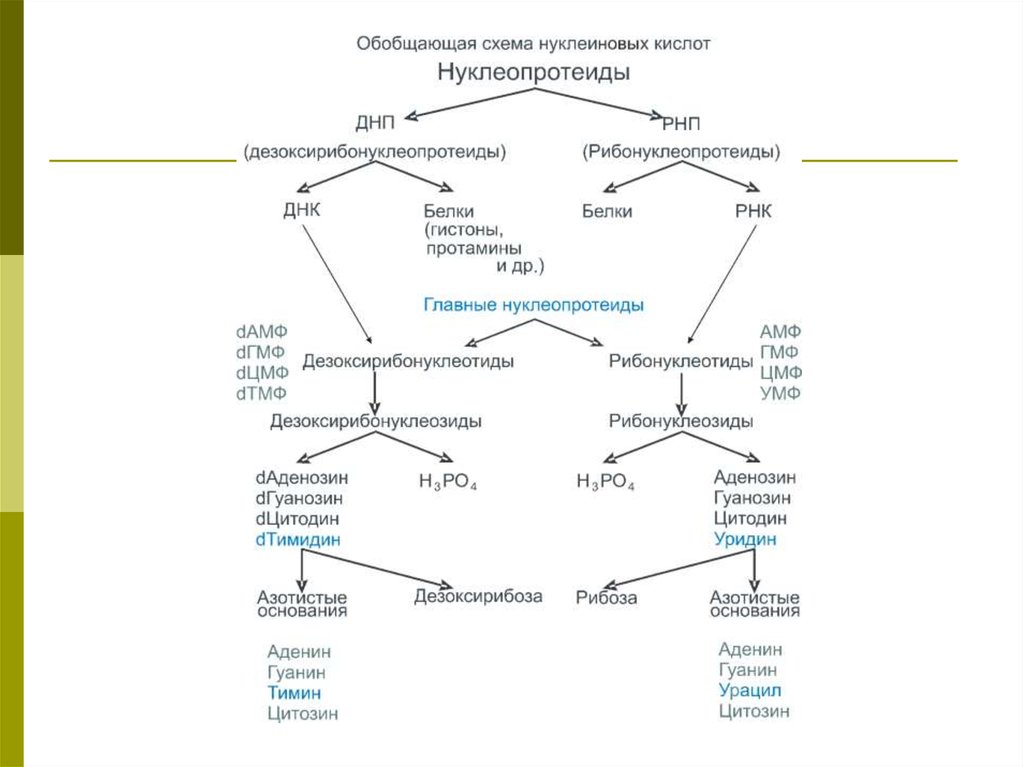
гибели.
•Этот процесс наблюдается в эпителии проксимальных
отделов почечных канальцев, где происходит реабсорбция
жидкости, что и является одной из причин развития острой
почечной недостаточности.
В случае смерти в течение 2-3 дней с момента отравления
обнаруживают в препаратах почек
кристаллы оксалата кальция СаС2О4.
5.
Гетероциклическиминазывают соединения
циклического строения,
содержащие в цикле не только
атомы углерода, но и атомы
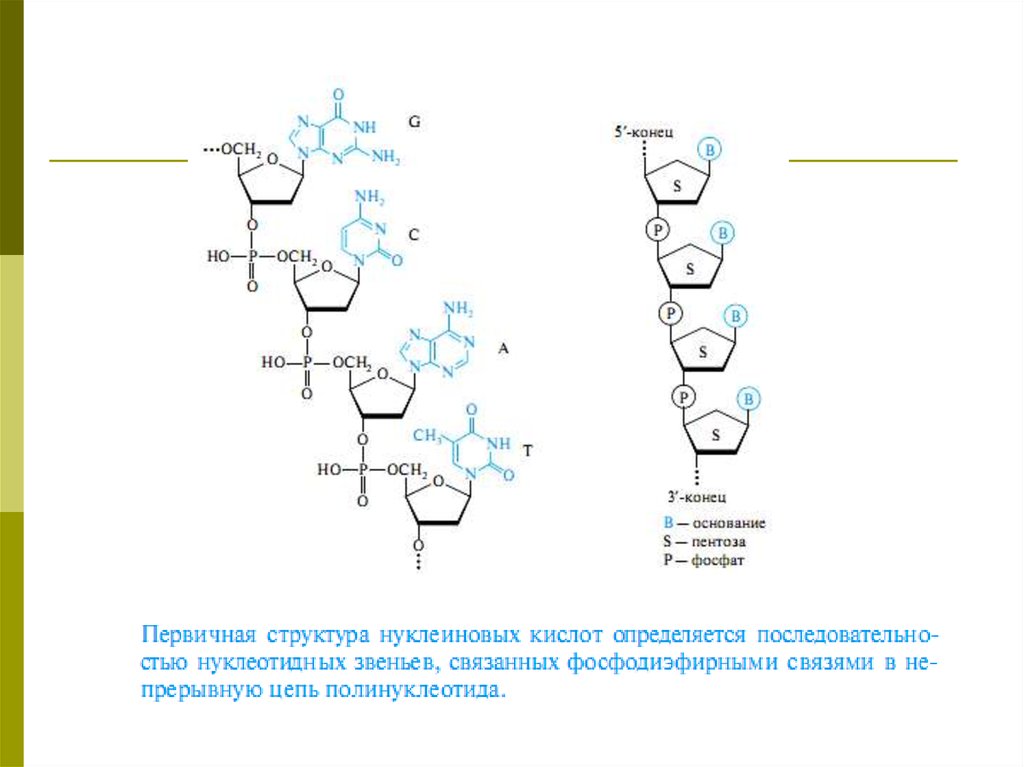
других элементов
(гетероатомов).
За счет гетероциклических соединений непрерывно
пополняется число синтетических лекарственных веществ.
Предпосылкой для этого является «родство» их строения с
природными биологически активными веществами организма
человека.
6.
По размеру цикла бывают: трех-, четырех-, пяти-,шести- и семичленными.
По типу элемента (с атомами азота, кислорода или
серы):
По числу гетероатомов (с одним и двумя гетероатомами,
но известны соединения и с четырьмя атомами в одном
цикле):
По природе и взаимному расположению нескольких
гетероатомов (возможны разнообразные комбинации
(например, N и S, N и О и т. д.), причем гетероатомы
могут занимать различные положения относительно друг
друга.
По степени насыщенности гетероциклы могут быть
ароматическими, ненасыщенными и насыщенными.
По числу циклов различают моноциклические,
полициклические (главным образом,
конденсированные) системы.
7.
3. Номенклатура•В номенклатуре ИЮПАК для многих гетероциклов
разрешается тривиальные и полутривиальные названия.
Правила ИЮПАК не регламентируют положение гетероатома при
написании формул гетероцциклов, но традиционно гетероатом /или
гетероатомы располагают в нижней части цикла
4. Принцип нумерация атомов
!Нумерация атомов в моноциклических соединениях всегда
начинается от гетероатома.
Если гетероцикл соедржит различные гетероатомы, то
соблюдают следующий порядок падения старшинства атомов:
О>S>N.
Нумерацию продолжают так, чтобы другой гетероатом
получил наименьший локант.
При наличии в молекуле неравноценных атомов азота (-N= и
-NH-),нумерация начинается от более насыщенного (от —NH-).
8.
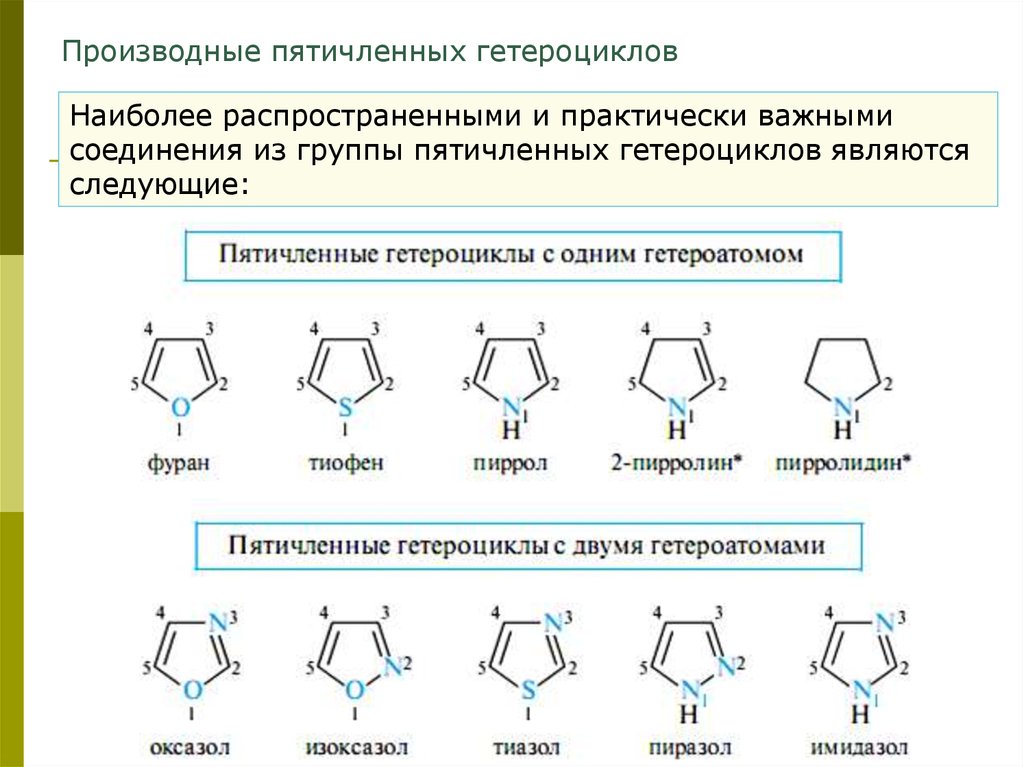
Производные пятичленных гетероцикловНаиболее распространенными и практически важными
соединения из группы пятичленных гетероциклов являются
следующие:
9.
Производные шестичленных гетероцикловИз шестичленных гетероциклов наибольший интерес для
медицины представляют следующие
Эти гетероциклы составляют основу молекул многих природных
лекарственных веществ (из группы алкалоидов, витаминов,
антибиотиков и др.).
10.
Систематическая номенклатураВ систематической номенклатуре моноциклических соединений,
содержащих один или несколько гетероатомов в цикле,
используется метод Ганча- Видмана.
Согласно этому методу, название гетероцикла образуют путем
сочетания соответствующего префикса:
-окса – для атома кислорода; тиа – для атома серы;
-аза – для атома азота- с корнями, отражающими размер
цикла (число атомов в цикле) и степень его насыщенности
(табл. …)
Для удобства произношения буква «а» в префиксах
часто опускается.
Примеры:
Локант«обозначенного водорода (Н)» показывает, что «лишний»
атом водорода находится в положении 2.
11.
Табл. Корни, соответствующие гетероциклам12.
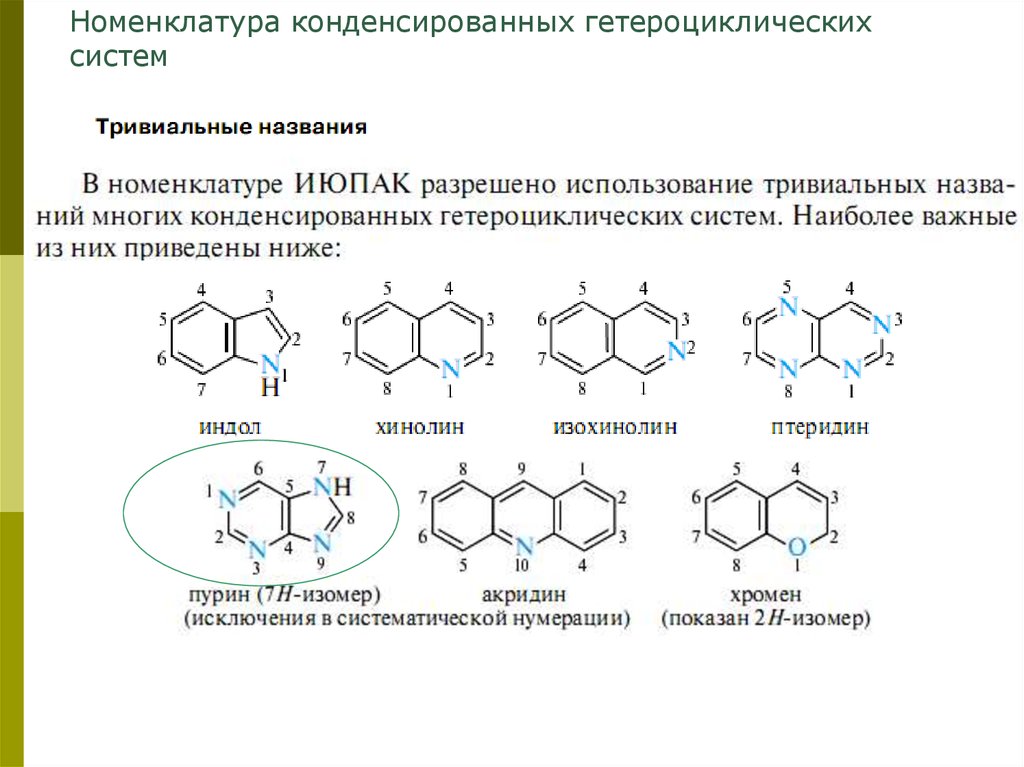
Номенклатура конденсированных гетероциклическихсистем
13.
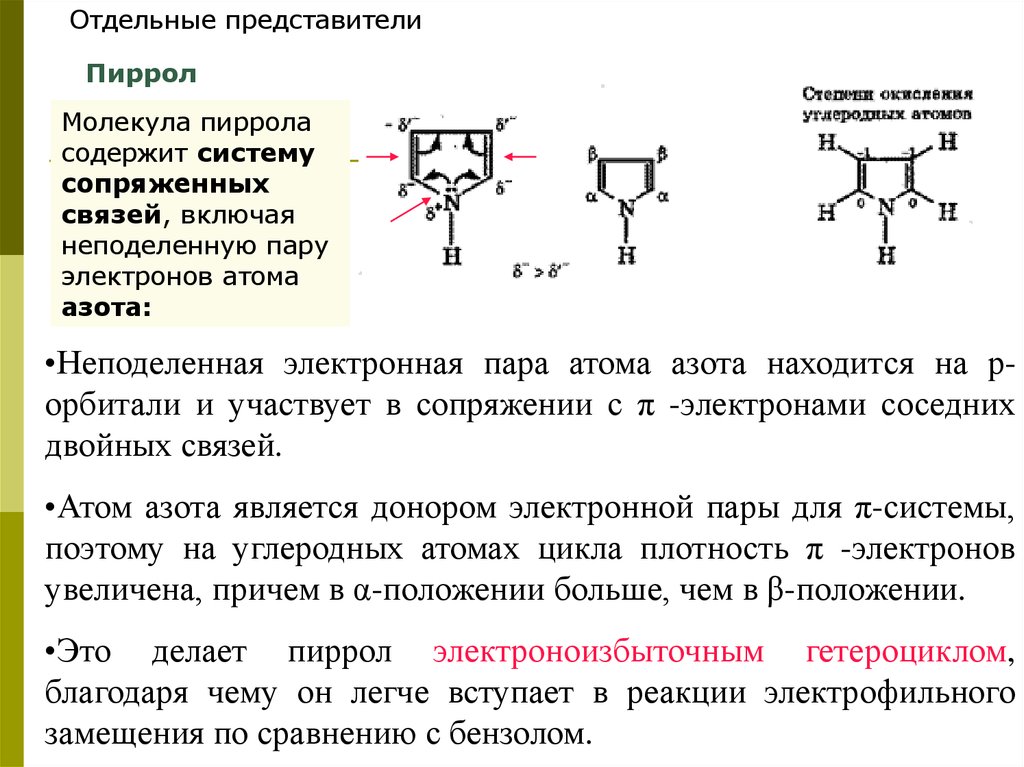
Отдельные представителиПиррол
Молекула пиррола
содержит систему
сопряженных
связей, включая
неподеленную пару
электронов атома
азота:
•Неподеленная электронная пара атома азота находится на рорбитали и участвует в сопряжении с π -электронами соседних
двойных связей.
•Атом азота является донором электронной пары для π-системы,
поэтому на углеродных атомах цикла плотность π -электронов
увеличена, причем в α-положении больше, чем в β-положении.
•Это делает пиррол электроноизбыточным гетероциклом,
благодаря чему он легче вступает в реакции электрофильного
замещения по сравнению с бензолом.
14.
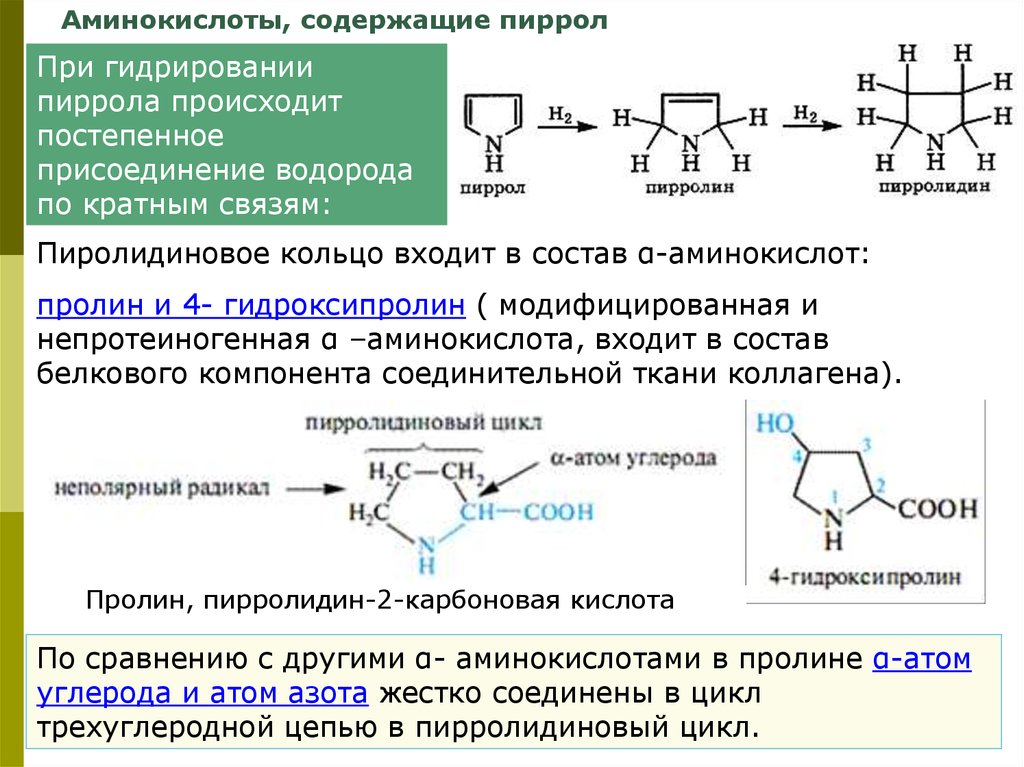
Аминокислоты, содержащие пирролПри гидрировании
пиррола происходит
постепенное
присоединение водорода
по кратным связям:
Пиролидиновое кольцо входит в состав α-аминокислот:
пролин и 4- гидроксипролин ( модифицированная и
непротеиногенная α –аминокислота, входит в состав
белкового компонента соединительной ткани коллагена).
Пролин, пирролидин-2-карбоновая кислота
По сравнению с другими α- аминокислотами в пролине α-атом
углерода и атом азота жестко соединены в цикл
трехуглеродной цепью в пирролидиновый цикл.
15.
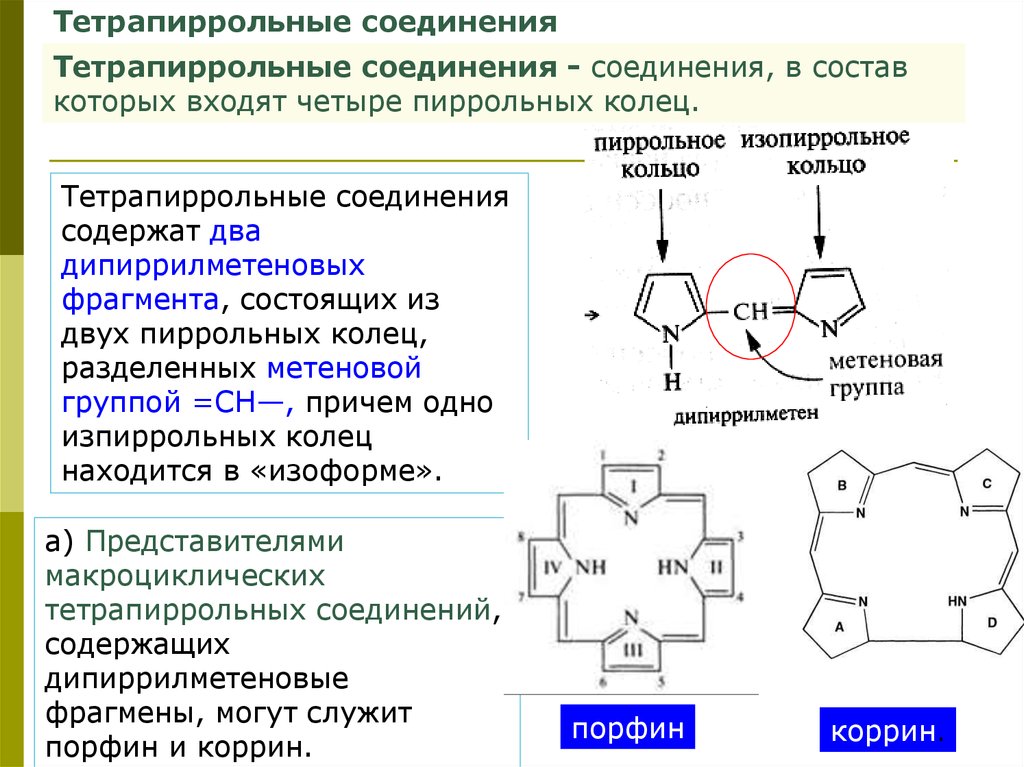
Тетрапиррольные соединенияТетрапиррольные соединения - соединения, в состав
которых входят четыре пиррольных колец.
Тетрапиррольные соединения
содержат два
дипиррилметеновых
фрагмента, состоящих из
двух пиррольных колец,
разделенных метеновой
группой =СН—, причем одно
изпиррольных колец
находится в «изоформе».
а) Представителями
макроциклических
тетрапиррольных соединений,
содержащих
дипиррилметеновые
фрагмены, могут служит
порфин и коррин.
порфин
коррин.
16.
ПорфиныПорфины, частично или полностью замещенные в
пиррольных циклах, называют порфиринами.
Родоначальником ряда порфиринов можно считать тетрапиррольный
порфирин, из которого получают все остальные порфирины,
замещая водородные атомы в положениях 1—8 различными
радикалами, чаще всего метильной, этильной и винильной группами
или остатком пропионовой кислоты.
Классификация порфиринов
Классификация порфиринов исходит из типа
заместителей его боковых цепей.
Наиболее важными считаются следующие классы:
•этиопорфирины, которые имеют в качестве заместителей 4
метильные и 4 этильные группы;
•мезопорфирины с четырьмя метильными, двумя этильными и
двумя карбоксивинильными группами;
•протопорфирины, содержащие четыре метальные, две винильные
и две карбоксиэтильные группы,
• копропорфирины с четырьмя метильными и четырьмя
карбоксиэтильными группами.
17.
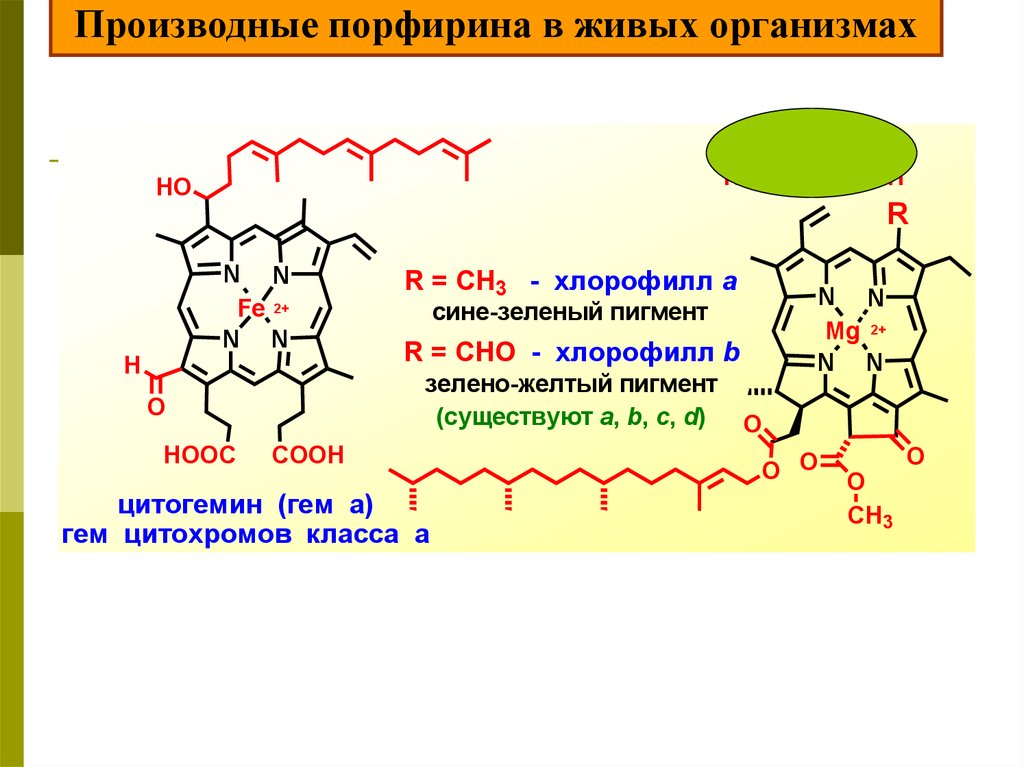
Тетрапиррольные соединенияПорфирины образуют комплексы с ионами многих металлов,
таких, как магний, железо, цинк, никель, кобальт, медь.
18.
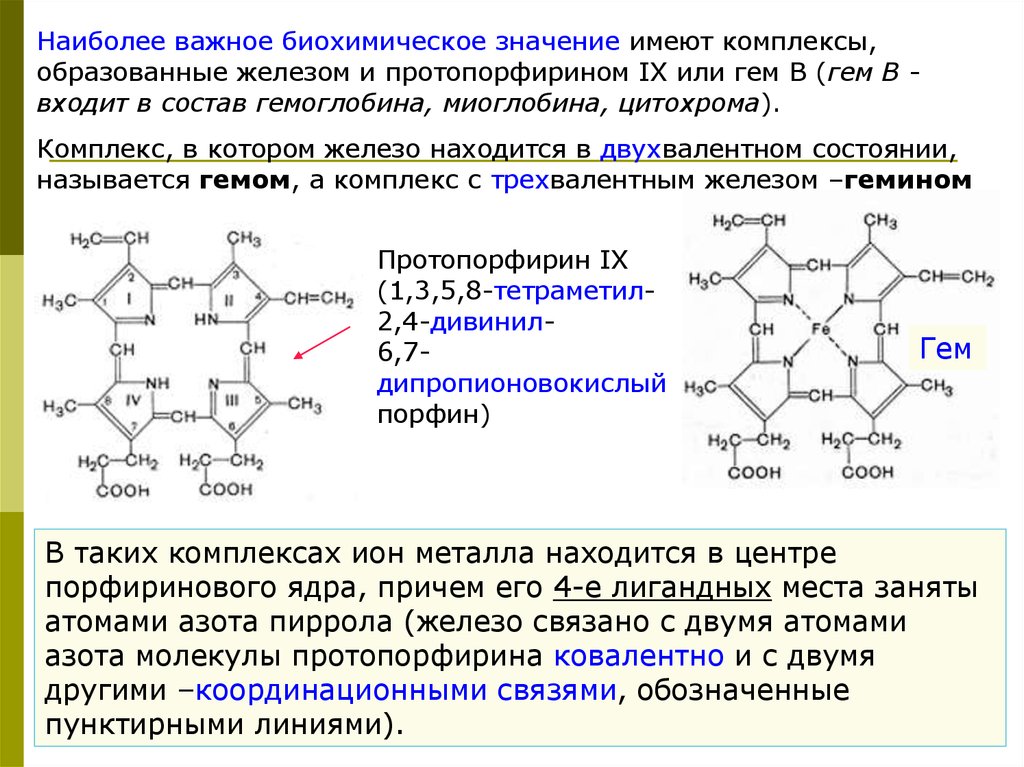
Наиболее важное биохимическое значение имеют комплексы,образованные железом и протопорфирином IX или гем В (гем В входит в состав гемоглобина, миоглобина, цитохрома).
Комплекс, в котором железо находится в двухвалентном состоянии,
называется гемом, а комплекс с трехвалентным железом –гемином
Протопорфирин IX
(1,3,5,8-тетраметил2,4-дивинил6,7дипропионовокислый
порфин)
Гем
В таких комплексах ион металла находится в центре
порфиринового ядра, причем его 4-е лигандных места заняты
атомами азота пиррола (железо связано с двумя атомами
азота молекулы протопорфирина ковалентно и с двумя
другими –координационными связями, обозначенные
пунктирными линиями).
19.
б) Строение линейныхтетрапиррольных соединений
(распад гемоглобина, образование
желчных пигментов)
•При биологическом окислении гемоглобина и других
гемсодержащих белков образуются окрашенные вещества,
содержащие линейную тетрапиррольную систему, так
называемые билирубиноиды.
•Их наиболее важный представитель — билирубин — имеет
оранжевую окраску.
•Билирубин и билирубиноиды являются пигментами желчи,
часть которых выделяется с мочой, придавая ей характерный
желтый оттенок.
•При желтухе, в результате чрезмерного разрушения
гемсодержащих белков, в крови постепенно накапливаются
пигменты желчи, что сопровождается пожелтением кожи.
20.
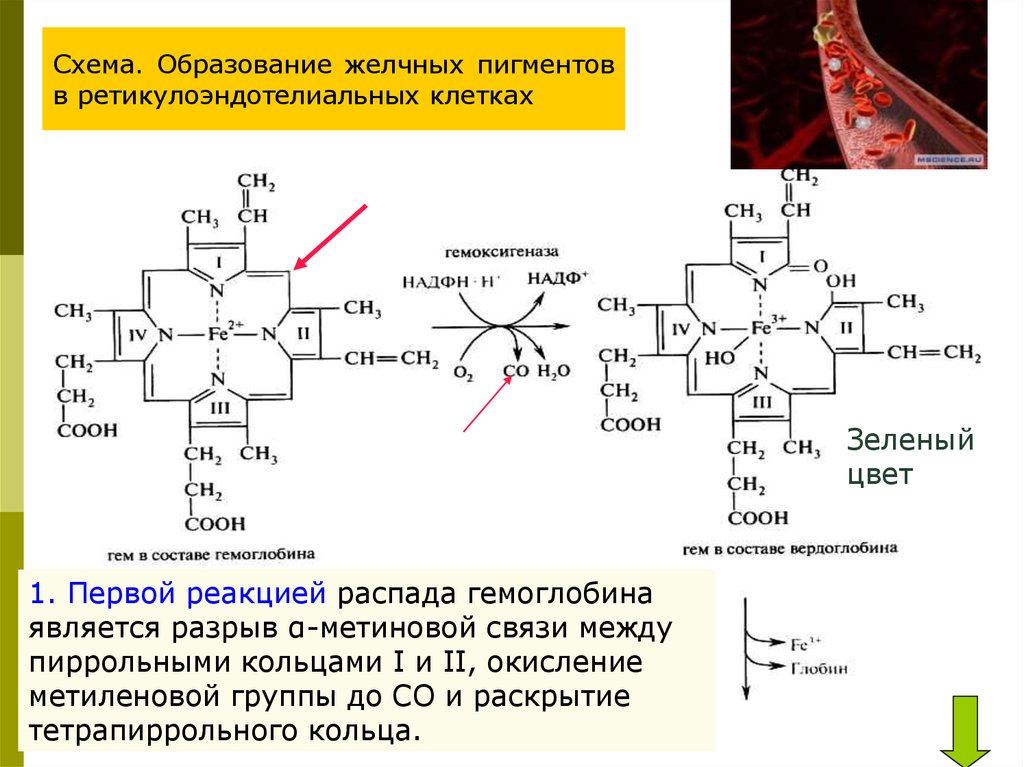
Схема. Образование желчных пигментовв ретикулоэндотелиальных клетках
Зеленый
цвет
1. Первой реакцией распада гемоглобина
является разрыв α-метиновой связи между
пиррольными кольцами I и II, окисление
метиленовой группы до СО и раскрытие
тетрапиррольного кольца.
21.
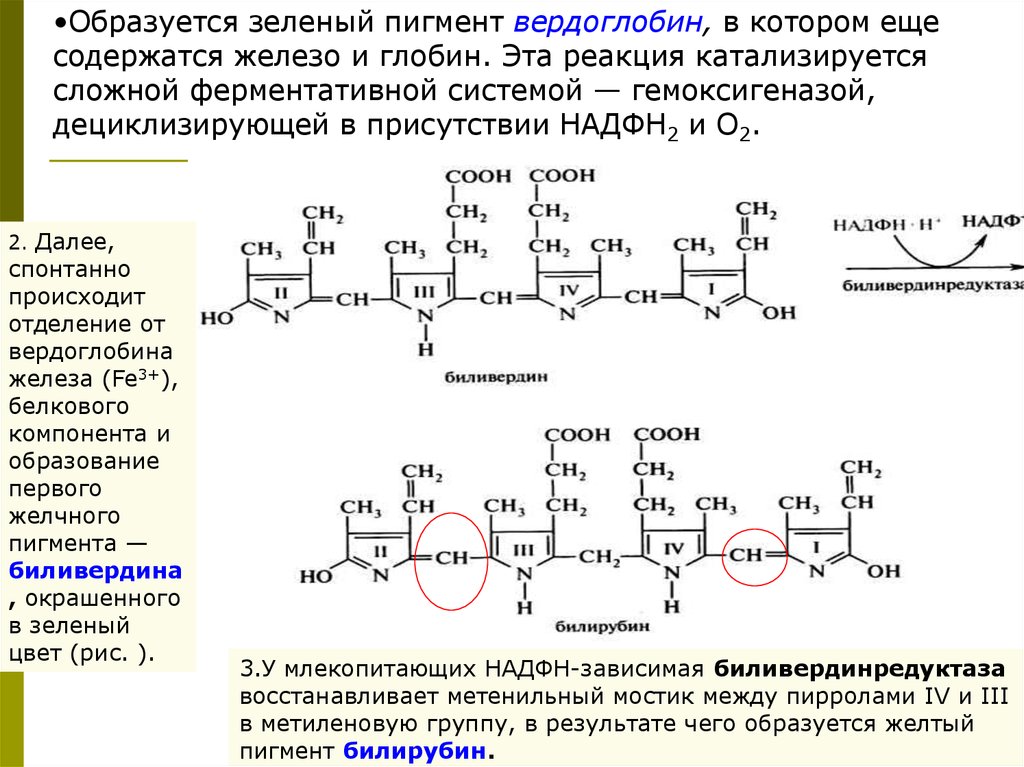
•Образуется зеленый пигмент вердоглобин, в котором ещесодержатся железо и глобин. Эта реакция катализируется
сложной ферментативной системой — гемоксигеназой,
дециклизирующей в присутствии НАДФН2 и О2.
2. Далее,
спонтанно
происходит
отделение от
вердоглобина
железа (Fe3+),
белкового
компонента и
образование
первого
желчного
пигмента —
биливердина
, окрашенного
в зеленый
цвет (рис. ).
3.У млекопитающих НАДФН-зависимая биливердинредуктаза
восстанавливает метенильный мостик между пирролами IV и III
в метиленовую группу, в результате чего образуется желтый
пигмент билирубин.
22.
NN
N N
Fe 2+
N N
NH N
гем организмах
Производные порфирина в живых
гемоглобина
коррин
порфирин
HOOC
HO
COOH
R
N N
Fe 2+
N N
H
N N
Mg 2+
N N
сине-зеленый пигмент
R = CHO - хлорофилл b
зелено-желтый пигмент
(существуют a, b, c, d)
O
HOOC
R = CH3 - хлорофилл а
COOH
цитогемин (гем а)
гем цитохромов класса а
O
O O
O
O
CH3
23.
76Et
Et
N
O
N
OPO3H2
N
N
H
N
H
ЛСД
псилоцибин
24.
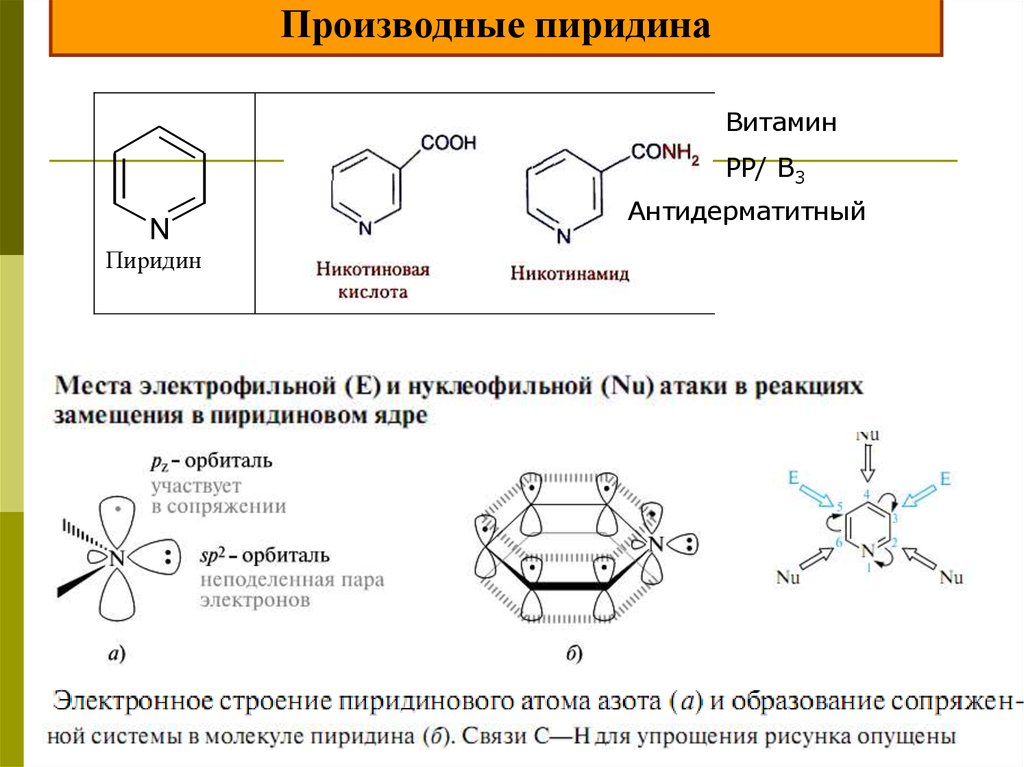
Производные пиридинаВитамин
РР/ В3
N
Пиридин
Антидерматитный
25.
Активная (коферментная) формаВитамин
2.В2 (рибофлавин)
3.В
(никотинамид)
3 (РР)
2.В
(рибофлавин)
2
3.В3 (РР) (никотинамид)
Активная (коферментная) форма
ФАД, ФМН
НАД,
НАДФ
ФАД,
ФМН
НАД, НАДФ
Тип катализируемой реакции
Перенос водорода
(биохимическая
функция)
(дыхание)
Перенос водорода
(дыхание)
Никотинамидные коферменты
• Это производные витамина РР, которые используются
ферментами – оксидоредуктазами.
•Функция НАД и НАДФ состоит в переносе атомов водорода и
электронов. Эта реакция осуществляется за счет
никотинамидной части молекул коферментов.
•Связь между ними и апоферментами непрочная, и они
ассоциируют между собой только в момент реакции.
В природе встречаются два вида коферментов этого
типа:
1. никотинамидадениндинуклеотид (НАД+)
2. никотинамидадениндинуклеотидфосфат (НАДФ+)
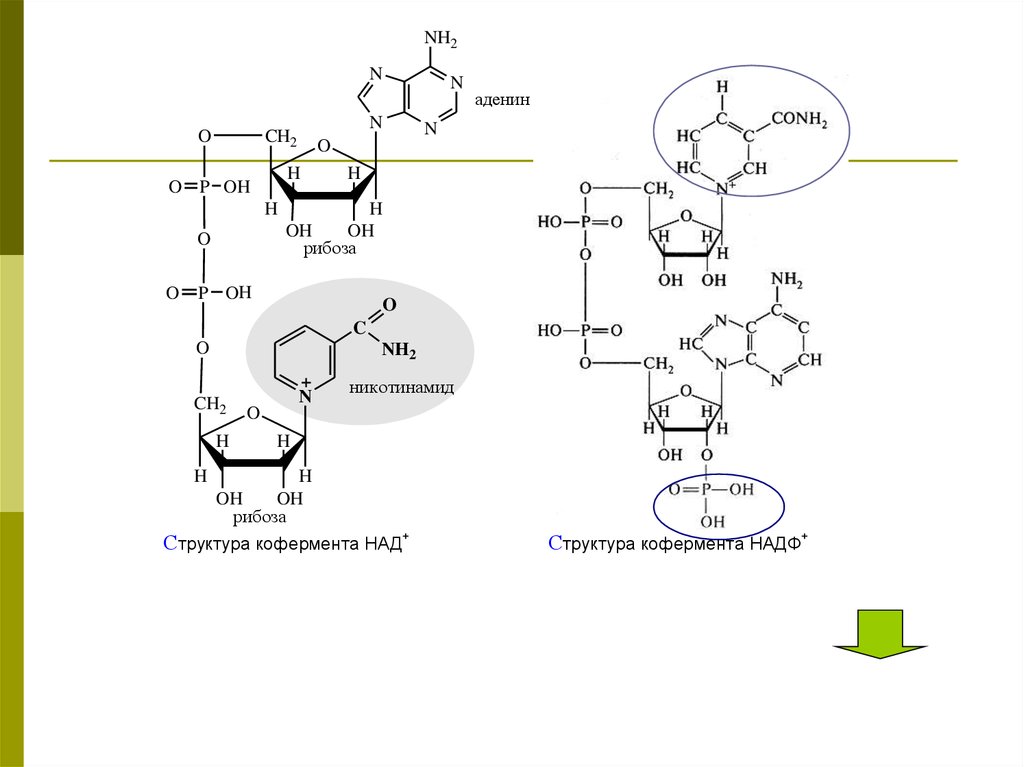
26.
NH2N
O
H
O
аденин
N
O
H
O P OH
O
N
CH2
N
H
H
OH
OH
рибоза
P OH
O
C
O
NH2
CH2
H
+
N
O
никотинамид
H
H
H
OH
OH
рибоза
Структура кофермента НАД+
Структура кофермента НАДФ+
27.
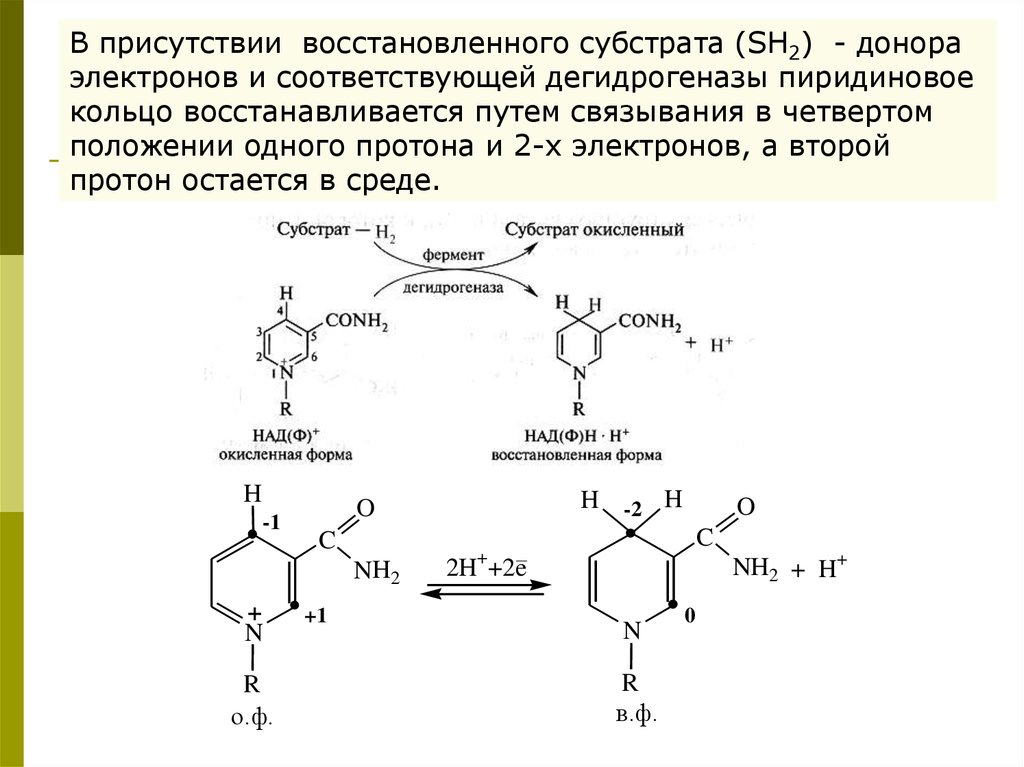
В присутствии восстановленного субстрата (SH2) - донораэлектронов и соответствующей дегидрогеназы пиридиновое
кольцо восстанавливается путем связывания в четвертом
положении одного протона и 2-х электронов, а второй
протон остается в среде.
H
-1
C
NH2
+
N
R
о.ф.
H -2 H
O
+1
O
C
2H++2e
NH2 + H+
N
R
в.ф.
0
28.
29.
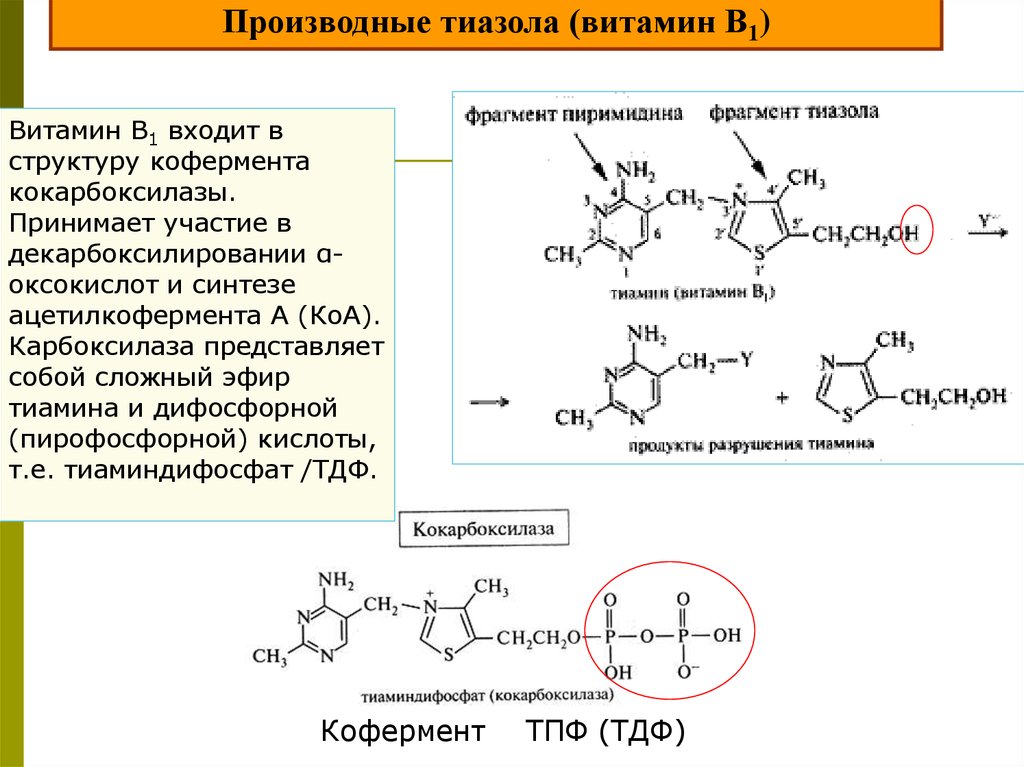
Производные тиазола (витамин В1)Витамин В1 входит в
структуру кофермента
кокарбоксилазы.
Принимает участие в
декарбоксилировании αоксокислот и синтезе
ацетилкофермента А (КоА).
Карбоксилаза представляет
собой сложный эфир
тиамина и дифосфорной
(пирофосфорной) кислоты,
т.е. тиаминдифосфат /ТДФ.
Кофермент
ТПФ (ТДФ)
30.
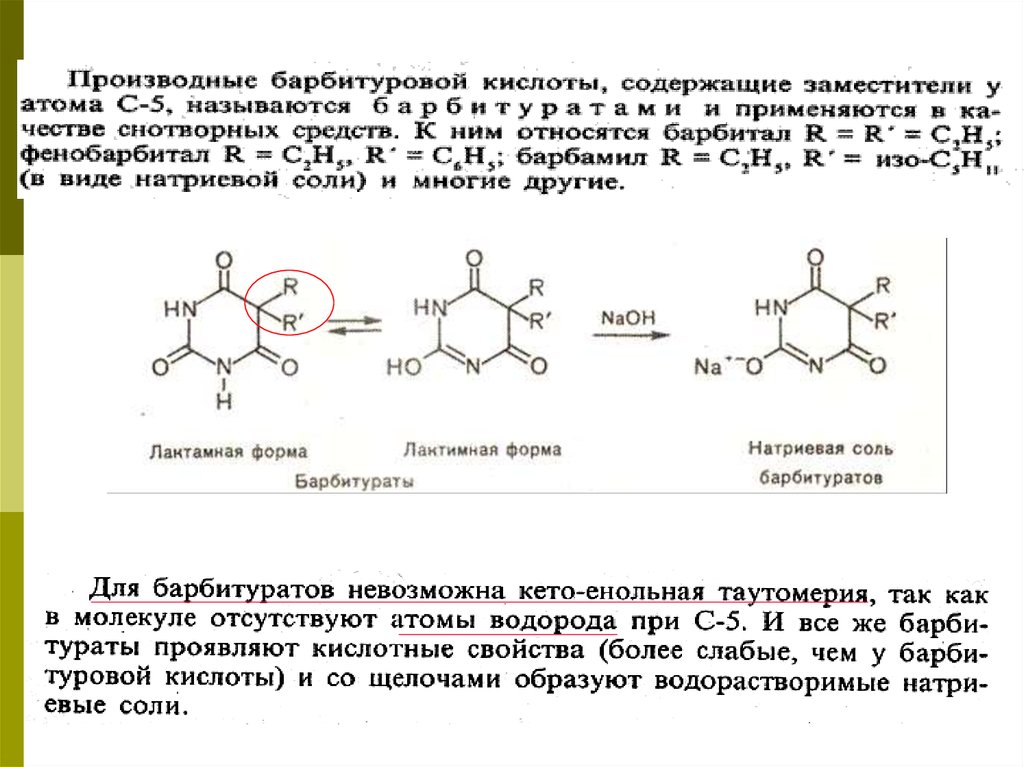
Производные барбитуровой кислоты31.
32.
-Классификация
COOH
COOH
1. По стереоизомерии.
H
H2N
NH2
H
R
R
D-ряд
L-ряд
Оптическая изомерия
Алифатические
2
2. По химическому
строению радикала.
Ароматические
Дополнительные
функциональные
группы
Гли
Ала
Вал
Лей
Вал
- ОН
Сер
Тре
Фен, Тир
- SH
Цис
Мет
- COOH
Аcп
Глу
Гетероциклические
Гис, Три, Про
- NH2
Лиз
Арг
Амиды
кислот
Асн
Глн
33.
Неполярные гидрофобные3. По полярности
радикала.
Ала, Вал,
Лей, Иле,
Про, Фен,
Три, Мет.
Неионогенные
Глн, Сер, Тре, Асн
Ионогенные
Кислые
Кислые
Основные
COOH
COOH
COOH
NH2
NH2
NH2
pI=7
pI<7
pI>7
все остальные
Асп 3,0; Глу 3,2
Цис 5,0; Тир 5,7
Лиз 9,8; Арг 10,8
Гис 7,6
Нейтральные
COOH
4. По
кислотноосновным
свойствам.
Полярные гидрофильные
NH2
Основные
34.
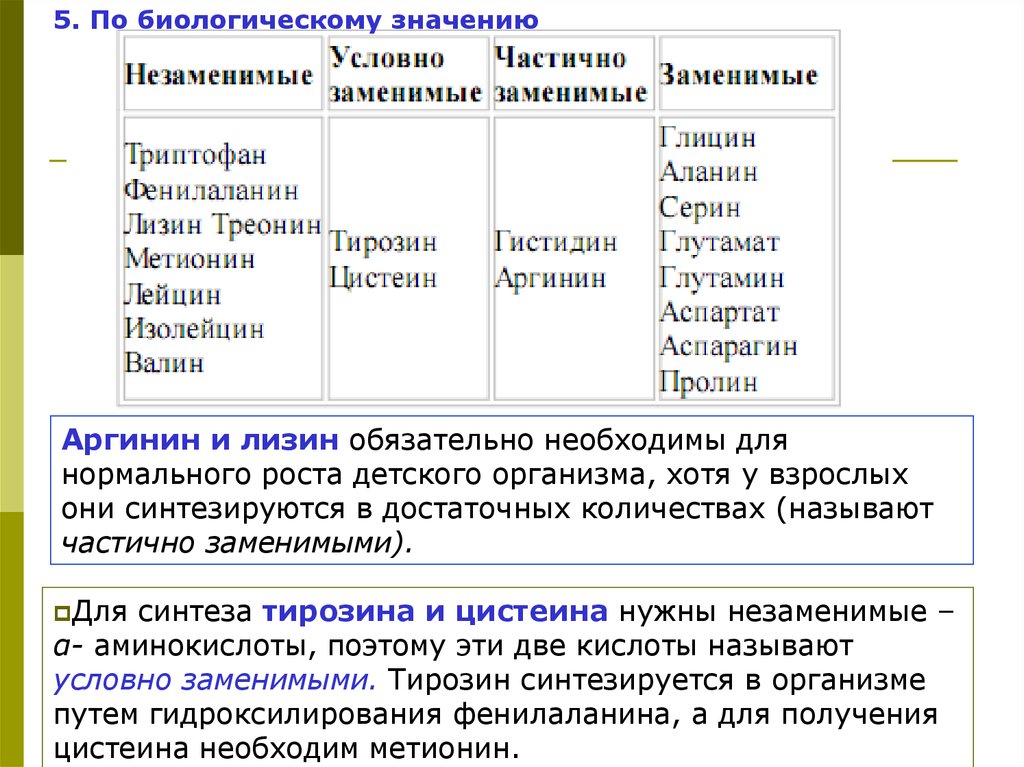
5. По биологическому значениюАргинин и лизин обязательно необходимы для
нормального роста детского организма, хотя у взрослых
они синтезируются в достаточных количествах (называют
частично заменимыми).
Для
синтеза тирозина и цистеина нужны незаменимые –
α- аминокислоты, поэтому эти две кислоты называют
условно заменимыми. Тирозин синтезируется в организме
путем гидроксилирования фенилаланина, а для получения
цистеина необходим метионин.
35.
Расстояние между атомами С и N в пептидной связи (=0,132 нм)является промежу-
36.
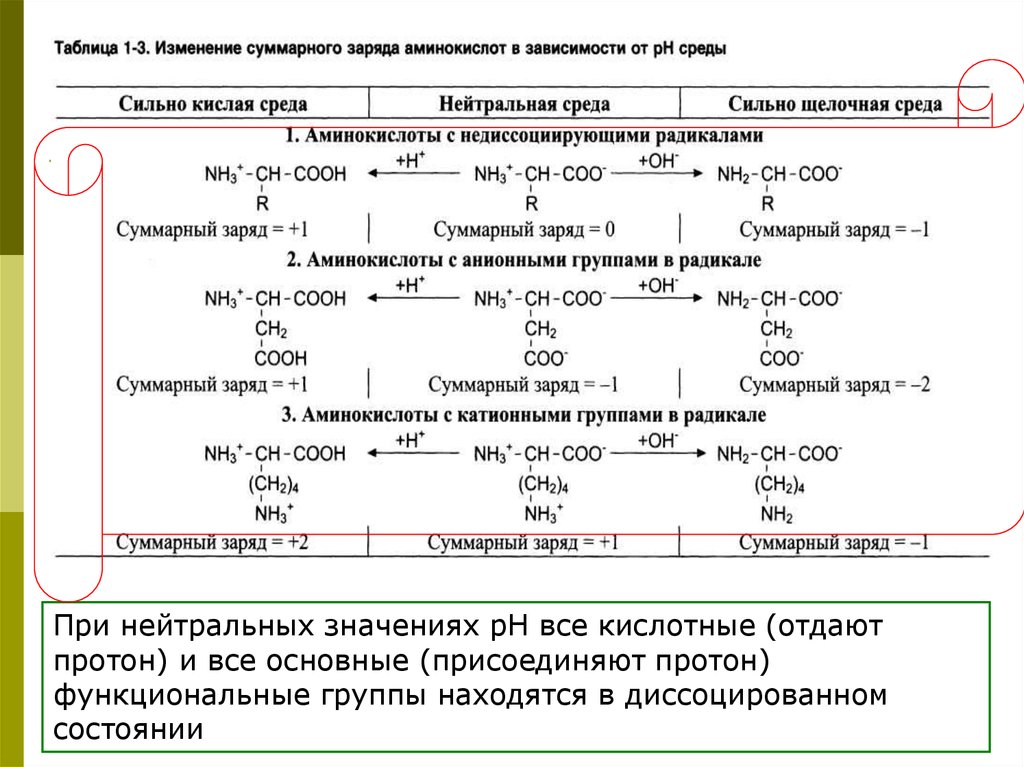
При нейтральных значениях рН все кислотные (отдаютпротон) и все основные (присоединяют протон)
функциональные группы находятся в диссоцированном
состоянии
37.
ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА АМИНОКИСЛОТ И БЕЛКОВИзоэлектрическую точку определяют по соотношению
Нейтральные α аминокислоты
pI 0,5( pKa1 pKa2 )
Кислые α аминокислоты
pI 0,5( pKa1 pKa3 )
Основные α аминокислоты
pI 0,5( pKa2 pKa3 )
См
табл.
38.
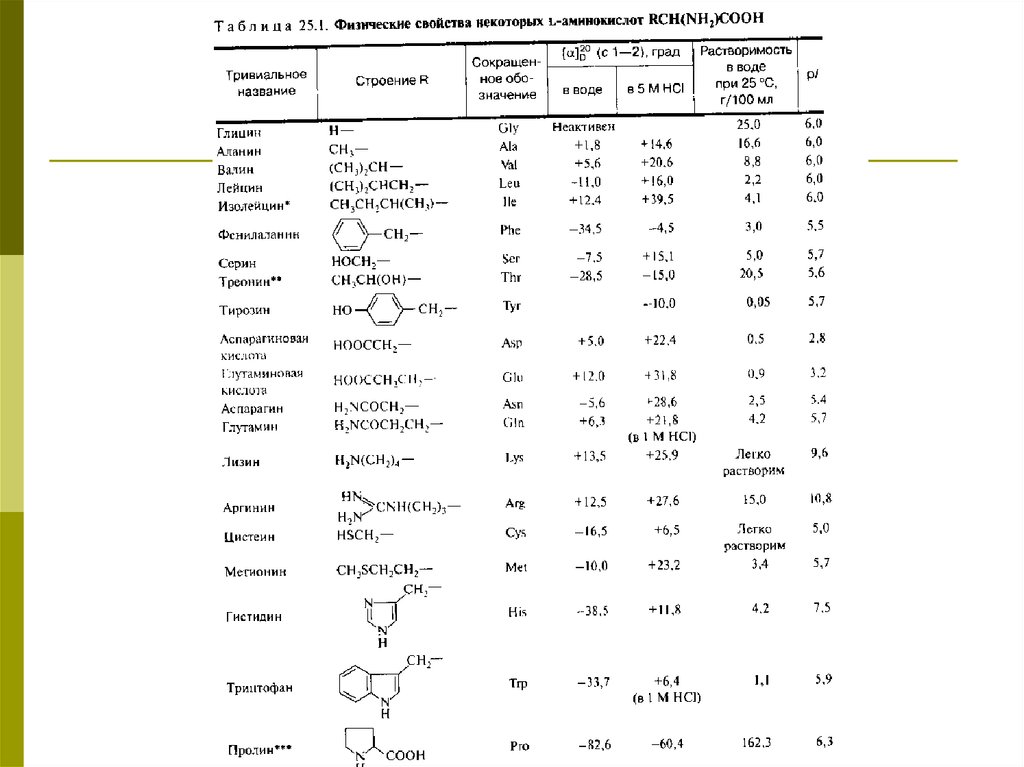
Кислотно-основные свойства важнейших αаминокислот-аминокислот
39.
40.
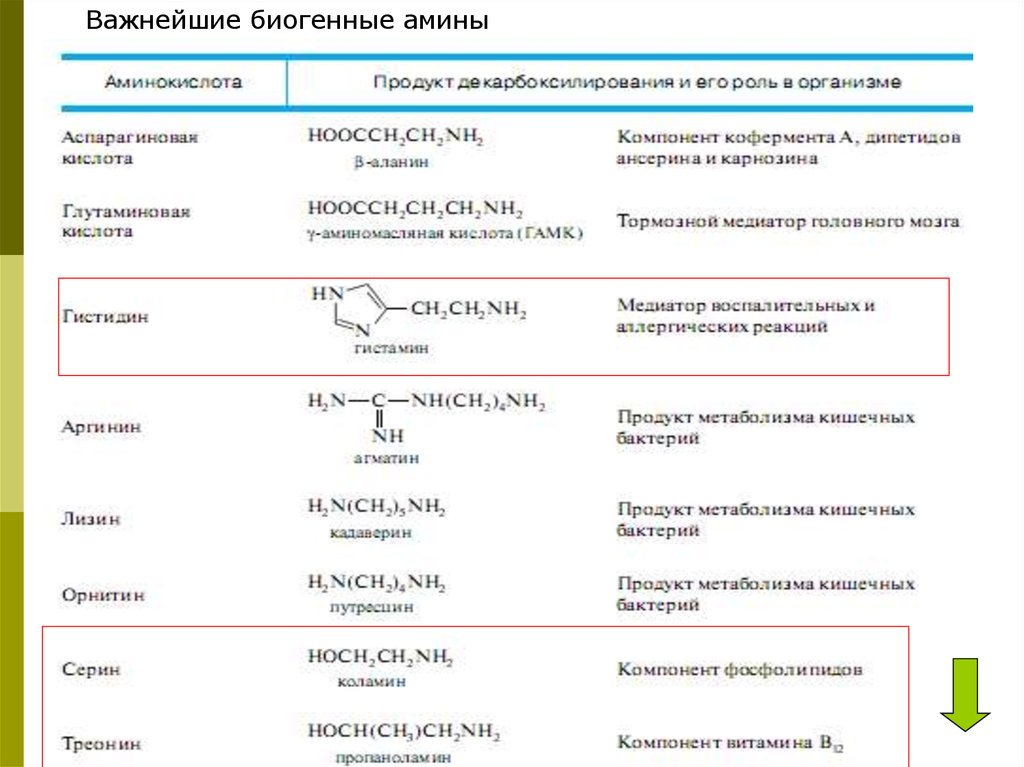
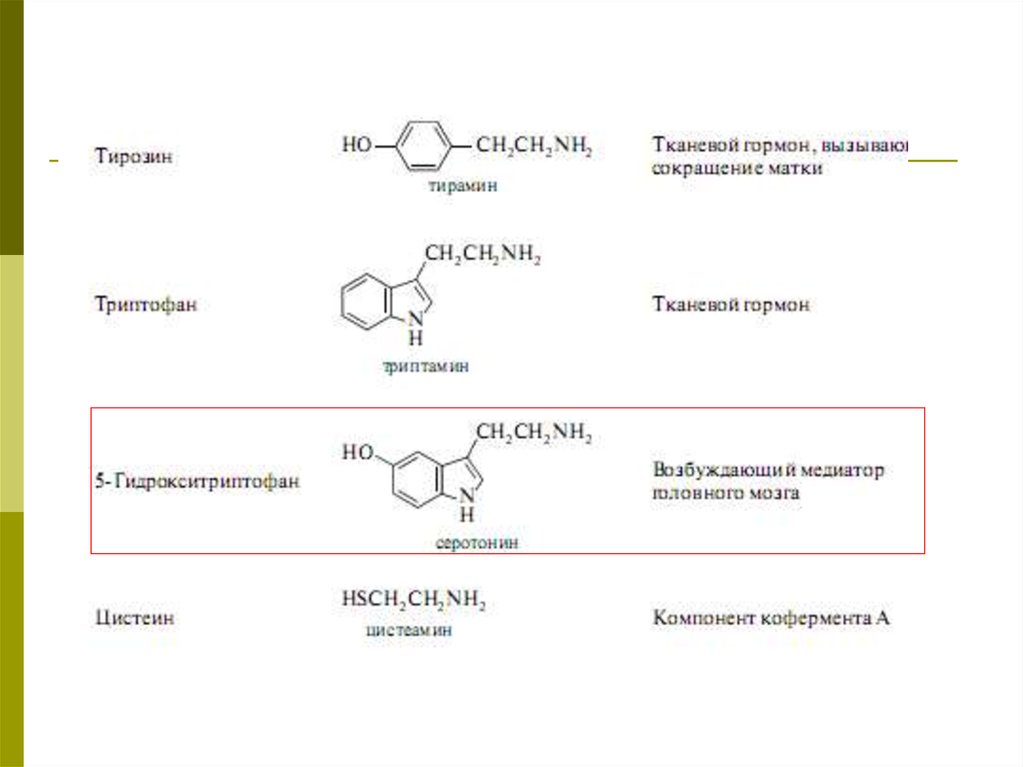
Важнейшие биогенные амины41.
42.
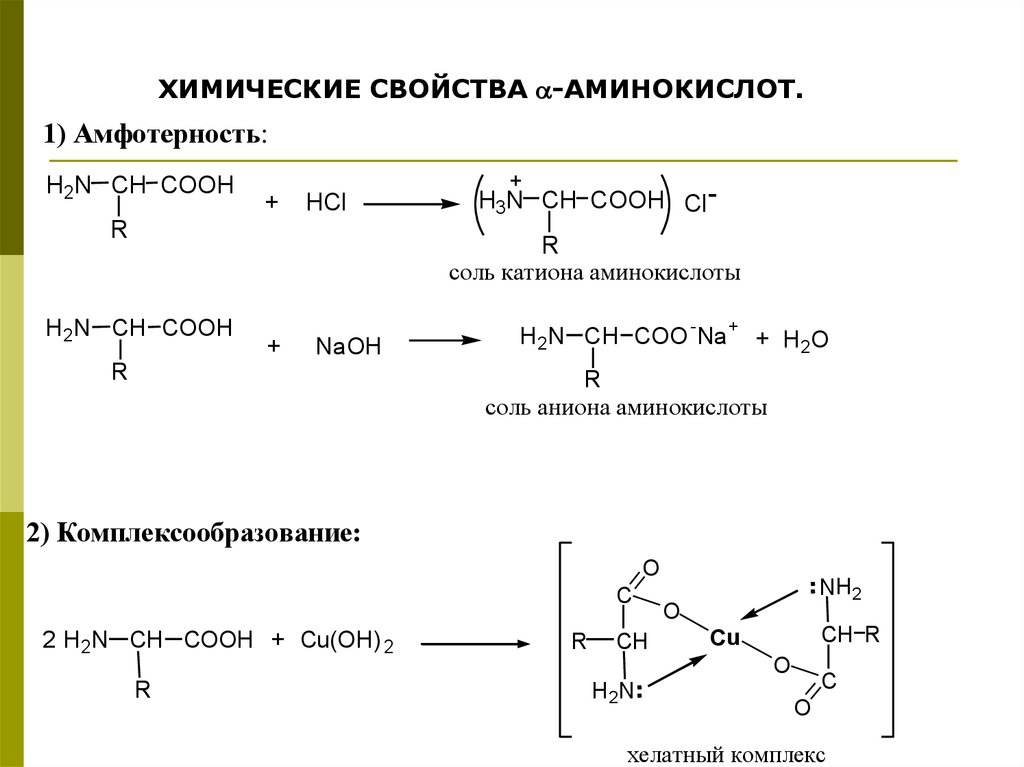
ХИМИЧЕСКИЕ СВОЙСТВА -АМИНОКИСЛОТ.1) Амфотерность:
H2N CH COOH
+
HCl
R
+
H3N CH COOH Cl R
соль катиона аминокислоты
H 2N CH COOH
+
NaOH
R
H2N CH COO -Na + + H2O
R
соль аниона аминокислоты
2) Комплексообразование:
O
2 H2N CH COOH + Cu(OH) 2
CH
O
CH R
Cu
O
H2N
C
..
R
R
NH2
..
C
O
хелатный комплекс
43.
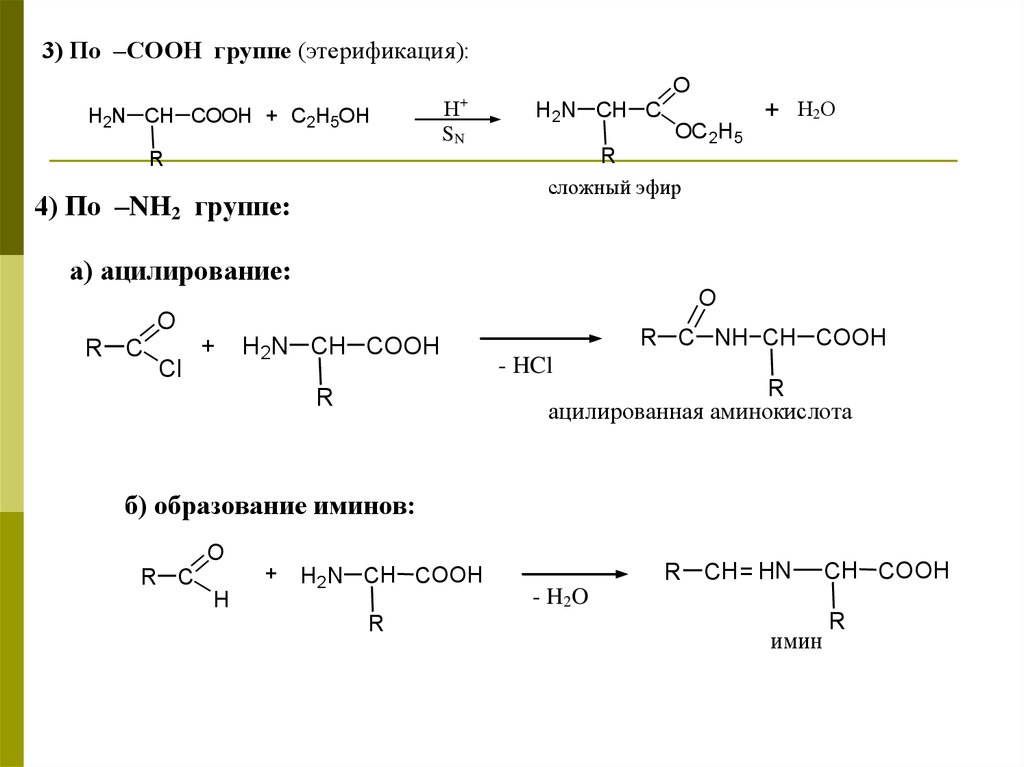
3) По –СООН группе (этерификация):H2N CH COOH + C2H5OH
+
Н
SN
O
H2N CH C
+ Н2О
OC 2H5
R
сложный эфир
R
4) По –NH2 группе:
а) ацилирование:
O
O
R C
Cl
+
H2N CH COOH
R C NH CH COOH
- HCl
R
ацилированная аминокислота
R
б) образование иминов:
O
R C
H
+ H2N CH COOH
R
R CH= HN
CH COOH
- H 2O
имин
R
44.
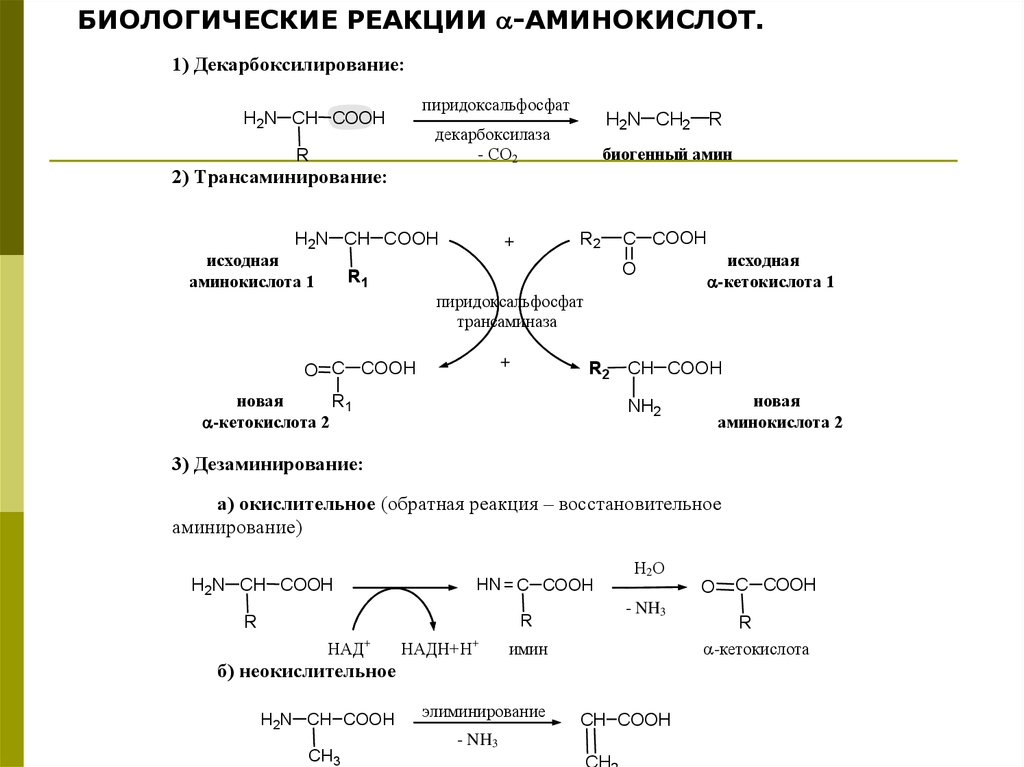
БИОЛОГИЧЕСКИЕ РЕАКЦИИ -АМИНОКИСЛОТ.1) Декарбоксилирование:
пиридоксальфосфат
H2N CH COOH
H2N CH2 R
декарбоксилаза
- СО2
R
биогенный амин
2) Трансаминирование:
H2N CH COOH
исходная
аминокислота 1
R2
+
C COOH
O
R1
исходная
-кетокислота 1
пиридоксальфосфат
трансаминаза
+
O C COOH
R2 CH COOH
новая
R1
-кетокислота 2
новая
аминокислота 2
NH2
3) Дезаминирование:
а) окислительное (обратная реакция – восстановительное
аминирование)
HN = C COOH
H2N CH COOH
НАД
+
+
НАДН+Н
O
- NH3
R
R
Н2 О
имин
б) неокислительное
H2N CH COOH
CH3
элиминирование
CH COOH
- NH3
CH
C COOH
R
-кетокислота
45.
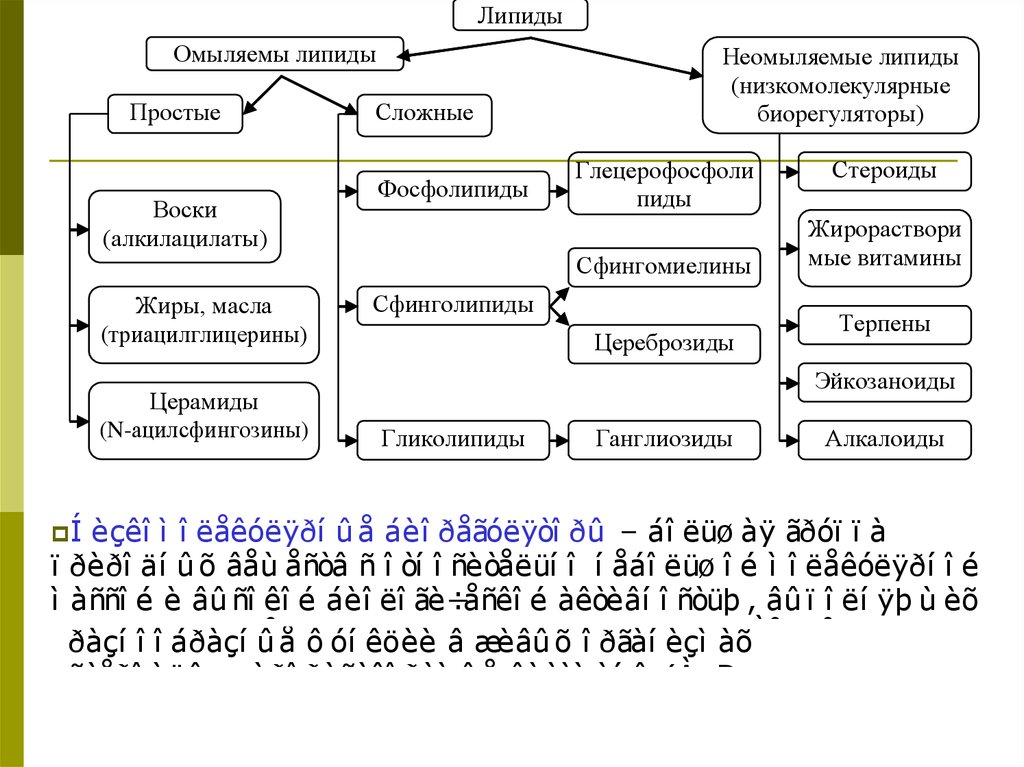
46. ЛИПИДЫ
(отгреч. Lipos -жир)
Класс органических соединений, содержащихся в живых
организмах. Не растворимы в воде и объединены
способностью растворяться в неполярных органических
растворителях.
Классификация.
В
зависимости от способности к гидролизу разделяют
на омыляемые и неомыляемые (в щелочной или кислой
среде не гидролизуются ), а в зависимости от
компонентного состава – на 2- большие группы:
простые и сложные.
47.
ЛипидыОмыляемы липиды
Простые
Воски
(алкилацилаты)
Сложные
Фосфолипиды
Неомыляемые липиды
(низкомолекулярные
биорегуляторы)
Глецерофосфоли
пиды
Сфингомиелины
Жиры, масла
(триацилглицерины)
Церамиды
(N-ацилсфингозины)
Í Íèçêî
èçêîì
Сфинголипиды
Цереброзиды
Стероиды
Жирораствори
мые витамины
Терпены
Эйкозаноиды
Гликолипиды
Ганглиозиды
Алкалоиды
ìî îëåêóëÿðí
ëåêóëÿðíûûååáèî
áèîðåãóëÿòî
ðåãóëÿòîðû
ðû––áîáîëüø
ëüøàÿ
àÿãðóï
ãðóïï ïàà
ï ïðèðî
ðèðîäíäíûûõõâåù
âåùåñòâ
åñòâññî òí
î òíî îñèòåëüí
ñèòåëüíî î í íåáî
åáîëüø
ëüøî é
î éì ìî ëåêóëÿðí
î ëåêóëÿðíî îéé
ì ìàññî
åñêî
àññîééèèâû
âûñîñîêîêîééáèî
áèîëîëîãè÷
ãè÷
åñêîééàêòèâí
àêòèâíî îñòüþ
ñòüþ, ,âû
âûï ïî ëí
î ëíÿþ
ÿþùùèõ
èõ
ðàçí
ðàçíî îî îáðàçí
áðàçíûûååôôóíóíêöèè
êöèèââæèâû
æèâûõõî îðãàí
ðãàíèçì
èçìàõ:Òåðï
àõ:Òåðïåíåíî îèäû
èäû, ,
ñòåðî
ñòåðîèäû
èäû, ,æèðî
æèðîðàñòâî
ðàñòâîðèì
ðèìûûååâèòàì
âèòàìèíèíûû(À,
(À,D,
D,E),
E),ôôëàâî
ëàâîí íî îèäû
èäû, ,
àíàíòèáèî
òèáèîòèêè,
òèêè,àëêàëî
àëêàëîèäû
èäû. .
48.
Основные структурные компонентыПри всем разнообразии строения для большинства липидов
характерно наличие в их составе двух обязательных
компонентов –высших жирных кислот и спиртов
Природные ВЖК характеризуются следующими признаками:
являются монокарбоновыми (см. общую формулу).
Содержат
четное число атомов углерода (наиболее
распространены, включающей 16, 18,20 или 22 атомов
углерода), хотя и редко, встречаются кислоты с нечетным
числом углеродных атомов;
Муравьиная,
уксусная, пропановая кислоты– в липидах
практически не встречаются.
49.
имеют неразветвленный углеводородный радикал.насыщенные ЖК имеют наиболее выгодную
зигзагообразную конформацию углеродной цепи, а
ненасыщенные ЖК содержат чаще всего от 1
(моноеновые) до 6 двойных (полиеновые) связей,
которые все имеют цис-конфигурацию (хотя это обычно
менее выгодно, чем транс-расположение).
Однако
в данном случае цис-форма приводит к
возможности формирования нужной вторичной
структуры в липидной части клеточных мембран;
райне редко в полиеновых кислотах встречается транс
–конфигурация.
50.
Двойные связи в полиненасыщенныхкислотах не сопряжены, а разделены двумя
-связями (метиленовой группой ÑÍ ),
2
отсюда и их название –
метиленразделенные кислоты. Два атома
водорода находятся по одну и ту же
сторону плоскости ñâÿçè .
Цис- конфигурация двойной связи придает
углеводородной цепи укороченный вид за
счет ее изгиба.
51.
Способ 1. В систематических названиях, основанных на заместительнойноменклатуре ИЮПАК, отражены длина цепи, положение и конфигурация кратных
связей, наличие и положение заместителей. Например, систематическое название
линоленовой кислоты (тривиальное) –(цис–) октадекатриен -9,12,15– овая кислота –
показывает, что в основе лежит кислота, имеющая 18 атомов углерода (октадекановая),
которая содержит 3 двойные связи (триен), расположенные после атомов
Ñ 9, Ñ 12, Ñ 15 или сокращенно С18:3 9,12,15.
Полярная
часть
молекулы
Неполярный углеводородный радикал
Способ 2 (в сокращенном виде). По этому способу линоленовая кислота
обозначается как 18 : 3 9,12,15 , где - (дельта) – это наличие двойной связи.
52.
Способ 3. Собственная (альтернативная) системаноменклатуры ВЖК (более современная).
По предлагаемому способу концевой атом углерода,
независимо от длины цепи, обозначается последней
буквой греческого алфавита ώ (омега или n).
Отсчет положения двойных связей производится не как
обычно от карбоксильной группы, а от метильной
группы.
Так, линоленовая кислота обозначается как 18:3 ώ -3,
где ώ –положение первой ненасыщенной связи по
отношению к ώ-углеродному атому.
линоленовая кислота 18 : 3
3 ( 3 кислота)
53.
??
?
В целом ненасыщенные жирные кислоты
по «начальному» положению двойной
связи подразделяют на следующие
типы:
9 (омега 9) – тип олеиновой кислоты
6 (омега 6) – тип линолевой кислоты
3 (омега 3) – тип линоленовой кислоты.
Из насыщенных кислот в липидах человеческого организма наиболее важны
пальмитиновая С16 (Ñ15 H 31COOH ) и стеариновая С18 (Ñ17 H 35COOH ) , а из
ненасыщенных — олеиновая С18:1 (Ñ17 H33COOH ) , линолевая С18::2 (Ñ17 H 31COOH ) ,
линоленовая С18:3 (Ñ17 H 29COOH ) и арахидоновая С20:4 (см. табл.).
В организме мононенасыщенные (в основном это
олеиновая и пальмитолеиновая) кислоты могут
образоваться из насыщенных жирных кислот путем
реакции дегидрирования (см табл.).
54.
Таблица . Основные ненасыщенные высшие жирныекислоты липидов
55.
Следует подчеркнуть роль полиненасыщенных линолевой илиноленовой кислот как соединений, незаменимых для
человека («витамин F»).
В организме они не синтезируются и должны поступать с
пищей в количестве около 5 г в день.
В природе эти кислоты содержатся в основном в растительных
маслах.
Они способствуют снижению содержания в крови холестирина
– одного из факторов развития атеросклероза.
Таблица ___. Важнейшие представители ώ -9, ώ -6 и ώ -3 кислот
Тип кислоты
Омега 9( 9)
Омега 6( 6)
Омега 3( 3)
Основные представители
Олеиновая
Линолевая
-Линеленовая
- Линоленовая
Эйкозапентаеновая
Докозагексаеновая
Основные источники
Масло оливковое
Масло подсолнечное, кукурузное, соевое
Масло огуречника, черной смородины, энотеры*
Льняное масло, масло периллы*
Рыбий жир
56.
Наряду с широко известными традиционными маслами,такими как оливковое, подсолнечное, льняное, перечень
природных источников полиеновых кислот значительно
расширяется за счет вовлечения новых видов масел,
например масло семян вечерней примулы (энотеры), масло
огуречника лекарственного, масло из семян периллы и др.
Полиеновые кислоты метаболически родственны.
В организме они могут образовываться с помощью реакций
дегидрирования и удлинения цепи. Так, арахидоновая кислота может
быть
синтезирована
в
организме
из
линолевой
кислоты,
эйкозапентаеновая — из линоленовой кислоты.
Пути превращения в организме линолевой
кислоты в арахидоновую
57.
СПИРТЫ.В состав липидов могут входить.
1) высшие одноатомные (С16 и более (например,
цетиловый спирт)- см. табл.;
2) полиолы (глицерин).Полиолы. Более половины
природных липидов принадлежит к глицеролипидам, т.
е. к производным трехатомного спирта — глицерина.
В составе нейтральных и фосфорсодержащих липидов
встречаются также и другие полиолы — этиленгликоль,
пропандиолы, изомерные бутандиолы.
3) двухатомный аминоспирт сфингозин (ненасыщенный
длинноцепочечный двухатомный аминоспирт)
Двойная связь в сфингозине имеет транс-конфигурацию, а
асимметрические атомы С-2 и С-3 — D-конфигурацию
58. Таблица. Основные высшие спирты липидов
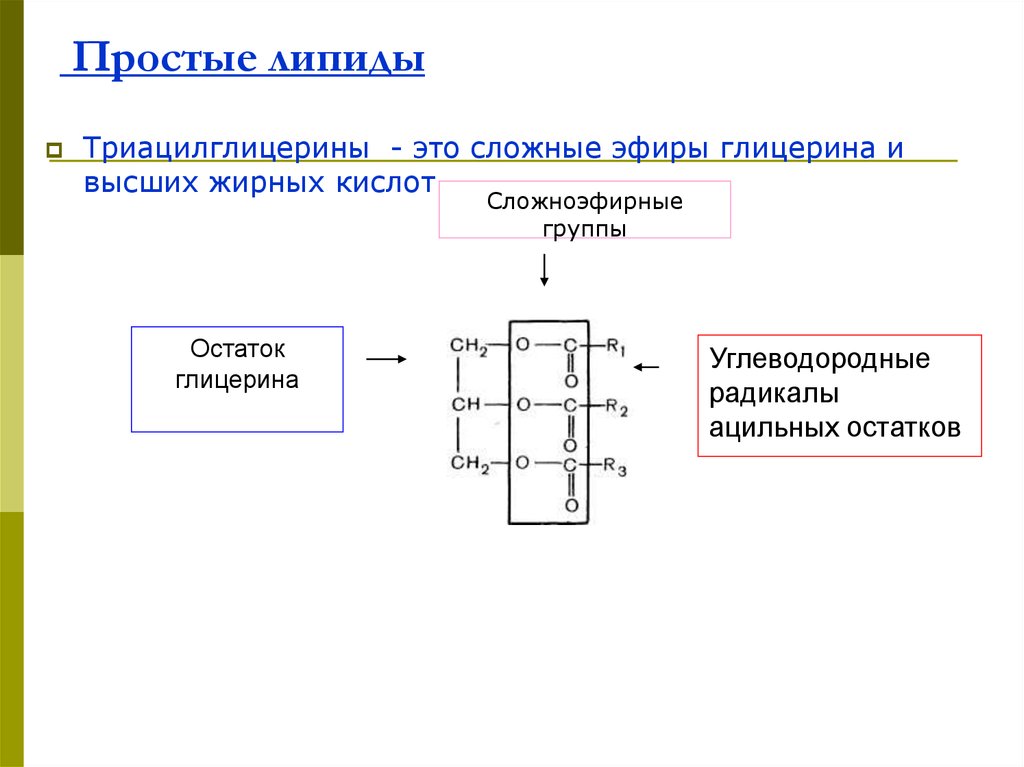
59. Простые липиды
Триацилглицерины - это сложные эфиры глицерина ивысших жирных кислот
Сложноэфирные
группы
Остаток
глицерина
Углеводородные
радикалы
ацильных остатков
60.
Номенклатура.По заместительной номенклатуре ИЮПАК
триацилглицерины называют как производные
глицерина, в которых атомы водорода ОН- групп
замещены ацильными остатками (RCO) высших жирных
кислот.
Названия этих остатков производят обычным способом с
использованием суффикса -оил и перечисляют в
алфавитном порядке с указанием их положения
три-О-стеароилглицерин
1-0-пальмитоил-ди-Остеароилглицерин
1 -О-олеоил-2-О-пальмитоил3 -О-стеароил глицерин
61.
В природе в основном встречаются только полные эфирыглицерина, т. е. триацилглицерины.
Природные триацилглицерины условно делятся на жиры
и масла в зависимости от консистенции (при температуре
20 °С). Консистенция триацилглицеринов зависит от их
состава.
•Триацилглицерины с преобладанием в составе остатков
насыщенных высших жирных кислот имеют твердую
консистенцию и называются жирами.
•Триацилглицерины с преобладанием в составе остатков
ненасыщенных высших жирных кислот имеют жидкую
консистенцию и называются маслами
• Триацилглицерины животного происхождения имеют
твердую консистенцию, за редким исключением — жидкую
(рыбий жир).
• Растительные триацилглицерины обычно жидкие, хотя
некоторые масла имеют твердую (масло какао, пальмовое
масло и др.) или густую (чаульмугровое масло)
консистенцию.
62.
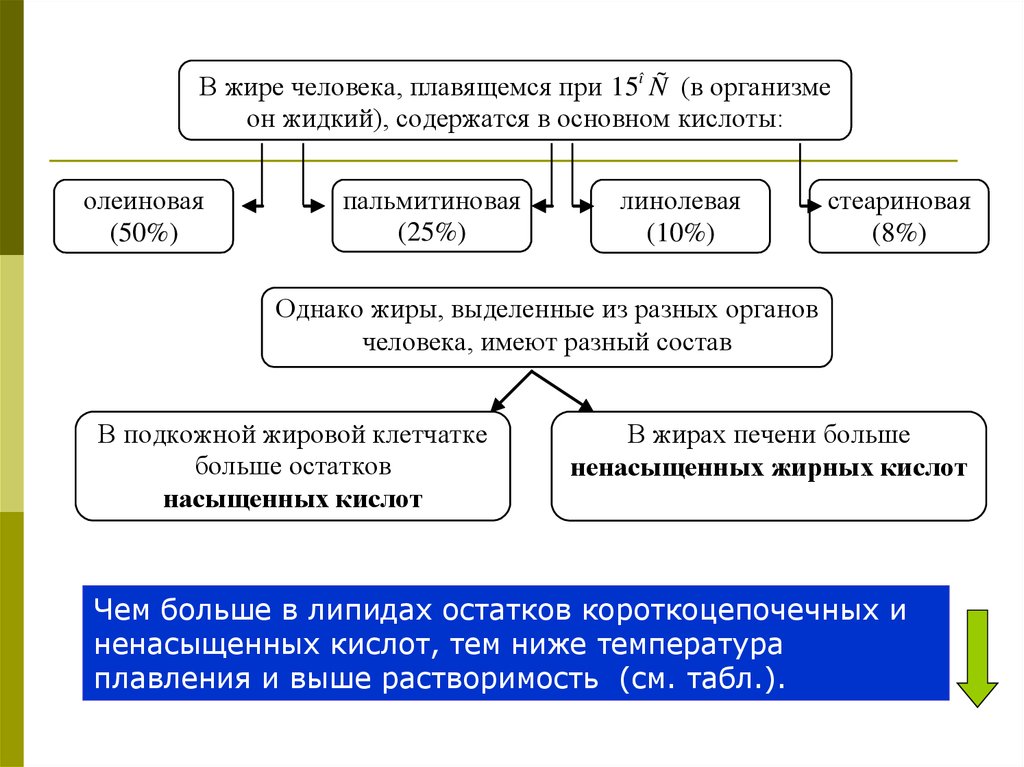
В жире человека, плавящемся при 15î Ñ (в организмеон жидкий), содержатся в основном кислоты:
олеиновая
(50%)
пальмитиновая
(25%)
линолевая
(10%)
стеариновая
(8%)
Однако жиры, выделенные из разных органов
человека, имеют разный состав
В подкожной жировой клетчатке
больше остатков
насыщенных кислот
В жирах печени больше
ненасыщенных жирных кислот
Чем больше в липидах остатков короткоцепочечных и
ненасыщенных кислот, тем ниже температура
плавления и выше растворимость (см. табл.).
63.
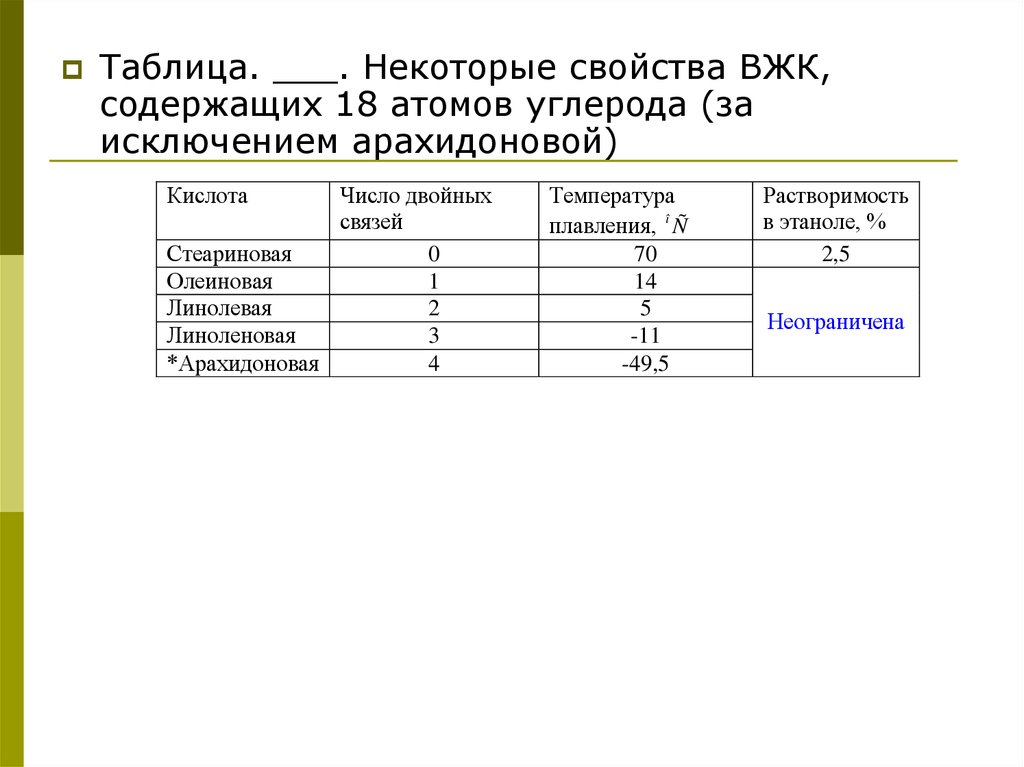
Таблица. ___. Некоторые свойства ВЖК,содержащих 18 атомов углерода (за
исключением арахидоновой)
Кислота
Число двойных
связей
Стеариновая
0
Олеиновая
1
Линолевая
2
Линоленовая
3
*Арахидоновая
4
Температура
плавления, î Ñ
70
14
5
-11
-49,5
Растворимость
в этаноле, %
2,5
Неограничена
64.
Свойства липидовТриацилглицерины, содержащие остатки насыщенных
кислот, являются достаточно инертными веществами,
способными лишь к небольшому числу превращений,
характерных вообще для сложных эфиров — гидролизу
(в организме гидролиз осуществляется поэтапно под
действием фермента -липаз), переэтерификации (замена
одного спиртового или кислотного остатка в молекуле
сложного эфира на другой).
Триацилглицерины, содержащие ненасыщенные
кислоты, способны, кроме того, вступать еще и в
реакции, характерные для двойных связей —
присоединения и окисления (см. тему «Пероксидное
окисление липидов»).
65.
Кислотное число — это масса гидроксида калия (мг),необходимая для нейтрализации свободных жирных кислот,
содержащихся в 1 г жира.
Число омыления — это масса гидроксида калия (мг),
необходимая для гидролиза нейтральных липидов (омыления)
и нейтрализации всех жирных кислот (в том числе
свободных), содержащихся в 1 г жира.
Йодное число (галогенирование) — это масса иода (г),
связываемая 100 г жира.
• Поскольку связывание иода происходит по месту двойных
связей ненасыщенных кислот, йодное число характеризует
степень ненасыщенности данного жира.
• По значению теоретического йодного числа выше 70
можно отнести к маслам.
66.
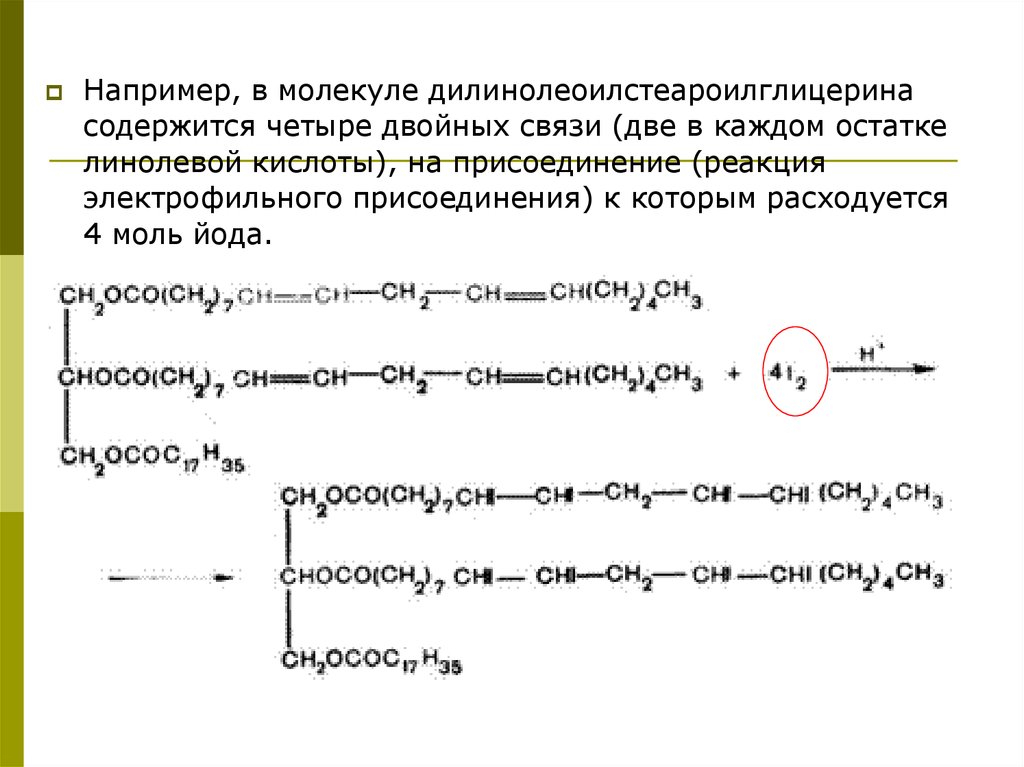
Например, в молекуле дилинолеоилстеароилглицеринасодержится четыре двойных связи (две в каждом остатке
линолевой кислоты), на присоединение (реакция
электрофильного присоединения) к которым расходуется
4 моль йода.
67.
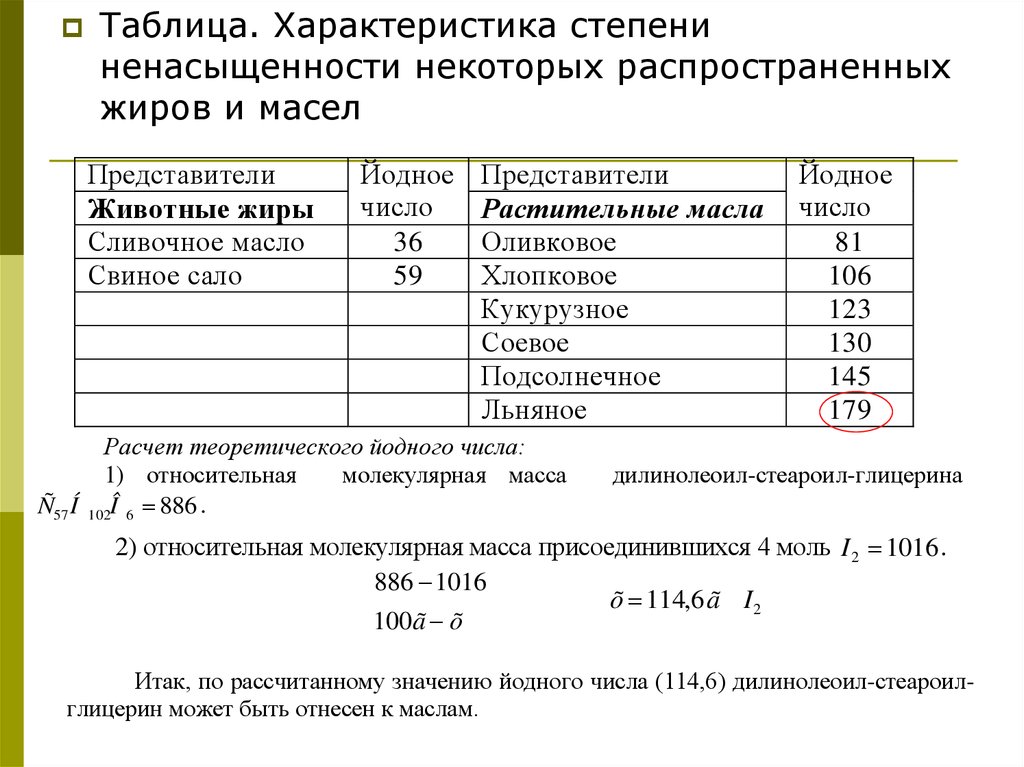
Таблица. Характеристика степениненасыщенности некоторых распространенных
жиров и масел
Представители
Животные жиры
Сливочное масло
Свиное сало
Йодное
число
36
59
Представители
Растительные масла
Оливковое
Хлопковое
Кукурузное
Соевое
Подсолнечное
Льняное
Расчет теоретического йодного числа:
1) относительная
молекулярная масса
Ñ57 Í 102Î 6 886 .
Йодное
число
81
106
123
130
145
179
дилинолеоил-стеароил-глицерина
2) относительная молекулярная масса присоединившихся 4 моль I 2 1016 .
886 1016
õ 114,6 ã I 2
100ã õ
Итак, по рассчитанному значению йодного числа (114,6) дилинолеоил-стеароилглицерин может быть отнесен к маслам.
68.
Масла, содержащие значительное количествоостатков полиеновых кислот, при достаточно
длительном контакте с воздухом «высыхают»
(т.е. происходит окислительная
полимеризация).
Результат процесса высыхания выражается в
том, что тонкие слои масел при контакте с
воздухом через некоторое время
превращаются в упругие пленки.
Для высыхающих масел характерны
более высокие значения йодных чисел.
69.
Амфильные свойства сложных липидовВ отличие от нейтральных липидов (триацилглицеролов)
молекулы всех сложных липидов, с одной стороны,
имеют длинные углеводородные остатки, отличающиеся
низким сродством к воде, т. е. гидрофобные радикалы, а
с другой — более компактные гидрофильные области,
получившие название полярных головок.
Подобные молекулы называются амфифильными
(амфипатическими), т. е. обладающими двойным
сродством к воде.
Наличие гидрофильных радикалов позволяет отнести эти
группы липидов к полярным липидам. Именно они
являются главными компонентами всех биологических
мембран, поэтому их принято называть мембранными
липидами.
Все мембраны имеют общий план строения, но
различаются в деталях химического состава и структуры
(см. табл.).
70.
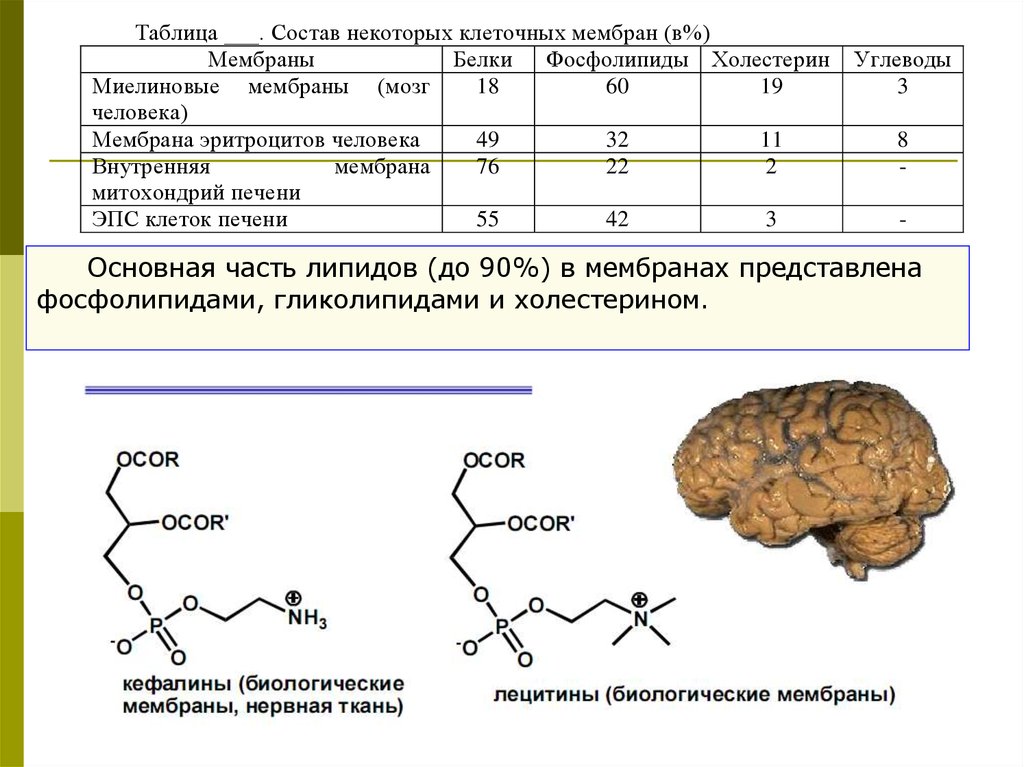
Таблица ___. Состав некоторых клеточных мембран (в%)Мембраны
Белки Фосфолипиды Холестерин
Миелиновые мембраны (мозг
18
60
19
человека)
Мембрана эритроцитов человека
49
32
11
Внутренняя
мембрана
76
22
2
митохондрий печени
ЭПС клеток печени
55
42
3
Углеводы
3
8
-
Основная часть липидов (до 90%) в мембранах представлена
фосфолипидами, гликолипидами и холестерином.
71.
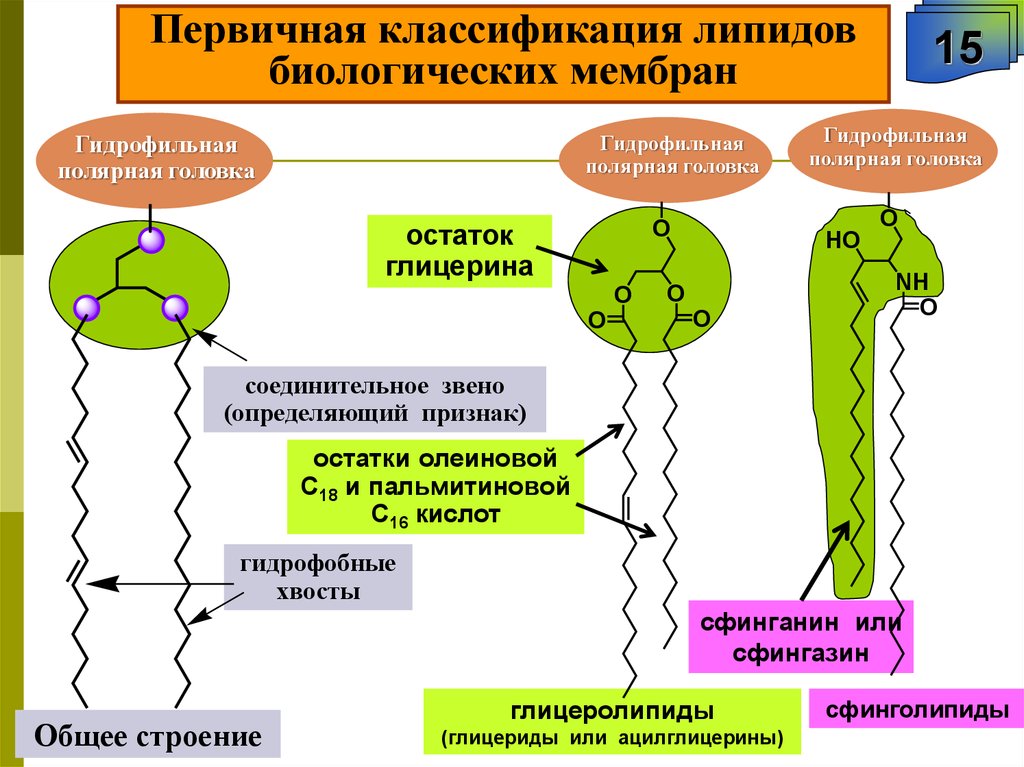
Первичная классификация липидовбиологических мембран
Гидрофильная
полярная головка
Гидрофильная
полярная головка
остаток
глицерина
O
Гидрофильная
полярная головка
O
O
O
15
HO
O
O
NH
O
соединительное звено
(определяющий признак)
остатки олеиновой
С18 и пальмитиновой
С16 кислот
гидрофобные
хвосты
сфинганин или
сфингазин
Общее строение
глицеролипиды
(глицериды или ацилглицерины)
сфинголипиды
72.
Фосфолипиды – главные компонентыбиологических мембран
L-ряд
гидрофильная
полярная головка
O P O
O
липиды
O
O
OH
X
16
*
O
O
глицерофосфолипиды
(сложный эфир фосфорной кислоты и диглицерида)
R1
R2
Х = Н, холин, этаноламин, серин, инозин и др.
Х = Н - фосфатидовая кислота
(1-5% от общего количества фосфолипидов; найдена
в тканях животных, растений и микроорганизмов;
предшественник всех других глицерофосфолипидов)
73.
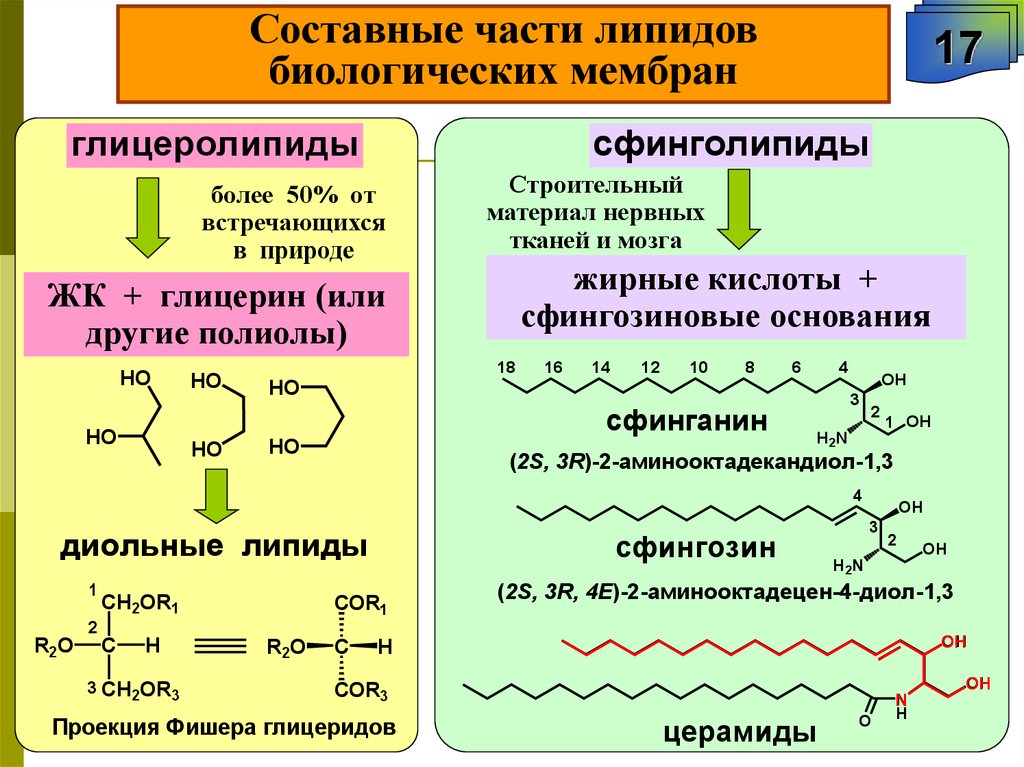
Составные части липидовбиологических мембран
сфинголипиды
глицеролипиды
более 50% от
встречающихся
в природе
Строительный
материал нервных
тканей и мозга
жирные кислоты +
сфингозиновые основания
ЖК + глицерин (или
другие полиолы)
HO
HO
18
16
14
12
10
8
HO
6
4
HO
сфинганин
HO
17
HO
OH
3
2
1 OH
H2N
(2S, 3R)-2-аминооктадекандиол-1,3
4
диольные липиды
1
CH2OR1
сфингозин
COR1
OH
3
2
(2S, 3R, 4Е)-2-аминооктадецен-4-диол-1,3
2
R2O
C
H
3 CH2OR3
R 2O
C
OH
H
COR3
Проекция Фишера глицеридов
OH
H2 N
церамиды
O
N
H
OH
74.
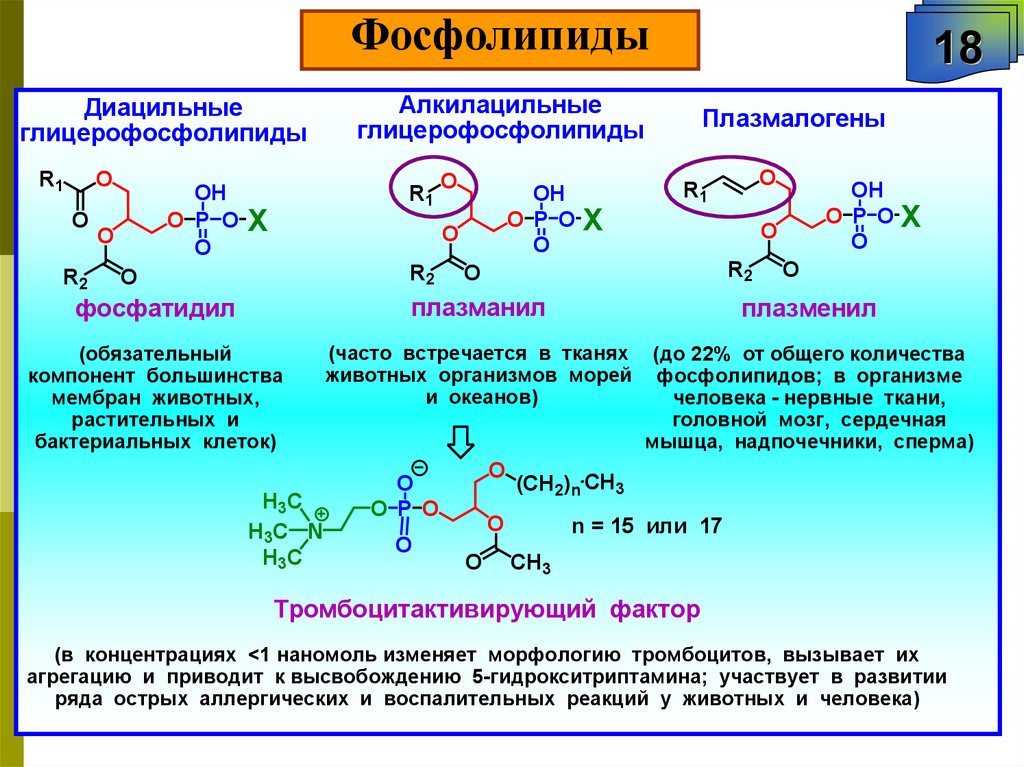
ФосфолипидыДиацильные
глицерофосфолипиды
R1
O
O
R2
OH
O P O
O
O
Алкилацильные
глицерофосфолипиды
R1
X
O
OH
O P O
O
O
R2
O
18
Плазмалогены
O
R1
X
OH
O P O
O
O
R2
O
X
O
фосфатидил
плазманил
плазменил
(обязательный
компонент большинства
мембран животных,
растительных и
бактериальных клеток)
(часто встречается в тканях
животных организмов морей
и океанов)
(до 22% от общего количества
фосфолипидов; в организме
человека - нервные ткани,
головной мозг, сердечная
мышца, надпочечники, сперма)
H3 C
H3 C N
H3 C
O
O
O P O
O
(CH2)n CH3
n = 15 или 17
O
O
CH3
Тромбоцитактивирующий фактор
(в концентрациях <1 наномоль изменяет морфологию тромбоцитов, вызывает их
агрегацию и приводит к высвобождению 5-гидрокситриптамина; участвует в развитии
ряда острых аллергических и воспалительных реакций у животных и человека)
75.
ФосфолипидыH3C
H3C N
H3C
19
O
O
O P O
O
1
O
2
3
O
R1
R2
O
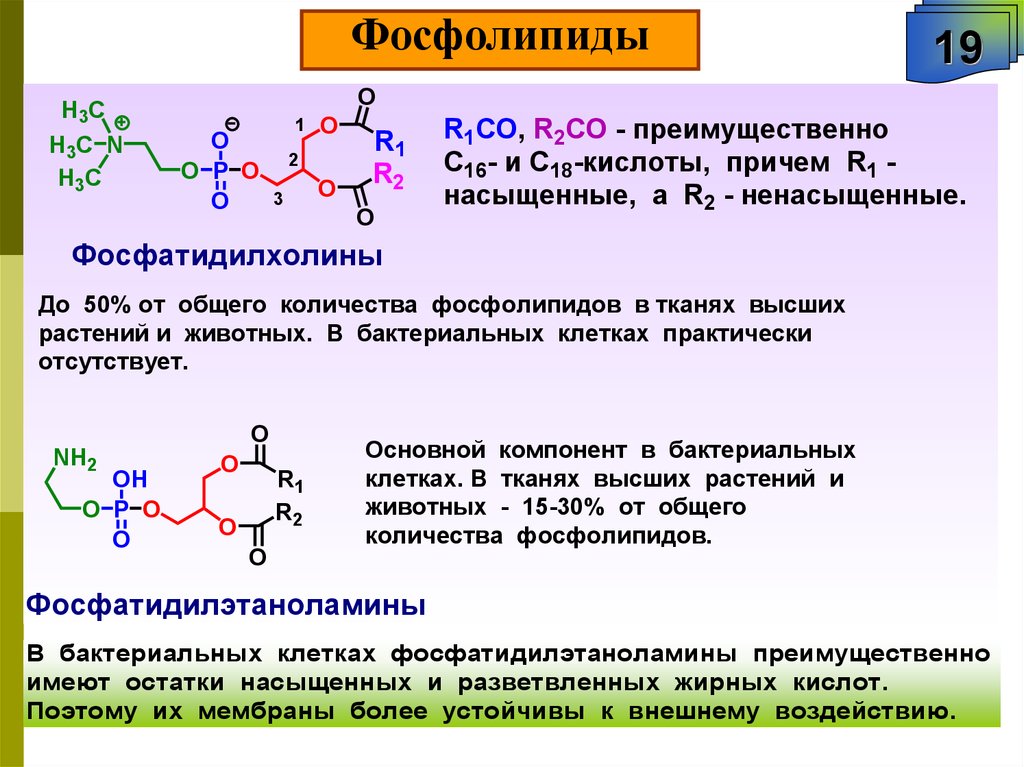
R1СО, R2СО - преимущественно
C16- и C18-кислоты, причем R1 насыщенные, а R2 - ненасыщенные.
Фосфатидилхолины
До 50% от общего количества фосфолипидов в тканях высших
растений и животных. В бактериальных клетках практически
отсутствует.
O
NH2
OH
O P O
O
O
R1
R2
O
O
Основной компонент в бактериальных
клетках. В тканях высших растений и
животных - 15-30% от общего
количества фосфолипидов.
Фосфатидилэтаноламины
В бактериальных клетках фосфатидилэтаноламины преимущественно
имеют остатки насыщенных и разветвленных жирных кислот.
Поэтому их мембраны более устойчивы к внешнему воздействию.
76.
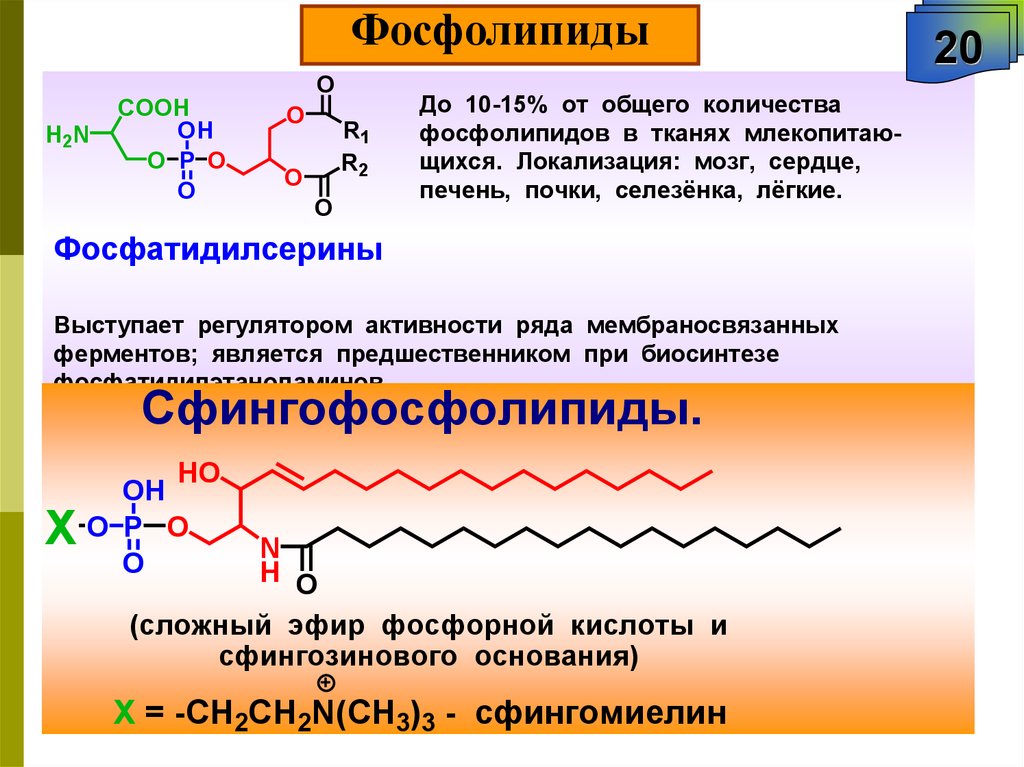
ФосфолипидыO
H2N
COOH
OH
O P O
O
O
R1
R2
O
O
До 10-15% от общего количества
фосфолипидов в тканях млекопитающихся. Локализация: мозг, сердце,
печень, почки, селезёнка, лёгкие.
Фосфатидилсерины
Выступает регулятором активности ряда мембраносвязанных
ферментов; является предшественником при биосинтезе
фосфатидилэтаноламинов.
Сфингофосфолипиды.
HO
X
OH
O P O
O
N
H O
(сложный эфир фосфорной кислоты и
сфингозинового основания)
Х = -CH2CH2N(CH3)3 - сфингомиелин
20
77.
ФосфолипидыГликолипиды.
O
OH
гидрофильная
полярная головка
O
O
HO
HO
O
O
OH
гликоглицеролипиды
липиды
OH
R1
R2
O
O
HO
HO
HO
O
OH
N
HO
гликосфинголипиды
HO
Gly O
цереброзиды
N
HO
NHCOCH3
HO
HO
HOOC
O
HO
OH
OH
Сиаловая кислота
(N-ацетилнейраминовая кислоты),
входит в состав ганглиозидов
21
78.
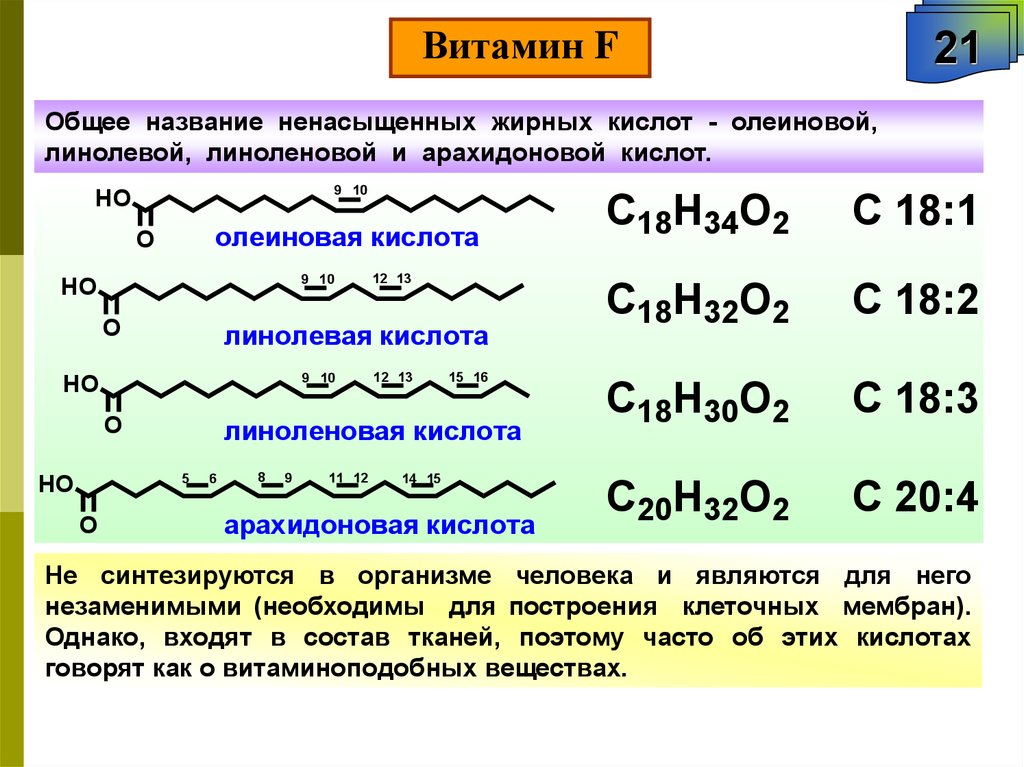
Витамин F21
Общее название ненасыщенных жирных кислот - олеиновой,
линолевой, линоленовой и арахидоновой кислот.
9 10
HO
олеиновая кислота
O
9 10
HO
O
линолевая кислота
9 10
HO
5
O
12 13
15 16
линоленовая кислота
O
HO
12 13
6
8
9
11 12
14 15
арахидоновая кислота
C18H34O2
C 18:1
C18H32O2
C 18:2
C18H30O2
C 18:3
C20H32O2
C 20:4
Не синтезируются в организме человека и являются для него
незаменимыми (необходимы для построения клеточных мембран).
Однако, входят в состав тканей, поэтому часто об этих кислотах
говорят как о витаминоподобных веществах.
79.
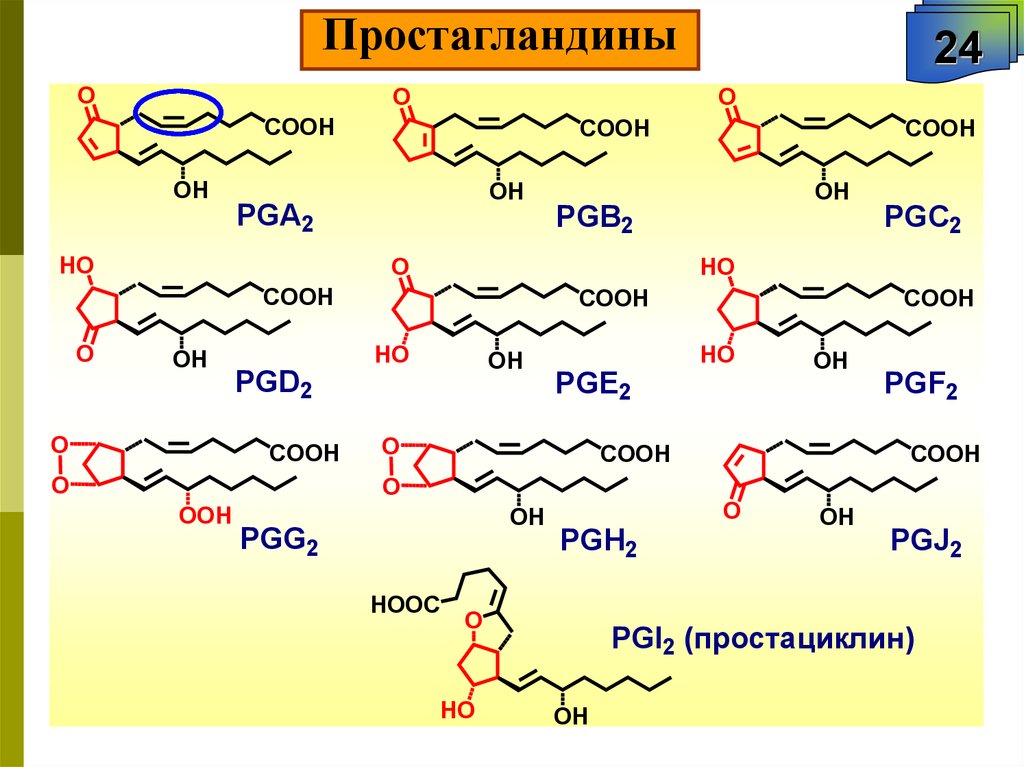
ПростагландиныO
O
O
COOH
COOH
OH
HO
OH
PGB2
O
O
COOH
HO
OH
PGD2
COOH
O
PGC2
HO
COOH
OH
COOH
OH
PGA2
O
24
COOH
HO
PGE2
O
OH
COOH
PGF2
COOH
O
OOH
OH
PGG2
HOOC
O
PGH2
O
HO
OH
PGJ2
PGI2 (простациклин)
OH
80.
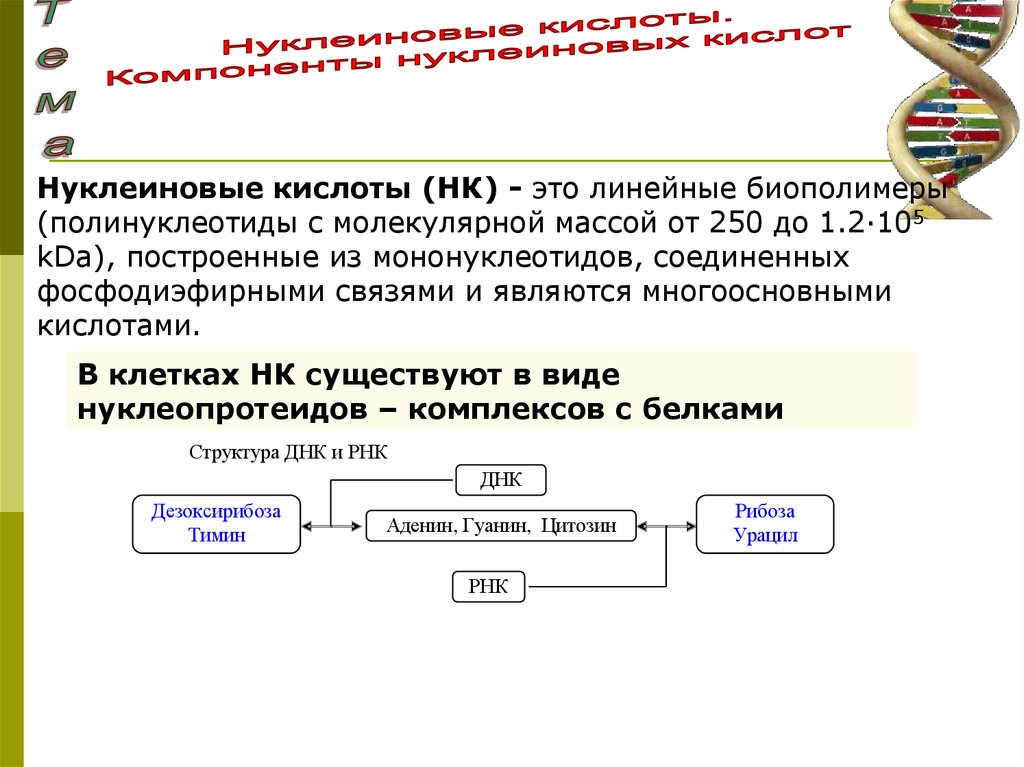
Нуклеиновые кислоты (НК) - это линейные биополимеры(полинуклеотиды с молекулярной массой от 250 до 1.2·105
kDa), построенные из мононуклеотидов, соединенных
фосфодиэфирными связями и являются многоосновными
кислотами.
В клетках НК существуют в виде
нуклеопротеидов – комплексов с белками
Структура ДНК и РНК
ДНК
Дезоксирибоза
Тимин
Аденин, Гуанин, Цитозин
РНК
Рибоза
Урацил
81.
•ДНК и РНК различаются поведением в условиях щелочногои кислотного гидролиза.
•ДНК устойчивы к гидролизу в щелочной среде.
•РНК легко гидролизуются в мягких условиях в щелочной
среде.
•Химический гидролиз ДНК почти не применяют из-за
осложнения его побочными процессами. Более
предпочтителен ферментативный гидролиз под действием
нуклеаз.
•Обычно для этой цели используют змеиный яд, в котором
содержатся ферменты, расщепляющие фосфодиэфирные
связи.
•Ферменты проявляют специфичность по отношению к
разным типам нуклеиновых кислот.
82.
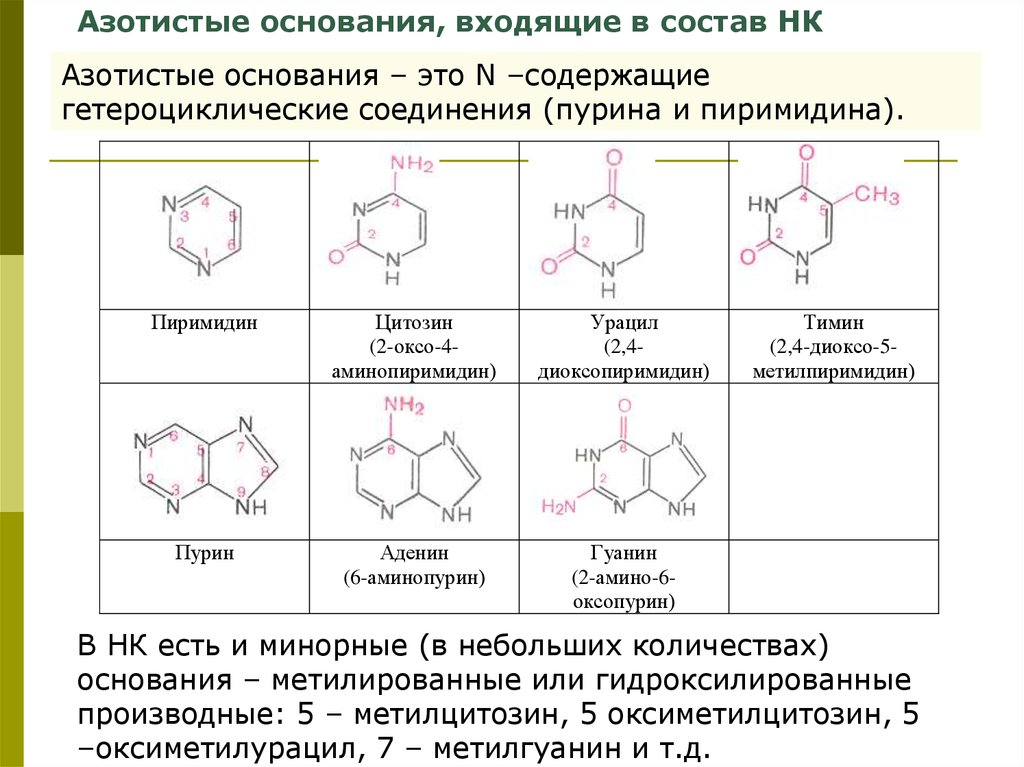
Азотистые основания, входящие в состав НКАзотистые основания – это N –содержащие
гетероциклические соединения (пурина и пиримидина).
Пиримидин
Цитозин
(2-оксо-4аминопиримидин)
Урацил
(2,4диоксопиримидин)
Пурин
Аденин
(6-аминопурин)
Гуанин
(2-амино-6оксопурин)
Тимин
(2,4-диоксо-5метилпиримидин)
В НК есть и минорные (в небольших количествах)
основания – метилированные или гидроксилированные
производные: 5 – метилцитозин, 5 оксиметилцитозин, 5
–оксиметилурацил, 7 – метилгуанин и т.д.
83.
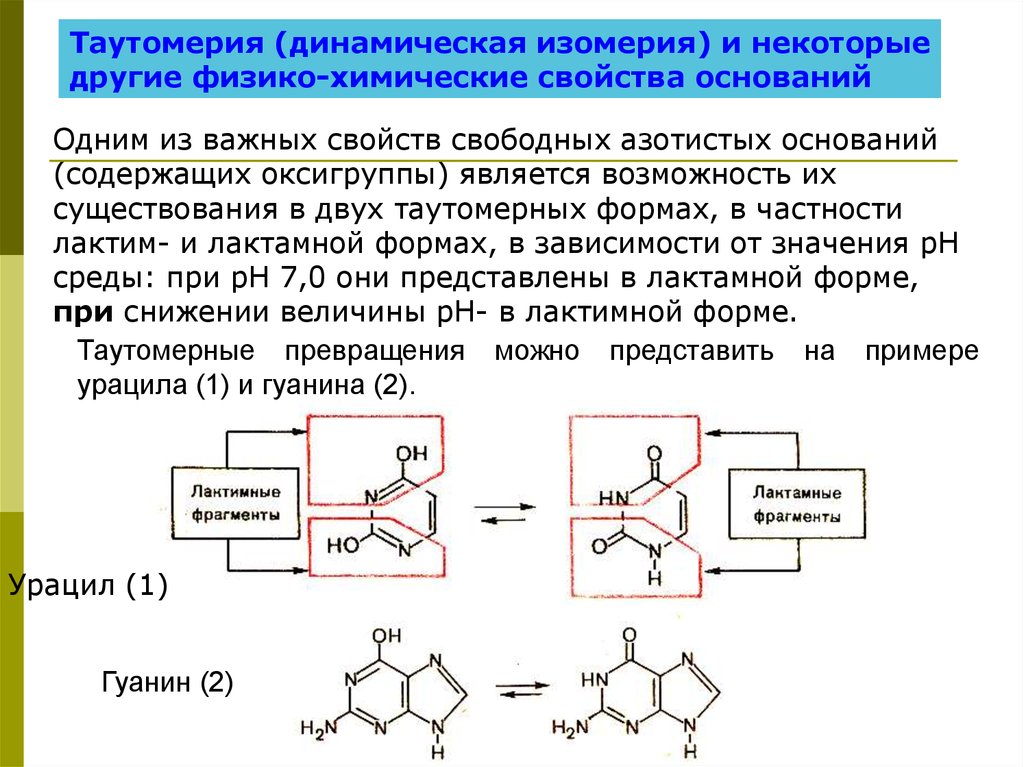
Таутомерия (динамическая изомерия) и некоторыедругие физико-химические свойства оснований
Одним из важных свойств свободных азотистых оснований
(содержащих оксигруппы) является возможность их
существования в двух таутомерных формах, в частности
лактим- и лактамной формах, в зависимости от значения рН
среды: при рН 7,0 они представлены в лактамной форме,
при снижении величины рН- в лактимной форме.
Таутомерные превращения можно представить на примере
урацила (1) и гуанина (2).
Урацил (1)
Гуанин (2)
84.
По данным ИК- и ЯМР-спектроскопии показано, что вНК пуриновые и пиримидиновые основания
преимущественно находятся в лактамной и аминной
формах; это обеспечивает правильность спаривания
нуклеотидов в ходе матричных синтезов НК.
Однако под влиянием внешних факторов, например
воздействия излучений, возможен переход оснований в
другие таутомерные формы, лежащий в основе
мутагенеза.
Азотистые основания поглощают свет в
ультрафиолетовой области спектра с максимумом около
260 нм. Поглощение в ультрафиолетовой области
используется для количественного определения НК.
85.
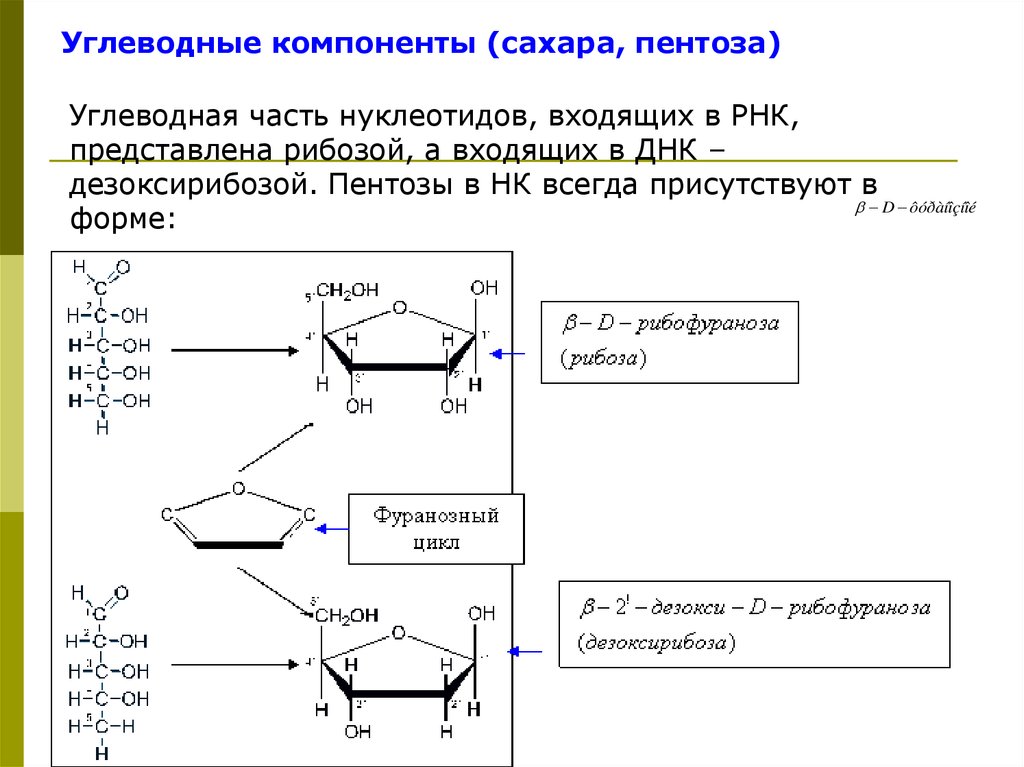
Углеводные компоненты (сахара, пентоза)Углеводная часть нуклеотидов, входящих в РНК,
представлена рибозой, а входящих в ДНК –
дезоксирибозой. Пентозы в НК всегда присутствуют в
D ôóðàíîçíîé
форме:
86.
Продукты превращения НКГипоксантин
Ксантин
Мочевая кислота
Лактам- лактимная таутомерия
Гипоксантин (6-гидроксипурин), ксантин (2,6-дигидроксипурин) и
мочевая кислота (2,6,8-тригидроксипурин) — продукты
превращения НК в организме.
Для них также возможна лактим-лактамная таутомерия, но в
кристаллическом виде они существуют преимущественно в
лактамной форме.
87.
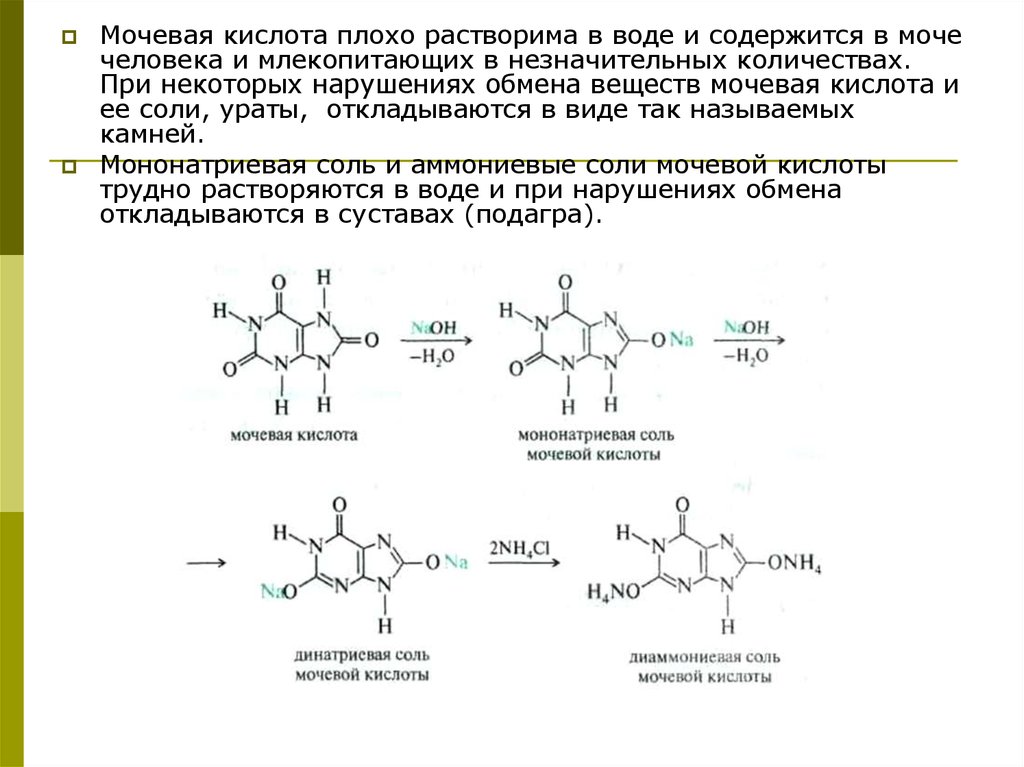
Мочевая кислота плохо растворима в воде и содержится в мочечеловека и млекопитающих в незначительных количествах.
При некоторых нарушениях обмена веществ мочевая кислота и
ее соли, ураты, откладываются в виде так называемых
камней.
Мононатриевая соль и аммониевые соли мочевой кислоты
трудно растворяются в воде и при нарушениях обмена
откладываются в суставах (подагра).
88.
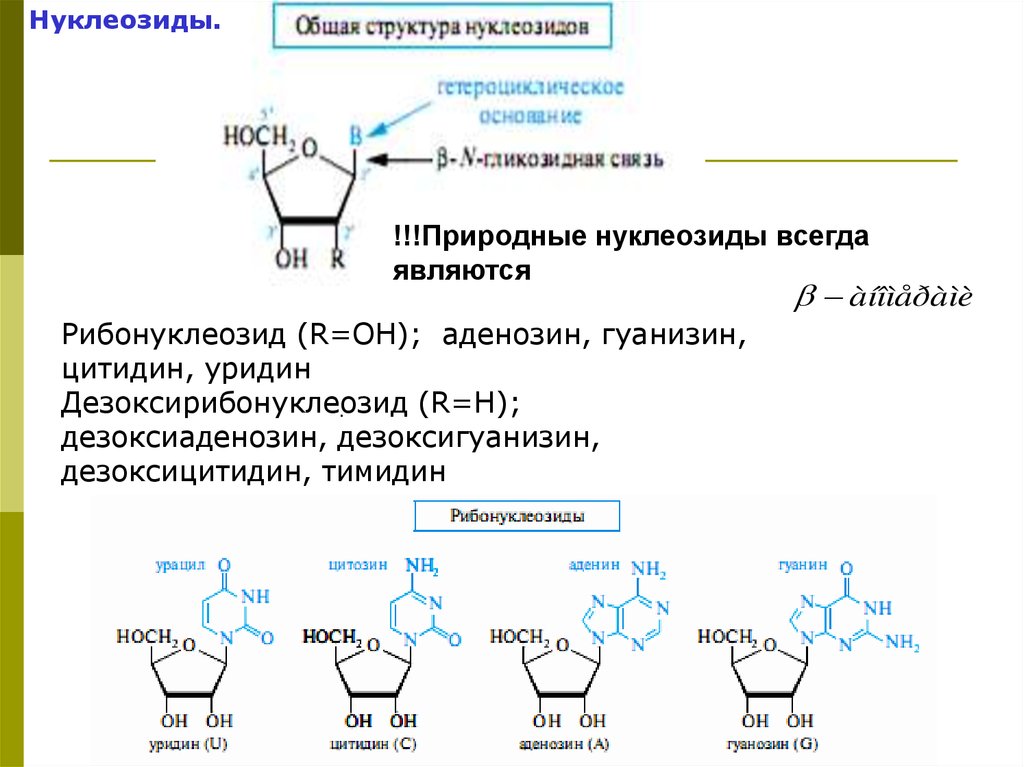
Нуклеозиды.!!!Природные нуклеозиды всегда
являются
àíîìåðàìè
Рибонуклеозид (R=OH); аденозин, гуанизин,
цитидин, уридин
Дезоксирибонуклеозид
(R=H);
.
дезоксиаденозин, дезоксигуанизин,
дезоксицитидин, тимидин
89.
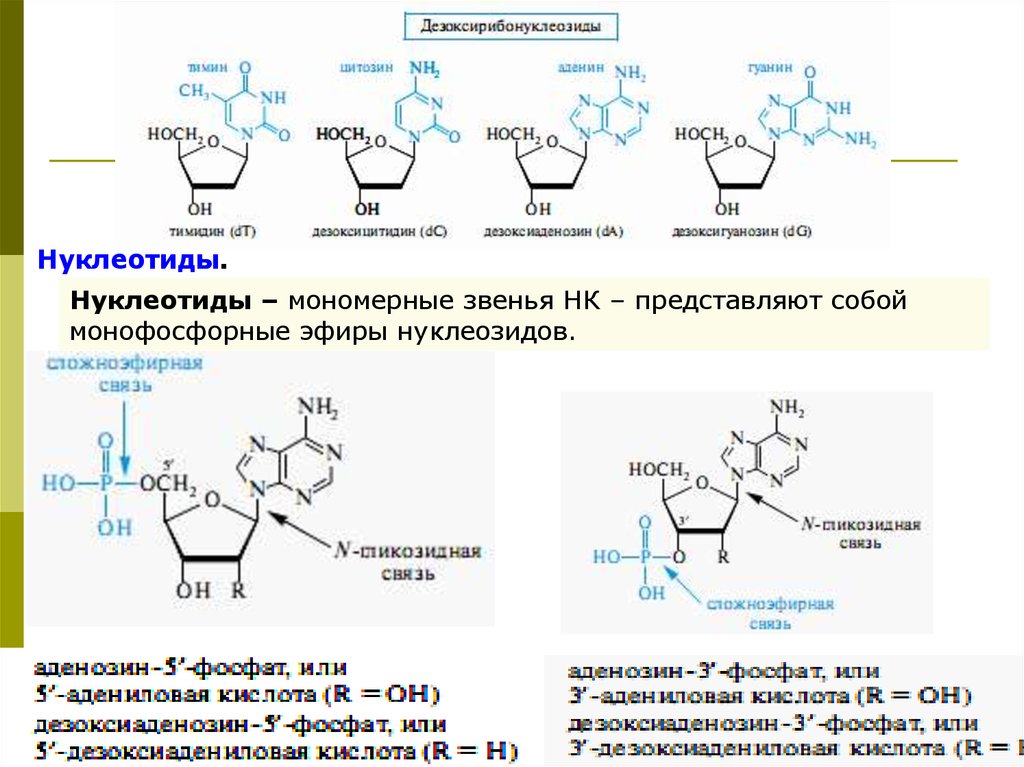
Нуклеотиды.Нуклеотиды – мономерные звенья НК – представляют собой
монофосфорные эфиры нуклеозидов.
90.
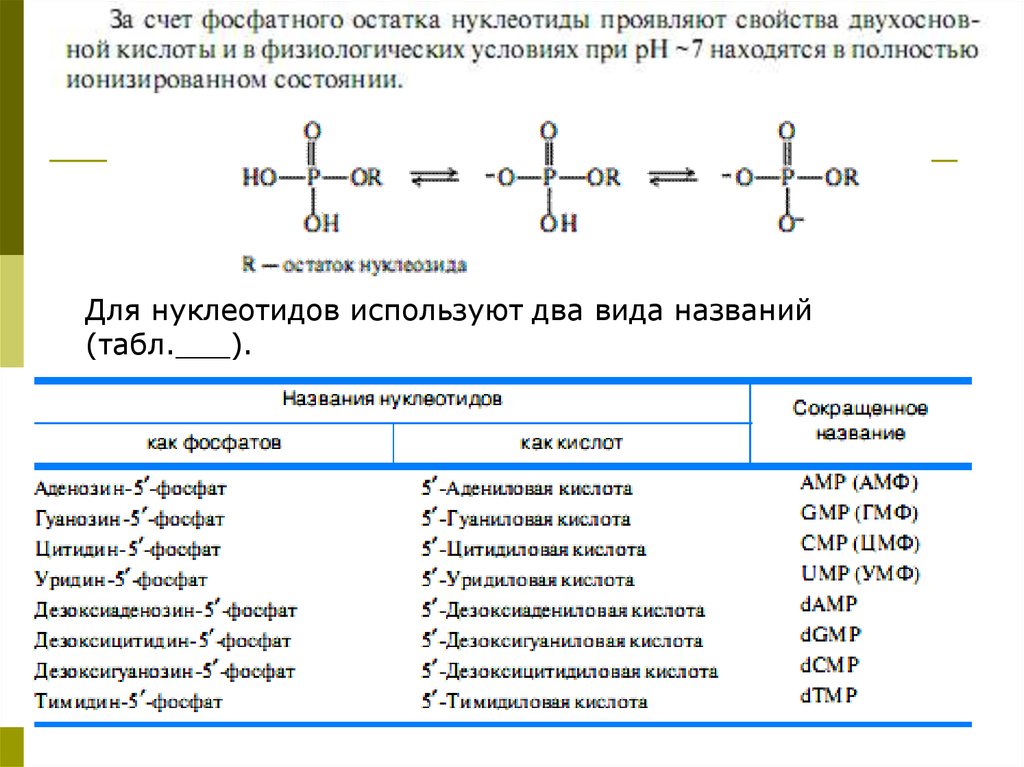
Для нуклеотидов используют два вида названий(табл.___).
91.
Эти два нуклеотида не входят в состав НК, но играют92.
Нуклеиновые кислоты93.
Первичная структура94.
95.
Вторичная структура96.
97.
98.
99.
Стерины.1
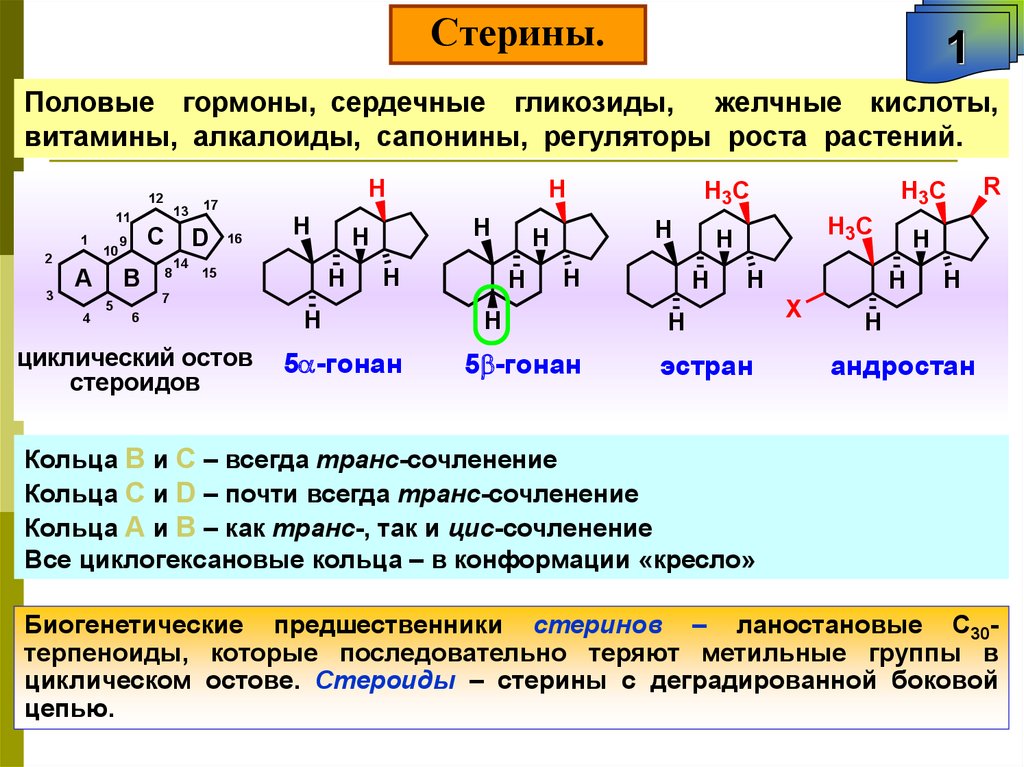
Половые гормоны, сердечные гликозиды, желчные кислоты,
витамины, алкалоиды, сапонины, регуляторы роста растений.
12
11
1
2
3
10
A
4
C
9
B
5
13
8
D
14
H
17
16
H
7
6
циклический остов
стероидов
H
H
H
15
H
H
H
5 -гонан
H
H
H
H3C
H
H
5 -гонан
H3C
H3C
H
H
H
H
эстран
H
H
X
R
H
H
андростан
Кольца В и С – всегда транс-сочленение
Кольца С и D – почти всегда транс-сочленение
Кольца А и В – как транс-, так и цис-сочленение
Все циклогексановые кольца – в конформации «кресло»
Биогенетические предшественники стеринов – ланостановые С30терпеноиды, которые последовательно теряют метильные группы в
циклическом остове. Стероиды – стерины с деградированной боковой
цепью.
100.
19H3C
3
X
R
H3C
H
H
17
H
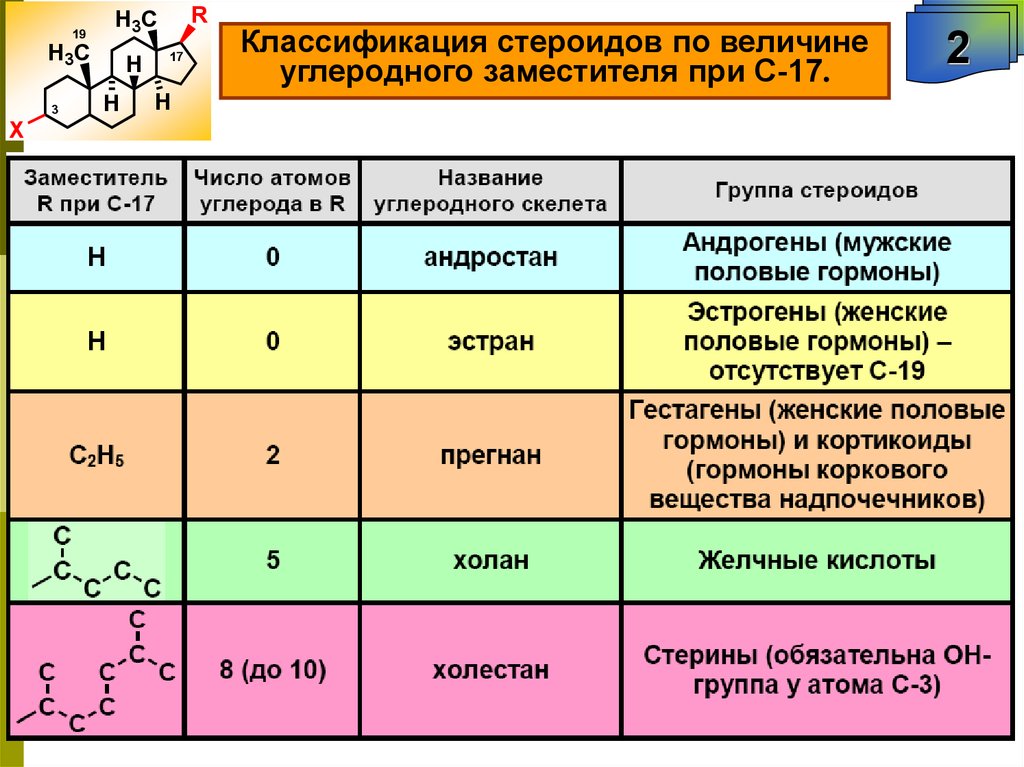
Классификация стероидов по величине
углеродного заместителя при С-17.
2
101.
Глюкокортикоиды и минералокортикоиды.12
Кортикоиды в фармацевтических препаратах
O
O
OH
HO
OH
H
O
O
O
HO
O
O
HO
OH
H
H
OH
H
F
H
O
CH3
метилпреднизолон
триамцинолон
OH
H
H
H
O
OH
OH
OH
H
O
преднизолон
гидрокортизон
OH
O
H
O
O
кортизон
OH
OH
H
H
H
H
O
HO
OH
H
H
H
OH
преднизон
OH
O
HO
H
F
H
OH
CH3
O
OH
O
HO
H
F
H
OH
CH3
O
дексаметазон
бетаметазон
Кортизон, преднизон – изначально неактивны, но в печени происходит их
активация (химическая модификация).
Фторированные кортикоиды – при бактериальном менингите; отеке
мозга; в офтальмологии; при лечении алкоголизма; при лейкозе.
102.
Глюкокортикоиды и минералокортикоиды.11
Кортикостероиды (кортикоиды) – гормоны коры надпочечников.
Надпочечники человека секретируют за сутки 0.15 – 0.40 мг основного
минералокортикоида альдостерона. За то же время глюкокортикостероида кортизола (он же - гидрокортизон) вырабатывается в норме 37 мг,
при стрессе - 300 - 400 мг.
Кортикостероиды обладают выраженной противовоспалительной,
глюкокортикоидной, минералокортикоидной, метаболической и иммуносупрессивной активностью.
Применяют при сахарном диабете; как противовоспалительные, противошоковые, антиаллергические и иммунодепрессантные препараты;
для лечения бронхиальной астмы, экзем, гепатитов, артритов, ревматизма, астении.
103.
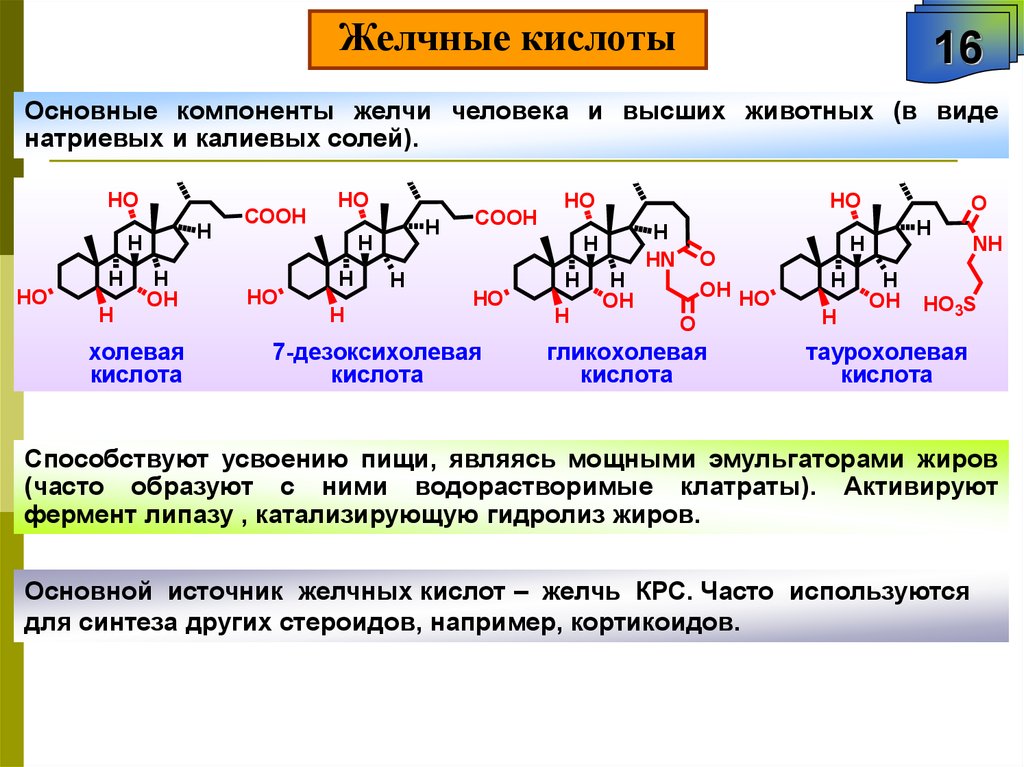
Желчные кислоты16
Основные компоненты желчи человека и высших животных (в виде
натриевых и калиевых солей).
HO
H
H
HO
H
H
H
OH
холевая
кислота
COOH
HO
H
H
HO
H
H
H
COOH
HO
HO
H
HO
7-дезоксихолевая
кислота
H
H
H
OH
H
HN
O
OH HO
O
гликохолевая
кислота
O
H
H
H
H
H
OH
NH
HO3S
таурохолевая
кислота
Способствуют усвоению пищи, являясь мощными эмульгаторами жиров
(часто образуют с ними водорастворимые клатраты). Активируют
фермент липазу , катализирующую гидролиз жиров.
Основной источник желчных кислот – желчь КРС. Часто используются
для синтеза других стероидов, например, кортикоидов.
104.
Сердечные гликозиды (карденолиды и буфадиенолиды)O
OHC
OH
HO
HO
O
O
OH
O
O
Общее строение
карденолидов R
H
H
H
O
1
O
O
из ландыша (Corvallaria majalis)
O
O
R3
R1
RO
O
HO
O
H
O
2
OH
сахар;
H, CHO, CH3
H, OH;
H, OH
O
дигитоксин
O
из наперстянки пурпурной
(Digitalis purpurea)
H
H
OH
OH
OH
OH
H
H
H
O
H
H
H
R2
R =
R1 =
R2 =
R3 =
строфантин
Общее строение
HO
HO
буфадиенолидов
H
RO
HO
HO
O
O
OH
O
O
H
OH
OH
OCH3
R3
17
O O
OH
OH
H
OH
В кардиологии (нормализуют работу сердечной мышцы). В больших концентрацисцилларен А
ях могут привести к остановке сердца.
из морского лука (Scilla maritima)
105.
106.
Аминогликозиды. Группа стрептомицина.6
Относятся к аминогликозидам. Занимают четвёртое место по использованию после
-лактамов, тетрациклинов и неполиеновых макролидов.
Общее в строении – 6-членные карбоциклические аминоспирты (аминоинозиты),
гликозилированные обычным сахаром или специфическими аминосахарами.
дигуанидиновое производное
- стрептидин
L-стрептоза
NH
OHC O
H2N NH
OH
H3C
O HO
N H NH
HO O
OH
HO
NH2
O H
HO
N
N-метил-L-глюкозамин
HO
CH3
Стрептомицин
HO
NH2
O
L-глюкозамин
R OH O H2N
HO
O
NH2
O
OH
O OH
HO
HO
O
NH2
R = OH паромомицин
R = H ливидомицин
Насчитывается более 100 природных соединений (продуцентов микроорганизмов рода Streptomyces, Micromonospora, Bacillus) и огромное количество полусинтетических антибиотиков (неомицин, канамицин, сизомицин, гентамицин).
107.
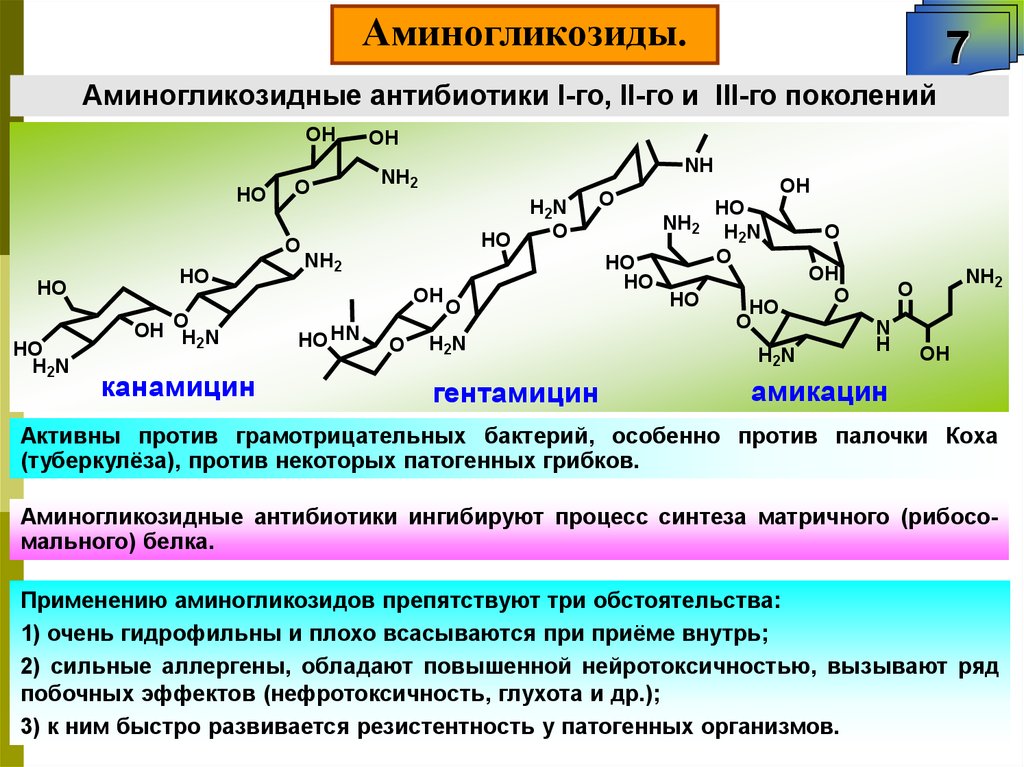
Аминогликозиды.7
Аминогликозидные антибиотики I-го, II-го и III-го поколений
OH
HO
O
O
HO
HO
H2N
HO
OH
NH
NH2
H2N
O
HO
NH2
OH
OH OH N
2
канамицин
HO HN
O
NH2
HO
HO
O
H2N
гентамицин
OH
O
HO
HO
H2N
O
HO
O
H2N
O
OH
O
NH2
O
N
H
OH
амикацин
Активны против грамотрицательных бактерий, особенно против палочки Коха
(туберкулёза), против некоторых патогенных грибков.
Аминогликозидные антибиотики ингибируют процесс синтеза матричного (рибосомального) белка.
Применению аминогликозидов препятствуют три обстоятельства:
1) очень гидрофильны и плохо всасываются при приёме внутрь;
2) сильные аллергены, обладают повышенной нейротоксичностью, вызывают ряд
побочных эффектов (нефротоксичность, глухота и др.);
3) к ним быстро развивается резистентность у патогенных организмов.
108.
Даже если Вы и совершитевеличайшую из всех ошибок,
ее результат будет Вам во
благо.
В этом мире есть хотя бы два
человека, за кого Вы могли бы
отдать свою жизнь. И, как минимум,
15 человек , кого Вы любите….
пусть и по-своему.






















































 chemistry
chemistry








