Similar presentations:
Биосинтез белка
1. БИОСИНТЕЗ БЕЛКА
Выполнила: ПорцеваЕлена 103 группа
2. Биосинтез белка
Сложныймногостадийный процесс
синтеза полипептидной цепи из
аминокислот, происходящий на
рибосомах с участием молекул мРНК
и тРНК.
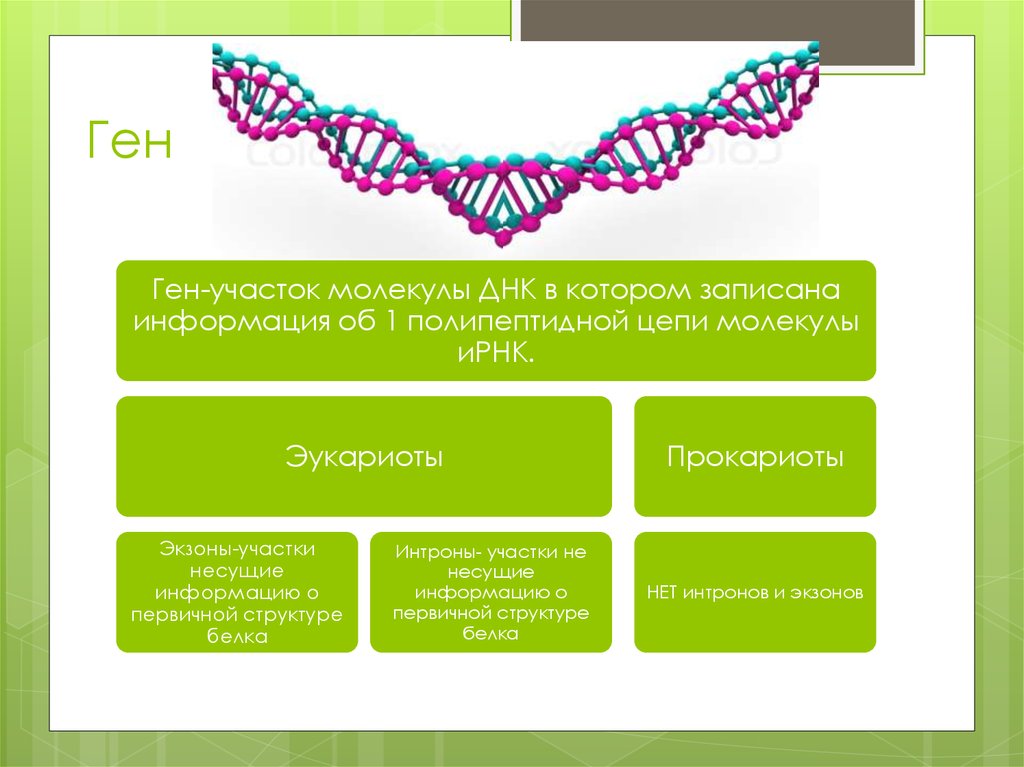
3. Ген
Ген-участок молекулы ДНК в котором записанаинформация об 1 полипептидной цепи молекулы
иРНК.
Эукариоты
Экзоны-участки
несущие
информацию о
первичной структуре
белка
Интроны- участки не
несущие
информацию о
первичной структуре
белка
Прокариоты
НЕТ интронов и экзонов
4. Генетический код
Последовательностьтрёх нуклеотидов,
входящих в состав ДНК и кодирующих
аминокислоту- триплет.
Каждый триплет кодирует 1
аминокислоту.
ЦАУ-УАУ-УУУ
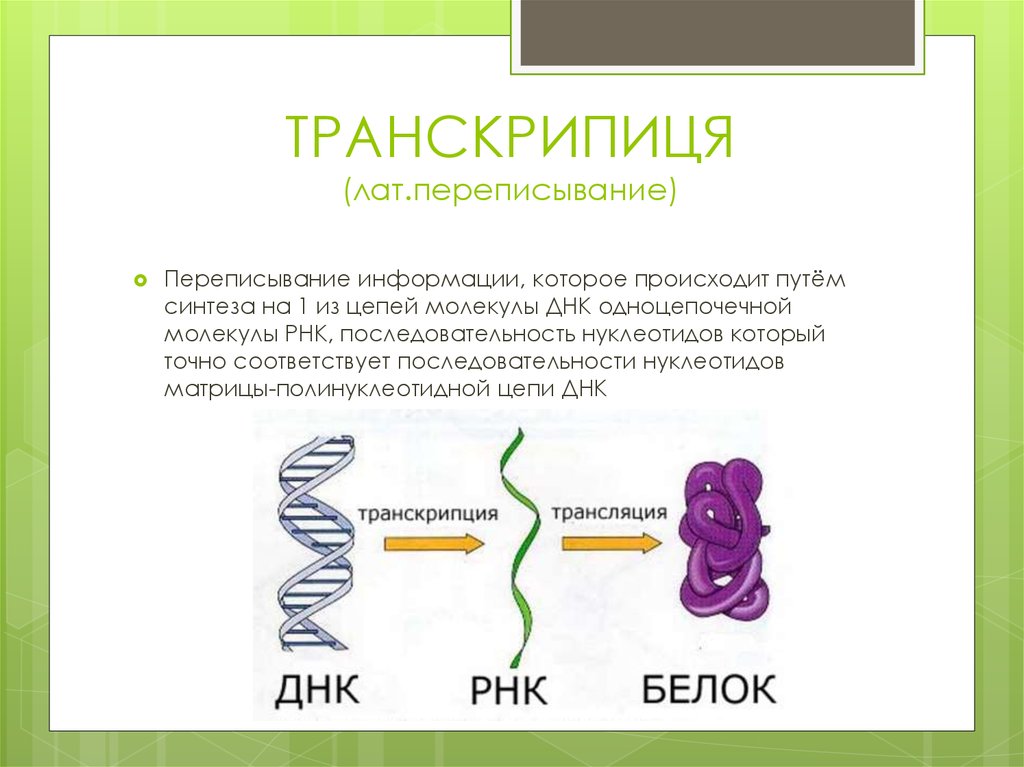
5. ТРАНСКРИПИЦЯ (лат.переписывание)
Переписывание информации, которое происходит путёмсинтеза на 1 из цепей молекулы ДНК одноцепочечной
молекулы РНК, последовательность нуклеотидов который
точно соответствует последовательности нуклеотидов
матрицы-полинуклеотидной цепи ДНК
6.
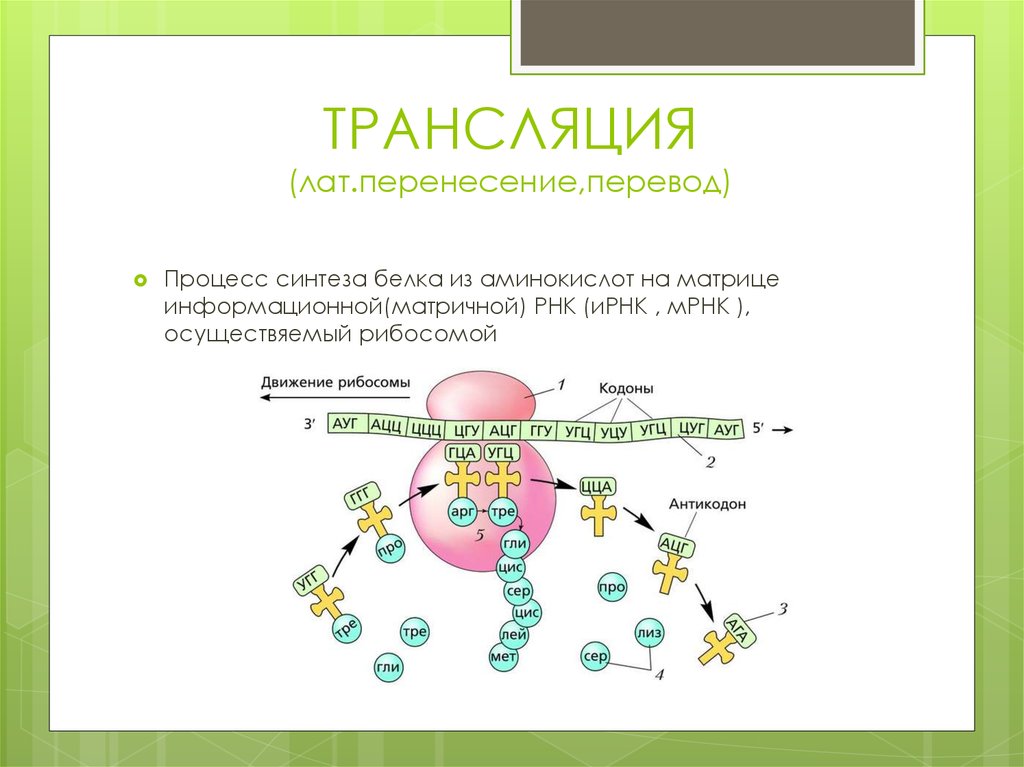
7. ТРАНСЛЯЦИЯ (лат.перенесение,перевод)
Процесс синтеза белка из аминокислот на матрицеинформационной(матричной) РНК (иРНК , мРНК ),
осуществяемый рибосомой
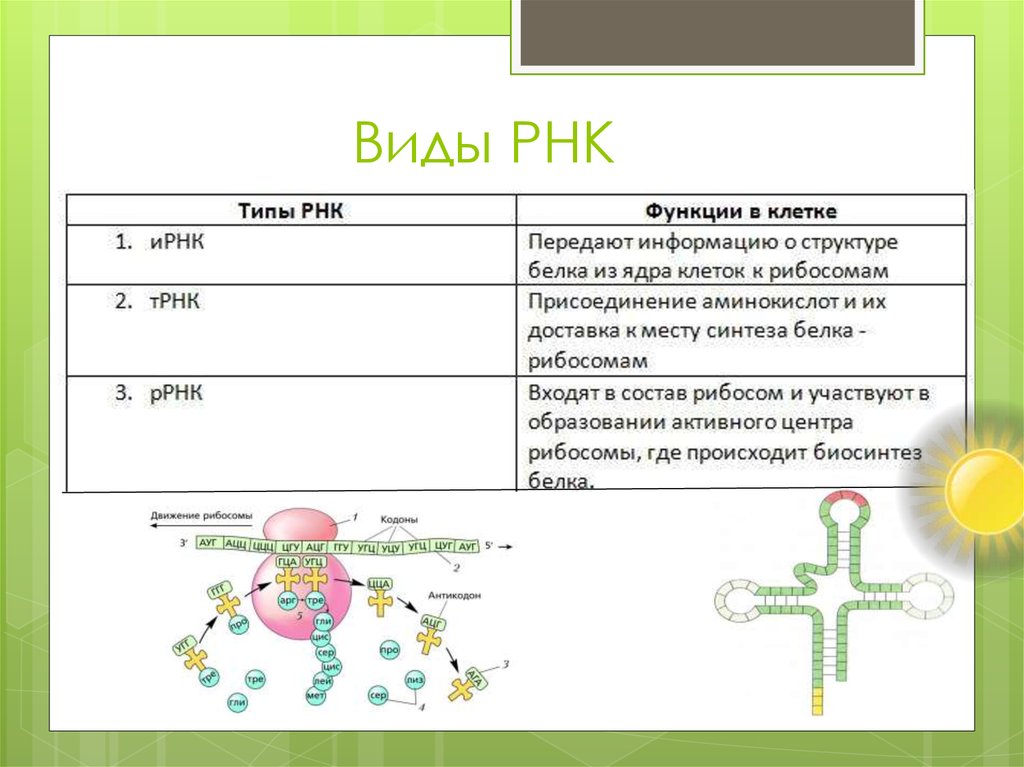
8. Виды РНК
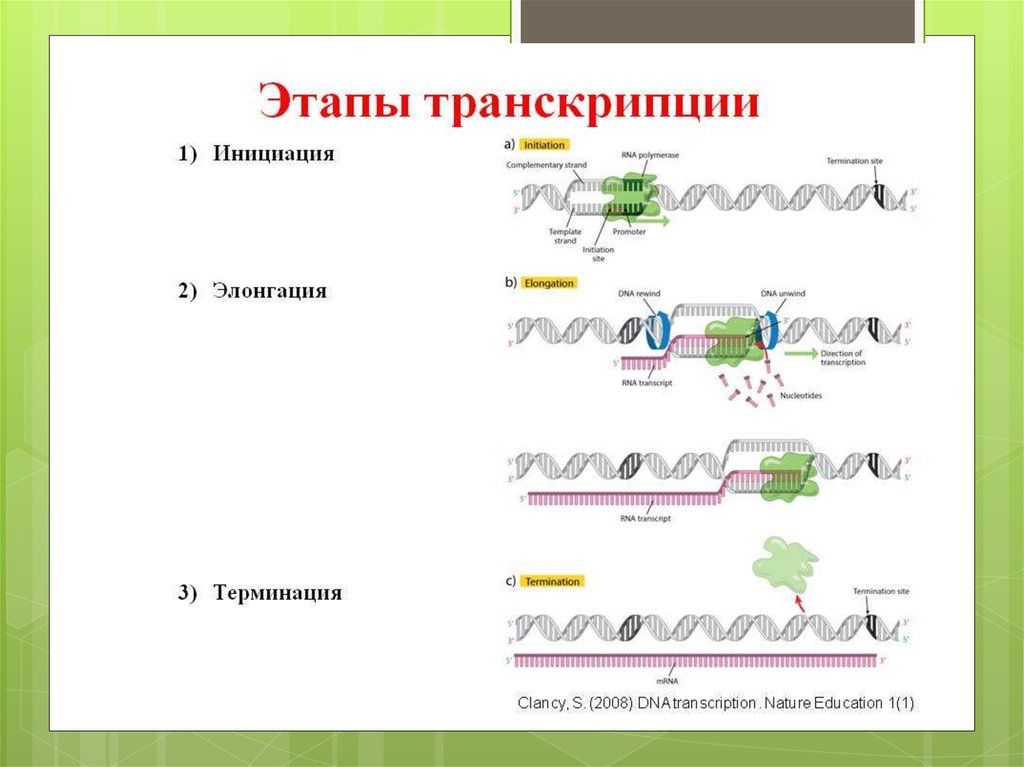
9. Инициация – начало процесса
Это начальная стадия трансляции, в котороймалая субъединица рибосомы соединяется с
самой первой т-РНК. Эта рибонуклеиновая
кислота несет на себе аминокислоту –
метионин. Трансляция всегда начинается
именно с этой аминокислоты, так как
стартовым кодоном является АУГ, который и
кодирует этот первый мономер в белковой
цепи
Для того чтобы рибосома узнала стартовый
кодон и не начала синтез с середины гена,
где последовательность АУГ тоже может
оказаться, вокруг начального кодона
располагается специальная
последовательность нуклеотидов. Именно по
ним рибосома узнает то место, на которое
должна сесть ее малая субъединица.
10. Элонгация – середина синтеза
На этом этапе происходитпостепенное наращивание
белковой цепочки.
Продолжительность элонгации
зависит от количества аминокислот в
белке
Первым делом к малой субъединице
рибосомы присоединяется большая.
И начальная т-РНК оказывается в ней
целиком. Снаружи остается только
метионин. Далее в большую
субъединицу заходит вторая т-РНК,
несущая другую аминокислоту.
После этого рибосома
передвигается по м-РНК ровно на три
нуклеотида (один кодон), первая тРНК отсоединяет от себя метионин и
отделяется от комплекса. На ее
месте оказывается вторая т-РНК, на
конце которой висит уже две
аминокислоты
11. Терминация
В дело вступаютфакторы терминации,
которые отделяют
готовый белок от
рибосомы.
Сама органелла может
либо распасться на две
субъединицы, либо
продолжить свой путь по
м-РНК в поисках нового
стартового кодона. На
одной м-РНК могут
находиться сразу
несколько рибосом.
Каждая из них - на своей
стадии трансляции
12. Белок
высокомолекулярные органическиевещества, состоящие из альфааминокислот, соединённых в цепочку
пептидной связью.
13. Первичная структура
Образуется при последовательности амк иполипептидной цепи
Важными особенностями первичной
структуры являются консервативные мотивы
— устойчивые сочетания аминокислотных
остатков, выполняющие определённую
функцию и встречающиеся во многих
белках. Консервативные мотивы
сохраняются в процессе эволюции видов,
по ним часто удаётся предсказать
функцию неизвестного белка
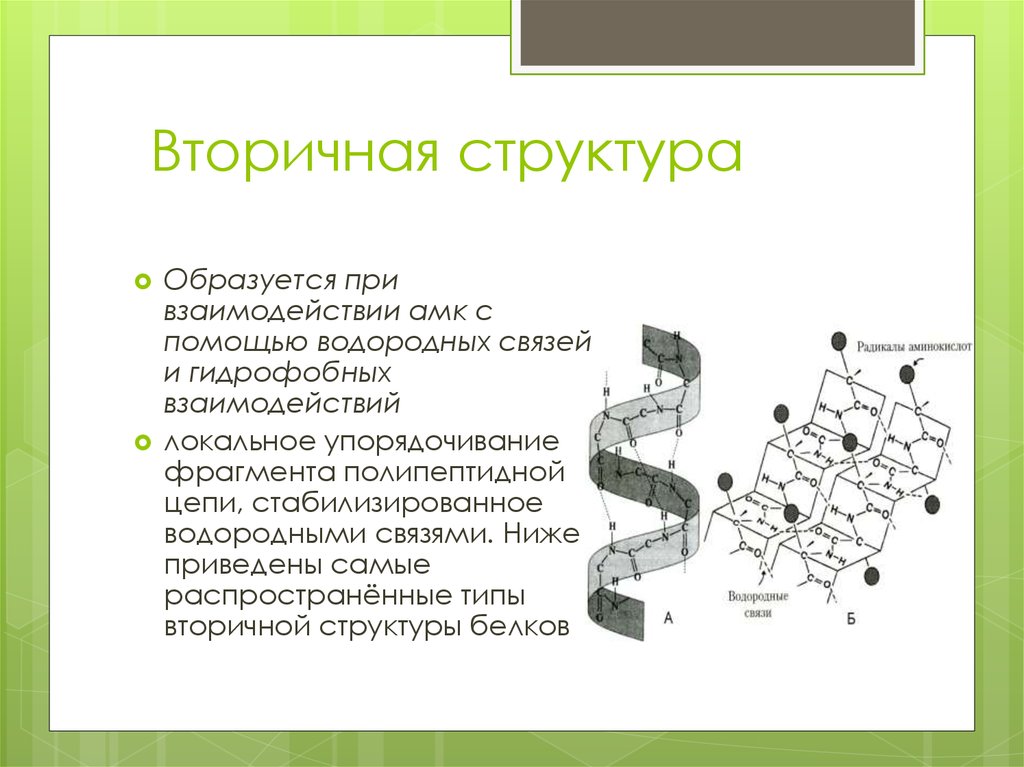
14. Вторичная структура
Образуется привзаимодействии амк с
помощью водородных связей
и гидрофобных
взаимодействий
локальное упорядочивание
фрагмента полипептидной
цепи, стабилизированное
водородными связями. Ниже
приведены самые
распространённые типы
вторичной структуры белков
15. Третичная структура
Образуется при взаимодействийвторичных структур , стабилизируется
ковалентными ионными водородными
связями и гидрофобными
взаимодействиями
ковалентные связи (между двумя
остатками цистеина — дисульфидные
мостики);
ионные связи между противоположно
заряженными боковыми группами
аминокислотных остатков;
водородные связи;
гидрофобные взаимодействия. При
взаимодействии с окружающими
молекулами воды белковая молекула
сворачивается так, чтобы неполярные
боковые группы аминокислот
оказались изолированы от водного
раствора; на поверхности молекулы
оказываются полярные гидрофильные
боковые группы.
16. Четвертичная структура
Образуетсявзаимное расположение
нескольких полипептидных цепей в
составе единого белкового комплекса
Надмолекулярные белковые комплексы
могут состоять из десятков молекул











 biology
biology