Similar presentations:
Основы молекулярной биологии. Биосинтез белка. Трансляция
1. Основы молекулярной биологии. Биосинтез белка. Трансляция.
СОСТАВИТЕЛЬ:Доцент кафедры биологии ОмГМУ, к.б.н.
Лазуткина Екатерина Александровна
1
2. План:
1.Рибосомный цикл биосинтеза белка
А) строение рибосомы. Полисома
Б) эпицикл трансляции: инициация,
элонгация, терминация
В) сходства и различия трансляции у про- и
эукариот.
2.
Регуляция синтеза белка на уровне
трансляции.
3.
Посттрансляционные изменения белков:
фолдинг, транспорт и деградация белков
2
3. Строение ядрышка
»»
»
»
»
»
»
»
»
»
Строение ядрышка при малом (а) и большом (б) увеличении:
ЯО — ядерная оболочка; ЯК — ядрышко;
ГК — гранулярный компонент; ФЦ — фибриллярный центр;
ПФК — плотный фибриллярный компонент
Схема компонентов ядрышка: 1 — гранулярный компонент
(нуклеолонема); 2 — фибриллярные центры;
3 — плотный фибриллярный компонент;
4 — околоядрышковый хроматин
http://biology-of-cell.narod.ru/nucleus8.html
3
4. 1. Рибосомный цикл биосинтеза белка А) строение рибосомы. Полисома
Биосинтез белков:1. Наиболее сложный из генетических процессов;
2. Наиболее энергоемкий процесс;
3. Протекает с высокой скоростью
(при 37˚ белок из 100 аминокислотных остатков синтезируется E. coli за 5 секунд)
В 2009 году В. Рамакришнан (Великобритания), Т.
Стейтс (США) и А. Йонат (Израиль) получили
Нобелевскую премию
"за исследования структуры и функции рибосомы".
Собственно трансляция осуществляется рибосомой
– белоксинтезирующей машиной
4
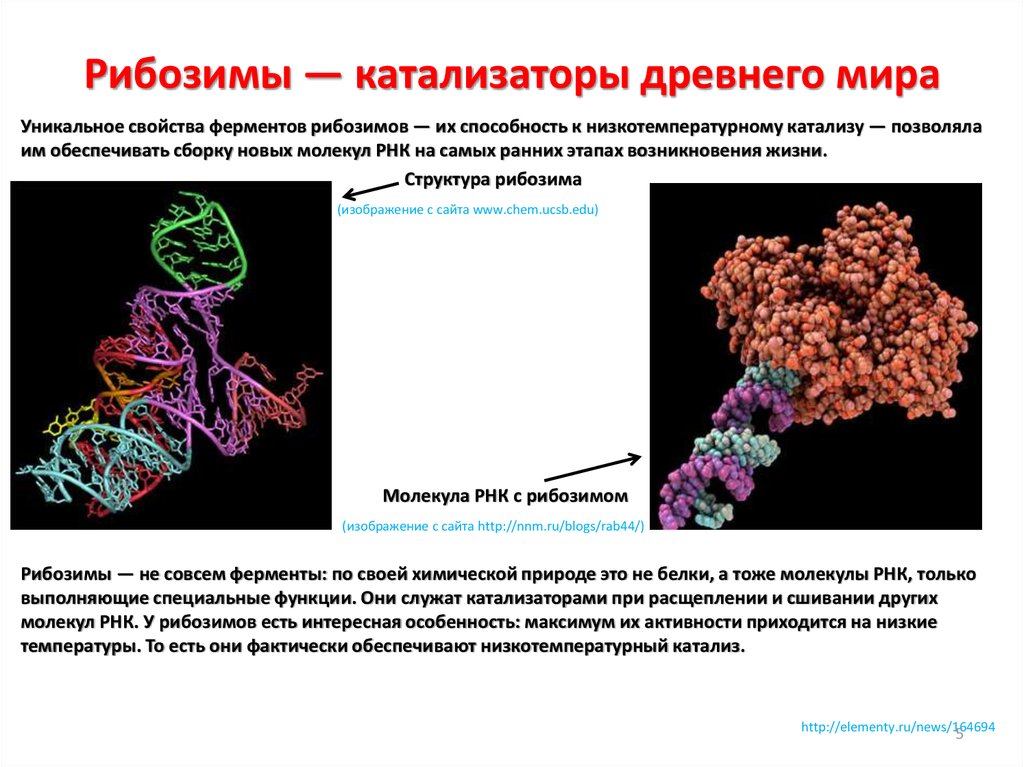
5. Рибозимы — катализаторы древнего мира
Уникальное свойства ферментов рибозимов — их способность к низкотемпературному катализу — позволялаим обеспечивать сборку новых молекул РНК на самых ранних этапах возникновения жизни.
Структура рибозима
(изображение с сайта www.chem.ucsb.edu)
Молекула РНК с рибозимом
(изображение с сайта http://nnm.ru/blogs/rab44/)
Рибозимы — не совсем ферменты: по своей химической природе это не белки, а тоже молекулы РНК, только
выполняющие специальные функции. Они служат катализаторами при расщеплении и сшивании других
молекул РНК. У рибозимов есть интересная особенность: максимум их активности приходится на низкие
температуры. То есть они фактически обеспечивают низкотемпературный катализ.
http://elementy.ru/news/164694
5
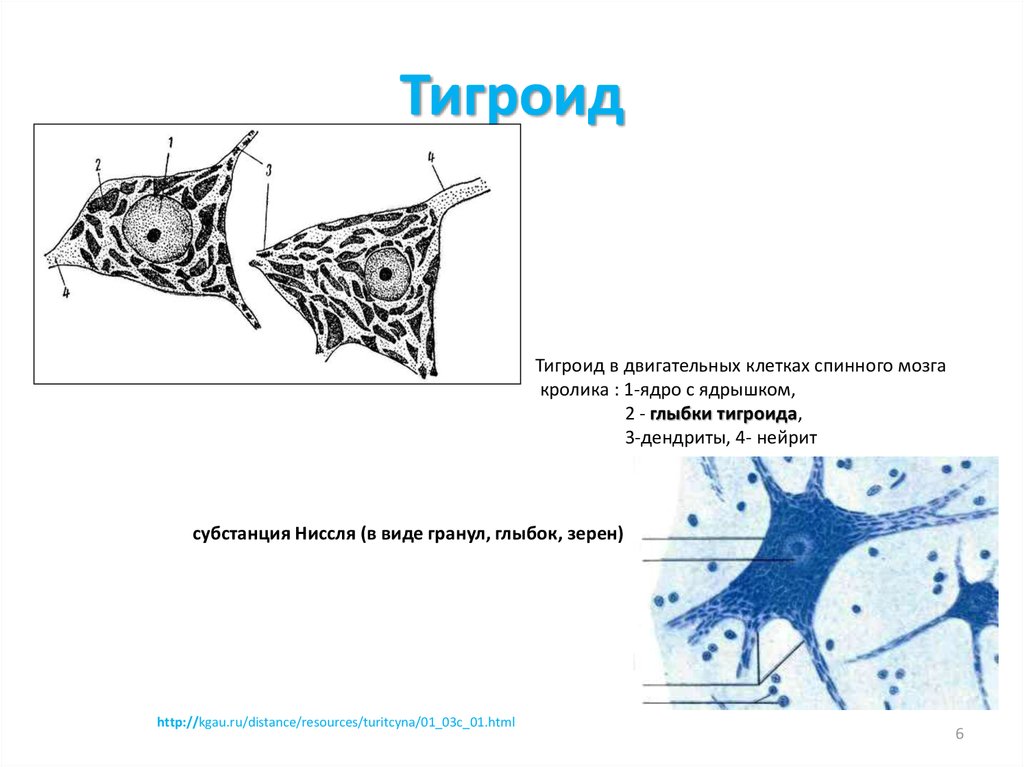
6. Тигроид
Тигроид в двигательных клетках спинного мозга
кролика : 1-ядро с ядрышком,
2 - глыбки тигроида,
3-дендриты, 4- нейрит
субстанция Ниссля (в виде гранул, глыбок, зерен)
http://kgau.ru/distance/resources/turitcyna/01_03c_01.html
6
7. Модель рибосомы E. coli
Рибосома состоит из большой и малой лабильноассоциированных субчастиц
30S
50S
7
8. Рибосома
Схематическое изображение рибосомы. Рибосома „считывает“ код и присоединяет нужнуюаминокислоту к строящейся пептидной цепочке. На рисунке аминокислоты обозначены буквами: М —
метионин, R — аргинин, S — серин.
8
9. Трехмерная модель рибосомы
910. Рибосома:
1. химически – рибонуклеопротеид,2. физически – компактная частица, диаметром около 30 нм,
3. функционально – молекулярная машина, протягивающая
вдоль себя мРНК, считывающая закодированную в мРНК
генетическую информацию и синтезирующая
полинуклеотидную цепь.
10
11.
Генетическая программа должна не только копироваться, но и выполняться. В ходе ее работы создаются белки — главныемолекулярные машины и строительные блоки живой клетки. Процесс происходит в два этапа. Вначале информация с ДНК
транскрибируется — переписывается на другой, очень похожий носитель — молекулу РНК. От ДНК она отличается
строением одного зубчика из четырех, а также основой, на которой эти зубчики сидят — она у РНК менее прочная.
Причина понятна — если ДНК нужна для продолжительного хранения информации, то РНК — временный носитель,
расходный материал, одноразовые дискеты или флэшки. Такая молекула РНК, на которую записана копия гена,
называется информационной, или матричной (мРНК). Эта длинная цепочка — одна половинка «застежки-молнии» —
может содержать до сотни тысяч зубчиков.
Когда переписывание информации завершено, мРНК выходит из клеточного ядра и встречается с рибосомой —
образуется молекулярный конвейер по производству белка. Каждые три зубчика РНК кодируют один строительный блок
белка — аминокислоту. Всего же в белках встречаются 20 видов таких строительных блоков, и они выстраиваются в
цепочку строго в порядке, запрограммированном в РНК. Этот процесс называется трансляцией — в компьютерном мире
этим термином обозначают перевод текста программы в исполняемый машинный код. Сходя с рибосомы, цепочка
аминокислот сразу сворачивается и образует устойчивую трехмерную структуру. Именно в таком виде белки выполняют
свои функции в клетке. Рибосомы могут неоднократно транслировать матричную РНК, раз за разом производя новые
молекулы белка. Но мРНК неустойчива и через несколько часов разрушается. Поэтому считалось, что синтез каждого
белка зависит главным образом от синтеза соответствующей мРНК в ядре клетки.
Покинув ядро клетки, РНК несет генетическую депешу к огромному
молекулярному комплексу — рибосоме.
Здесь происходит трансляция — перевод генетического кода в структуру
белковых молекул. Рибосома, двигаясь вдоль цепочки РНК (синяя), считывает
код и добавляет к растущей молекуле белка (желтая) соответствующие
аминокислоты. Фото: SPL/EAST NEWS
11
http://www.vokrugsveta.ru/vs/article/6503/
12. Строение рибосомы
РибосомаКоэффициент
седиментации рибосомы
Прокариотическая рибосома
Большая субчастица
Коэффициент
седиментации рибосомы
Количество белков
70S
Малая субчастица
50S
30S
34 молекулы белков,
из них 31 разные
21 белок
Эукариотическая рибосома
Большая
субчастица
60S
80S
Малая субчастица
40S
не менее 50 разных не менее 33 разных
белков
белков
Покинув ядро клетки, РНК несет генетическую депешу к
огромному молекулярному комплексу - рибосоме.
Здесь происходит трансляция - перевод генетического
кода в структуру белковых молекул. Рибосома, двигаясь
вдоль цепочки РНК (синяя), считывает код и добавляет к
растущей молекуле белка (желтая) соответствующие
аминокислоты. Фото: SPL/EAST NEWS
12
13.
Полирибосомы (полисомы) –синтезирующие белок
внутриклеточные комплексы,
каждый из которых состоит из
молекулы мРНК и многих
связанных с ней рибосом.
13
14. Синтез белков молекулой РНК
http://nnm.ru/blogs/rab44/14
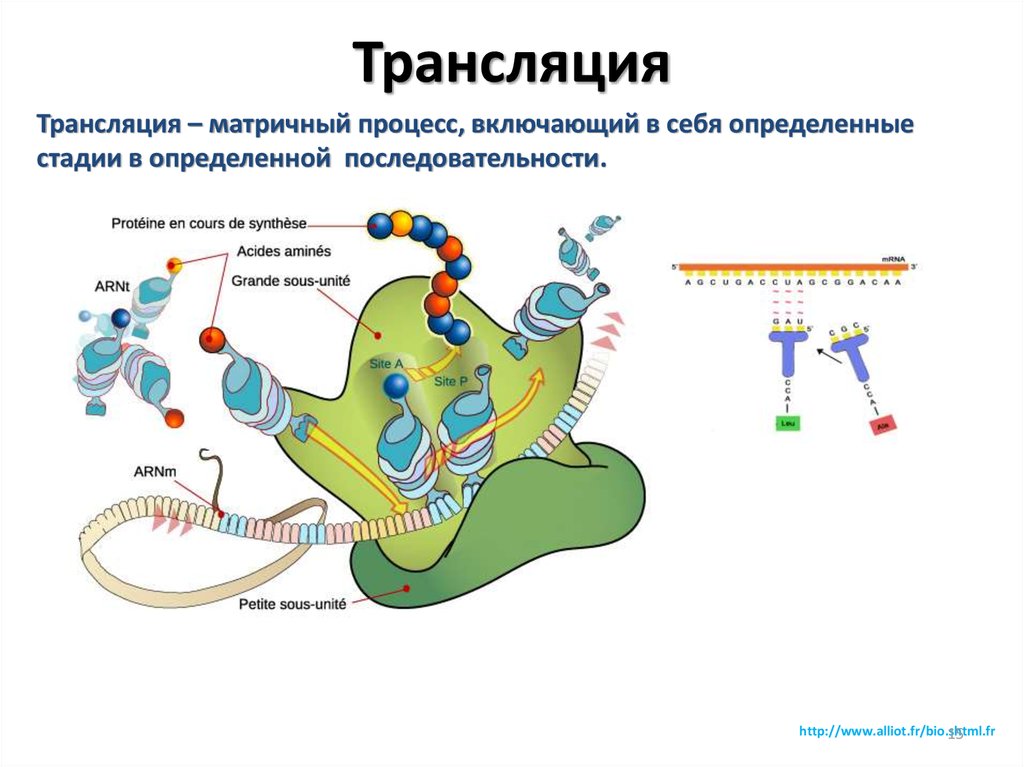
15. Трансляция
Трансляция – матричный процесс, включающий в себя определенныестадии в определенной последовательности.
http://www.alliot.fr/bio.shtml.fr
15
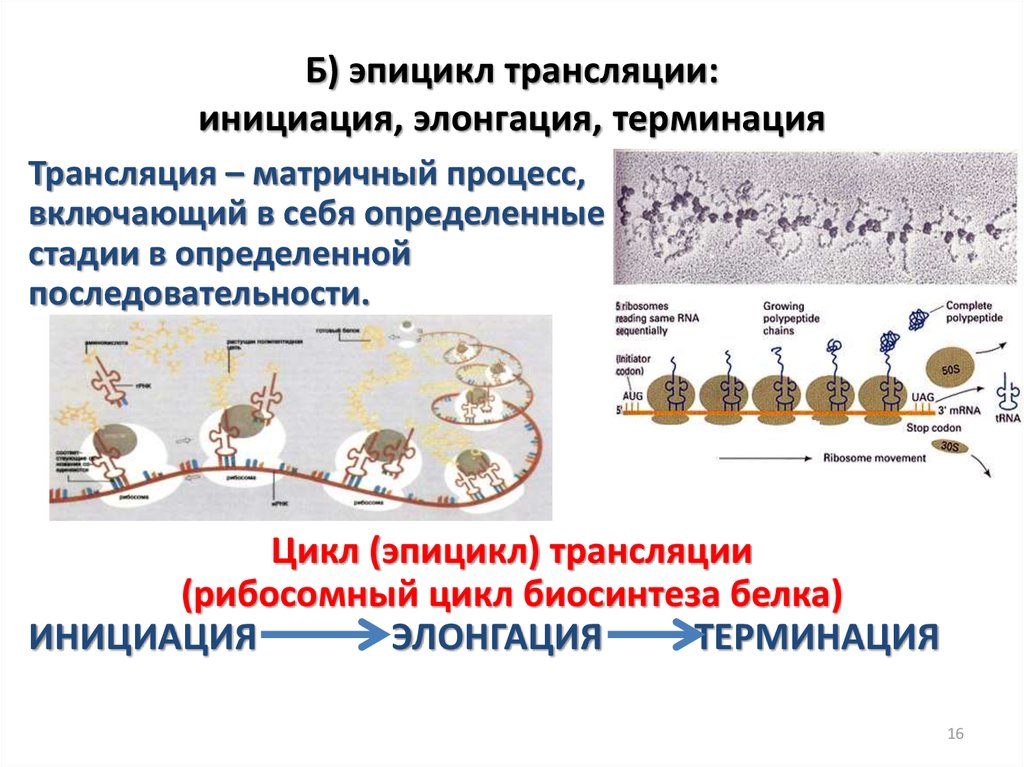
16. Б) эпицикл трансляции: инициация, элонгация, терминация
Трансляция – матричный процесс,включающий в себя определенные
стадии в определенной
последовательности.
Цикл (эпицикл) трансляции
(рибосомный цикл биосинтеза белка)
ИНИЦИАЦИЯ
ЭЛОНГАЦИЯ
ТЕРМИНАЦИЯ
16
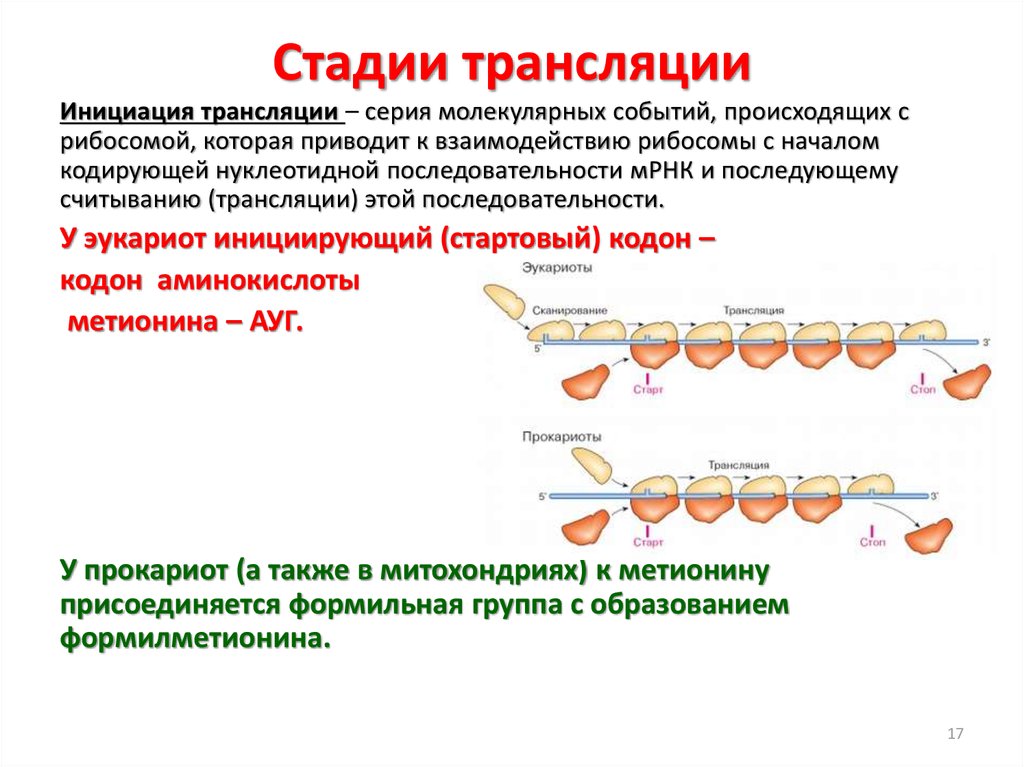
17. Стадии трансляции
Инициация трансляции – серия молекулярных событий, происходящих срибосомой, которая приводит к взаимодействию рибосомы с началом
кодирующей нуклеотидной последовательности мРНК и последующему
считыванию (трансляции) этой последовательности.
У эукариот инициирующий (стартовый) кодон –
кодон аминокислоты
метионина – АУГ.
У прокариот (а также в митохондриях) к метионину
присоединяется формильная группа с образованием
формилметионина.
17
18.
Схема, демонстрирующая участиедвух рибосомных субчастиц —
малой (желтая) и большой
(красная) — в процессе
инициации трансляции.
A и P — два участка связывания
тРНК. Цифрами обозначены
соответствующие факторы
инициации (IF2, IF3).
Инициаторная тРНК изображена в
виде зеленой фигуры с кружком
(метионином) на акцепторном
конце, мРНК показана синей
линией.
18
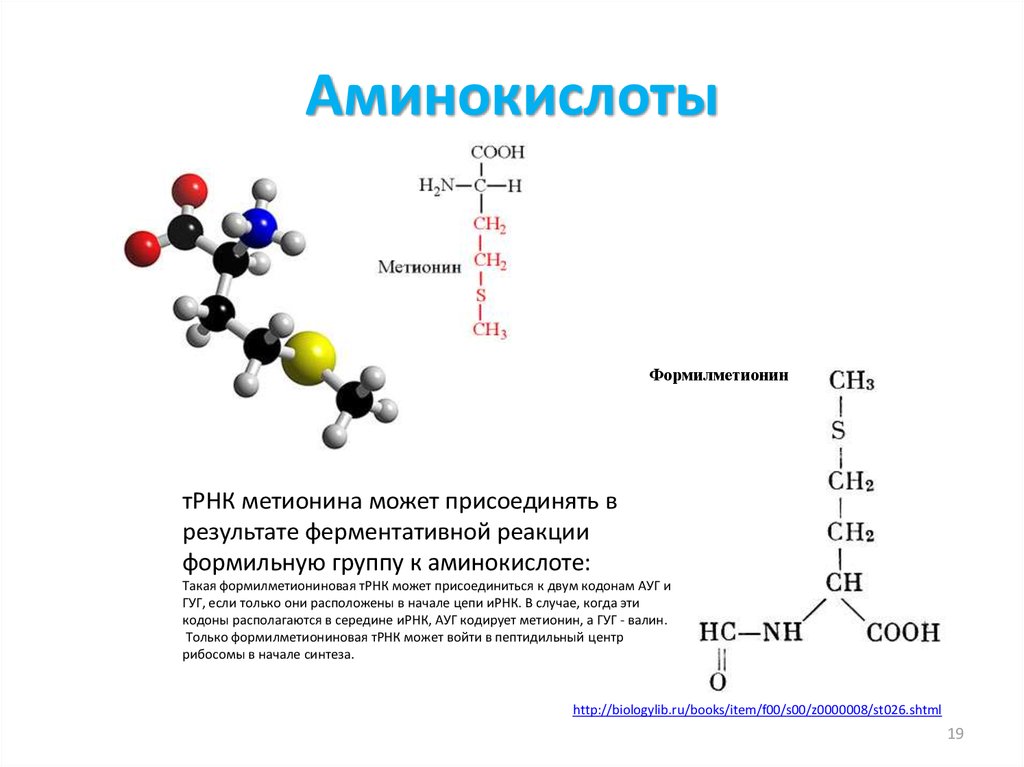
19. Аминокислоты
»Формилметионин
»
тРНК метионина может присоединять в
результате ферментативной реакции
формильную группу к аминокислоте:
Такая формилметиониновая тРНК может присоединиться к двум кодонам АУГ и
ГУГ, если только они расположены в начале цепи иРНК. В случае, когда эти
кодоны располагаются в середине иРНК, АУГ кодирует метионин, а ГУГ - валин.
Только формилметиониновая тРНК может войти в пептидильный центр
рибосомы в начале синтеза.
http://biologylib.ru/books/item/f00/s00/z0000008/st026.shtml
19
20. Стадии трансляции
Элонгация - собственно трансляция кодирующейпоследовательности мРНК рибосомой. Она имеет
два аспекта: генетический (сканирование значащих
кодонов мРНК) и биохимический (синтез
полипептидной цепи).
Элонгационный цикл составляют три
последовательных шага:
связывание аминоацил-тРНК, транспептидация и
транслокация.
Схема элонгации пептида на рибосоме:
а — инициаторная аминоацил-тРНК находится в P-участке и первая элонгаторная
аминоацил-тРНК приходит в A-участок;
б — транспептидация приводит к переносу аминокислотного остатка от
инициаторной тРНК на аминоацил-тРНК в A-участке;
в — транслокация перемещает тРНК из А-участка в Р-участок, и эта тРНК увлекает
за собой связанный с ней (комплементарный) кодон мРНК. Таким образом, мРНК
оказывается сдвинутой относительно рибосомы на один триплет нуклеотидов, и в
А-участке устанавливается очередной кодон (CUG);
г — аминоацил-тРНК, комплементарная этому кодону связывается с А-участком;
д — транспептидация переносит дипептид на аминоацил-тРНК в А-участке;
е — транслокация перемещает тРНК из А-участка в Р-участок, что приводит к
сдвигу мРНК еще на один триплет. В А-участке устанавливается новый кодон
(UCU). Далее процесс продолжается по описанной выше схеме (г >> д >> е).
20
21. Стадии трансляции
Из 64 возможных кодонов мРНК три:УАА, УАГ, УГА, являются терминирующими
или стоп-кодонами: они останавливают
трансляцию.
Терминация — узнавание терминирующего
кодона (стоп-кодона) и отделение продукта.
21
22. Стадии трансляции
Схема терминации трансляции:а — после добавления последнего аминокислотного
остатка к растущему полипептиду, т.е. образования
последней пептидной связи в А-участке
устанавливается триплет, не кодирующий никакой
аминокислоты — кодон терминации (UAG, UAA или
UGA);
б — А-участок с кодоном терминации воспринимает
специальные белки — факторы терминации RF1 (или
RF2, RF3);
в — пептидилтрансферазный центр рибосомы под
действием факторов терминации катализирует
реакцию переноса С-конца синтезированного
полипетида от тРНК на молекулу воды: происходит
гидролиз связи между тРНК и полипептидом, и
полипептид освобождается из рибосомы в среду;
г —деацилированная тРНК освобождается из
рибосомы;
д - «пустая» рибосома легко диссоциирует на
субчастицы, причем малая субчастица может
некоторое время оставаться в лабильной ассоциации
с мРНК и скользить вдоль нее, находя следующий
кодон инициации (реинициация следующей
кодирующей последовательности в полицистронных
мРНК). Удалению деацилированной тРНК и
диссоциации рибосом может содействовать
специальный белок — фактор освобождения (RRF).
22
23. в) сходство и различия трансляции у про- и эукариот
Различия наблюдаются по:1. размеру и коэффициенту седиментации рибосом;
2. способности присоединяться к иРНК;
3. механизму выбора старт-кодона;
4. формату белкового синтеза
кэпирование
23
http://web-local.rudn.ru/web-local/prep/rj/index.php?id=1911&p=227
24. 2. Регуляция синтеза белка на уровне трансляции
Основные стратегии регуляции биосинтеза белка:Немедленное использование производимой генами иРНК
и ее быстрая де-градация (метаболически нестабильная иРНК). В
основном именно эту стратегию используют прокариоты.
2.
Наработка метаболически стабильных иРНК впрок.
Стратегия активации-неактивации типична для эукариот.
3. Подавление трансляции у животных и растений с помощью
малых некодирующих РНК-транскриптов
(miРНК – микроРНК), кодируемых специальными генами.
1.
24
25.
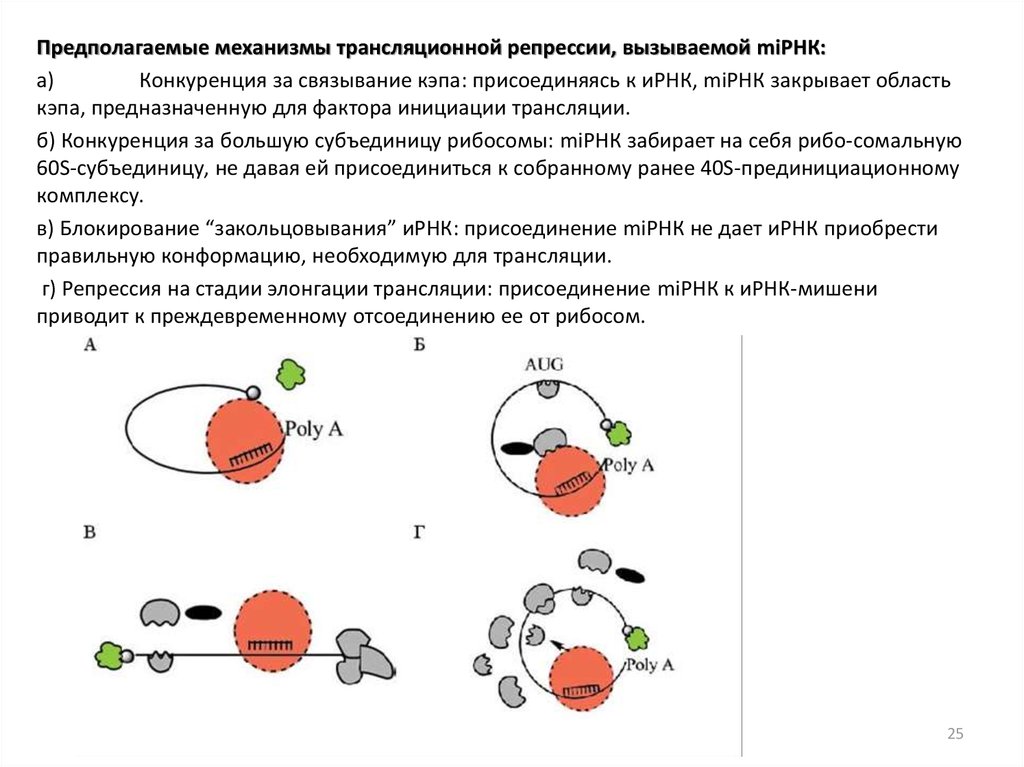
Предполагаемые механизмы трансляционной репрессии, вызываемой miРНК:a)
Конкуренция за связывание кэпа: присоединяясь к иРНК, miРНК закрывает область
кэпа, предназначенную для фактора инициации трансляции.
б) Конкуренция за большую субъединицу рибосомы: miРНК забирает на себя рибо-сомальную
60S-субъединицу, не давая ей присоединиться к собранному ранее 40S-прединициационному
комплексу.
в) Блокирование “закольцовывания” иРНК: присоединение miРНК не дает иРНК приобрести
правильную конформацию, необходимую для трансляции.
г) Репрессия на стадии элонгации трансляции: присоединение miРНК к иРНК-мишени
приводит к преждевременному отсоединению ее от рибосом.
25
26. 3. Посттрансляционные изменения белков: фолдинг, транспорт и деградация белков
Посттрансляционной модификацией белков называют изменение первичной структурыполипептидной цепи после завершения ее синтеза рибосомами; то есть, это химические
превращения, изменяющие ковалентную структуру полипептидной цепи.
Особенности реакций пострансляционных модификаций:
• Катализируются специфическими ферментами;
• Могут происходить как во время синтеза полипептидной цепи, так и после
окончания синтеза;
• Нематричные процессы, отсюда – образование множественных форм белков;
• Некоторые реакции характерны для очень многих белков, а некоторые – для
ограниченной группы (или отдельных) белков;
• Более 5% генов в геноме в геноме человека кодируют ферменты, участвующие в
пострансляционной модификации белков.
26
27. Фолдинг белков
Что такое фолдинг?В клетках за производство белков отвечают рибосомы, где белки собираются из отдельных аминокислот в
соответствии с последовательностью, считываемой из ДНК.
Результатом работы такого биологического конвейера являются длинные молекулы — «заготовки» для
белков. И хотя геном сегодня расшифрован, то есть, известна первичная структура некоторого количества
белков, в том числе — человека, даже в этом случае невозможно судить о его функциях. Последние
проявляются только после того, как длинная цепочка аминокислот свернется и примет необходимую форму.
Из миллионов потенциально возможных пространственных комбинаций белок принимает однуединственную заранее известную форму. Этот процесс и называется фолдингом.
Таким образом, в организме образуются готовые к работе
гемоглобин, инсулин и др.
Процесс сворачивания может проходить в
несколько стадий длительностью от нескольких
секунд до нескольких минут. В последней фазе
протеин из «предварительного состояния»
мгновенно принимает окончательную форму.
Именно эта фаза продолжительностью
несколько десятков микросекунд
представляет собой сложнейшую проблему
для моделирования.
27
28. Факторы и ферменты фолдинга
Факторами фолдинга являются молекулярные шапероны и шаперонины .(шапероны (дуэньи) — дамы пожилого возраста, сопровождающие девушку на балах)
Шаперон — белковая машина,
помогающая другим белкам
приобрести правильную
пространственную конформацию.
белок - GroEL
28
29. Шапероны
Молекулярные шапероны – этобольшая группа неродственных
белковых семейств, которые участвуют
в стабилизации развернутых или
частично свернутых белков и
содействуют корректному фолдингу и
сборке белковых комплексов.
Шапероны часто называют
«белками теплового шока».
http://www.vechnayamolodost.ru/pages_6/novoevgerontolo/teplshokista13.html29
30. Шаперонины
Шаперонины представляют собой сложные белки,состоящие из большого количества субъединиц.
Они похожи на стаканчик с полостью внутри.
В эту полость помещается принесенная шаперонами
полипептидная цепь, после чего «стаканчик»
закрывается «крышечкой».
Попавшая внутрь шаперонина молекула оказывается
полностью изолированной и получает возможность
без помех осуществить стадию медленного сворачивания.
http://sov.opredelim.com/docs/136900/index-3147.html
30
31. Структура шаперонина TRiC
• .31
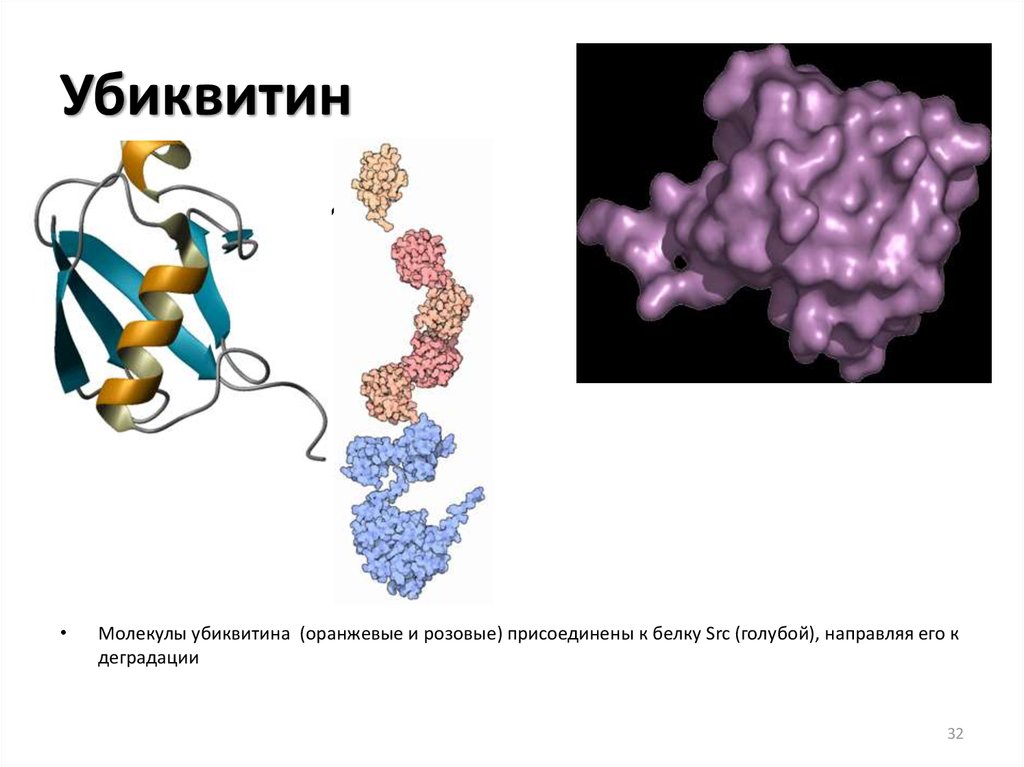
32. Убиквитин
• олекулы убикМолекулы убиквитина (оранжевые и розовые) присоединены к белку Src (голубой), направляя его к
деградации
32
33. Протеасома
Ленточная диаграмма протеасомы, вид сверху и сбоку. Активный сайт,Гидролизующий белки, находится внутри цилиндра
Схематическое изображение коровой 20S протеасомы
Saccharomyces cerevisiae, вид сбоку.
α-субъединицы, составляющие внешние кольца показаны зелёным,
β-субъединицы, образующие внутренние кольца, — синим
http://ead.univ-angers.fr/~jaspard/Page2/COURS/Zsuite/3BiochMetab/7Ubiquitinylation/1Ubiquitinylation.htm
33
34. Болезни, вызываемые неправильно собранными белками
Муковисцидозболезнь Хантингтона
Болезнь
Альцгеймера
Болезнь Крейцфельда-Якоба
34

























 biology
biology