Similar presentations:
Строение атома. (8 класс)
1.
Урок 8 классаСтроение атома
1
2.
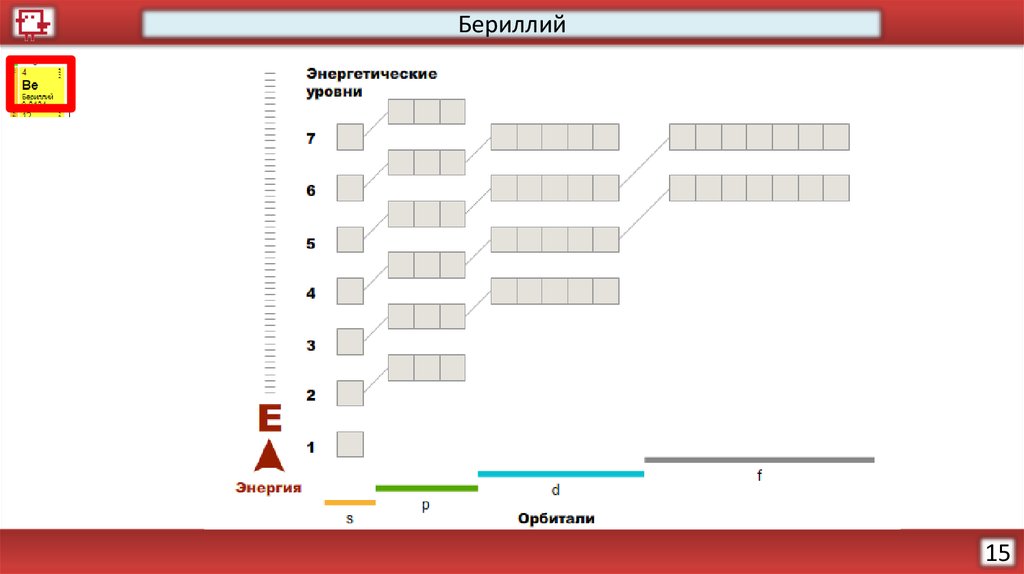
Бериллий14
3.
Бериллий15
4.
БериллийКоличество электронов на
внешнем уровне - 1
Радиус - 112 пм
Валентность - 2
Х.с.:
Be+ 2NaOH + 2H2O = Na2[Be(OH)4]
Ф.с. – относительно твёрдый, но
хрупкий металл серебристобелого цвета.
16
5.
Бор17
6.
Бор18
7.
БорКоличество электронов на
внешнем уровне - 3
Радиус - 98 пм
Валентность - 3
Х.с.:
B2O3 + 3H2O = H3BO3
4H3BO3 + NaOH = Na2B4O7
Ф.с. – бесцветное, серое или
красное кристаллическое либо
тёмное аморфное вещество
19
8.
Углерод20
9.
Углерод21
10.
УглеродКоличество электронов на
внешнем уровне - 4
Радиус - 91 пм
Валентность – 2, 4
Х.с.:
С+1/2О2 = СО; СО + 1/2О2 = СО2
CO2 + H2O = H2CO3
Ф.с. – Матово-чёрный (графит),
либо прозрачный (алмаз)
22
11.
Азот23
12.
Азот24
13.
АзотКоличество электронов на
внешнем уровне - 5
Радиус - 92 пм
Валентность – 3, 4
Х.с.:
N2O5 + H2O = 2HNO3
N2O3 + H2O = 2HNO2
Ф.с. – газ без цвета, вкуса и
запаха.
14.
Азот15.
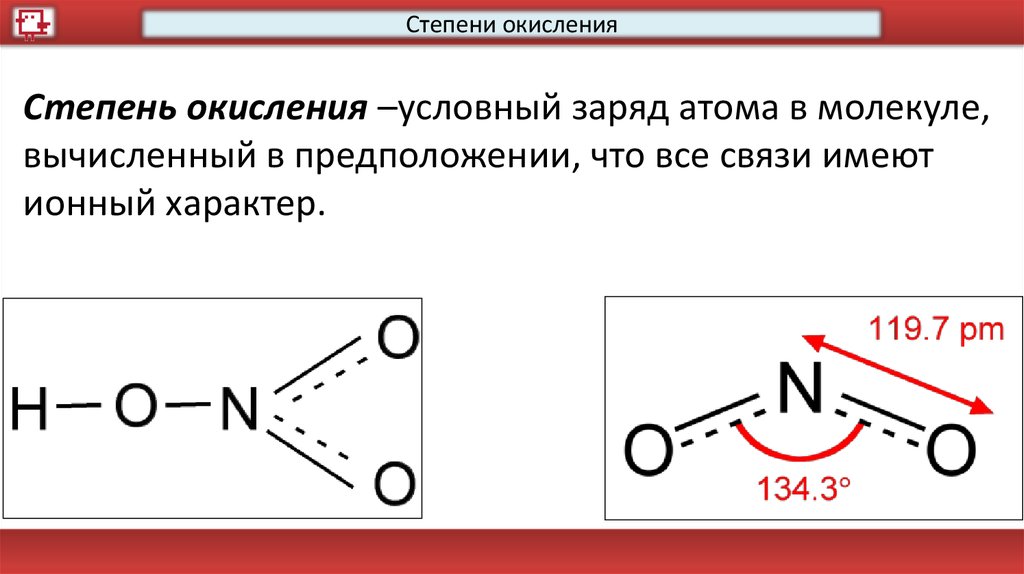
Степени окисленияСтепень окисления –условный заряд атома в молекуле,
вычисленный в предположении, что все связи имеют
ионный характер.
16.
Азот17.
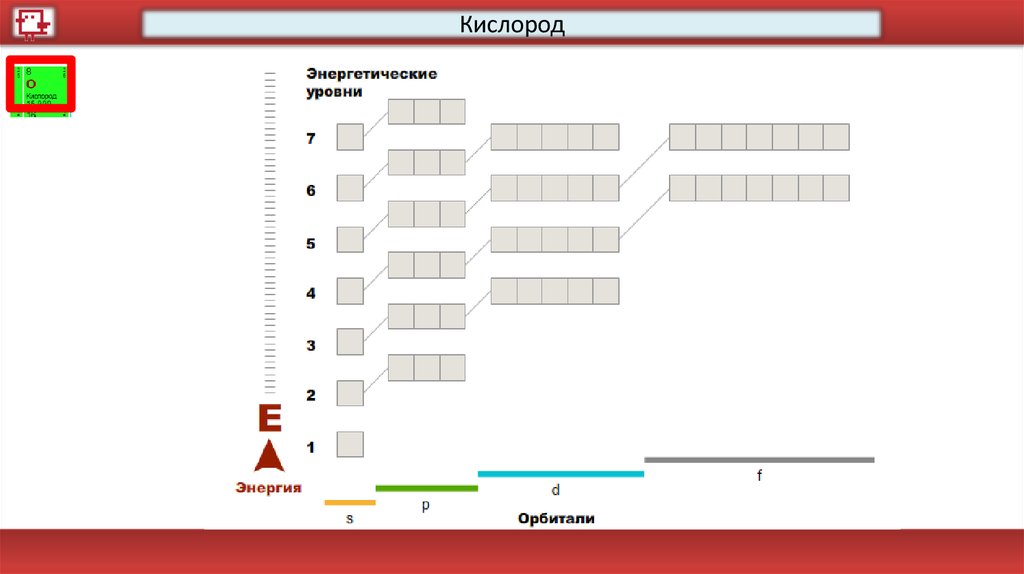
Кислород18.
КислородКоличество электронов на
внешнем уровне - 6
Радиус - 92 пм
Валентность – 2
Х.с.:
2H2+ O2 = 2H2O
Ф.с. – газ без цвета, вкуса и
запаха.
19.
Какое это соединение?20.
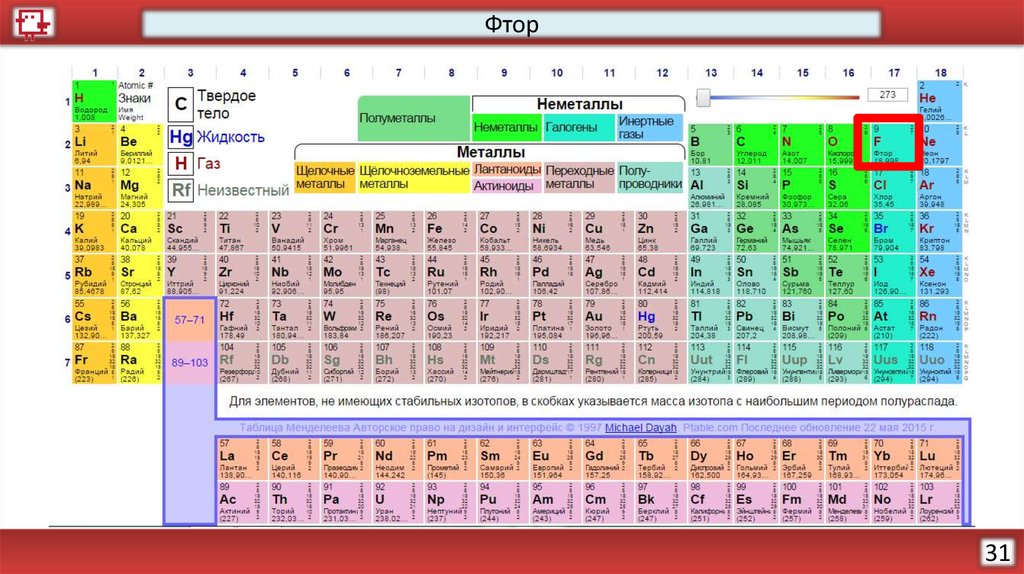
Фтор31
21.
Фтор32
22.
ФторКоличество электронов на
внешнем уровне - 7
Радиус - 73 пм
Валентность – 1
Х.с.:
H2 + F2 = 2HF
Xe + F2 = XeF2
Ф.с. – бесцветный газ
33
23.
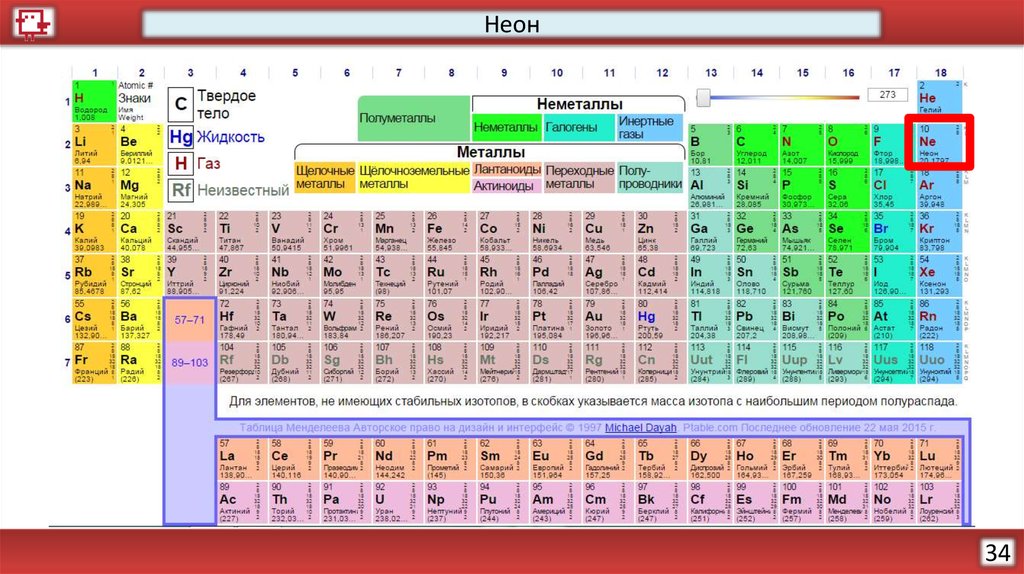
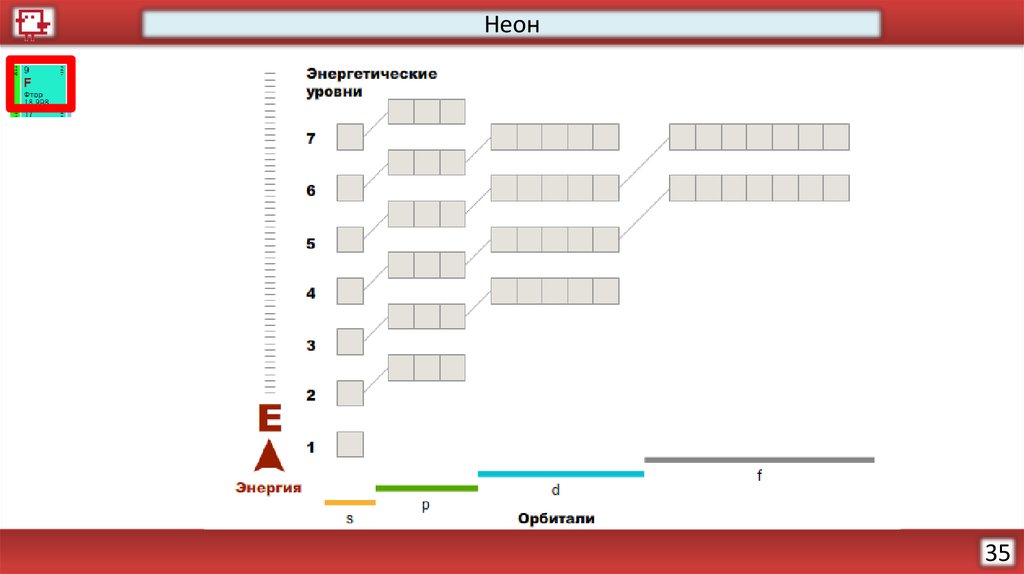
Неон34
24.
Неон35
25.
НеонКоличество электронов на
внешнем уровне - 8
Радиус – 38 (?) пм
Валентность – не образует
соединений
Х.с. - отсутствуют
Ф.с. – Инертный газ без цвета,
вкуса и запаха
36
26.
Неон37
27.
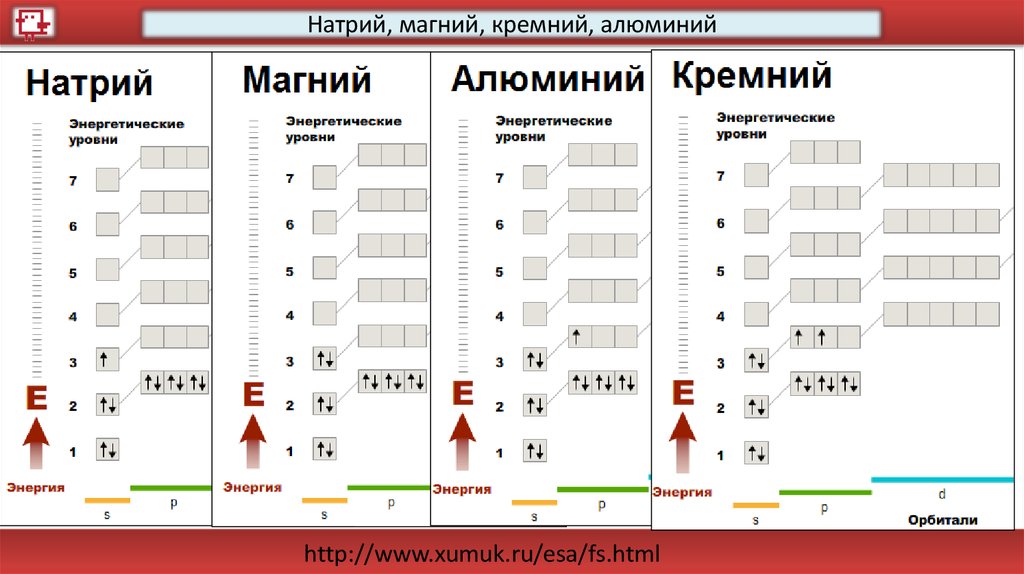
Натрий38
28.
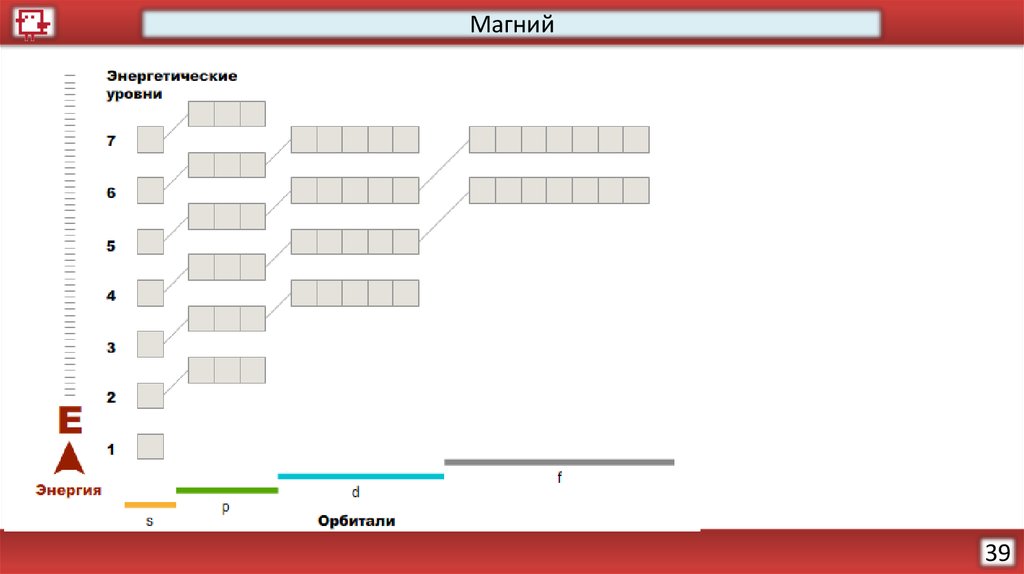
Магний39
29.
Алюминий40
30.
Кремний41
31.
Натрий, магний, кремний, алюминийhttp://www.xumuk.ru/esa/fs.html
32.
Урок 8 классаТипы химической связи.
33.
Натрий, магний, кремний, алюминийhttp://www.xumuk.ru/esa/fs.html
34.
Химическая связьХимическая связь — это взаимодействие атомов, обусловливающее
устойчивость молекулы или кристалла как целого. Химическая связь
определяется взаимодействием между заряженными частицами (ядрами и
электронами)
Принадлежность элементов к металлам и неметаллам определяется их
способностью отдавать или присоединять электроны при химических реакциях
Начало периода
Металлы, легко отдают
валентные электроны.
Середина периода
Элементы, атомы
которых труднее
отдают валентные
электроны.
Конец периода
Элементы, атомы
кторых энергично
присоединяют
валентные электроны.
35.
Химическая связьНаиболее сильными металлическими свойствами
обладают те элементы, атомы которых легко отдают
электроны.
Наоборот, неметаллические свойства особенно выражены
у тех элементов, атомы которых энергично присоединяют
электроны.
36.
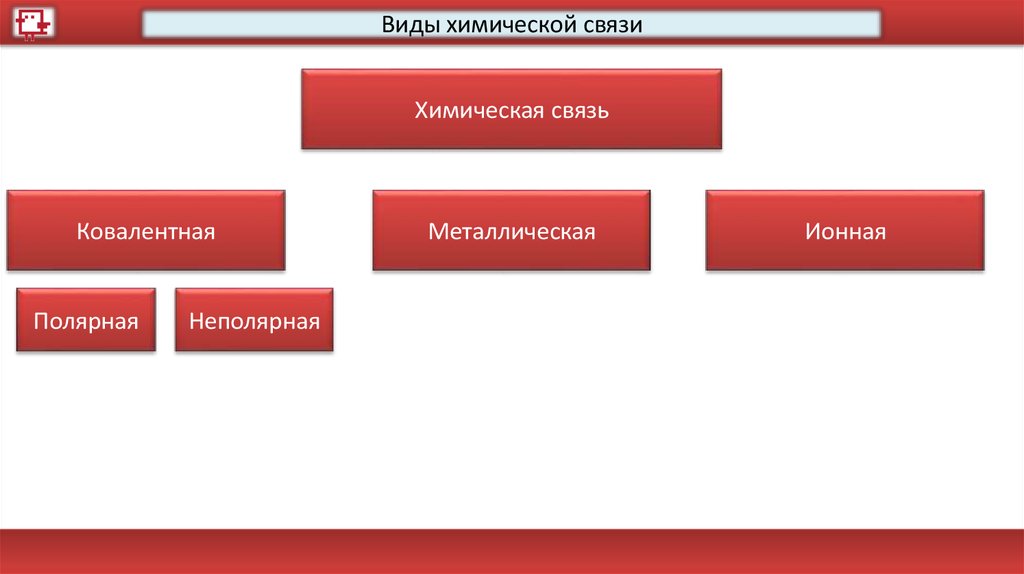
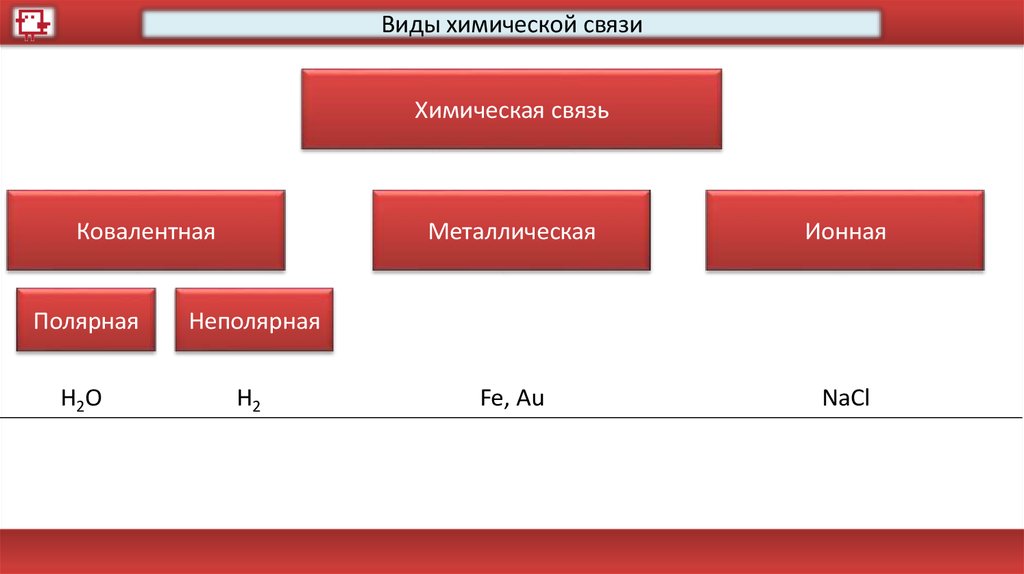
Виды химической связиХимическая связь
Ковалентная
Полярная
Неполярная
Металлическая
Ионная
37.
Виды химической связиХимическая связь
Ковалентная
Полярная
Неполярная
H2O
H2
Металлическая
Ионная
Fe, Au
NaCl
38.
Виды химической связиХимическая связь
Ковалентная
Чем они
отличаются?
Полярная
Неполярная
H2O
H2
Металлическая
Ионная
Fe, Au
NaCl
39.
ЭлектроотрицательностьЭлектроотрицательность – свойство атомов данного
элемента оттягивать на себя электроны от атомов других
элементов в соединениях.
40.
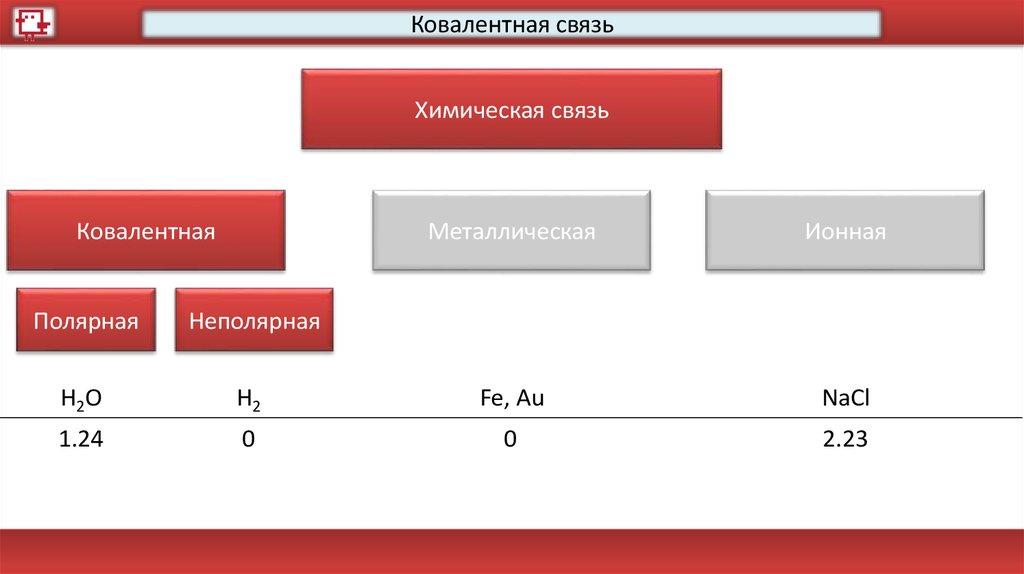
Виды химической связиХимическая связь
Ковалентная
Металлическая
Ионная
Полярная
Неполярная
H2O
H2
Fe, Au
NaCl
1.24
0
0
2.23
41.
Ковалентная связьХимическая связь
Ковалентная
Металлическая
Ионная
Полярная
Неполярная
H2O
H2
Fe, Au
NaCl
1.24
0
0
2.23
42.
Ковалентная связьКовалентная связь – это связь, образующуюся между атомами с
одинаковой или близкой электроотрицательностью.
В слове «ковалентный» приставка «ко» означает «совместное
участие», а «валентный» - способность.
H2, N2, O2, F2, Cl2
H2O, HCl
43.
Ковалентная связьПри образовании ковалентной связи атомы объединяют свои
электроны в общую орбиталь, которая формируется из атомных
оболочек отдельных атомов.
Эта новая оболочка содержит по возможности завершённое
число электронов и заменяет атомам их собственные
незавершённые атомные оболочки.
44.
Ковалентная связьN N
45.
Ковалентная связьO O
46.
Ковалентная связьH H
47.
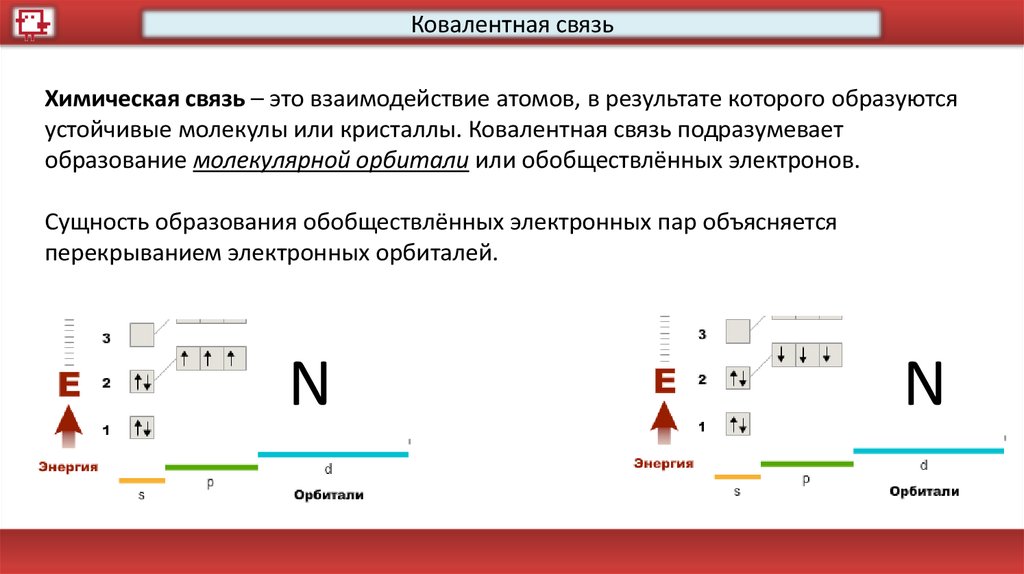
Ковалентная связьХимическая связь – это взаимодействие атомов, в результате которого образуются
устойчивые молекулы или кристаллы. Ковалентная связь подразумевает
образование молекулярной орбитали или обобществлённых электронов.
Сущность образования обобществлённых электронных пар объясняется
перекрыванием электронных орбиталей.
N
N
48.
Ковалентная связьХимическая связь – это взаимодействие атомов, в результате которого образуются
устойчивые молекулы или кристаллы. Ковалентная связь подразумевает
образование молекулярной орбитали или обобществлённых электронов.
Сущность образования обобществлённых электронных пар объясняется
перекрыванием электронных орбиталей.
N
N
49.
Ковалентная связьВспоминаем, что означают буквы s, p, d
50.
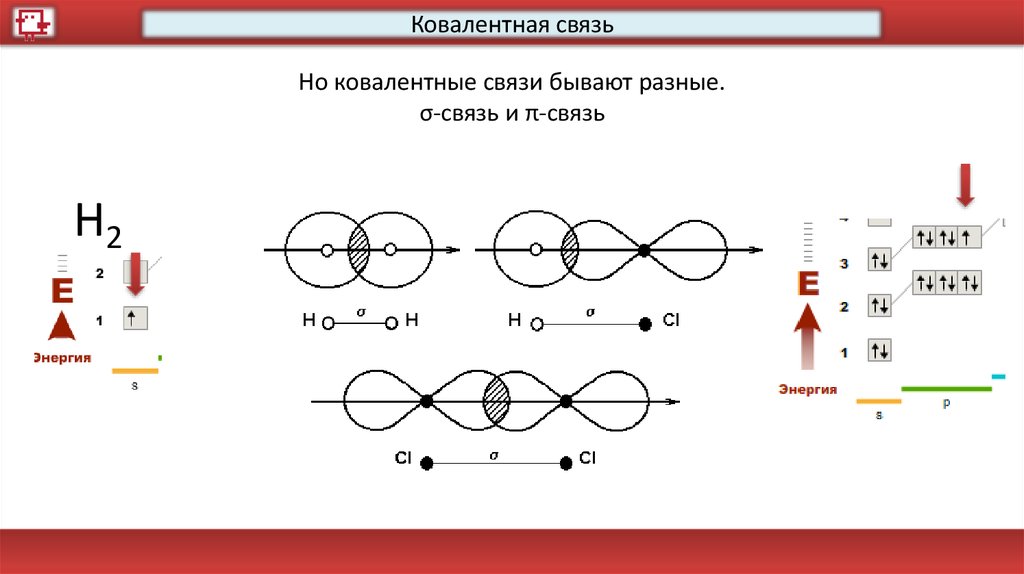
Ковалентная связьНо ковалентные связи бывают разные.
σ-связь и π-связь
Н2
51.
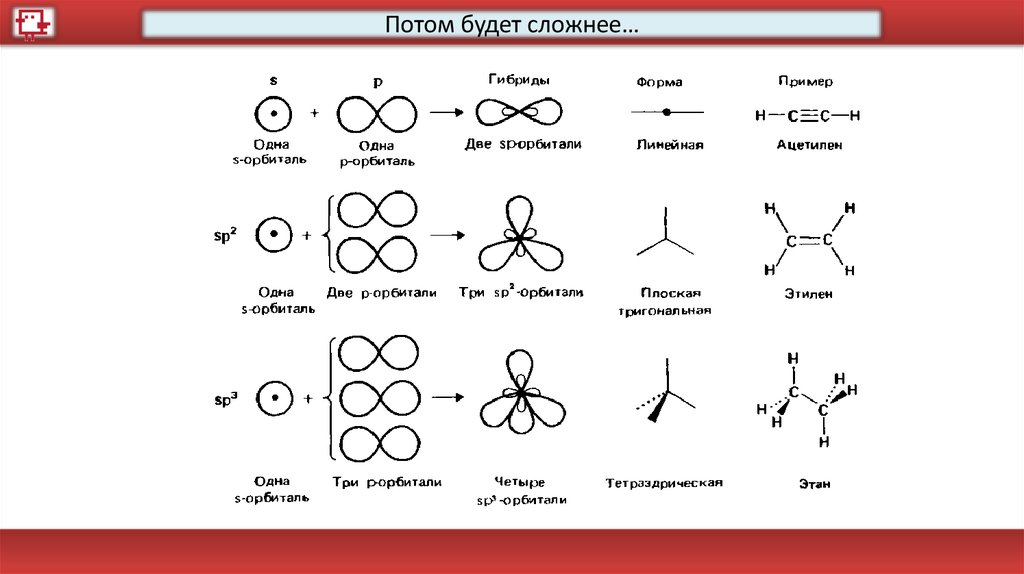
Потом будет сложнее…52.
Полярная и неполярная…Ковалентную химическую связь, которая образуется
между атомами с одинаковой
электроотрицательностью, называют ковалентной
неполярной связью. N2, H2, Cl2.
Химическую связь, образованную атомами,
электроотрицательности которых отличаются, но
незначительно, называют ковалентной полярной
связью. HCl, H2O, CH4.
53.
ВалентностьВалентность – способность атомов химических элементов
вступать в химические соединения с атомами других
элементов.
Другими словами, это способность атома образовывать
определенное число химических связей с другими атомами.
54.
Ковалентная связьХимическая связь
Ковалентная
Металлическая
Ионная
H2O
H2
Fe, Au
NaCl
1.24
0
0
2.23
55.
Ионная связь.Ионы – это заряженные частицы, в которые
превращаются атомы в результате отдачи или
присоединения электронов.
e-, p+, H+, (OH)-, Na+, Ca2+, (NO3)-
56.
Ионная связь.Ионная связь образуется при взаимодействии
атомов
элементов,
электроотрицательности
которых резко различаются.
Электроны почти полностью переходят от одного
атома к другому.
+
Na
e
Cl
Na F
57.
Ионная связь.Ионная связь образуется при взаимодействии
атомов
элементов,
электроотрицательности
которых резко различаются.
Электроны почти полностью переходят от одного
атома к другому.
+
Na
e
Cl
Na F
58.
Ионная связь.Химическую связь, возникающую между ионами в
результате действия электростатических сил
притяжения, называют ионной связью.
NaCl, KF, LiCl.
+
Na
e
Cl
Na F
59.
Степени окисленияСтепень окисления –условный заряд атома в
молекуле, вычисленный в предположении, что все
связи имеют ионный характер.
электроотрицательность элементов влияет на
распределение электронов между
взаимодействующими атомами.
60.
Ковалентная связьХимическая связь
Ковалентная
Металлическая
Ионная
H2O
H2
Fe, Au
NaCl
1.24
0
0
2.23
61.
Металлическая связьМеталлическая связь — химическая связь между
атомами в металлическом кристалле, возникающая
за счёт обобществления их валентных электронов.
В узлах кристаллической решётки расположены положительные ионы
металла. Между ними беспорядочно, подобно молекулам газа, движутся
электроны проводимости, происходящие из атомов металлов при
образовании ионов. Эти электроны играют роль «цемента», удерживая
вместе положительные ионы; в противном случае решётка распалась бы
под действием сил отталкивания между ионами.











































 chemistry
chemistry








