Similar presentations:
КРЕМНИЙ
1. Кремний и его соединения
2.
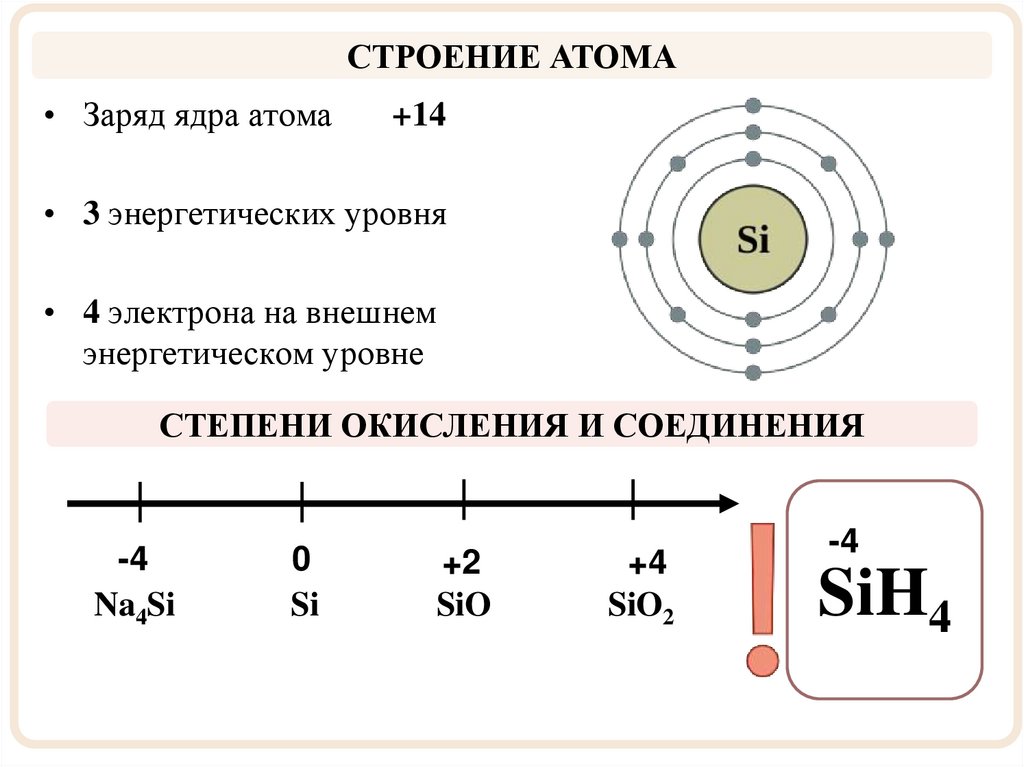
СТРОЕНИЕ АТОМА• Заряд ядра атома
+14
• 3 энергетических уровня
• 4 электрона на внешнем
энергетическом уровне
СТЕПЕНИ ОКИСЛЕНИЯ И СОЕДИНЕНИЯ
-4
Na4Si
0
Si
+2
SiO
+4
SiO2
-4
SiH4
3.
ФИЗИЧЕСКИЕ СВОЙСТВАПростое вещество кремний – кристалл темно-серого цвета с
металлическим блеском, довольно хрупок.
Температура плавления 1415 °C
Плотность 2,33 г/см3
Полупроводник.
4.
ПОЛУЧЕНИЕ КРЕМНИЯВ промышленности
• Сплавление угля с песком
2C + SiO2 Si + 2CO
В лаборатории
• Взаимодействие магния и песка
2Mg + SiO2 Si + 2MgO
5.
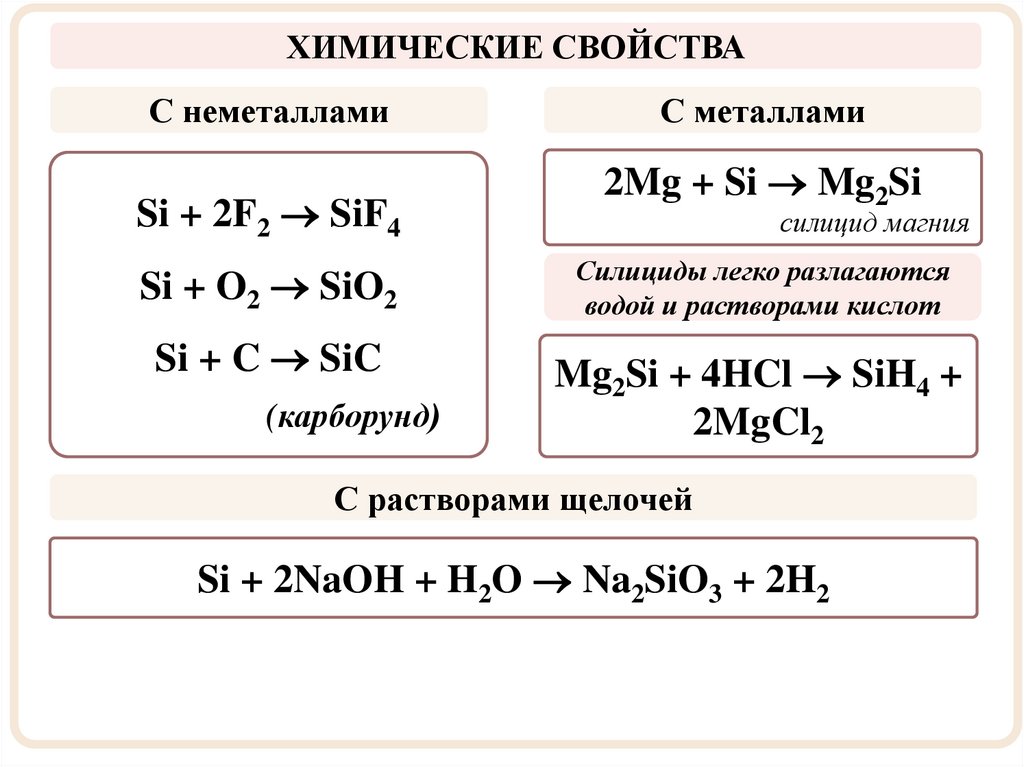
ХИМИЧЕСКИЕ СВОЙСТВАС неметаллами
Si + 2F2 SiF4
Si + O2 SiO2
Si + C SiC
(карборунд)
С металлами
2Mg + Si Mg2Si
силицид магния
Силициды легко разлагаются
водой и растворами кислот
Mg2Si + 4HCl SiH4 +
2MgCl2
С растворами щелочей
Si + 2NaOH + H2O Na2SiO3 + 2H2
6.
СОЕДИНЕНИЯ КРЕМНИЯОксид кремния, кварц, песок
SiO2
Твердое, нерастворимое в воде
вещество
ХИМИЧЕСКИЕ СВОЙСТВА
Оксид кремния - КИСЛОТНЫЙ
со щелочами:
SiO2 + 2NaOH Na2SiO3 + H2O
с основными оксидами:
SiO2 + CaO CaSiO3
C карбонатами:
SiO2 + CaCO3 CaSiO3 + CO2
7.
СОЕДИНЕНИЯ КРЕМНИЯКремниевая кислота
H2SiO3
Твердое, нерастворимое в воде
вещество
ХИМИЧЕСКИЕ СВОЙСТВА
Слабая кислота
реагирует только с сильными основаниями и их оксидами:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
При нагревании кремниевая кислота разлагается на оксид и
воду:
H2SiO3 → SiO2 + H2O
8.
СОЕДИНЕНИЯ КРЕМНИЯСоли кремниевой кислоты - силикаты
SiO32-
Большинство силикатов нерастворимо в воде, кроме
силикатов натрия и калия, их называют «жидким
стеклом».
ХИМИЧЕСКИЕ СВОЙСТВА
Типичные соли, вступают в реакции
ионного обмена
9.
ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КРЕМНИЯ1. Электроника:
Полупроводники
Солнечные батареи
2. Металлургия:
Легирование сплавов
Ферросилиций
3. Химическая промышленность:
Силиконы
Силикаты (стекло, керамика)
4. Строительство:
Стекло
Огнеупоры.
5. Медицина:
Имплантаты, косметика.
6. Энергетика:
Солнечные панели.







 chemistry
chemistry








