Similar presentations:
8-3-8 ков байл (3)
1. Ковалентті байланыс.
Оқу бағдарламасына сәйкес оқу мақсаты8.1.4.1 -электртерістілік ұғымы негізінде
атомдар арасындағы ковалентті
байланыстың түзілуін түсіндіру
ProPowerPoint.Ru
2.
Сенерекшесің
Мен үшін жақсы
мұғалім бәрінен
де артық,
өйткені мұғалім
— мектептің
жүрегі.
Ыбырай
Алтынсарин
Сен батыл
әрі
ержүрексің
Сенің
қолыңнан
бәрі
келеді
Айналаңа
нұр шаша
біл
Ата -анаңа
қамқор бол
Адамға тіл,
құлақ қандай
керек болса...
білім де сондай
керек.
Ахмет
Байтұрсынұлы
Сенің
болашағыңа
сенемін
3.
Сен өтеақкөңіл
жансың
Балам —
сенің
болашағың,
оны жарқын
ет!
Арманыңнан
ешқашан
бастартпа
Әр күнің
жаңа
мүмкіндікк
е толы
болсын
Еңбегің
елеусіз
қалмайды,с
ен оған
лайықсыңІ
Жеңістерің
көп,жолың
ашық
болсын!
Сенім мен
табандылық
жеңістің
кілті
Мен саған
сенемінІ
4.
21
1
1
2
2
1
2
2
1
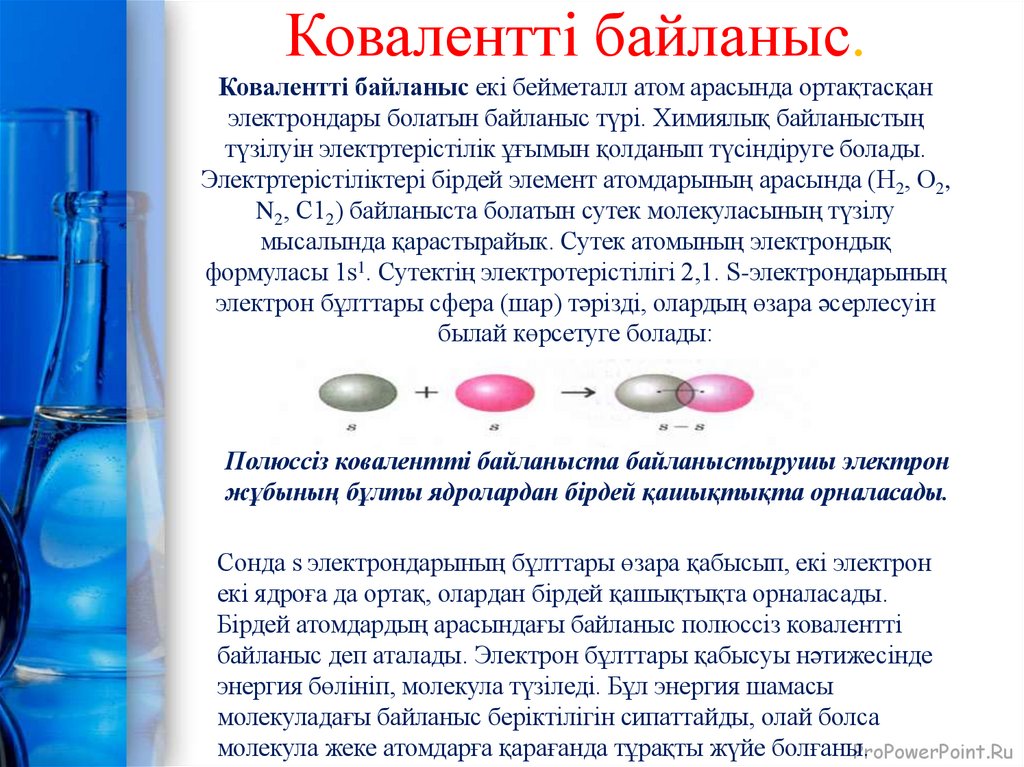
5. Ковалентті байланыс. Ковалентті байланыс екі бейметалл атом арасында ортақтасқан электрондары болатын байланыс түрі. Химиялық
Ковалентті байланыс.Ковалентті байланыс екі бейметалл атом арасында ортақтасқан
электрондары болатын байланыс түрі. Химиялық байланыстың
түзілуін электртерістілік ұғымын қолданып түсіндіруге болады.
Электртерістіліктері бірдей элемент атомдарының арасында (Н2, О2,
N2, С12) байланыста болатын сутек молекуласының түзілу
мысалында қарастырайык. Сутек атомының электрондық
формуласы 1s1. Сутектің электротерістілігі 2,1. S-электрондарының
электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін
былай көрсетуге болады:
Полюссіз ковалентті байланыста байланыстырушы электрон
жұбының бұлты ядролардан бірдей қашықтықта орналасады.
Cонда s электрондарының бұлттары өзара қабысып, екі электрон
екі ядроға да ортақ, олардан бірдей қашықтықта орналасады.
Бірдей атомдардың арасындағы байланыс полюссіз ковалентті
байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде
энергия бөлініп, молекула түзіледі. Бұл энергия шамасы
молекуладағы байланыс беріктілігін сипаттайды, олай болса
молекула жеке атомдарға қарағанда тұрақты жүйе болғаны.
ProPowerPoint.Ru
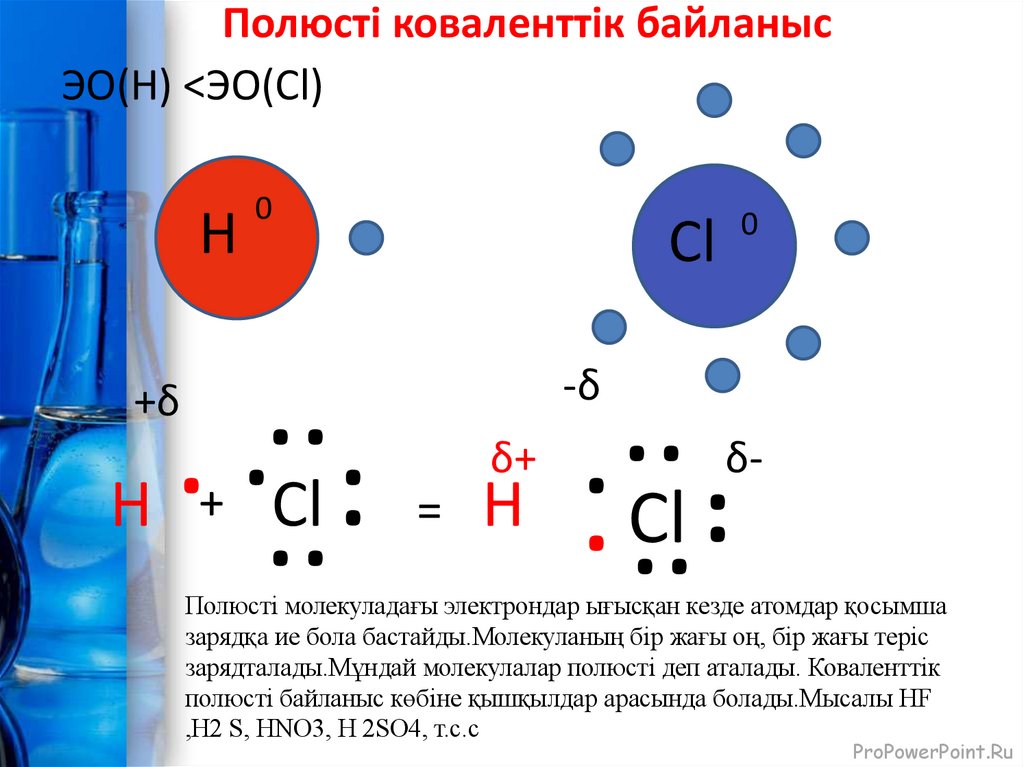
6. Полюсті коваленттік байланыс
ЭО(Н) <ЭО(Cl)H
0
..
.
.
.
Н
Cl .
..
Сl
..
.
Н . Cl .
.
..
-δ
+δ
+
0
δ+
=
δ-
Полюсті молекуладағы электрондар ығысқан кезде атомдар қосымша
зарядқа ие бола бастайды.Молекуланың бір жағы оң, бір жағы теріс
зарядталады.Мұндай молекулалар полюсті деп аталады. Коваленттік
полюсті байланыс көбіне қышқылдар арасында болады.Мысалы HF
,H2 S, HNO3, H 2SO4, т.с.с
ProPowerPoint.Ru
7.
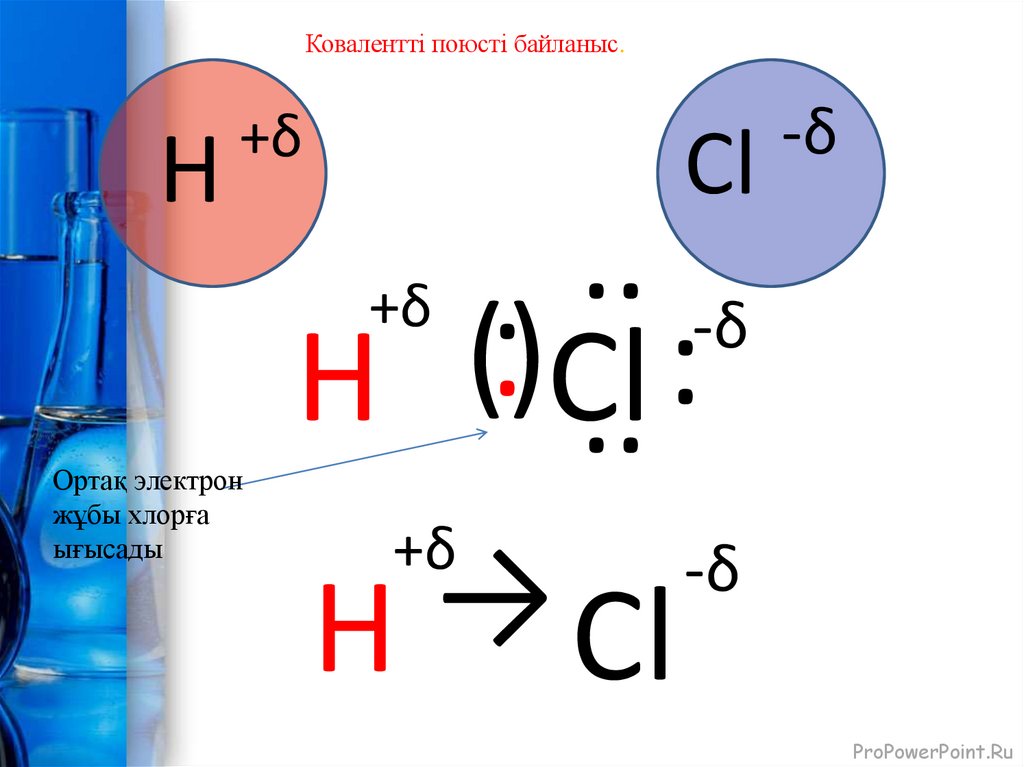
Ковалентті поюсті байланыс.H
+δ
Ортақ электрон
жұбы хлорға
ығысады
Cl
-δ
..
+δ .
-δ
.
(
.
)
.
H Cl
..
+δ
-δ
→
H Cl
ProPowerPoint.Ru
8.
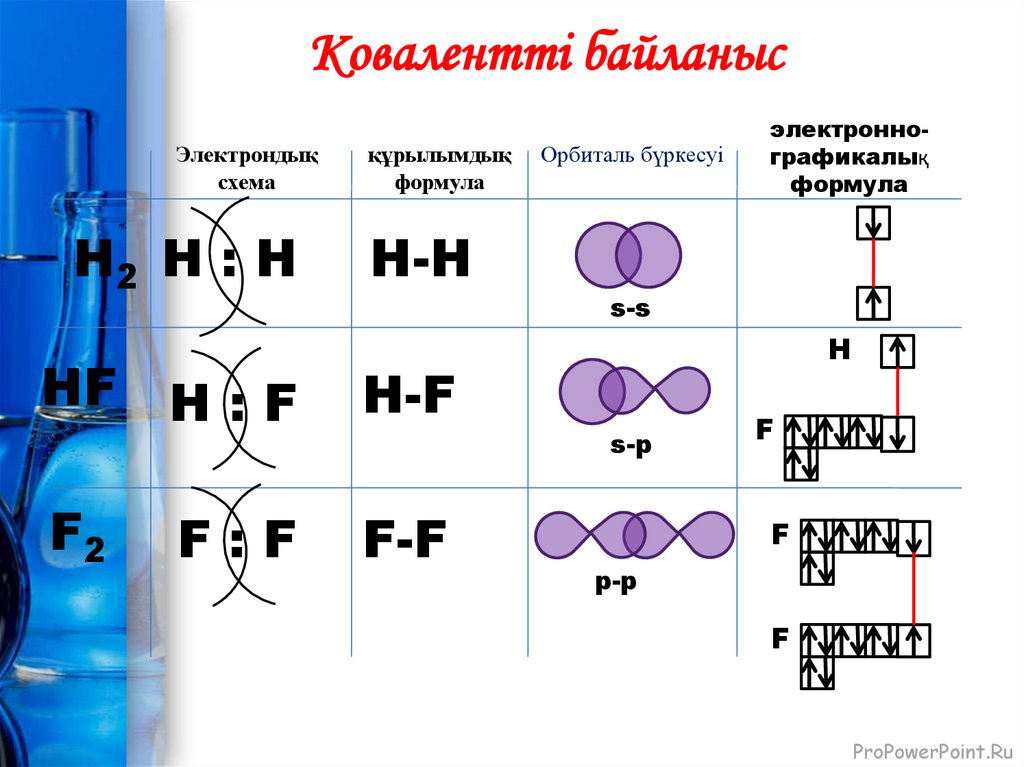
Ковалентті байланысЭлектрондық
схема
Н2 Н : Н
құрылымдық
формула
Н-H
s-s
НF Н : F
Н-F
F2
F-F
F:F
Орбиталь бүркесуі
электроннографикалық
формула
H
s-p
F
F
p-p
F
ProPowerPoint.Ru
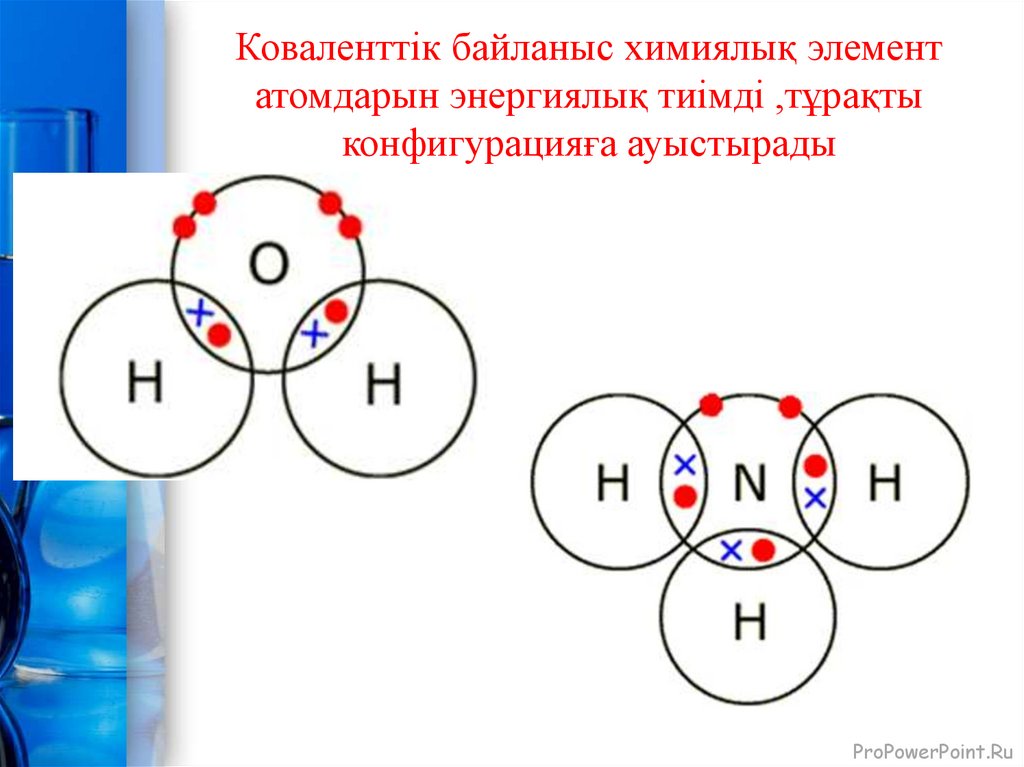
9. Коваленттік байланыс химиялық элемент атомдарын энергиялық тиімді ,тұрақты конфигурацияға ауыстырады
ProPowerPoint.Ru10. Ковалентті байланыс.
Донорлы-акцепторлы механизм бойынша түзілетінқосылыс комплексті (кешенді) қосылыстар деп аталады.
Орталық атомды комплекс түзуші (N атомы) немесе кешентүзуші, ал
оның жанына шоғырланған атомды лигандтар (Н+) деп атайды.
Кешентүзуші мен лигандтар бірігіп ішкі сфераны түзеді.
Коваленттік байланыс түзілу барысында атомдарда ортақ жұп түзу үшін
жалқы электрондар
әрбір атомда болуы шарт емес. Байланысқа
қатынасушы бір атомда электрондар жұбы болса, екіншісінде сол
электрондар орналаса алатындай бос орын, яғни деңгейше болса, олар
өзара бір-бірімен донорлы-акцепторлы байланыс түзеді. Электрон жұбы
бар атом не бөлшек донор, ал бос деңгейшесі бар атом не бөлшек
акцептор деп аталынады. Мысалы, аммиак пен хлорлы сутек арасындағы
қосылу реакциясы:
ProPowerPoint.Ru
11. Жұптық жұмыс тапсырмасы: Берілген заттардың ішінен ковалентті полюсті байланысатын заттарды тауып, «нүктелер мен айқыштар»
диаграммасы арқылытүсіндіру.
N2 , NH3, H2, KF
CO2, NH3, H2O, НCl
N2, H2, F2, C
Na, H2, HF, CaCO3
Дескриптор
коваленттік байланыстың
"нүктелер мен айқыштар"
диаграммасын сала біледі1балл
қос және үш еселі
байланыстың түзілуін
түсінеді-1 балл
ковалентті байланыстың
қасиеттерін сипаттайды-1
балл
ProPowerPoint.Ru
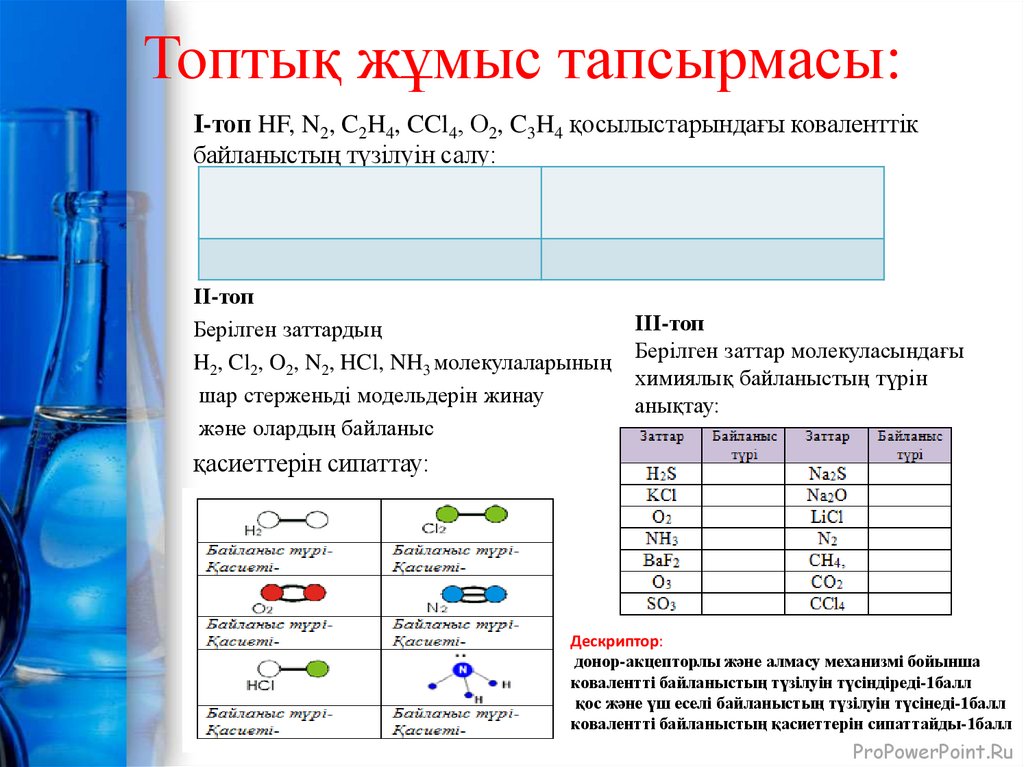
12. Топтық жұмыс тапсырмасы:
І-топ HF, N2, C2H4, CCl4, О2, C3H4 қосылыстарындағы коваленттікбайланыстың түзілуін салу:
ІІ-топ
Берілген заттардың
H2, Cl2, O2, N2, HCl, NH3 молекулаларының
шар стерженьді модельдерін жинау
және олардың байланыс
ІІІ-топ
Берілген заттар молекуласындағы
химиялық байланыстың түрін
анықтау:
қасиеттерін сипаттау:
Дескриптор:
донор-акцепторлы және алмасу механизмі бойынша
ковалентті байланыстың түзілуін түсіндіреді-1балл
қос және үш еселі байланыстың түзілуін түсінеді-1балл
ковалентті байланыстың қасиеттерін сипаттайды-1балл
ProPowerPoint.Ru
13. Жеке жұмыс тапсырмасы:
1.Химиялық байланыс түзуге қандай электрондарқатысады және неге?
2.Cl2,
H2,
HCl,
NH3
молекулаларындағы
байланыстың түзілуін ескере келе О2, N2
молекулаларында байланыстың түзілуін салу:
Дескриптор:
донор-акцепторлы және алмасу механизмі бойынша ковалентті
байланыстың түзілуін түсіндіреді-1балл
қос және үш еселі байланыстың түзілуін түсінеді-1балл
ProPowerPoint.Ru
14.
Сабақтытүсінбедім!
134579
12
11
18
682
10
13
15
17
30
14
16
23
20
19
22
21
24
26
25
27
28
29
79
5
4
3
12
11
18
8
6
10
13
15
17
30
21
14
16
23
20
19
22
21
24
26
25
27
28
29
734518629
12
11
18
10
13
15
17
30
14
16
23
20
19
22
21
24
26
25
27
28
29