Similar presentations:
Лекция Термодинамика. Кинетика. Поверхностные явления
1.
Медик без довольногопознания химии
совершенен быть не
может…»
«
М.В.Ломоносов
2.
Отличительная чертасовременной медицины –
активное внедрение
достижений химии в
теорию и практику
исследования функций
живого организма
3. Химия – фундамент для изучения
• биологической химии;• физиологии;
• гистологии;
• фармакологии;
• санитарии и гигиены;
• анестезиологии и др.
4. Лекция №1
Процессы, происходящиев живом организме –
физико-химическая
интерпретация
5. ЦЕЛЬ ЛЕКЦИИ:
Показать применение основныхпонятий и законов химической
термодинамики и химической кинетики
для изучения закономерностей
протекания биохимических процессов в
организме. Охарактеризовать
особенности состояния поверхностного
слоя и значение поверхностных
явлений для медицины и биологии
6. ПЛАН ЛЕКЦИИ:
1.2.
3.
4.
Человек как термодинамическая система.
Особенности живых организмов как
термодинамических систем. Принцип
Пригожина
Применение основных понятий химической
термодинамики в биохимии.
Катализ в живых организмах. Ферменты как
катализаторы биохимических процессов.
Особенности кинетики ферментативных
реакций.
Поверхностные явления. Основы
хроматографии и ее применение в медикобиологических исследованиях.
7. Процессы обмена веществ и энергии – самые характерные признаки жизни
В живых организмах энергияхимических реакций превращается в
другие формы энергии
– Механическую (механическое сокращение
мышц)
– Электрическую (изменение потенциалов на
клеточных мембранах нервных клеток)
– Тепловую (поддержание теплового баланса
организма) и т.д.
8. Термодинамика
изучает законы, которые описываютэнергетические превращения,
сопровождающие физические,
химические и биологические процессы
9. Термодинамическая система –
это тело или совокупностьвзаимодействующих между
собой тел, которые
отделены от окружающей
среды реальными или
воображаемыми границами.
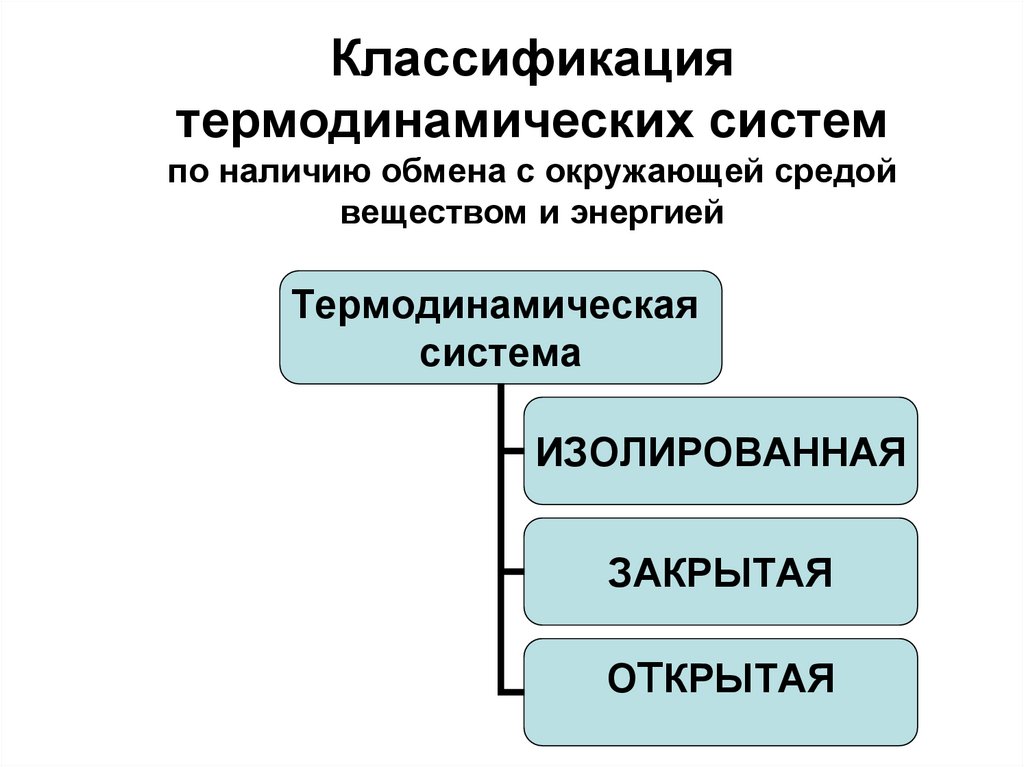
10. Классификация термодинамических систем по наличию обмена с окружающей средой веществом и энергией
Термодинамическаясистема
ИЗОЛИРОВАННАЯ
ЗАКРЫТАЯ
ОтКРЫТАЯ
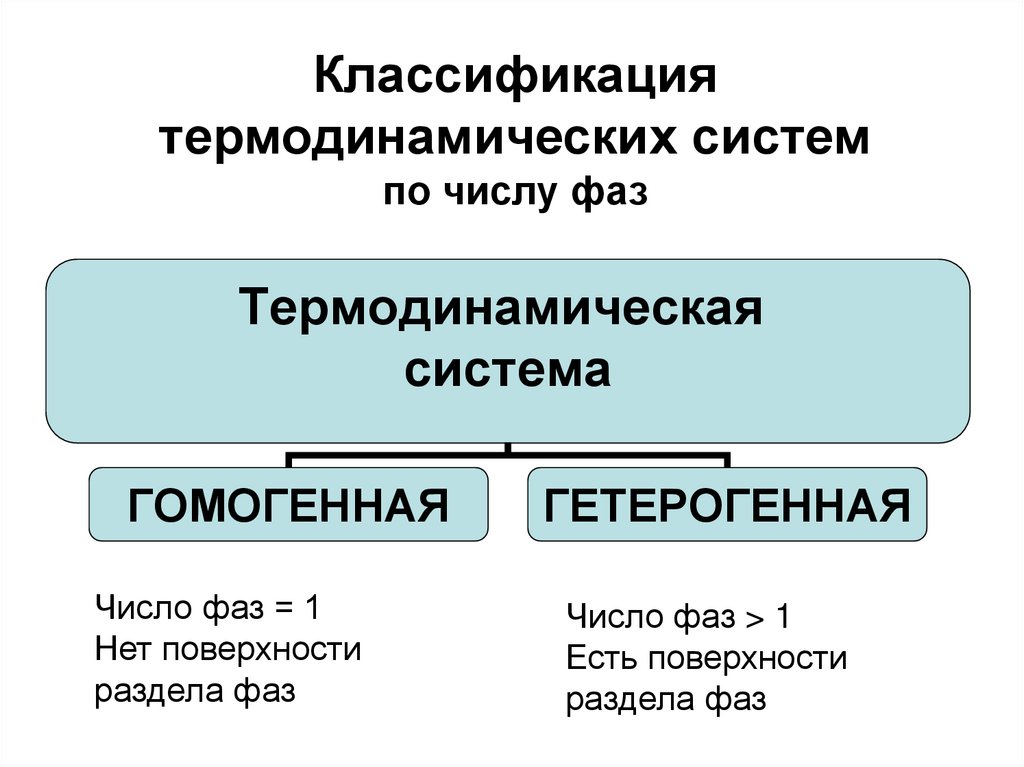
11. Классификация термодинамических систем по числу фаз
Термодинамическаясистема
ГОМОГЕННАЯ
Число фаз = 1
Нет поверхности
раздела фаз
ГЕТЕРОГЕННАЯ
Число фаз > 1
Есть поверхности
раздела фаз
12. Термодинамические параметры – это физические величины, характеризующие состояние термодинамической системы: масса (m),
количество вещества (n),температура (Т), давление (р), объем (V),
концентрация (С), и др.
Термодинамический процесс –
это переход системы из одного
состояния в другое, сопровождающийся
необратимым или обратимым
изменением хотя бы одного параметра,
характеризующего данную систему
13. Термодинамический процесс:
• изотермический (T = const);• изобарный (р = const);
• изохорный (V = const).
14. Организм человека как термодинамическая система:
• Открытая, так как происходит обмен массой иэнергией;
• Гетерогенная, так как она неравномерна по
составу и свойствам;
• Находится в стационарном состоянии, так как
характеризуется постоянством параметров и
наличием потоков массы и энергии;
• Характеризуется протеканием изобарноизотермических процессов.
15. Организм человека за 40 лет в среднем потребляет
• 40 тонн воды• 6 тонн пищи
• 12 миллионов литров кислорода
16. Первое начало термодинамики - закон сохранения и превращения энергии (Р.Майер, 1842 г.; Д.Джоуль, 1842 г.; Г.Гельмгольц, 1847
Первое начало термодинамики закон сохранения и превращенияэнергии
(Р.Майер, 1842 г.; Д.Джоуль, 1842 г.;
Г.Гельмгольц, 1847 г.)
«При переходе термодинамической
системы из одного состояния в другое,
энергия не возникает ниоткуда и не
исчезает в никуда, а только
превращается из одного вида в другой в
строго эквивалентных количествах.»
Q = ∆U + A
17. История открытия первого начала термодинамики (Р.Майер )
• Наблюдение: венозная кровь жителей Явыболее светлая, чем у жителей Германии;
• Предположение: это обусловлено разным
количеством остаточного кислорода в крови,
т.е. жители теплых регионов потребляют
кислорода меньше, чем жители холодных
регионов;
• Вывод: теплота, выделяющаяся при
трансформации пищевых продуктов в
организме человека, расходуется на
поддержание постоянной температуры тела и
совершение мышечной работы.
18. Термохимия – это раздел химии, изучающий тепловые эффекты химических реакций
Термохимические уравнения –это уравнения химических реакций,
учитывающие тепловые эффекты:
Н2(г) + 1/2О2(г) = Н2О(ж), ∆Н = -258, 8 кДж;
Н2(г) + 1/2О2(г) = Н2О(ж) + 285, 8 кДж.
19. Экзотермические процессы
Эндотермическиепроцессы
• сопровождаются
выделением
энергии из
системы в
окружающую
среду;
•сопровождаются
поглощением
энергии системой из
окружающей среды;
• ∆H < 0 ;
• Q>0;
• ∆U < 0 .
•∆Н > 0;
•Q < 0;
•∆U > 0.
20. Закон Лавуазье-Лапласа:
«Теплота разложения какого-либохимического соединения равна по
абсолютной величине и
противоположна по знаку теплоте
его образования»
∆Нd = - ∆Нf
∆Нd + ∆Нf = 0
decomposition
formation
Н2(г) + 1/2О2(г) = Н2О(ж) + 285,8 кДж
Н2О(ж) = Н2(г) + 1/2О2(г) - 285,8 кДж
21. Закон Гесса:
«Тепловой эффект химическихреакций, протекающих при
постоянном давлении или при
постоянном объеме, не зависит от
числа промежуточных стадий, а
определяется лишь начальным и
конечным видом и состоянием
системы»
∆Н = ∆Н1 + ∆Н2
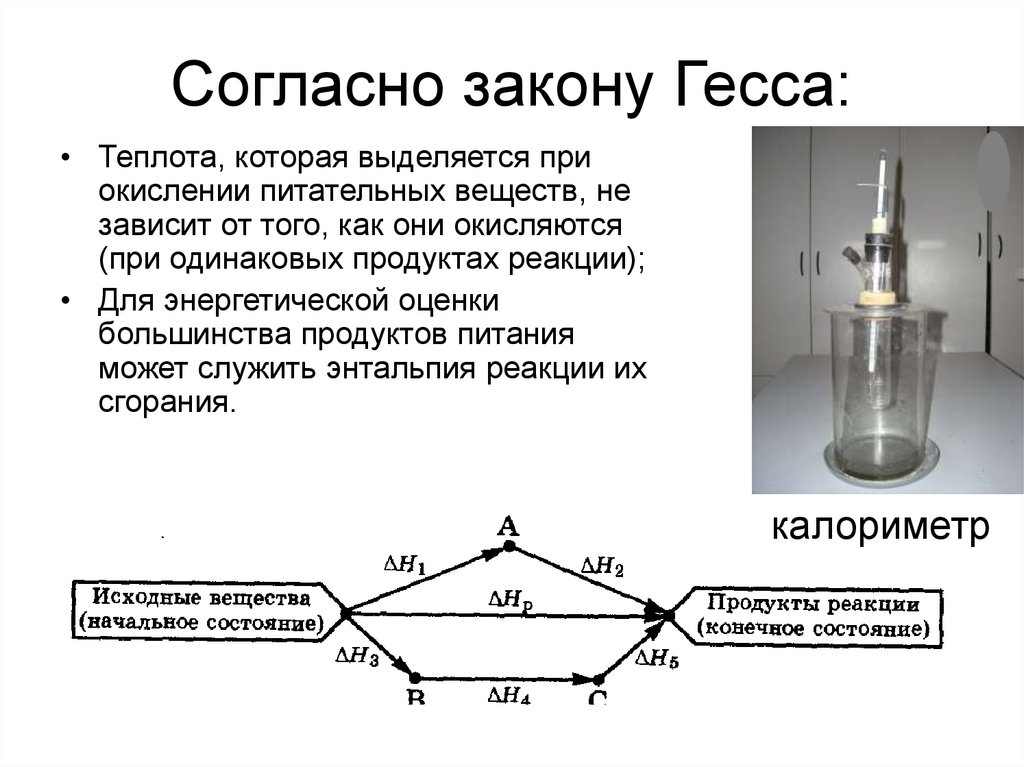
22. Согласно закону Гесса:
• Теплота, которая выделяется приокислении питательных веществ, не
зависит от того, как они окисляются
(при одинаковых продуктах реакции);
• Для энергетической оценки
большинства продуктов питания
может служить энтальпия реакции их
сгорания.
калориметр
23. Научная диетология
• Приводит в соответствие пищевойрацион человека его энергозатратам;
• Основана на законах термодинамики
(первое начало, закон Гесса и его
следствия);
• Учитывает химический состав
продуктов питания и энергетические
характеристики питательных веществ.
24.
25. Калорийность питательных веществ
это энергия,выделяемая при
полном окислении
(сгорании) 1 грамма
питательных
веществ
1 калория = 4,18 Дж
26. ПЛАН ЛЕКЦИИ:
1.2.
3.
4.
Человек как термодинамическая система.
Особенности живых организмов как
термодинамических систем. Принцип
Пригожина
Применение основных понятий химической
термодинамики в биохимии.
Катализ в живых организмах. Ферменты как
катализаторы биохимических процессов.
Особенности кинетики ферментативных
реакций.
Поверхностные явления. Основы
хроматографии и ее применение в медикобиологических исследованиях.
27. Второй закон термодинамики характеризует направленность самопроизвольно протекающего процесса
«Теплота самопроизвольно не может перейтиот менее нагретого тела к более нагретому.»
«В изолированных системах самопроизвольно
протекают те процессы, при которых система
переходит из менее вероятного состояния в
более вероятное.»
«В изолированных системах самопроизвольно
протекают процессы, в которых энтропия
системы увеличивается ΔS > 0.»
28. Термодинамический процесс
Самопроизвольный Несамопроизвольный• требует для своего
• не требует для
своего протекания протекания
затраты энергии
затраты энергии
извне
• пример: разделение
воздуха на
• пример: переход
составляющие
тепла от более
компоненты
нагретого тела к
менее нагретому
29. Причины самопроизвольного протекания процесса – стремление системы
• к минимуму внутренней энергии(энтальпия характеризует
теплосодержание системы => ΔН<0);
• к неупорядоченному состоянию,
которое более вероятно (энтропия
характеризует меру беспорядка в
системе => ΔS>0).
30. Объединенное выражение первого и второго законов термодинамики
∆G = ∆H - T∆SИзобарно-изотермический потенциал
(свободная энергия Гиббса) ΔG:
•термодинамическая функция состояния
системы;
•экстенсивная термодинамическая величина;
•количественная мера работы, которую система
может совершить.
31. Критерии самопроизвольного протекания термодинамических процессов:
• ∆G < 0, ∆ H < 0, ∆ S > 0 - процессидет самопроизвольно;
• ∆ G > 0, ∆ H > 0, ∆ S < 0 - процесс
самопроизвольно не идет;
• ∆ G = 0, ∆ H = Т∆S - состояние
термодинамического
равновесия.
32. Живая клетка
• Нуждается в энергии для своегосуществования
• Получает энергию за счет окисления
продуктов питания или использует солнечную
энергию
• Полученную энергию переводит в
химическую энергию за счет синтеза АТФ
• АТФ выполняет функцию аккумулятора
энергии
33. Макроэргическая связь
Это такая связь, при гидролизе которойвыделяется значительная энергия:
АТФ + Н2О → АДФ + Ф
ΔGореак= -30,5 кДж/моль
АТФ + Н2О → АМФ + Ф + Ф
ΔGореак= -61,0 кДж/моль
34. Классификация биохимических процессов по изменению изобарно-изотермического потенциала
Классификация биохимическихпроцессов по изменению изобарноизотермического потенциала
• Экзергонические процессы
сопровождаются уменьшением энергии
Гиббса (ΔG<0);
• Эндергонические процессы
сопровождаются увеличением энергии
Гиббса (ΔG>0);
35. Принцип энергетического сопряжения
энергия, необходимая дляпротекания эндергонической
реакции, поступает за счет
осуществления экзергонической
реакции
36. Принцип энергетического сопряжения
АТФ + Н2О → АДФ + Н3РО4(ΔGореак= - 29,2 кДж/моль)
Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О
(ΔGореак= + 13,1 кДж/моль)
Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ
(ΔGореак= - 29,2 + 13,1 = - 16,1 кДж/моль)
37. Принцип Пригожина (1946)
«В стационарнойтермодинамически открытой
системе скорость производства
энтропии в результате протекания
необратимых процессов имеет
минимальное для данных условий
положительное значение.»
∆Si / ∆z → 0
38. ПЛАН ЛЕКЦИИ:
1.2.
3.
4.
Человек как термодинамическая система.
Особенности живых организмов как
термодинамических систем. Принцип
Пригожина
Применение основных понятий химической
термодинамики в биохимии.
Катализ в живых организмах. Ферменты как
катализаторы биохимических процессов.
Особенности кинетики ферментативных
реакций.
Поверхностные явления. Основы
хроматографии и ее применение в медикобиологических исследованиях.
39. Химическая кинетика изучает:
•скорость химическихреакций;
•механизм протекания
реакций;
•зависимость скорости
реакции от различных
факторов.
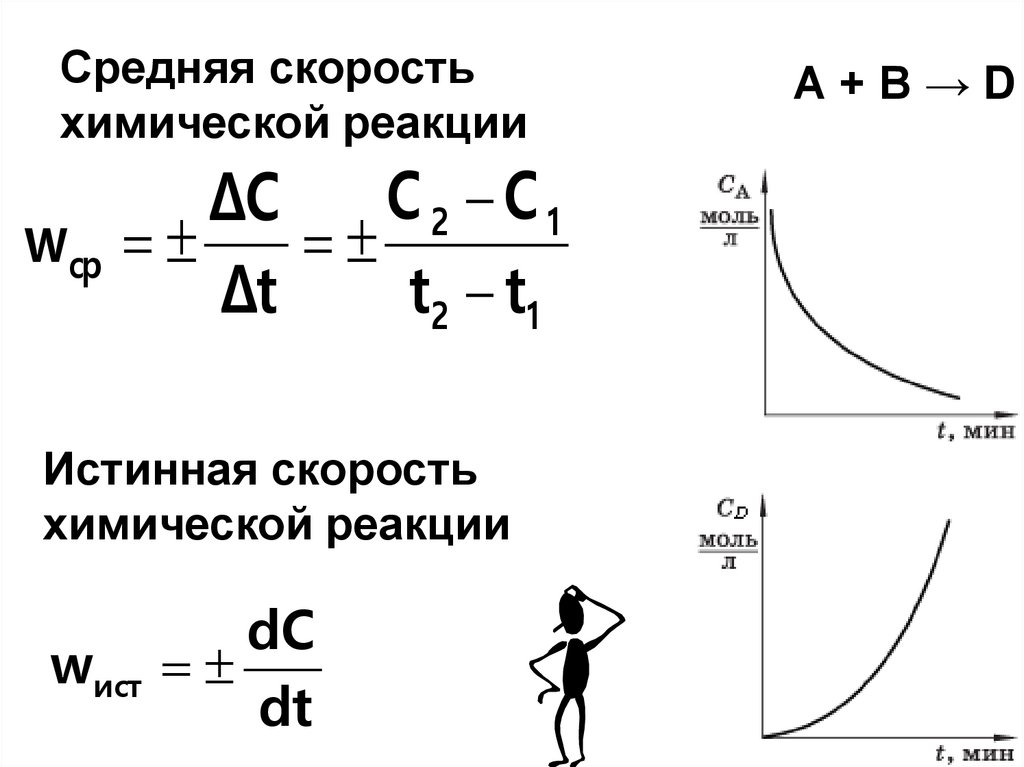
40. Средняя скорость химической реакции
C 2 C1ΔC
wср
Δt
t2 t1
Истинная скорость
химической реакции
dC
wист
dt
А+В→D
41. Факторы, влияющие на скорость химической реакции
• природа реагирующихвеществ;
• концентрация
реагирующих веществ;
• температура;
• катализатор.
42. Закон действующих масс:
«При постоянной температурескорость химической реакции в каждый
момент времени прямо
пропорциональна произведению
концентраций реагирующих веществ в
степенях, равных их
стехиометрическим коэффициентам.»
Для реакции
aA + bB ↔ dD + eE
Wпр = k1CAa ∙ CBb
Wобр = k2CDd ∙ CEe
43. Влияние температуры на скорость химической реакции (правило Вант-Гоффа):
«С увеличениемтемпературы на
каждые 10 градусов
скорость
химической
реакции
возрастает в
среднем в 2-4 раза.»
Якоб Хендрик Вант-Гофф
(1852-1911)
44. Уравнения Вант-Гоффа
wT wT2
( T2 T1 )
10
1
kT2 kT1
(T2 T1 )
10
T T
1
2
(T2 T1 )
10
45. Катализ-
Катализэто явлениеизменения скорости
химической реакции в
присутствии
катализатора.
46. Ферменты (энзимы) -
Ферменты (энзимы) • биологические катализаторы,ускоряющие химические реакции в живых
организмах;
• вещества белковой природы;
• известно более 2000 ферментов.
Субстрат –
соединение, на которое воздействует
данный фермент
47.
48. Основные особенности каталитического действия ферментов:
• исключительно высокаякаталитическая активность;
• специфичность действия к субстрату
и катализируемой реакции;
• сверхчувствительность к изменениям
рН среды и температуры;
• инактивация фермента.
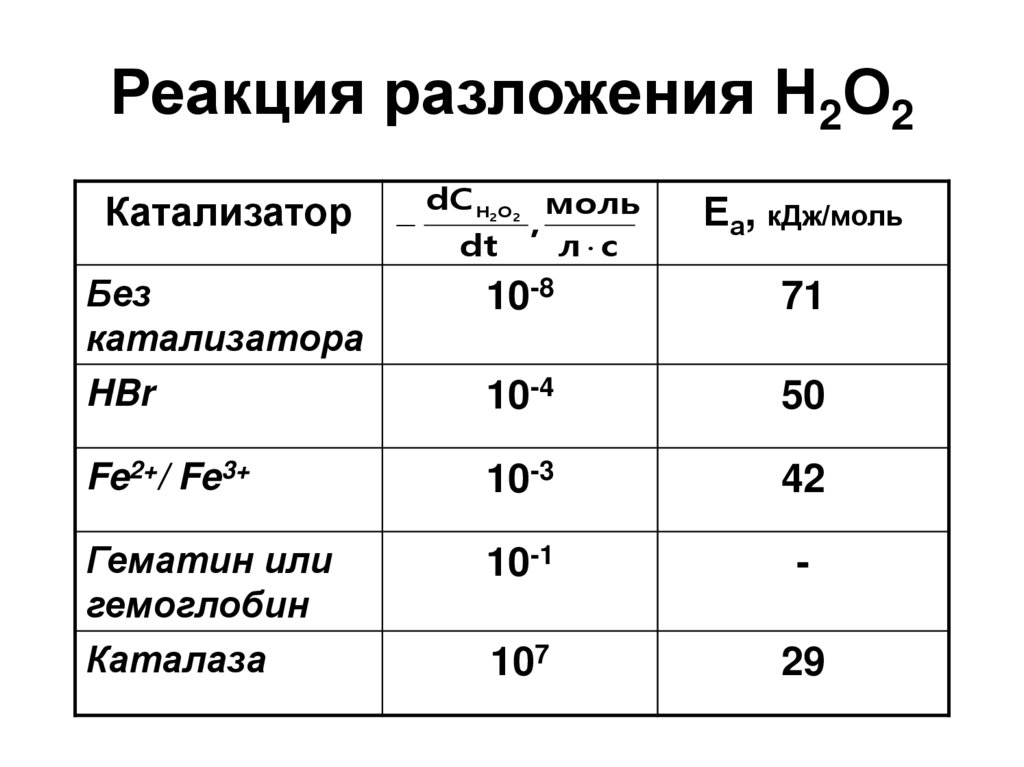
49. Реакция разложения Н2О2
КатализаторdC H O
2
dt
2
моль
,
л с
Еа, кДж/моль
Без
катализатора
HBr
10-8
71
10-4
50
Fe2+/ Fe3+
10-3
42
Гематин или
гемоглобин
Каталаза
10-1
-
107
29
50. Ферменты проявляют свою активность в условиях жизнедеятельности организма (в мягких условиях):
• невысокие температуры;• узкий интервал значений рН,
(обычно близкий к
нейтральному);
• постоянное давление.
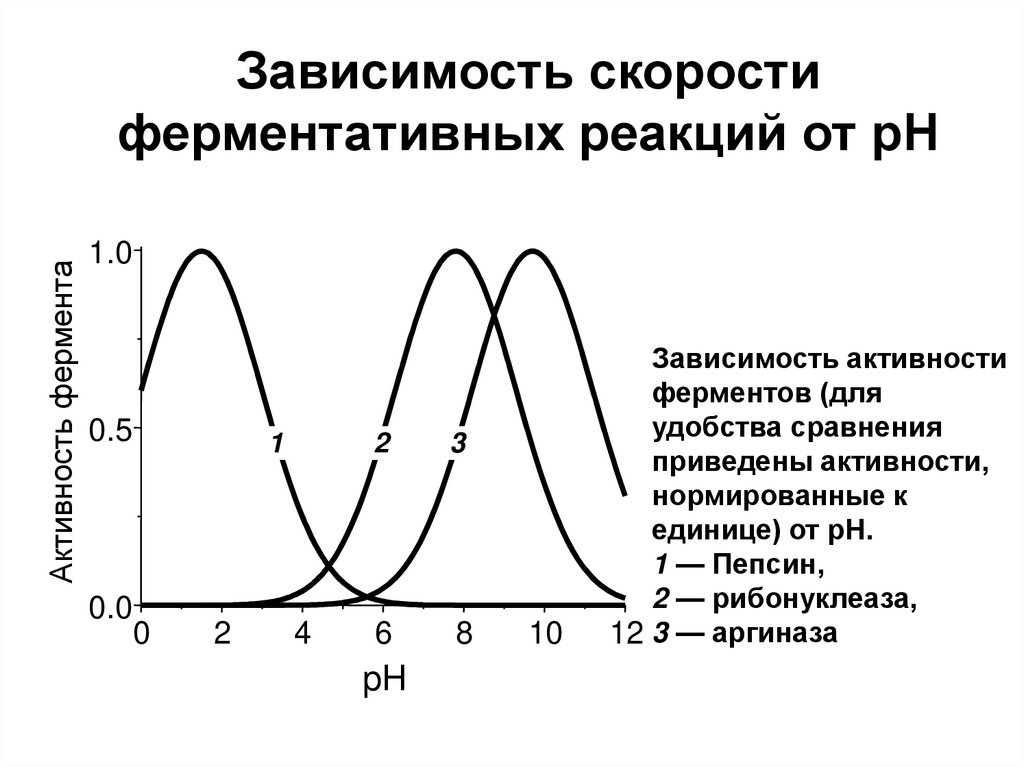
51. Зависимость скорости ферментативных реакций от рН
Активность ферментаЗависимость скорости
ферментативных реакций от рН
1.0
0.5
0.0
1
0
2
4
2
3
6
8
pH
10
Зависимость активности
ферментов (для
удобства сравнения
приведены активности,
нормированные к
единице) от рН.
1 — Пепсин,
2 — рибонуклеаза,
12 3 — аргиназа
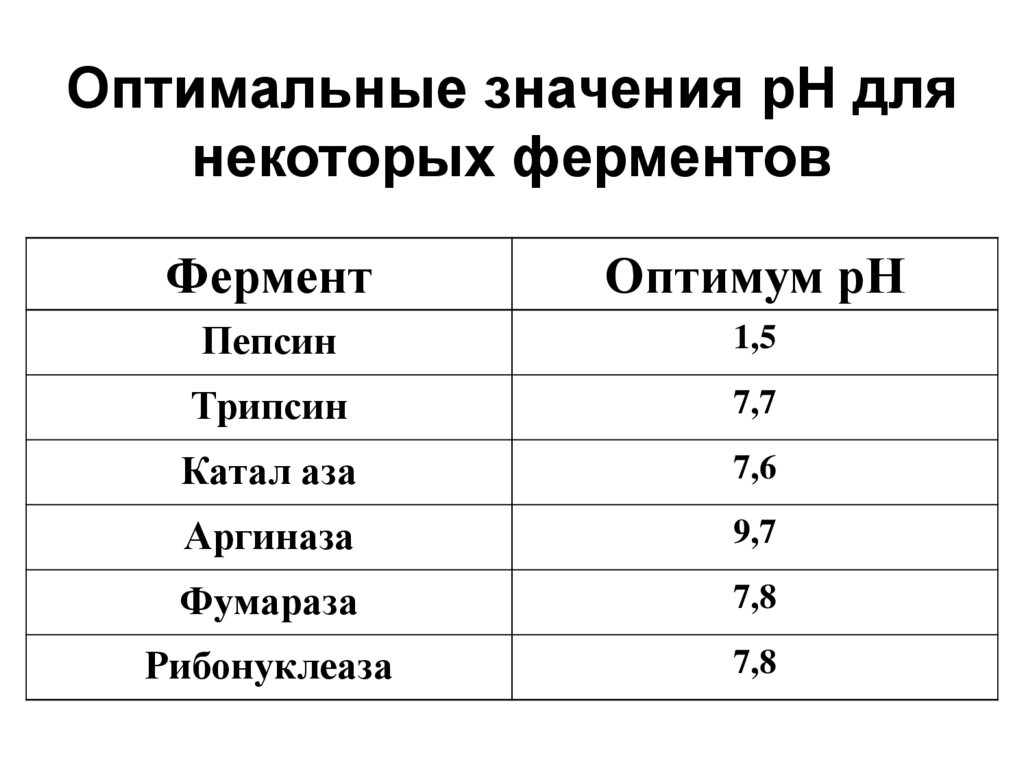
52. Оптимальные значения рН для некоторых ферментов
ФерментОптимум рН
Пепсин
1,5
Трипсин
7,7
Катал аза
7,6
Аргиназа
9,7
Фумараза
7,8
Рибонуклеаза
7,8
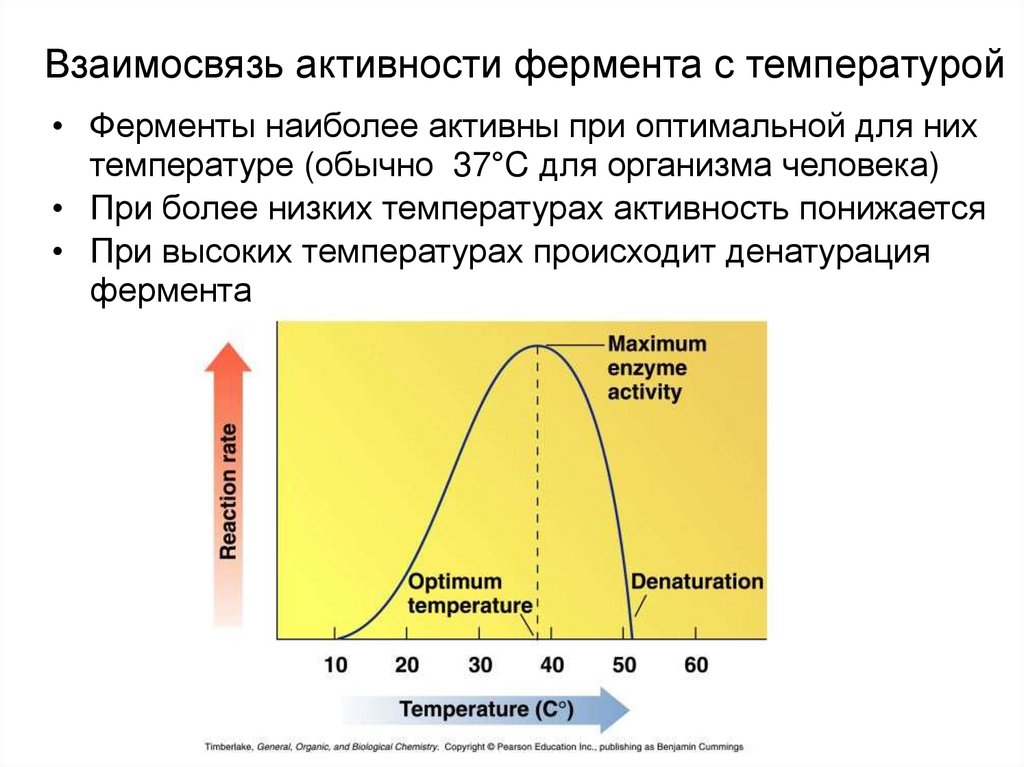
53. Температурный оптимум -
Температурный оптимум это температура, прикоторой фермент проявляет
максимальную активность.
Температурный оптимум для
ферментов человеческого
организма составляет
310 -313 К.
54. Взаимосвязь активности фермента с температурой
• Ферменты наиболее активны при оптимальной для нихтемпературе (обычно 37°C для организма человека)
• При более низких температурах активность понижается
• При высоких температурах происходит денатурация
фермента
55. Схема ферментативной реакции
Е + S ↔ ЕS → Р + ЕУравнение Михаэлиса-Ментен
[S ]
w wmax
km [S ]
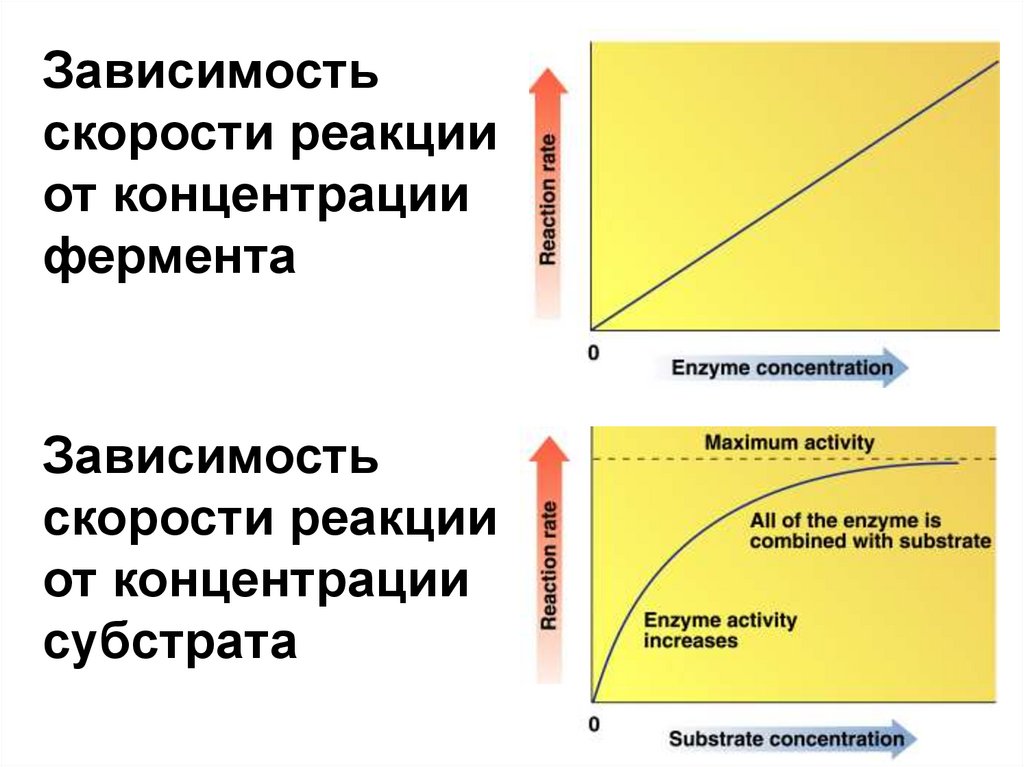
56.
Зависимостьскорости реакции
от концентрации
фермента
Зависимость
скорости реакции
от концентрации
субстрата
57. Смещение химического равновесия
Принцип Ле-Шателье:• Анри-Луи
если находящаяся
• (1850–1936 ) в химическом равновесии
система подвергается
внешнему воздействию,
то в ней возникают процессы,
стремящиеся ослабить это
Анри-Луи Ле Шателье
(1850-1936)
воздействие
Принцип адаптивных перестроек
любая живая система при воздействии на нее
перестраивается так, чтобы уменьшить это воздействие
58. ПЛАН ЛЕКЦИИ:
1.2.
3.
4.
Человек как термодинамическая система.
Особенности живых организмов как
термодинамических систем. Принцип
Пригожина
Применение основных понятий химической
термодинамики в биохимии.
Катализ в живых организмах. Ферменты как
катализаторы биохимических процессов.
Особенности кинетики ферментативных
реакций.
Поверхностные явления. Основы
хроматографии и ее применение в медикобиологических исследованиях.
59. Поверхностные явления
– это явления, происходящие на границераздела фаз, обусловленные
особенностями состава и структуры
поверхности
60. Живые организмы – системы с очень развитыми поверхностями раздела: кожные покровы, поверхность стенок кровеносных сосудов,
слизистыеоболочки, клеточные мембраны и т.п.
В организме человека площади поверхности
составляют:
• Эритроцитов 2500 – 3800 м2
• Капилляров печени – около 400 м2
• Альвеол – около 1000 м2
• Скелета – около 2000 км2
61.
Поверхностно-активныевещества (ПАВ) в организме
Эндогенные (образуются в организме: белки, фосфолипиды,
ЖК и их соли, гормоны)
экзогенные (раздражают и деструктивные в-ва)
Биологическая роль эндогенных ПАВ
– ПАВ слюны – смачивают пищевые комков, антимикробное
действие
– ПАВ печени – в желчи ЖКТ
–Эмульгируют жиры
–Активируют фермент липазу
–Образуют водораствоимые комплексы с жирами
– ПАВ легких
– повышают адсорбцию О2
– препятятвуют слипанию альвеол
62. Поверхностные явления в медицине
• Адсорбционная терапия – удалениетоксикантов, алкалоидов, солей
тяжелых металлов, пестицидов из
желудочно-кишечного тракта при
отравлениях;
• Гемосорбция – удаление из крови
токсических веществ, вирусов, бактерий
63. Применение адсорбционных процессов в медицине
• Адсорбенты Al(OH)3, MgO, AlPO4 входят всостав препаратов алмагель, фосфалюгель и
др.
• Активированный угол применяется как
адсорбент газов, токсинов, алкалоидов.
• Препараты на основе клетчатки способны
адсорбировать бактерии и назначаются как
дополнительное средство при тяжелых
бактериальных инфекциях.
• Препарат полисорб на основе SiO2
неселективный полифункциональный
энтеросорбент
64. Хроматография
физико-химический методисследования, основанный на
многократно повторяющихся процессах
сорбции и десорбции между двумя
фазами – подвижной и неподвижной
65. Классификация хроматографических методов
По цели проведения:- аналитическая хроматография используется
для качественного и количественного анализа
смеси веществ;
- препаративная хроматография предназначена
для очистки вещества от примесей.
По агрегатному состоянию подвижной фазы:
- газовая
- жидкостная.
По форме проведения
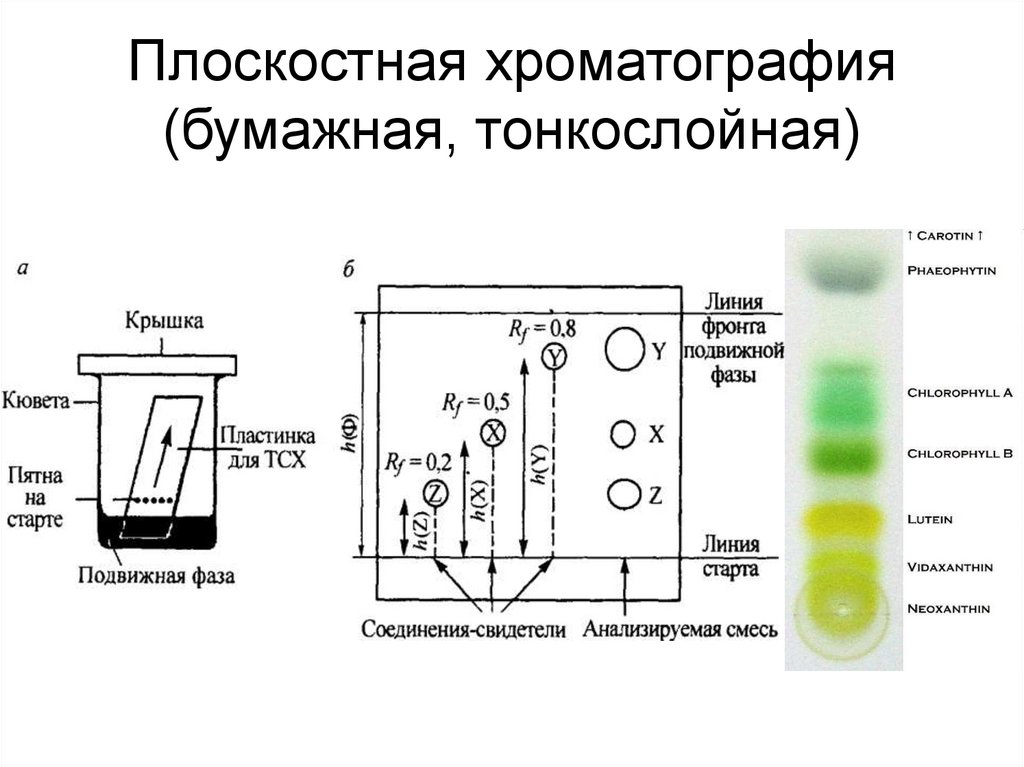
- плоскостная (тонкослойная или бумажная)
- объемная (колоночная).
66. Классификация хроматографических методов
По механизму разделения веществ- адсорбционная (разделяются вещества с различной
способностью к адсорбции)
- распределительная (различные константы
распределения при абсорбции веществ жидкой
неподвижной фазой, которая обычно нанесена
тонким слоем на твердый носитель)
- ионообменная (различны константы ионного обмена
разделяемых ионов между раствором и ионитом.
- молекулярно-ситовая (гель-фильтрация) различия в
размерах частиц.
- биоспецифическая хроматография избирательное
взаимодействие фермента с субстратом, антигена с
антителом, гормона с рецептором
67. Виды хроматографии
Thin layerPaper
Paper
Column
HPLC
Gas
68.
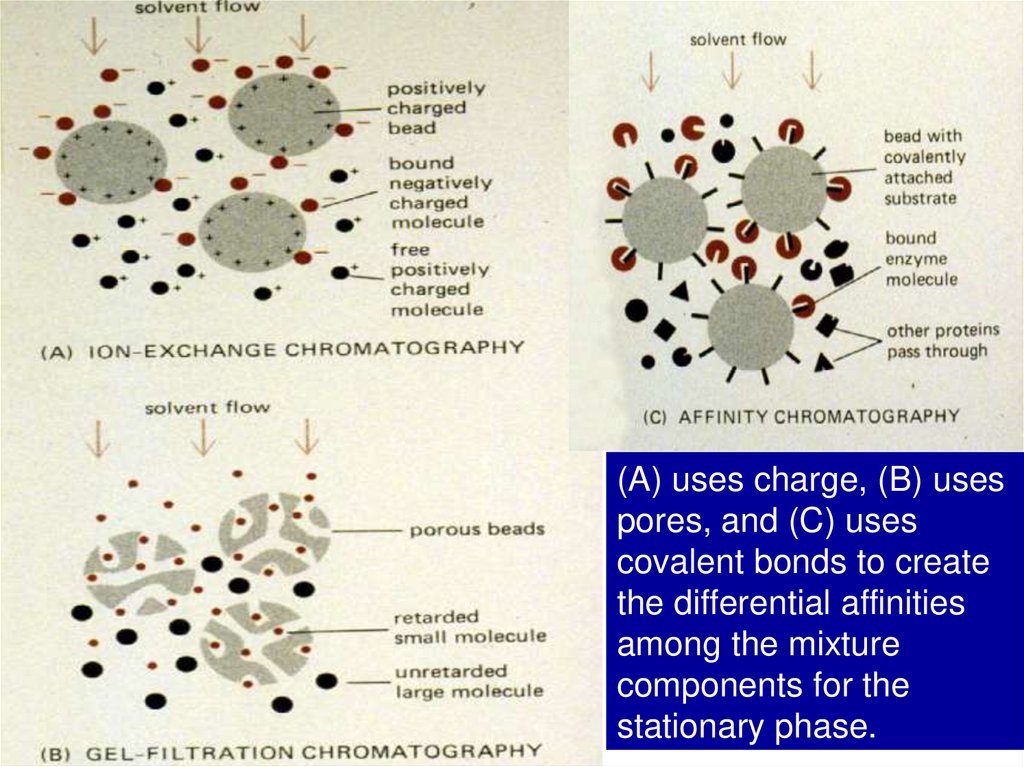
(A) uses charge, (B) usespores, and (C) uses
covalent bonds to create
the differential affinities
among the mixture
components for the
stationary phase.
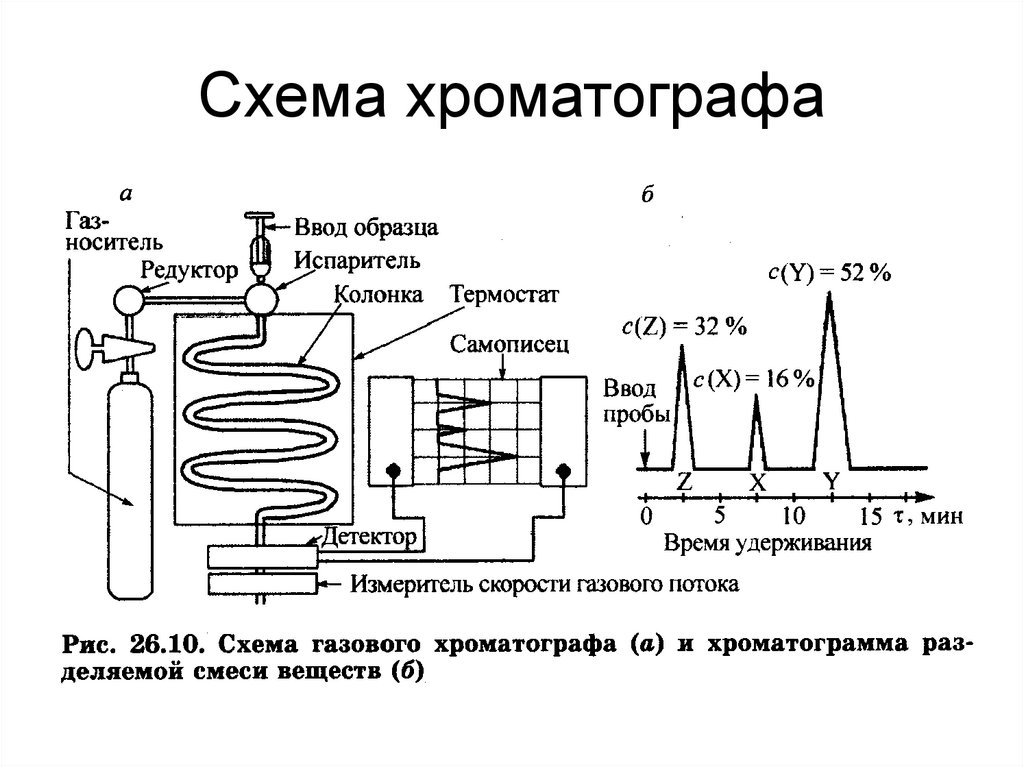
69. Схема хроматографа
70. Хроматограф
Примержидкостного
хроматографа. В
центре —
охлаждаемый бокс
с колонкой и
насосами для
принудительного
прокачивания
мобильной фазы.
Справа коллектор
фракций с
многочисленными
гнёздами для
пробирок. Элюат
поступает сюда из
колонки по тонкой
трубке, проходя по
пути через
оптический
детектор. Слева
монитор
компьютера, на
котором отражается
ход хроматографии.
71. Газовый хроматограф
Пример газовогохроматографа.
Сверху расположен
автосемплер для
ввода жидких проб
72. Плоскостная хроматография (бумажная, тонкослойная)
73. Значение хроматографии как важного диагностического метода постоянно возрастает
• Анализ крови наприсутствие в ней
алкоголя, наркотиков,
летучих токсических
веществ
• Метод допинг-контроля
• Определение
патологических
микрокомпонентов в
биологических жидкостях
и др.






































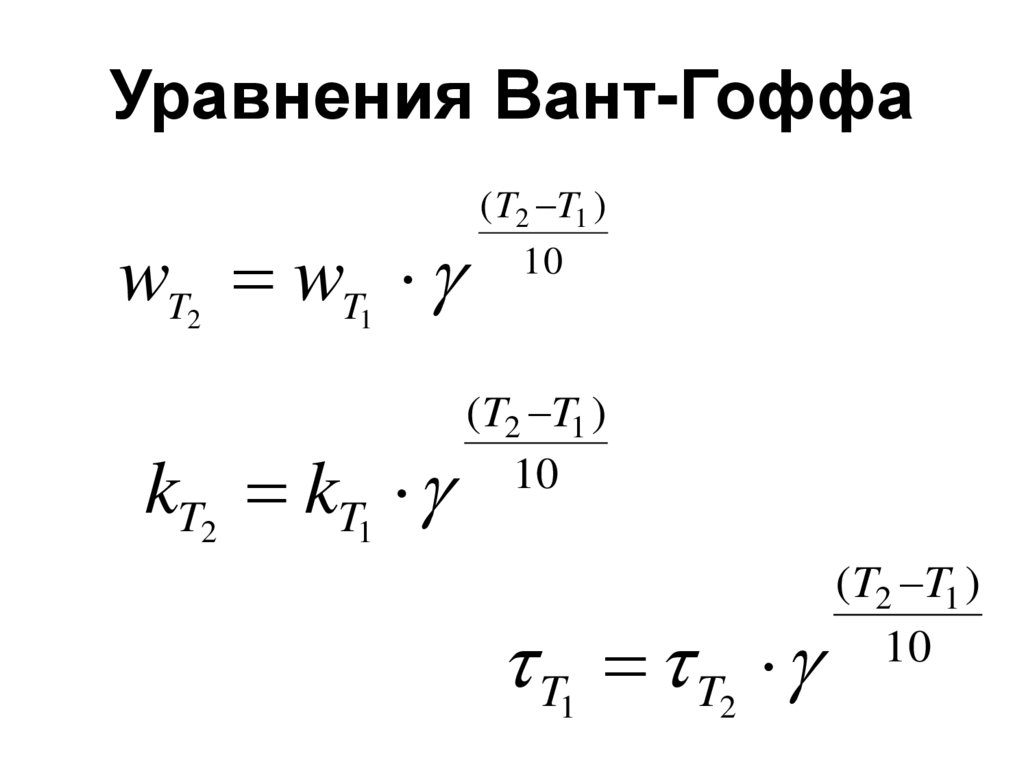




















 chemistry
chemistry








